2. 浙江大学 能源清洁利用国家重点实验室, 浙江 杭州 310027
2. State Key Laboratory of Clean Energy Utilization, Zhejiang University, Hangzhou 310027, China
随着能源的消费量的不断提高, 污染物的排放也随之增加.其中氮氧化物能够引起雾霾、光化学烟雾、酸雨等环境污染, 是急需得到控制的大气污染物.氮氧化物广泛存在于电力行业、机动车、水泥工业、钢铁工业和有色金属冶炼过程排放的烟气中, 其中90%以上为一氧化氮(NO), 因此研究NO的转化脱除具有十分重要的意义. NO的催化氧化是多种氮氧化物控制技术的关键步骤, 比如在快速选择性催化还原(Fast-SCR)、湿法脱硝及多种污染物湿法协同脱除、柴油机尾气的氮氧化物储存还原(NSR)等技术中, 都应用到NO的催化氧化.
目前研究的NO氧化反应的催化剂主要有过渡金属氧化物催化剂、负载型贵金属催化剂、活性炭和分子筛等[1-3].其中过渡金属氧化物催化剂因其价格适中、氧化还原能力较强的特点被广泛研究[4-5].研究表明, 锰氧化物的储存-释放氧的能力较强, 氧化还原性能优良[6-7], 因其突出的氧化性能而备受关注, 被广泛用于液相和气相污染物的治理[8-9].
学者对锰氧化物催化氧化NO的反应进行了相关研究[10-12], 发现锰氧化物具有比其他氧化物催化剂更高的活性, 同时也通过原位表征手段研究了锰氧化物催化氧化NO的机理[11], 探测到了NO吸附和反应后形成的硝酸盐和亚硝酸盐物质.从NO的氧化遵循的Langmuir-Hinshelwood(L-H)机理和Eley-Rideal(E-R)机理[13-15]可知, 催化剂对NO吸附能力可间接地体现催化剂表面活性氧的氧化性能[16-17].然而原位表征手段无法对NO吸附在催化剂表面的初始状态进行探讨, 因此有必要通过量子化学计算来更准确和详细地分析NO在锰氧化物表面的吸附和氧化[18].
我们在第一性原理密度泛函理论框架下研究了NO在Mn2O3表面上的吸附, 对比了Mn2O3表面各吸附位结合NO后的结构参数、吸附能, 研究了NO吸附后Mn吸附位周围的电子转移情况.并研究了NO与O2在催化剂表面共吸附后的结构参数、吸附能和电子结构, 从原子水平和电子结构方面深入研究NO在Mn2O3表面的吸附行为.
1 计算方法与模型采用基于密度泛函理论的VASP软件包(Vienna Ab initio Simulation Package) [19-20]进行第一性原理计算.计算过程中描述电子交换关联势能采用的广义梯度近似方法采用的是PW91[21-22]实现.价电子与内层电子、原子核之间的相互作用由冻结芯电子的投影缀加波(PAW)方法[19]处理.价电子波函数通过平面波函数展开, 截断动能为500 eV [23-25].布里渊区积分使用Monkhorst-Pack网格, 高斯展开参数SIGMA选取0.1 eV.
计算采用的GGA+U即是基于Dudarev方法的实现. Mn2O3体系中包含高度局域的3d电子, 标准的GGA方法不能正确描述在3d电子轨道部分占据时的能带结构和电子态, GGA+U方法引入的Hubbard U参数有助于消除自相互作用带来的误差, 从而改进对电子关联作用的描述.计算时采用引入了Hubbard参数U=4.5 eV [25-26]处理Mn 3d电子的强关联作用.
文中NO在催化剂表面的吸附能的计算公式为:
| $ {E_{{\rm{eds}}}} = {E_{{\rm{(slab + NO)}}}}-{E_{{\rm{slab}}}}-{E_{{\rm{NO}}}} $ | (1) |
此处, E(slab+NO)表示体系在吸附NO原子后的总能, Eslab表示未吸附NO的催化剂体系的总能量, ENO为NO分子的基态能量, 计算结果中的负号表示反应放热.
体相Mn2O3晶胞具有方铁锰矿结构, 如图 1(a)所示.计算Mn2O3单晶胞时使用的k点规模为4×4×4.晶格参数优化后, 得到晶格常数为a=9.58 Å, 与文献中的计算结果吻合[25]. Mn2O3的(110)面被认为最为稳定的一个晶面.因此, (110)面是三氧化二锰中出现的最主要晶面, 我们考察Mn2O3(110)面上NO的吸附和氧化.计算时采用的模型为以单胞晶格为基础构建的以(110)面作为吸附面的晶胞, 4层O-Mn-O原子层结构, 为消除相邻表面间的影响并保证表面原子层有足够的自由空间, Z方向上重复的slab之间的真空层厚度为15 Å.结构优化时晶胞的尺寸根据单胞优化的晶格常数固定, 并固定底部的1个原子层, 令其他原子在三位维度方向上可自由驰豫.表面结构优化的收敛判据设定为每个原子受到的Hellma-Feynman力小于0.02 eV/Å.由于表面晶胞较大, 结构优化时布里渊区采样使用了3×2×1的k点, 在计算总能时则加密至9×7×1.
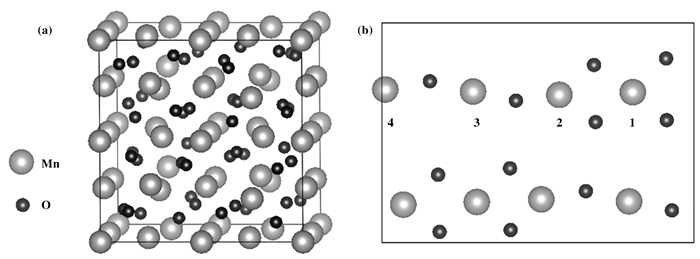
|
图 1 (a) Mn2O3晶胞模型图; (b)Mn2O3(110)表面上NO的吸附位点的顶视图 Figure 1 (a) Topology of Mn2O3 cell; (b) top view of the adsorption sites on Mn2O3 (110) surface |
前人研究表明, NO在MnOx催化剂上吸附时, NO分子中的N原子先与催化剂表面的金属原子配位, 并伴随从5σ轨道的电荷转移和N—O键的增强[27].下面将研究NO在Mn2O3(110)表面上及NO在有氧缺陷的Mn2O3(110)表面上的吸附.
在Mn2O3(110)模型表面, Mn2O3的原子排列复杂, 根据Mn周围的O排布情况, 考察了Mn位点和O位点top位的吸附情况.通过计算发现, NO在O top位的吸附非常不稳定, 最终会移到与Mn top位.因此NO在Mn2O3(110)吸附只考虑4个Mn top位, 如图 1(b)所示.
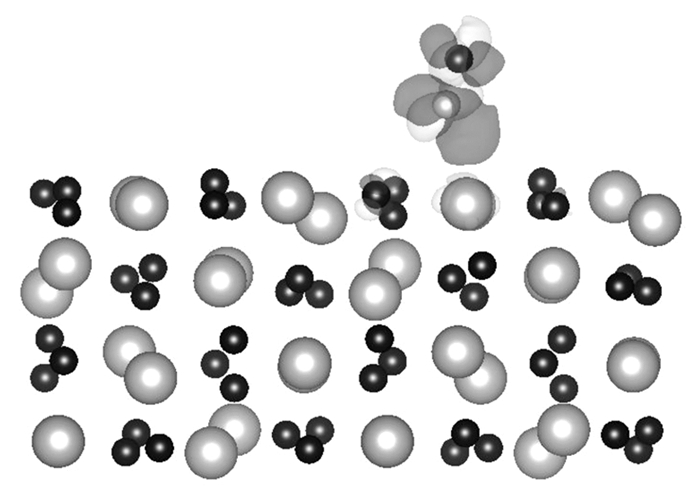
经过结构优化, 最终在各个位置上的吸附情况见图 2.结构优化后NO在Mn2O3(110)表面上的吸附能和N—Mn、N—O键长见表 1.从图表中可以看出, 最终优化的结构NO原子均有效吸附在表面, 吸附前后的结构总能变化在-0.61~-1.29 eV之间.吸附能为-0.4 eV以上为化学吸附, 因此在Mn2O3(110)表面上NO的吸附为化学吸附, 与基底发生较强的相互作用.其中在Mn top 1位的吸附能最大, 此时N与Mn的距离为2.46 Å, 与Mn附近的O的距离为1.96 Å, 而NO本身的NO键为1.17 Å, NO不仅吸附在Mn 1的位置, 还与Mn附近的O发生较强的相互作用, 使其中一个O原子脱出表面0.3 Å.其次为Mn top 3位, 吸附能为-0.88 eV, N与Mn的距离为2.10 Å.

|
图 2 NO在Mn2O3(110)表面上不同位点的吸附结构侧视图 Figure 2 Side view of bonding geometry for NO bound on the Mn2O3 (110) surface |
| 表 1 NO在Mn2O3(110)表面Mn top吸附位上的吸附能和主要结构参数 Table 1 Adsorption energies, structural parameters and spin magnetic moment for NO adsorption on Mn2O3(110) surface |
为了进一步分析吸附系统的特性, 计算了电荷密度差图(CDD).先计算NO/Mn2O3体系的电荷密度, 再单独计算NO体系和Mn2O3体系的电荷密度, 这两个体系中的各原子位置与NO/Mn2O3体系中的原子位置相同.最后用NO/Mn2O3体系的电荷密度减去NO体系和Mn2O3体系的电荷密度, 得到电荷密度差图.这可直接观察到NO吸附到Mn2O3(110)面上时体系各位置的电荷增减.如图 3所示, 深灰色部分表示电荷密度增加了0.005 e/Å3及以上, 浅灰色表示电荷密度减少了0.005 e/Å3及以上.从图中可以看出, NO的吸附对NO分子本身、吸附位的Mn原子和吸附位旁边的O原子的电荷密度有一定程度的影响. N原子下方和吸附位的Mn原子之间的电荷密度增大, 而Mn原子上部的电荷密度减小, 说明NO吸附后, Mn的部分电子转移到NO分子上, 这与表 1中的自旋磁矩结果相符.自旋磁矩可用来判断未成对电子, +2价时, Mn的3d轨道上的电子分别排布在5个单占轨道上, 理论上自旋磁矩为5 μB, +3价的Mn的自旋磁矩理论上为4 μB.体系表面的Mn原子因为缺少与之成键的氧原子, 因此其化学价应小于+3价.当NO吸附在Mn top 3位时, 吸附位的Mn的自旋磁矩减小至3.99 μB, 说明Mn原子的化学价略有升高, 与NO分子进行了电子转移.
|
图 3 NO吸附在Mn top 3位的电荷密度差图 Figure 3 Charge density difference (CDD) of NO bound on the Mn top 3 site (dark grey parts denote electron density excess and light grey parts denote electron density loss; the contours start from 0.005 e/Å3) |
图 4所示分别为NO自由分子、Mn2O3未吸附时、NO在Mn2O3(110)面吸附后的投影态密度图.自由的NO分子中有4σ键、5σ键、1π键和2π键, 分别局域在-12、-8、-7 eV和费米能级附近. N和O的电子峰广泛交叠, 说明N与O之间的强共价键作用. Mn top 3位上吸附NO之后, N和O的态密度都有所变化, N、O的2π电子峰左移, 并在-1~-6 eV之间Mn 3d价带区域出现微弱的电子峰. Mn的整个态密度向低能方向移动, 在-11.8、-7.7、-6.8、0.4和1.9 eV处出现新的电子峰, Mn、N、O在这些价带区域的电子峰有微弱交叠, 说明此时NO与Mn2O3表面发生了较弱的共价键作用.
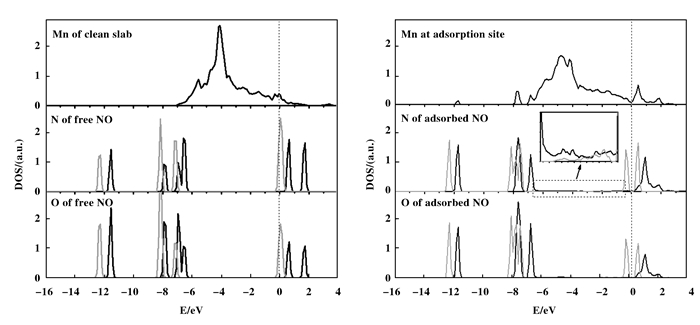
|
图 4 NO分子以及Mn top 3位上吸附NO前后的投影态密度(PDOS) Figure 4 Projected density of states (PDOS) for Mn2O3(110) clean slab, free NO molecule and Mn2O3(110) slab with NO bound on Mn top 3 site (black curves for the majority spin and grey curves for the minority spin) |
首先考察O2在Mn2O3表面上的吸附.考虑了O2在Mn top 3位和Mn bridge位的吸附, 结构优化后的吸附结构图见图 5.经自洽计算, O2在Mn top3位的吸附能为-0.51 eV, 两个O分别与Mn成键, 键长分别为2.03和2.06 Å; 在Mn bridge位的吸附能为-0.25 eV.
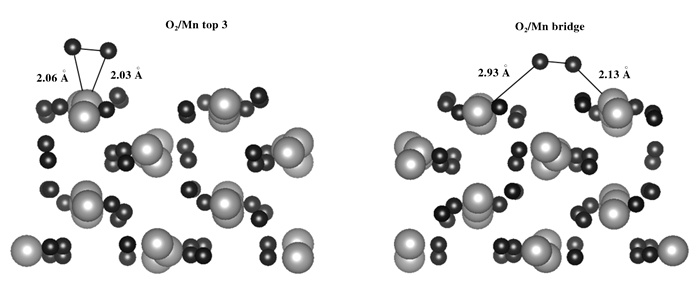
|
图 5 O2在Mn2O3表面上吸附结构侧视图 Figure 5 Side view of bonding geometry for O2 bound on the Mn2O3 (110) surface (Mn in light grey, O in black) |
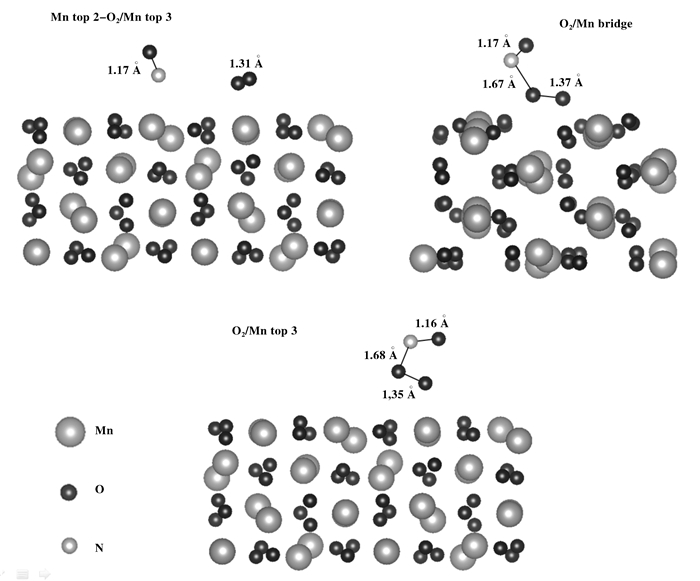
接下来考察NO与O2共吸附的情况.分别考虑NO在Mn top 2位和O2 top位的情况. NO在O2/Mn2O3表面吸附之后, 形成如图 6所示的结构.当O2吸附在Mn bridge位时, O2 top位上的吸附结构最终与Mn top 2位的吸附结构一致, 统一将这两个优化后的构型记为O2/Mn bridge. 表 2列出了NO在O2/Mn2O3表面上吸附的吸附能和主要结构参数.当NO在Mn top 2位吸附, O2在Mn top 3位上吸附时, NO与O2不能发生反应. NO和O2中的键长分别为1.17和1.31 Å. NO在O2/Mn top 3位的吸附能为-1.23 eV, NO与O2中的一个O成键, 形成了ONOO*结构, NO分子的键长减小, 为1.16 Å, O2分子的键长增加到1.35 Å, ON—OO的键长为1.68 Å, O—N—O的夹角为109.0°. NO在O2/Mn bridge位O2也形成了ONOO*结构, 吸附能为-1.39 eV, NO分子的键长减小, 为1.17 Å, O2分子的键长增加到1.37 Å, ON—OO的键长减小为1.67 Å, O—N—O键角为112.3°.在NO2分子中, N—O键长为1.20 Å, O—N—O键角为134.3°; Fajin等[28]在研究NO与O2在Au表面的吸附时发现, ONOO*结构是最稳定的吸附结构和反应中间体, 该结构可分解形成吸附态的NO2*和O*.
|
图 6 NO与O2在Mn2O3表面上共吸附结构侧视图 Figure 6 Side view of bonding geometry for NO bound on the O2/Mn2O3 (110) surface |
| 表 2 NO在O2/Mn2O3表面上吸附的吸附能和主要结构参数 Table 2 Adsorption energies and structural parameters for NO adsorption on O2/Mn2O3(110) surface |
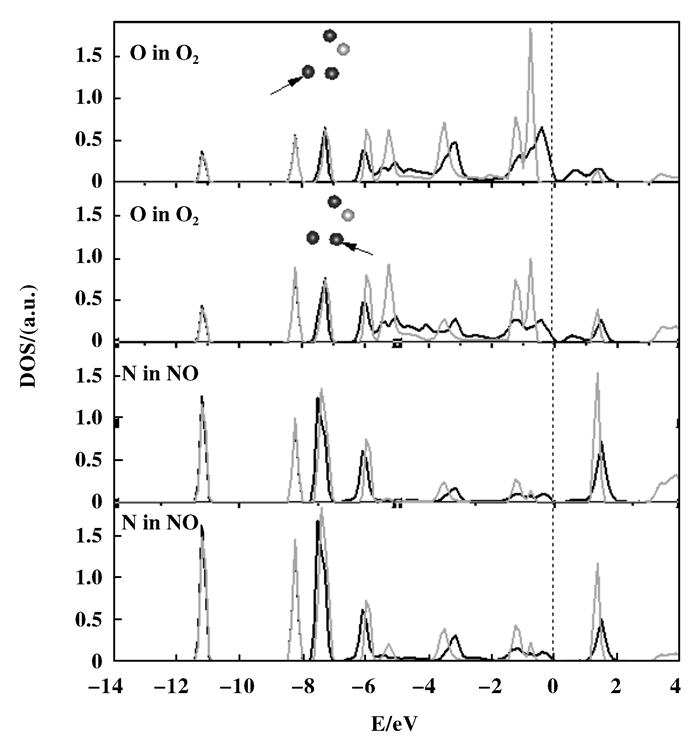
图 7所示为O2/Mn bridge位上吸附NO后的投影态密度.对比图 4中自由的NO分子和吸附在Mn top 3位后的投影态密度, 可见NO与O2形成ONOO*结构后, 电子峰发生很大变化. NO和O2的电子峰广泛交叠, 说明成键原子之间有强共价键作用. O2在0~-6 eV之间出现大量电子峰, 此区域是Mn的电子峰区间, 说明O2与Mn之间有强相互作用.此外, N最外层有5个电子, 若形成气相ONOO结构, 会有未成键电子的存在, 如图 4中自由的NO分子在-6.5 eV处的电子峰.而对比图 7中N的PDOS图, 两个自旋方向的曲线重合度很高, 说明没有未成键电子.所以Mn与ONOO*发生了电子转移, 为该结构提供了电子, 使其未成键电子成键.
|
图 7 O2/Mn bridge位上吸附NO后的投影态密度 Figure 7 Projected density of states for NO bound on O2/Mn bridge site (black curves for the majority spin and grey curves for the minority spin) |
通过计算NO分子吸附在Mn2O3表面的几何构型、吸附能和电子性质得知, 在Mn2O3(110)表面上, NO倾向于吸附在Mn top位, 吸附位Mn周围的配位结构发生变化, 使得Mn的电子向NO转移. Mn2O3表面吸附O2后再进一步吸附NO, 可形成ONOO*结构, ONOO*是一种可直接分解生成NO2的反应中间态.通过对结合能分析, NO和O2在表面共吸附形成ONOO*结构时的吸附能高于单纯吸附NO时的吸附能.
| [1] |
a. Dranga B A, Lazar L, Koeser H. Oxidation catalysts for elemental mercury in flue gases-A review[J]. Catal, 2012, 2(1): 139-170. b. Wang Shu-jie(王舒捷), Zou Gu-chu(邹谷初), Xu Yao(徐尧), et al. Ce-based catalysts for simultaneous removal of both diesel soot and NOx(Ce基复合氧化物同时催化去除碳烟-NOx的性能研究)[J]. J Mol Catal(China)(分子催化), 2015, 29(1): 60-67. c. Zhu Rong-shu(朱荣淑), He Jian-sheng(何建昇), Yao Ze(姚泽), et al. Simultaneous removal of soot and NOx with ruthenium-based Bi-noble metal catalysts(Ru系双贵金属催化同时去除碳颗粒和NOx)[J]. J Mol Catal(China)(分子催化), 2015, 29(1): 68-74. d. Xu Yao(徐尧), Zou Gu-chu(邹谷初), Wang Shu-jie(王舒捷), et al. Solution combustion synthesis of LiCoO2 for simultaneously catalytic removal of soot and NOx(溶液燃烧法制备LiCoO2及其同时催化去除碳烟和NOx性能研究)[J]. J Mol Catal(China)(分子催化), 2015, 29(1): 52-59. |
| [2] |
a. Hunter B M, Gray H B, Müller A M. Earth-abundant heterogeneous water oxidation catalysts[J]. Chem Rev, 2016, 116(22): 14120-14136. b. Gao Rui-rui(高蕊蕊), Lou Xiao-rong(娄晓荣), Bai Wen-jun(白文君), et al. Influence of preparation technology on the activities of Mn-Fe/ZSM-5 catalysts for selective catalytic reduction of NO with NH3(制备工艺对Mn-Fe/ZSM-5催化剂在NH3选择催化还原NO反应中催化性能的影响)[J]. J Mol Catal(China)(分子催化), 2015, 29(6): 563-574. c. Song Zhong-xian(宋忠贤), Ning Ping(宁平), Li Hao(李昊), et al. Effect of Ce/Mn molar ratios on the low-temperature catalytic activity of CeO2-MnOx catalyst for selective catalytic reduction of NO by NH3(不同Ce/Mn摩尔比对CeO2-MnOx催化剂低温NH3选择性催化还原NO的影响)[J]. J Mol Catal(China)(分子催化), 2015, 29(5): 422-430. d. Tang Fu-shun(唐富顺), Zhao Hui(赵辉), Liu Jin(刘津), et al. Effect of dispersion structure of Co constituents on the activity of the supported Co/ZSM-5 catalysts for the De-NOx of diesel vehicles(担载型Co/SM-5催化剂表面Co组分结构与柴油车NOx净化性能)[J]. J Mol Catal(China)(分子催化), 2015, 29(3): 256-265. e. Sun Sheng-nan(孙圣楠), Li Chun-hu(李春虎), Yang Wei-wei(杨微微), et al. Photocatalytic removal of NO from flue gas by TiO2 loaded on semi-coke prepared by sol-gel method(溶胶-凝胶法制备TiO2负载活化半焦光催化烟气脱硝)[J]. J Mol Catal(China)(分子催化), 2015, 29(2): 188-196. |
| [3] |
a. Qin H, Hu Y, Zhu C, et al. Functionalization of polyvinyl alcohol composite membrane by CoOOH for direct borohydride fuel cells[J]. Electrochem Commun, 2017, 77: 1-4. b. Li Ling(李灵), Huang Ying-ping(黄应平), Zhang Ai-qing(张爱清), et al. Synthesis and visible-light photocatalysis performance research of BiVO4/Bi6O6(OH)3(NO3)3 composite photocatalyst (BiVO4/Bi6O6(OH)3(NO3)3复合光催化剂的制备及光催化性能研究)[J]. J Mol Catal(China)(分子催化), 2016, 30(5): 470-479. c. Su Qian(苏潜), Huang Yan(黄妍), Zhang Yin(张颖), et al. Effects of copper sources on selective catalytic reduction of NO with NH3 of Cu-SAPO-34(铜源对Cu-SAPO-34氨催化还原NO性能的影响)[J]. J Mol Catal(China)(分子催化), 2016, 30(2): 151-158. d. Yu Rui(喻瑞), Zhao Zhen-chao(赵侦超), Zhang Zhen-yu(张振宇), et al. Effects of Pt modification and reaction atmosphere on the catalytic performances of Cu/Al-rich beta zeolite in selective catalytic reduction of NO by NH3(Pt修饰和反应气氛对富铝Cu-Beta分子筛NH3-SCR反应性能的影响)[J]. J Mol Catal(China)(分子催化), 2016, 30(5): 428-434. |
| [4] |
a. Zhang Li-na(张丽娜), Deng You-quan(邓友全), Shi Feng(石峰). Preparation of Fe-doped TiO2 for the selective oxidation of aromatic alcohols with oxygen under visible light irradiation (Fe掺杂改性TiO2的制备及其可见光催化醇氧化性能研究)[J]. J Mol Catal (China)(分子催化), 2015, 29(2): 179-187. b. Xing Shuai(邢帅), Jiang Hong(姜宏), Xiong Chun-rong(熊春荣), et al. Research of silicon-based composite oxides supported on oxided cocount shell active carbon as denitration catalyst at low temperature(椰壳活性炭氧化后负载硅基复合氧化物低温脱硝催化剂的研究)[J]. J Mol Catal(China)(分子催化), 2016, 30(2): 140-150. c. Jin Qi-jie(金奇杰), Sui Guo-rong(眭国荣), Liu Qing(刘青), et al. Compatibility optimization of Mn-Mo-W-Ox catalyst for selective catalytic reduction of NO by NH3(Mn-Mo-W-Ox脱硝催化剂活性组分的配伍优化)[J]. J Mol Catal(China)(分子催化), 2017, 31(2): 159-168. |
| [5] | Li Zhen(李振), Lu Gong-xuan(吕功煊). The study of photoelectric chemical oxidation of water by nickel-modified WO3 film(镍修饰WO3膜光电化学氧化水的研究)[J]. J Mol Catal (China)(分子催化), 2014, 28(4): 351–358. |
| [6] | Xu H, Qu Z, Zong C, et al. MnOx/graphene for the ca-talytic oxidation and adsorption of elemental mercury[J]. Environ Sci Technol, 2015, 49(11): 6823–6830. DOI:10.1021/es505978n |
| [7] | Frey C E, Kwok F, Gonzálesflores D, et al. Mohney. Evaporated manganese films as a starting point for the pre-paration of thin-layer MnOx water-oxidation anodes[J]. Sustainable Energy & Fuels, 2017, 1(5): 1162–1170. |
| [8] | Gao R, Zhang D, Maitarad P, et al. Morphology-dependent properties of MnOx/ZrO2-CeO2 nanostructures for the selective catalytic reduction of NO with NH3[J]. J Phys Chem C, 2013, 117(20): 10502–10511. DOI:10.1021/jp400984z |
| [9] | Ramírez A, Hillebrand P, Stellmach D, et al. Evaluation of MnOx, Mn2O3, and Mn3O4 electrodeposited films for the oxygen evolution reaction of water[J]. J Phys Chem C, 2014, 118(26): 14073–14081. DOI:10.1021/jp500939d |
| [10] | Wu Z, Tang N, Xiao L, et al. MnOx/TiO2 composite nanoxides synthesized by deposition-precipitation method as a superior catalyst for NO oxidation[J]. J Coll Interf Sci, 2010, 352(1): 143–148. DOI:10.1016/j.jcis.2010.08.031 |
| [11] | Tang N, Liu Y, Wang H, et al. Mechanism study of NO catalytic oxidation over MnOx/TiO2 Catalysts[J]. J Phys Chem C, 2011, 115(16): 8214–8220. DOI:10.1021/jp200920z |
| [12] | Li X, Zhang S, Jia Y, et al. Selective catalytic oxidation of NO with O2 over Ce-doped MnOx/TiO2 catalysts[J]. J Nat Gas Chem, 2012, 21(1): 17–24. DOI:10.1016/S1003-9953(11)60327-7 |
| [13] | Chen Z, Liu X, Cho K, et al. Density functional theory study of the oxygen chemistry and NO oxidation mechanism on low-index surfaces of SmMn2O5 mullite[J]. Acs Catal, 2015, 5(8): 4913–4926. DOI:10.1021/acscatal.5b00249 |
| [14] | Aslam R, Usman M R, Irfan M F. A comparative study of LHHW and ER kinetic models for NO oxidation over Co3O4 catalyst[J]. J Environ Chem Eng, 2016, 4(3): 2871–2877. DOI:10.1016/j.jece.2016.05.035 |
| [15] | Sinthika S, Vala S T, Kawazoe Y, et al. CO oxidation prefers Eley-Rideal or Langmuir-Hinshelwood pathway:Monolayer vs. Thin Film of SiC[J]. Acs Appl Mater & Interf, 2016, 8(8): 5290–5299. |
| [16] | Du X, Gao X, Hu W, et al. Catalyst design based on DFT calculations:Metal oxide catalysts for gas phase NO reduction[J]. J Phys Chem C, 2014, 118(25): 13617–13622. DOI:10.1021/jp502040y |
| [17] | Du X, Tang J, Chen Y, et al. Adsorption of As4O6 from flue gas by zeolites:Influence of pore structure and Al substitution[J]. Micro Mes Mater, 2017, 243: 22–27. DOI:10.1016/j.micromeso.2017.02.026 |
| [18] | Dong Hong-zhi(董虹志), Yin Xiao-hong(尹晓红), Sui Dan-dan(隋丹丹), et al. Calculation of CO2 adsorption on SrTiO3(100) with density functional theory(基于密度泛函理论计算的CO2在SrTiO3(100)表面的吸附)[J]. J Mol Catal (China)(分子催化), 2012, 26(6): 554–559. |
| [19] | Kresse G, Furthmuller J. Efficient iterative schemes for ab initio total-energy calculations using a plane-wave basis set[J]. Phys Rev B, 1996, 54(16): 11169–11186. DOI:10.1103/PhysRevB.54.11169 |
| [20] | Kresse G, Furthmuller J. Efficiency of ab-initio total energy calculations for metals and semiconductors using a plane-wave basis set[J]. Comp Mater Sci, 1996, 6(1): 15–50. DOI:10.1016/0927-0256(96)00008-0 |
| [21] | Perdew J P, Chevary J A, Vosko S H, et al. Atoms, molecules, solids, and surfaces-applications of the fe-neralized fradient approximation for exchange and correlation[J]. Phys Rev B, 1992, 46(11): 6671–6687. DOI:10.1103/PhysRevB.46.6671 |
| [22] | Perdew J P, Wang Y. Accurate and simple analytic representation of the electron-gas correlation-energy[J]. Phys Rev B, 1992, 45(23): 13244–13249. DOI:10.1103/PhysRevB.45.13244 |
| [23] | Joshi A, Rammohan A, Jiang Y, et al. Density functional theory (DFT) study of the interaction of ammonia with pure and tungsten-doped ceria[J]. J Mol Struc-Theochem, 2009, 912(1/3): 73–81. |
| [24] | Watkins M B, Foster A S, Shluger A L. Hydrogen cycle on CeO2 (111) surfaces:Density functional theory calculations[J]. J Phys Chem C, 2007, 111(42): 15337–15341. DOI:10.1021/jp071715s |
| [25] | Cockayne E, Levin I, Wu H, et al. Magnetic structure of bixbyite alpha-Mn2O3:A combined DFT+U and neutron diffraction study[J]. Phys Rev B, 2013, 87(18): 398–401. |
| [26] | Hsi H C, Chen C T. Influences of acidic/oxidizing gases on elemental mercury adsorption equilibrium and kinetics of sulfur-impregnated activated carbon[J]. Fuel, 2012, 98(6): 229–235. |
| [27] | Hadjiivanov K I. Identification of neutral and charged NxOy surface species by IR spectroscopy[J]. Catal Rev, 2000, 42(1/2): 71–144. |
| [28] | Fajin J L C, Cordeiro M N D S, Gomes J R B. DFT study on the reaction of NO oxidation on a stepped gold surface[J]. Appl Catal a-Gen, 2010, 379(1/2): 111–120. |
 2017, Vol. 31
2017, Vol. 31


