2. 江西师范大学 物理系 计算材料物理实验室, 江西 南昌 330022
2. Department of Physics, Laboratory of Computational Materials Physics, Jiangxi Normal University, Nanchang 330022, China
水煤气变换反应(CO+H2O→CO2+H2, 简称WGSR)是一个重要的工业制氢反应, 在合成氨[1]、合成甲醇[2-3]、调节合成气加工过程中H2/CO的比例[4-5]等传统工业领域及燃料电池领域均有着广泛地应用.事实上, 任何包含有H2O和CO气体的体系都必须考虑到WGSR, 因此该反应一直备受关注.
WGSR是一个放热反应, 热力学上该反应在低温下非常有利, 但它必须在有催化剂的条件下才能进行. Cu/ZnO/Al2O3是公认的高活性低温WGSR催化剂[6-7], 例如, Utaka等[8]发现在420 K反应温度和有O2存在情况下, Cu/ZnO/Al2O3催化WGSR的CO转化率高达90%.在WGSR中, Cu0和Cu+被认为是Cu/ZnO/Al2O3催化剂的活性中心[6, 9-10].由此, 我们认为Cu2O同样对WGSR具有良好的催化活性. Cu2O通常含有(111), (110)及(100)三种低指数表面.其中, (111)面最为稳定且含有路易斯酸碱对, 因而引起科研工作者的更多关注.而且, 实验研究[11-13]表明在WGSR中, 被氧化的铜的表面结构与Cu2O(111)表面结构非常类似.基于以上原因, 我们选择Cu2O(111)作为模型催化剂来研究WGSR在Cu2O表面的反应机理.考虑到化学环境对Cu+催化活性的影响, 对Cu2O催化WGSR的反应机理开展研究是非常必要的, 这不仅有助于进一步表征Cu+在WGSR中的催化作用, 而且有利于加深对Cu/ZnO/Al2O3催化WGSR过程的理解.
目前文献已提出了3种主要的WGSR反应机理, 即:氧化还原机理(CO与O反应生成CO2)、甲酸根机理(CO与OH反应生成HCOO)、羧基机理(CO与OH反应生成COOH).关于铜基催化剂催化WGSR, 理论上, Gokhale等[14]采用密度泛函理论研究了Cu(111)催化WGSR的氧化还原机理和羧基机理, 结果表明羧基机理为主要反应路径.然而, Lin等[15]发现在Cu(111)表面, 3种反应机理均可行.任宁宁等[16]的计算结果则表明, 对于Cu6TM(TM=Ni, Pd), WGSR主要按照氧化还原反应机理进行, 而对于Cu6TM(TM=Co, Rh), WGSR的3种反应机理均可行.最近, Cong等[17]计算了WGSR在2Cu/ZnO(1010)上的反应机理, 发现氧化还原机理和羧基机理都可行, 当反应发生在Cu位时, H2O的解离为以上两种反应机理的速控步骤; 而当反应发生在界面处时, 氧化还原机理的速控步骤为OH的重新结合, 羧基机理的速控步骤则为COOH的形成.实验上, Chamnankid等[18]通过漫反射傅里叶变换红外光谱分析发现WGSR在Cu负载的CeO2-ZrO2催化剂上的反应机理为甲酸根机理, 甲酸根的解离为速控步骤. Takehira[6]、Flytzani-Stephanopoulos[19]和Mierczynski[20]等课题组分别研究了Cu/ZnO/Al2O3、Cu-CeO2、Cu/ZnAl2O4负载型铜基催化剂上的WGSR, 并认为反应机理是氧化还原机理.他们的根据是:在反应过程中, 催化剂里的Cu发生了0价和+1价之间的转换, 使得H2O分解成H2和吸附的O原子, CO被氧化成了CO2, 从而驱动了反应的进行.由此可见, 铜基催化剂催化WGSR的反应机理还存在一定的争议, 需要理论和实验研究的进一步补充.实验往往难以捕获和表征反应过程中可能存在的重要中间体和过渡态, 这些却可以通过理论模拟实现.另一方面, 尽管有关铜基催化剂催化WGSR的文献报道与日俱增, 但主要集中在金属铜或负载型金属铜催化剂的研究上[21-25], 有关铜基氧化物的研究却鲜见报道[26], 尤其关于Cu2O.由前所诉, Cu2O因含有活性中心Cu+而可能具有良好的WGSR催化性能.事实上, Liu等[27]的研究已表明Cu2O(111)催化WGSR的优势反应路径中最高能垒为118 kJ·mol-1, 最低能垒为3 kJ·mol-1, 优势反应路径为羧基机理.然而, 并未对甲酸根机理进行全面地研究, 仅简单计算了CO+OH→mono-HCOO这个反应路径, 并没有考虑生成trans-HCOOH、cis-HCOOH和bi-HCOO这些中间物种的可能性.例如, Zeinalipour-Yazdi等[28]在对铑团簇催化WGSR的研究中发现, 均相水煤气变换反应下, CO会直接进攻H2O反应生成trans-HCOOH中间体, 而后trans-HCOOH又可以旋转其C—OH键180°转变成cis-HCOOH物质.最后, cis-HCOOH直接分解成CO2和H2. Shido等[29]用FT-IR光谱技术研究了MgO表面催化WGSR产生的中间体, 其结果表明, 吸附在催化剂表面的OH基团和CO反应生成了双配位的甲酸盐类物质(bi-HCOO).此外, 我们知道, 两种不同吸附物种之间的共吸附模式通常有LH(Langmuir-Hinshelwood)和ER(Eley-Rideal)两种, 而Liu等[27]的研究仅考虑了LH模式, 并未考虑ER模式.因此, 系统而全面地研究WGSR在Cu2O(111), 有助于进一步完善人们对Cu+催化WGSR的理解.
为此, 我们构建Cu2O(111)表面的周期性平板模型, 采用密度泛函理论方法对Cu2O催化WGSR的反应机理进行系统研究, 考察可能的反应物、中间体及产物构型及可能的反应路径, 找出最优反应路径, 并对其中产生现象进行合理地解释.希望我们的研究有助于理解水煤气转化在其他铜基催化剂上的反应.
1 计算模型与方法我们选取Cu2O(111)-(
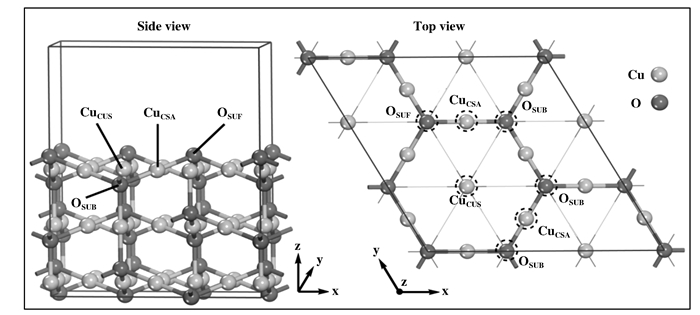
|
图 1 计算所采用的Cu2O(111)面的侧视图和俯视图 Figure 1 Top and side views of Cu2O(111) surface used for our calculations |
所有计算采用基于密度泛函理论(DFT)的Dmol3程序包[32-33]来实现.交换相关势采用广义梯度积分(GGA)和BLYP泛函相结合的方法[34-35]; 价电子波函数采用双数值基组加极化函数(DNP)[36]来展开; Cu原子的内层电子由有效核电势(ECP)代替, O和H原子采用全电子基组; 布里渊区积分的Monkhorst-Pack网格参数设为2 × 2 × 1, 展宽因子取0.005 Ha.结构优化过程以能量、力和位移为收敛判据, 3者的阈值分别为1.0 × 10-5 Ha、2.0 × 10-3 Ha/Å和5.0 × 10-3 Å.当上述3个标准中有两个得到满足时, 可以认为自洽计算收敛.采用上述方法计算得到的H2、CO、CO2的键长分别为0.746、1.143、1.178 Å, 相应的实验值[37-38]分别为0.73、1.14、1.16 Å.计算值与实验值相近, 说明我们所选取的方法可靠.所有过渡态采用完全线性同步和二次同步变换LST/QST方法[39]进行搜索, 关于该方法的详细介绍请见我们前期发表的论文[40-42].
对于吸附质, 吸附能和共吸附能的定义如下:
Eads =[E(Cu2O)+E(adsorbate)]-E(total)
Eco-ads =[E(Cu2O)+E(H2O)+E(CO)]-E(total)
其中, E(total)表示吸附后体系的总能量, E(Cu2O)表示Cu2O(111)清洁表面的能量, E(adsorbate)、E(H2O)和E(CO)则分别指吸附前吸附质、H2O分子和CO分子的能量. Eads和Eco-ads为正值表示吸附体系的稳定性.
2 结果与讨论 2.1 各物种在Cu2O(111)表面的吸附为便于准确构建各种反应路径, 需先考察WGSR反应过程中各物种在催化剂表面的吸附行为, 因此我们首先计算了反应物CO和H2O、产物CO2和H2、中间物种O、OH、H及HCOO及COOH在Cu2O(111)面的吸附构型, 相应稳定构型、构型参数和吸附能见图 2.对于反应物分子CO和H2O, 如图 2(a)和图 2(b)所示, CO分子更容易以C端垂直吸附于CuCUS位, 而H2O分子通过O原子吸附到CuCUS位上, Cu2O(111)面对CO的吸附能(118 kJ·mol-1)明显大于H2O(88 kJ·mol-1); H2O分子中靠近表面的O—H键由于受到表面OSUF的影响被拉长, 而另外一个稍离表面的O—H键的键长变化不明显, 同时C—O键长也没有明显地变化(自由态时H2O中O—H键长为0.972 Å, CO分子中C—O键长为1.143 Å), 这意味着H2O分子较CO分子更容易分解.对于产物分子CO2和H2, 其吸附能分别为11和29 kJ·mol-1, 均为物理吸附, 表明CO2和H2分子极易从Cu2O(111)表面脱离, 这有利于催化剂的循环使用; 对于中间物种, O原子的最佳吸附位为3Cu位, 如图 2(e)所示, 即O与一个CuCUS和两个CuCSA相连接, 吸附能为256 kJ·mol-1; OH自由基最佳吸附位为CuCUS位, 以O为接触端倾斜地吸附于Cu2O(111)表面, ∠HOCu=110.2°, 如图 2(f), O—H键长和吸附能分别为0.975 Å和292 kJ·mol-1; H原子的最佳吸附位为CuCUS位, 而不是OSUF位, 这与Zhang等[43]的研究结果不同, 他们认为H原子吸附在OSUF位时最稳定, CuCUS位次之.通过我们的Mulliken电荷分析可知, 吸附前CuCUS和OSUF所带的Mulliken电荷分别是0.244和-0.519;吸附H原子后则分别为-0.054和-0.478, 吸附前后CuCUS和OSUF的分别转移电荷-0.298和0.041.由此可见, CuCUS较OSUF发生了更多的电荷转移, 电荷转移越多, H原子的吸附则越强, 因此H在CuCUS位的吸附较OSUF位更强.
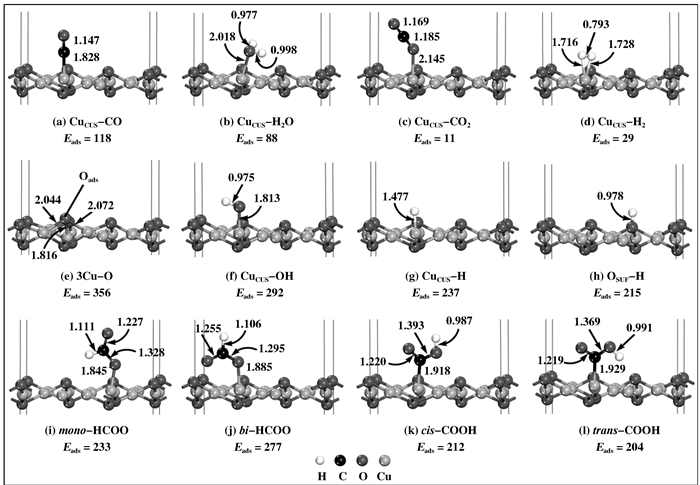
|
图 2 各物种在Cu2O(111)面上的稳定吸附构型及相应的结构参数和吸附能 Figure 2 The stable structures, corresponding parameters and adsorption energies of spices on Cu2O(111) surface The bond lengths and adsorption energies are given in Å and kJ·mol-1. [PS: The same color scheme is applied in following figures] |
甲酸根HCOO在Cu2O(111)表面有两种稳定构型, 分别标记为单配位型甲酸根(mono-HCOO)和双配位型甲酸根(bi-HCOO), 稳定构型分别见图 2(i)和图 2(j).单配位型中仅有一个O原子与底物表面发生作用, 而双配位型中两个O原子均与底物表面发生作用, 前者的吸附能为233 kJ·mol-1, 后者吸附能较之更大, 为277 kJ·mol-1, 因此bi-HCOO的结构在Cu2O(111)表面比mono-HCOO稳定.羧基COOH与甲酸根HCOO为同分异构体, 其在Cu2O(111)表面上也有两种稳定构型, 分别标记为顺式羧基(cis-COOH)和反式羧基(trans-COOH), 如图 2(k)、图 2(l), 它们均以C端为接触点吸附于CuCUS位, cis-COOH结构的吸附能(212 kJ·mol-1)比trans-COOH结构的吸附能(204 kJ·mol-1)略高, 因此这两种羧基构型在Cu2O(111)表面为竞争构型.
2.2 CO+H2O在Cu2O(111)表面的共吸附物种为探测WGSR的反应机理, 对分子吸附和解离吸附的H2O与CO分子的共吸附进行了研究, 考虑了LH和ER两种共吸附模式, 以期寻找到可能存在的中间体.我们构建了多种可能的共吸附构型, 计算发现了反式甲酸trans-HCOOH、顺式甲酸cis-HCOOH和HCOO…H 3种有趣的中间体(见图 3). 3种中间体均是通过其羟基O端吸附于CuCUS位, HCOO…H中间体的吸附最强, 其次为trans-HCOOH, cis-HCOOH的吸附最弱.其中, trans-HCOOH存在两种稳定的结构, 如图 3(a)、(b)所示, trans-HCOOH(2)构型的吸附能较trans-HCOOH(1)构型的吸附能略大5 kJ·mol-1.通过分析两者的结构可以发现, 由于trans-HCOOH(2)中O—H键更靠近Cu2O(111)表面的OSUF位, O—H键长伸长程度较trans-HCOOH(1)中更大, 因此我们推测trans-HCOOH(2)较trans-HCOOH(1)更容易解离形成甲酸根HCOO.事实上, trans-HCOOH(1)、trans-HCOOH(2)和cis-HCOOH互为同分异构体, 后面的过渡态计算结果表明, trans-HCOOH(1)结构可以转变成cis-HCOOH结构, 详细的讨论见2.3.3节.根据键级计算结果, trans-HCOOH(2)中C—H和O—H键的键级分别为0.88和0.59;而cis-HCOOH结构中的C—H和O—H键的键级分别为0.79和0.50.这些数据说明, 两种结构中的C—H和O—H键均以共价键为主, 且cis-HCOOH结构中的C—H和O—H键的键级均较trans-HCOOH(2)更小, 即cis-HCOOH的C—H和O—H键的成键强度更弱, 这与相应的键长相吻合.因而, cis-HCOOH中C—H键和O—H键均较trans-HCOOH(2)更容易断裂, 从而有利于cis-HCOOH的进一步分解.当然, 这需要得到过渡态计算的进一步证实.
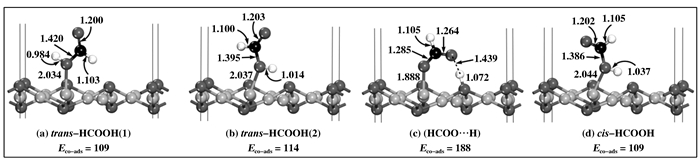
|
图 3 CO和H2O在Cu2O(111)表面共吸附物种的稳定构型 Figure 3 The stable structures of the spices formed by CO+O2 coadsorption trans-HCOOH(1): the structure formed by CO with dissociative H2O; trans-HCOOH(2): the structure formed by CO with molecularly adsorbed H2O; HCOO…H: the structure formed by CO with dissociative H2O; cis-HCOOH: the structure generated from trans-HCOOH(1) or HCOO…H. The values in square brackets denote Mulliken charges. The bond lengths and adsorption energies are given in Å and kJ·mol-1. |
基于上述吸附研究结果, 我们研究了WGSR的氧化还原机理、羧基机理和甲酸根机理3种典型的反应机理.其中, 每种机理均考虑了以解离吸附的H2O作为初始态, 经过一系列的反应最终生成CO2和H2.此外, 甲酸根机理还考虑了以CO和H2O分子的共吸附作为初始态的情况.对于有CO直接参与的反应步骤, 同时考虑了ER和LH两种反应途径.下文中*号代表吸附态, (g)代表气态, 反应热为负值表示放热.
2.3.1 氧化还原机理表 1给出了氧化还原机理中各基元反应的活化能及反应热.由表 1可知, 该反应机理以分子吸附的H2O为初始态, 整个反应过程经历了5步.第1步基元反应为H2O的解离, 解离仅需克服49 kJ·mol-1的能垒, 解离产生的H原子吸附到OSUF位.因此, H2O容易在Cu2O(111)面上发生解离, 这和Mishra等[44]的观点相同.第2步反应为OH的分解, 我们考虑了两种分解路径:一是OH与吸附H反应生成吸附的O和气态的H2, 产生的O原子吸附在3Cu位; 二是O—H键发生断裂, 生成吸附的O原子和H原子. O原子吸附在3Cu位, 而产生的H原子则吸附在OSUF位.两个路径的活化能都很高(254 vs. 187 kJ·mol-1), 且反应高度吸热(205 vs. 145 kJ·mol-1).因此, OH基团的分解在Cu2O(111)面上是很难进行的.第3步基元反应为H原子的迁移, H由OSUF位迁移到CuCUS位需要越过一个不大的能垒(96 kJ·mol-1), 且反应为放热反应, 放出的热量为70 kJ·mol-1, 说明H原子的迁移是可行地.之后两个H原子只需越过一个更低的能垒(62 kJ·mol-1)即可结合形成吸附的H2.最后, 吸附的O原子可与CO分子通过ER反应路径生成吸附的CO2, 反应能垒为114 kJ·mol-1, 且反应高度放热, 放出的热量为239 kJ·mol-1.由2.1节的分析可知, H2和CO2在Cu2O(111)表面均为很弱的物理吸附, 很容易从表面脱附, 从而保证催化剂的循环使用.综上所述, WGSR在Cu2O(111)表面上的氧化还原机理由于第2步中OH很难分解而不可行.
| 表 1 WGSR按照氧化还原机理反应过程中各基元反应的活化能(Ea)和反应热(Er) Table 1 Activation barriers (Ea) and reaction energy (Er) of elementary reactions of WGSR Redox mechanism |
与氧化还原机理相同, 羧基机理也是以吸附的H2O作为反应初始态, 第1步反应同样为H2O的分解.不同的是, 第2步反应为CO与H2O分解形成的OH反应生成cis-COOH, 接下来cis-COOH结构进一步转变成同分异构体的trans-COOH, 然后发生trans-COOH的分解, 形成气态的CO2和吸附的H原子, 吸附的2个H原子反应生成物理吸附的H2, 从而完成整个反应过程. 图 4给出了cis-COOH基团的生成路径图, 由图 4可以看出, CO与OH即可通过ER机理也可通过LH机理反应生成吸附的cis-COOH. ER机理中(见图 4(a)), CO分子从真空中慢慢接近OH基团, 进攻CuCUS—O键, 使之伸长而断裂, 形成顺式羧基(cis-COOH), 反应仅需越过一个较低的能垒(42 kJ·mol-1), 放热42 kJ·mol-1. LH机理(见图 4(b))的反应过程与ER基本类似, 只是反应开始时, CO和OH共吸附于Cu2O(111)表面.相比ER机理, LH机理需要越过的能垒更高(149 kJ·mol-1), 且反应为吸热反应, 吸收的热量为64 kJ·mol-1.因此, 对于cis-COOH的生成, ER机理较LH机理更为有利.事实上, 我们还探究了CO分子和H2O分子作为反应初始态生成COOH基团的情况, 但是优化后并未得到COOH基团, 而是得到CuCUS—CO+OSUF—H2O共吸附组合.

|
图 4 生成cis-COOH基团的反应路径图 Figure 4 The reaction profiles for the formation of the cis-COOH group (a) ER mechanism; (b) LH mechanism. The lengths and energies are given in Å and kJ·mol-1 |
由图 2(k)可知, cis-COOH结构中的H远离OSUF位, 这种结构不利于cis-COOH中O—H键的断裂, 我们推测这种结构很难分解.事实上, 过渡态计算结果也表明, cis-COOH分解生成CO2和H的反应能垒高达323 kJ·mol-1(见图 5(a)), 反应不可行.从结构上看, 相对于cis-COOH, trans-COOH构型(见图 2(l))中的H原子更靠近OSUF位, 这种结构将有利于trans-COOH的进一步分解, 因此我们探究了cis-COOH→trans-COOH的结构转变过程.由图 5(b)可知, cis-COOH基团经O—H键旋转得到trans-COOH基团, 反应能垒仅为46 kJ·mol-1, 这么小的能垒有利于cis-COOH→trans-COOH的构型转变.接下来将进一步发生trans-COOH的分解, 由图 5(c)可知, 分解过程中, Cu2O(111)表面上的OSUF原子吸引trans-COOH上的H原子, 使O—H键断裂, 最终形成气态的CO2和吸附的H原子.该分解反应所需要的活化能要比cis-COOH分解的活化能低许多, 仅为63 kJ·mol-1.最后发生的反应与氧化还原机理的第(3)-(4)步相同.很显然, WGSR的羧基机理在Cu2O(111)表面上是可行地, 比较各反应步骤的能垒, 发现表面上吸附H的迁移过程为控速步骤, 迁移能垒为96 kJ·mol-1.
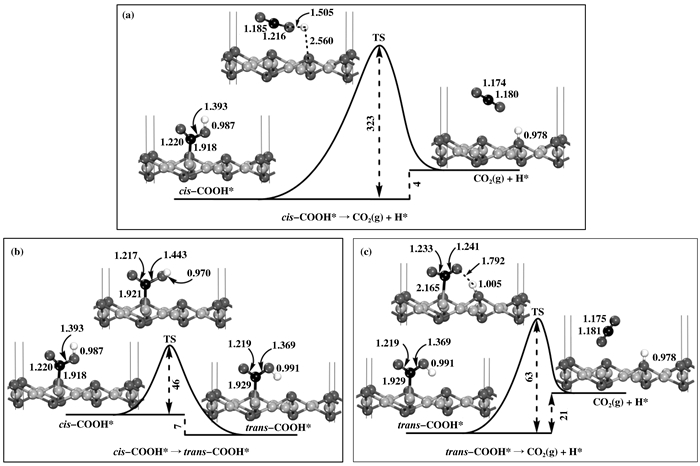
|
图 5 cis-COOH基团分解(a)、cis-COOH基团向trans-COOH基团转变(b)和trans-COOH基团分解(c)的反应路径图 Figure 5 The reaction profiles for the dissociation of the cis-COOH group (a), the transformation from cis-COOH to trans-COOH (b) and the dissociation of the trans-COOH group (c). The lengths and energies are given in Å and kJ·mol-1 |
由共吸附的研究结果可知, CO与分子吸附或解离吸附的H2O共吸附可形成trans-HCOOH(1)、trans-HCOOH(2)和HCOO…H 3种中间体.在讨论甲酸根机理之前, 我们先探究这3种中间体的形成过程.对于每种中间体, 均考虑了可能的所有反应路径, 包括ER和LH机理. 表 2分别给出了生成trans-HCOOH(1)、trans-HCOOH(2)和HCOO…H的可能路径及相应的活化能和反应热.对于trans-HCOOH(1)中间体, 在我们所考虑的4种可能路径中, path 1(a)和1(b)路径是可行的, 而path 1(c)和1(d)不可行, 说明trans-HCOOH(1)中间体可通过CO与解离吸附的H2O作用生成, 而不能通过CO与分子吸附的H2O作用生成.进一步分析表 2中path 1(a)和1(b)的数据可知, path 1(a)所需的活化能极低, 仅为23 kJ·mol-1, 且反应为放热反应(-46 kJ·mol-1); path 1(b)所需越过的能垒更高, 活化能为129 kJ·mol-1, 且反应为吸热反应(63 kJ·mol-1).很显然, 不论从热力学还是动力学上, path 1(a)较path 1(b)更容易进行, 即, ER机理均较LH机理更为有利.对于trans-HCOOH(2)中间体, 我们仅考虑了CO与分子吸附的H2O作用(见表 2中path 2(a)和2(b)), 发现path 2(a)较path 2(b)更为有利, 前者反应需越过153 kJ·mol-1的能垒, 反应吸热90 kJ·mol-1; 而后者虽然为放热反应, 但能垒高达187 kJ·mol-1, 不利于反应的进行. HCOO…H中间体(见表 2中path 3(a)和3(b))则是通过CO进攻H2O解离形成的OH基团得到, 发现path 3(a)需要克服的能垒比path 3(b)低得多, 能垒分别为128和231 kJ·mol-1.由分析可知, trans-HCOOH(1)和HCOO…H两种中间体均是通过CO与解离吸附的H2O反应生成, 而trans-HCOOH(2)则是通过CO与分子吸附的H2O反应生成.比较各有利反应路径的能垒发现trans-HCOOH(1)中间体最容易生成, 其次为HCOO…H, trans-HCOOH(2)最难生成.
| 表 2 形成trans-HCOOH(1)、trans-HCOOH(2)和HCOO…H中间体的活化能(Ea)及反应热(Er) Table 2 Activation barriers (Ea) and reaction energies (Er) for the formation of trans-HCOOH(1), trans-HCOOH(2) and HCOO…H intermediates. |
正如我们在2.2节部分所言, trans-HCOOH(1)和HCOO…H结构中OH上的H离表面OSUF位较远导致该结构很难进一步分解生成CO2和H2, 能垒分别高达322和216 kJ·mol-1.然而, trans-HCOOH(2)和cis-HCOOH结构因为OH上的H离表面更近, 所以我们考虑trans-HCOOH(1)和HCOO…H这两种结构分别转化成trans-HCOOH(2)和cis-HCOOH结构, 然后再进一步分解的反应路径. 表 3列出了各结构转变的反应能垒及反应热.由表 3可知, 在Cu2O(111)表面, trans-HCOOH(1)和HCOO…H均可以转变成trans-HCOOH(2)和cis-HCOOH结构, 特别地, trans-HCOOH(1)→trans-HCOOH(2)反应只需越过一个很小的能垒(5 kJ·mol-1), 相当于自发反应, 且反应为放热反应. trans-HCOOH(1)→ cis-HCOOH反应的能垒亦不高, 仅为59 kJ·mol-1.相对于trans-HCOOH(1)结构的转变, HCOO…H转变成trans-HCOOH(2)和cis-HCOOH相对难些, 能垒分别为91和110 kJ·mol-1, 但其能垒值仍在反应可跨越的范围之内.
| 表 3 Trans-HCOOH(1)和HCOO…H结构分别向trans-HCOOH(2)和cis-HCOOH结构转变的反应能垒(Ea)及反应热(Er) Table 3 Activation barriers (Ea) and reaction energies (Er) of the structure transition from trans-HCOOH(1) and HCOO…H to trans-HCOOH(2) and cis-HCOOH on Cu2O(111) |
甲酸根机理则分别以trans-HCOOH(2)和cis-HCOOH物种为反应初始态, 每种初始态分别考虑了直接分解和间接分解两种不同的反应路径, 见图 6和图 7, 最终得到CO2和H2.当以trans-HCOOH(2)为初始态时, 该初始态通过O—H和C—H键的同时断裂直接分解生成CO2和H2的能垒高达266 kJ·mol-1 (见图 6(a)), 如此高的能垒不利于直接分解反应的进行. trans-HCOOH(2)的间接分解路径见图 6(b), trans-HCOOH(2)先经历TS1断裂O—H键, 生成吸附的mono-HCOO和吸附的H原子.这步反应能垒仅为26 kJ·mol-1; 接下来生成的mono-HCOO基团经历TS2断裂C—H键, 得到气态的CO2和吸附的H原子.这步反应需要越过一个更高的能垒(109 kJ·mol-1); 接下来发生的反应与氧化还原机理的第(3)-(4)步相同(见表 1), 最终H2从表面脱附.整个反应表现为放热反应, 放出的热量为18 kJ·mol-1.这些数据表明该反应路径是可行的, 其中TS2的能垒最高, 说明mono-HCOO的解离为整个反应的控速步骤.
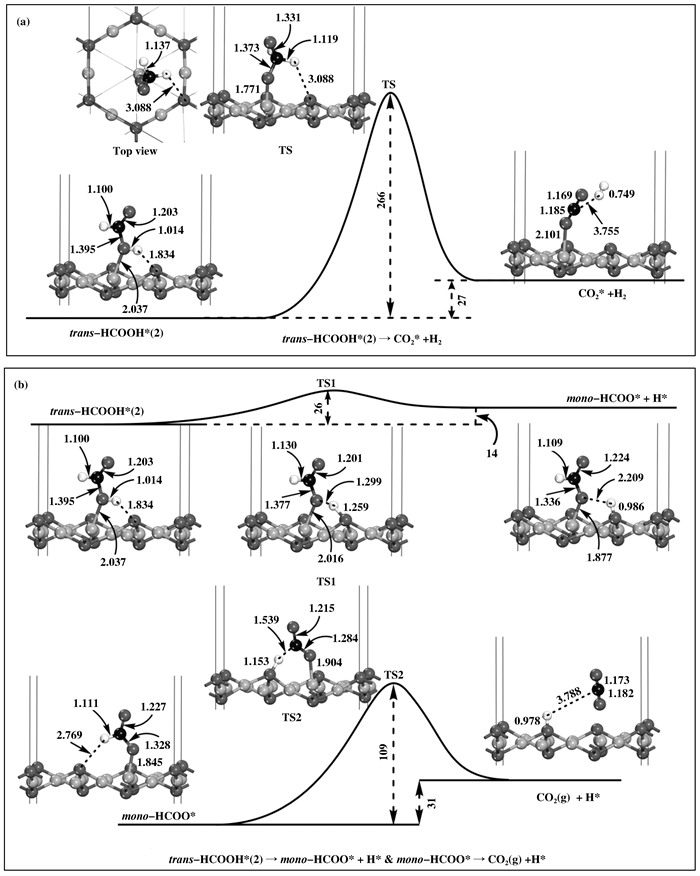
|
图 6 trans-HCOOH(2)进一步分解生成CO2和H2的反应路径图 Figure 6 The reaction profiles for the further dissociation of trans-HCOOH(2) to form CO2 and H2 The lengths and energies are given in Å and kJ·mol-1 |
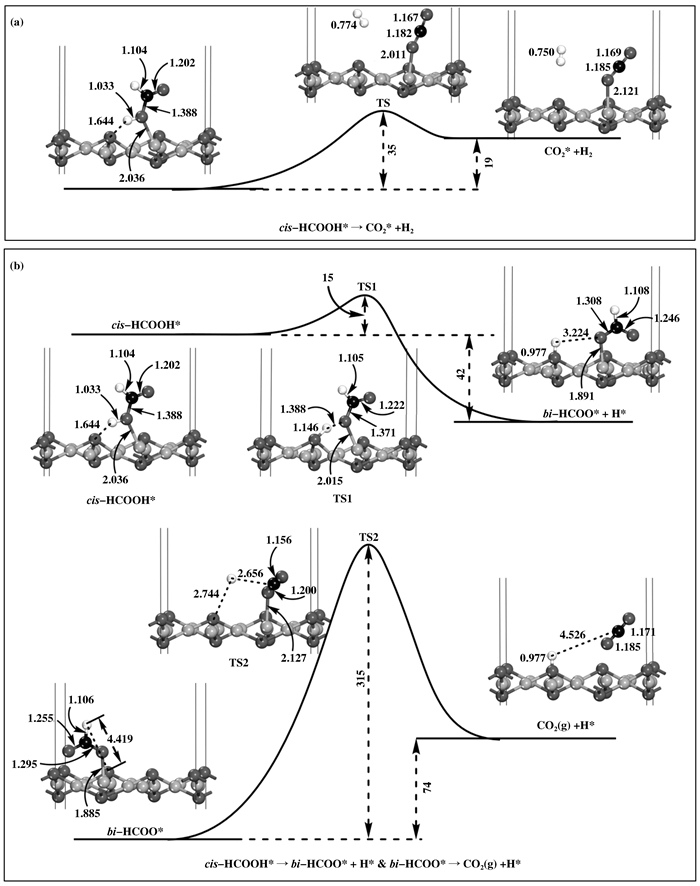
|
图 7 cis-HCOOH进一步分解生成CO2和H2的反应路径图 Figure 7 The reaction profiles for the further dissociation of cis-HCOOH to form CO2 and H2 The lengths and energies are given in Å and kJ·mol-1 |
与trans-HCOOH(2)不同, cis-HCOOH的直接分解路径是可行的; 而先通过生成bi-HCOO, 再进一步分解bi-HCOO基团形成CO2和H2的间接分解路径不可行.如图 7, 前者的能垒为一个较小的值(35 kJ·mol-1).然而, 对于后者, 虽然第一步反应(cis-HCOOH→bi-HCOO*+H*)很容易进行, 能垒仅为15 kJ·mol-1, 但是第二步反应(bi-HCOO* → CO2(g)+H*)很难进行, 其能垒高达315 kJ·mol-1.可见, trans-HCOOH(2)的间接分解和cis-HCOOH的直接分解路径是甲酸根机理的可行路径, 且后者较前者更容易进行, 这与我们在2.2节的键级分析所得结论一致.
综合以上分析, 在Cu2O(111)催化WGSR的3种反应机理中, 氧化还原机理由于OH基团的分解需要越过一个很高的能垒而不可行, 羧基机理和甲酸根机理均可行.其中羧基机理的有利反应路径中各基元反应如下:
(1) H2O*→OH*+H*OSUF Ea1 = 49 kJ·mol-1
(2) CO(g)+OH*→cis-COOH* Ea2 = 42 kJ·mol-1
(3) cis-COOH*→trans-COOH* Ea3 = 46 kJ·mol-1
(4) trans-COOH*→CO2(g)+H*OSUF Ea4 = 63 kJ·mol-1
(5) H*OSUF+H*OSUF→H*CuCUS+H*OSUF Ea5 = 96 kJ·mol-1
(6) H*CuCUS+H*OSUF→H2* Ea6 = 62 kJ·mol-1
(7) H2*→H2(g) Ea7 = 25 kJ·mol-1
甲酸根机理最有利的反应路径中各基元反应如下:
(1) H2O*→OH*+H*OSUF Ea1= 49 kJ·mol-1
(2) CO(g)+OH*+H*OSUF→trans-HCOOH*(1) Ea2 = 23 kJ·mol-1
(3) trans-HCOOH*(1)→cis-HCOOH* Ea3 = 59 kJ·mol-1
(4) cis-HCOOH*→CO2*+H2(g) Ea4 = 35 kJ·mol-1
从能量角度分析, 甲酸根机理较羧基机理更为有利, 前者的控速步骤为trans-HCOOH*(1)→cis-HCOOH*, 其能垒仅为59 kJ·mol-1; 而后者的控速步骤则为H的迁移, 迁移能垒为96 kJ·mol-1.
3 结论采用GGA-BLYP的方法, 通过计算模拟从理论上对Cu2O(111)催化水煤气变换反应的反应机理进行了研究.我们所考虑的3种反应机理中, 甲酸根机理最为有利, 羧基机理次之, 氧化还原机理不可行.甲酸根机理和羧基机理的有利反应路径均始于H2O分子的解离, 解离能垒为49 kJ·mol-1.对于羧基机理, 随后, CO进攻OH基团反应形成cis-COOH, 反应能垒为42 kJ·mol-1.反应形成的cis-COOH与trans-COOH属于同分异构体, 从结构上看, 后者的O—H键中的H原子较前者更靠近Cu2O(111)表面, 从而有利于后者的分解.因此, cis-COOH结构将进一步转变为trans-COOH结构, 转变能垒为46 kJ·mol-1.之后, trans-COOH结构将越过63 kJ·mol-1的能垒分解生成气态的CO2和吸附的H原子.最终, 两个吸附的H原子先迁移、后结合脱出H2. H的迁移是羧基机理的速控步骤, 能垒不高, 为96 kJ·mol-1.
对于甲酸根机理, 接下来CO与H2O解离生成的OH和H反应只需跨过一个较小的能垒(23 kJ·mol-1)即可生成trans-HCOOH(1)中间体, 该中间体将可进一步构型转变成trans-HCOOH(2)和cis-HCOOH两种结构, 所需能垒分别为5和59 kJ·mol-1.由键级分析可知, cis-HCOOH结构较trans-HCOOH(2)结构更容易发生C—H和O—H键的断裂, 我们的过渡态计算结果也证实了这点. cis-HCOOH可直接分解为CO2和H2, 能垒仅为35 kJ·mol-1. trans-HCOOH(2)的直接分解路径不可行, 而经由trans-HCOOH*(2) →mono-HCOO*+H*→CO2(g)+H*+H*→CO2(g)+H2*→CO2(g)+H2(g)的间接分解路径是可行的, 反应所需的最高能垒为109 kJ·mol-1, 较cis-HCOOH*→CO2*+H2(g)反应更难.因此, 甲酸根机理的最优反应路径为H2O* → H*+OH*; CO(g)+OH*+H*→trans-HCOOH*(1)→cis-HCOOH*→CO2*+H2(g)→CO2(g)+H2(g).该路径决速步是trans-HCOOH*(1)转变为cis-HCOOH*的过程, 活化能为59 kJ·mol-1.
| [1] |
a. Saeidi S, Fazollahi F, Najari S, et al. Hydrogen production: Perspectives, separation with special emphasis on kinetics of WGS reaction: A state-of-the-art review[J]. J Ind Eng Chem, 2017, 49(1): 1-25. b. Tan Wei(谈薇), Wang Yu-qi(王玉琪), Wang Jin-yan(王金艳), et al. Promoting effect of potassium on the performance of iron/cocoanut-char catalyst in direct synthesis of ammonia from methane and nitrogen at atmospheric pressure (K促进的Fe/椰壳炭催化剂对甲烷氮气常压合成氨性能的影响)[J]. J Mol Catal(China)(分子催化), 2015, 29(6): 513-524. c. Tian Chang-shui(田长水), Liu Ya-ting(刘雅婷), Sheng Wen-long(盛文龙), et al. Preparation of TiO2 nanofibers templated with mesoporous SiO2 spheres and photocatalytic synthesis of ammonia(介孔SiO2球为模板制备TiO2纳米纤维及光催化合成氨)[J]. J Mol Catal(China)(分子催化), 2016, 30(6): 566-574. |
| [2] |
a. Wainwright M S, Trimm D L. Methanol synthesis and water-gas shift reactions on raney copper catalysts[J]. Catal Today, 1995, 23(1): 29-42. b. Yang Guang(杨光), Chen Yong(陈勇), Li Chen-zhi(李臣芝), et al. Effect of preparation conditions on catalystic performance of Cu-MnOx for low-temperature methanol synthesis(制备条件对Cu-MnOx低温液相甲醇合成性能影响)[J]. J Mol Catal(China)(分子催化), 2015, 29(2): 143-151. c. Tian Hui-hui(田慧辉), Li Lei-lei(李磊磊), Dong Wei-bing(董伟兵), et al. Effect of the polyethylene glycols medium on catalytic performance for the ethanol synthesis from syngas in slurry reactor(聚乙二醇介质对浆态床合成气制乙醇催化性能的影响)[J]. J Mol Catal(China)(分子催化), 2016, 30(3): 234-242. |
| [3] | Rozovskii A Y, Lin G I. Fundamentals of methanol synthesis and decomposition[J]. Top Catal, 2003, 22(3): 137–150. |
| [4] |
a. Velu S, Suzuki K, Kapoor M P, et al. Selective production of hydrogen for fuel cells via oxidative steam reforming of methanol over CuZnAl(Zr)-oxide catalysts[J]. Appl Catal A, 2001, 213(1): 47-63. b. He Run-xia(何润霞), Zhi Ke-duan(智科端), Wang Bin(王斌), et al. Influence of copper-manganese salt precursorson catalytic performance of copper-manganese catalysts for water-gas shift reaction)铜锰盐前驱体对铜锰催化剂变换反应性能的影响)[J]. J Mol Catal(China)(分子催化), 2015, 29(6): 534-544. c. Fang Chuan-yan(方传艳), Wei Jian(位健), Wang Rui(王锐), et al. Catalytic conversion of syngas to light olefins over Cu-Fe based catalyst(Cu-Fe基催化剂上合成气直接制取低碳烯烃的研究)[J]. J Mol Catal(China)(分子催化), 2015, 29(1): 27-34. |
| [5] | Geissler K, Newson E, Vogel F, et al. Autothermal methanol reforming for hydrogen production in fuel cell applications[J]. Phys Chem Chem Phys, 2001, 3(3): 289–293. DOI:10.1039/b004881j |
| [6] | Atake I, Nishida K, Li D, et al. Catalytic behavior of ternary Cu/ZnO/Al2O3 systems prepared by homogeneous precipitation in water-gas shift reaction[J]. J Mol Catal A, 2007, 275(1): 130–138. |
| [7] | Madon R J, Braden D, Kandoi S, et al. Microkinetic analysis and mechanism of the water gas shift reaction over copper catalysts[J]. J Catal, 2011, 281(1): 1–11. DOI:10.1016/j.jcat.2011.03.008 |
| [8] | Utaka T, Sekizawa K, Eguchi K. CO removal by oxygen-assisted water gas shift reaction over supported Cu catalysts[J]. Appl Catal A, 2000, 194/195(1): 21–26. |
| [9] | Shishido T, Yamamoto M, Li D, et al. Water-gas shift reaction over Cu/ZnO and Cu/ZnO/Al2O3 catalysts prepared by homogeneous precipitation[J]. Appl Catal A, 2006, 303(1): 62–71. DOI:10.1016/j.apcata.2006.01.031 |
| [10] | Shishido T, Yamamoto M, Atake I, et al. Cu/Zn-based catalysts improved by adding magnesium for water-gas shift reaction[J]. J Mol Catal A, 2006, 253(1): 270–278. |
| [11] | Lee S, Mettlach N, Nguyen N, et al. Copper oxide reduction through vacuum annealing[J]. Appl Surf Sci, 2003, 206(1): 102–109. |
| [12] | Zhou L, Günther S, Moszynski D, et al. Reactivity of oxidized copper surfaces in methanol oxidation[J]. J Catal, 2005, 235(2): 359–367. DOI:10.1016/j.jcat.2005.08.020 |
| [13] | Matsumoto T, Bennett R A, Stone P, et al. Scanning tunneling microscopy studies of oxygen adsorption on Cu (111)[J]. Surf Sci, 2001, 471(1): 225–245. |
| [14] | Gokhale A A, Dumesic J A, Mavrikakis M. On the mechanism of low-temperature water gas shift reaction on copper[J]. J Am Chem Soc, 2008, 130(4): 1402–1414. DOI:10.1021/ja0768237 |
| [15] | Lin C H, Chen C L, Wang J H. Mechanistic studies of water-gas-shift reaction on transition metals[J]. J Phys Chem C, 2011, 115(38): 18582–18588. DOI:10.1021/jp2034467 |
| [16] | Ren Ning-ning(任宁宁), Guo Ling(郭玲), Dong Xiao-na(董晓娜), et al. Theoretical study on menchanism of water-gas shift reaction catalyzed by binary copper cluster(二元铜团簇催化水煤气变换反应机理的理论研究)[J]. Acta Chim Sin(化学学报), 2015, 73(4): 343–348. |
| [17] | Cong V T, Huynh L K, Jiang J C, et al. Density function theory study of water gas shift reaction on 2Cu/ZnO (1010) surface[J]. Comput Theor Chem, 2016, 1081(1): 62–70. |
| [18] | Chamnankid B, Föttinger K, Rupprechter G, et al. Cu/Ni-loaded CeO2-ZrO2 catalyst for the water-gas shift reaction:Effects of loaded metals and CeO2 addition[J]. Chem Eng Technol, 2014, 37(12): 2129–2134. DOI:10.1002/ceat.201300869 |
| [19] | Li Y, Fu Q, Flytzani-Stephanopoulos M. Low-temperature water-gas shift reaction over Cu-and Ni-loaded cerium oxide catalysts[J]. Appl Catal B, 2000, 27(3): 179–191. DOI:10.1016/S0926-3373(00)00147-8 |
| [20] | Mierczynski P, Maniukiewicz W, Maniecki T P. Comparative studies of Pd, Ru, Ni, Cu/ZnAl2O4 catalysts for the water gas shift reaction[J]. Open Chem, 2013, 11(6): 912–919. |
| [21] | Plata J J, Graciani J, Evans J, et al. Cu deposited on CeOx-modified TiO2(110):Synergistic effects at the metal-oxide interface and the mechanism of the WGS reaction[J]. ACS Catal, 2016, 6(7): 4608–4615. DOI:10.1021/acscatal.6b00948 |
| [22] | Prats H, Gamallo P, Sayos R, et al. Unexpectedly large impact of van der Waals interactions on the description of heterogeneously catalyzed reactions:The water gas shift reaction on Cu(321) as a case example[J]. Phys Chem Chem Phys, 2016, 18(4): 2792–2801. DOI:10.1039/C5CP06863K |
| [23] | Saqlain M A, Hussain A, Siddiq D M, et al. DFT study of synergistic catalysis of the water-gas-shift reaction on Cu-Au bimetallic surfaces[J]. ChemCatChem, 2016, 8(6): 1208–1217. DOI:10.1002/cctc.201501312 |
| [24] | Tang Q L, Liu Z P. Identification of the active Cu phase in the water-gas shift reaction over Cu/ZrO2 from first principles[J]. J Phys Chem C, 2010, 114(18): 8423–8430. DOI:10.1021/jp100864j |
| [25] | Li D L, Xu S P, Cai Y B, et al. Characterization and catalytic performance of Cu/ZnO/Al2O3 water-gas shift catalysts derived from Cu-Zn-Al layered double hydro-xides[J]. Ind Eng Chem Res, 2017, 56(12): 3175–3183. DOI:10.1021/acs.iecr.6b04337 |
| [26] | Mendes D, Chibante V, Mendes A, et al. Determination of the low-temperature water-gas shift reaction kinetics using a Cu-based catalyst[J]. Ind Eng Chem Res, 2010, 49(22): 11269–11279. DOI:10.1021/ie101137b |
| [27] | Liu Y-M, Liu J-T, Liu S-Z, et al. Reaction mechanisms of methanol synthesis from CO/CO2 hydrogenation on Cu2O(111):Comparison with Cu (111)[J]. J CO2 Util, 2017, 20(1): 59–65. |
| [28] | Zeinalipour-Yazdi C D, Efstathiou A M. Preadsorbed water-promoted mechanism of the water-gas shift reaction[J]. J Phys Chem C, 2008, 112(48): 19030–19039. DOI:10.1021/jp806366j |
| [29] | Shido T, Asakura K, Iwasawa Y. Reactant-promoted reaction mechanism for catalytic water-gas shift reaction on MgO[J]. J Catal, 1990, 122(1): 55–67. DOI:10.1016/0021-9517(90)90261-H |
| [30] | Sun B Z, Chen W K, Wang X, et al. A density functional theory study on the adsorption and dissociation of N2O on Cu2O(111) surface[J]. Appl Surf Sci, 2007, 253(18): 7501–7505. DOI:10.1016/j.apsusc.2007.03.042 |
| [31] | Sun Bao-zhen(孙宝珍), Chen Wen-kai(陈文凯), Xu Xiang-lab(徐香兰). Theoretical studies of the adsorption and dissociation of two NO molecules on Cu2O(111) surface(NO双分子在Cu2O(111)面吸附与解离的理论研究)[J]. Acta Phys-Chim Sin(物理化学学报), 2006, 22(9): 1126–1131. |
| [32] | Delley B. An all-electron numerical method for solving the local density functional for polyatomic molecules[J]. J Chem Phys, 1990, 92(1): 508–517. DOI:10.1063/1.458452 |
| [33] | Delley B. From molecules to solids with the DMol3 approach[J]. J Chem Phys, 2000, 113(18): 7756–7764. DOI:10.1063/1.1316015 |
| [34] | Becke A D. A multicenter numerical integration scheme for polyatomic molecules[J]. J Chem Phys, 1988, 88(4): 2547–2553. DOI:10.1063/1.454033 |
| [35] | Lee C, Yang W, Parr R G. Development of the colle-salvetti correlation-energy formula into a functional of the electron density[J]. Phys Rev B, 1988, 37(2): 785–789. DOI:10.1103/PhysRevB.37.785 |
| [36] | Inada Y, Orita H. Efficiency of numerical basis sets for predicting the binding energies of hydrogen bonded complexes:Evidence of small basis set superposition error compared to gaussian basis sets[J]. J Comput Chem, 2008, 29(2): 225–232. DOI:10.1002/(ISSN)1096-987X |
| [37] | Zhao Y, Tian D X. Hydrogen adsorption and dissociation on Pd19 cluster using density functional calculations[J]. Comput Theor Chem, 2012, 991(1): 40–43. |
| [38] | Huber K P, Herzberg G. Molecular Spectra and Molecular Structure IV[M]. New York: Van Nostrand Reinhold, 1979. |
| [39] | Halgren T A, Lipscomb W N. The synchronous-transit method for determining reaction pathways and locating molecular transition states[J]. Chem Phys Lett, 1977, 49(2): 225–232. DOI:10.1016/0009-2614(77)80574-5 |
| [40] | Sun B Z, Chen W K, Xu Y J. Reaction mechanism of CO oxidation on Cu2O(111):A density functional study[J]. J Chem Phys, 2010, 133(15): 154502. DOI:10.1063/1.3489663 |
| [41] | Sun B Z, Xu X L, Chen W K, et al. Theoretical insights into the reaction mechanisms of NO oxidation catalyzed by Cu2O (111)[J]. Appl Surf Sci, 2014, 316(1): 416–423. |
| [42] | Sun B Z, Chen W K, Xu Y J. Coadsorption of CO and NO on the Cu2O(111) surface:A periodic density functional theory study[J]. J Chem Phys, 2009, 131(17): 174503. DOI:10.1063/1.3251055 |
| [43] | Zhang R G, Wang B J, Ling L X, et al. Adsorption and dissociation of H2 on the Cu2O(111) surface:A density functional theory study[J]. Appl Surf Sci, 2010, 257(4): 1175–1180. DOI:10.1016/j.apsusc.2010.07.095 |
| [44] | Mishra A K, de Leeuw N H. Mechanistic insights into the Cu(I) oxide-catalyzed conversion of CO2 to fuels and chemicals:A DFT approach[J]. J CO2 Util, 2016, 15(1): 96–106. |
 2017, Vol. 31
2017, Vol. 31


