钯催化卤代芳烃和芳基硼酸的Suzuki偶联反应是有机化学合成中构筑碳-碳键的重要手段, 是构建联芳烃键的最有效方法之一[1-9], 联苯类化合物作为重要的有机原料, 被广泛应用于天然产物、药物中间体和功能材料等合成领域[10-14].然而由于均相钯催化剂难以分离, 易对产物造成污染, 具有回收困难及无法循环利用等缺点, 限制了该反应在工业上的应用, 而负载型钯催化剂则是解决上述问题的可行途径之一[15-19].
催化剂载体是负载型催化剂的重要组成部分, 主要用于支持活性组分, 使催化剂具有特定的物理性状.硅纳米片是近年来科学家们研究制备的新型材料, 由硅化钙在酸性条件下水解得到的层状材料, 与石墨烯结构类似, 具有层状、二维蜂窝状网格结构[20-25].相比于传统的硅纳米颗粒, 这种硅纳米片的厚度只有2~5 nm, 具有极好的结晶性, 电学性能和大的比表面积, 且表面存在一定量的Si-H和Si-OH基团, 可以用功能基团对其进行表面改性, 因此非常适合作为负载型催化剂的优良载体[26-27].
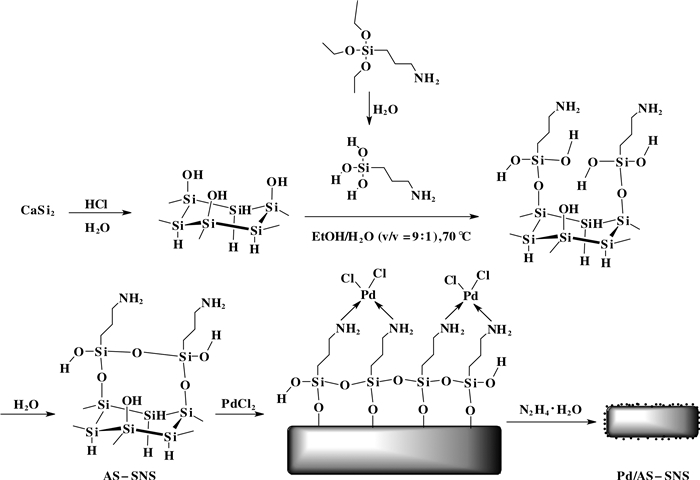
通过硅化钙在酸性条件下水解反应制得硅纳米片(如图 1所示), 采用3-氨丙基三乙氧基硅烷对其进行表面修饰, 合成了表面修饰的硅纳米片载体.再与氯化钯配位, 得到功能化的硅纳米片负载钯催化剂(Pd/AS-SNS), 并研究了其催化溴代芳烃和芳基硼酸的Suzuki偶联反应性能.
|
图 1 硅纳米片负载钯催化剂(Pd/AS-SNS)的合成路线 Figure 1 Schematic diagram for the forming process of Pd/AS-SNS composite materials |
所用药品和试剂均为市售分析纯或化学纯.红外使用Nicolet700红外线光谱仪测定;形貌分析使用Hitachi(日立) HT7700透射电镜;核磁共振采用Bruker Advance 400 MHz型核磁共振仪测定, CDCl3为溶剂, TMS为内标;气相色谱仪GC采用日本岛津GC-2010.
1.2 催化剂制备 1.2.1 硅纳米片(SNS)载体的制备硅纳米片的制备方法已有不少文献报道[28-30], 我们在参考文献基础上, 成功制备了硅纳米片材料.称取1 g CaSi2放入150 mL史莱克瓶中, 加入100 mL浓盐酸, 氮气保护, -25 ℃搅拌反应5 d.然后抽滤, 乙醇洗数次, 直到滤液洗成中性.得到灰绿色滤渣, 真空干燥, 研磨, 得到0.48 g灰绿色固体粉末Si6H3(OH)3, 标记为SNS.
1.2.2 KH550改性硅纳米片(AS-SNS)制备取2.00 g硅纳米片, 量取180 mL工业酒精置于300 mL烧瓶中, 超声分散30 min, 加入20 mL水.然后70 ℃搅拌回流, 逐滴加入10 mL 3-氨丙基三乙氧基硅烷, 继续反应8 h, 抽滤并用酒精洗涤数次, 除去未反应的硅烷偶联剂, 得到灰色固体粉末.然后60 ℃真空干燥10 h, 取出产品, 研磨, 得到2.05 g硅烷偶联剂KH550改性的硅纳米片, 标记为AS-SNS.
1.2.3 催化剂(Pd/AS-SNS)的制备配置PdCl2溶液:称取166.63 mg PdCl2, 加少量浓盐酸溶解, 转移到10 mL容量瓶, 加蒸馏水定容, 得到钯含量为10 mg/mL的PdCl2溶液.
硅纳米片负载1%钯催化剂的制备:称取2.00 g改性的硅纳米片AS-SNS置于300 mL烧瓶中, 加入180 mL无水乙醇.超声分散30 min, 然后滴加2 mL PdCl2溶液, 搅拌3 h, 用稀NaOH调pH 8~9, 加入过量水合肼, 继续搅拌3 h, 然后抽滤并用酒精洗涤数次, 得到灰色固体粉末, 置于60 ℃真空干燥箱中干燥10 h, 取出产品, 研磨, 得到1.92 g钯负载量为1%的硅纳米片负载钯催化剂, 标记为Pd/AS-SNS-1.
同理, 我们负载了不同Pd含量的催化剂, 得到Pd/AS-SNS-2、Pd/AS-SNS-3、Pd/AS-SNS-4、Pd/AS-SNS-5.
作为对比, Aldrich公司生产的纳米二氧化硅也使用了同样的负载方法得到钯负载量为2%的催化剂(Pd/SiO2-2).
1.3 Pd/AS-SNS催化Suzuki偶联反应在10 mL的史莱克瓶中, 加入1.0 mmol溴代芳烃、1.2 mmol芳基硼酸、2.0 mmol碳酸钾, 6 mL乙醇/水(体积比为1: 1)混合溶剂和加入定量的催化剂Pd/AS-SNS(Pd相对溴代芳烃摩尔比为0.2%), 然后在55 ℃下搅拌反应一定的时间, 取少量反应液, 用乙酸乙酯萃取, 将所得有机相进行气相色谱GC-2010分析反应产率.反应完成后, 过滤掉催化剂, 混合物用水洗3次, 再用乙酸乙酯萃取3次, 用无水硫酸镁干燥, 过滤, 旋蒸掉溶剂, 用石油醚和乙酸乙酯过柱分离, 所得产物进行核磁表征.
2 结果与讨论 2.1 AS-SNS和Pd/AS-SNS的表征首先, 以硅化钙为原料, 在酸性条件下水解制得硅纳米片载体, 通过图 1所示的路线合成硅纳米片负载钯催化剂Pd/AS-SNS.并通过透射电子显微镜(TEM)和电感耦合等离子体质谱(ICP-MS)对其进行表征.
为进一步证实钯纳米颗粒负载到硅纳米片上, 以及负载的钯颗粒的大小和分散情况, 我们用透射电子显微镜对载体硅纳米片和硅纳米片负载钯催化剂进行了表征, 测试结果如图 2所示.硅纳米片的TEM图(a)表明硅纳米片为片状结构.图(b)说明了3-氨丙基三乙氧基硅烷改性后的硅纳米片结构形状没有发生变化.图(c, d)为钯负载量分别为2%和3%的催化剂Pd/AS-SNS的TEM图, 可以明显看出, 在载体表面负载了较多的钯纳米粒子, 钯颗粒尺寸大小主要为2~5 nm, 且分散较均匀.而从图(e)催化剂Pd/AS-SNS-5的TEM图可知, 负载量较大时, 钯纳米粒子会发生一定团聚而变大.图(f)说明了未用3-氨丙基三乙氧基硅烷改性的硅纳米片直接负载钯催化剂, 由于缺少锚固基团, 导致负载的钯粒子相对较少且会团聚长大.

|
图 2 (a) 硅纳米片, (b) AS-SNS, (c) Pd/AS-SNS-2, (d) Pd/AS-SNS-3, (e) Pd/AS-SNS-5, (f) Pd/SNS-2的TEM图 Figure 2 TEM micrograph for silicon nanosheets and products (a) silicon nanosheets, (b) AS-SNS, (c) Pd/AS-SNS-2, (d) Pd/AS-SNS-3, (e) Pd/AS-SNS-5, (f) Pd/SNS-2 |
ICP-MS测试催化剂中Pd含量如表 1所示.
| 表 1 ICP-MS测催化剂中Pd含量 Table 1 ICP-MS analysis for Pd content loading |
我们以对溴甲苯与苯硼酸的反应作为Suzuki模型反应, 探索硅纳米片负载钯催化剂Pd/AS-SNS的催化活性, 考察不同条件(催化剂用量、不同钯负载量的催化剂、溶剂及碱)对催化性能的影响, 进行反应条件优化.
从表 2中可知, 当催化剂Pd/AS-SNS-2用量为0.2%Pd(Pd相对对溴甲苯摩尔比为1%)时, 反应1 h, 对溴甲苯与苯硼酸的反应产率已经达到了99%(表 2, Entry 3), 当催化剂用量减少到0.005%时, 通过延长反应时间, 仍然能获得69%的产率(表 2, Entry 6), 表明用很少量的该催化剂催化Suzuki反应, 既能起到很高效的催化活性.所以从反应效率和节约的角度考虑, 较合理的催化剂用量为0.2%Pd.
| 表 2 催化剂用量对Suzuki反应的影响 Table 2 Catalyst optimization of Suzuki-Miyaura reactionsa |
从表 3中可以看出, 3-氨丙基三乙氧基硅烷改性的硅纳米片负载钯催化剂的催化活性较好(表 3, Entry1-5), 反应1 h, Suzuki反应产率均达到了90%以上.其中钯负载量为2%的硅纳米片负载钯催化剂Pd/AS-SiO2-2催化效果最佳, 反应1 h, 产率达到99%(表 3, Entry2).当钯负载量超过2%时, 催化剂的催化活性逐渐降低.由表 1中ICP-MS数据可知, 这是由于随着钯负载量较大时, 逐渐超出了硅纳米片载体对钯纳米粒子的承受能力, 使钯不能均匀的负载到载体上.而且从图 2中TEM图谱可知, 当钯负载量较大时, 会聚集形成较大的钯纳米颗粒, 分散度下降, 导致该催化剂的催化活性降低. 表 3中Entry6可知没有用3-氨丙基三乙氧基硅烷改性的硅纳米片直接负载的钯催化剂Pd/SiO2-2的催化效果明显下降, 由图 2中TEM图谱(f)可知, 因为载体没有锚固基团, 直接负载导致钯颗粒团聚长大且钯负载量较少, 自然催化效果不佳.从上述数据分析可知2%钯负载量的催化剂Pd/AS-SiO2-2的催化活性最好.
| 表 3 不同Pd负载量的催化剂对Suzuki反应的影响 Table 3 Various catalyst formulations in the model reaction of Suzuki coupling reactiona |
从表 4中可以看出, 在催化剂Pd/AS-SNS-2催化作用下, 对溴甲苯和苯硼酸在醇水体系中反应效果较好, 发现当水与无水乙醇体积比例为1: 1时, 反应1 h, 能获得最高产率99%(表 4, Entry1).所以选取无水乙醇和水体积比1: 1作为该反应的最佳溶剂.
| 表 4 不同溶剂对Suzuki反应的影响 Table 4 Solvent optimization of Suzuki reactions in the presence of Pd/AS-SiO2-2 a |
在乙醇/水(v/v=1: 1)混合溶剂体系下, 考察了使用不同碱对Suzuki偶联反应的影响.从表 5中可以看出, 当无机碱碳酸钾、碳酸钠及磷酸钾作为反应用碱时, 均能达到很好的效果(表 5, Entry1-3), 其中碳酸钾作碱时, 产率最高, 反应1 h, 产率达到99%.而使用有机碱的效果明显不佳.所以选择碳酸钾作为该反应的最佳碱.
| 表 5 不同碱对Suzuki反应的影响 Table 5 Base optimization of Suzuki reactions in the presence of Pd/AS-SNS-2 a |
为进一步验证硅纳米片负载钯催化剂Pd/AS-SNS在Suzuki偶联反应具有广泛适用性, 在最佳反应条件下, 通过改变所使用的溴代芳烃及芳基硼酸的种类, 考察了Pd/AS-SNS催化不同底物的Suzuki偶联反应, 结果见表 6.从表 6中可知, 对于无论是带有吸电基还是供电基的溴代芳烃和芳基硼酸的Suzuki反应, 产率均达到91%以上(表 6, Entry1-14), 表明硅纳米片负载钯催化剂Pd/AS-SNS对于Suzuki反应具有非常高效的催化活性.
| 表 6 催化剂Pd/AS-SNS催化不同底物的Suzuki反应 Table 6 Catalytic performance of Pd-AS-SNS-2 on the Suzuki reaction for different substancesa |
催化剂的回收和循环使用性能是负载型催化剂的重要指标之一, 我们以对溴甲苯与苯硼酸的反应为例, 考察了硅纳米片负载钯催化剂的重复使用性能, 结果见图 3.从图 3可知, 催化剂Pd/AS-SNS-2循环使用8次, 催化对溴甲苯与苯硼酸的反应产率依然能达到95%左右, 说明了催化剂Pd/AS-SNS具有很好的稳定性.我们对重复使用了8次的催化剂Pd/AS-SNS-2做了ICP-MS测试, 其钯含量为1.42%, 与使用前Pd/AS-SNS-2的钯含量1.82%相比, 下降了0.4%, 表明有一部分钯损失.由图 4 TEM测试结果可以看出催化剂循环使用8次后, 催化剂的结构没有发生变化, 但有部分钯纳米颗粒间的团聚略有加重.因此, 催化剂循环使用过程中钯的微量流失以及钯粒子间的团聚加重是导致催化剂活性降低的主要原因.

|
图 3 催化剂Pd/AS-SNS的循环使用结果 Figure 3 Recycling of Pd/AS-SiO2-2 catalyst on the suzuki reaction |

|
图 4 催化剂Pd/AS-SNS-2循环使用8次后的TEM图 Figure 4 TEM micrograph for Pd/AS-SNS-2 after 8 recycles |
通过硅化钙在酸性条件下水解制得硅纳米片为载体, 经3-氨丙基三乙氧基硅烷化学改性后与氯化钯配位, 再经还原制备了一种新型的硅纳米片负载钯催化剂, 并将其成功应用于Suzuki反应, 在温和的反应条件下, 这种新颖的硅纳米片负载钯催化剂可有效地催化多种溴代芳烃与芳基硼酸的Suzuki反应, 产率高达91%以上.此外, 经多次循环使用后, 该催化剂非常稳定, 依然保持良好的催化活性.
| [1] | Littke A F, Fu G C. Palladium-catalyzed coupling reactions of aryl chlorides[J]. Angew Chem Int Ed, 2002, 41(22): 4176–4211. DOI:10.1002/1521-3773(20021115)41:22<4176::AID-ANIE4176>3.0.CO;2-U |
| [2] | Shen X, Jones G O, Watson D A, et al. Enantioselective synthesis of axially chiral biaryls by the Pd-catalyzed suzukimiyaura reaction:Substrate scope and quantum mechanical investigations[J]. J Am Chem Soc, 2010, 132(32): 11278–11287. DOI:10.1021/ja104297g |
| [3] | Guo M P(郭孟萍), Zhou Li(周丽), He R(何仁). Study on suzuki reaction for the synthesis of fluorinated liquid crystals catalyzed by P, N coordinated palladium complexes(P, N配位的环钯配合物催化Suzuki偶联合成含氟液晶化合物的研究)[J]. J Mol Catal (China)(分子催化), 2006, 20(3): 203–206. |
| [4] | Suzuki A. Cross-coupling reactions of organoboranes:An easy way to construct C-C bonds (Nobel Lecture)[J]. Angew Chem Int Ed, 2011, 50(30): 6722–6737. DOI:10.1002/anie.201101379 |
| [5] | Sajith A M, Muralidharan A. Exploration of copper and amine-free sonogashira cross coupling reactions of 2-halo-3-alkyl imidazo[4, 5-b]pyridines using tetrabutyl ammonium acetate as an activator under microwave enhanced conditions[J]. Tetra Lett, 2012, 53(39): 5206–5210. DOI:10.1016/j.tetlet.2012.07.028 |
| [6] | Xu Guang-qing(徐广庆), Zhao Qing(赵庆), Tang Wen-jun(汤文军). Development of efficient asymmetric suzuki-miyaura cross-coupling and applications in synthesis(发展高效的不对称Suzuki-Miyaura偶联反应及其合成应用)[J]. Chin J Org Chem(China)(有机化学), 2014, 34(10): 1919–1940. |
| [7] | Li Q H, Ding Y, Yang X J. Nickel-catalyzed cross-coupling reaction of alkynyl bromides with Grignard reagents[J]. Chin Chem Lett, 2014, 25(9): 1296–1300. |
| [8] | Li Q H, Ding Y, Huang N W. Synthesis and biological activities of dithiocarbamates containing 1, 2, 3-triazoles group[J]. Chin Chem Lett, 2014, 25(11): 1469–1472. DOI:10.1016/j.cclet.2014.05.022 |
| [9] | Zhang Hong-ying(张红英), Yan Xue-ming(颜雪明). Synthesis of the functional MCM-41 supported bidentate nitrogen palladium complex and its catalytic properties in the suzuki coupling(功能化MCM-41负载双齿氮钯催化剂的制备及其在Suzuki偶联中的应用)[J]. J Mol Catal(China)(分子催化), 2013, 27(5): 400–405. |
| [10] | Miyaura N, Suzuki A. Palladium-catalyzed cross-coupling reactions of organoboron compounds[J]. Chem Rev, 1995, 95(7): 2457–2483. DOI:10.1021/cr00039a007 |
| [11] | Corbet J P, Mignani G. Selected patented cross-coupling reaction technologies[J]. Chem Rev, 2006, 106(7): 2651–2710. |
| [12] | Richardson T I, Clarke C A, Yu K L, et al. Novel 3-aryl indoles as progesterone receptor antagonists for uterine fibroids[J]. ACS Med Chem Lett, 2011, 2(2): 148–153. DOI:10.1021/ml100220b |
| [13] | Tan J J, Chen Y G, Li H M, et al. Suzuki-miyaura cross-coupling reactions of unprotected haloimidazoles[J]. J Org Chem, 2014, 79(18): 8871–8876. DOI:10.1021/jo501326r |
| [14] | Xin Y, Wen G A, Zeng W J, et al. Hyperbranched oxadiazole-containing polyfluorenes:toward stable blue light PLEDs[J]. Macromolecules, 2005, 38(16): 6755–6758. DOI:10.1021/ma050833f |
| [15] | Schweizer S, Becht J M, Le Drian C. Highly efficient reusable polymer-supported Pd catalysts of general use for the Suzuki reaction[J]. Tetrahedron, 2010, 66(3): 765–772. DOI:10.1016/j.tet.2009.11.050 |
| [16] | Zhang Fei-bao(张飞豹), Zhang Cai-hua(张蔡华), Deng Yuan(邓元), et al. Palladium Supported on SBA-15 as a new recyclable catalyst for the mizoroki-heck reaction(SBA-15负载Pd催化剂的制备及其在Heck反应中的应用研究)[J]. Acta Chim Sin(China)(化学学报), 2010, 68(5): 443–448. |
| [17] | Estrada G O D, Blanco A L P, da Silva J F M, et al. Pd/Nb2O5:efficient supported palladium heterogeneous catalyst in the production of key intermediates for the synthesis of 'sartans' via the Suzuki reaction[J]. Tetra Lett, 2012, 53(9): 1089–1093. DOI:10.1016/j.tetlet.2011.12.076 |
| [18] | Du Q W, Zhang W, Ma H, et al. Immobilized palladium on surface-modified Fe3O4/SiO2 nanoparticles:as a magnetically separable and stable recyclable high-perfor-mance catalyst for Suzuki and Heck cross-coupling reactions[J]. Tetrahedron, 2012, 68(6): 3577–3584. |
| [19] | Yuan Ding-zhong(袁定重), Chen Bi-bo(陈碧波). Synthesis and characterization of graphene oxide supported schiff base palladium catalyst and its catalytic performance to suzuki reaction(氧化石墨烯负载席夫碱钯催化剂的合成, 表征及对Suzuki反应催化性能的研究)[J]. Chin J Org Chem(China)(有机化学), 2014, 34(8): 1630–1638. |
| [20] | Changgu L, Xiao D W, Jeffrey W K, et al. Measurement of the elastic properties and intrinsic strength of monolayer graphene[J]. Science, 2008, 321(5887): 385–387. |
| [21] | Tetsuya M, Kengo N, Masuhiro M. Formation of single-and double-layer silicon in slit pores[J]. Phys Rev B, 2008, 77(8): 081401(1-4). |
| [22] | Cahangirow S, Topsakal M. Universal detector efficiency of a mesoscopic capacitor[J]. Phys Rev Lett, 2009, 102(23): 236801(1-4). |
| [23] | Takeda K, Shiraishi K. Electronic structure of silicon-oxygen high polymers[J]. Sol Sta Commun, 1993, 85(4): 301–305. DOI:10.1016/0038-1098(93)90020-N |
| [24] | Hideyuki N, Takuya M, Masashi H, et al. Soft synthesis of singl-crystal silicon monolayer sheets[J]. Angew Chem, 2006, 45(38): 6303–6306. DOI:10.1002/(ISSN)1521-3773 |
| [25] | Yusuke S, Hirotaka O, Takuya M, et al. Synthesis and optical properties of monolayer organosilicon nanosheets[J]. J Am Chem Soc, 2010, 132(17): 5946–5947. DOI:10.1021/ja100919d |
| [26] |
a. Basu B, Paul S. An improved preparation of mesoporous silica-supported Pd as sustainable catalysts for phosphine-free Suzuki-Miyaura and Heck coupling reactions[J]. Appl Org Chem, 2013, 27(10):588-594. b. Wang Qing-yun(王清云),Tong Yong-chun(佟永纯),Xu Xin-jian(徐新建), et al. The influence of the stone-wales defect in graphene on the platinum catalyzed dissociation of oxygen(石墨烯中的stone-wales缺陷对铂原子催化解离氧分子的影响)[J]. J Mol Catal(China)(分子催化), 2016, 30(1):80-87. c. Yang Qin(杨琴),Zhou Juan(周娟),Yin Meng-yun(尹梦云), et al. Lysine-graphene oxideasa heterogeneous ligand applied in CuI-catalyzed C-N coupling reaction (赖氨酸修饰氧化石墨烯固体配体在C-N偶联中的应用研究)[J]. J Mol Catal(China)(分子催化), 2016, 30(2):99-104. d. Ni Jun(倪军),Lup Xiao-fang(罗小芳),Zhan Yong(詹勇), et al. Application and progress of the novel activated carbon in the field of catalysis(新型碳材料在催化领域中的应用及进展)[J]. J Mol Catal(China)(分子催化), 2016, 30(3):282-296. |
| [27] |
a. Adam F, Appaturi J N, Iqbal A. The utilization of rice husk silica as a catalyst:Review and recent progress[J]. Catal Today, 2012, 190(1):2-14. b. Pang Shao-feng(庞少峰), Yuan Hang-kong(袁航空), Wu Ya-juan(吴亚娟), et al. Co@N-graphene/C catalyzed oxidative amination of toluene derivatives(Co@N-石墨烯/C催化甲苯衍生物氧化胺化研究)[J]. J Mol Catal(China)(分子催化), 2017, 31(2):105-120. c. Lu Gong-xuan(吕功煊), Tian Bin(田彬). Formation of deuterium and helium during photocatalytic hydrogen generation from water catalyzed by Pt-graphene sensitized with Br-dye under visible light irradiation9溴染料敏化担载Pt石墨烯催化可见光制氢、氘和氦)[J]. J Mol Catal(China)(分子催化), 2017, 31(2):101-104. d. Lu Gong-xuan(吕功煊),Zhang Wen-yan(张文妍). Photocatalytic hydrogen evolution and induced transmutation of potassium to calcium via low-energy nuclear reaction(LENR) driven by visible light (可见光驱动的光催化产氢同时诱导低能核反应嬗变钾为钙)[J]. J Mol Catal(China)(分子催化), 2017, 31(5):401-410. |
| [28] | Hideyuki N, Masahiko I, Hiroshi N. Preparation and structure of novel siloxene nanosheets[J]. Chem Commun, 2005, 23(0): 2945–2947. |
| [29] | Hideyuki N, Mitsuru N, Koji N, et al. Preparation of alkyl-modified silicon nanosheets by hydrosilylation of layered polysilane (Si6H6)[J]. J Am Chem Soc, 2012, 134(12): 5452–5455. |
| [30] | Zhang F B, Lv S F, Jiang J X, et al. Preparation of siloxene nanosheet-supported palladium as sustainable catalyst for Mizoroki-Heck reaction[J]. Appl Org Chem, 2014, 28(11): 826–830. DOI:10.1002/aoc.v28.11 |
 2018, Vol. 32
2018, Vol. 32