2. 江南大学 粮食发酵工艺与技术国家工程实验室, 江苏 无锡 214122
2. National Engineering Laboratory for Cereal Fermentation Technology, Jiangnan University, Wu xi 214122, China
固定化酶技术通过将酶固定在载体上获得酶的催化特性, 并使酶能回收再利用, 因此被广泛应用在食品、医药等行业[1-3].酶固定化载体有很多种, 如无机材料、生物大分子和高分子聚合物材料[1-3], 其中, 高分子聚合物因比表面积大、成本低和易修饰改性被广泛应用[1-2, 4-6].
脂肪酶(EC 3.1.1.3, Lipase), 是一类特殊的酯链水解酶, 能催化多种反应, 如酯化、水解和聚合反应, 在食品工业中应用广泛, 但游离脂肪酶存在易失活、难回收的问题, 而固定化酶技术能改善脂肪酶的催化稳定性和重复利用性[1-3].
聚丙烯腈由丙烯腈和丙烯酸甲酯共聚而成, 耐一般溶剂、不易水解、抗氧化、化学稳定性好, 耐微生物侵蚀, 具有优异的成膜性, 已被广泛应用于膜分离及酶固定化领域[7-12].但聚丙烯腈富含惰性强的腈基, 分子链间作用力强, 链对称性差, 成膜后表面反应性差, 机械强度一般, 生物相容性差[10, 13], 因此为获得性能更好的酶固定化载体, 需对聚丙烯腈膜进行表面改性, 常用的改性方法有化学交联、复合涂层等[14-15].
聚乙烯亚胺富含胺类基团, 可用于聚丙烯腈表面改性[16-17]以增强聚丙烯腈膜的表面反应活性.我们在聚丙烯腈膜表面采用化学法交联聚乙烯亚胺后固定脂肪酶, 引入具有生物亲和性的海藻酸钠参与酶固定, 再以氯化钙后处理, 成功提高固定化脂肪酶的固定量和稳定性, 得到具有工业应用潜力的固定化脂肪酶.
1 材料与方法 1.1 材料与仪器脂肪酶(Lipase, 10 000 U/g), 购自昆明爱科特生物科技有限公司; 聚丙烯腈粉末(PAN, Mw 60 000~80 000), 购自上海金山石化公司; 聚乙烯亚胺(PEI, Mw 1800)、棕榈酸对硝基苯酯(p-NPP), 购自阿拉丁(上海)有限公司; 其他生化试剂均购自国药集团化学试剂有限公司.
往复式水浴恒温培养振荡器, 购自上海智城分析仪器制造有限公司; 紫外-可见光分光光度计UV-1200, 购自上海美谱达仪器有限公司; 傅里叶变换红外光谱仪, 购自美国尼高力仪器公司.
1.2 实验方法 1.2.1 聚丙烯腈中空膜制备及化学交联聚乙烯亚胺采用相转化法制备聚丙烯腈中空膜: 10 g聚丙烯腈粉末与5 mL致孔剂聚乙二醇[18]加入55 mL N, N-二甲基甲酰胺中, 混匀后65 ℃密封反应48 h, 形成棕黄色粘稠液体后取出, 室温冷却12 h除去气泡; 室温下将反应液在深度0.1 mm的玻璃板槽中铺开, 室温蒸发90 s后转移至凝固浴(10% DMF/水溶液, 25 ℃)中2 min铸膜.将膜裁剪成20 cm2待用.取样烘干称重.记为PAN膜.
取PAN膜, 置于2 mol/L NaOH溶液中, 60 ℃反应90 min; 反应结束后转移至1 mol/L HCl溶液中, 质子化4 h后蒸馏水洗净, 最后投入到PEI水溶液(10 g/L)中, 37 ℃过夜搅拌反应; 反应结束用蒸馏水洗净, 待用.记为PAN-PEI膜.
1.2.2 固定脂肪酶取60 mg PAN-PEI膜酸化后加到10 mL脂肪酶液(0.6 mg/mL, pH 5.0)中, 再加入20 mg海藻酸钠, 25 ℃, 150 r/min, 固定2 h.得到固定化脂肪酶记为PAN-PEI-SA/E.
固定后再分别用不同浓度的戊二醛(25 ℃, 静置1.5 h)、环氧氯丙烷(37 ℃, 搅拌1.5 h)和CaCl2(37 ℃, 静置1.5 h)对固定化酶进行后处理.得到固定化脂肪酶记为PAN-PEI-SA/E-GA、PAN-PEI-SA/E-EPC、PAN-PEI-SA/E-CaCl2.
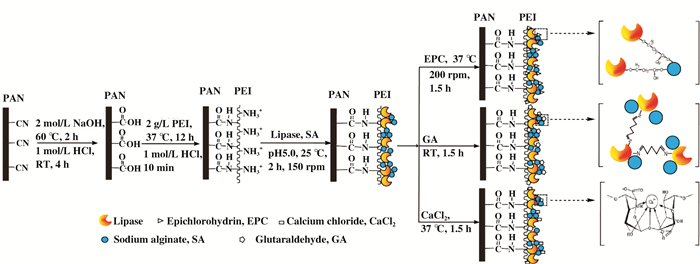
|
图 1 脂肪酶固定化流程示意图 Figure 1 Process of enzyme immobilization |
蛋白含量的测定参照Bradford法[19]:取0.5 mL待测样品加到2.5 mL考马斯亮蓝工作液中, 混匀后静置5 min, 于595 nm处测吸光值, 根据蛋白浓度标准曲线y=6.1312x+0.0705(y为595 nm处吸光值, x为蛋白浓度mg/mL, R2=0.998 4)计算样品中酶量.需做空白对照以排除PEI和海藻酸钠对测量结果的影响.
| $ {\rm{载酶量}}\left( {{\rm{Enzyme\;loading}}} \right)\left( {{\rm{mg\;enzyme/g\;support}}} \right) =\\ \frac{{{\rm{used\;enzyme\;before\;immobilization-remaining\;enzyme\;after\;immobilization}}}}{{{\rm{mass\;of\;support}}}} $ |
脂肪酶酶活测定参照对硝基苯酚法[20]:玻璃试管中加PBS缓冲液(20 mmol/L, pH 7.0)8 mL和适量脂肪酶或固定化脂肪酶, 45 ℃水浴预热5 min后加入预热的棕榈酸对硝基苯酯(100 mmol/L)0.15 mL, 45 ℃恒温振荡反应5 min后, 取1 mL反应液加入到2倍体积的Na2CO3(1 mol/L)中终止反应.空白对照不加酶.
样品稀释适当倍数在405 nm处测吸光值, 根据对硝基苯酚浓度标准曲线y=7.4801x+0.056(y为吸光值, x为对硝基苯酚浓度μmol/L, R2=0.998)计算酶活U.
酶活定义:在实验条件下, 每分钟催化生成1 μmol的对硝基苯酚所需要的酶量, 定义为一个酶活单位(U).
| $ {\rm{aa}}\left( {{\rm{Specific\;activity}}} \right)\left( {{\rm{U/mg}}} \right) = \frac{{{\rm{enzyme\;activity}}}}{{{\rm{mass\;of\;enzyme}}}} $ |
| $ {\rm{相对酶活}}\left( {{\rm{Relative}}} \right)\left( {\rm{\% }} \right) = \frac{{{\rm{enzyme\;activity}}}}{{{\rm{highest\;enzyme\;activity\;of\;same\;Group samples}}}} \times 100 $ |
(1) 万能试验机测样品最大拉伸力: PAN膜裁剪成条状, 调整仪器设置夹距2 cm, 拉伸速度20 mm/min, 预加张力0 N, 测试3次, 取平均值. (2)称重法计算膜孔隙率:干燥的PAN膜质量为m1; 该膜浸没水中12 h后, 擦干表面水渍, 质量为m2.
| $ \begin{array}{l} {\rm{孔隙率}}\left( {{\rm{Porosity}}} \right) = \frac{{{V_{{\rm{pore}}}}}}{{{V_{{\rm{membrane\;appearance}}}}}}\\ \;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\; = \frac{{{V_{{\rm{pore}}}}}}{{{V_{{\rm{pore}}}} + {V_{{\rm{membrane\;skeleton}}}}}}\\ \;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\; = \frac{{{V_{{\rm{pore}}}}}}{{{V_{{\rm{pore}}}} + \frac{{{m_1}}}{{{\rho _{{\rm{PAN}}}}}}}}\\ \;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\; = \;\frac{{{m_2} - {m_1}}}{{{m_2} - {m_1} + \frac{{{m_1}}}{{1.184}}}} \end{array} $ |
其中:聚丙烯腈膜密度1.184 g/cm3; V孔由孔隙吸水量确定, 室温下, V孔=m吸水=m2-m1.
(3) 样品经KBr压片后进行红外吸收扫描, 红外光谱分辨率为0.4 cm-1, 扫描速度为0.2 cm-1/s, 波数扫描范围4 000~400 cm-1.
(4) 样品经表面喷金处理后以扫描电子显微镜对样品表面形态进行分析.
2 结果与讨论 2.1 聚丙烯腈中空膜结构表征及催化原理由图 2可知, 所有样品均在2 242 cm-1处出现腈基(CN)的伸缩振动吸收峰, 2 940 cm-1处出现C—H键的伸缩振动吸收峰, 在1 730 cm-1出现C = O的伸缩振动吸收峰, 这表明聚丙烯腈是由丙烯腈和丙烯酸甲酯共聚而成; 与PAN膜相比, 改性后PAN-PEI膜在1 670 cm-1出现较强的酰胺吸收峰, 在1 560 cm-1处出现CO2--NH3+变形振动峰, 1 402 cm-1处出现CO2-不对称伸缩峰, 表明成功交联PEI; 与PAN-PEI膜相比, 固定化脂肪酶(PAN-PEI-SA/E、PAN-PEI-SA/E-CaCl2、PAN-PEI-SA/E-GA、PAN-PEI-SA/E-EPC)的4个样品中, 在618 cm-1出现脂肪酶特征峰[20], 这表明脂肪酶被成功固定在载体表面.
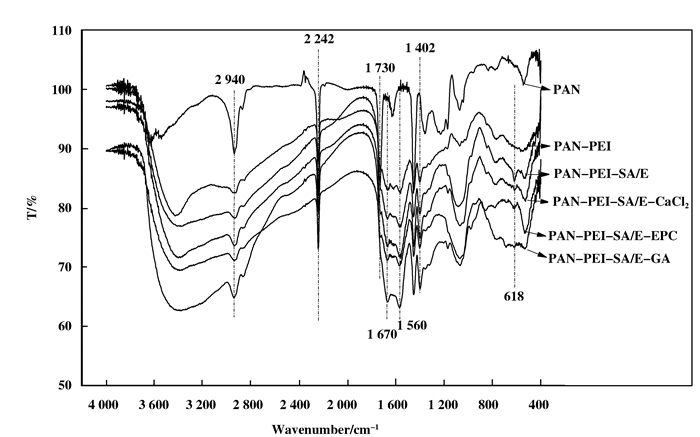
|
图 2 不同样品的红外波谱图 Figure 2 Infrared spectra of PAN、PAN-PEI、PAN-PEI-SA/E、PAN-PEI-SA/E-CaCl2、PAN-PEI-SA/E-GA、PAN-PEI-SA/E-EPC |
结合表 1和图 3, 随着改性和酶的固定, PAN膜的最大拉伸力逐渐降低, 表明采用化学交联PEI的方法改性PAN膜时会对PAN膜结构造成破环, 但主要发生在碱水解和交联PEI时, 而酶固定过程几乎不对膜的机械强度造成破坏. PAN膜内部孔隙在交联PEI后发生变化, 表面孔径逐渐变小, 孔隙率逐渐降低, 由0.85(PAN)降低至0.81(PAN-PEI), PEI层附着在空隙内, 表明PEI交联成功; 固定脂肪酶后(PAN-PEI-SA/E)膜孔隙被海藻酸钠和脂肪酶覆盖, 但孔隙率降低至0.71;进一步处理后(PAN-PEI-SA/E-CaCl2、PAN-PEI-SA/E-GA、PAN-PEI-SA/E-EPC)载体表面海藻酸钠覆盖量减少, 孔隙率则降至0.57, 但脂肪酶仍附着在表面.
| 表 1 最大拉伸力和孔隙率 Table 1 The tensile strength and porosity |

|
图 3 PAN膜改性固定前后扫描电镜图 Figure 3 SEM images of PAN membrances before and after immobiliazation |
脂肪酶的催化活性中心由丝氨酸、天冬氨酸和组氨酸组成, 位于脂肪酶结构内部, 其表面被相对疏水的氨基酸残基形成的螺旋状结构覆盖, 这层“盖子”结构的外表面相对亲水, 而面向内部的内表面相对疏水.酶固定时, 脂肪酶的相对亲水外表面更易与亲水的PAN-PEI膜及海藻酸钠发生相互作用, 达到酶固定的目的; 当疏水性酯类底物(如p-NPP)经传质作用后通过载体的孔隙与固定的脂肪酶发生接触, 脂肪酶“盖子”的疏水表面张开, 底物与活性中心接触, 实现脂肪酶水解酯类的作用.如表 2, 固定后游离脂肪酶的比酶活仅降低0.26 U/mg, 表明改性PAN膜几乎不会造成游离脂肪酶的损失; 但固定化脂肪酶的比酶活只有1.63 U/mg, 这是由于部分固定在PAN膜上的脂肪酶失活[1]和改性PAN膜表面传质阻力[18]较大造成的.
| 表 2 固定前后脂肪酶比酶活 Table 2 Specific Activity of Lipase before and after Immobilization |
PAN膜固定脂肪酶时, 为得到较优的固定效果, 对化学交联反应条件和酶固定条件进行单因素条件优化.
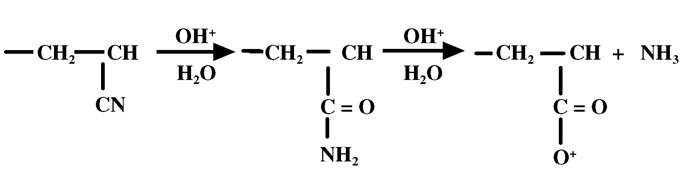
2.2.1 PAN碱水解条件及PEI交联浓度结合图 4和5, 随着碱水解时间增加, PAN膜载体上2 242 cm-1处的CN伸缩振动峰逐渐减小, 而1 730 cm-1处的C = O的伸缩振动峰逐渐增大, 并且在1 670 cm-1出现酰胺吸收峰, 这表明PAN膜与NaOH反应时间越长, 腈基水解量越大, 因为PAN与NaOH溶液在加热的条件下反应, 腈基被不可逆地水解成羧酸盐/酰胺(图 6).但水解时间超过1.5 h后, PAN膜的机械性能降低, 表明膜结构开始被破坏, CN峰大小基本保持不变.
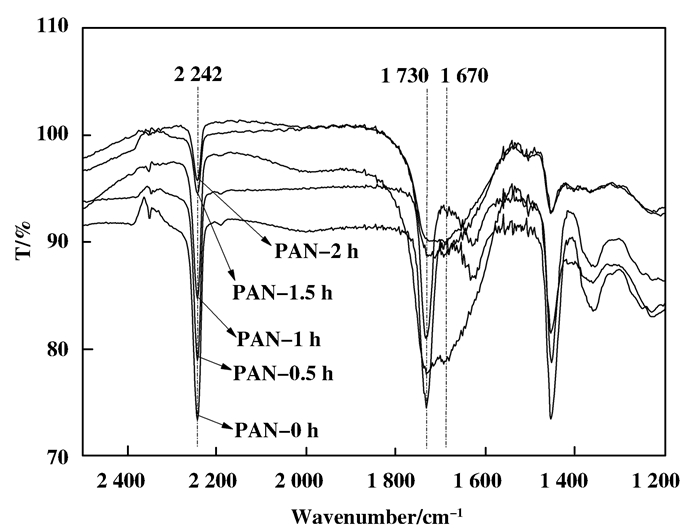
|
图 4 不同水解时间膜红外波谱 Figure 4 Infrared spectra of PAN by different alkaline hydrolysis time |
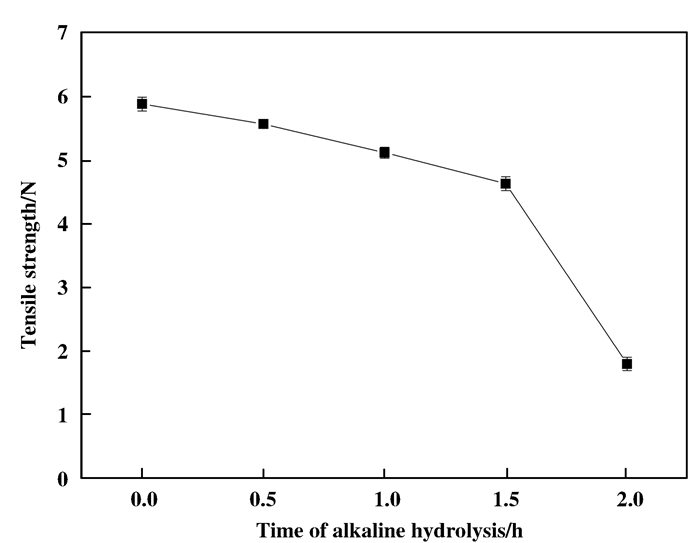
|
图 5 不同水解时间膜最大拉伸力 Figure 5 The tensile strength of PAN by different alkaline hydrolysis time |
|
图 6 碱水解原理[9] Figure 6 Mechanism of alkaline hydrolysis |
由此初步确定碱水解条件为: NaOH浓度为2 mol/L, 碱水解温度为60 ℃, 碱水解时间为90 min.
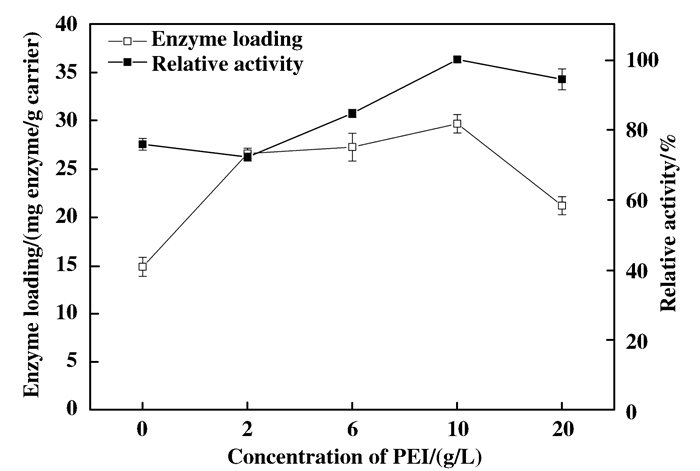
化学交联PEI时, PEI浓度会对交联效果有影响, 分别用不同浓度PEI(0、2、6、10、20 g/L)与质子化后的PAN膜进行反应, 考察PEI浓度对交联效果的影响.
从图 7可知, 随着PEI浓度升高, 固定的脂肪酶量和得到的酶活均不断升高, 当PEI浓度为10 g/L时, PAN膜固定的酶量和得到的酶活最大; 但PEI浓度继续提高时, 固定效果下降, 这可能是因为高浓度的PEI在PAN膜表面发生物理聚集, 形成一层不够牢固的聚集层, 固定结束后固定的在聚集层的酶与PEI一起被洗脱, 使得酶的固定量和固定化酶活降低.
|
图 7 不同浓度PEI对PAN-PEI改性效果的影响 Figure 7 Effect of concentrations of PEI on modification of PAN films |
实验发现, PAN-PEI膜直接固定的脂肪酶易脱落, 重复催化能力弱.为提高稳定性, 在固定过程中分别用戊二醛(GA, 终浓度1%)、牛白蛋白(BSA, 终浓度0.2%)、聚乙烯亚胺(PEI, 终浓度1%)、环氧氯丙烷(EPC, 终浓度2%)、壳聚糖(CTS, 终浓度0.5%)、聚乙二醇400(PEG, 终浓度1%)和海藻酸钠(SA, 终浓度0.5%)参与酶固定, 考察得到的固定化酶稳定性.
从表 3可知, 加入不同试剂对固定结果有不同的影响.直接固定时, 酶活力快速降低, 7次反应后酶活仅保留35.81%, 这是因为静电作用不牢固, 酶分子掉落; 加入SA时, 7次反应后能保留65.45%的酶活, 且与其他试剂(PEI、GA、BSA、EPC、PEG、CTS)相比, SA能提高固定效果, 原因是SA富羧基, 能与荷正电的载体表面的氨基形成更密集的静电作用[21], 将酶分子包裹在载体表面提高酶固定量, 酶固定量由29.7(mg enzyme)/(g support)提高至32.7 (mg enzyme)/(g support), 而且SA生物亲和性好, 能为脂肪酶提供适宜的微环境.
| 表 3 不同试剂对连续反应酶活的影响 Table 3 Effects of different additives during immobilization |
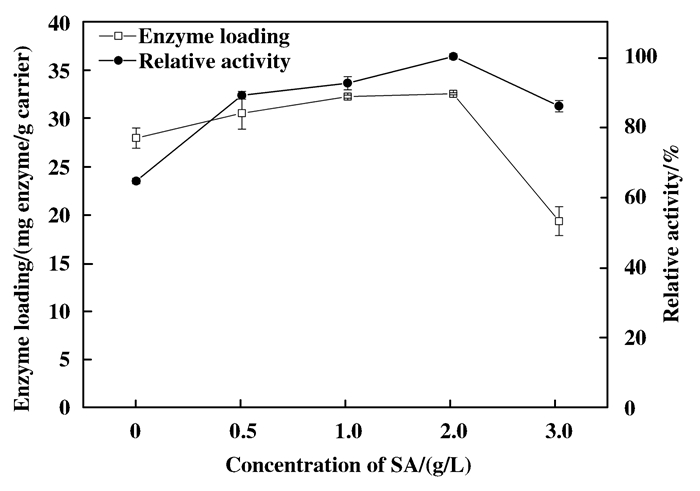
从图 8可知, 随着SA浓度提高, 固定的酶量和酶活均有所提高, 当SA浓度达到2 g/L时, 固定效果最佳; 但SA浓度继续增大会对固定效果造成不利影响, 这是因为高浓度的SA包裹在膜表面, 不仅减少载体与酶的接触机会, 降低酶固定量, 还会增大已固定的酶与底物间的传质阻力, 进而造成固定效果降低.
|
图 8 海藻酸钠浓度对固定效果的影响 Figure 8 Effects of concentrations of sodium alginate on immobilization |
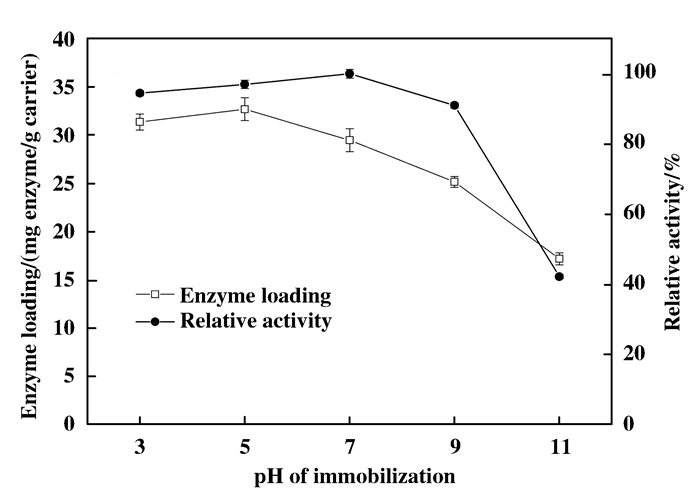
在前一步实验基础上, 分别用pH为3、5、7、9、11的缓冲液来固定酶, 考察环境pH对固定效果的影响.
从图 9可知, 偏酸性条件下固定效果较优, 当pH为5时固定酶量最大, 当固定的pH为7时酶活力最大; 但pH>7时固定效果逐渐变差.原因可能有两个:一是酸性条件下膜表面PEI层带正电, 易与酶分子发生静电作用, 而碱性条件下, 膜表面电荷性质发生变化, 酶结合量降低; 二是实验选择的脂肪酶偏好酸性.由此选择在弱酸性条件下固定酶.
|
图 9 固定时pH对固定效果的影响 Figure 9 Effects of pH on immobilization |
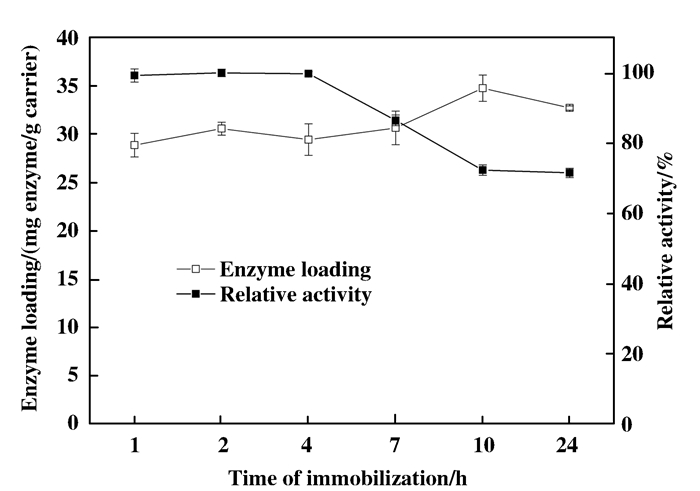
在前一步基础上, 控制固定时间分别为1、2、4、7、10、24 h, 考察固定时间对固定效果的影响.
由图 10可知, 在1~4 h内酶固定量和酶活力变化不大, 其中固定2 h时的酶固定量相对最大; 4~24 h内, 酶固定量增大, 10 h时达到最大值, 但酶活力却下降, 可见在长时间的固定过程中酶活会有损失, 由此选择固定时间为2 h.
|
图 10 固定时间对固定效果的影响 Figure 10 Effects of time on immobilization |
根据单因素实验结果, 选择PAN膜为载体, 碱水解时间为90 min, PEI浓度为10 g/L, 固定条件:加酶量6 mg、载体60 mg、缓冲液10 mL(pH 5.0), 海藻酸钠2 g/L, 温度为25 ℃、转速为150 r/min、时间2 h.
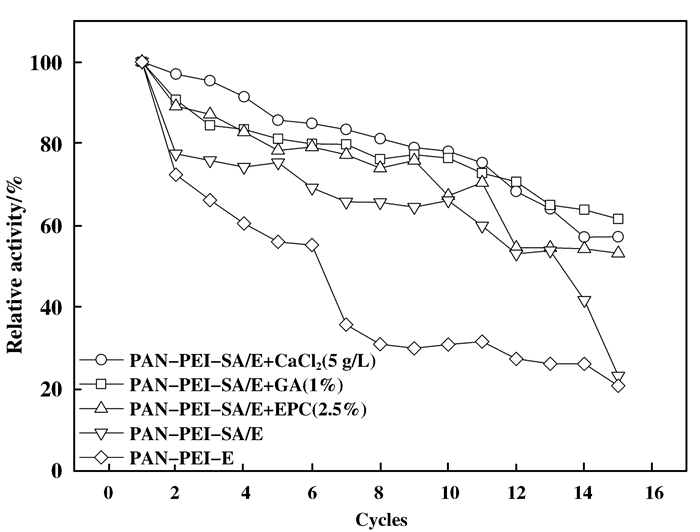
2.3 固定化酶的重复反应及存储稳定性 2.3.1 重复利用性当SA参与固定时, 固定化酶的稳定性提高, 但仍然达不到要求, 为进一步增强固定化酶的稳定性, 分别用GA、EPC和CaCl2对固定化酶PAN-PEI-SA/E进行后处理.
从图 11可知, 重复反应15次后PAN-PEI膜固定的酶酶活迅速降低, 仅保留初始的20.86%, 尤其在6次反应后保留酶活降至40%以下; 在SA参与固定后, 酶固定量和固定化酶稳定性均提高, 但13次反应后保留酶活快速降低, 由53.92%降至23.14%;固定化酶用CaCl2、GA、EPC进行后处理, 虽然处理过程中有脂肪酶掉落, 但最终固定化酶稳定性明显提高, 其中5 g/L CaCl2/醋酸缓冲液(pH 5.0)、1% GA/PBS缓冲液(pH 7.0)和2.5% EPC/醋酸缓冲液(pH 5.0)后处理的固定化酶的稳定性最佳, 15次连续反应酶活保留率均达到55%.但由表 2可知, GA后处理时的剧烈的共价键合作用会造成酶活损失, 使PAN-PEI-SA/E-GA酶活低于PAN-PEI-SA/E-CaCl2和PAN-PEI-SA/E-EPC, 且GA会对PAN-PEI膜结构造成破坏[11]; EPC酸性条件下(pH 5.0)的开环反应温和, 酶活损失小; CaCl2中的Ca2+会与包裹在PAN膜表面的SA中的羟基配位而形成凝胶层, 酶活力基本不损失, 且膜载酶量仅损失2.32 (mg enzyme)/(g support), 而EPC处理后载酶量下降5.42 (mg enzyme)/(g support), 但EPC和CaCl2处理时会减少表面多余SA的包裹量, 降低酶与底物间的传质阻力而提高酶活.另外, 相同的实验条件下与商品化的固定化脂肪酶诺维信435(Nov 435)相比(表 4), 虽然Nov 435稳定性更好, 15次反应后可保留85%以上的酶活力, 但其载酶量低, 在15次反应中PAN-PEI-SA/E-CaCl2和PAN-PEI-SA/E-EPC酶活均高于Nov 435, 表明PAN膜固定的脂肪酶存在良好的应用前景.
|
图 11 重复反应15次酶活保留情况 Figure 11 Enzyme activity retained after 15 reaction cycles by different post-treatment |
| 表 4 不同后处理条件下的15次重复反应酶活保留情况 Table 4 Enzyme activity retained after 15 reaction cycles by different post-treatment |
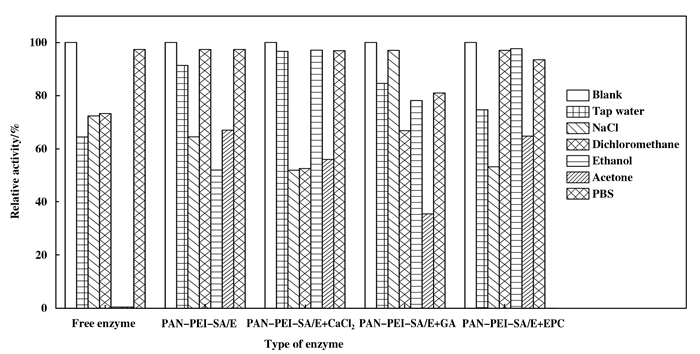
在前一步实验的基础上, 分别将后处理后的固定化脂肪酶在PBS(pH 7.0)、自来水、NaCl(1 mol/L)、二氯甲烷、乙醇、丙酮中保存40 h, 考察不同存储条件对固定化酶的影响.
从图 12可知, 储存40 h后固定化酶和游离酶在PBS缓冲液中酶活保留均较好; 在自来水中PAN-PEI-SA/E-CaCl2酶活保留最佳; 在1 mol/L NaCl溶液中储存时, PAN-PEI-SA/E-GA有最好的酶活保留率; 用乙醇和丙酮储存时, 由于沉降作用, 游离酶在溶液中没有检测到酶活, 而固定化酶则能检测到酶活; 在二氯甲烷中, PAN-PEI-SA/E-CaCl2仍然有较优的酶活保留效果.
|
图 12 不同条件储存40 h Figure 12 Effiects of different conditions of storage after 40 h |
根据之前实验结果, 考察固定化脂肪酶PAN-PEI-SA/E-CaCl2酶学性质.
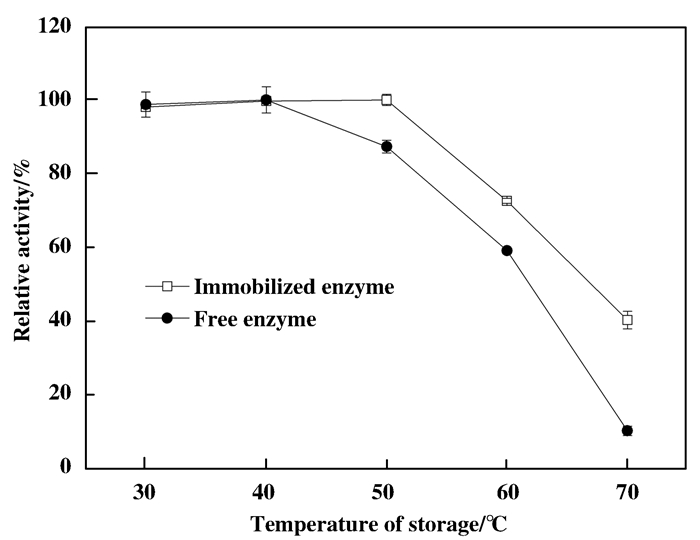
2.4.1 温度分别在30、40、50、60、70 ℃, pH 7.0条件下, 测定PAN-PEI-SA/E-CaCl2酶活, 得出最适反应温度; 再在上述温度下保温6 h后再测定酶活, 考察温度对游离和固定脂肪酶酶活的影响.
结合图 13和14, 游离酶最适反应温度为40 ℃, 固定化脂肪的最适反应温度为60 ℃.根据图 14, 在不同温度下保温6 h后, 30~40 ℃时游离酶和固定化酶均能较好的保留酶活, 温度达到50 ℃时游离酶开始有酶活的损失, 固定化酶却没有损失; 随着温度的提高, 游离酶的酶活力快速降低, 固定化酶酶活保留优于游离酶, 表明固定化酶的温度耐受性提高.

|
图 13 最适反应温度 Figure 13 The optimum reaction temperature of free and immobilized enzyme |
|
图 14 温度耐受性 Figure 14 The tolerance of temperature of free and immobilized enzyme |
分别在pH 3、5、6、7、8、9、11的条件下, 测定PAN-PEI-SA/E-CaCl2酶活, 得出最适反应pH; 再在上述pH下, 4 ℃保温6 h后再测定酶活, 考察pH对游离和固定脂肪酶酶活的影响.
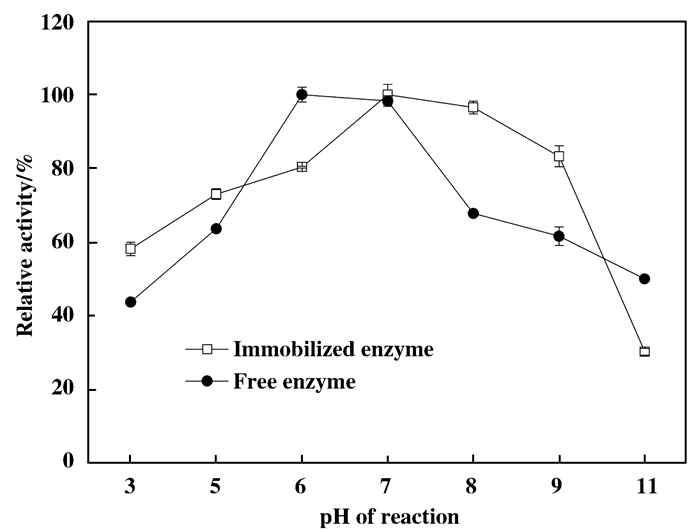
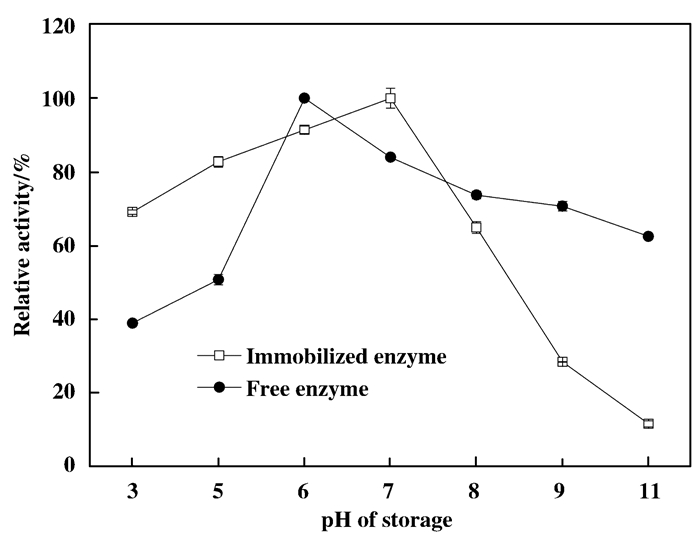
结合图 15和16, 与游离酶相比, 固定化酶的最适反应pH变为7, 耐弱酸性增强, 在pH=3时, 能保留60%以上的酶活力, 而在pH升高时, 酶活力降低, 当pH升高到9以后, 酶活快速降低, 仅能保留20%的酶活力, 耐酸性有提高.
|
图 15 最适反应pH Figure 15 The optimum reaction pH of free and immobilized enzyme |
|
图 16 pH耐受性 Figure 16 The tolerance of pH of free and immobilized enzyme |
在pH 7.0下, 考察10 mmol/L浓度的不同离子(Fe3+、Zn2+、Mn2+、Ca2+、Cu2+、Mg2+、Al3+、Co2+、Ba+和EDTA)对酶活力的影响.
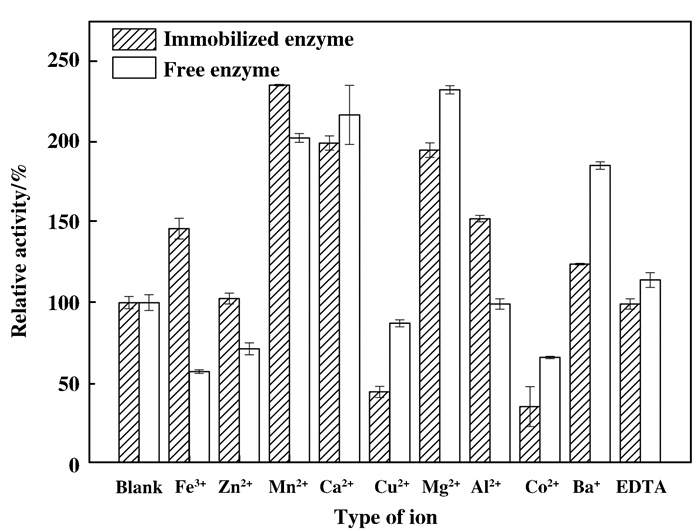
从图 17可知, Fe3+、Mn2+、Ca2+、Mg2+、Al3+、Ba+对固定化酶起促进作用, 其中Mn2+促进作用最大, Cu2+和Co2+对固定化酶有抑制作用, Co2+的抑制效果最明显; EDTA、Zn2+对酶活力基本没有影响; 而游离酶中, Mn2+、Ca2+、Mg2+、Ba+可以促进酶活力提高, Fe3+、Zn2+、Cu2+、Co2+会抑制酶活力, Al3+和EDTA则基本不影响酶活力.综合比较, 在选定的金属离子和EDTA中, 多数金属离子对固定化酶的抑制作用要小于游离酶.
|
图 17 金属离子及EDTA对酶活性的影响 Figure 17 Effects of metal ion and EDTA on enzyme activity |
通过化学法在聚丙烯腈膜上交联聚乙烯亚胺并固定脂肪酶, 再通过引入海藻酸钠参与固定和氯化钙后处理的方法, 获得耐酸性和耐温性均有所提高的固定化脂肪酶PAN-PEI-SA/E-CaCl2.循环反应表明, 15次反应后, 该固定化酶酶活保留率为58.77%.该固定化酶的反应稳定性低于Nov 435, 但固定酶量和单位酶活更高, 这为获得工业生产更高效稳定的固定化脂肪酶提供研究基础.但是载体准备时, 相转化法制备聚丙烯腈中空膜易造成原料的浪费且载体传质阻力较大, 后续的研究中优化制备工艺提高原料利用率并降低传质阻力, 扩大应用前景.
| [1] |
a. Sheldon R A, van Pelt S. Enzyme immobilisation in biocatalysis:why, what and how[J]. Chem Soc Rev, 2013, 42(15):6223-6235. b. Liu Wen-fang(刘文芳),Wei Li-na(魏利娜). Research progress on carbonic anhydrase immobilization(碳酸酐酶固定化研究进展)[J]. J Mol Catal(China)(分子催化), 2016, 30(2):182-197. c. Dou Bo-xin(窦博鑫),Xin Jia-ying(辛嘉英),Fan Hong-chen(范洪臣), et al. Functional self-assembly gold nanoparticle modified electrodes and application in the field of biosensors with enzyme immobilization(功能化金纳米修饰电极自组装及其在固定化酶生物传感器中应用)[J]. J Mol Catal(China)(分子催化), 2016, 30(4):391-400. |
| [2] | Hanefeld U, Gardossi L, Magner E. Understanding enzyme immobilisation[J]. Chem Soc Rev, 2009, 38(2): 453–468. DOI:10.1039/B711564B |
| [3] | Guo yong(郭勇). Enzyme engineering(酶工程)[M]. Science Press(科学出版社), 2009. |
| [4] | Jain S, Chattopadhyay S, Jackeray R, et al. Surface mo-dification of polyacrylonitrile fiber for immobilization of antibodies and detection of analyte[J]. Anal Chim Acta, 2009, 654(2): 103–110. DOI:10.1016/j.aca.2009.08.030 |
| [5] | Chen S, Gao H, Chen J, et al. Surface Modification of polyacrylonitrile fibre by nitrile hydratase from corynebacterium nitrilophilus[J]. Appl Biochem Biote, 2014, 174(6): 2058–2066. DOI:10.1007/s12010-014-1186-6 |
| [6] | Mei S, Xiao C, Hu X, et al. Hydrolysis modification of PVC/PAN/SiO2 composite hollow fiber membrane[J]. Desalination, 2011, 280(1/3): 378–383. |
| [7] | 宁炜. 聚合物表面胺化接枝改性的研究[D]. 北京化工大学硕士论文. 2006. Ning Wei. Studies on polymer surface photografying for amination[D]. Master Dissertation of Beijing University of Chemical Technology. 2006. |
| [8] | 王清清. PAN/O-MMT复合纳米纤维的表面功能化及其催化吸附性能研究[D]. 江南大学博士论文. 2014. Wang Qing-qing. Surface functionalization of PAN/O-MMT composite nanofibers and their perfomance in catalysis and adsorption[D]. Doctoral Dissertation of Jiangnan University. 2014. |
| [9] | Stoilova O, Manolova N, Gabrovska K, et al. Electrospun polyacrylonitrile nanofibrous membranes tailored for acetylcholinesterase Immobilization[J]. J Bioac & Compat Poly, 2010, 25(1): 40–57. |
| [10] | Bode-Aluko C A, Pereao O, Fatoba O, et al. Surface-modified polyacrylonitrile nanofibres as supports[J]. Poly Bull, 2017, 74(6): 2431–2442. DOI:10.1007/s00289-016-1830-0 |
| [11] | Ren Yuan-lin(任元林), Liu Tian-tian(刘甜甜), Wang Ling-jie(王灵杰). Modification of polyacrylonitrile nanofibers and its application to adsorption of copper ions(PAN纳米纤维的改性及其对铜离子的吸附性能)[J]. J f Tianjin Poly Univer(天津工业大学学报), 2015, 34(6): 1–6. |
| [12] | 娄倩芳. 海藻糖合成酶的固定化研究[D]. 江南大学硕士论文. 2016. Lou Qian-fang. Immobilization of Trehalose Synthase[D]. Master Dissertation of Jiangnan University. 2016. |
| [13] | Wang Ling-shu(万灵书), Huang Xiao-jun(黄小军), Xu Zhi-kang(徐志康). Modification and applications of polyacrylonitrile-based membranes:An overview(聚丙烯腈分离膜改性研究进展及其应用)[J]. J Func Poly(功能高分子学报), 2004, 17(3): 527–534. |
| [14] | Amirilargani M, Sadrzadeh M, Sudhölter E J R, et al. Surface modification methods of organic solvent nanofiltration membranes[J]. Chem Engineer J, 2016, 289(Supplement C): 562–582. |
| [15] | Kochkodan V, Hilal N. A comprehensive review on surface modified polymer membranes for biofouling mitigation[J]. Desalination, 2015, 356(Supplement C): 187–207. |
| [16] | Wang Li(王力), Chen Zhao-wen(陈兆文), Zhang Qin(张琴), et al. Research on preparation of PAN-PEI fiber using in naval vessels and its properties of HCHO adsorption(舰艇用PAN-PEI纤维的制备及其吸附甲醛性能研究)[J]. Ship Sci Technol(舰船科学技术), 2016, 38(3): 144–148. |
| [17] | Tao S, Jin Q, Liu Z. Polyethyleneimine-treated polyacrylonitrile membrane hemofilter for critically ill patients receiving anticoagulant-free prolonged intermittent renal replacement therapy:a single-center, prospective, self-controlled pilot study[J]. Bmc Nephrology, 2017, 18(1): 208. DOI:10.1186/s12882-017-0627-1 |
| [18] | Panda S R, De S. Effects of polymer molecular weight, concentration, and role of polyethylene glycol as additive on polyacrylonitrile homopolymer membranes[J]. Poly Engineer Sci, 2014, 54(10): 2375–2391. DOI:10.1002/pen.v54.10 |
| [19] | Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analy Biochem, 1976, 72(s 1/2): 248–254. |
| [20] | 黄宇美. 磁性纤维素纳米晶固定化脂肪酶的制备、表征及其应用[D]. 华南理工大学硕士论文. 2015. Huang Yu-mei. Preparation, characterization and application of lipase immobilized onto novel magnetic cellulose nanocrystals[D]. Master Dissertation of South China University of Technology. 2015. |
| [21] | 姜忠义, 赵静, 潘福生, 等. 中国专利[P]. 104785121 A. 2015. Jiang Zhong-yi, Zhao Jing, Pan Fu-sheng, et al. CN[P]. 104785121 A. 2015. |
 2018, Vol. 32
2018, Vol. 32


