2. 中国科学院兰州化学物理研究所 羰基合成与选择氧化国家重点实验室, 甘肃 兰州 730000
2. State Key Laboratory for Oxo Synthesis and Selective Oxidation, Lanzhou Institute of Chemical Physics, Chinese Academy of Sciences, Lanzhou 730000, China
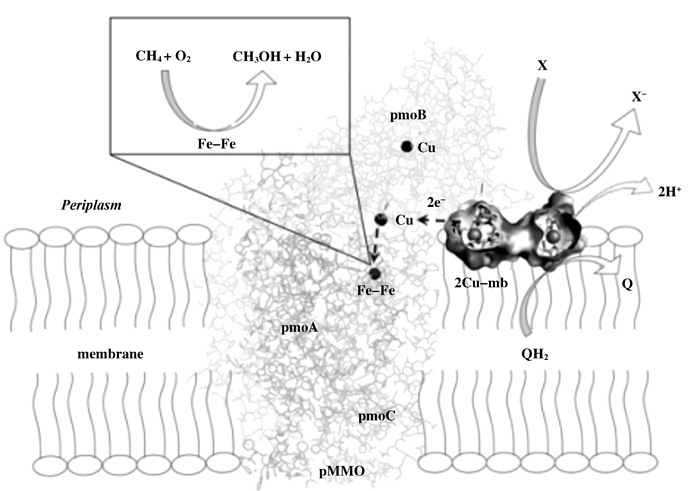
甲烷氧化菌(Methanotrophs)是一类以甲烷作为唯一碳源和能源生长的革兰氏阴性菌, 广泛存在于湿地[1]、土壤[2]、水稻中[3], 在全球碳循环中扮演着重要角色.甲烷单加氧酶(methane monooxygenase, MMO), 是甲烷氧化菌代谢途径中的重要酶之一, 它能够催化甲烷氧化成为甲醇[4], 而催化这一反应过程的MMO有两种形式:可溶性MMO(soluble methane monooxygenase, sMMO)和位于细胞质内膜的颗粒性甲烷单加氧酶(particulate methane monooxygenase, pMMO)[5-6].实际上, 两种蛋白是不同基因表达的产物, 两者的表达受到培养基中不同程度Cu2+浓度的限制[7].当培养基中Fe3+充足而Cu2+有限时, 甲烷氧化菌细胞仅表达sMMO; Cu2+浓度相对较高时, sMMO的表达就会切换成pMMO.除此以外, Cu2+还能作为一种代谢激活剂, 促进细胞内膜上pMMO的高浓度水平合成.研究发现, 几近所有的类型的甲烷氧化菌都能表达pMMO, 但仅有一小部分甲烷氧化菌在无铜的环境下表达sMMO[8].由于pMMO存在范围广、且不受铜浓度条件的制约, 因此在生物修复方面具有较高的实际应用价值和应用前景.有学者将纯化得到的膜水平pMMO嵌入到易交联、生物兼容性良好的聚乙二醇双丙烯酸酯水凝胶(PEGDA)中, 制成一种催化甲烷转化为甲醇的新型生物催化材料, 酶活保存率为100%, 同时能作为3D打印的底物, 为生物反应器的设计以及甲烷的工业化转换提供了新的思路[9].研究发现, pMMO除能够氧化甲烷之外, 还能氧化卤化烃, 如三聚乙烯(trichloroethylene, TCE)等[10]. TCE是一类可疑性致癌物, 也是地下水源的主要污染物之一[11].由于pMMO氧化TCE的过程中不会有有毒中间产物生成, 因此成为TCE生物修复的首选方案.
虽然pMMO广泛存在, 但由于其内膜蛋白的性质以及纯化过程中的不稳定性[12], 使其生物化学性质、金属活性位点等方面仍存在许多未知和争议.有一部分学者认为pMMO中含有2个铜原子和1~2个铁原子[13].另有一部分人认为, pMMO是一种含有15~21个铜原子的金属酶.铜原子被整合成5~7个自旋耦合的三核铜簇, 其中2~3个铜簇参与到催化反应中来, 另有3~4个铜簇与NADH到活性中心之间的电子传递有关[4].还有一部分学者认为pMMO中含有8~15个铜原子和2个铁原子, 其中的6~13个铜原子能够与一种荧光小肽(甲烷氧化菌素methanobactin, mb)结合, 形成mb-Cu, 参与电子与活性中心之间的交流, 或在铜捕获机制中, 起到维持氧化还原状态、抑制氧自由基的作用[13].
pMMO的分离纯化是pMMO理化性质、金属活性中心等各方面的研究与发展的前提条件, 因此纯化出稳定性较好、酶活力较高的pMMO显得至关重要.目前对pMMO纯化的研究主要集中在Methylococcus capsulatus(Bath)和Methylosinus trichosporium(OB3b)两种甲烷氧化菌上[14]: Methylococcus capsulatus Bath属Ⅰ型好氧甲基球菌属, 是γ-变形菌的一种, 利用磷酸核酮糖途径(RuMP pathway)同化甲醛, 胞内膜呈束状分布[7]; Methylosinus trichosporium(OB3b)属Ⅱ型好氧甲基弯菌属, 主要代谢途径为丝氨酸途径(Serine pathway), 其双层膜吸附于细胞壁周围[7].除利用这两种类型的甲烷氧化菌进行pMMO分离纯化外, 也有一些学者选择了其他类型的甲烷氧化菌, 近年来都取得了不少应用进展.
1 pMMO的分离纯化为使pMMO高水平表达, 甲烷氧化菌的培养一般是在NMS培养基的基础上补充一定量的Cu2+和Fe3+, 但不同实验室在pMMO分离纯化中选择的Cu2+和Fe3+浓度不同.一部分人认为培养基中Cu2+终浓度为60 μmol/L时, pMMO表达水平最高[15]; 终浓度为80 μmol/L时, 细胞中Cu2+已饱和.但也有人认为培养基中Cu2+浓度为30~35 μmol/L、Fe3+浓度为18 μmol/L时, pMMO表达水平最高、酶活最好[16].培养完成后的发酵液离心, 收集菌体细胞沉淀进行pMMO的纯化.一般pMMO的分离纯化主要分为细胞质膜的分离、pMMO的解离以及pMMO的纯化这3个阶段.细胞内膜的分离一般是通过机械法破碎细胞(如超声破碎、高压匀浆法), 超速离心分离膜组分. pMMO的解离是指在表面活性剂(又称去垢剂)的作用下, 将pMMO等膜蛋白包裹从细胞内膜中分离下来, 再采用离心操作达到分离的目的.对于pMMO的纯化操作多采用FPLC层析分离、离子交换柱层析以及凝胶过滤层析等手段.对pMMO的分离纯化操作的核心在于细胞破碎方式、表面活性剂在浓度以及用量以及离心分离条件的控制、各种层析分离介质和洗脱液的选择等.
1.1 含pMMO细胞质膜的分离pMMO位于甲烷氧化菌的细胞质膜, 嵌入脂质双分子层的内部[17], 与膜结合紧密, 而甲烷氧化菌又是革兰氏阴性菌[18], 与其他革兰氏阳性菌相比, 其细胞壁较为脆弱, 因此需要采用专门的细胞破碎方法.一是利用超声波的空穴作用将细胞破碎.破碎时, 超声波强度不宜太大, 强度过高易引起蛋白的失活, 而且破碎时细胞浓度不宜过高, 一般控制在20%左右, 除此之外超声的频率、处理时间以及介质的离子强度、pH等都会对破碎效果产生一定的影响.此种方法细胞破碎的效果较为明显, 适用于小规模的细胞菌悬液的处理, 成本相对昂贵. 1977年, Tonge等[19]首次利用超声破碎细胞(150 W, 4×45 s), 得到Methylosinus trichosporium(OB3b)细胞破碎物, 比活力为0.22 μmol/min·mg(甲烷氧化反应表示). Masayuki Takeguchi等[20]在超声破碎时, 着重控制温度在4 ℃且破碎环境密闭无氧, 并发现适当的Cu2+能够提高Methylosinus trichosporium(OB3b)细胞破碎时pMMO活性, 同时在破碎过程中适当补充PMSF, 也能够起到防止蛋白降解的作用; 除超声外, 也可以采用匀浆法, 使细胞受到剪切力而破坏.影响匀浆破碎的主要因素有压力、温度和通过匀浆阀的次数等.一般通过高压匀浆的破碎率可达67%, 破碎率要达90%至少将菌悬液通过匀浆法2次, 但不能单纯追求高破碎率, 最好是提高操作压力, 减少操作次数.此法一般用于大规模菌悬液的处理, 且样品损失小, 成本适中. 1989年, Smith&Dalton等[21]利用高压匀浆法, 使Methylococcus capsulatus(Bath)在140 MPa压力下匀浆破碎. Choi等[15]利用高压匀浆法(18 000 Ib/in2)在4 ℃厌氧(95%氩气, 5%氢气)条件下对Methylococcus capsulatus(Bath)细胞进行破碎. Ashraf Kitmitto等[22]采用连续破碎系统, 4 ℃、25 MPa连续破碎3次, 分离得到的细胞质膜, 以5 mmol/L NADH作还原剂, 比活力为230 nmol/min·mg(丙烯环氧化反应表示). Yu等[16]在滤膜反应器的辅助作用下去除培养基组分收集菌体沉淀, 高压匀浆(20 000 Ib/in2)分离包浆与膜组分, 超速离心收集膜组分, 并考察了培养基中铜浓度与细胞内膜中pMMO含量及比活力之间的相互关系.
破碎后, 沉降未破碎的细胞以及细胞碎片, 超速离心或透析收集细胞内膜.用中性pH缓冲溶液(含少量NaCl或KCl)盐洗1~3次, 除去细胞外膜、可溶性蛋白以及质蛋白等. Lieberman等[23]用超声破碎法将Methylococcus capsulatus(Bath)细胞裂解, 超速离心收集膜组分.选用含NaCl的25 mmol/L Pipes缓冲液反复重悬3次, 终浓度为10~20 mg/mL, 并用液氮滴冻, -80 ℃储存.膜水平下, 四甲基对苯二酚和NADH为最有效的还原剂, 酶活为19.4 nmol/min·mg(丙烯环氧化反应表示).研究发现, 盐洗细胞膜能够起到粗略去除外源金属离子以及未紧密结合的蛋白等.
Takeguchi等[20]在4 ℃无氧条件下利用超声破碎法对细胞进行破碎, 缓冲液事先用纯净氮气脱气.用含KCl的MOPS缓冲液盐洗膜沉淀, 离心收集沉淀, 即得到含有pMMO的细胞膜组分.研究发现, EDTA、甲醇、硫脲、叠氮化物、乙炔等物质会抑制细胞质内膜上pMMO的活性; 同时对反应条件进行考察, 发现利用55 mmol/L MOPS缓冲液(pH=7)、45 ℃下反应, 细胞内膜上pMMO活性效果最好.
细胞质内膜的存在为维持pMMO天然构象、催化活性以及稳定性提供了最佳环境, 而且内膜上含有一系列电子传递链, 虽然电子传递机制尚未明确, 这使得含pMMO的膜组分成为除含pMMO完整细胞外酶活以及电子供体研究的最佳阶段.
1.2 pMMO从细胞质膜中的解离纯化中, 无论是以改变pMMO天然构象或是阻断pMMO与其他蛋白、脂质之间相互作用的方式, 将pMMO从磷脂双分子层的疏水环境中分离都会造成pMMO活性的丧失.因此使用去垢剂解离是pMMO解离中使用次数最多、使用范围最广的一种.去垢剂(detergent)又称表面活性剂, 是一类同时具有亲水极性基团和疏水非极性基团的双极性分子[24-25].在去垢剂的作用下, 细胞膜解体, pMMO等膜蛋白释放, 并在无膜状态下为pMMO等膜蛋白提供相对稳定的疏水环境, 起到维持和保护蛋白结构和活性的作用.
去垢剂的选择较多, 其中十二烷基β-D-麦芽糖苷(dodecyl β-D-maltoside, DDM)是使用最广的一种, 它是一种非离子型去垢剂, 常用于膜研究中蛋白的抽提和溶解, 但在其浓度及用量的选择上存在差异. Shiemke等[26]按质量分数为10%~20%的量向10 mmol/L pH=7.0的Pipes缓冲液中加入DDM, 并向膜组分的悬浮液中逐滴加入并搅拌, 3 ℃下震荡15~45 min. Piku BASU等[27]按去垢剂/蛋白=1.5(W/W)的比例, 向冰上的膜蛋白组分中持续搅拌逐滴滴加.这一过程保留了原酶活的近75%的活性. Choi等[20]研究发现去垢剂较少0.5~0.75(DDM/膜蛋白, mg/mg)或较多2~3(DDM/膜蛋白, mg/mg)时, 都会造成pMMO提取物的失活.向纯化产物中额外添加DDM, 考察了去垢剂与金属离子含量之间的关系, 研究发现每毫克膜蛋白中DDM含量为0.1、0.2 mg时, pMMO活性及其金属离子含量仍保持不变; 当DDM含量大于0.3 mg时, pMMO丧失活性, 每个pMMOαβγ亚基中Cu原子数大约为2.为降低去垢剂DDM对pMMO活性的抑制, Miyaji等[28]向解离后的pMMO组分中加入吸附剂BioBeads SM-2, 除去溶解组分中过量的DDM, 并考察吸附时间对pMMO活性以及DDM含量的影响. Smith等[21]将DDM解离并去除多余DDM后得到的pMMO储存在卵磷脂中.除DDW外, Brij 58和Tween 20也能解离pMMO, 解离中能够抑制蛋白聚沉, 但由于其水油度(hydrophile lipophile balance, HLB)较高, 与磷脂双分子层的亲和性较差, 限制了它们在pMMO解离中的应用.此外选择去垢剂时要注意, 着重选择温和的两性去垢剂和非离子去垢剂, 它不会破坏后续纯化(如离子交换), 但离子交换剂会破坏去垢剂与pMMO之间的库仑力, 使纯化失效.
除使用去垢剂之外, XIN等[29]研究发现, 低Cu2+浓度条件下培养Methylosinus trichosporium IMV 3011时, pMMO极易从细胞内膜中解离, 因此并未使用去垢剂而是采用超声的方式使pMMO脱落.膜水平状态下, 以琥珀酸盐为还原剂时比活力最高, 为16.8 nmol/min·mg(丙烯环氧化反应表示).
1.3 pMMO的纯化对于解离后的pMMO等膜蛋白及其他组分, 成分复杂, 研究者多选用几步柱层析方法相结合的方式进行pMMO分离纯化, 其中离子交换层析、凝胶过滤层析的使用最为广泛, 依据分子间的相互作用、物质的大小以及性状等方面的差异将pMMO与其他杂蛋白进行分离, 达到纯化的目的.离子交换层析是pMMO纯化中常用的方法, 它以离子交换剂为固定相, 特定的含离子溶液为流动相, 利用离子交换剂对分离物的各种离子结合力的差异, 将混合流动相中不同离子进行分离, 具有分辨率高、分离效果好的特点.纯化时常采用阴离子交换剂, 交换剂类型不同, 交换容量以及蛋白质吸着容量也会存在差异, 最常用的阴离子交换剂填料基质DEAE, 如DEAE Sepharose CL-6B、DEAE Sepharose FF等. Choi等[30]选择用5.0×7 cm DEAE Sepharose FF将收集到的含pMMO的蛋白组分进行纯化, 得到NDH-pMMO的混合物; 经2.6×20 cm DEAE Sepharose FF得到pMMO, 厌氧条件下超滤浓缩.纯化后NDH-pMMO的混合物和pMMO的活性分别为147±43 nmol/min·mg和134±36 nmol/min·mg.辛嘉英等[31]等研究发现低Cu2+浓度下pMMO极易从细胞内膜上解离, 利用DEAE-SepharoseCL-6B离子交换层析柱对Methylosinus trichosporium IMV 3011细胞膜中pMMO和NADH脱氢酶进行了分离纯化, 并对不同状态下pMMO利用的电子供体进行研究, 并提出了pMMO可能的电子传递链.
除使用离子交换层析的方法外, 多数pMMO纯化采用混合层析的方式, 即离子交换层析和凝胶过滤层析相结合的方式.凝胶过滤层析也叫凝胶排阻层析, 是将样品混合物通过一定孔径的凝胶固定相使不同分子量的组分得以分离.凝胶空隙的大小严格决定了其分离范围, 较大的分子由于受到空间的阻碍作用未进入凝胶颗粒内部而沿凝胶空隙流出, 停留时间短, 因而最先被洗脱; 小分子物质由于进入凝胶介质内部, 停留时间较长.此方法只需要一种缓冲溶液, 且操作条件温和, 凝胶介质为惰性载体, 常用Superdex、Sephacryl等凝胶介质.挪威学者Piku等[27]利用FPLC快速蛋白纯化系统对pMMO进行纯化.解离后的pMMO超滤浓缩至20 mg/mL, 1.5 cm×68 cm Superdex 200凝胶层析分离, 流速1.5 mL/min, 酶活测定确定pMMO组分, 分离得到含羟化酶(pMMOH)和还原酶(pMMOR)的pMMO复合物(pMMOc); 经DEAE-cellulose DE52离子交换柱(1.5 cm×15 cm)分离得到羟化酶和还原酶.利用四甲基对苯二酚作还原剂, 对pMMOc及其个体组分(pMMOH、pMMOR)的丙烯环氧化反应进行研究, 发现单独的pMMOH或pMMOR均没有MMO活性, 这也就说明二者在催化丙烯环氧化反应中都是不可或缺的.若将pMMOc中再次添加分离得到的pMMOH和pMMOR, pMMOc活性略有增加, 但比活力仍保持不变(约为28 nmol/min·mg). Kitmitto等[22]在Piku的基础上对pMMO进行调整, 选择MonoQ-10阴离子交换柱纯化得到pMMO复合物, Superdex 200凝胶层析继续纯化, 0~1 mol/L NaCl梯度洗脱得到pMMO羟化酶.
美国的科学家Lieberman等[23]使用柱层析的方法分离纯化了M.capsulatus(Bath)中的pMMO组分.纯化过程如下:事先用柱平衡液稀释的膜蛋白组分, Source 30Q阴离子交换柱, NaCl梯度洗提, Centriprep 50超滤浓缩; Sephacryl S200凝胶过滤层析, 最后浓缩至5~10 mg/mL.实验证明, 大部分杂蛋白以及脂质类物质都能通过Source 30Q除去, 而小分子蛋白不能, 因此采用Sephacryl S200凝胶过滤将其分离除去, 纯化后的pMMO活性为17.7 nmol/min·mg(四甲基对苯二酚为还原剂).
Miyaji等[28]利用POROS 20 HQ对解离后的组分进行纯化后得到4个组分峰, 四甲基对苯二酚存在下组分1具有pMMO活性, 活性为3.4 nmol/min·mg, 与膜水平中酶活相比(3.8 nmol/min·mg), 四甲基对苯二酚存在下纯化后的pMMO保持了近88%的酶活.
纯化时除考虑柱层析类型以及填料种类外也要在维持pMMO活性的基础上, 考虑流速、洗脱液以及其他因素的影响:流速要视柱填料类型、颗粒大小以及洗脱液粘度等条件而定, 填料的颗粒大, 流速快, 反之则慢; 洗脱液的粘度大, 流速就慢, 反之则快, 而且其他层析条件相同时, 流速会受层析柱的长度与横截面积的影响; 此外, 在缓冲液选择时注意避免能与介质相互作用的缓冲盐类, 避免因平衡破坏而使pMMO解吸, 常用的洗脱液有MOPS、PIPES等, 且缓冲液浓度一般控制在10~50 mmol/L, pH控制在7~7.5, 采用梯度洗脱的方式(一般是NaCl溶于稀缓冲溶液).具体柱层析纯化pMMO的方法如表 1所示.
| 表 1 柱层析纯化pMMO的方法总结 Table 1 Summary on purification of pMMO by column chromatography |
pMMO能够氧化五碳以内的烷烃和烯烃, 但不能同sMMO一样氧化环烃、芳香烃等物质[7], 因此多采用丙烯环氧化反应对pMMO酶活进行测定, 酶活用1 mg干重细胞1 min产生环氧丙烷的纳摩尔数表示[24], 单位: nmol/min·mg, 也有一部分人选择用甲烷氧化反应评价pMMO活性[32].环氧化反应中, 需要辅酶NADH不断再生, 因此在酶活测定中采用NADH或四甲基对苯二酚作为还原剂, 以维持pMMO催化反应的持续进行.整细胞以及膜水平条件下, 以NADH或对苯二酚作还原剂, 都可检测到pMMO活性; 然而经DDM解离后, NADH作还原剂几乎不能检测到pMMO活性, 但对苯二酚可以.研究发现, pMMO的活性可能会受到以下几方面的影响.
2.1 培养基成分的影响培养基中Cu2+浓度是决定pMMO活性的直接因素. Cu2+浓度不仅能够作为切换sMMO与pMMO表达的枢纽, 更重要的是, 它能够激发pMMO的高水平表达.当培养基中Cu2+浓度为4 μmol/L时, pMMO开始表现出活性, 并生成大量细胞质膜[30]. Masayuki等[15]研究发现, M.trichosporiumOB3b中pMMO需要一定的Cu(Ⅱ)离子, 但过量的Cu(Ⅱ)离子会抑制pMMO的活性; 同时金属离子、牛血清白蛋白(BSA)以及PMSF等都会对膜水平下pMMO的活性产生一定的影响. Choi等[15]在对Methylococcus capsulatus Bath的研究中发现, 当NMS培养基中Cu2+浓度为60 μmol/L时, 其膜水平pMMO的表达效果最高, 可达75~230 nmol min-1(mg protein)-1, 而mb-Cu以及Cu(Ⅱ)的添加更能提高pMMO的酶活; 当培养基中Cu2+浓度达80 μmol/L时, 细胞中Cu2+浓度几近饱和.此外, pMMO的高水平表达也需要一定量的Fe3+.当培养基中Fe3+: Cu2+=1: 2.5时, 无细胞状态下pMMO的活性较高[23].但也有学者研究发现, 自然环境中铜含量很低时, 仍能检测到大量pMMO的存在[33].
2.2 厌氧条件的影响厌氧条件对pMMO活性也会产生一定的影响.为维持pMMO的稳定性, 大多数的pMMO分离纯化都选择在4 ℃、无氧条件下进行的, 而且研究发现, 膜水平下高活性pMMO就是在厌氧条件下分离得到的[30], 其比活力为290 nmol环氧丙烷(mg protein·min)-1.但也有学者认为, pMMO并不是氧敏感型蛋白[23], 厌氧条件对pMMO活性的影响并不大.
2.3 mb-Cu对pMMO的作用甲烷氧化菌素(methanobactin, mb), 是甲烷氧化菌分泌的一种能与Cu结合、分子量大小为1218Da的荧光小肽[34], 在甲烷氧化菌铜捕获体系中起着至关重要的作用, 在食品添加剂[35]、食品安全快速检测[36]、生物催化等[37]方面具有广泛的应用前景.溶液中的mb是一种动态的小分子, 与Cu(Ⅱ)离子结合(如图 1所示).当甲烷氧化菌在限铜条件下培养时, mb会以分泌物的形式排放到细胞外, 若培养基中Cu2+浓度达到一定时, mb就会与铜结合以mb-Cu的形式构成pMMO的结构组分存在于细胞膜中[38], 若将其从pMMO中分离, 会造成pMMO的不可逆性失活[39].研究发现, 从Methylococcus capsulatus Bath、Methylomicrobium album BG8以及Methylosinus trichosporium OB3b中分离得到的mb-Cu都是具有氧化还原活性的分子, 具有自由基清除剂的作用, 表现出氧化酶(Oxidase)、超氧化物歧化酶(Superoxide dismutase, SOD)以及过氧化氢还原酶(hydrogen peroxide)活性, 其表现出的SOD活性在无细胞水平下能够起到保护pMMO、防止氧化对其造成损伤的作用[39].
mb-Cu能够提高电子流向pMMO的速率, 对pMMO活性存在着一定的影响[30].有的学者认为无细胞状态下, NADH作为还原剂, 电子传递过程如下: NADH→mb-Cu→Cu-pMMO-H→Fe-Fe-pMMO-H, 其中Cu-pMMO-H为pMMO羟化酶的Cu(Ⅱ)金属活性中心, Fe-Fe-pMMO-H为pMMO羟化酶的双核铁活性中心[20].
Choi等[15]研究发现, Methylococcus capsulatus Bath中或Methylosinus trichosporium OB3b中分离纯化得到的mb均能提高完整Methylococcus capsulatus Bath细胞水平或膜水平状态下甲烷氧化速率; 若向pMMO酶活为290 nmol/min·mg(环氧丙烷)的细胞膜组分中加入mb-Cu, 其酶活显著增加(400 nmol/min·mg), 约为完整细胞酶活的50%~75%. EPR光谱表明, mb-Cu能够提高电子流向pMMO的速率.但mb-Cu(Methylosinus trichosporium OB3b)对pMMO(Methylosinus trichosporium OB3b)以及mb-Cu(Methylococcus capsulatus Bath)对pMMO(Methylococcus capsulatus Bath)的影响并没有报道, 有待进一步研究.
2.4 其他物质纯化过程中, 电子传递链中涉及的与pMMO相关的细胞色素、脱氢酶等物质的破碎都会造成pMMO的失活.研究发现, 这些物质可能与pMMO构成一种活性中心复合物[23].同时, 解离后、纯化后pMMO的不规则折叠都会影响pMMO的活性.此外, Chen等[40]在Methylococcus capsulatus Bath菌中发现一种非血红素铁蛋白(bacteriohemerythrin, McHr), 并认为它能够作为分子氧的载体携带分子氧到达细胞膜的微环境中参与环氧化反应的进行, 在膜水平条件下具有显著提高pMMO催化丙烯环氧化的能力.
3 结论及展望pMMO的纯化过程较为复杂, 大部分研究都采用两种或两种以上的操作步骤, 包括细胞破碎、超滤、表面活性剂解离、离子交换层析、凝胶过滤层析等.此外, 其活性可能受到很多因素条件的限制, 如Cu2+和Fe3+浓度、厌氧条件、折叠方式等.只有获得活性较高、稳定性较好的pMMO, 才能更深入的了解pMMO的催化机理、生化性质以及金属活性中心, 才能更好的应用于环境保护、生物催化等各个领域.
| [1] | Deng Yong-cui(邓永翠), Che Rong-xiao(车荣晓), Wu Yi-bo(吴伊波), et al. A review of the physiological and ecological characteristics of methanotrophs and methanotrophic community diversity in the natural wetlands(好氧甲烷氧化菌生理生态特征及其在自然湿地中的群落多样性研究进展)[J]. J Acta Ecologica Sin(China)(生态学报), 2015, 35(14): 4579–4591. |
| [2] | Huang Meng-qing(黄梦青), Zhang Jin-feng(张金凤), Yang Yu-sheng(杨玉盛), et al. Advance in research method of soilmethanotrophs diversity(土壤甲烷氧化菌多样性研究方法进展)[J]. J Sub Res Environ(China)(亚热带资源与环境学报), 2013, 8(2): 41–48. |
| [3] | Zheng Yong(郑勇), Zheng Yuan-ming(郑袁明), He Ji-zheng(贺纪正). Response of methanotrophic community structure and oxidation potential to cadmium stress in a Chinese paddy soil(水稻土甲烷氧化菌对镉胁迫的响应)[J]. J Ecol Environ Sci(China)(生态环境学报), 2012, 1(4): 737–743. |
| [4] | Rosenzweig A C. The metal centres of particulate methane mono-oxygenase[J]. Biochem Soc Trans, 2008, 36(6): 1134–1137. DOI:10.1042/BST0361134 |
| [5] | Wu Jun-hua(吴军华). Current research on methanotrophs and methane monooxygenase(甲烷氧化菌及甲烷单加氧酶的研究进展)[J]. J Chin Brew(China)(中国酿造), 2011, 234(9): 11–14. |
| [6] | Sirajuddin S, Rosenzweig A C. Enzymatic oxidation of methane[J]. Biochem, 2015, 54(14): 2283–2294. DOI:10.1021/acs.biochem.5b00198 |
| [7] | Hanson R S, Hanson T E. Methanotrophic bacteria[J]. Microbiol Rev, 1996, 60(2): 439–471. |
| [8] | Hakemian Amanda S, Rosenzweig Amy C. The bioche-mistry of methane oxidation[J]. Ann Rev Biochem, 2007, 76(1): 223–241. DOI:10.1146/annurev.biochem.76.061505.175355 |
| [9] | Blanchette C D, Knipe J M, Stolaroff J K, et al. Printable enzyme-embedded materials for methane to methanol conversion[J]. Nat Commun, 2016, 7: 1–9. |
| [10] | Lontoh S, Dispirito A A, Semrau J D. Dichloromethane and trichloroethylene inhibition of methane oxidation by the membrane-associated methane monooxygenase of Methylosinus trichosporium OB3b[J]. Arch Micro, 1999, 171(5): 301–308. DOI:10.1007/s002030050714 |
| [11] | Tsien H C, Brusseau G A, Hanson R S, et al. Biodegradation of trichloroethylene by Methylosinus trichosporium OB3b[J]. Appl & Environ Micro, 1989, 55(12): 3155–3161. |
| [12] | Zhang S, Karthikeyan R, Fernando S D. Low-temperature biological activation of methane:structure, function and molecular interactions of soluble and particulate methane monooxygenases[J]. Rev Environ Sci & Biotechnol, 2017, 16(4): 1–13. |
| [13] | Antholine W E, Dispirito A A. Membrane-associated methane monooygenase from type X and type Ⅰ methanotrophs[J]. Off Sci & Techni Infor Techni Rep, 2009, 102(8): 1571–1580. |
| [14] | Su Yao(苏瑶), Kong Jiao-yan(孔娇艳), Zhang Xuan(张萱). Copper in methane oxidation:A review(甲烷氧化过程中铜的作用研究进展)[J]. J Appl Ecolo(China)(应用生态学报), 2014, 4(5): 1221–1230. |
| [15] | Choi D W, Antholine W E, Do Y A, et al. Effect of methanobactin on the activity and electron paramagnetic resonance spectra of the membrane-associated methane monooxygenase in Methylococcus capsulatus Bath[J]. Microbiol, 2005, 151: 3417–3426. DOI:10.1099/mic.0.28169-0 |
| [16] | Yu S S, Chen K H, Tseng M Y, et al. Production of high-quality particulate methane monooxygenase in high yields from methylococcus capsulatus (Bath) with a hollow-fiber membrane bioreactor[J]. J Bacter, 2003, 185(20): 5915–5924. DOI:10.1128/JB.185.20.5915-5924.2003 |
| [17] | Chan Sunny I, Chen Kelvin H, Yu Steve S, et al. Toward delineating the structure and function of the particulate methane monooxygenase from methanotrophic bacteria[J]. Biochem, 2004, 43(15): 4421–4430. DOI:10.1021/bi0497603 |
| [18] | Wei Cong(魏聪), Liu Guo-ren(刘国生). Separation and identification of methanotrophs and study on its phy-siological characteristics(甲烷氧化菌的筛选与生理特性研究)[J]. J Anhui Agricul Sci(China)(安徽农业科学), 2013, 2013(7): 2832–2832. |
| [19] | Tonge G M, Harrison D E, Higgins I J. Purification and properties of the methane mono-oxygenase enzyme system from Methylosinus trichosporium OB3b[J]. Biochem J, 1977, 161(2): 333–344. DOI:10.1042/bj1610333 |
| [20] | Takeguchi M, Miyakawa K, Okura I. Purification and properties of particulate methane monooxygenase from Methylosinus trichosporium, OB3b[J]. Mol Catal Chem, 1998, 132(2): 145–153. |
| [21] | Smith D D S, Dalton H. Solubilisation of methane monooxygenase from Methylococcus capsulatus, (Bath)[J]. Eur J Biochem, 2010, 182(3): 667–671. |
| [22] | Ashraf Kitmitto, Natalia Myronova, Piku Basu, et al. Characterization and structural analysis of an active particulate methane monooxygenase trimer from methylococcus capsulatus(Bath)[J]. Biochem, 2005, 44(33): 10954–10965. DOI:10.1021/bi050820u |
| [23] | Lieberman R L, Rosenzweig A C. Biological methane oxidation:Regulation, biochemistry, and activie site structure of particulate methane monooxygenase[J]. Biochem Mol Biology, 2004, 39: 147–164. |
| [24] | Eriks L R, Mayor J A, Kaplan R S. A strategy for identification and quantification of detergents frequently used in the purification of membrane proteins[J]. Analy Biochem, 2003, 323(2): 234–241. DOI:10.1016/j.ab.2003.09.002 |
| [25] | Shi C W, Shao W, Xiong Y, et al. A gas chromatograp-hic method for quantification of detergents frequently used in membrane protein structural studies[J]. Analy Biochem, 2008, 383(2): 326–328. DOI:10.1016/j.ab.2008.08.028 |
| [26] | Shiemke A K, Cook S A, Miley T, et al. Detergent solubilization of membrane-bound methane monooxygenase requires plastoquinol analogs as electron donors[J]. Arch Biochem & Biophys, 1995, 321(2): 421–428. |
| [27] | Piku Basu, Bettina Katterle, Kristoffer Andersson K, et al. The membrane-associated form of methane mono-oxygenase from Methylococcus capsulatus (Bath) is a copper/iron protein[J]. J Biochem Soc, 2003, 8(2): 417–427. |
| [28] | Miyaji A, Kamachi T, Okura I. Improvement of the purification method for retaining the activity of the particulate methane monooxygenase from Methylosinus trichosporium OB3b[J]. Biotechnol Lett, 2002, 24(22): 1883–1887. DOI:10.1023/A:1020963112179 |
| [29] | Xin Jia-ying(辛嘉英), Cui Jun-ru(崔俊儒), Hu Xiao-xue(胡霄雪). Study on the electron donors for particulate monooxygenase(颗粒性甲烷单加氧酶的电子供体研究)[J]. J Mol Catal(China)(分子催化), 2002, 16(3): 161–165. |
| [30] | Choi D W, Kunz R C, Boyd E S, et al. The membrane-associated methane monooxygenase(pMMO) and pMMO-NADH:Quinone oxidoreductase complex from Methylococus capsulatus Bath[J]. J Bacter, 2003, 6(10): 5755–5764. |
| [31] | Xin J Y, Cui J R, Hu X X, et al. Particulate methane monooxygenase from Methylosinus trichosporium is a copper-containing enzyme[J]. Biochem & Biophys Res Commun, 2002, 295(1): 182–186. |
| [32] | Culpepper M A, Rd C G, Gunderson W A, et al. Identification of the valence and coordination environmentof the particulate methane monooxygenase copper centers by advanced EPR characterization[J]. J Amer Chem Soc, 2014, 136(33): 11767–11775. DOI:10.1021/ja5053126 |
| [33] | Semrau J D, Dispirito A A, Yoon S. Methanotrophs and copper[J]. Fems Microbiol Rev, 2010, 34(4): 496–531. DOI:10.1111/j.1574-6976.2010.00212.x |
| [34] | Choi D W, Semrau J D, Antholine W E, et al. Oxidase, superoxide dismutase, and hydrogen peroxide reductase activities of methanobactin from types Ⅰ and Ⅱ methanotrophs[J]. J Inorg Biochem, 2008, 102(8): 1571–1580. DOI:10.1016/j.jinorgbio.2008.02.003 |
| [35] | Xing Hai-li(邢海丽), Xin Jia-ying(辛嘉英), Wang Yan(王艳), et al. Optimization of combinations of methanobactin, sodium benzoate and potassium sorbate for enhanced antibacterial effect by response surface methodology(响应面优化甲烷氧化菌素、苯甲酸钠和山梨酸钾复配剂抑菌效果)[J]. Food Sci(China)(食品科学), 2016, 37(18): 1–5. DOI:10.7506/spkx1002-6630-201618001 |
| [36] | Chen Lin-lin(陈林林), Zhang Wei(张伟), Wang Zhen-xing(王振兴), et al. Determination of superoxide dismutase activity in methanobactin-copper complexes by pyrogallol autoxidation(邻苯三酚自氧化法测定甲烷氧化菌素一铜配合物的超氧化物歧化酶活性)[J]. J Food Saf & Qual(China)(食品安全质量检测学报), 2017, 8(9): 3438–3444. |
| [37] | Xin J, Lin K, Wang Y, et al. Improved biological synthesis of gold nanoparticles using methanobactin[J]. J Korean Soc Appl Biolo Chem, 2015, 58(3): 1–9. |
| [38] | Xin Jia-ying(辛嘉英), Yan Ming-fei(阎明飞), Zhou Jie-qiong(周琦琼), et al. Copper capture mechanism of methanotrophs(甲烷氧化细菌的铜捕获机理)[J]. J Mol Catal(China)(分子催化), 2009, 23(5): 470–476. |
| [39] | Pesch M L, Christl I, Barmettler K, et al. Isolation and purification of Cu-free methanobactin from Methylosinus trichosporium OB3b[J]. Geochem Trans, 2011, 12(1): 2–9. DOI:10.1186/1467-4866-12-2 |
| [40] | Chen K H, Wu H H, Ke S F, et al. Bacteriohemerythrin bolsters the activity of the particulate methane monooxygenase (pMMO) in Methylococcus capsulatus(Bath)[J]. J Inorg Biochem, 2012, 111(6): 10–17. |
 2018, Vol. 32
2018, Vol. 32