克脑文格尔(Knoevenagel)缩合反应是指含有羰基的醛或酮在催化剂存在下与活泼亚甲基化合物的脱水缩合反应, 是增长碳链形成碳碳双键的重要方法. Knoevenagel缩合反应广泛应用于在一些具有生物学意义的杂环化合物的合成[1], 以及众多重要医药中间体、化妆品、农用化学品的生产[2].该反应通常需要在吡啶等弱碱性均相催化剂催化下进行, 但均相催化剂普遍存在催化剂与产物分离困难, 对环境污染严重等问题.因此, 近年来人们相继开发了一些新型多相催化剂, 如Lewis酸[3]、固体碱[4]、水滑石[5]、分子筛[6-8]以及各种氨基功能化材料[9-11]等, 以克服均相催化剂在使用中存在的困难.即使如此, 催化剂在分离过程中(过滤或离心)仍存在分离效率低, 催化剂有所损失的问题.磁性纳米材料一经发现, 就引起了人们的极大关注.目前, 纳米磁性材料已在污水处理[12-13]、催化[14-15]、载体[16-17]等诸多领域得到广泛应用.尤其在催化领域, 作为载体, 磁性纳米粒子可以负载各种有机官能团以及金属, 得到多种多相催化剂, 在许多反应上显示优良的催化性能[18-21].一些氨基化Fe3O4的研究也见诸文献, 并在Knoevenagel缩合反应中得到应用, 但这些氨基化方法过于繁琐, 限制了它们的大规模应用[22-24].
醛作为Knoevenagel缩合反应的原料之一, 通常通过相应的醇氧化得到.与醛相比, 醇更加廉价易得, 且相对稳定.因此, 将醇的氧化反应和Knoevenagel缩合反应串联[25-27], 既可省去中间产物的分离和提纯, 也减少了产品的损失, 实现资源的最大利用.而且, 当以分子氧为氧化剂时, 理论上氧化副产物只有水, 符合“绿色化学”理念.均相催化剂和多相催化剂都可催化醇的的选择性氧化[28-33].与其他反应一样, 均相体系反应活性高, 但产品分离与纯化较为困难.近年来, 各类多相催化剂被广泛用于醇的选择性氧化反应, 而且多以Ru[34]、Cu[35-36]、Au[37]、Pd[38]等金属和杂多酸[39]作为活性组分.由于钌存在不同价态的氧化-还原离子对, 在均相和多相条件下均有很好的催化活性, 因此, 对钌基催化剂的研究更加深入.例如, Yamaguchi等[40]通过将Ru负载到Al2O3得到多相催化剂, 可催化分子氧将多种伯醇、仲醇高选择性地氧化为相应的醛、酮.随后, Kotani等[41]则将Ru负载于磁性Fe3O4纳米离子, 用于相同反应, 实现了催化剂与产物的快速分离.
基于上述原因, 我们以聚乙烯亚胺(PEI)为氨基改性剂, 对Fe3O4纳米粒子进行包覆, 进而将Ru(OH)x负载到磁性纳米粒子表面得到多功能催化剂, 实现分子氧选择性氧化醇与Knoevenagel缩合“一锅”串联反应, 取得较好的预期结果.
1 实验部分 1.1 试剂与仪器所有原料及试剂均为分析纯. FeCl3·6H2O、FeCl2·4H2O、氨水(25%)(天津市大茂化学试剂厂), 底物醇、聚乙烯亚胺(M.W=10 000)(上海阿拉丁生化科技股份有限公司), RuCl3·3H2O(九鼎化学), 氢氧化钠(天津恒山化工科技有限公司).
采用德国布鲁克AXS有限公司达芬奇型X射线衍射仪(XRD)分析催化剂形态, 测试时使用Cu-Kα射线, 以6°/min在20°~70°范围内扫描;采用美国SDT Q-600型差热分析仪(TG)分析纳米离子的稳定性和PEI包覆率, 测试时样品在N2氛围下, 以10 ℃/min的升温速率从室温加热至900 ℃;利用德国Brucker公司的Bruker Vector 22型傅里叶变换红外光谱仪(FT-IR)分析催化剂的结构, 溴化钾压片; 采用美国Opfima 7300V型电感耦合等离子发射光谱仪(ICP-OES)测定催化剂中钌的含量; 采用美国ESCALAB 250Xi型X射线光电子能谱仪(XPS)测试钌的价态; 采用瑞士AVANCE400核磁共振波谱仪确定产品结构, CDCl3为溶剂, TMS为内标; 采用山东鲁南瑞虹化工仪器有限公司的SP-6890型气相色谱仪(SE-54气相色谱柱, 30 m×0.25 mm×0.50 μm, FID检测器)对反应进行监测并确定反应的转化率和选择性.分析过程中, 汽化室和检测器温度设定为280 ℃, 柱头压为0.05 MPa, 先将柱温在80 ℃保持3 min, 然后再以30 ℃/min的速率升温至270 ℃, 并在此温保持10 min.
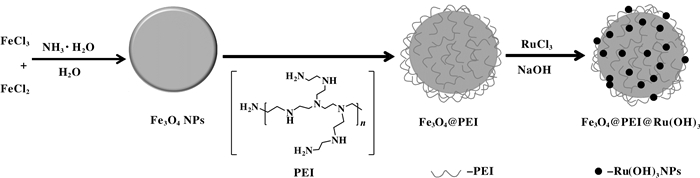
1.2 催化剂的制备多功能化磁性纳米粒子的制备路线如图式 1.
|
图式 1 催化剂的合成路线 Scheme1 Synthetic route of catalyst |
Fe3O4纳米粒子的制备采用共沉淀法.先将4.70 g(17.4 mmol)FeCl3·6H2O和1.71 g(8.6 mmol)FeCl2·4H2O用200 mL去离子水溶解.氮气保护下将溶液加热到60 ℃, 然后向其中缓慢滴加25%的氨水溶液, 直至pH=10.继续搅拌0.5 h后停止加热, 自然降至室温.利用外部磁铁将Fe3O4粒子从反应液中分离出来, 然后用去离子水多次洗涤至中性, 最后在50 ℃下真空干燥6 h得到Fe3O4纳米粒子.
1.2.2 Fe3O4@PEI粒子的制备[43]取4 g PEI用200 mL去离子水溶解, 向其中加入2 g Fe3O4纳米粒子, 并用超声将其分散均匀.室温搅拌24 h后, 用去离子水洗至中性, 并在50 ℃下真空干燥6 h, 得到Fe3O4@PEI.
1.2.3 Fe3O4@PEI@Ru(OH)x的制备[41]将2 g制备的Fe3O4@PEI加入到60 mL RuCl3水溶液(0.13 g RuCl3·3H2O)中并超声分散20 min, 然后在室温下用1 mol/L NaOH溶液将反应液调至pH≈13, 保持搅拌24 h.最后用磁铁将所得固体从反应液中分离, 并用去离子水多次洗涤至中性, 并在50 ℃下真空干燥6 h, 得到Fe3O4@PEI@Ru(OH)x.经TG和ICP分析, PEI和钌含量分别为8%和2.4%.
1.3 催化反应“一锅”串联反应在聚四氟乙烯衬里的小高压釜中进行.称取1.0 mmol醇、100 mg Fe3O4@PEI@Ru(OH)x、1.5 mL甲苯依次加入到高压釜中, 密封后用氧气置换空气, 并充压至0.5 MPa, 然后升温至130 ℃进行反应.反应完毕, 降至室温.向其中加入1.1 mmol丙二腈或氰乙酸乙酯继续反应.反应完毕, 用磁铁将反应液与催化剂分离, 产物经硅胶柱层析分离得到, 洗脱剂为石油醚:乙酸乙酯=10:1.
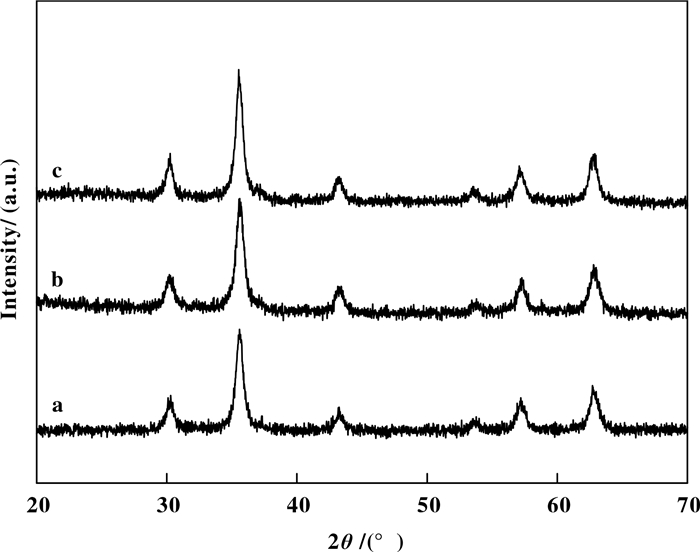
2 结果与讨论 2.1 催化剂的表征图 1为纯Fe3O4和改性的Fe3O4纳米粒子的XRD谱图. Fe3O4(a)的衍射峰位置与文献报道一致[44].在b和c中也观察到2θ =30.1°, 35.5°, 43.1°, 53.4°, 57.0°和62.6°处Fe3O4的特征峰, 证明包覆PEI和负载Ru(OH)x后没有改变Fe3O4晶体结构.在XRD中没有检测到Ru的特征峰(c), 表明Ru(OH)x在Fe3O4颗粒表面均匀分散, 晶粒细小.
|
图 1 (a) Fe3O4, (b) Fe3O4@PEI及(c) Fe3O4@ PEI@Ru(OH)x的X射线衍射谱图 Figure 1 XRD patterns of (a) Fe3O4, (b) Fe3O4@ PEI and (c) Fe3O4@PEI@Ru(OH)x |
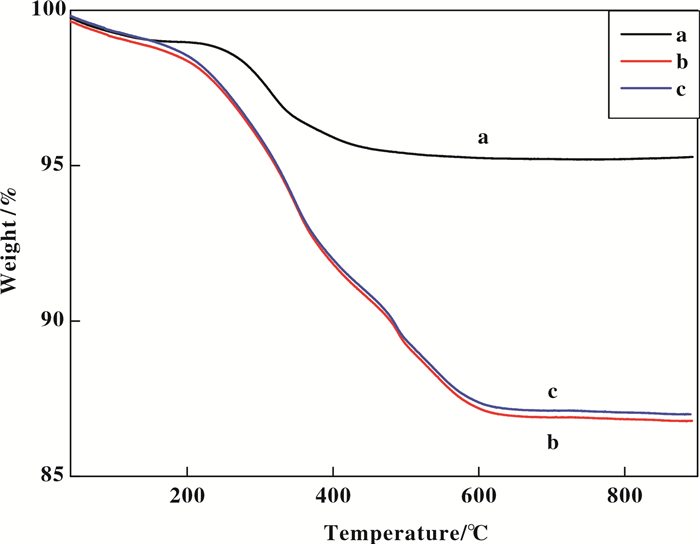
图 2为磁性粒子的热重图.曲线a为Fe3O4的受热失重曲线, 室温到200 ℃约1%的失重是由于Fe3O4表面物理吸附的水分子的脱附所致, 200~450 ℃约4%的失重是由结晶水的脱附引起[45].曲线b和c除了水分的脱附失重外, 在450~610 ℃温度区间显示另一大的失重, 这是由包覆于Fe3O4表面的PEI的分解所致.此外, 曲线b和c形状基本一致, 证明Ru(OH)x的负载没有对PEI修饰的Fe3O4的结构产生影响.从失重曲线可以得出PEI在Fe3O4的包覆率为8%.
|
图 2 (a) Fe3O4, (b) Fe3O4@PEI及(c) Fe3O4@ PEI@Ru(OH)x的失重曲线 Figure 2 TG curves of (a) Fe3O4, (b) Fe3O4@ PEI and (c) Fe3O4@PEI@Ru(OH)x |
如图 3所示, 图 3a中, 波数581 cm-1处的吸收峰是Fe3O4中Fe—O键的振动峰[44]; 图 3b中波数1 327和1 545 cm-1处的吸收峰由聚乙烯亚胺的-NH2的剪切振动峰所致[43], 证明聚乙烯亚胺在四氧化三铁表面的成功包覆. 图 3c与图 3b相比几乎没有变化, 再结合图 2的热重分析结果, 充分证明Ru(OH)x的负载对Fe3O4@PEI没有影响.

|
图 3 (a) Fe3O4, (b) Fe3O4@PEI及(c) Fe3O4@ PEI@Ru(OH)x的傅里叶变换红外光谱图 Figure 3 FT-IR spectra of (a) Fe3O4, (b) Fe3O4@ PEI and (c) Fe3O4@PEI@Ru(OH)x |
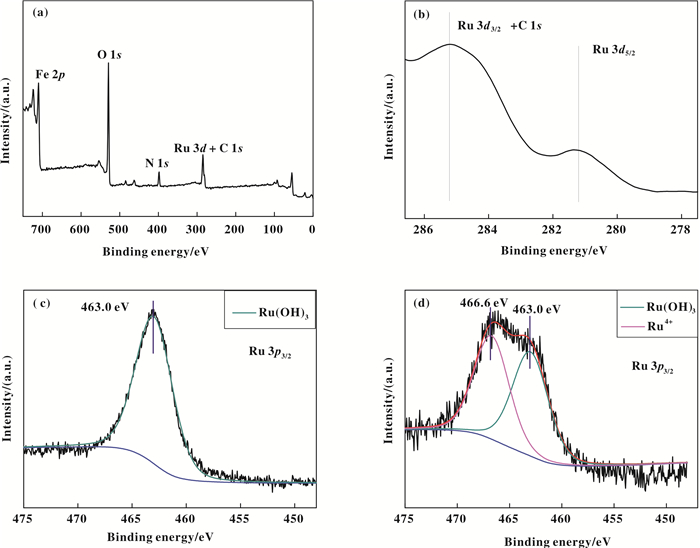
图 4a为新鲜Fe3O4@PEI@Ru(OH)x样品的XPS全谱.由图可以确定Fe, O, C, N, Ru的存在. C和N的存在进一步证明PEI成功地包覆于Fe3O4表面. 图 4b为Ru 3d的特征峰.虽然Ru 3d3/2和C 1s结合能的特征峰在285.3 eV处重叠, 但在281.1 eV处存在Ru 3d5/2结合能特征峰以及463.0 eV(图 4c)处存的Ru 3p3/2结合能特征峰, 从而证明新鲜样品中钌以+3价存在[46]. 图 4d为用过的催化剂中Ru 3p3/2结合能的特征峰, 与图 4c对比, 在结合能466.6 eV出现了4价钌的特征峰, 证明经过氧化反应后催化剂中一部分钌从+3价氧化到了+4价[47].
|
图 4 Fe3O4@PEI@Ru(OH)x (a)宽谱(b) Ru 3d (c) Ru 3p3/2 (d)用过催化剂Ru 3p3/2的X射线光电子能谱图 Figure 4 XPS spectra of Fe3O4@PEI@Ru(OH)x. (a) wide scan spectrum, (b) Ru 3d, (c) Ru 3p3/2 of fresh sample, and (d) Ru 3p3/2 of used sample |
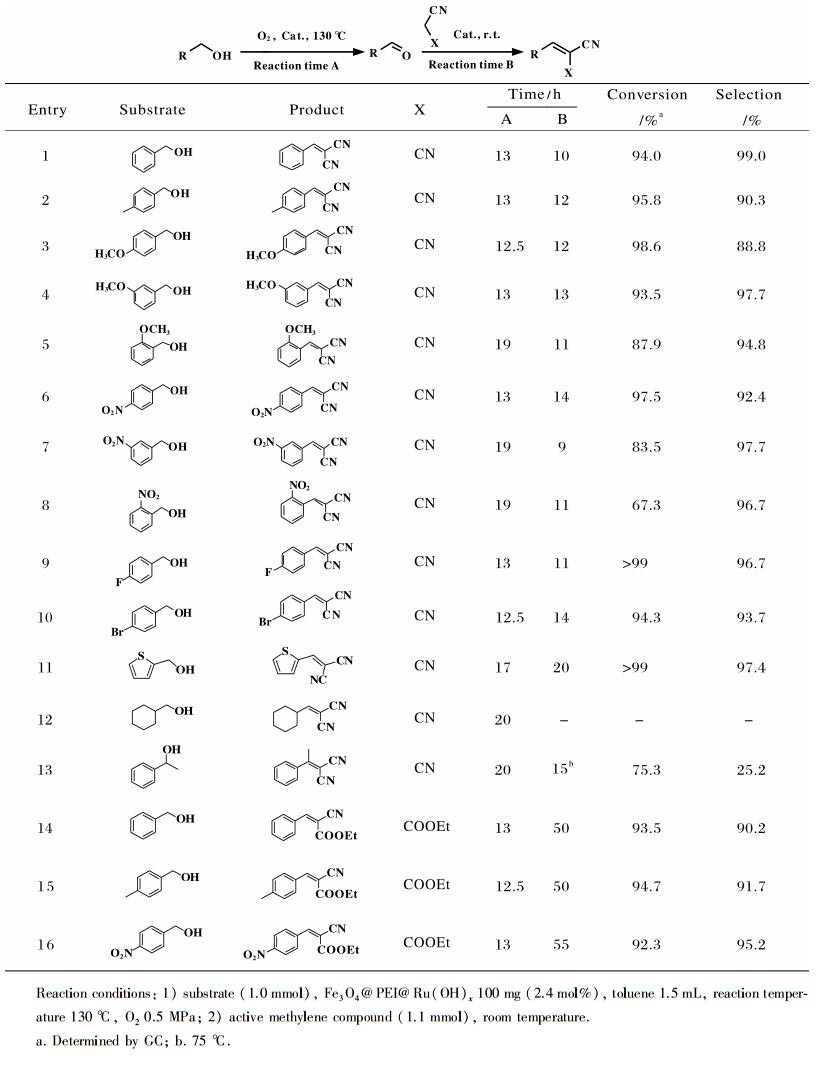
首先, 以苯甲醇为模板底物考察了醇氧化反应的条件.如表 1所示, 所有反应条件下苯甲醛的选择性均大于99%.当以甲苯为溶剂、0.5 MPa O2、100 mg催化剂、110 ℃进行反应时, 反应13 h转化率达到75.4% (Table 1, entry 1);升高温度至130 ℃时, 相同反应时间转化率升至94.0% (Table 1, entry 2);继续提高温度至170 ℃, 反应11 h, 转化率只比130 ℃时提高了1.1% (Table 1, entry 3), 故以后均选择130 ℃为反应温度.随后, 对O2的压力进行了考察.在0.3 MPa O2压力下反应13 h, 转化率只有81.2% (Table 1, entry 4);将压力提高到0.7 MPa, 反应11 h达到94.6% (Table 1, entry 5), 与0.5 MPa O2下反应相比, 反应时间缩短不大, 故以后均采用0.5 MPa O2作为反应压力.当将溶剂替换为乙酸乙酯和1, 4-二氧六环时, 相同条件下转化率均有明显下降(Table 1, entries 6-7).另外, 空白条件下反应13 h, 几乎没有苯甲醛的生成.催化剂用量为50 mg时, 反应13 h转化率只有54.7%.当催化剂的用量增大到150 mg时, 反应11 h转化率可达95.5%, 但与100 mg催化剂用量相比, 催化剂用量增加了50%, 苯甲醇的转化率却只提高了1.1% (Table 1, entries 8-10).因此, 催化剂用量选择100 mg.最终确定反应的优条件为:溶剂甲苯、0.5 MPa O2压力、温度130 ℃、催化剂用量100 mg.
| 表 1 苯甲醇氧化反应条件的考察 Table 1 Investigation on the reaction conditions for the benzyl alcohol oxidation |
将Fe3O4@PEI@Ru(OH)x催化剂用于包括芳香族、杂环和脂肪族的伯醇, 以及1-苯乙醇等不同结构醇的分子氧氧化与克脑文格尔缩合的串联反应, 以考察该催化剂的底物适用性, 结果见表 2.由表 2可知, 各种取代的苯甲醇都可不同程度地转化为相应的缩合产物, 其中一些底物由于中间产物醛未能全部发生Knoevenagel反应, 使得总反应的选择性有所降低.当取代基在对位时, 无论取代基是供电子基还是吸电子取代基, 都可以被高选择性地氧化成醛, 继而通过Knoevenagel缩合反应转化为相应的缩合产物, 但反应速率有所不同.从表 2可以看出, 供电子基取代和吸电子基取代的苯甲醇反应结果类似(Table 2, entries 1-3, 6, 9-10).从表 2还可看到, 当取代基的位置发生变化时, 氧化反应的速率有明显不同(Table 2, entries 3-8), 反应速率顺序为对位取代醇>间位取代醇>邻位取代醇.如对硝基苯甲醇反应13 h转化率即可以达到97.5%, 而间硝基苯甲醇反应19 h, 转化率只有83.5%, 邻硝基苯甲醇反应19 h转化率只有67.3%, 表明空间位阻越大使得Ru越难与醇羟基配位进行反应.杂环伯醇代表化合物噻吩甲醇也可以顺利地进行氧化反应, 串联反应的总收率接近80% (Table 2, entry 11).该催化剂对脂肪族伯醇的氧化没有催化活性, 缩合反应当然不能进行(Table 2, entry 12).由于空间位阻, 仲醇氧化的速率有所降低, 并且第二步的Knoevenagel反应在加热至75 ℃也只有少量产品的生成(Table 2, entry 13).当丙二腈换为氰乙酸乙酯时, 第二步缩合反应很慢, 反应50 h中间体醛才能完全转化为相应的缩合产物(Table 2, entries 14-16), 这是由于氰乙酸乙酯中亚甲基的酸性比丙二腈亚甲基的酸性弱所致[9, 48].
| 表 2 Fe3O4@PEI@Ru(OH)x催化的不同底物的串联反应 Table 2 Aerobic oxidation/Knoevenagel tandem reaction with different substrates catalyzed by Fe3O4@PEI@Ru(OH)x |
以苯甲醇的氧化反应为模版反应, 考察了Fe3O4@PEI@Ru(OH)x的循环使用性能.每次反应完成后, 用外部磁铁将催化剂和反应液分离, 再用甲苯洗涤催化剂3次, 干燥后用于下次反应, 发现Fe3O4@PEI@Ru(OH)x再次使用后, 转化率只有68.4%. ICP分析发现催化剂钌的含量在反应后没有发生变化, 都为2.4%, 而XPS分析发现, 催化剂反应后有Ru4+出现, 据此推测催化剂失活的主要原因是氧化反应过程中催化剂表面活性的Ru3+被氧化为惰性的Ru4+.
3 结论PEI改性的Fe3O4纳米粒子可负载Ru(OH)x得到多功能磁性催化剂Fe3O4@PEI@Ru(OH)x.该催化剂在分子氧氧化醇-克脑文格尔“一锅”串联反应中显示良好的催化性能.该催化剂具有较广的底物适用性和易于与反应液分离的优点.但Fe3O4@PEI@Ru(OH)x经过醇的氧化反应后, 催化活性明显下降. ICP与XPS分析结果证明, 催化剂失活的原因是在醇氧化反应中催化剂中一部分活性的Ru3+被氧化为惰性的Ru4+, 而非钌的流失.
| [1] | Tietze L F. Domino reactions in organic synthesis[J]. Chem Rev, 1996, 96(1): 115–136. DOI:10.1021/cr950027e |
| [2] | Ono Y. Solid base catalysts for the synthesis of fine che-micals[J]. J Catal, 2003, 216(1): 406–415. |
| [3] | Kumbhare R M, Sridhar M. Magnesium fluoride catalyzed Knoevenagel reaction:An efficient synthesis of electrophilic alkenes[J]. Catal Commun, 2008, 9(3): 403–405. DOI:10.1016/j.catcom.2007.07.027 |
| [4] | Huang J, Ding S M, Xiao W M, et al. 3-Aminopropyl-triethoxysilane functionalized graphene oxide:A highly efficient and recyclable catalyst for knoevenagel condensation[J]. Catal Lett, 2015, 145(4): 1000–1007. DOI:10.1007/s10562-014-1461-8 |
| [5] | Khan F A, Dash J, Satapathy R, et al. Hydrotalcite catalysis in ionic liquid medium:A recyclable reaction system for heterogeneous knoevenagel and nitroaldol condensation[J]. Tetra Lett, 2004, 45(15): 3055–3058. DOI:10.1016/j.tetlet.2004.02.103 |
| [6] | Sujandi E A, Prasetyanto S E, Park . Synthesis of short-channeled amino-functionalized SBA-15 and its beneficial applications in base-catalyzed reactions[J]. Appl Catal A-Gener, 2008, 350(2): 244–251. DOI:10.1016/j.apcata.2008.08.020 |
| [7] | Martins L, Hölderich W, Hammer P, et al. Preparation of different basic Si-MCM-41 catalysts and application in the knoevenagel and claisen-schmidt condensation reactions[J]. J Catal, 2010, 271(2): 220–227. DOI:10.1016/j.jcat.2010.01.015 |
| [8] | Gao Jin-bao(高金宝), Wang Li-bing(王丽冰), Liu Xiu-li(刘秀丽), et al. The synthesis, characterization of functionalized SBA-15 and the solvent effect in knoevenagel condensation(功能化SBA-15的合成、表征及其在Knoevenagel缩合反应中溶剂效应的研究)[J]. J Mol Catal(China)(分子催化), 2008, 22(2): 117–122. |
| [9] | Martínez F, Orcajo G, Briones D, et al. Catalytic advantages of NH2-modified MIL-53(Al) materials for knoevenagel condensation reaction[J]. Micro Mes Mater, 2017, 246: 43–50. DOI:10.1016/j.micromeso.2017.03.011 |
| [10] | Mangala K, Sreekumar K. Dendrimer functionalized po-lysilane:An efficient and recyclable organocatalyst[J]. J Appl Polym Sci, 2015, 132(10): 41593–41599. |
| [11] | Sun Y B, Cao C Y, Huang P P, et al. Amines functionalized C60 as solid base catalysts for knoevenagel condensation with high activity and stability[J]. RSC Adv, 2015, 5(105): 86082–86087. DOI:10.1039/C5RA16011A |
| [12] | Rajput S, Jr P C, Mohan D. Magnetic magnetite (Fe3O4) nanoparticle synthesis and applications for lead (Pb2+) and chromium (Cr6+) removal from water[J]. J Coll Inter Sci, 2016, 468: 334–346. DOI:10.1016/j.jcis.2015.12.008 |
| [13] | Wu S P, Huang J C, Zhuo C H, et al. One-step fabrication of magnetic carbon nanocomposite as adsorbent for removal of methylene blue[J]. J Inorg Org Pol, 2016, 26(3): 632–639. DOI:10.1007/s10904-016-0355-1 |
| [14] | Niu H L, Lu J H, Song J J, et al. Iron oxide as catalyst for nitroarenes hydrogenation:the Important role of oxygen vacancies[J]. Ind Engineer Chem Res, 2016, 55(31): 8527–8533. DOI:10.1021/acs.iecr.6b00984 |
| [15] | Zhang Z H, Lu H Y, Yang S H, et al. Synthesis of 2, 3-dihydroquinazolin-4(1H)-ones by three-component coupling of isatoic anhydride, amines, and aldehydes catalyzed by magnetic Fe3O4 nanoparticles in water[J]. J Comb Chem, 2010, 12(5): 643–646. DOI:10.1021/cc100047j |
| [16] | Byun S, Song Y, Kim B M. Heterogenized bimetallic Pd-Pt-Fe3O4 nanoflakes as extremely robust, magnetically recyclable catalysts for chemoselective nitroarene reduction[J]. ACS Appl Mater Inter, 2016, 8(23): 14637–14647. DOI:10.1021/acsami.6b05229 |
| [17] | Zhu M, Diao G. Magnetically magnetically recyclable Pd nanoparticles immobilized on magnetic Fe3O4@C nanocomposites:Preparation, characterization, and their catalytic activity toward suzuki and heck coupling reactions[J]. J Phys Chem C, 2011, 115(50): 24743–24749. DOI:10.1021/jp206116e |
| [18] | Shokouhimehr M, Piao Y, Kim J, et al. A magnetically recyclable nanocomposite catalyst for olefin epoxidation[J]. Angew Chem Int Ed, 2007, 46(37): 7039–7043. DOI:10.1002/(ISSN)1521-3773 |
| [19] | Abu-Reziq R, Alper H, Wang D, et al. Metal supported on dendronized magnetic nanoparticles:Highly selective hydroformylation catalysts[J]. J Am. Chem Soc, 2006, 128(15): 5279–5282. DOI:10.1021/ja060140u |
| [20] | Aiguo Hu, And G T Y, Wenbin Lin. Magnetically reco-verable chiral catalysts immobilized on magnetite nanoparticles for asymmetric hydrogenation of aromatic ketones[J]. J Am Chem Soc, 2005, 127(36): 12486–12487. DOI:10.1021/ja053881o |
| [21] | Shylesh S, Schünemann V, Thiel W R. Magnetically separable nanocatalysts:Bridges between homogeneous and heterogeneous catalysis[J]. Angew Chem Int Ed, 2010, 49(20): 3428–3459. DOI:10.1002/anie.200905684 |
| [22] | Zhang Y C, Sun X C, Guo Z M, et al. Synthesis of py-ridinecarboxaldimine grafted to magnetic nanoparticles (Fe3O4@SiO2) and its application in the aerobic oxidation of primary alcohols catalyzed by CuBr2/TEMPO[J]. Russ J Gener Chem, 2016, 86(4): 944–952. DOI:10.1134/S1070363216040320 |
| [23] | Filho J B M D R, Pires G P, Teotonio E E S, et al. Knoevenagel condensation of aldehydes and ketones with malononitrile catalyzed by amine compounds-tethered Fe3O4@SiO2 nanoparticles[J]. Catal Lett, 2017, 147(1): 167–180. DOI:10.1007/s10562-016-1916-1 |
| [24] | Rostami A, Atashkar B, Gholami H. Novel magnetic nanoparticles Fe3O4-immobilized domino knoevenagel condensation, michael addition, and cyclization catalyst[J]. Catal Commun, 2013, 37: 69–74. DOI:10.1016/j.catcom.2013.03.022 |
| [25] | Zhang Y C, Lu F, Zhang H Y, et al. Activated carbon supported ruthenium nanoparticles catalyzed synthesis of imines from aerobic oxidation of alcohols with amines[J]. Catal Lett, 2017, 147(1): 20–28. DOI:10.1007/s10562-016-1930-3 |
| [26] | Ma Y, Qian C T, Wang L M, et al. Lanthanide triflate catalyzed biginelli reaction. one-pot synthesis of dihydropyrimidinones under solvent-free conditions[J]. J Org Chem, 2000, 65(12): 3864–3868. DOI:10.1021/jo9919052 |
| [27] | Demaray J A, Thuener J E, Dawson M N, et al. Synthesis of triazole-oxazolidinones via a one-pot reaction and evaluation of their antimicrobial activity[J]. Bioorg Med Chem Lett, 2008, 18(17): 4868–4871. DOI:10.1016/j.bmcl.2008.07.087 |
| [28] | Liu J X, Ma S M. Room temperature Fe(NO3)3·9H2O/TEMPO/NaCl-catalyzed aerobic oxidation of homopro-pargylic alcohols[J]. Tetrahedron, 2013, 69(47): 10161–10167. DOI:10.1016/j.tet.2013.08.082 |
| [29] | Thangavel S, Boopathi S, Mahadevaiah N, et al. Cataly-tic oxidation of primary aromatic alcohols using half sandwich Ir, Rh(Ⅲ) and Ru(Ⅱ) complexes:A practical and theoretical study[J]. J Mol Catal A-Chem, 2016, 423: 160–171. DOI:10.1016/j.molcata.2016.06.017 |
| [30] | Jiang N, Ragauskas A J. Cu(Ⅱ)-catalyzed selective ae-robic oxidation of alcohols under mild conditions[J]. J Org Chem, 2006, 71(18): 7087–7090. DOI:10.1021/jo060837y |
| [31] | Lee A F, Gee J J, Theyers H J. Aspects of allylic alcohol oxidation-a bimetallic heterogeneous selective oxidation catalyst[J]. Green Chem, 2000, 2(6): 279–282. DOI:10.1039/b006528p |
| [32] | Ji H B, Ebitani K, Mizugaki T, et al. Environmentally friendly alcohol oxidation using heterogeneous catalyst in the presence of air at room temperature[J]. Catal Commun, 2002, 3(11): 511–517. DOI:10.1016/S1566-7367(02)00194-2 |
| [33] | Wu Cang-cang(吴藏藏), Zheng Li(郑丽), Xu Xiu-feng(徐秀峰). Selective catalytic oxidation of benzyl alcohol over Mn-Al and Cu-Mn-Al composite oxide catalysts(Mn-Al和Cu-Mn-Al复合氧化物催化苯甲醇选择氧化反应)[J]. J Mol Catal(China)(分子催化), 2016, 30(6): 532–539. |
| [34] | Zhan B Z, White M A, Sham T K, et al. Zeolite-confined nano-RuO2:A green, selective, and efficient catalyst foraerobic alcohol oxidation[J]. J Am Chem Soc, 2003, 125(8): 2195–2199. DOI:10.1021/ja0282691 |
| [35] | Zaccheria F, Ravasio N, Psaro R, et al. Anaerobic oxidation of nonactived secondary alcohols over Cu/Al2O3[J]. Chem Commun, 2005, 2005(2): 253–255. |
| [36] | Li He-jian(李和建), Wu Cang-cang(吴藏藏), Zheng Li(郑丽), et al. Selective catalytic oxidation of benzyl alcohol over Cu-BTC and its derivatives(Cu-BTC及其衍生物在苯甲醇选择氧化反应中的催化活性)[J]. J Mol Catal(China)(分子催化), 2017, 31(4): 341–347. |
| [37] | Liu Y, Tsunoyama H, Akita T, et al. Size effect of silica-supported gold clusters in the microwave-assisted oxidation of benzyl alcohol with H2O2[J]. Chem Lett, 2010, 39(3): 159–161. DOI:10.1246/cl.2010.159 |
| [38] | Mori K, Yamaguchi K, Hara T, et al. Controlled synthesis of hydroxyapatite-supported palladium complexes as highly efficient heterogeneous catalysts[J]. J Am Chem Soc, 2003, 34(6): 11572–11573. |
| [39] | Bamoharram F, Heravi M, HodaTeymouri , et al. Preyssler heteropolyacid supported on nano-SiO2:A green and reusable catalyst in selective oxidation of benzyl alcohols to benzaldehydes[J]. Syn Rea Inorg M, 2011, 41(10): 1221–1228. DOI:10.1080/15533174.2011.591873 |
| [40] | Yamaguchi K, Mizuno N. Supported ruthenium catalyst for the heterogeneous oxidation of alcohols with molecular oxygen[J]. Angew Chem Int Ed, 2002, 41(23): 4538–4542. DOI:10.1002/1521-3773(20021202)41:23<4538::AID-ANIE4538>3.0.CO;2-6 |
| [41] | Kotani M, Koike T, Yamaguchi K, et al. Ruthenium hydroxide on magnetite as a magnetically separable heterogeneous catalyst for liquid-phase oxidation and reduction[J]. Green Chem, 2006, 8(8): 735–741. DOI:10.1039/b603204d |
| [42] | Massart R. Preparation of aqueous magnetic liquids in alkaline and acidic media[J]. IEEE Trans Magn, 1981, 17(2): 1247–1248. DOI:10.1109/TMAG.1981.1061188 |
| [43] | Zhu W W, Li Y J, Zeng F, et al. Superparamagnetic Fe3O4 nanoparticles modified by water-soluble and biocompatible polyethylenimine for lipase immobilization with physical and chemical mechanisms[J]. RSC Adv, 2015, 5(29): 23039–23045. DOI:10.1039/C4RA15832F |
| [44] | Lei Z L, Li Y L, Wei X Y. A facile two-step modifying process for preparation of poly(SStNa)-grafted Fe3O4/SiO2 particles[J]. J Sol State Chem, 2008, 181(3): 480–486. DOI:10.1016/j.jssc.2007.12.004 |
| [45] | Song W C, Liu M C, Hu R, et al. Water-soluble polyacrylamide coated-Fe3O4 magnetic composites for high-efficient enrichment of U(Ⅵ) from radioactive wastewater[J]. Chem Eng J, 2014, 246: 268–276. DOI:10.1016/j.cej.2014.02.101 |
| [46] | Podolean I, Kuncser V, Gheorghe N, et al. Ru-based magnetic nanoparticles (MNP) for succinic acid synthesis from levulinic acid[J]. Green Chem, 2013, 15(11): 3077–3082. DOI:10.1039/c3gc41120f |
| [47] | Yuan Q Q, Zhang D M, Haandel L V, et al. Selective liquid phase hydrogenation of furfural to furfuryl alcohol by Ru/Zr-MOFs[J]. J Mol Catal A-Chem, 2015, 406: 58–64. DOI:10.1016/j.molcata.2015.05.015 |
| [48] | Yang Y, Yao H F, Xi F G, et al. Amino-functionalized Zr(Ⅳ) metal-organic framework as bifunctional acid-base catalyst for Knoevenagel condensation[J]. J Mol Catal A-Chem, 2014, 390: 198–205. DOI:10.1016/j.molcata.2014.04.002 |
 2018, Vol. 32
2018, Vol. 32