2. 东北大学 冶金学院, 辽宁 沈阳 110819
2. School of Metallurgy, Northeastern University, Shenyang, Liaoning 110819, China
化石燃料燃烧产生的氮氧化物(NOx)对环境造成了严重的污染, 如光化学烟雾、酸雨和雾霾等一系列环境问题[1-2].以NH3作为还原剂的选择性催化还原(SCR)氮氧化物已被证明是减少固定源NOx排放最有效的技术.目前, 燃煤电厂SCR脱硝催化剂应用的最多的是以MoO3或WO3作为增效剂的钒钛系催化剂, 其活性温度窗口仅为300~400 ℃[3].然而, 大多数工业炉窑的烟气温度在200~250 ℃之间, 相比电厂300~400 ℃的烟气温度, 其温度相对较低.如果直接采用电厂用的钒钨钛催化剂, 由于其活性温度窗口较高, 因此低温脱硝效率相对较低, 且经过NOx脱除后的NH3逃逸量较大, 很难达到国家排放标准.除此之外, V2O5氧化物本身存在一定毒性, 所以钒钨钛催化剂的处理及后期更换很容易产生二次污染.因此, 环保高效的低温SCR脱硝催化剂的研发已经迫在眉睫.
氧化铝颗粒具有耐高温, 机械性能优异, 比表面积大, 易于形状控制等优点, 使其成为低温脱硝催化剂的优良载体[4-7]. Fe的加入可以使Bransted酸和Lewis酸的数量增多, 进而促进NH3的附着和活化[8-11].过渡金属Mn存在多种价态以及各种表面活性氧, 因而引起了人们的高度关注[12-14]. Kapteijn等[15]研究发现, 锰氧化物的SCR活性按MnO2 > Mn5O8 > Mn2O3 > Mn3O4 > MnO的顺序降低, MnO2氧化物的催化活性最高. Smirniotis等[16]采用浸渍法制备了以TiO2、Al2O3和SiO2为载体负载锰催化剂并研究了它们的低温脱硝性能, 发现高表面锰氧化物浓度和催化剂的氧化还原性能是实现较好的低温脱硝性能的重要因素.因此本文拟以Al2O3为载体, Fe、Mn为活性组分, 采用浸渍法制备Fe/Al2O3和Mn-Fe/Al2O3催化剂, 并研究其低温脱硝性能.
1 实验部分 1.1 催化剂制备我们采用等体积浸渍法制备了Fe/Al2O3和Mn-Fe/Al2O3系列催化剂.首先称取一定量的Al2O3粉末及Fe(NO3)3·9H2O晶体; 添加一定体积去离子水将Fe(NO3)3·9H2O配制成Fe(NO3)3水溶液, 将称量后的Al2O3粉末与Fe(NO3)3溶液混合, 磁力搅拌3 h后置于鼓风干燥箱105 ℃的干燥10 h, 将干燥后的催化剂样品粉末装于坩埚中于450 ℃马弗炉中焙烧5 h, 随后随炉冷却.以相同方法分别制备xFe/ Al2O3系列催化剂, x=3, 5, 7, 9, 11为Fe/Al质量百分比.
采用相同的方法及制备条件制备Mn/Fe质量比分别为9:7、11:7、13:7和15:7的Mn-Fe/ Al2O3催化剂.
1.2 催化剂性能测试催化剂的性能评价采用固定床催化反应装置.将0.4 g(0.4 mL)催化剂装入反应器后放置在电加热炉内加热, 待达到设定温度后通入混合气体.实验采用模拟工业烟气进行测试, NO浓度为420 ppm、NH3浓度为420 ppm、O2为5%(体积百分比)、N2为平衡气, 总流量为300 mL/min, 空速为45 000 h-1.反应器进出口NOx(NO和NO2之和)浓度由多功能在线烟气分析仪测定.
催化剂活性评价通过NOx转化效率衡量, 由式(1)计算:
| $ {\eta _{N{O_x}}} = \frac{{{{\left[ {N{O_x}} \right]}_{in}} - {{\left[ {N{O_x}} \right]}_{out}}}}{{{{\left[ {N{O_x}} \right]}_{in}}}} $ | (1) |
其中, [NOx]in、[NOx]out分别为NOx进口浓度和出口浓度.
1.3 催化剂表征 1.3.1 N2等温吸附-脱附测试(BET)采用美国Micromeritics Instrument Corporation公司ASAP 2020 HD88型N2吸附仪测试催化剂的比表面积、孔容和孔径分布.根据Brunauer-Emmett-Teller (BET)方程计算催化剂的比表面积, 采用Barrett-Joyner-Halenda (BJH)模型获取其比孔容及孔径分布.实验时, 将200 mg样品先在真空中200 ℃下热处理4 h, 再以高纯N2作吸附介质, 在-196 ℃(液氮温度)下测定其吸附数据.
1.3.2 X射线衍射(XRD)采用德国D8 advance型X射线衍射仪(Bruker)对催化剂样品晶相结构进行分析.实验用Cu Kα射线, 扫描角度范围为10°~80°, X射线的波长为0.154 06 nm.
1.3.3 表面扫描电镜及元素分析(SEM)表面扫描电镜及元素分析(SEM)采用美国Phillips XL-30-ESEM扫描电子显微镜测定, 并以X射线能谱(EDS)测定催化剂表面的元素分布, 工作电压为20 kV.
1.3.4 X射线光电能谱(XPS)采用美国Thermo Fisher Scientific公司X射线光电子能谱(X-ray Photoelectron Spectrometer, XPS)来测定催化剂内部和表面的电子结构和化学组成, 并分析其价态规律.检测条件为: Al Kα射线源, 操作功率为300 W.
1.3.5 程序升温脱附(NH3-TPD)采用美国麦克公司AutoChem Ⅱ型化学吸附仪测试催化剂表面酸性. NH3-TPD以流量为40 mL·min-1的高纯He为载气, 100 mg样品先在350 ℃下用载气吹扫60 min, 然后冷却降温到50 ℃, 吸附10% NH3/He气体120 min至饱和, 用载气高纯He吹扫直到基线稳定, 以10 ℃·min-1的升温速率升温至400 ℃, 脱附的NH3浓度由热导池检测器测定.热导池温度100 ℃, 桥电流80 mA.
1.3.6 H2程序升温还原(H2-TPR)采用美国麦克公司AutoChem Ⅱ型化学吸附仪测试分析催化剂表面氧化还原性能.测试条件为: H2-TPR以高纯Ar为载气, 先在350 ℃下烘干60 min, 样品用量100 mg, 载气流量30 mL·min-1, 降温至50 ℃下吹扫30 min直至基线水平后, 切换成10% H2/Ar, 以10 ℃·min-1的升温速率升至700 ℃, 还原反应前后氢气的浓度变化由热导池检测器分析.热导池温度100 ℃, 桥电流80 mA.
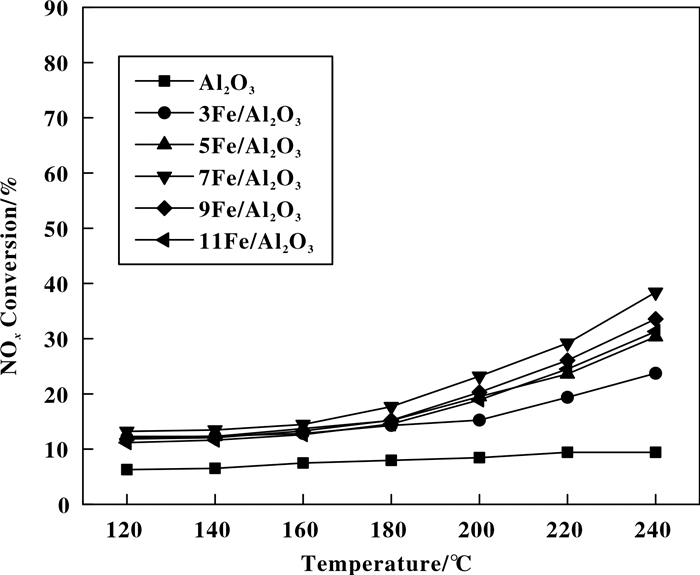
2 结果与讨论 2.1 Fe负载量对催化剂低温脱硝性能的影响图 1为Al2O3上负载不同含量Fe的催化剂样品在不同温度下的NOx转化率曲线.从图 1可以看出, 未负载Fe的Al2O3催化剂脱硝效率很低, 且NOx转化率随温度的升高变化很小, 一直稳定在6%左右.随着负载Fe含量的增加, 催化剂脱硝效率有一定提高, 但当Fe的负载量达到7%时, 催化剂样品的脱硝效率随Fe负载量的增大呈下降趋势.这可能是由于较低浓度的Fe负载量未能使催化剂表面的活性位达到饱和, 但当负载量达到7%时, 催化剂表面的活性组分发生团聚或覆盖现象, 导致活性位数量减少, 从而使催化剂NOx转化率降低[17].由图 1可以看出7Fe/Al2O3催化剂在低温段(120~240 ℃)的脱硝效率较低, Kim等[18-19]研究发现通过浸渍法制备单一金属铁氧化物负载在载体表面的催化剂的活性温度窗口处于中温端, 而在低温段的脱硝效率较低, 我们的实验结果与他们得到的结论一致.
|
图 1 不同Fe负载量的xFe/Al2O3催化剂在不同温度下的NOx转化率曲线 Figure 1 NOx conversion curves of xFe/Al2O3 catalysts with different Fe contents at different temperatures |
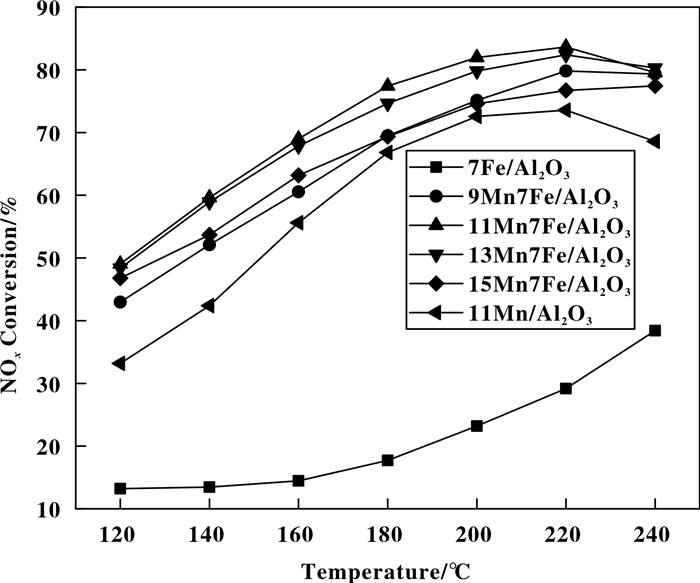
由图 1可知, 当Al2O3上负载7%Fe时, 催化剂获得较高的低温脱硝性能.因此, 我们选择7Fe/Al2O3催化剂下Mn添加量对7Fe/Al2O3催化剂低温脱硝性能的影响研究. 图 2为不同Mn添加量对7Fe/Al2O3催化剂脱硝性能的影响.从图 2可以明显看出, Mn的添加极大地提高了催化剂的低温脱硝性能.随着Mn/Fe质量比的增大, 催化剂的脱硝性能呈现先升高高后降低的趋势.当Mn/Fe质量比为11:7时, 11Mn7Fe/Al2O3催化剂获得最佳的低温脱硝效率, 在220 ℃时, 脱硝效率达到87%.当Mn/Fe质量比高于11:7, MnFe/Al2O3催化剂的脱硝效率降低, 这主要是由于活性组分占据了Al2O3载体上的空穴或者在载体表面出现了团聚现象, 覆盖了催化剂载体表面, 使得活性位点减少, 进而脱硝活性随之降低[20].对比11Mn7Fe/Al2O3和11Mn/Al2O3催化剂的效率可以发现, 未加Fe的11Mn/Al2O3催化剂的低温脱硝效率要比11Mn7Fe/Al2O3低15%左右, 说明Fe在11Mn7Fe/Al2O3催化剂中对NO脱除有一定的促进作用.
|
图 2 不同Mn负载量的xMn7Fe/Al2O3催化剂在不同温度下的NOx转化率曲线 Figure 2 NOx conversion curves of xMn7Fe/AC catalysts with different Mn contents at different temperatures |
催化剂比表面积的大小在一定程度上会影响催化剂的SCR活性, 大比表面积的催化剂拥有更多的活性位点, 更多气体分子在催化剂表面得到活化, 进而促进脱硝反应的进行[21].因此我们对催化剂进行了N2等温吸附-脱附测试, 其比表面积、平均孔容和平均孔径测试结果如表 1所示.从表 1可以看出, Al2O3催化剂的比表面积为63.10 m2·g-1, 平均孔容为0.19 cm3·g-1, 平均孔径为12.20 nm. 7Fe/Al2O3和11Mn7Fe/Al2O3催化剂的平均孔容孔径与Al2O3催化剂相差很小.负载7%Fe并未使催化剂的比表面积增加, 反而减少; 在7Fe/Al2O3的基础上添加Mn使催化剂的比表面积进一步减少.结合图 1和2可知, 11Mn7Fe/Al2O3显示出最佳的低温脱硝效率, 但其比表面积并非最大, 这说明比表面积和孔径的大小并不是决定Mn-Fe/Al2O3催化剂性能高低的主要因素, 催化剂的脱硝性能可能受活性组分种类及数量的影响更大.
| 表 1 不同催化剂的BET物理性质 Table 1 BET physical properties of different catalysts |
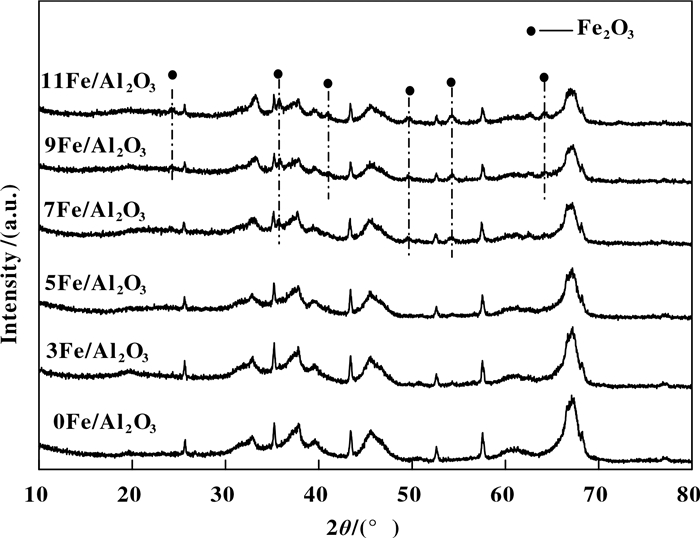
为了研究催化剂物相组成对其脱硝性能的影响, 对制备的催化剂样品进行了XRD检测, 结果如图 3、4所示. 图 3为xFe/Al2O3催化剂的XRD谱图, 与JCPDS(Joint Committee on Powder Diffraction Standards, 粉末衍射标准联合委员会)标准卡片对比, 可以发现3Fe/Al2O3和5Fe/Al2O3催化剂没有出现Fe氧化物的晶相特征衍射峰; 当Fe的质量比达到7%时, 开始出现Fe2O3的衍射峰, 并且随着Fe添加量逐渐增大, Fe2O3衍射峰强度增强而且峰宽变窄, 说明3Fe/Al2O3和5Fe/Al2O3催化剂的活性组分以非晶态形式均匀地分布在催化剂表面.当负载量达到一定浓度后, 催化剂表面的活性组分开始发生团聚, 形成Fe2O3晶相. Wu等[22]研究表明, 非晶相可以在催化剂表面生成高浓度的活性组分, 从而获得优异的活性. XRD结果表明7Fe/Al2O3催化剂中活性组分刚刚开始结晶, 此时非晶相含量最高, 这可能是造成7Fe/Al2O3催化剂脱硝效率较高的原因.
|
图 3 xFe/Al2O3催化剂的XRD谱图 Figure 3 XRD patterns of xFe/Al2O3 catalysts |
|
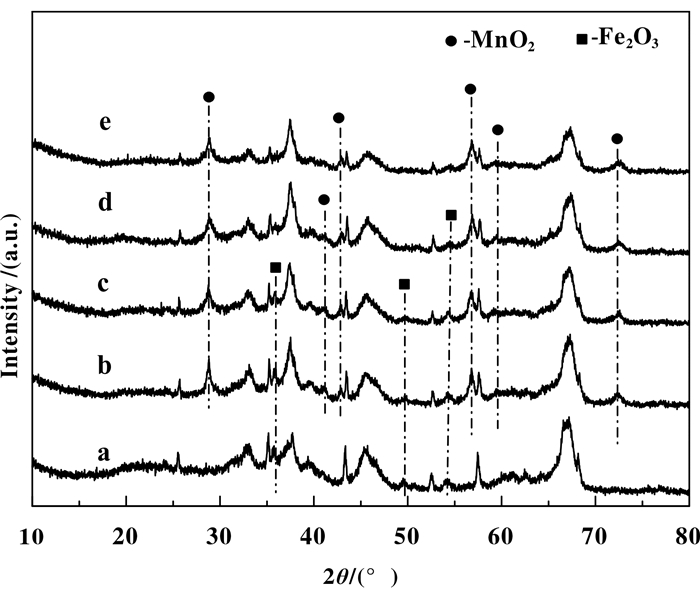
图 4 xMn-7Fe/Al2O3催化剂的XRD谱图 Figure 4 XRD patterns of xMn-7Fe/Al2O3 catalysts (a. 7Fe/Al2O3; b. 9Mn7Fe/Al2O3; c. 11Mn7Fe/Al2O3; d. 13Mn7Fe/Al2O3; e. 15Mn7Fe/Al2O3) |
图 4为xMn7Fe/Al2O3催化剂的XRD谱图, 可以发现Mn添加后导致Fe2O3晶相的峰高降低, 峰宽变宽, 并且随着Mn添加量逐渐增大, Fe2O3峰强度变得较低而且峰宽变得更宽; 同时锰氧化物的峰也逐渐变低、变宽, 说明MnO2和Fe2O3在xMn7Fe/Al2O3催化剂中具有很强的相互作用, Mn的负载量可以影响活性组分Fe2O3的微观晶体结构, 改善Fe2O3的分散, 从而促使催化剂脱硝性能提升.当活性组分分散程度达到最佳值时, 得到的催化剂的低温脱硝效率最好.
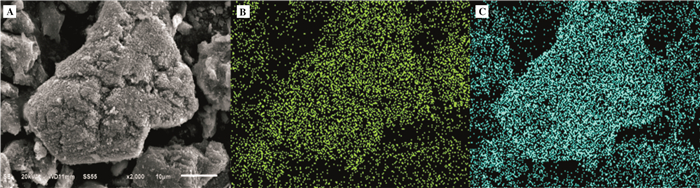
2.3.3 SEM分析为了探究催化剂颗粒表面形貌以及分析Mn、Fe元素在催化剂上的分散, 对制备的Mn-Fe/Al2O3催化剂样品进行了SEM测试, 并以X射线能谱(EDS)测定催化剂表面的元素分布, 发现Fe、Mn分布都比较均匀, 因此我们只对11Mn7Fe/Al2O3催化剂进行SEM分析.
图 5中A为11Mn7Fe/Al2O3催化剂样品的SEM图, B、C分别11Mn7Fe/Al2O3催化剂样品Fe、Mn的元素分布图.由图 5A可以看出, 11Mn7Fe/Al2O3催化剂表面较为粗糙, 表面分布着凹凸不平的微小结构.从图 5B、5C可以发现, 11Mn7Fe/Al2O3催化剂表面Fe、Mn元素分布比较均匀, 说明Fe、Mn的氧化物均匀地分布在催化剂表面, 这样有利于其获得较佳的低温脱硝性能.
|
图 5 11Mn7Fe/Al2O3催化剂的SEM及元素分布图 Figure 5 SEM and elemental distribution images of 11Mn7Fe/Al2O3 catalysts |
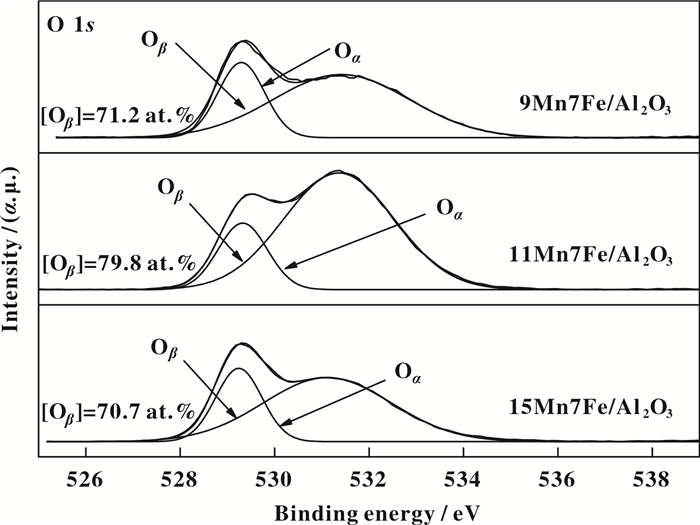
为了表明催化剂表面活性元素价态及比例对催化剂脱硝性能的影响, 我们对9Mn7Fe/Al2O3、11Mn7Fe/Al2O3和15Mn7Fe/Al2O3催化剂进行了XPS分析, 其中O 1s、Fe 2p和Mn 2p的图谱如图 6、7和8所示. 图 6为9Mn7Fe/Al2O3、11Mn7Fe/Al2O3和15Mn7Fe/Al2O3催化剂的O 1s图谱.分别对各催化剂图谱进行分峰拟合, 3种催化剂均可分为两个峰, 分别在529.3和531.4 eV左右.结合能位于529.6~530.1 eV归属于晶格氧, 标记为“Oα”; 结合能位于531.3~532.0 eV左右的属于表面化学吸附氧, 标记为“Oβ”[23].一般来说, 表面吸附氧Oβ的活性明显高于Oα[24-26].由图 6可知, 11Mn7Fe/Al2O3催化剂的表面化学吸附氧Oβ的含量为79.8%, 明显高于9Mn7Fe/Al2O3和15Mn7Fe/Al2O3催化剂, 因此11Mn7Fe/Al2O3催化剂表现出较高的低温脱硝活性.
|
图 6 O 1s轨道XPS能谱图 Figure 6 XPS spectra of O 1s |
|
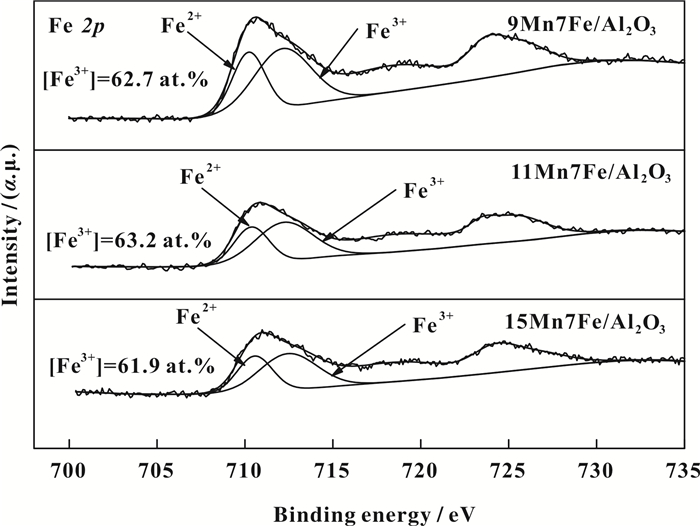
图 7 Fe 2p轨道XPS能谱图 Figure 7 XPS spectra of Fe 2p |
|
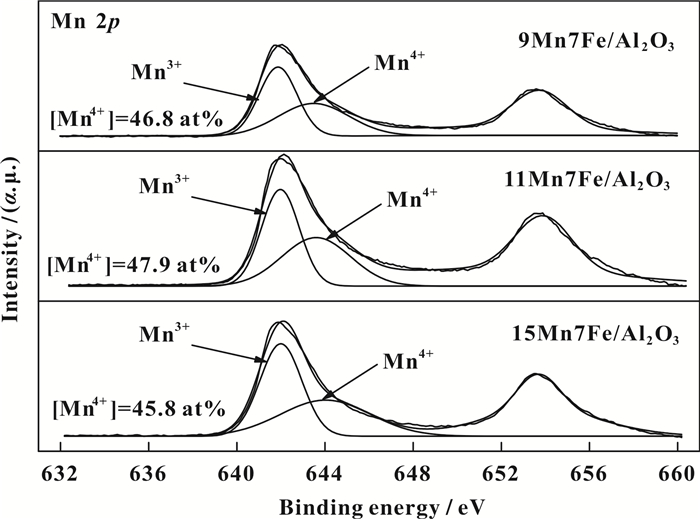
图 8 Mn 2p轨道XPS能谱图 Figure 8 XPS spectra of Mn 2p |
图 7为9Mn7Fe/Al2O3、11Mn7Fe/Al2O3和15Mn7Fe/ Al2O3催化剂的Fe 2p图谱.由图 7可知, 3种催化剂的Fe 2p能谱图分别在711和725 eV处出现两个峰, 对应于Fe 2p3/2和Fe 2p1/2.对Fe 2p3/2进行分峰拟合后得到3种催化剂两个峰的结合能分别位于710.4和712.2 eV左右, 对应于Fe2+和Fe3+[27-29]. 9Mn7Fe/Al2O3、11Mn7Fe/Al2O3、15Mn7Fe/ Al2O3催化剂中的Fe3+含量分别为62.7%、63.2%、61.9%, 11Mn7Fe/Al2O3催化剂的Fe3+含量相对于9Mn7Fe/Al2O3和15Mn7Fe/Al2O3催化剂较高.研究表明, Fe3+有利于催化剂活性的提高[30-32], 因此11Mn7Fe/Al2O3催化剂表现出较高低温脱硝性能.
图 8为9Mn7Fe/Al2O3、11Mn7Fe/Al2O3和15Mn7Fe/ Al2O3催化剂的Mn 2p图谱.对Mn 2p3/2图谱分峰拟合, 后得到3种催化剂两个峰的结合能分别位于642.0和643.8 eV左右, 对应于Mn3+和Mn4+[33-34], Mn主要以Mn3+和Mn4+的形式存在于催化剂表面. 9Mn7Fe/Al2O3、11Mn7Fe/Al2O3和15Mn7Fe/Al2O3催化剂中Mn4+/(Mn3++Mn4+)比例分别为46.8%、47.9%和45.8%.其中Mn4+可以促进NO氧化, 有助于SCR反应[35]; 同时Mn4+的氧化还原过程在低温SCR反应中也起着重要作用[36]. 11Mn7Fe/Al2O3催化剂Mn4+含量较9Mn7Fe/Al2O3和15Mn7Fe/Al2O3催化剂高, 这可能是9Mn7Fe/Al2O3和15Mn7Fe/Al2O3催化剂低SCR活性的另一个诱因.
2.3.5 NH3-TPD分析NH3的吸附和活化是控制催化活性的重要因素, 催化剂的表面酸度和酸位点数量在NH3低温SCR中起着重要的作用[22]. NH3的程序升温脱附测试可用于定性评估催化剂的表面酸度.因此我们对Al2O3、7Fe/Al2O3和11Mn7Fe/Al2O3催化剂进行了NH3-TPD研究, 图 9为各个催化剂的NH3-TPD图谱. NH3脱附峰面积能够反映催化剂表面的酸性位点数量, 而NH3脱附峰对应的温度能够说明催化剂表面的酸性强弱[37].由图 9可以看出, 各催化剂的NH3-TPD图谱具备相似的脱附曲线. NH3在50 ℃开始脱附, 并在95 ℃时达到脱附峰值, 随后在474 ℃又出现NH3的脱附峰.当Al2O3负载Fe之后, 低温段的脱附峰并没有发生变化, 而在高温区NH3脱附峰的峰面积明显增大, 而且脱附温度向高温偏移, 这说明Fe的添加使催化剂样品的表面酸性增强, 酸性位点增多.当在7Fe/Al2O3催化剂上添加Mn后, 可以明显的发现, 在301 ℃处出现新的NH3脱附峰, 并且高温处的脱附峰峰面积增大, 这表明Mn的添加使催化剂样品表面强性酸位点的酸性增强, 而且催化剂表面出现新的中强性酸位点, 有利于NH3的吸附与活化, 进而使得11Mn7Fe/Al2O3催化剂低温脱硝性能优于7Fe/Al2O3催化剂.
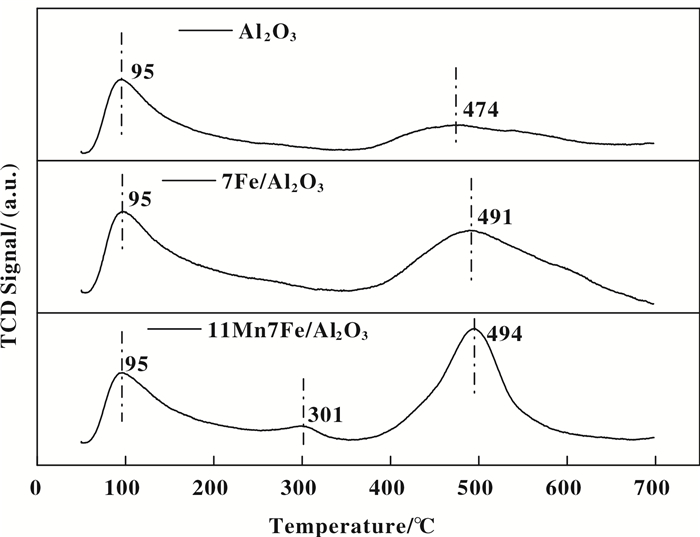
|
图 9 各催化剂的NH3-TPD图谱 Figure 9 NH3-TPD profiles of different catalysts |
为了探究金属氧化物的可还原性与催化剂脱硝性能之间的关联, 对Al2O3、7Fe/Al2O3和11Mn7Fe/Al2O3样品进行H2-TPR分析, 结果如图 10所示.
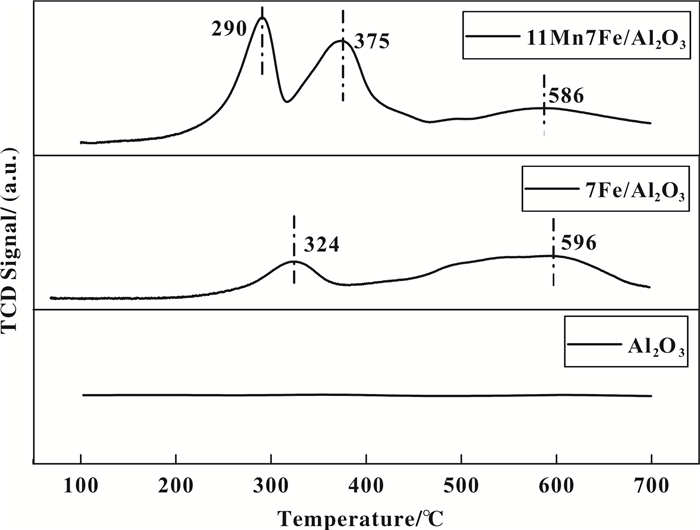
|
图 10 各催化剂的H2-TPR图谱 Figure 10 H2-TPR profiles of different catalysts |
由图 10可以看出, 纯的Al2O3催化剂样品一条直线, 没有出现还原峰. 7Fe/Al2O3催化剂出现两个还原峰, 分别在324和596 ℃.根据参考文献[38-41], 在324 ℃处的还原峰归因于Fe2O3还原到Fe3O4, 596 ℃处的还原峰对应Fe3O4到FeO的还原. 11Mn7Fe/Al2O3催化剂的H2-TPR图谱上出现3个还原峰, 290和375 ℃处的还原峰分别对应MnO2向Mn2O3(290 ℃)和Mn2O3向Mn3O4(375 ℃)还原峰[42].还原峰温度高低是催化剂还原能力的判断依据, 较低的还原峰温度拥有较强的还原能力.由图 10可以发现, 11Mn7Fe/Al2O3样品的还原峰温度(290 ℃)比7Fe/Al2O3样品还原峰温度(324 ℃)低, 说明3种催化剂样品的还原性按照以下顺序: 11Mn7Fe/Al2O3 > 7Fe/Al2O3 > Al2O3, 这与前面的SCR低温脱硝性能结果相符.
2.4 H2O和SO2对11Mn7Fe/Al2O3性能的影响为了研究H2O和SO2对11Mn7Fe/Al2O3催化剂低温脱硝性能的影响, 我们对其在220 ℃进行了抗硫抗水性能测试, 结果如图 11所示.从图 11可以发现, 在未通入H2O和SO2时, 11Mn7Fe/Al2O3催化剂的脱硝效率一直保持在83%左右.在120 min时, 在模拟烟气中通入5%(体积百分比) H2O, 催化剂的脱硝效率开始逐渐下降, 30 min后效率维持在75%左右.脱硝效率的下降可能是由于H2O和NH3分子在催化剂表面存在竞争吸附, 使得NH3的吸附量减少.当停止通入H2O后, 11Mn7Fe/Al2O3催化剂的脱硝效率开始恢复并保持83%左右.此时竞争吸附消失, 催化剂表面上提供NH3吸附的活性位点数量恢复, 所以当停止通H2O后, 催化剂的脱硝效率可以恢复.当模拟烟气中通入200 ppmSO2时, 11Mn7Fe/Al2O3催化剂的脱硝效率急剧下降, 160 min后保持稳定, 此时的NOx转化率只有50%左右.停止通SO2后, 催化剂的脱硝效率不发生变化.这可能是因为在SO2氧化成SO3后, 与反应产物H2O反应生硫酸.硫酸与烟气中的NH3形成硫酸铵或硫酸氢铵, 这些铵盐覆盖在催化剂表面的活性位点上, 从而抑制NH3吸附和氧化; 还有就是硫酸与催化剂反应生成金属硫酸盐, 使得催化剂活性组分的量减少, 进而降低脱硝效率.当烟气中同时通入5%(体积百分比)H2O和200 ppm SO2时, 催化剂的中毒更深, 稳定后的脱硝效率只有41%左右.停止通入H2O和SO2后, 11Mn7Fe/Al2O3催化剂的脱硝效率没有恢复.这可能因为硫酸铵或硫酸氢铵在220 ℃难以分解, 使得催化剂永久性失活.
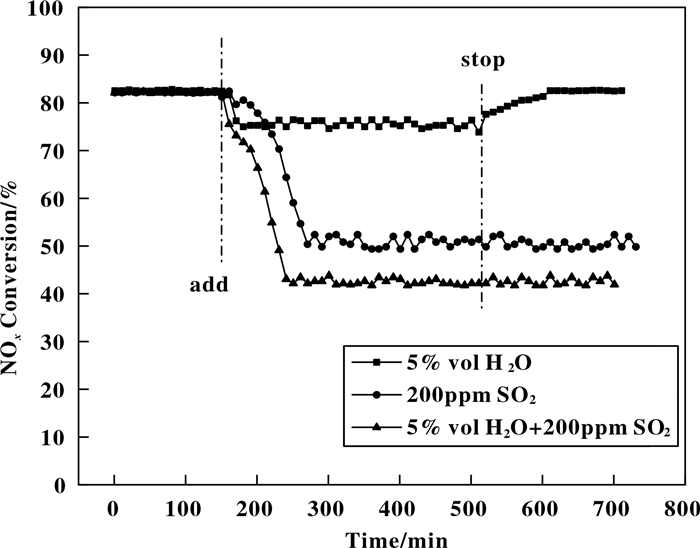
|
图 11 H2O和SO2对11Mn7Fe/Al2O3催化剂低温脱硝效率的影响 Figure 11 Effect of H2O on the NOx conversions of 11Mn7Fe/Al2O3 catalyst |
为了研究11Mn7Fe/Al2O3催化剂的稳定性能, 测试了11Mn7Fe/Al2O3催化剂在2000 min内220 ℃的脱硝效率, 结果如图 12所示.从图 12可以发现, 催化剂在前600 min一直稳定在84%, 而后开始呈下降趋势, 经过2000 min的测试, 催化剂的NOx脱除率还维持在80%, 说明11Mn7Fe/Al2O3催化剂能长时间保持较高的脱硝效率, 所以该催化剂具有较好的稳定性能.

|
图 12 在2000 min内11Mn7Fe/Al2O3催化剂NOx脱除率 Figure 12 NOx conversions of 9Mn/Al2O3 catalysts for 2000 min |
Fe的添加使Fe/Al2O3催化剂样品的表面酸性增强, 酸性位点增多, 从而提高了其低温SCR脱硝活性; Fe负载量为7%时, Fe/Al2O3催化剂的低温SCR脱硝效果较佳; 单独负载Fe时, 低温段的脱硝效率较低.添加Mn后, xMnFe/Al2O3催化剂低温脱硝性能得到一定的提高, 其中当Mn/Fe质量比为11:7时催化剂的低温脱硝效率最好.
3.2MnO2和Fe2O3在xMn7Fe/Al2O3催化剂中具有较强的相互作用, 影响活性组分微观晶体结构, 改善活性组分分散程度, 从而提高了催化剂的低温脱硝性能. Fe和Mn的添加对催化剂的比表面积以及表面微观结构影响不大.
3.3添加Mn后, 催化剂样品表面强性酸位点的酸性增强, 表面出现新的中强性酸位点, 从而低温催化活性提高. 11Mn7Fe/Al2O3催化剂表面吸附氧Oβ、Mn4+和Fe3+的数量相对于其他催化剂较多, 因此其脱硝效率高于其他催化剂的脱硝效率.
3.411Mn7Fe/Al2O3催化剂表现出良好的抗水性能, 但抗硫性能还需进一步改善.
| [1] | Abelson P H. Air pollution and acid rain[J]. Sci, 1985, 230(4726): 617–617. DOI:10.1126/science.230.4726.617 |
| [2] |
a. Taylor K. Nitric oxide catalysis in automotive exhaust systems[J]. Catal Rev, 2010, 35(4): 457-481. b. Jin Qi-jie(金奇杰), Sui Guo-rong(眭国荣), Liu Qing(刘青), et al. Compatibility optimization of Mn-Mo-W-Ox catalyst for selective catalytic reduction of NO by NH3(Mn-Mo-W-Ox脱硝催化剂活性组分的配伍优化)[J]. J Mol Catal(China)(分子催化), 2017, 31(2): 159-168. c. Zhao Meng-meng(赵梦梦), Chen Meng-yin(陈梦寅), Zhang Peng-ju(张鹏举), et al. Influence of SiO2 -doped V2O5-WO3/TiO2 catalysts by Co-precipitation method on SCR performance(共沉淀法掺杂SiO2对V2O5-WO3/TiO2催化剂SCR性能的影响)[J]. J Mol Catal(China)(分子催化), 2017, 31(3): 223-235. |
| [3] |
a. Granger P, Parvulescu V I. Catalytic NOx abatement systems for mobile sources: from three-way to lean burn after-treatment technologies[J]. Chem Rev, 2011, 111(5): 3155-3207. b. Zi Zhao-hui(訾朝辉), Zhu Bao-zhong(朱宝忠), Sun Yun-lan(孙运兰), et al. Low-temperature selective catalytic reduction of NOx with ammonia over MnOx/Al2O3 catalysts(MnOx/Al2O3催化剂低温SCR脱硝性能)[J]. J Mol Catal(China)(分子催化), 2018, 32(3): 249-260. c. Tang Nan(唐南), Huang Yan(黄妍), Li Yuan-yuan(李元元), et al. Low temperature selective cataly-tic reduction of NO with NH3 over Fe-Mn catalysts prepared by hydrothermal method(水热法制备铁锰催化剂脱硝性能及抗水抗硫性能研究)[J]. J Mol Catal(China)(分子催化), 2018, 32(3): 240-248. |
| [4] | Wang Z M, Lin Y S. Sol-gel synthesis of pure and copper oxide coatedmesoporous alumina granular particles[J]. J Catal, 1998, 174(1): 43–51. DOI:10.1006/jcat.1997.1913 |
| [5] | Buelna G, Lin Y S. Sol-gel-derived mesoporous γ-alumina granules[J]. Micro Mes Mater, 1999, 30(30): 359–369. |
| [6] | Zhang Li-feng(张李锋), Shi You(石悠), Zhao Bing-yuan(赵斌元), et al. Progress in research on γ-Alumina catalyst carrier(γ-Al2O3载体研究进展)[J]. Mater Rev(材料导报), 2007, 21(2): 67–71. DOI:10.3321/j.issn:1005-023X.2007.02.017 |
| [7] | Levin I, Brandon D. Metastable alumina polymorphs:crystal structures and transition sequences[J]. J Am Ceram Soc, 2005, 81(8): 1995–2012. DOI:10.1111/jace.1998.81.issue-8 |
| [8] | Fabrizioli P, Bürgi T, Baiker A. Environmental catalysis on iron oxide-silica aerogels:selective oxidation of NH3 and reduction of NO by NH3[J]. J Catal, 2002, 206(1): 143–154. DOI:10.1006/jcat.2001.3475 |
| [9] | Indovina V, Campa M C, Pepe F, et al. The catalytic activity of FeOx/ZrO2 and FeOx/sulphated-ZrO2 for the NO abatement with C3H6 in the presence of excess O2[J]. Appl Catal B:Environ, 2005, 60(1): 23–31. |
| [10] | Cao F, Su S, Xiang J, et al. The activity and mechanism study of Fe-Mn-Ce/γ-Al2O3 catalyst for low temperature selective catalytic reduction of NO with NH3[J]. Fuel, 2015, 139: 232–239. DOI:10.1016/j.fuel.2014.08.060 |
| [11] | Ramis G, Larrubia M A. An FT-IR study of the adsorption and oxidation of N-containing compounds over Fe2O3/Al2O3 SCR catalysts[J]. J Mol Catal A:Chem, 2004, 215(1): 161–167. |
| [12] | Roy S, Viswanath B, Hegde M S, et al. Low-temperature selective catalytic reduction of NO with NH3 over Ti0.9M0.1O2-δ[J]. J Phy Chem C, 2008, 112(15): 6002–6012. DOI:10.1021/jp7117086 |
| [13] | Yang S J, Wang C Z, Li J H, et al. Low temperature selective catalytic reduction of NO with NH3 over Mn-Fe spinel:Performance, mechanism and kinetic study[J]. Appl Catal B:Environ, 2011, 110(41): 71–80. |
| [14] | Sang M L, Hong S C. Promotional effect of vanadium on the selective catalytic oxidation of NH3 to N2 over Mn/V/TiO2 catalyst[J]. Appl Catal B:Environ, 2015, 163(163): 30–39. |
| [15] | Kapteijn F, Singoredjo L, Andreini A, et al. Activity and selectivity of pure manganese oxides in the selective catalytic reduction of nitric oxide with ammonia[J]. Cheminform, 1994, 3(2/3): 173–189. |
| [16] | Smirniotis P G, Sreekanth P M, Peña D A, et al. Manganese oxide catalysts supported on TiO2, Al2O3 and SiO2:A comparison for low-temperature SCR of NO with NH3[J]. Ind Engineer Chem Res, 2006, 45(19): 6436–6443. DOI:10.1021/ie060484t |
| [17] | Wang Xiao-bo(王晓波), Gui e-ting(归柯庭). Low-temperature selective catalytic reduction of NO with NH3 over iron based catalysts(铁基催化剂低温脱硝性能研究)[J]. J Engineer Therm(工程热物理学报), 2013, 34(9): 1671–1674. |
| [18] | Iwasaki M, Yamazaki K, Banno K, et al. Characterization of Fe/ZSM-5 DeNOx catalysts prepared by different methods:Relationships between active Fe sites and NH3-SCR performance[J]. J Catal, 2008, 260(2): 205–216. DOI:10.1016/j.jcat.2008.10.009 |
| [19] | Kim Y J, Kwon H J, Heo I, et al. Mn-Fe/ZSM5 as a low-temperature SCR catalyst to remove NOx from diesel engine exhaust[J]. Appl Catal B:Environ, 2012, 126(38): 9–21. |
| [20] | Gao Yan-jie(高彦杰). Preparation and properties of denitrification catalysts for low temperature selective catalytic reduction(南京理工大学硕士论文)[D]. 2009 |
| [21] | Wang Dong(王栋), Zhang Xin-li(张信莉), Peng Jian-sheng(彭建升), et al. Effects of calcination temperature on selective catalytic reduction of NOx over γ-Fe2O3 catalysts prepared with microwave assistance(煅烧温度对γ-Fe2O3催化剂结构及其脱硝活性的影响)[J]. Res Environ Sci(Res Environ Sci), 2015, 28(5): 808–815. |
| [22] | Wu Z B, Jiang B Q, Liu Y. Effect of transition metals addition on the catalyst of manganese/titania for low-temperature selective catalytic reduction of nitric oxide with ammonia[J]. Appl Catal B:Environ, 2008, 79(4): 347–355. DOI:10.1016/j.apcatb.2007.09.039 |
| [23] | Carja G, Kameshima Y, Okada K, et al. Mn-Ce/ZSM5 as a new superior catalyst for NO reduction with NH3[J]. Appl Catal B:Environ, 2007, 73(1/2): 60–64. |
| [24] | Zhang L, Zhang D S, Zhang S X, et al. Design of meso-TiO2@MnOx-CeOx/CNTs with a core-shell structure as De NOx catalysts:Promotion of activity, stability and SO2-tolerance[J]. Nanoscale, 2013, 5(20): 9821–9829. DOI:10.1039/c3nr03150k |
| [25] | Chen L, Li J H, Ge M F. Promotional effect of Ce-doped V2O5-WO3/TiO2 with low vanadium loadings for selective catalytic reduction of NOx by NH3[J]. J Phy Chem C, 2009, 113(50): 21177–21184. DOI:10.1021/jp907109e |
| [26] | Wu Z B, Jin R B, Liu Y, et al. Ceria modified MnOx/TiO2 as a superior catalyst for NO reduction with NH3 at low-temperature[J]. Catal Commun, 2008, 9(13): 2217–2220. DOI:10.1016/j.catcom.2008.05.001 |
| [27] | Roosendaal S J, Asselen B V, Elsenaar J W, et al. The oxidation state of Fe(100) after initial oxidation in O2[J]. Surf Sci, 1999, 442(3): 329–337. DOI:10.1016/S0039-6028(99)01006-7 |
| [28] | Zhang R R, Li Y H, Zhen T L. Ammonia selective catalytic reduction of NO over Fe/Cu-SSZ-13[J]. RSC Adv, 2014, 4(94): 52130–52139. DOI:10.1039/C4RA09290B |
| [29] | Allen G C, Curtis M T, Hooper A J, et al. X-ray photoelectron spectroscopy of iron-oxygen systems[J]. J Chem Soc Dalton Trans, 1974, 1974(14): 1525–1530. |
| [30] | Devadas M, Kr cher O, Elsener M, et al. Characterization and catalytic investigation of Fe-ZSM5 for urea-SCR[J]. Catal Today, 2007, 119(1/4): 137–144. |
| [31] | Delahay G, Valade D, Guzmán-Vargas A, et al. Selective catalytic reduction of nitric oxide with ammonia on Fe-ZSM-5 catalysts prepared by different methods[J]. Appl Catal B:Environ, 2005, 55(2): 149–155. DOI:10.1016/j.apcatb.2004.07.009 |
| [32] | Zhang D, Yang R T. NH3-SCR of NO over one-pot Cu-SAPO-34 catalyst:Performance enhancement by doping Fe and MnCe and insight into N2O formation[J]. Appl Catal A:Gen, 2017, 543: 247–256. DOI:10.1016/j.apcata.2017.06.021 |
| [33] | Fang C, Zhang D, Cai S X, et al. Low-temperature selective catalytic reduction of NO with NH3 over nanoflaky MnOx on carbon nanotubes in situ prepared via a chemical bath deposition route[J]. Nanoscale, 2013, 5(19): 9199–9207. DOI:10.1039/c3nr02631k |
| [34] | Wang F, Dai H X, Deng J G, et al. Manganese oxides with rod-, wire-, tube-, and flower-like morphologies:highly effective catalysts for the removal of toluene[J]. Environ Sci Technol, 2012, 46(7): 4034–4041. DOI:10.1021/es204038j |
| [35] | Liu F D, He H, Ding Y, et al. Effect of manganese substitution on the structure and activity of irontitanate catalyst for the selective catalytic reduction of NO with NH3[J]. Appl Catal B:Environ, 2009, 93(1): 3760–3769. |
| [36] | Thirupathi B, Smirniotis P G. Nickel-doped Mn/TiO2 as an efficient catalyst for the low-temperature SCR of NO with NH3:Catalytic evaluation and characterizations[J]. J Catal, 2012, 288(4): 74–83. |
| [37] | Huang Zeng-bing(黄增斌), Li Cui-qing(李翠清), Wang Zhen(王振), et al. Performance of Mn-Ce catalysts supported on different zeolites in the NH3-SCR of NOx(不同分子筛负载锰铈催化剂的低温NH3-SCR脱硝性能)[J]. J Fuel Chem Technol(燃料化学学报), 2016, 44(11): 1388–1393. DOI:10.3969/j.issn.0253-2409.2016.11.016 |
| [38] | Khan A, Smirniotis P G. Relationship between temperature-programmed reduction profile and activity of modified ferrite-based catalysts for WGS reaction[J]. J Mol Catal A-Chem, 2008, 280(1): 43–51. |
| [39] | Zhang Q L, Qiu C T, Xu H D, et al. Low-temperature selective catalytic reduction of NO with NH3 over monolith catalyst of MnOx/CeO2-ZrO2-Al2O3[J]. Catal Today, 2011, 175(1): 171–176. DOI:10.1016/j.cattod.2011.05.009 |
| [40] | Ettireddy P R, Ettireddy N, Mamedov S, et al. Surface characterization studies of TiO2 supported manganese oxide catalysts for low temperature SCR of NO with NH3[J]. Appl Catal B:Environ, 2007, 76(1): 123–134. |
| [41] | Liu F D, He H, Ding Y, et al. Effect of manganese substitution on the structure and activity of irontitanate catalyst for the selective catalytic reduction of NO with NH3[J]. Appl Catal B:Environ, 2009, 93(1): 3760–3769. |
| [42] | Fang D, Xie J L, Hu H, et al. Identification of MnOx species and Mn valence states in MnOx/TiO2 catalysts for low temperature SCR[J]. Chem Eng J, 2015, 271: 23–30. DOI:10.1016/j.cej.2015.02.072 |
 2018, Vol. 32
2018, Vol. 32


