低碳烯烃在石油化工领域扮演着重要角色, 可以用来生产各种化工产品如合成纤维、合成橡胶、合成塑料、合成树脂等.近年来通过催化脱氢制低碳烯烃, 由于反应过程所需温度较低, 产品选择性高, 因而受到越来越多的重视[1-2].
烷烃直接催化脱氢反应主要使用铂系催化剂, 其反应活性较强, 但是不稳定、易失活, 产物选择性不佳, 副反应较多.为提高Pt催化剂的选择性和稳定性, 通常会向催化剂中加入一种或多种助剂[2]. Sn被认为是目前使用最为广泛的Pt基催化烷烃脱氢的助剂. Sn的加入能够阻碍副反应的发生, 增强活性金属颗粒抗烧结能力, 增强产物的选择性与稳定性, 使得烷烃脱氢活性大幅度提高.目前烷烃脱氢反应体系的研究主要在催化剂助剂、载体开发和催化剂制备方法上[3-6].
铂系催化剂烷烃脱氢性能除了受助剂影响外, 同样受到载体的影响.通常烷烃脱氢反应的载体必须拥有强的热稳定性, 合适的酸碱性, 较大的比表面积和均匀的孔径分布[2].焙烧后的镁铝水滑石是一种两性氧化物, 具有温和的酸碱性, 在高温下具有强的热稳定性, 同时由于载体表面Al3+的存在, 能有效的分散活性金属颗粒, 因此作为脱氢反应的催化剂载体具有显著优势, 受到越来越多研究者的青睐[7-8]. Akporiaye等[9]报道利用浸渍法将Pt和Sn负载到焙烧的水滑石Mg(Al)O载体上, 发现PtSn/Mg(Al)O催化剂比传统的PtSn/Al2O3在丙烷脱氢反应上表现出好的活性和选择性. Xia等[10]还发现在合成镁铝水滑石载体时, Mg/Al的摩尔比, 和合成过程的pH对丙烷脱氢的活性具有影响.作者发现当Mg/Al=4时, 催化剂具有纳米片状结构、最大的比表面积、最小的金属颗粒尺寸、最好的Pt分散度和合适的酸碱性. PtIn/Mg(Al)O-4在丙烷脱氢反应里拥有最高的丙烷转化率和丙烯选择性.而共沉淀的pH值能够影响催化剂的结晶相、比表面积、表观形貌、表面酸碱分布、金属相还原性质、表面化学价、金属颗粒分布和积碳形成, 使得pH为8时, 表现为最佳的催化性能[11]. Alexis等[12-15]发现, 在镁铝水滑石载体中掺入Ga或者In取代部分Al离子焙烧后的水滑石载体表现出比没有掺入时更好的催化活性和烯烃选择性.研究表明部分的Ga3+或者In3+被还原, 与Pt之间形成合金, 起到助剂的作用.
我们以镁铝水滑石作为载体, 利用水滑石层间阴离子的可交换性, 负载活性金属铂和锡用于丙烷脱氢反应, 考察了水滑石载体, 反应原料气和反应温度对丙烷脱氢的活性的影响.
1 实验部分 1.1 催化剂的载体的制备水滑石采用共沉淀法制备, 具体步骤如下:按Mg/Al=2, Ga含量(重量百分比)0、1%、2%、5%, 称取10.0 g Mg(NO3)2·6H2O、7.76 g Al(NO3)3·9H2O和一定量Ga(NO3)3·9H2O溶于100 mL超纯水中;称取4.38 g Na2CO3和3.82 g NaOH溶于100 mL超纯水;将配置的溶液用恒流泵缓慢滴加在第3个烧杯中, 烧杯中放置100 mL超纯水, 同时不断搅拌, 调节pH为10, 且滴加过程中维持为10, 待盐溶液滴加完毕.将滴加完毕的溶液转移至烧瓶中, 80 ℃下搅拌12 h, 反应完毕待冷却抽滤, 用蒸馏水洗涤干净, 烘干, 得到水滑石载体, 分别命名为Mg(Al)O、Mg(Ga)(Al)O-1%、Mg(Ga)(Al)O-2%、Mg(Ga)(Al)O-5%, 分别代表Ga含量(重量百分比)为0、1%、2%、5%.
1.2 PtSn-Mg(Ga)(Al)O催化剂的制备称取0.5 g K2PtCl6固体, 溶解于100 mL超纯水, 配制成K2PtCl6溶液;称取0.1 g Na2SnO3固体, 溶解于100 mL超纯水中, 容量瓶定容, 配制成NaSnO3溶液. PtSn金属助剂利用离子交换法进行制备, 将配置的1.65 mL K2PtCl6和2.7 mL Na2SnO3溶液与1.0 g水滑石载体加入100 mL超纯水中, Pt含量(重量百分比)0.5%, Sn/Pt比为0.5, 之后将混合液在70 ℃恒温油浴环境下高速搅拌24 h, 使混合液中的PtCl62-和SnO32-与水滑石层间阴离子充分交换.反应结束后将混合液冷却至室温过滤, 并用去离子水洗涤干净, 在烘箱100 ℃下干燥12 h.将干燥后的样品, 在氢气氛围(H2/Ar=1/19)下600 ℃还原3 h, 样品分别命名PtSn-Mg(Al)O、PtSn-Mg(Ga)(Al)O-1%、PtSn-Mg(Ga)(Al)O-2%、PtSn-Mg(Ga)(Al)O-5%.
1.3 丙烷脱氢反应催化剂性能评价丙烷催化脱氢反应装置为固定床流动反应装置, 将石英管置于加热炉内, 石英管直径10 mm, 催化剂位于炉内恒温段.催化剂用量为100 mg, 利用Alicat质量流量计控制原料气流量, 丙烷催化脱氢反应原料气为C3H8: N2=20:80混合气, 丙烷气体(C3H8/N2)流量为40 mL/min, 反应过程加入氢气为纯氢气, 反应后产物经气相色谱Agilent 7890在线分析, 该色谱包含有3个样品定量环、2个六通阀以及2个十通阀, 其中一个定量环中气体经色谱柱分离后进入到FID检测器中, 用于检测C1-C5气体, 另外两个定量环中气体经色谱柱分离后进入到两个TCD检测器中, 其中一个TCD检测器用于检测H2, 另一个TCD检测器用于检测N2、CO、CO2等气体.
丙烷脱氢催化剂性能计算如以下公式:
| $ 丙烷转化率 = \frac{{{{\rm{C}}_{\rm{3}}}{{\rm{H}}_{{\rm{8in}}}} - {{\rm{C}}_{\rm{3}}}{{\rm{H}}_{{\rm{8out}}}}}}{{{{\rm{C}}_{\rm{3}}}{{\rm{H}}_{{\rm{8in}}}}}} \times 100\% $ |
| $ 丙烷选择性 = \frac{{{{\rm{C}}_{\rm{3}}}{{\rm{H}}_{{\rm{6out}}}}}}{{{{\rm{C}}_{\rm{3}}}{{\rm{H}}_{{\rm{8in}}}} - {{\rm{C}}_{\rm{3}}}{{\rm{H}}_{{\rm{8out}}}}}} \times 100\% $ |
其中, C3H8 in和C3H8 out分别指入口处和出口处丙烷的流量, C3H6 out指出口处丙烯的流量.
1.4 催化剂表征手段XRD(X-ray diffraction)采用荷兰X’ Pert Pro MPD(PW 3040/60)型, 以Cu Kα(λ=0.154)为辐射源, 管电压为40 kV, 管电流为40 mA, 5 °~80 °扫描, 扫描速率为2 (°)/min, 扫描步长0.02 °.
采用日本JEM-2100F型号透射电子显微镜(TEM)观测催化剂形貌、PtSn在载体上的分布及粒径, 加速电压为200 kV.催化剂经过研磨后分散在无水乙醇中, 然后分散在铜网上, 进行拍摄. X射线光电子能谱(XPS)用于催化剂表面组分分析, 采用Escalab 250Xi型光电子能谱仪测得, 激发源为Al Kα, 样品催化剂的测试温度为5~10 nm, 靶电压为15 kV, 靶电流为10 mA, 真空室气压小于2×10-6 Pa.测试得到结果利用XPS Peak软件进行分峰拟合.
2 结果与讨论 2.1 Mg(Al)O作为载体的丙烷脱氢反应研究图 1为Mg(Al)O水滑石载体在焙烧前和负载PtSn焙烧后的XRD图谱.从图 1可以看出Mg(Al)O水滑石显现出了水滑石的典型特征峰(PDF#035-0964), 衍射峰峰型窄而尖锐, 说明样品生长的结构有序程度较高.水滑石Mg(Al)O在11.7°处的(003)晶面间距d003为0.75 nm.晶面间距d003主要与水滑石层间阴离子种类、数目、排列形式和层板与阴离子之间的相互作用力有关.在60.9°处(110)晶面间距d110为0.15 nm, d110反映的是金属阳离子平均半径和层板上原子排列密度, 受合成载体金属的比例和种类影响.
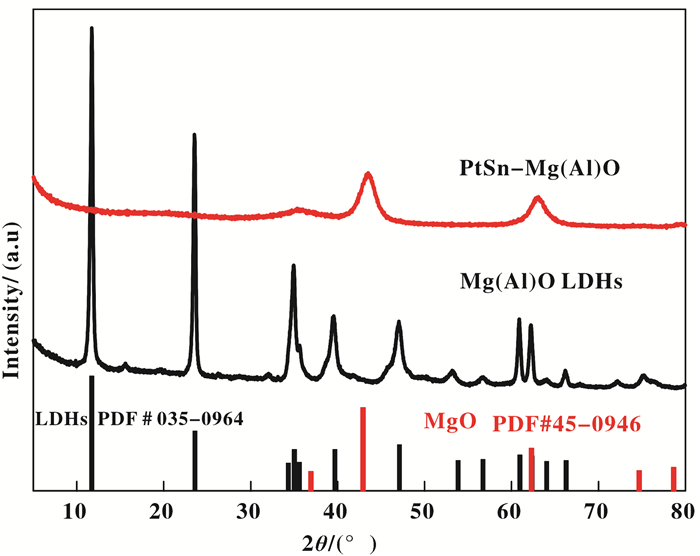
|
图 1 Mg(Al)O水滑石载体在焙烧前和负载PtSn焙烧后的XRD图谱 Figure 1 XRD patterns of Mg(Al)O LDHs and the calcined PtSn-Mg(Al)O catalyst |
当水滑石负载PtSn, 焙烧后, 如图所示, 焙烧后的水滑石特征衍射峰全部消失, 这是由于水滑石在高温条件下会脱除结合水和层板间的阴离子, 规整的层状结构坍塌, 从二维的层状结构转变成三维结构, 形成混合金属氧化物的结构.焙烧后样品在35.0°、43.5°和62.9°处出现3个峰, 43.5°和62.9°处出现两个峰, 表现为方镁石MgO的(200)和(220)结晶相特征峰(PDF#45-0946), 而在35.0°处出现一个峰, 说明这个峰并不是MgO的晶相峰, MgO的(111)特征峰在36.9°处, 经分析可能是羟镁铝石[Mg6Al2(OH)18·4H2O]的特征峰.此外, 负载Pt和Sn后, XRD并没有检测到Pt和Sn物种的衍射峰, 可能是由于颗粒尺寸较小或者浓度较低.
图 2为催化剂PtSn-Mg(Al)O丙烷脱氢反应随时间变化的丙烷转化率和丙烯选择性.从图 2(a)中可以看出, 当只有丙烷气体通过时, 反应初始的丙烷转化率为36.6%, 随着反应时间延长, 丙烷转化率逐渐下降, 初始阶段下降特别快, 到40 min以后趋于平缓, 最终反应2 h, 丙烷转化率维持在6%左右.当在原料气中加入H2时, 丙烷脱氢初始转化率为43.8%, 随着反应时间延长, 催化活性能维持在一个较稳定的阶段, 反应2 h后, 丙烷转化率为29.1%. H2的加入能够抑制积碳的形成, 从而使得反应的脱氢性能得到大幅度提高.
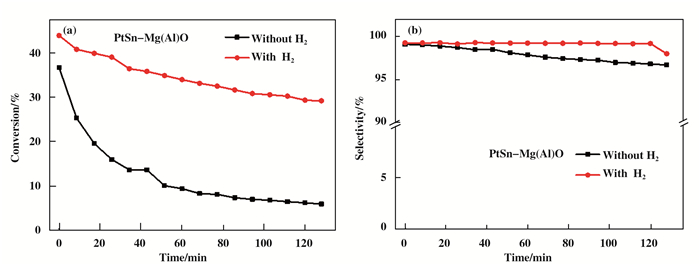
|
图 2 Mg(Al)O作为载体的在氢气丙烷气氛下和丙烷直接气氛下直接脱氢反应的(a)丙烷转化率和(b)丙烯选性随时间的变化 Figure 2 (a) Propane conversion and (b) propylene selectivity of propane dehydrogenation reaction for Mg(Al)O with H2 and without H2 atmosphere Reaction condition: mcat=100 mg, T=550 ℃, H2/C3H8= 0 and 0.5:1, WHSV=9.43 h-1 |
从图 2(b)中可以看出, PtSn-Mg(Al)O催化剂在原料气中加氢气或者不加氢气, 反应过程中均具有较高的选择性, 初始的选择性达99%以上, 反应一段时间后, 选择性略有下降, 原料气中加入H2, 丙烯产物选择性略高于没有加入H2的.实验结果表明, 说明H2的加入对催化剂选择性有所提升.
2.2 Mg(Ga)(Al)O作为载体的丙烷脱氢反应研究如图 3(a)所示为水滑石Mg(Ga)(Al)O的XRD谱图.从图 3(a)中可以看出Mg(Al)O水滑石显现出了水滑石的典型特征峰(PDF#035-0964), 当掺杂不同含量的Ga之后形成的Mg(Ga)(Al)O水滑石, 结构晶相单一, 仍然呈现镁铝水滑石的典型特征峰.如表 1所示, 一系列不同Ga含量的Mg(Ga)(Al)O水滑石在11.7°处的(003)晶面间距d003约为0.76 nm.在60.9°处(110)晶面间距d110约为0.15 nm, d003和d110的参数并没有随Ga含量的改变而发生变化, 说明少量的Ga的加入并没有影响镁铝水滑石的主体结构, 少量Ga的掺入只是取代了部分Al的位置, 并不影响整体水滑石结构.

|
图 3 不同Ga含量的Mg(Ga)(Al)O水滑石载体在(a)焙烧前和(b)负载PtSn焙烧后的XRD图谱 Figure 3 XRD patterns of Mg(Ga)(Al)O LDHs and the calcined PtSn-Mg(Ga)(Al)O catalyst |
| 表 1 不同Ga含量的Mg(Ga)(Al)O水滑石载体的结构参数 Table 1 The structural parameters of Mg(Ga)(Al)O LDHs with different Ga contents |
图 3(b)为Mg(Ga)(Al)O水滑石在负载PtSn助剂经H2还原后的XRD图谱, 从图中可以看出焙烧后镁铝水滑石特征衍射峰全部消失, 所有样品都在43.5°和62.9°处出现两个峰, 表现为方镁石MgO的(200)和(220)结晶相, MgO的(111)特征峰在36.9°处, 而焙烧后的样品在35.0°处出现了一个峰, 说明这个峰并不是MgO的晶相峰, 经分析可能是羟镁铝石[Mg6Al2(OH)18·4H2O]的特征峰. Mg(Al)O水滑石在适当的温度焙烧下, 焙烧产物是Al离子融入晶格的MgO固溶体结构.当温度焙烧高达1000 ℃时, 焙烧产物是结晶较好的MgO和尖晶石MgAl2O4混合物[16].随后有人发现, 在合成水滑石时, 加入部分Ga3+时, 能形成三元水滑石Mg(Ga)(Al)O, 三元水滑石中Ga是取代部分Al3+, 但是掺杂的Ga含量较低, 从XRD结构上, 仍然显现出典型的Mg(Al)O水滑石结构, 说明在形成水滑石结构过程中, Ga的掺入并不影响水滑石结构.所以焙烧后产物也同样显现出MgO结构, 即Ga离子和Al离子以原子态形式融入MgO形成固溶体氧化物[12-13, 17].因此, 不同含量Mg(Ga)(Al)O水滑石在负载PtSn后的XRD图谱基本一致, 说明Ga的加入并没有改变焙烧后样品的晶型结构, 主要是由于Al和Ga是在原子级别上取代Mg, 高度分散在载体上, 整体仍表现为MgO的结构.
随后将不同Ga含量的Mg(Ga)(Al)O负载PtSn后作用于丙烷脱氢反应, 所有反应均是在H2和丙烷共存的条件下进行的.如图 4所示, 丙烷脱氢反应随时间变化的丙烷转化率和丙烯选择性.从图中可以看出, 所有的催化剂在开始阶段都有一个逐渐稳定的过程, 当Ga含量(重量百分比)为0、1%、2%和5%时, 丙烷转化率的高低顺序依次为PtSn-Mg(Ga)(Al)O-1% > PtSn-Mg(Al)O > PtSn-Mg(Ga)(Al)O-2% > PtSn-Mg(Ga)(Al)O-5%.催化剂PtSn-Mg(Ga)(Al)O-1%具有最优的丙烷脱氢活性, 反应初始时, 丙烷转化率为46.5%, 反应2 h后, 丙烷转化率仍有37.5%.对于PtSn-Mg(Al)O, 丙烷脱氢初始转化率为43.8%, 随着反应时间延长, 催化活性能维持在一个较稳定的阶段, 反应2 h后, 丙烷转化率为29.1%.对于PtSn-Mg(Ga)(Al)O-2%, 丙烷脱氢反应初始转化率为27.0%, 整个反应过程中, 丙烷转化率几乎没有变化, 始终维持在27.0%左右.对于PtSn-Mg(Ga)(Al)O-5%, 丙烷脱氢反应初始转化率为25.7%, 随着反应进行, 转化率略有下降, 反应到2 h后, 丙烷脱氢反应转化率约为21.9%.实验结果表明, 随着Ga的加入, 能够有效促进丙烷脱氢反应, 当Ga含量继续增加时, 丙烷转化率反而下降. 图 4(b)中所示, 所有催化剂在整个反应过程中均具有较高的选择性, 均达到98%以上, 说明Ga的加入对催化剂选择性没有太大影响.实验结果表明, 催化剂PtSn-Mg(Ga)(Al)O丙烷脱氢反应性能明显受到催化剂载体Ga含量的影响.
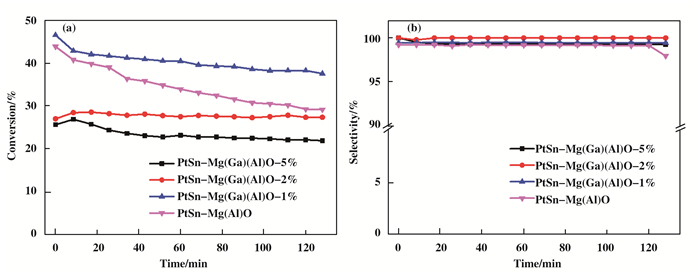
|
图 4 不同Ga含量的Mg(Ga)(Al)O作为载体的丙烷直接脱氢反应的(a)丙烷转化率和(b)丙烯选择性 Figure 4 (a) Propane conversion and (b) propylene selectivity of propane dehydrogenation reaction for Mg(Ga)(Al)O with different Ga contents Reaction condition: mcat=100 mg, T=550 ℃, H2/C3H8= 0.5:1, WHSV=9.43 h-1 |
图 2中对PtSn-Mg(Al)O的丙烷脱氢活性进行研究, 发现原料气中H2的加入能够抑制积碳的形成, 从而抑制催化剂的失活使得反应的脱氢性能得到大幅度提高.因此通过改变原料气中H2和C3H8的摩尔比, 进一步探究氢气的加入对PtSn-Mg(Ga)(Al)O-1%催化剂催化丙烷脱氢性能的影响.实验过程中H2/C3H8的摩尔比分别为0:1, 0.25:1, 0.5:1, 0.75:1.从图 5(a)中可以看出, H2/C3H8的摩尔比对PtSn-Mg(Ga)(Al)O-1%催化剂催化丙烷脱氢性能有明显的影响.在未添加H2的情况下, 即H2/C3H8的摩尔比为0:1时, 催化剂的活性在2 h迅速从46.6%下降至14.1%.而随着H2含量的不断升高, 当H2/C3H8摩尔比为0.25:1时, 丙烷脱氢转化率从45.1%下降到30%.随着H2/C3H8的摩尔比0.5:1时, 催化剂的反应活性维持在最佳水平, 初始转化率为46.5%左右, 反应2 h后, 转化率依然有37.6%.但是此后随着H2/C3H8摩尔比继续增大(0.75:1), 催化剂的反应活性不断降低, 初始转化率为39.7%, 反应2 h后, 转化率维持在32.0%.实验结果表明H2的加入能抑制烷烃脱氢过程中积碳前驱体的形成, 当加入氢气的含量较低时, 能明显抑制积碳的生成, 从而抑制催化剂的失活, 但是当氢气的含量进一步增加时, 氢气的加入会使脱氢反应向反方向进行, 且氢气的加入会使氢气吸附在催化剂上的Pt活性位点上, 从而使得转化率不断降低.
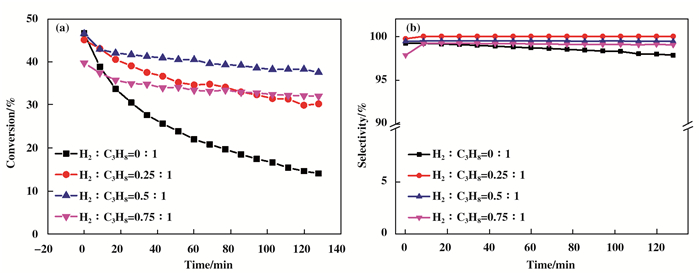
|
图 5 不同氢气丙烷比例下的丙烷直接脱氢反应的(a)丙烷转化率和(b)丙烯选择性 Figure 5 (a) Propane conversion and (b) propylene selectivity of propane dehydrogenation reaction for Mg(Ga)(Al)O with different molar ratio of H2 and C3H8 Reaction condition: mcat=100 mg, T=550 ℃, WHSV=9.43 h-1 |
从图 5(b)给出了H2/C3H8的摩尔比对PtSn-Mg(Ga)(Al)O-1%催化剂催化丙烷脱氢丙烯选择性的影响.氢气的加入后丙烯的选择性明显优于不加入氢气的. H2/C3H8摩尔比改变时, 丙烯的选择性均大于98%, 并无明显影响.
2.4 温度对PtSn-Mg(Ga)(Al)O-1%性能影响烷烃脱氢是一个吸热反应, 温度对烷烃脱氢反应性能具有较大影响.因此考查了反应温度对催化剂PtSn-Mg(Ga)(Al)O丙烷脱氢性能的影响, 结果如图 6所示.由图可知, 结果显示600 ℃反应温度下催化剂丙烷转化率最高, 初始转化率为52.5%, 反应2 h后, 转化率仍然有49.0%.当温度为550 ℃时, 初始转化率为46.5%, 反应2 h后, 转化率为37.6 %.当温度为500 ℃时, 转化率最低, 初始转化率31.2%, 反应2 h后, 转化率依然维持在29.9%.从结果可知, 丙烷转化率随反应温度的增加而增大.但是温度越高, 所需要的能耗越大.同时温度升高使得反应过程中活化能减小, 使得脱氢反应进一步进行, 导致副反应的增加及形成积碳.从图 6(b)中所示, 600 ℃时丙烯的选择性低于550 ℃, 这是由于在高温条件下, 更容易导致C—C键的断裂, 从而生成CH4副产物, 导致丙烯的选择性略有降低.因此综合考虑能耗, 丙烷转化率和丙烯选择性, 选择了550 ℃作为相对合适的反应温度.
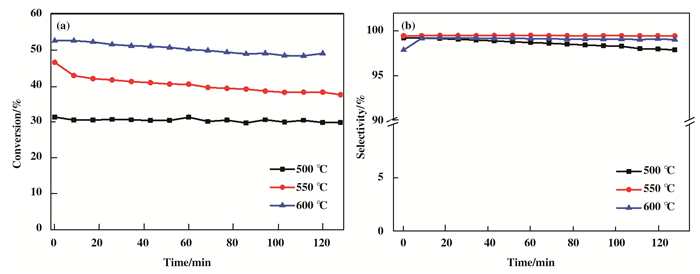
|
图 6 温度对丙烷直接脱氢反应(a)丙烷转化率和(b)丙烯选择性的影响 Figure 6 (a)Propane conversion and (b) propylene selectivity of propane dehydrogenation reaction for Mg(Ga)(Al)O in the different reaction temperature Reaction condition: mcat=100 mg, H2/C3H8= 0.5:1, WHSV=9.43 h-1 |
上述实验结果表明, 当Mg(Ga)(Al)O水滑石为载体, 且Ga的含量为1%时, 丙烷脱氢反应最有最好的性能.当在原料气中混入H2 , 当H2/C3H8的摩尔比0.5:1时, 丙烷脱氢反应最有最好的性能, 结果如图 7所示.当H2/C3H8摩尔比为0:1时, PtSn-Mg(Ga)(Al)O-1%的丙烷平均转化率为24.1%, PtSn-Mg(Al)O的丙烷平均转化率为12.4%, 相差1.9倍左右; 当H2/C3H8摩尔比为0.5:1时, PtSn-Mg(Ga)(Al)O-1%的丙烷平均转化率为40.3%, PtSn-Mg(Al)O的丙烷平均转化率34.5%, 相差1.2倍左右.结果说明, 由于载体中Ga的加入, 能够提高丙烷脱氢的转化率; 同时从图 7(b)中可得出, 由于Ga的加入, 生成丙烯的选择性有一定的提高.
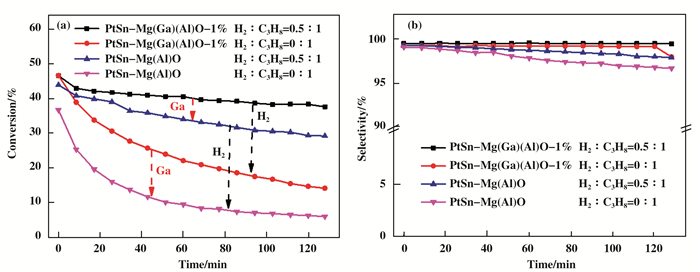
|
图 7 掺Ga的水滑石载体和原料气中混入H2对丙烷脱氢反应的(a)丙烷转化率和(b)丙烯选择性的影响 Figure 7 (a) Propane conversion and (b) propylene selectivity of propane dehydrogenation reaction for Mg(Al)O and Mg(Ga)(Al)O hydrotalcites as supports and with different molar ratio of H2 and C3H8 Reaction condition: mcat=100 mg, T=550 ℃, WHSV=9.43 h-1 |
当以Mg(Al)O为载体时, 在原料其中混入H2, H2/C3H8摩尔比为0.5:1相对于H2/C3H8摩尔比为0:1, 丙烷的平均转化率由12.4%提高到了34.5%, 大幅度提高, 约2.8倍; 且从从图 7(b)中可看出选择性也略有提高.当以Mg(Ga)(Al)O-1%为载体时, 在原料其中混入H2, H2/C3H8摩尔比为0.5:1相对于H2/C3H8摩尔比为0:1, 丙烷的平均转化率由24.1%提高到了40.3%, 约提高了1.7倍.而对于含Ga的载体, 改变原料气选择性略有提高, 但不明显(图 7(b)).
H2的加入对丙烷脱氢反应的活性和选择性影响, 随着H2比例增加, 活性和选择性达到一个最大值, 但是随着H2比例继续增加, 又有所下降.目前对于Pt基催化剂上丙烷无氧脱氢反应机理主要有两种认识[18]. (1)Pt为烷烃脱氢的活性中心, 其它添加剂仅起助剂的作用.铂催化剂上的活性结构可分为两类, 即多铂原子组成的铂簇团和孤立的单金属原子中心.后者可能是位于晶粒边、角和棱上的孤立原子, 也可能是被非活性金属如Sn、In等分割包围的孤立原子. Biloen和Kogan [19-20]的研究指出丙烷脱氢的活性位是单个的铂原子, 脱氢反应的决速步骤是β-H的解离.首先C—H键断裂, 发生解离吸附; 其次, 第二个C—H断裂产生一个 π键; 最后是烯烃发生脱附. (2)Pt起反溢流氢的作用.杨维慎等[21]认为在Pt-Sn/Al2O3上丙烷脱氢以不同于单铂催化剂的机理进行, 催化剂中金属铂与氧化态锡组分间存在协同催化作用.即丙烷首先在氧化态锡中心上活化形成中间物RI, 随后金属铂中心通过反溢流过程从反应中间物RI上移去H2而生成丙烯及氧化态锡中心复原, 从而使催化脱氢过程得以循环进行.
对于在烷烃脱氢反应中加入H2, 促进反应进行, 抑制催化剂失活, Bell研究小组以Pt为烷烃脱氢活性中心, Sn起助剂作用, 反应主要分为三步, 首先C—H键断裂, 发生解离吸附; 其次, 第二个C—H断裂产生一个π键; 最后是烯烃发生脱附.对于H2的作用, 作者认为在低H2分压下, 催化剂表面的吸附H原子增加能够使吸附在烷烃物种上的氢原子加速脱附, 从而加速了烯烃的生成.在高的H2分压下, 新的烷烃物种的氢化反应变得更加显著, 从而导致烷烃的重整, 和烯烃生成反应速率的下降.随着反应的进行, 生成烯烃产物变逐渐达到一个平衡值[12, 22].
2.6 PtSn-Mg(Ga)(Al)O-1%丙烷脱氢长寿命实验对催化剂PtSn-Mg(Ga)(Al)O-1%进行了丙烷脱氢长寿命的稳定性实验, 图 8为其在40 h内的丙烷脱氢反应中的选择性和稳定性.反应初始丙烷转化率为46.6%, 反应40 h后下降至23.5%, 下降率分别为49.5%.反应过程中初始选择性为99.0%, 反应40 h后, 丙烯选择性为96.7%, 整个反应过程中丙烯选择性略呈下降趋势, 但仍表现出较高的选择性.
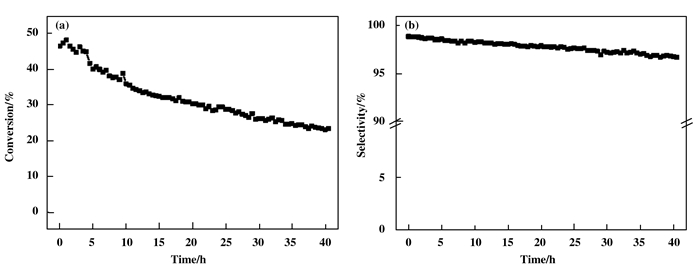
|
图 8 PtSn-Mg(Ga)(Al)O-1%丙烷脱氢反应长寿命实验的(a)丙烷转化率和(b)丙烯选择性 Figure 8 (a) Propane conversion and (b) propylene selectivity of propane dehydrogenation reaction for PtSn-Mg(Ga)(Al)O-1% catalysts in stability tests Reaction condition: mcat=100 mg, T=550 ℃, H2/C3H8= 0.5:1, WHSV=9.43 h-1 |
烷烃脱氢反应中催化剂失活主要由两种原因造成, 一种是积碳原因引起, 另外一种就是催化剂上的活性金属团聚长大.为了证明催化剂失活是由于积碳产生, 我们做了烷烃脱氢反应的循环再生反应性能考察, 如图 9所示为催化剂PtSn-Mg(Ga)(Al)O-1%的循环再生实验丙烷转化率和丙烯选择性.从图中看出, 将催化剂在空气中焙烧后, 循环反应中催化剂丙烷烷转化率和丙烯选择性均没有发生明显变化.因此我们认为引起催化剂失活的主要原因就是催化剂表面积碳而不是催化剂金属颗粒烧结.积碳可以通过氧化完全去除, 催化剂反应活性可以通过催化剂再生完全恢复.
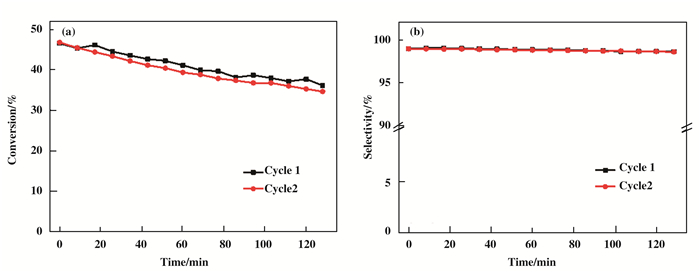
|
图 9 PtSn-Mg(Ga)(Al)O-1%丙烷脱氢反应循环再生实验的(a)丙烷转化率和(b)丙烯选择性 Figure 9 (a) Propane conversion and (b) propylene selectivity of propane dehydrogenation reaction for PtSn-Mg(Ga)(Al)O-1% catalysts in reaction-regeneration cycles Reaction condition: mcat=100 mg, T=550 ℃, H2/C3H8= 0.5:1, WHSV=9.43 h-1 |
图 10为催化剂PtSn-Mg(Ga)(Al)O-1%的TEM形貌图以及其表面金属颗粒粒径分布.催化剂PtSn-Mg(Ga)(Al)O-1%经过高温焙烧, 仍能观察到水滑石前驱体形成的片状结构, 且焙烧后载体呈现出孔状结构(图 10(a)), 同时在图 10(b)放大的TEM图中可以看到PtSn金属颗粒均匀分散在上载体上, 金属颗粒的平均粒径为2.04±0.4 nm.
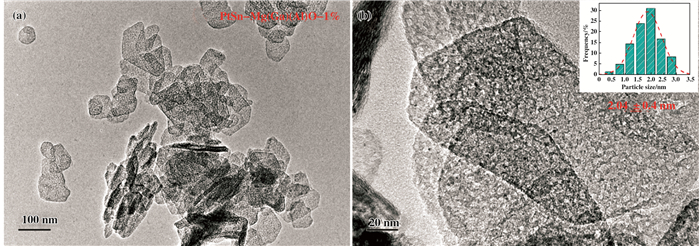
|
图 10 PtSn-Mg(Ga)(Al)O-1%的TEM表征以及表面金属颗粒粒径分析 Figure 10 TEM images and the corresponding particle size distributions of PtSn-Mg(Ga)(Al)O-1% catalyst |
图 11为催化剂PtSn-Mg(Ga)(Al)O-1%的Pt 4f和Sn 3d XPS谱图.如图 11(a)所示, Al的2p峰在74.3 eV, Pt的4f峰在71.2 eV, 表明催化剂经H2还原后, 主要是以单质Pt的形式存在[23].采用高斯拟合法进行多峰拟合, Sn 3d XPS谱图如图 11(b)所示, 在484.8 eV处代表还原态零价Sn的峰, 486.2和493.9 eV代表Sn的二价氧化态的峰, 在487.5和495.3 eV处的峰代表 4价氧化态的锡.实验结果表明, 表明催化剂经H2还原后, Sn主要以还原态和氧化态共存的形式存在[17, 24].
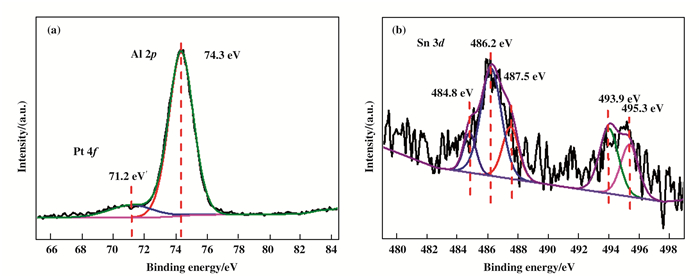
|
图 11 PtSn-Mg(Ga)(Al)O-1%催化剂的Pt 4f和Sn 3d XPS图谱 Figure 11 Pt 4f and Sn 3d XPS profiles of PtSn-Mg(Ga)(Al)O-1% catalyst |
我们以镁铝水滑石作为载体, 利用水滑石层间阴离子的可交换性, 负载活性金属铂和锡用于丙烷脱氢反应, 对丙烷脱氢的活性进行了研究.当以Mg(Al)O水滑石作为载体时, 当在原料气中加入H2时, 能够使得丙烷脱氢的转化率大幅度提升, 且选择性也有所提升.当改善水滑石载体时, 在水滑石载体中加入Ga能够影响丙烷脱氢活性, 当镓的含量为1%时催化剂丙烷脱氢反应活性最高, 即催化剂PtSn-Mg(Ga)(Al)O-1%具有最优的丙烷脱氢活性, 反应初始时, 丙烷转化率为46.5%, 反应2 h后, 丙烷转化率仍有37.5%.当以Mg(Ga)(Al)O-1%为载体时, 考察了不同H2/C3H8摩尔比对丙烷脱氢活性的影响, 结果表明当H2/C3H8摩尔比为0.5:1时, 丙烷脱氢反应具有最佳的反应活性.烷烃脱氢是一个吸热反应, 同时考察了温度对烷烃脱氢反应性能影响, 结果表明温度越高, 丙烷脱氢反应具有更高的转化率.对催化剂进行长时间寿命实验考察, 发现当反应经过40 h后, 丙烷的转化率仍有23.5%, 说明PtSn-Mg(Ga)(Al)O-1%催化剂具有较好的稳定性.
| [1] | Chen Ling-peng(陈领鹏), Tian Zhi-peng(田志鹏), Lu Wei(吕微), et al. Preparation of Pt-SnE/Mg(Al) O catalyst by anion exchange method and its performance in alkane dehydrogenation)(离子交换法制备Pt-SnE/Mg(Al)O催化剂及其烷烃催化脱氢性能)[J]. J Fuel Chem Technol(燃料化学学报), 2016, 44(5): 597–606. DOI:10.3969/j.issn.0253-2409.2016.05.012 |
| [2] | Sattler J J, Ruiz-Martinez J, Santillan-Jimenez E, et al. Catalytic dehydrogenation of light alkanes on metals and metal oxides[J]. Chem Rev, 2014, 114(20): 10613–10653. DOI:10.1021/cr5002436 |
| [3] | Llorca J, Homs N, Leon J, et al. Supported Pt-Sn catalysts highly selective for isobutane dehydrogenation:preparation, characterization and catalytic behavior[J]. Appl Catal A:Gener, 1999, 189(1): 77–86. DOI:10.1016/S0926-860X(99)00253-7 |
| [4] | Pham H N, Sattler J J, Weckhuysen B M, et al. Role of Sn in the regeneration of Pt/gamma-Al2O3 light alkane dehydrogenation catalysts[J]. ACS Catal, 2016, 6(4): 2257–2264. DOI:10.1021/acscatal.5b02917 |
| [5] | Shi L, Deng G M, Li W C, et al. Al2O3 nanosheets rich in pentacoordinate Al3+ ions stabilize Pt-Sn clusters for propane dehydrogenation[J]. Angew Chem Inter Edit, 2015, 54(47): 13994–13998. DOI:10.1002/anie.201507119 |
| [6] | Xiong H, Lin S, Goetze J, et al. Thermally stable and regenerable Pt-Sn clusters for propane dehydrogenation prepared via atom trapping on ceria[J]. Angew Chem Inter Edit, 2017, 56(45): 8986–8891. |
| [7] | Kwak J H, Hu J, Mei D, et al. Coordinatively unsaturated Al3+ centers as binding sites for active catalyst phases of platinum on γ-Al2O3[J]. Science, 2009, 325(5948): 1670–1673. DOI:10.1126/science.1176745 |
| [8] | Di Cosimo J, Dıez V, Xu M, et al. Structure and surface and catalytic properties of Mg-Al basic oxides[J]. J Catal, 1998, 178(2): 499–510. DOI:10.1006/jcat.1998.2161 |
| [9] | Akporiaye D, Jensen S, Olsbye U, et al. A novel, highly efficient catalyst for propane dehydrogenation[J]. Indus & Engineer Chem Res, 2001, 40(22): 4741–4748. |
| [10] | Xia K, Lang W Z, Li P P, et al. The influences of Mg/Al molar ratio on the properties of PtIn/Mg(Al)O-x catalysts for propane dehydrogenation reaction[J]. Chem Engineer J, 2016, 284: 1068–1079. DOI:10.1016/j.cej.2015.09.046 |
| [11] | Xia K, Lang W Z, Li P P, et al. The properties and catalytic performance of PtIn/Mg(Al)O catalysts for the propane dehydrogenation reaction:Effects of pH value in preparing Mg(Al)O supports by the co-precipitation method[J]. J Catal, 2016, 338: 104–114. DOI:10.1016/j.jcat.2016.02.028 |
| [12] | Siddiqi G, Sun P, Galvita V, et al. Catalyst performance of novel Pt/Mg(Ga)(Al)O catalysts for alkane dehydrogenation[J]. J Catal, 2010, 274(2): 200–206. DOI:10.1016/j.jcat.2010.06.016 |
| [13] | Sun P, Siddiqi G, Chi M, et al. Synthesis and characterization of a new catalyst Pt/Mg(Ga)(Al)O for alkane dehydrogenation[J]. J Catal, 2010, 274(2): 192–199. DOI:10.1016/j.jcat.2010.06.017 |
| [14] | Sun P, Siddiqi G, Vining W C, et al. Novel Pt/Mg (In)(Al)O catalysts for ethane and propane dehydrogenation[J]. J Catal, 2011, 282(1): 165–174. DOI:10.1016/j.jcat.2011.06.008 |
| [15] | Filez M, Redekop E A, Poelman H, et al. Unravelling the formation of Pt-Ga alloyed nanoparticles on calcined Ga-modified hydrotalcites by in situ XAS[J]. Chem Mater, 2014, 26(20): 5936–5949. DOI:10.1021/cm502658d |
| [16] | Millange F, Walton R I, O'Hare D. Time-resolved in situ X-ray diffraction study of the liquid-phase reconstruction of Mg-Al-carbonate hydrotalcite-like compounds[J]. J Mater Chem, 2000, 10(7): 1713–1720. DOI:10.1039/b002827o |
| [17] | Fang S, Zhang K, Wang C, et al. The properties and catalytic performance of PtSn/Mg (x-Ga) AlO catalysts for ethane dehydrogenation[J]. RSC Adv, 2017, 7(37): 22836–22844. DOI:10.1039/C7RA00670E |
| [18] | Liu Shu-he(刘淑鹤), Fang Xiang-chen(方向晨), Zhang Xi-wen(张喜文), et al. Advances in catalytic mechanisms and kinetics of propane dehydrogenation(丙烷脱氢催化反应机理及动力学研究进展)[J]. Chem Indus Engineer Pro(化工进展), 2009, 28(2): 259–266. DOI:10.3321/j.issn:1000-6613.2009.02.016 |
| [19] | Biloen P, Dautzenberg F, Sachtler W. Catalytic dehydrogenation of propane to propene over platinum and platinum-gold alloys[J]. J Catal, 1977, 50(1): 77–86. DOI:10.1016/0021-9517(77)90010-0 |
| [20] | Kogan S, Schramm H, Herskowitz M. Dehydrogenation of propane on modified Pt/θ-alumina performance in hydrogen and steam environment[J]. Appl Catal A:Gener, 2001, 208(1/2): 185–191. |
| [21] | Yang Wei-shen(杨维慎), Lin Li-wu(林励吾). The Progress of supported platinum-tin catalysts(负载型铂锡催化剂的研究进展)[J]. Peterochem Technol(石油化工), 1993, 22(5): 347–352. |
| [22] | Galvita V, Siddiqi G, Sun P, et al. Ethane dehydrogenation on Pt/Mg(Al)O and PtSn/Mg(Al)O catalysts[J]. J Catal, 2010, 271(2): 209–219. DOI:10.1016/j.jcat.2010.01.016 |
| [23] | Sattler J J, Gonzalez-Jimenez I D, Luo L, et al. Platinum-promoted Ga/Al2O3 as highly active, selective, and stable catalyst for the dehydrogenation of propane[J]. Angew Chem, 2014, 126(35): 9405–9410. DOI:10.1002/ange.201404460 |
| [24] | Zhu Y, An Z, Song H, et al. Lattice-confined Sn (Ⅳ/Ⅱ) stabilizing raft-like Pt clusters:High selectivity and durability in propane dehydrogenation[J]. ACS Catal, 2017, 7(10): 6973–6978. DOI:10.1021/acscatal.7b02264 |
 2018, Vol. 32
2018, Vol. 32


