2. 中国科学院兰州化学物理研究所 羰基合成与选择氧化国家重点实验室, 甘肃 兰州 730000
2. State Key Laboratory for Oxo Synthesis and Selective Oxidation, Lanzhou Institute of Chemical Physics, Chinese Academy of Sciences, Lanzhou 730000, China
甲烷在自然界中分布很广, 是天然气、沼气的主要成分.随着页岩气产业的快速发展, 近十年间天然气的成本下降了近3/4, 但年产量仍持续增长[1], 这使甲烷成为廉价的能源.此外, 近二十年间由甲烷排放造成的温室效应是二氧化碳的72倍[2], 其不完全燃烧产生的有害气体也会对环境造成严重的污染[3].以甲烷为原料, 通过生物炼制生产液体燃料(Biological conversion of natural gas to liquid fuel, Bio-GTL), 一方面可以达到甲烷减排的目的, 延缓温室效应.另一方面可以源源不断的生产液体燃料, 缓解能源供需紧张的现状.
其实通过甲烷生产液体燃料的研究由来已久, 在过去二十年中, 研究人员对将甲烷用于费托合成(Fischer-Tropsch, FT)进行了大量研究.但收率低、选择性差、大量的资金和能量投入限制了FT的进一步发展和应用[4].近年来, 能源危机和环境问题使得可再生能源尤其是生物质能源具有极大的吸引力, 利用微生物发酵产生的脂质则可以作为传统从动植物中获取脂质的潜在替代品进行液体燃料的生产.已经有以藻类[5]、含油酵母[6]、虾类副产品[7]为原料进行生物柴油生产的研究, 但Bio-GTL的相关报道还很少.
Bio-GTL的工艺基础在于甲烷氧化菌能够代谢甲烷, 甲烷氧化菌是以甲烷为唯一碳源和能源进行生长的一类细菌.上世纪六七十年代, 随着甲烷氧化菌分离纯化方法的逐步建立[8], 研究人员对这种菌展开了大量研究.研究发现, 当甲烷氧化菌在Cu2+存在下生长时, 细胞中的颗粒性甲烷单加氧酶(particulate methane monooxygenase, pMMO)大量表达, 此时细胞内膜大量合成, 成为生物质的主要部分[9].这使利用甲烷氧化菌的膜脂生产可再生柴油的碳氢原料成为可能.但成功实施Bio-GTL还面临着诸多问题.
甲烷氧化菌细胞生长速度慢、发酵周期长, 发酵后细胞干重一般都在0.6 g/L以下.主要原因是甲烷氧化菌生长所需的甲烷和氧气常温常压下在水中的溶解度非常低, 气液传质问题严重限制了甲烷氧化菌的生长, 使其不能满足工业化生产的要求.在脂质提取过程中, 膜脂的两亲性和表面活性会对提取产生不利影响[10-11].极性基团的存在使得部分磷脂与水互溶.磷脂的表面活性使其在提取过程中倾向于发生乳化作用, 乳液的形成会降低脂质的回收率, 导致溶剂的浪费甚至分离失败[11].在加氢脱氧过程中, 焦炭的形成和磷脂中的P、N组分都会导致催化剂钝化甚至失活[12].虽然困难重重, 但甲烷氧化菌膜脂含量水平之高加上其遗传稳定性和所能达到的减排效果仍推动了研究人员对Bio-GTL的深入研究.
目前, Bio-GTL工艺还不成熟, 国内没有相关报道, 国外也只是在实验室进行了小规模探索性试验.我们综述了近几年甲烷氧化菌在高密度培养及深加工炼制生物柴油的研究进展, 着重分析了高密度培养和深加工过程中在传质与反应器设计、菌种培养、脂质提取、加氢脱氧等关键过程面临的技术难点, 并提出今后可能的发展方向.
1 生产生物柴油的原料分类传统意义上, 生物柴油是由动物油脂(猪油、牛油等)和植物油脂(玉米、大豆等)制成的, 对植物油脂来说, 其中许多植物是主要的粮食作物, 这种生产加剧了粮食供应紧张问题, 特别是在我国, 粮食供应有限且人多地少, 不可能用大量的粮食作物作为生产生物柴油的原料, 过多的占用耕地种植油料作物.我国餐饮业发达, 废弃油脂量多.目前生产生物柴油所用的原料主要为餐饮废油, 但其来源复杂, 杂质含量高, 生产出的生物柴油产品性质不稳定, 生产过程中的三废问题也会对环境造成严重的污染[13].基于以上问题, 拓宽生物柴油的原料范围是十分必要的, 大力发展以非食用油料植物(麻风树、蓖麻等)为原料生产生物柴油是方向之一.微生物油脂(甲烷氧化菌、藻类等)产油量高、稳定性好且在生产过程中对温室气体的减排效果显著, 是一种非常有潜力的生产原料.已有试验证明了这种生产方式的可行性及其在经济和环境上的优势[5, 10], 引起学术界和工业界的广泛关注.以动植物油脂、餐饮废油、微生物油脂为原料生产生物柴油的特点比较见表 1.
| 表 1 不同原料生产生物柴油的特点比较[5, 13] Table 1 Comparison of the characteristics of biodiesel production from different raw materials[5, 13] |
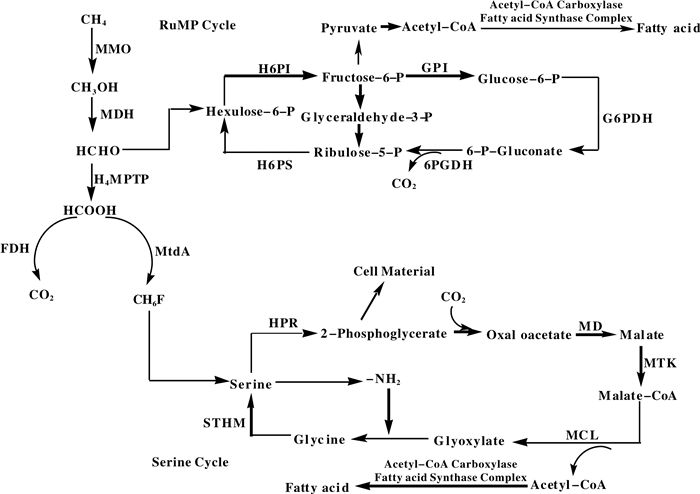
甲烷氧化菌的代谢途径(图 1).根据甲烷氧化菌的细胞结构和代谢水平可将其分为3种类型: TypeⅠ、TypeⅡ、TypeⅩ.其中TypeⅠ和TypeⅩ为γ型变形菌, TypeⅡ为α型变形菌.这3种类型菌的甲醛同化途径和胞质内膜结构都是不同的. TypeⅠ菌通过核酮糖单磷酸循环(RuMP循环)同化甲醛.含有主要由十六碳脂肪酸构成的束状排列的胞质内膜. TypeⅡ菌通过丝氨酸代谢途径同化甲醛.胞质内膜沿着细胞壁排列, 主要由十八碳脂肪酸构成. TypeⅩ菌通过RuMP循环同化甲醛, 但在其中也发现了少量的核酮糖二磷酸羧化酶(丝氨酸循环代谢酶)[14].几乎所有的甲烷氧化菌都能够将甲烷氧化成二氧化碳和水, 并生成一系列的中间代谢产物, 如甲醇、甲醛、甲酸等.
|
图 1 甲烷氧化菌的代谢途径[1, 14] Figure 1 Metabolic pathway of methane oxidizing bacteria[1, 14] MMO: methane monooxygenase; MDH: methanol dehydrogenase; FDH: formate dehydrogenase; H4MPTP: methylene tetrahydromethanopterin pathway; MtdA: methylene tetrahydromethanopterin dehydrogenase; H6PI: hexulose-6-phosphate isomerase; GPI: glucose phosphate isomerase; G6PDH: glucose-6-phosphate dehydrogenase; 6-PGDH: 6-phosphogluconate dehydrogenase; H6PS: hexulose-6-phosphate synthetase; STHM: serine hydroxymethyl transferase; HPR: hydroxypyruvate reductase; MD: malate dehydrogenase; MTK: malate thiokinase; MCL: malyl coenzyme A lyase |
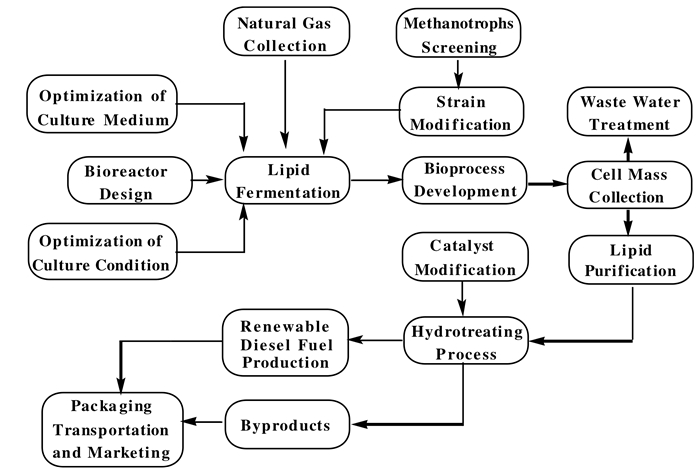
Bio-GTL的简易流程(图 2), 包括天然气的采购与运输、天然菌种的筛选、改良菌株的培育、培养基与培养条件、反应器的设计、脂质提取和加工过程的开发等.尽管基于甲烷氧化菌生产可再生燃料有诸多优势, 但在甲烷氧化菌的高密度培养、膜脂的提取与加工过程中仍面临着许多技术瓶颈.接下来我们详细综述了Bio-GTL中甲烷氧化菌的高密度培养及深加工炼制生物柴油过程中的几个关键方面.
3.1 甲烷氧化菌的高密度培养 3.1.1 传质与反应器设计传质问题是Bio-GTL工艺的主要挑战之一[15-16].为了使微生物的利用效率最大化, 气体分子必须进入气液界面, 然后通过培养基扩散, 最后到达微生物细胞表面, 在那里参与代谢反应.在整个过程中, 气液界面传质是气体扩散的主要障碍. Vega[17]指出传质、反应动力学和细胞生长3者之间存在非常紧密的联系.在发酵初始阶段, 甲烷和氧气容易获得, 此时细胞生长受代谢反应动力学的控制.随着细胞密度的增长, 传质率成为决定细胞生长的主要因素[18], 高细胞密度下由于传质问题导致的碳源和氧气不充分供给对细胞生长的影响变得明显, 进而导致产率降低.
Klasson[19]提出的传质系数(KL, m/s)公式可以方便我们理解并解决传质率限制的问题.公式如下:
| $ \frac{{dN_S^G}}{{dt}} = \frac{{{V_L} \times {K_L} \times a}}{H}\left( {P_S^G - P_S^L} \right) $ |
其中NSG(mol)是液相中的底物摩尔数, VL(L)为反应器的体积, PSG、PSL(Pa)分别为气体底物在气相和液相中的分压, H(L×Pa/mol)为亨利常数, a(m2/L)为单位体积中气液界面表面积. PSG和、PSL之间的分压差是传质过程中的主要驱动力[20].反应器的设计宗旨就是通过产生尺寸尽可能小的泡沫和气泡, 增加气液界面表面积(有效传质区域)来提高传质系数.一般来说, 用于气体发酵的微生物性质各不相同, 并没有最佳的生物反应器设计.高传质率, 低运行和维护成本及易于扩大生产是开发高效反应器的关键指标[20].几种常见的气体发酵反应器已经提出并使用(表 2).其中丹麦技术大学提出的U型环流反应器(U-Loop reactor)是目前效果最好的反应器, 它配有静态混合器和热交换器, 在实现气液高度混合的同时能将反应释放的热量及时除去.以甲烷氧化菌为原料已成功用于单细胞蛋白的生产[21].连续搅拌罐式反应器(Continuous stirred tank reactors, CSTR)是工业发酵中应用最广泛的生物反应器.在CSTRs中提高传递系数的常用方法是增加搅拌速度或修改叶轮设计, 叶轮产生的水剪切力能将大气泡分解成较小的气泡, 增加传质界面面积[22].然而, 过度搅动造成的高剪切速率可能会对细胞造成损害[24].同时, 这种方式对能量需求的增加降低了大规模发酵生产的经济可行性[20, 25]. Ellenberger等[34]发现在鼓泡塔反应器(Bubblecolumn reactor)中, 塔底激振器在低频振动(40~120 Hz)的情况下可使喷嘴处气泡的尺寸减少40%~50%, 有效促进气液传质. Sheets等[35]成功将滴流床反应器(Trickle bed reactor)应用于甲烷氧化菌生产甲醇的研究.最近, Zhu等[36-37]提出通过向气体发酵系统中添加功能化纳米颗粒, 利用功能化纳米颗粒的优良吸附能力来提高传质效率.
| 表 2 几种常见气体发酵反应器的性能比较 Table 2 The performance comparison of several common gas fermentation reactors |
为解决传质问题, 清华大学邢新会研究小组以M. trichosporium OB3b为研究对象, 尝试添加石蜡油作为甲烷传递体, 促进甲烷从气相向甲烷氧化菌细胞内的传质.在摇瓶试验的基础上进行放大, 优化了5L发酵罐中的石蜡油培养体系, 并对石蜡油强化细胞生长机制进行初步的探讨[38].研究发现, 在摇床试验中, 当石蜡油添加浓度为4%~6%时, 细胞生长最快, 细胞密度最大.在5L发酵罐的放大试验中, 发现石蜡油添加可以极大的缩短细胞生长的迟滞期, 但高浓度的石蜡油会抑制细胞的生长, 当石蜡油浓度为5%时, 细胞生长最快, 密度最高, 发酵终止后, 细胞干重高于9.89 g/L, 为无石蜡油添加时的4.5倍.原因一方面可能是石蜡油的添加使细胞培养液发生乳化现象改变了其流体力学性质, 溶液粘度的提高促进了甲烷的传质.另一方面由于细胞与石蜡油之间存在相互作用, 细胞易富集于在石蜡油与水的界面处, 石蜡油中高浓度的甲烷便于通过石蜡油向菌体细胞传递, 加快细胞氧化甲烷的速率.
我们为解决传质问题进行了以甲醇替代甲烷作为碳源的研究[39].试验用甲醇蒸汽对甲烷氧化菌M.IMV3011进行驯化处理后以甲醇为碳源进行培养, 研究发现当甲醇的添加量为0.05 %(V/V)时, 细胞生长最快, 最快生长速率为0.046 h-1, 延滞期为60.4152 h, 此时OD600值为1.578, 细胞密度最高, 细胞干重是未添加甲醇的5倍.这种培养方法虽可使细胞密度和生长速率增大, 但甲醇的抑制作用使细胞生长的延滞期变长, 而且发酵过程中无法确定甲醇的消耗情况, 不能保证菌种一直在最适甲醇浓度下生长, 这是后续研究需解决的问题.
3.1.2 培养基设计为微生物提供合适的营养对任何一个生物培养过程来说都是十分重要的, 一个发酵培养基是否合适直接影响了产率和效价.培养甲烷氧化菌常用的培养基为无机盐培养基(nitrate mineral salt medium, NMS medium)[40], 主要成分为硝酸盐、矿物质、常量营养素磷、钾和一些微量营养素铜等.研究表明Cu2+在甲烷氧化菌的生长中扮演着重要角色, 发现Cu2+浓度为0.85~1 μmol/g(细胞干重)时, pMMO活性显著上升, 此时细胞内膜大量合成[9, 41].还发现Cu2+浓度影响着甲烷氧化速率[42]和细胞生长速率[43]. Stanley[41]认为相比于α型变形菌, γ型变形菌生长需要更高含量的Cu2+.除Cu2+对细胞生长的影响外, 加州大学Taylor研究小组[44]发现在培养过程中通入少量的CO2或在液相中加入Na HCO3, 可以促进M.trichosporium OB3b的生长. Xing等[45]发现当额外添加柠檬酸浓度为15 μmol/L时, M. trichosporium OB3b胞内新陈代谢活性增强, 生长速度加快, 细胞浓度可提高3~4倍. Henry[46]报道螯合剂(Na-EDTA)能显著促进甲烷氧化菌对三氯乙烯的氧化速率.低浓度的ETDA也表现出能加快α型变形菌的生长[47].发现Mg2+可以影响Methylocystis sp. GB 25中PHB的积累[48], 这可能是由于干扰渗透平衡使钾离子流失到培养基中导致的[49].
在实验室层面, 尽管向培养基中加入一些金属离子和盐类物质能够加快细胞生长速率, 提高产量.但人们往往忽视了这些添加物可能会成为工业化生产过程中的污染物, 给脂质提取和催化升级等下游加工过程带来不可预知的成本和难度.因此应在综合生物处理框架中研究培养基优化, 尽量减少在上游过程中引入不必要的化学物质.
3.1.3 培养条件控制培养条件需要考虑的因素包括pH、温度、溶氧量、甲烷与氧气比例等. pH是微生物保持最佳活性的重要环境因素之一, 氢离子浓度水平影响微生物的生理行为.多数甲烷氧化菌生长的最适pH范围都在5.0~10.0左右.例如, M. buryatense 5G能够在pH为6.8~10.5的环境下生长, 最适pH为9.5[50]. M.alcaliphilum20G生长的最适pH在9.0~9.5[51], 也有报道一些极端嗜酸甲烷氧化菌像M.Verrucomicrobia, 可以在pH低至1的环境中生长[52].温度也是一个关键参数, 它会影响细胞生长、碳源利用、脂质组成和甲烷在培养基中的溶解度.尽管有报道发现一些甲烷氧化菌能够在低于5 ℃和高于70 ℃的环境中生长, 但绝大多数甲烷氧化菌生长的最适温度都在25~35 ℃[53]. Taylor对M.trichosporium OB3b的培养条件进行了优化研究, 发现温度为30~34 ℃, pH在6.0~7.0, 磷酸盐浓度为10~40 mmol/L时, 细胞生长最好, 最大比生长速率达到0.08 h-1, 发酵180 h后, 细胞干重达到3 g /L[44].发现甲烷与氧气的比例对细胞代谢和气液传质系数影响较大[54-55].对于几乎所有α、γ型变形菌, 氧气浓度在0.45%~20%(v/v)时, 甲烷氧化速率达到最大[56].
3.1.4 培养方式选择通常为了实现细胞的高密度培养并同时得到期望的细胞产品, 补料分批培养是最常用的一种发酵培养方式.已经有采用补料分批培养的方式, 分别利用甲烷氧化菌和含油酵母生产聚-β-羟基丁酸酯(PHB)和脂质的报道[57-58].甲烷氧化菌中脂质的积累可通过调整培养过程中Cu2+、O2、氮源和磷源的浓度来控制.故甲烷氧化菌脂质的生产也可以效仿此方法, 采用营养平衡-营养限制的两段式培养方式, 将整个生产过程分为细胞生长和脂质积累两个阶段.首先让甲烷氧化菌在营养平衡培养基中大量增殖菌体, 然后合理调整发酵培养条件, 使菌体在第二阶段中大量积累脂质.此外, Chang的研究小组[59-60]一直在开发以糖作为碳源的多级连续高密度培养系统(MSC-HCDC), 该系统由多个CSTR反应器串联而成, 通过细胞回收或细胞固定实现细胞的高密度培养, 其产率与补料分批培养相当. MSC-HCDC也可被完善用于气体发酵生产微生物脂质或脂肪酸, 已经有采用改进后的MSC-HCDC提高PHB和糖发酵中脂肪酸产量的报道[61].
传统发酵过程中需实时监测糖水平以调整发酵反应进程, 甲烷氧化菌的培养也需安装监测甲烷和O2的流量、压力传感器以达到在线分析和控制的目的.实时监测甲烷和O2的浓度还可以帮助研究人员避免空气中甲烷含量5%(体积百分比)的爆炸下限和15%(体积百分比)的爆炸上限[62], 为发酵生产提供安全保障.
3.2 甲烷氧化菌膜脂深加工炼制生物柴油 3.2.1 脂质提取传统的脂质提取方法是使用氯仿-甲醇组合, 这种方法虽然有效, 但共溶剂萃取面临的溶剂回收和废水处理问题是工业化生产难以接受的.正己烷易回收, 可用于脂质提取, 但甲烷氧化菌膜脂中的极性部分在正己烷中的溶解度低并且在萃取过程中倾向于发生乳化作用[10-11].研究认为提取前用酸、碱预处理可一定程度上解决提取过程中膜脂溶解性差和表面活性问题. Dong等[10]将M.buryatense 5GB1生物质用碱预处理后, 发现生物质几乎完全溶解, 整个体系转变成仅有少量残留物的透明溶液.原因可能是革兰氏阴性菌细胞壁的完整性易受碱水解的影响, 碱将嵌入膜脂中的糖蛋白基质分解掉了.但萃取过程中乳化问题依旧存在, 采用冻结和离心的手段虽能缓解乳化现象但效果不佳.相反, 用酸预处理时, 乳化现象不明显, 但酸的加入又促进了生物质凝结.为了利用碱处理的生物质水解能力和酸处理的乳化还原能力, Dong的研究小组进一步试验确定最佳预处理条件为: 150 ℃下用1%NaOH, 2%H2SO4分别处理5 min.两阶段预处理后观察到非常少的乳液形成, 低速离心后可将有机溶剂完全从水相中分离出来, 得到最高收率接近100%. LC-MS分析显示原始生物质中的脂质为磷脂, 经两阶段预处理后, 几乎所有磷脂都转化为游离脂肪酸, 成为催化升级的优选原料.
超临界萃取(Supercritical fluid extraction, SFE)是一种新兴的绿色提取技术[63], 可用于脂质的提取. SFE的优势在于高压下以CO2为溶剂进行提取, 这样在压力恢复常态时CO2易被除去使得脂质的回收变得容易.但也存在问题, 在没有夹带剂的情况下, 超临界CO2的非极性属性决定了其对脂质的提取具有选择性, 因而纯粹的SFE在面对甲烷氧化菌中部分极性脂质时, 并不能发挥作用. Soh等[64]用SFE对甲烷氧化菌中不同类型的脂质进行提取, 最大产率仅为60%.将SFE优化升级用于甲烷氧化菌的脂质提取还有待研究. Toribio等[65]用甲醇改性的CO2对玉米中的极性脂质进行超临界萃取, 显著增加了脂质的提取率.并将此方法成功用于获取转基因玉米的脂肪酸谱. Spence等[66]采用微滤与超临界萃取相结合的方式对酪乳粉中的复合脂质进行提取, 发现提取前对样品进行物理振动处理或向其中加入硅藻土能提高脂质的可提取性, 提取率分别达到了86%和70%.另有研究发现温度和Cu2+浓度会对脂质提取产生较大影响.温度影响提取脂质的种类, Cu2+浓度影响提取脂质的数量. Burdette[67]以TypeⅠMethylomonas methanica为研究对象, 试验发现25 ℃时产物中脂肪酸甲酯(C16:1)含量最高, 在30和33 ℃时含量明显降低. Cu2+浓度为5 μmol/L时脂肪酸甲酯(C16:1)产量最高.在2L发酵罐扩大培养后总脂质产量占总生物量的4.8%, 其中脂肪酸(C16:1)占总脂肪酸甲酯的70%.
综上, 在脂质提取工艺中, 适当的前处理可提高脂质的可提取性.不同溶剂体系和提取条件对不同类别脂质选择性不同.在开发基于溶剂的萃取体系时应充分考虑生物体的脂质组成及上游技术和下游技术的关联性.溶剂的选择决定了所提取脂质的质量和数量, 间接决定了下游深加工技术的成本和产量.另外在所有步骤中都要对脂质组成进行全面表征, 不断调整脂质提取和加工技术, 实现脂质提取效率的最大化.
3.2.2 加氢脱氧微生物脂质与可进行燃料生产的碳氢原料的最大差别是微生物脂质中含氧量非常高, 这使其具有高活性、低热值、高粘度等不利性质[68]. Bio-GTL的最后一步是将从甲烷氧化菌中提取的脂质经加氢脱氧(Hydrodeoxygenation, HDO)升级为燃料范围的烃类化合物. HDO指在H2和催化剂的作用下, 使生物质中C=C, C=O和芳香环饱和并释放CO2或H2O的过程[69]. HDO是一种既定的炼油工艺, 其碳转化效率高, 无CO2排放, 可减少硫、氮、稠环芳烃和金属等污染物, 同时提高产物的十六烷值、密度和烟点.
HDO面临的最大挑战是催化剂的失活问题.一种兼顾活性与稳定的催化剂对HDO来说至关重要.一般来说, 焦化、烧结、水的影响都会使催化剂钝化甚至失活[70-71].在这些失活原因中, 焦化的发生被证明是催化剂失活的主要原因.通过聚合和缩聚反应形成的焦炭掩盖了催化剂表面的活性位点, 使催化剂钝化甚至失活.焦炭形成的程度主要取决于催化剂的性质和操作条件[72].
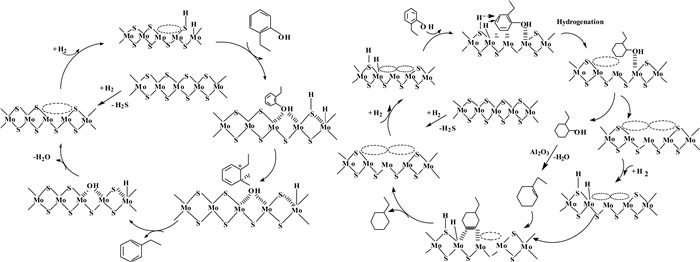
过渡金属硫化催化剂(Transition metal sulfides, TMSs)在传统HDO处理中应用最广, 其中以γ-Al2O3为载体的CoMo/Al2O3和NiMo/Al2O3是使用最多的两种TMSs催化剂.在CoMo/Al2O3和NiMo/Al2O3中, Mo为活性元素, Co和Ni为助催化剂.通常认为位于MoS2纳米团簇边缘的S空位为TMSs的催化位点, 这些位点表现出Lewis酸的性质, 可通过未配对的电子吸附杂原子, 在碳-杂原子键的断裂中发挥着重要作用[73-74]. Ni和Co通过削弱S—Mo键增加S空位催化位点的活性.此外, TMSs催化剂表面的H+和SH-使TMSs表现出Bronsted酸的特性, SH-将质子传递给表面附着分子, 附着分子首先形成碳阳离子, 最后变成脱氧化合物.同时, S—H和Mo—H中的H使C=C被还原成C—C(图 3)[72, 75].
|
图 3 CoMoS/Al2O3催化2-乙基酚的加氢脱氧机理[72, 75] Figure 3 The mechanism of hydrodeoxygenation pathway of 2-ethylphenol over a CoMoS/Al2O3 catalyst[72, 75] |
由此可见, 对于TMSs催化剂, 一方面含氧化合物的吸附与解吸由催化位点的Lewis酸度控制, 质子传递也取决于催化剂表面上SH-或H+基团的Bronsted酸性.另一方面, 焦化的形成也与包括Lewis酸性位点和Bronsted酸性位点在内的的催化剂的酸度有关, 焦化程度随着酸度的增加而增加[76].所以说酸度既是反应发生的诱因, 也是使催化剂失活的原因.因此, 适量的酸度在限制焦化形成的同时对HDO的有效转化十分重要.目前, 还没有将TMSs催化剂用于甲烷氧化菌膜脂加氢处理的报道, 其对甲烷氧化菌膜脂加氢处理的效果还有待研究.
贵金属催化剂像钯, 铂和铑与TSMs相比虽然成本较高, 但其活氢能力高, 对底物吸附能力强, 使用后可进行有效回收循环利用, 不会造成污染, 近年来受到广泛关注. Gutierrez等[70]研究发现, 铂族金属催化剂, 尤其是含铑的催化剂与常规TSMs催化剂相比, 催化HDO过程中焦炭沉积更少, 催化效率相当甚至更好. Dong[10]等用Pb/SiO2催化甲烷氧化菌脂质的加氢脱氧过程, 脂质转化率超过99%.
操作条件也影响HDO过程中焦化的发生.已经证实在高压下氢气通过饱和焦化物前体可有效去除焦化物.而升高的温度易发生缩聚反应, 从而增加焦化物的形成[71, 77].从HDO反应的角度来看, 多步骤工艺有利于减少焦化的发生并防止生物质快速热解产物的重新聚合. Huber[78]提出了3步法, 首先使用Ru/C催化剂在125 ℃ 98 Pa下去除不稳定的羰基官能团, 然后在300 ℃ 98 Pa下用Pt/C进行加氢反应提高H/C比并防止潜在的焦化发生.最后在600 ℃下用HZSM-5进行双级加氢处理.整体焦炭形成从约32%降至12.6%.
综上, 甲烷氧化菌膜脂加氢处理的发展要从催化剂的开发和优化过程条件两方面着手, 一方面开发耐焦化、成本低、无污染的新型催化剂, 另一方面不断优化过程条件, 有效将甲烷氧化菌的膜脂转化为燃料范围的烃类.
4 展望目前Bio-GTL仍处于起步阶段, 推动其在未来的发展可着眼于以下几个方面: ①依托于分子生物学技术, 通过基因工程、代谢工程构建出生长迅速、膜脂含量丰富的重组菌株. ②基于传质问题, 不断改进和优化现有反应器, 开发新型气体发酵反应器. ③不断进行培养基和培养条件的优化, 降低生产成本, 提高脂质产率. ④目前脂质提取分析都选择用干细胞团进行, 这会使成本增加.未来新提取技术的开发应放在湿法提取上. ⑤加强多金属组分、复合多功能型催化剂的开发, 开发可调节酸度和孔隙率的载体, 加强催化剂的改性研究.
| [1] | Fei Q, Guarnieri M T, Tao L, et al. Bioconversion of natural gas to liquid fuel:opportunities and challenges[J]. Biotechnol Adv, 2014, 32(3): 596–614. DOI:10.1016/j.biotechadv.2014.03.011 |
| [2] | Phillips N G, Ackley R, Crosson E R, et al. Mapping urban pipeline leaks:methane leaks across Boston[J]. Environ Poll, 2013, 173(1): 1–4. |
| [3] | Elvidge C D, Ziskin D, Baugh K E, et al. A fifteen year record of global natural gas flaring derived from satellite data[J]. Energies, 2009, 2(3): 595–622. DOI:10.3390/en20300595 |
| [4] | Vosloo A C. Fischer-Tropsch:a futuristic view[J]. Fuel Proce Technol, 2001, 71(1): 149–155. |
| [5] | Levine R B, Pinnarat T, Savage P E. Biodiesel Production from Wet Algal Biomass through in Situ Lipid Hydrolysis and Supercritical Transesterification[J]. Ener & Fuels, 2010, 24(9): 5235–5243. |
| [6] | Poli J S, Silva M A N D, Siqueira E P, et al. Microbial lipid produced by Yarrowia lipolytica QU21 using industrial waste:a potential feedstock for biodiesel production[J]. Biores Technol, 2014, 161(6): 320–326. |
| [7] | Zhang G, French W T, Hernandez R E, et al. Microbial lipid production as biodiesel feedstock from N-acetylglucosamine by oleaginous microorganisms[J]. J Chem Technol & Biotechnol, 2011, 86(5): 642–650. |
| [8] | Whittenbury R, Phillips K C, Wilkinson J F. Enrichment, Isolation and Some Properties of Methane-utilizing Bacteria[J]. J Gener Micro, 1970, 61(2): 205–218. DOI:10.1099/00221287-61-2-205 |
| [9] |
a. Peltola P, Priha P, Laakso S. Effect of copper on membrane lipids and on methane monooxygenase activity of Methylococcus capsulatus, (Bath)[J]. Archi Micro, 1993, 159(6): 521-525. b. Lin Hui-ying(林惠颖), Xin Jia-ying(辛嘉英), Li Chun-yu(李春雨), et al. Progress on isolation and purification of particulate methane monooxygenase (颗粒性甲烷单加氧酶分离纯化方法的研究进展)[J]. J Mol Catal(China)(分子催化), 2018, 32(1): 90-98. c. Li Chun-yu(李春雨), Xin Jia-ying(辛嘉英), Lin Hui-ying(林惠颖), et al. Study on functionalized gold nanoparticles of methanobactin by copper ion coordination uesd as simulated peroxidase(铜离子配位甲烷氧化菌素功能化纳米金模拟过氧化物酶的研究)[J]. J Mol Catal(China)(分子催化), 2017, 31(5): 480-485. d. Dou Bo-xin(窦博鑫), Xin Jia-ying(辛嘉英), Wang Zhen-xing(王振兴), et al. Multilayer self-assembly modified electrode of methanobactin functionalized gold nanoparticle to catalytic reduction of hydrogen peroxide(甲烷氧化菌素功能化金纳米层层自组装修饰电极上过氧化氢的催化还原)[J]. J Mol Catal(China)(分子催化), 2017, 31(6): 534-543. |
| [10] | Dong T, Fei Q, Genelot M, et al. A novel integrated biorefinery process for diesel fuel blendstock production using lipids from the methanotroph, Methylomicrobium buryatense[J]. Ener Conver & Manage, 2017, 140: 62–70. |
| [11] | Dong T, Knoshaug E P, Pienkos P T, et al. Lipid reco-very from wet oleaginous microbial biomass for biofuel production:A critical review[J]. Appl Ener, 2016, 177: 879–895. DOI:10.1016/j.apenergy.2016.06.002 |
| [12] | Kubicka D, Kaluža L. Deoxygenation of vegetable oils over sulfided Ni, Mo and NiMo catalysts[J]. Appl Catal Gener, 2010, 372(2): 199–208. DOI:10.1016/j.apcata.2009.10.034 |
| [13] | Wang Chang-wen(王常文), Cui Fang-fang(崔方方), Song Yu(宋宇). Research situation and development prospect of biodiesel(生物柴油的研究现状及发展前景)[J]. Chin Oil & Fats(中国油脂), 2014, 39(5): 44–48. |
| [14] | Hanson R S, Hanson T E. Methanotrophic bacteria[J]. Micro Rev, 1996, 60(2): 439–471. |
| [15] | Conrado R J, Gonzalez R. Envisioning the Bioconversion of Methane to Liquid Fuels[J]. Science, 2014, 343(6171): 621–623. DOI:10.1126/science.1246929 |
| [16] | Klasson K T, Ackerson M D, Clausen E C, et al. Biological conversion of coal and coal-derived synthesis gas[J]. Fuel, 1993, 72(12): 1673–1678. DOI:10.1016/0016-2361(93)90354-5 |
| [17] | Vega J L, Clausen E C, Gaddy J L. Design of bioreactors for coal synthesis gas fermentations[J]. Res Conser&Recy, 1990, 3(2): 149–160. |
| [18] | Chinn M S. Gasification and synthesis gas fermentation:an alternative route to biofuel production[J]. Biofuels, 2011, 2(4): 405–419. DOI:10.4155/bfs.11.108 |
| [19] | Klasson K T, Gupta A, Clausen E C, et al. Evaluation of mass-transfer and kinetic parameters for Rhodospirillum rubrum, in a continuous stirred tank reactor[J]. Appl Biochem & Biotechnol, 1993, 39/40(1): 549–557. |
| [20] | Munasinghe P C, Khanal S K. Biomass-derived syngas fermentation into biofuels:Opportunities and challenges[J]. Biores Technol, 2010, 101(13): 5013–5022. DOI:10.1016/j.biortech.2009.12.098 |
| [21] | Olsen D F, Jørgensen J B, Villadsen J, et al. Optimal operating points for SCP production in the U-loop reactor[J]. IFAC Proce Volu, 2010, 43(5): 499–504. DOI:10.3182/20100705-3-BE-2011.00083 |
| [22] | Bredwell M D, Srivastava P, Worden R M. Reactor design issues for synthesis-gas fermentations[J]. Biotechnol Pro, 1999, 15(5): 834–844. DOI:10.1021/bp990108m |
| [23] | Asimakopoulos K, Gavala H N, Skiadas I V. Reactor systems for syngas fermentation processes:a review[J]. Chem Engineer J, 2018. |
| [24] | Kadic E. Survey of gas-liquid mass transfer in bioreactors[D]. Iowa State University: University of Iowa State, 2010. 150-272. |
| [25] | Ungerman A J, Heindel T J. Carbon monoxide mass transfer for syngas fermentation in a stirred tank reactor with dual impeller configurations[J]. Biotechnol Pro, 2007, 23(3): 613–620. |
| [26] | Bouaifi M, Hebrard G, Bastoul D, et al. A comparative study of gas hold-up, bubble size, interfacial area and mass transfer coefficients in stirred gas-liquid reactors and bubble columns[J]. Chem Engineer & Proce Pro Intens, 2001, 40(2): 97–111. |
| [27] | Datar R P, Shenkman R M, Cateni B G, et al. Fermentation of biomass-generated producer gas to ethanol[J]. Biotechnol & Bioengin, 2004, 86(5): 587–594. |
| [28] | Zhang Xiao-dong(张晓东). Simulations of gas-liquid flow in a bubble column and an internal alrlift loop reactor(鼓泡塔与内循环气升式反应器内气-液两相流的数值模拟)[D]. Beijing University of Chemical Technology(北京化工大学), 2006. http://cdmd.cnki.com.cn/Article/CDMD-10010-2006125174.htm |
| [29] | Zhao Dong-sheng(赵东胜), Liu Gui-min(刘桂敏), Zhao Yan-li(赵艳丽). Research progress of airlift reactor(气升式反应器研究进展)[J]. Chem Pro(化工进展), 2007, 26(6): 810–813. DOI:10.3321/j.issn:1000-6613.2007.06.010 |
| [30] | Wang Rong(王蓉), Mao Zai-sha(毛在砂). Research status and prospects of trickle bed reactor(滴流床反应器的研究现状和展望)[J]. Chem Pro(化工进展), 1992, 1992(3): 10–16. |
| [31] | Lee K C, Rittmann B E. Applying a novel autohydrogenotrophic hollow-fiber membrane biofilm reactor for denitrification of drinking water[J]. Wat Res, 2002, 36(8): 2040–2052. DOI:10.1016/S0043-1354(01)00425-0 |
| [32] | Nerenberg R, Rittmann B E. Hydrogen-based, hollow-fiber membrane biofilm reactor for reduction of perchlorate and other oxidized contaminants[J]. Wat Sci& Technol J Inter Assoc Wat Poll Res, 2004, 49(11/12): 223–230. |
| [33] | Tsai S P, Datta R, Basu R, et al. Modular membrane supported bioreactor for conversion of syngas components to liquid products: US, US 8017384 B2[P]. 2011. |
| [34] | Ellenberger J, Krishna R. Shaken, not stirred, bubble column reactors:Enhancement of mass transfer by vibration excitement[J]. Chem Engineer Sci, 2003, 58(3): 705–710. |
| [35] | Sheets J P, Lawson K, Ge X, et al. Development and evaluation of a trickle bed bioreactor for enhanced mass transfer and methanol production from biogas[J]. Biochem Engineer J, 2017, 122: 103–114. DOI:10.1016/j.bej.2017.03.006 |
| [36] | Zhu H, Shanks B H, Heindel T J. Enhancing CO-water mass transfer by functionalized MCM41 nanoparticles[J]. Ind Eng Chem Res, 2008, 47(20): 7881–7887. DOI:10.1021/ie800238w |
| [37] | Zhu H Y, Shanks B H, Choi D W, et al. Effect of functionalized MCM41 nanoparticles on syngas fermentation[J]. Biom & Bioen, 2010, 34(11): 1624–1627. |
| [38] | Han Bing(韩冰). Molecular ecology study on methanotrophs and fundermantal research on the applications of methanotrophs(甲烷氧化菌的微生态解析及其应用基础研究)[D]. Tsinghua University(清华大学), 2008. http://cdmd.cnki.com.cn/Article/CDMD-10003-2008094694.htm |
| [39] | Liang Hong-ye(梁洪野). High density culture of methane oxidizing bacteria(甲烷氧化菌的高密度培养)[D]. Harbin University of Commerce(哈尔滨商业大学), 2011. http://cdmd.cnki.com.cn/Article/CDMD-10240-1012251923.htm |
| [40] | Park S, Hanna L, Taylor R T, et al. Batch cultivation of methylosinus trichosporium OB3b. Ⅰ:Production of soluble methane monooxygenase[J]. Biotechnol & Bioengineer, 1991, 34(8): 423–433. |
| [41] | Stanley S H, Prior S D, Dalton H. Copper stress underlies the fundamental change in intracellular location of methane mono-oxygenase in methane-oxidizing orga-nisms:Studies in batch and continuous cultures[J]. Biotechnol Lett, 1983, 5(7): 487–492. DOI:10.1007/BF00132233 |
| [42] | Prior S D, Dalton H. The effect of copper ions on membrane content and methane monooxygenase activity in methanol-grown cells of methylococcus capsulatus[J]. Microbiol, 1985, 131(1): 155–163. DOI:10.1099/00221287-131-1-155 |
| [43] | Takeda K, Tanaka K. Ultrastructure of intracytoplasmic membranes of methanomonas margaritae cells grown under different conditions[J]. Ant Van Leeuw, 1980, 46(1): 15–25. DOI:10.1007/BF00422225 |
| [44] | Park S, Hanna L, Taylor R T, et al. Batch cultivation of methylosinus trichosporium OB3b. Ⅰ:Production of soluble methane monooxygenase[J]. Biotechnol& Bioengineer, 2010, 38(4): 423–433. |
| [45] | Xing X H, Luo W M F. Effects of organic chemicals on growth of methylosinus trichosporium OB3b[J]. Biochem Engineer J, 2006, 31(2): 113–117. DOI:10.1016/j.bej.2006.06.001 |
| [46] | Henry S M, Grbic-Galic D. Effect of mineral media on trichloroethylene oxidation by aquifer methanotrophs[J]. Micro Ecol, 1990, 20(1): 151–169. |
| [47] | Yingxin , Zhang , Jiaying , et al. Biosynthesis of poly-3-hydroxybutyrate with a high molecular weight by methanotroph from methane and methanol[J]. J Ener Chem, 2008, 17(1): 103–109. |
| [48] | Wendlandt K D, Jechorek M, Helm J, et al. Producing poly-3-hydroxybutyrate with a high molecular mass from methane[J]. J Biotechnol, 2001, 86(2): 127–133. DOI:10.1016/S0168-1656(00)00408-9 |
| [49] | Helm J, Wend landt K D, Jechorek M, et al. Potassium deficiency results in accumulation of ultra-high molecular weight poly-β-hydroxybutyrate in a methane-utilizing mixed culture[J]. J Appl Micro, 2008, 105(4): 1054–1061. DOI:10.1111/jam.2008.105.issue-4 |
| [50] | Kaluzhnaya M, Khmelenina V, Eshinimaev B, et al. Taxonomic characterization of new alkaliphilic and alkalitolerant methanotrophs from soda lakes of the southeastern transbaikal region and description of methylomicrobium buryatense, sp.nov[J]. Syst & Appl Micro, 2001, 24(2): 166–176. |
| [51] | Khmelenina V N, Kalyuzhnaya M G, Starostina N G, et al. Isolation and characterization of halotolerant alkaliphilic methanotrophic bacteria from tuva soda lakes[J]. Curr Micro, 1997, 35(5): 257–261. DOI:10.1007/s002849900249 |
| [52] | Pol A, Heijmans K, Harhangi H R, et al. Methanotrophy below pH 1 by a new verrucomicrobia species[J]. Nature, 2007, 450(7171): 874–878. DOI:10.1038/nature06222 |
| [53] | Tsubota J, Bts E, Khmelenina V N, et al. Methylothermus thermalis gen. nov. sp. nov. a novel moderately thermophilic obligate methanotroph from a hot spring in Japan[J]. Int J Syst Evol Micro, 2005, 55(5): 1877–1884. DOI:10.1099/ijs.0.63691-0 |
| [54] | Asenjo J A, Suk J S. Microbial Conversion of Methane into poly-β-hydroxybutyrate (PHB):Growth and intracellular product accumulation in a type Ⅱ methanotroph[J]. J Ferment Technol, 1986, 64(4): 271–278. DOI:10.1016/0385-6380(86)90118-4 |
| [55] | Whittenbury R, Phillips K C, Wilkinson J F. Enrichment, isolation and some properties of methane-utilizing bacteria[J]. J Gener Micro, 1970, 61(2): 205–218. DOI:10.1099/00221287-61-2-205 |
| [56] | Ren T, Amaral J A, Knowles R. The response of methane consumption by pure cultures of methanotrophic[J]. Revue Canad De Micro, 1997, 43(10): 925–928. DOI:10.1139/m97-133 |
| [57] | Shah N N, Hanna M L, Taylor R T. Batch cultivation of methylosinus trichosporium OB3b:V. Characterization of poly-beta-hydroxybutyrate production under methane-dependent growth conditions[J]. Biotechnol & Bioengineer, 1996, 49(2): 161–171. |
| [58] | Fei Q, Chang H N, Shang L, et al. Exploring low-cost carbon sources for microbial lipids production by fed-batch cultivation of cryptococcus albidus[J]. Biotechnol & Biopro Engineer, 2011, 16(3): 482–487. |
| [59] | Chang H N, Kim N J, Kang J, et al. Multi-stage high cell continuous fermentation for high productivity and titer[J]. Biopro & Biosyst Engineer, 2011, 34(4): 419–431. |
| [60] | Chang H N, Jung K, Choi J D, et al. Multi-stage conti-nuous high cell density culture systems:a review[J]. Biotechnol Adv, 2014, 32(2): 514–525. DOI:10.1016/j.biotechadv.2014.01.004 |
| [61] | Wen Z Y, Chen F. A perfusion-cell bleeding culture strategy for enhancing the productivity of eicosapentaenoic acid by Nitzschia laevis[J]. Appl Micro & Biotechnol, 2001, 57(3): 316–322. |
| [62] | Zlochower I A, Green G M. The limiting oxygen concentration and flammability limits of gases and gas mixtures[J]. J Loss Prevent Pro Indus, 2009, 22(4): 499–505. DOI:10.1016/j.jlp.2009.03.006 |
| [63] | Halim R, Danquah M K, Webley P A. Extraction of oil from microalgae for biodiesel production:A review[J]. Biotechnol Adv, 2012, 30(3): 709–732. DOI:10.1016/j.biotechadv.2012.01.001 |
| [64] | Soh L, Zimmerman J. Biodiesel production:the potential of algal lipids extracted with supercritical carbon dioxide[J]. Green Chem, 2011, 13(6): 1422–1429. DOI:10.1039/c1gc15068e |
| [65] | Toribio L, Bernal J L, Nozal M J, et al. Sequential supercritical fluid extraction of lipids. application to the obtention of the fatty acid profile of some genetically modified varieties of corn[J]. Food Analy Met, 2011, 4(2): 196–202. DOI:10.1007/s12161-010-9157-1 |
| [66] | Spence A J, Jimenezflores R, Qian M, et al. Evaluation of supercritical fluid extraction aids for optimum extraction of nonpolar lipids from buttermilk powder[J]. J Dairy Sci, 2009, 92(12): 5933–5936. DOI:10.3168/jds.2009-2286 |
| [67] | Burdette M D. Production of biodiesel-like components by the Type Ⅰ methanotroph methylomonas methanica[D]. Clemson: University of South Carolina, 2013. 35-53. https://tigerprints.clemson.edu/all_theses/2309/ |
| [68] | Furimsky E. Catalytic hydrodeoxygenation[J]. Appl Catal A Gener, 2000, 199(2): 147–190. DOI:10.1016/S0926-860X(99)00555-4 |
| [69] | Final Technical Report. Opportunities for biorenewables in oil refineries: Report of scientific technical Information[R]. USA, 2007. |
| [70] | Gutierrez A, Kaila R K, Honkela M L, et al. Hydrodeoxygenation of guaiacol on noble metal catalysts[J]. Catal Today, 2009, 147(3): 239–246. |
| [71] | Furimsky E, Massoth F E. Deactivation of hydroproces-sing catalysts[J]. Catal Today, 1999, 52(4): 381–495. DOI:10.1016/S0920-5861(99)00096-6 |
| [72] | He Z, Wang X. Hydrodeoxygenation of model compounds and catalytic systems for pyrolysis bio-oils upgrading[J]. Catal Sust Ener, 2012, 1(Jan): 28–52. |
| [73] | |
| [74] | Lin Y C, Li C L, Wan H P, et al. Catalytic hydrodeoxygenation of guaiacol on Rh-based and sulfided CoMo and NiMo catalysts[J]. Ener & Fuels, 2011, 25(3): 890–896. |
| [75] | Romero Y, Richard F, Brunet S. Hydrodeoxygenation of 2-ethylphenol as a model compound of bio-crude over sulfided Mo-based catalysts:Promoting effect and reaction mechanism[J]. Appl Catal B Envir, 2010, 98(3): 213–223. |
| [76] | Mortensen P M, Grunwaldt J D, Jensen P A, et al. A review of catalytic upgrading of bio-oil to engine fuels[J]. Appl Catal Gener, 2011, 407(1): 1–19. |
| [77] | Venderbosch R H, Ardiyanti A R, Wildschut J, et al. Stabilization of biomass-derived pyrolysis oils[J]. J Chem Technol & Biotechnol Biotechnol, 2010, 85(5): 674–686. |
| [78] | Vispute T P, Zhang H, Sanna A, et al. Renewable chemical commodity feedstocks from integrated catalytic processing of pyrolysis oils[J]. Science, 2010, 330(6008): 1222–1227. DOI:10.1126/science.1194218 |
 2018, Vol. 32
2018, Vol. 32