1, 4-丁炔二醇(BYD)作为重要的基础化工原料被广泛应用于石油加工, 聚合新材料, 合成树脂, 和医药、农药等领域.随着BYD下游聚酯新材料等产业的发展, 以及新的延伸产品的开发应用, 对BYD的需求快速增加, 呈现出蓬勃的发展势头[1-5].
工业上, BYD生产以甲醛、乙炔为原料(Reppe法)并采用Cu-Bi催化剂[6-7].按Cu-Bi存在形态的不同, 文献中报道了Bi掺杂的CuO粉体以及孔雀石类的无载体催化剂和以氧化物为载体的负载型CuO-Bi2O3催化剂[8-13].近年来, 我们从新型高效催化剂开发角度报道了以硅镁复合物气凝胶为载体的CuO-Bi2O3催化剂, 在上述催化剂中引入Fe3O4制备的可磁分离催化剂, 及包覆SiO2壳层的CuO-Bi2O3催化剂, 这些催化剂催化性能均有显著提高[11, 14-15].上述催化剂中Cu2+原位转变为炔化亚铜活性物种后方具有催化性能[16-18].为了解决Cu2+还原过程消耗反应原料甲醛及还原过程难以控制, 易生成金属铜导致乙炔聚合, 造成催化剂失活等问题.我们围绕Cu2O基催化剂的制备, 通过Cu2O制备过程中沉淀剂浓度的调变或借助载体效应调控了Cu2O的结晶度及Cu+的化学环境, 使Cu2O中Cu+不经进一步还原直接转变为炔化亚铜活性物种, 催化剂表现出较高的炔化性能[19-20].除了载体性能、沉淀剂浓度以外, 其他制备条件, 如沉淀剂及还原剂的引入方式等同样对制备的Cu2O结构产生影响[21], 并可能进一步影响其甲醛乙炔化性能.
采用液相还原法, 通过改变沉淀剂NaOH及还原剂抗坏血酸钠的引入顺序, 制备了不同结构的Cu2O, 研究了Cu2O结构对催化甲醛乙炔化反应性能的影响规律, 为高效炔化催化剂的开发提供参考.
1 实验部分 1.1 催化剂制备称取所需量Cu(NO3)2·3H2O溶解于去离子水中, 配置成Cu2+浓度为0.125 mol /L的水溶液, 取100 mL上述溶液与100 mL PEG-600混合均匀.在30 ℃强搅拌条件下快速加入150 mL NaOH溶液(1.67 mol /L), 以1.25 mL /min的速率滴加0.25 mol /L的L-抗坏血酸钠溶液300 mL.待滴加完成后保持条件不变继续搅拌30 min, 后静置老化1 h.产物经离心、洗涤后在60 ℃的真空环境中干燥4 h, 样品记为Cu2O(1).在上述条件中, 改变NaOH的添加顺序, 先加入L-抗坏血酸钠溶液, 磁力搅拌5 min后, 再加入NaOH溶液, 其他条件不变, 所得样品标记为Cu2O(3), 将NaOH溶液和L-抗坏血酸钠溶液混合后加入, 其他条件不变, 所得样品标记为Cu2O(2).
1.2 催化剂表征样品的XRD表征采用德国Bruker D8 Advance型X射线粉末衍射仪, 使用Cu Kα (λ=0.154 06 nm)辐射源, 40 kV, 40 mA条件, 2θ的范围为10°~ 80°, 扫描速率为0.1°·s-1.拉曼光谱(Raman spectra)在Horiba Soiontific LabRam HR Evolution型紫外共焦拉曼光谱仪上进行测试, 使用波长为532 nm的激光光源, 功率0.08 mV. FT-IR表征利用Thermo Fisher Nicolet iS50型傅里叶变换红外光谱仪, 分辨率为4 cm-1, 扫描次数64次, 溴化钾稀释样品压片.俄歇电子能谱(XAES)在日本岛津Kratos公司生产的AXIS ULTRA DLD型多功能电子能谱仪上测定, Al Kα作为激发光源, 样品分析区域为700 μm×300 μm, X射线工作功率为150 W. H2-TPR表征采用美国Micromeritics AutoChem Ⅱ 2920化学吸附仪, 30 mg催化剂装入样品管中, 在200 ℃下N2吹扫0.5 h, 降温至30 ℃, 通入H2/N2体积比为5:95的混合气40 mL·min-1, 待基线走平后, 以10 ℃·min-1的速率升温至500 ℃, 采用TCD检测耗氢量.
1.3 催化剂性能评价催化剂性能评价采用自建的模拟淤浆床反应装置, 取催化剂2.5 g与39%的甲醛水溶液50 mL, 置于100 mL三口圆底烧瓶中, 通入N2吹扫20 min升温至90 ℃后, 改通C2H2开始反应, 在反应过程中每隔2 h取0.5 mL样品进行分析.催化剂稳定性实验反应时间为8 h, 过滤出反应液后, 将催化剂加入圆底烧瓶中, 并补加0.2 g新鲜催化剂重新进行评价.采用Agilent 7890A型气相色谱仪进行组份分析, 1, 4-丁二醇作内标物, 色谱柱选用DB-5(0.32 mm × 50 m), 柱室温度采用程序升温, 先在100 ℃保持4 min, 后以15 ℃/min升温至180 ℃, 保持8 min, FID检测器, 检测室温度300 ℃, 汽化室250 ℃.反应完毕后溶液中残留甲醛含量采用碘量法测定[5].
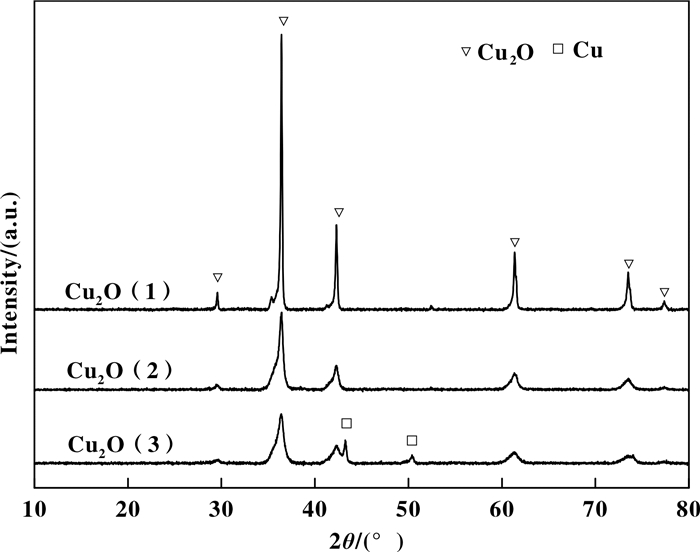
2 结果及讨论 2.1 催化剂结构分析由图 1 Cu2O样品的XRD图可以看出, 所制备的3种Cu2O均在2θ = 29.6 °、36.5 °、42.4°、61.4°、73.6°、77.4°处出现Cu2O的特征衍射峰, 分别对应于Cu2O的(110)、(111)、(200)、(220)、(311)、(222)晶面, 这与立方相Cu2O标准图谱(JCPDS卡片, 编号05-0667)吻合.对比各催化剂, Cu2O衍射峰强度存在明显差异, 先加入NaOH, 后滴加L-抗坏血酸钠制备的Cu2O(1)样品, Cu2O衍射峰强度最大, 表明此方法制备的Cu2O结晶较为完整, 晶粒尺寸较大. Cu2O(2)样品中Cu2O衍射峰强度变弱, 表明Cu2O结晶性变差, 分散度提高.而Cu2O(3)样品除表现为结晶度较差的Cu2O以外, 在2θ = 43.2°、50.4°处出现了金属Cu的特征衍射峰.由文献[21]可知, 溶液体系中Cu2O粒子的形成经历了先生成Cu的碱式盐, 被还原为Cu+, 并进一步分解形成Cu2O的过程: Cu2+→Cu(OH)2→Cu2O.在Cu(NO3)2体系中, 先加入NaOH, 过量的OH-促使生成大晶粒的Cu(OH)2, 后期L-抗坏血酸钠在240 min内缓慢滴加, 使得开始生成的Cu2O核数量少, 相对粒子的生长时间延长, 大晶粒的Cu(OH)2逐渐转变为大晶粒的Cu2O.先滴加L-抗坏血酸钠, 后加入NaOH, 过量的还原剂接触Cu2+ 导致部分Cu2+过度还原为金属铜. NaOH和L-抗坏血酸钠混合均匀后滴加, 体系中硝酸铜大量存在, OH-很快被Cu2+消耗, 整个反应体系接近中性, 低的OH-浓度不影响晶体各面的生长速度, 所得Cu2O结晶度较低, 分散性较好.
|
图 1 不同方法制备Cu2O催化剂的XRD图 Fig.1 XRD patterns of Cu2O catalysts prepared with different methods |
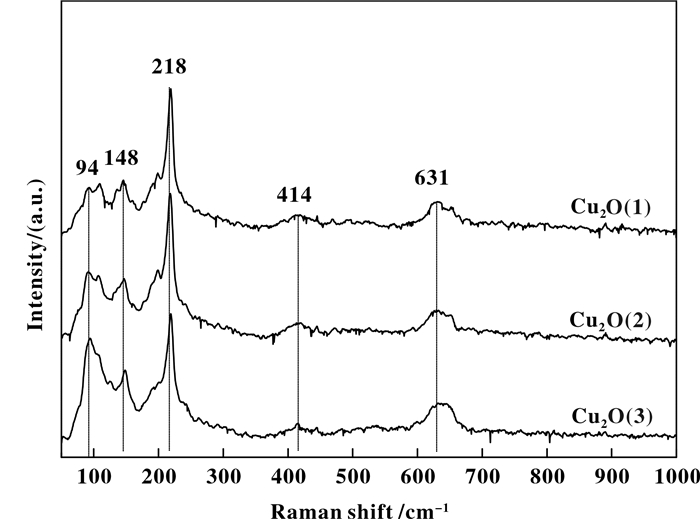
图 2为不同方式制备Cu2O样品的Raman图谱.Cu2O有6种振动模式, Γ = F2g + 2F1u + F2u + Eu + A2u.理论上, 具有拉曼活性的完整Cu2O晶体, 只表现出F2g振动模式.但催化剂的晶格缺陷, 将激发出一些非拉曼活性的振动模式, 据此可以鉴别Cu2O物种[22-23]. 图 2中, 在94、148、218、414和631 cm-1处的拉曼位移均来源于Cu2O[24].对比3种Cu2O拉曼峰强度可以发现, 强度差别不大, 表明3种样品的表面性质相近, 均呈现结晶较为完整的Cu2O结构.结合XRD对Cu2O样品体相结晶度表征的结果, 可以推测3种方式制备的Cu2O结构不均一, Cu2O(1)样品表现为内外结晶度均较高的Cu2O晶粒, Cu2O(2)与Cu2O(3)则表现为表面结晶完整, 而晶粒内部结晶度差的结构特征.
|
图 2 Cu2O催化剂的Raman谱 Fig.2 Raman spectra of Cu2O catalysts |
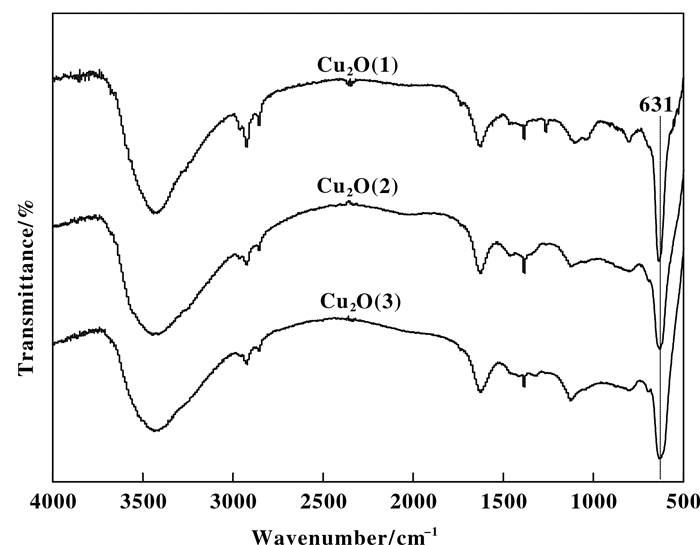
图 3为不同方式制备Cu2O样品的FT-IR谱图, 由图可知, 3种Cu2O样品均在631 cm-1处出现Cu2O的特征峰, 归属于Cu—O键伸缩振动[25].在3410和1630 cm-1附近出现的吸收区域分别归属于O—H键伸缩振动与弯曲振动; 在2800~3000 cm-1及700~1500 cm-1两处出现了明显的吸收带, 分别归属于饱和C—H键的伸缩振动和C—O键的伸缩振动, 表明3种Cu2O样品粒子表面都残存着少量的有机分子, 如未反应的L-抗坏血酸钠、反应后的L-抗坏血酸钠氧化产物及分散剂PEG等.
|
图 3 Cu2O催化剂的FT-IR谱 Fig.3 FT-IR spectra of Cu2O catalysts |
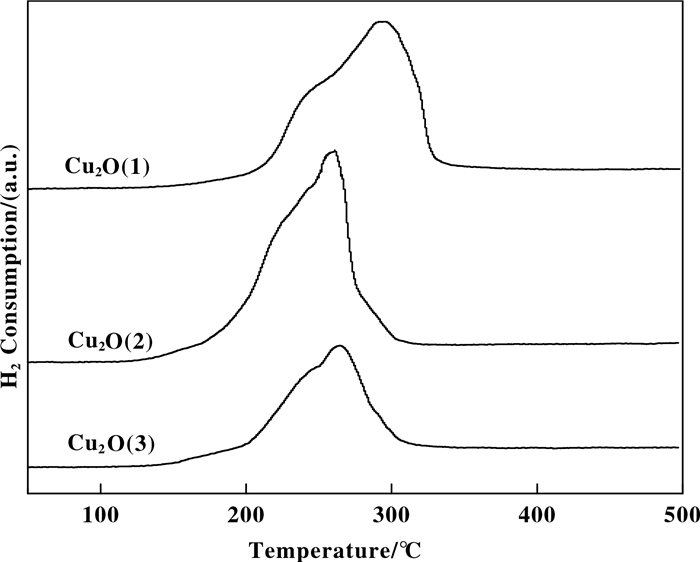
Cu2O样品的还原性能采用H2-TPR进行表征.如图 4所示, Cu2O(2)与Cu2O(3)表现为相似峰形与峰位置, 均在140~320 ℃范围内, 表现为峰顶温度为265 ℃的主耗氢峰及225 ℃左右的还原肩峰. Cu2O(1)还原峰明显向高温区迁移, 在160至330 ℃的范围内出现峰顶温度300 ℃的主耗氢峰, 以及235 ℃处的明显肩峰.
|
图 4 Cu2O催化剂的TPR图 Fig.4 TPR profiles of Cu2O catalysts |
Cu2O物种的还原是Cu+转变为Cu0的过程, 但从动力学角度分析, 包括表面诱导反应与体相迁移两个阶段.表面诱导阶段受催化剂表面Cu+电子组态、氧空穴及表面缺陷等的影响, Cu2O表现为不同的起始还原行为.体相迁移阶段受Cu2O晶粒尺寸及晶格参数影响较大, 通过影响活性H或H2以及体相O的迁移, 从而使Cu2O表现为不同的还原温度[26-29].
结合样品的XRD、Raman表征, 可以推测Cu2O的TPR行为差异由Cu2O结晶程度、晶粒尺寸决定, 3种样品表面结晶度相近, 存在相同的缺陷位, 与H2的接触面相同, 导致还原峰的起始温度均为150 ℃左右.随着活性H原子逐渐向体相迁移, Cu2O(2)及Cu2O(3)内部结晶度较差, 粒径小, 表现为低的还原温度. Cu2O(1)样品体相Cu2O晶型完整, 粒径较大, 阻碍了活性H向体相内的迁移, 表现为高的还原温度.
从3个样品的还原峰面积来看, Cu2O(3)样品还原峰面积明显低于Cu2O(1)与Cu2O(2), 归因于Cu2O(3)样品中部分金属Cu的存在.金属Cu作为活化H2的活性中心, 理论上可以降低Cu2O(3)的初始还原温度, 但从图 4的H2-TPR中, 未观察到Cu2O(3)出现较Cu2O(2)更低的还原温度, 推测金属Cu处于Cu2O样品的体相结构, 而非表面, 未发挥其在表面还原阶段活化H2的作用.这一推测可由Cu2O(3)具有与其他样品相似的Raman谱图进一步印证.
3 催化剂活性评价催化性能评价结果见表 1.由表 1可以看出, 经8 h的甲醛乙炔化反应, Cu2O(2)催化剂上甲醛转化率、1, 4-丁炔二醇选择性与收率分别为80.4%、89.2%与71.7%, 明显高于Cu2O(3)样品的54.1%、75.3%与40.7%, 以及Cu2O(1)样品的70.3%、80.1%与56.3%.在3种Cu2O样品中, Cu2O(2)样品具有最高的催化性能.
| 表 1 Cu2O催化剂的评价结果 Table 1 Catalytic performance of Cu2O catalysts |
在甲醛乙炔化反应中, 甲醛可转化为丙炔醇及1, 4-丁炔二醇(BYD), 反应方程式为:
| $ C{{H}_{2}}O+{{C}_{2}}{{H}_{2}}\to HC\equiv CC{{H}_{2}}OH\xrightarrow{C{{H}_{2}}O}HOC{{H}_{2}}C\equiv CC{{H}_{2}}OH $ |
在色谱数据中未检测到副产物丙炔醇, 仅观察到BYD存在.因此, 在Cu2O催化剂中, 甲醛与乙炔的反应仅生成了目标产物BYD.但从表 1可以看出, BYD的选择性均达不到100%, 也就是说BYD并非甲醛转化的唯一产物.基于对反应过程的深入分析, 我们认为甲醛存在其他的转化方式, 一是甲醛作为还原剂用于Cu2O的还原, 自身转变为甲酸; 另一方面是甲醛自聚为多聚甲醛.甲醛与甲酸在气相色谱中具有极低的响应信号, 而多聚甲醛通常以固体形式析出, 沉积在催化剂表面, 均难采用色谱分析确定其生成量.但从BYD的选择性体现了甲醛的这些消耗量.可以看出, 3种催化剂的BYD选择性由小到大的顺序为: Cu2O(3) < Cu2O(1) < Cu2O(2), 表明Cu2O(3)中有最多的甲醛用于Cu2O的还原或转化为聚甲醛, 而Cu2O(1)中更多的甲醛转变为目标产物BYD.
直接以BYD收率作为评判催化剂性能的参数, 随反应时间延长, BYD收率的变化曲线示于图 5.可以看出催化剂的BYD收率随时间延长, 均有不同程度的提高.当反应时间为8 h, Cu2O(2)样品的BYD收率为70.5%, 高于Cu2O(1)和Cu2O(3)的BYD收率, 分别为55.3%和40.1%.当反应时间进一步增加到12 h时, 3个催化剂上BYD的收率均明显增大, Cu2O(2)样品达到86.8%, Cu2O(1)和Cu2O(3)样品分别达到72.7%和48.7%. Cu2O(2)的催化性能明显优于Cu2O(1)和Cu2O(3)的催化反应性能.
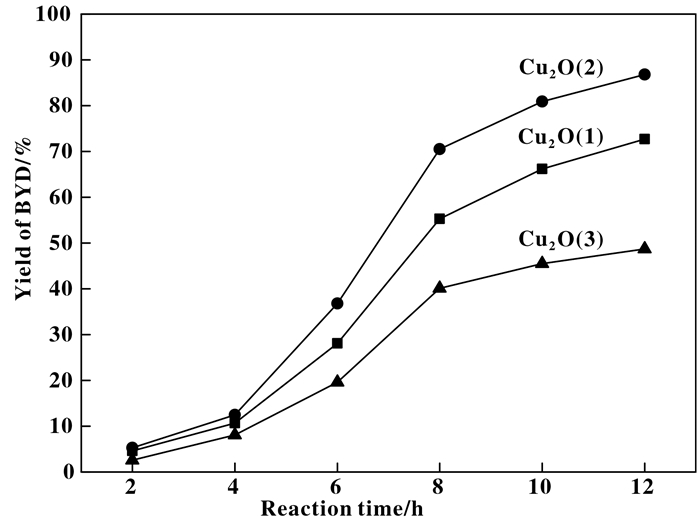
|
图 5 反应时间对催化性能的影响 Fig.5 Effect of reaction time on catalytic performance of catalysts Reaction conditions: catalyst amount 2.5 g; HCHO amount 50 mL; C2H2 30 mL/min; reaction temperature 90 ℃; reaction time 12 h |
进一步对催化剂的稳定性进行考察, 循环结果示于图 6, 由图可知, 随着评价次数的增加, 所有催化剂上1, 4-丁炔二醇的收率都发生下降. Cu2O(1)和Cu2O(3)催化剂1, 4-丁炔二醇的收率下降尤为明显, 分别由56.3%下降至38.3%以及由40.7%下降至15.4%, 而Cu2O(2)催化剂1, 4-丁炔二醇收率由71.7%左右下降至56.5%左右, 且在第4次循环实验才表现出明显的下降趋势.表明Cu2O(2)催化剂较Cu2O(1)和Cu2O(3)催化剂使用稳定性得到了提高.
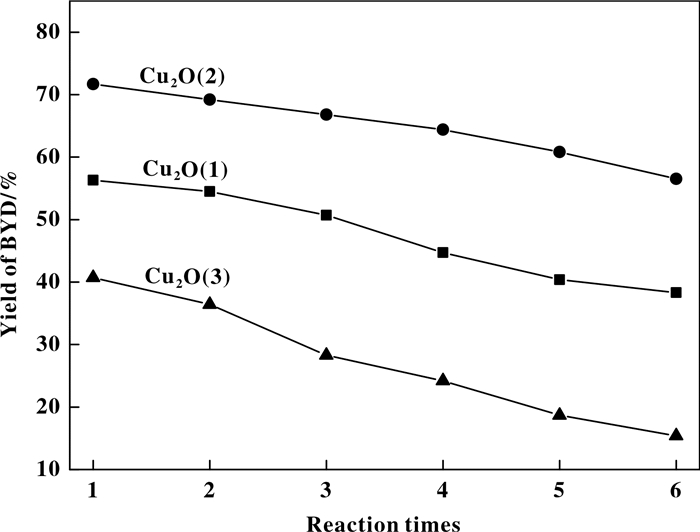
|
图 6 催化剂的循环套用实验 Fig.6 Cyclic test of catalyst Reaction conditions: catalyst amount 2.5 g; HCHO amount 50 mL; C2H2 30 mL/min; reaction temperature 90 ℃; reaction time 8 h |
结合上述表征结果分析, 3种催化剂表现出不同炔化性能的原因在于Cu2O是否有效转变成炔化亚铜活性物种. Cu2O(2)中Cu2O结晶度及晶粒尺寸适中, 表现为适宜的还原性, 在甲醛乙炔化反应中易高效转变为炔化亚铜活性物种, 并暴露出高的活性比表面, 具有最优的催化性能. Cu2O(1)具有完整的Cu2O晶型, 并表现为大的晶粒尺寸, 在原位反应中转化成的炔化亚铜暴露出较少的活性比表面, 从而表现出低的炔化性能.而Cu2O(3)样品中存在少量金属铜, 导致生成的炔化亚铜较少, 且金属Cu易催化生成聚炔副产物, 因而催化性能最低.
上述推测进一步被反应6次后样品的XRD图(图 7)所证实.由图可知, 3种样品Cu2O物种均消失, 出现了金属Cu的特征衍射峰, 且峰强度存在明显差异. Cu2O(3)表现为尖锐的、峰强度较大的金属Cu衍射峰, 表明大量Cu2O被甲醛还原为非活性的金属Cu, 相应的转化为无定形炔化亚铜活性物种的量减少; 而Cu2O(1)和Cu2O(2)中仅有少量的非活性金属Cu, 表明仅有少量的Cu2O被还原为非活性金属Cu, 其余Cu2O转变为无定形炔化亚铜活性物种.
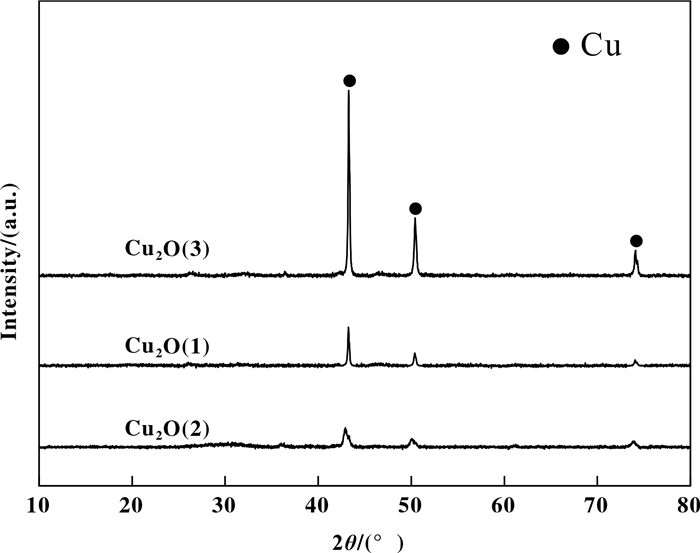
|
图 7 6次循环后Cu2O催化剂的XRD图 Fig.7 XRD patterns of Cu2O catalysts after 6 cycles |
XAES通常被用于区分Cu0和Cu+. 图 8为使用6次后Cu2O催化剂的Cu LMM俄歇能谱, 由图可知, 所有催化剂都在910~925 eV之间存在一个宽阔的动能峰, 经过分峰拟合可分成两个位于916.2和918.6 eV的对称峰, 分别对应于Cu+和Cu0.其中, Cu2O(3)样品表面Cu0含量最高, Cu2O(2)样品表面Cu0含量最低, 这与反应6次以后催化剂的XRD图一致.金属铜的生成是由于部分活性物种被甲醛过度还原所致, 一方面可导致活性位点减少[30-31]; 另一方面促进了聚炔等副产物的生成, 聚炔沉积在催化剂表面, 覆盖了活性Cu+位点, 从而导致1, 4-丁炔二醇的收率下降.
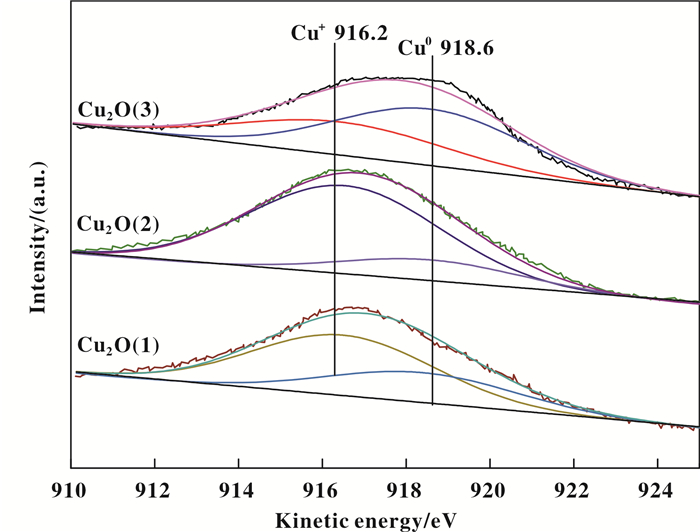
|
图 8 6次循环后Cu2O催化剂的Cu LMM俄歇能谱 Fig.8 Cu LMM XAES spectra of Cu2O catalysts after 6 cycles |
通过改变液相还原过程中沉淀剂NaOH及还原剂抗坏血酸钠的添加顺序, 有效调变了Cu2O的结晶度及晶粒尺寸.先加抗坏血酸钠溶液, 后加NaOH溶液, Cu2O结晶不完整, 粒径较小, 同时样品中存在金属Cu, 可催化产生大量聚炔副产物, 聚炔等副产物的生成会覆盖活性中心, 使得活性中心暴露数量减少, 进而表现出低的催化性能; 先加NaOH溶液, 后加抗坏血酸钠溶液, 造成Cu2O的快速结晶, 形成的颗粒尺寸较大, 大颗粒的Cu2O在转变为炔化亚铜活性物种时, 暴露的活性位点较少, 催化剂也表现出较差的催化性能; 滴加NaOH溶液与抗坏血酸钠的混合溶液制备的Cu2O, 由于具有适宜的结晶度及粒径尺寸, 转变为高分散、高活性比表面大的炔化亚铜活性物种, 炔化性能最优.
| [1] |
a. Li H T, Zhao Y X, Gao C G, et al. Study on deactivation of Ni/Al2O3 catalyst for liquid phase hydrogenation of crude 1, 4-butanediol aqueous solution[J]. Chem Eng J, 2012, 181/182: 501-507. b. Li Hai-tao(李海涛), Hao Quan-ai(郝全爱), Wang Zhi-peng(王志鹏), et al. Study on catalytic performance of CuO-ZnO catalyst prepared by different precipitants(不同沉淀剂制备CuO-ZnO催化剂甲醛乙炔化反应性能)[J]. J Mol Catal(China)(分子催化), 2019, 33(2): 124-131. c. Tian Ya-ni(田亚妮), Zhao Fang(赵芳), Wang Chang-zhen(王长真), et al. Effect of Cu additive on the hydrogenation of 1, 4-Butynediol over Ni-Cu/SiO2 bimetallic catalyst (Cu对Ni-Cu/SiO2催化1, 4-丁炔二醇加氢性能的影响)[J]. J Mol Catal(China)(分子催化), 2019, 33(2): 132-139. |
| [2] |
a. Wang Z P, Niu Z Z, Hao Q A, et al. Enhancing the ethynylation performance of CuO-Bi2O3 nanocatalysts by tuning Cu-Bi interactions and phase structures[J]. Catalysts, 2019, 9(35): 1-18. b. Zhao Fang(赵芳), Wang Chang-zhen(王长真), Tian Ya-ni(田亚妮), et al. Metal promoter effect of Ni-M/SiO2 in hydrogenation of 1, 4-butynediol(Ni-M/SiO2催化1, 4-丁炔二醇加氢的金属助剂效应)[J]. J Mol Catal(China)(分子催化), 2019, 33(1): 83-89. c. Liao Xin(廖欣), Zhang Yin(张因), Li Hai-tao(李海涛), et al. CeO2 prepared in N2 atmosphere and supported Ni-based catalyst for hydrogenation of maleic anhydride(氮气气氛下焙烧的CeO2载体负载Ni基催化剂的顺酐加氢性能研究)[J]. J Mol Catal(China)(分子催化), 2017, 31(1): 53-60. |
| [3] | Guo Jiang-yuan(郭江渊), Li Hai-tao(李海涛), Zhang Zhi-long(张智隆), et al. Effect of surface acidity on Ni/SiO2-Al2O3 catalyst performance for 1, 4-butynediol hydrogenation(表面酸性对Ni/SiO2-Al2O3催化剂催化1, 4-丁炔二醇高压加氢性能的影响)[J]. J Mol Catal (China)(分子催化), 2016, 30(1): 37–45. |
| [4] | Liu Lin-li(刘琳丽), Li Hai-tao(李海涛), Wang Chang-zhen(王长真), et al. Effect of Supports on the hydrogenation of 1, 4-butynediol over supported Ni catalyst(负载Ni催化剂上1, 4-丁炔二醇加氢反应的载体效应研究)[J]. J Mol Catal (China)(分子催化), 2018, 32(2): 99–106. |
| [5] | Wang Zhi-peng(王志鹏), Niu Zhu-zhu(牛珠珠), Ban Li-jun(班丽君), et al. Formaldehyde ethynylation reaction over Cu2O supported on TiO2 with different phases(不同晶相TiO2负载Cu2O催化甲醛乙炔化反应)[J]. Chem J Chin Univer(高等学校化学学报), 2019, 40(2): 334–341. |
| [6] | Duncanson I T, Sutherland I W, Cullen B, et al. The hydrogenation of 2-butyne-1, 4-diol over a carbon-supported palladium catalyst[J]. Catal Lett, 2005, 103(3): 195–199. |
| [7] | Telkar M M, Rode C V, Jaganathan R, et al. Platinum catalyzed hydrogenation of 2-butyne-1, 4-diol[J]. J Mol Catal A:Chem, 2002, 187(1): 81–93. DOI:10.1016/S1381-1169(01)00457-5 |
| [8] | Wang Zhi-peng(王志鹏), Niu Zhu-zhu(牛珠珠), Ban Li-jun(班丽君), et al. The influence of N doping on TiO2 supported Cu based catalyst for formaldehyde ethynylation(N掺杂对TiO2负Cu基催化剂甲醛乙炔化性能的影响)[J]. J Shanxi Nor Univer(Nat Sci Edit)(陕西师范大学学报), 2019, 47(1): 99–106. |
| [9] | Gao Yu-ming(高玉明), Tian Heng-shui(田恒水), Zhu Yun-feng(朱云峰). Catalytic synthesis on 1, 4-butynediol by CuO-Bi2O3 particles(CuO-Bi2O3粉体催化合成1, 4-丁炔二醇的研究)[J]. Guangdong Chem Indus(广东化工), 2008, 35(9): 53–55. DOI:10.3969/j.issn.1007-1865.2008.09.019 |
| [10] | Jiang Jian(蒋健), Lin Shen(林深), Liu Chun-lian(刘春莲). Preparation and catalytic activity of Cu/Bi2O3 nanoparticles(纳米CuO/Bi2O3粉体的制备及催化性能)[J]. Chin J Syn Chem(合成化学), 2005, 13(1): 45–48. DOI:10.3969/j.issn.1005-1511.2005.01.010 |
| [11] | Zheng Yan(郑艳), Sun Zi-jin(孙自瑾), Wang Yong-zhao(王永钊), et al. Preparation of CuO-Bi2O3/SiO2-MgO catalyst and its ethynylation performance(CuO-Bi2O3/SiO2-MgO催化剂的制备及炔化性能)[J]. J Mol Catal (China)(分子催化), 2012, 26(3): 233–238. |
| [12] | Yang G H, Xu Y B, Su X T, et al. MCM-41 supported CuO/Bi2O3 nanoparticles as potential catalyst for 1, 4-butynediol synthesis[J]. Ceram Int, 2014, 40(3): 3969–3973. DOI:10.1016/j.ceramint.2013.08.044 |
| [13] | Luo Ping(罗平), Zhao Xin-ming(赵新明), Li Hai-xia(李海侠), et al. Research of EQ-201 acetylene catalyst in reppe synthesizing 1, 4-butynediol(Reppe法合成1, 4-丁炔二醇EQ-201型炔化催化剂的研究)[J]. Chem Engineer Des Commun(化工设计通讯), 2012, 38(5): 87–93. DOI:10.3969/j.issn.1003-6490.2012.05.026 |
| [14] | Wang Jun-jun(王俊俊), Li Hai-tao(李海涛), Ma Zhi-qiang(马志强), et al. Preparation of magnetic CuO-Bi2O3/Fe3O4-SiO2-MgO catalyst and its catalytic performance for formaldehyde ethynylation(磁性CuO-Bi2O3/Fe3O4-SiO2-MgO催化剂的制备及甲醛乙炔化性能)[J]. J Chem Indus Engineer(化工学报), 2015, 66(6): 2098–2104. |
| [15] | Ma Zhi-qiang(马志强), Zhang Hong-xi(张鸿喜), Li Hai-tao(李海涛), et al. Preparation of core-shell CuO-Bi2O3@meso-SiO2 catalyst and its catalytic performance for formaldehyde ethynylation(核壳结构CuO-Bi2O3@meso-SiO2催化剂的制备及甲醛乙炔化性能)[J]. Indus Catal(工业催化), 2015, 23(5): 344–348. DOI:10.3969/j.issn.1008-1143.2015.05.003 |
| [16] | Luo Min(罗敏), Li Hai-tao(李海涛), Ma Zhi-qiang(马志强), et al. Researches on activation process of CuO-Bi2O3/SiO2-MgO catalyst in formaldehyde ethynylation reaction(甲醛乙炔化反应中CuO-Bi2O3/SiO2-MgO催化剂活化过程研究)[J]. Indus Catal(工业催化), 2014, 22(5): 363–368. DOI:10.3969/j.issn.1008-1143.2014.05.007 |
| [17] | Hort E V, Piscataway N J. Ethynylation catalyst and method of production alkynols by low pressure reactions, US 3920759[P]. 1975-11-18. |
| [18] | Wang Jun-jun(王俊俊), Zhang Hong-xi(张鸿喜), Li Hai-tao(李海涛), et al. Effect of iron promoter on structure and catalytic performance of CuO/SiO2-MgO catalyst for formaldehyde ethynylation(Fe助剂对CuO/SiO2-MgO催化剂结构和甲醛乙炔化性能的影响)[J]. Indus Catal(工业催化), 2015, 23(6): 455–458. DOI:10.3969/j.issn.1008-1143.2015.06.008 |
| [19] | Yang Guo-feng(杨国峰), Li Hai-tao(李海涛), Zhang Hong-xi(张鸿喜), et al. Effect of NaOH concentration on structure and catalytic performance of Cu2O for formaldehyde ethynylation(NaOH浓度对Cu2O结构及甲醛乙炔化性能的影响)[J]. J Mol Catal (China)(分子催化), 2016, 30(6): 540–546. |
| [20] | Li Hai-tao(李海涛), Niu Zhu-zhu(牛珠珠), Yang Guo-feng(杨国峰), et al. Support effect of Cu2O/TiO2 employed in formaldehyde ethynylation(Cu2O/TiO2催化甲醛乙炔化反应的载体效应)[J]. J Chem Indus Engineer(化工学报), 2018, 69(6): 2512–2518. |
| [21] | Zhao Hua-tao(赵华涛), Wang Dong(王栋), Zhang Lan-yue(张兰月), et al. A simple method for the preparation of Cu2O with different morphologies in high reaction concentration(高反应浓度下制备不同形貌氧化亚铜的简易方法)[J]. Chem Inorg J Chin(无机化学学报), 2009, 29(1): 142–146. DOI:10.3321/j.issn:1001-4861.2009.01.025 |
| [22] | Dawson P, Hargreave M M, Wilkinson G R. The dielectric and lattice vibrational spectrum of cuprous oxide[J]. J Phys Chem Sol, 1973, 34(12): 2201–2208. DOI:10.1016/S0022-3697(73)80067-8 |
| [23] | Singhal A, Pai M R, Rao R, et al. Copper(Ⅰ) oxide nanocrystals one step synthesis, characterization, formation mechanism and photocatalytic properties[J]. Euro J Inorg Chem, 2013, 2013(14): 2640–2651. DOI:10.1002/ejic.201201382 |
| [24] | Ren D, Deng Y L, Handoko A D, et al. Selective electrochemical reduction of carbon dioxide to ethylene and ethanol on copper(Ⅰ) oxide catalysts[J]. ACS Catal, 2015, 5(5): 2814–2821. DOI:10.1021/cs502128q |
| [25] | Kaviyarasan K, Anandan S, Mangalaraja , et al. Sono chemical synthesis of Cu2O nanocubes for enhanced chemiluminescence applications[J]. Ultrason Sono Chem, 2016, 29: 388–393. DOI:10.1016/j.ultsonch.2015.10.018 |
| [26] | Kim J Y, Rodriguez J A, Hanson J C, et al. Reduction of CuO and Cu2O with H2:H embedding and kinetic in the formation of suboxides[J]. J Am Chem Soc, 2003, 125(35): 10684–10692. DOI:10.1021/ja0301673 |
| [27] | Rodriguez J A, Hanson J C, Frenkel A I, et al. Experimental and theoretical studies on the reaction of H2 with NiO:Role of O vacancies and mechanism for oxide reduction[J]. J Am Chem Soc, 2002, 124(2): 346–354. DOI:10.1021/ja0121080 |
| [28] | Delmon B, Thomas J M, Bell R G, et al. Handbook of heterogeneous catalysis[M]. Germany: Wiley-VCH Verlag Gmbh, 1997. |
| [29] | Kung H H. Studies in surface science and catalysis[M]. Netherlands: Elsevier, 1989. |
| [30] | Gupte S P, Jadkar P B, Chaudhari R V. Kinetics of ethynylation of formaldehyde to butynediol[J]. React Kinet Catal Lett, 1984, 24(1/2): 173–177. |
| [31] | Tamhankar S S, Gupte S P, Chaudhari R V. Kinetics of a non-catalytic slurry reaction:reaction of acetylene with cuprous oxide suspended in water[J]. Chem Eng J, 1981, 22: 15–24. DOI:10.1016/0300-9467(81)85002-2 |
 2019, Vol. 33
2019, Vol. 33


