2. 中国科学院大学, 北京 100049;
3. 兰州大学 化学化工学院, 甘肃 兰州 730000
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. College of Chemistry and Chemical Engineering, Lanzhou University, Lanzhou 730000, China
Suzuki-Miyaura反应是有机硼试剂与有机卤化物在钯或镍催化下, 并且在碱的存在下发生的交叉偶联反应, 在有机化学中已经成为构建C—C键最常用的工具之一, C—C键的形成是合成许多双环芳烃的关键步骤.与钯催化的其他交叉偶联反应相比[1], Suzuki反应的明显优势包括: (1)反应条件温和; (2)有机硼试剂的现成可用性, 它们对水和相关溶剂以及空气中的氧都是惰性的, 且热稳定性好; (3)对底物的普适性较好; (4)原料和副产物毒性低.这些特性使研究人员能够将其应用于从天然产物合成到高分子材料开发的广泛领域, 尤其是合成的不同取代的双环芳烃是天然产物、药物和先进材料等许多复杂分子的基本骨架[2-3].由于Suzuki反应在各种药物合成中的巨大贡献, 2010年9月日本科学家铃木章教授因为钯催化的有机合成交叉偶联反应[4]而获得诺贝尔化学奖.
近年来, Suzuki偶联反应发生经过不断地研究和发展, 研究方向多分为以下几个方面: (1)改变反应条件使反应能耗降低, 同时达到高产率和高选择性并且使用环境友好的溶剂; (2)研究合成出新的配体, 并利用配体地特性来控制Suzuki偶联反应的立体、区域和化学选择性; (3)优化催化剂, 均相催化方面研究无配体催化剂的方法; (4)研究了许多可以重复使用的新型高活性多相催化剂[4-7].随之发展的多相催化剂不需要使用磷配体, 对空气和水分不敏感, 在较短的反应时间内和较温和条件下可以得到高收率的偶联产物, 因此, 多相催化提供了一种更高效和经济的方法来进行偶联反应.之前的研究表明, Suzuki偶联反应的催化剂主要有两大类Pd类, Ni类, 前者可用于含水体系, 耐受很多的官能团, 后者在反应中必需是无水无氧的.
在这篇文章中, 我们主要介绍Suzuki偶联反应中催化剂绿色化多相化的一些研究进展.我们所讨论的催化体系主要分为两大类, 均相催化剂和非均相催化剂.
1 均相催化Suzuki反应均相催化体系由于所有的反应物、试剂和催化剂都溶解在相同的反应介质中, 有利于扩大反应范围并且大规模生产, 因此在工业催化中具有很大的吸引力.大多数均相催化体系活性高, 选择性强, 但热稳定性有限, 从反应混合物中除去均相催化剂需要一个繁琐的过程.
1.1 无配体均相催化Suzuki反应Suzuki偶联反应的均相催化通常是由有机溶剂中与各种配体的可溶性钯(Pd)配合物催化的, 螯合膦钯配合物和含磷钯环在这些催化剂的研究中最常见, 许多这种均相催化过程由于其高活性和选择性而成为化学家们的首选, 但它们在从最终反应产物中分离催化剂方面存在很大的困难.由于Suzuki偶联反应的均相催化剂一般需要配体、溶剂和助剂等, 而这些在反应中会产生大量的有机废物, 因此有大量的研究致力于不需要配体的催化剂或反应过程不需要有机溶剂. Bugamen等[8]通过在惰性条件下的水中进行反应, 开发了一种无配体Suzuki Miyaura交叉偶联反应的一种新方法, 最近, 还有报道利用Pd(OAc)2作为催化剂, 在甲苯[9]、水丙酮[10]、PEG 300[11]、水乙醇[12]中偶联芳基卤化物和芳基硼酸的高效无配体方案[13].费平等[14]报道了钯催化苯胺与芳基硼酸的交叉偶联反应, 在室温下不需要配体、碱和盐的帮助(如图 1).在甲醇中, 反应中必须的氧化加成步骤将Pd(OAc)2转化为携带OMe或OAc作为配体的Pd(0)L2配合物, 因此再不需要其他配体的帮助, 供电子基团底物的Suzuki反应产率较高.而对于没有邻位取代基的底物, 反应钯配合物缺乏伪装的供电子配体, 其产率明显较低.
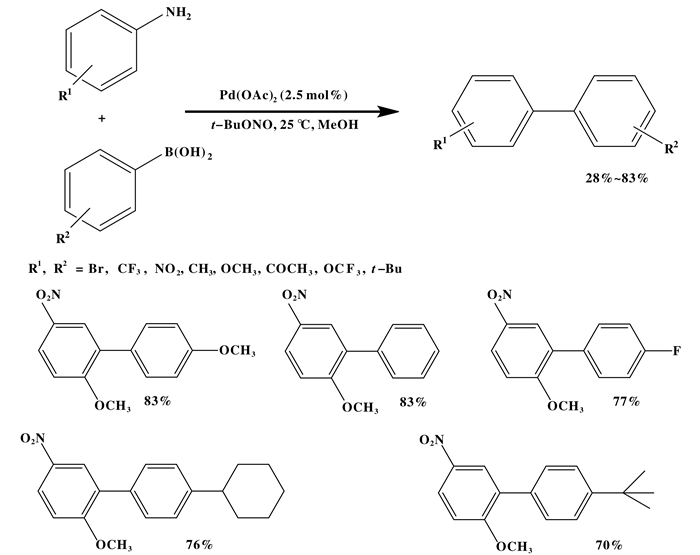
|
图 1 无配体醋酸钯催化Suzuki反应 Fig.1 Suzuki reaction catalyzed by palladium acetate without ligands |
Wang等[15]报道了PdCl2催化的Suzuki偶联反应, 其产率为80%~99% (如图 2).该催化体系Suzuki偶联反应在常温下, 碱为碳酸钠, 用PdCl2作为催化剂, 以甲醇为溶剂得到了良好的产率.其中供电子取代基和吸电子取代基的碘苯的产率为92%~99%.相应的溴苯的产率为(84%~94%).这个研究的优点是无配体、反应效率高(1当量四硼酸钠与4当量芳基卤化物反应)、反应温度温和且反应过程简单等.然而, 芳基氯化物的反应活性, 即使反应时间较长, 也只能得到中等产率的双环芳烃(29%~42%).这可能是由于缺乏供电子配体, 而这些配体通常使芳基氯化物的偶联反应发生.
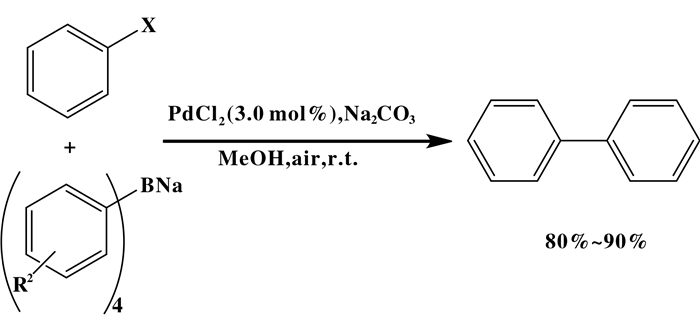
|
图 2 无配体氯化钯催化Suzuki反应 Fig.2 Suzuki reaction catalyzed byligand-free palladium chloride |
随着无配体钯催化剂催化Suzuki偶联反应研究的不断发展, 溶剂由有机溶剂转换为水或水和有机溶剂的混合物, 如乙醇或二甲酰胺, 最近研究报道[16-17]的无配体钯催化方法, 使用了PdCl2作为催化剂, 在环境温度下和有氧条件下, 并且在一定量的碳酸钾存在下, 成功地催化了芳基卤化物与芳基硼酸的Suzuki偶联反应.催化剂钯负载量为0.1%~0.5%(摩尔百分比), 产率几乎为100%.总结一下这些无配体新方法的优点: (1)反应不需要在氮气气氛下进行, 在有氧条件下反应是有效的; (2)有机溶剂有可能降低了产物的收率, 但水和乙醇的混合物在较短的反应时间内就可以得到较优秀的产率.在中间步骤氧化加成过程中, 水或乙醇的加入可能作为供电子配体, 从而稳定PdCl2配合物.氧的存在被认为可以抑制钯配合物的活化和失活过程, 而氮则有助于团聚, 从而导致一种不活泼钯的形成.在下面的研究中, 如图 3[16, 18]供电子基团、吸电子基团和邻取代基的芳基溴化物都具有良好的反应活性, 能以定量产率生成相应的产物.但是如果增加芳基溴代化合物和芳基硼酸的空间基团就会降低反应活性, 降低收率, 延长反应时间.具有吸电子基团和中性基团的芳基硼酸产率适中(52%~99%), 说明具有供电子基团的芳基硼酸在该催化体系中具有较高的反应活性.
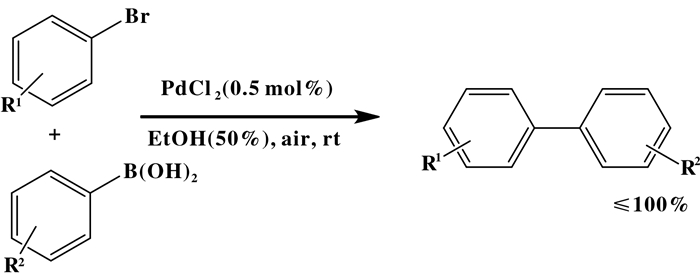
|
图 3 无配体氯化钯在乙醇的水溶液中催化Suzuki反应 Fig.3 Ligand-free palladium chloride catalyzed Suzuki reaction in ethanol aqueous solution |
在经典的Suzuki偶联反应膦配体催化剂中螯合膦和含磷钯环比较常见. Karami等[19]在温和条件下制备了用于偶联或芳基溴化物与氯化物的邻位金属配合物(如图 4a). Lang合成了手性二茂铁(如图 4b), 并与Pd2(dba)3结合, 在低至1 ppm的催化剂负载下催化芳基硼酸偶联反应, 得到的TON值高达750 000[20]. Fernandez等[21]在非常温和的反应条件下, 利用含有膦酰肼的配合物(如图 4c)进行不对称Suzuki反应的催化, 从而制备了对映异构的双环芳烃.为了使偶联反应的条件变得温和, 提高产物产率和反应的选择性, 对于膦配体的研究, 许多研究者都尝试用位阻比较大的多齿膦配体代替了单齿膦配体[22](如图 4d, 4e, 4f).
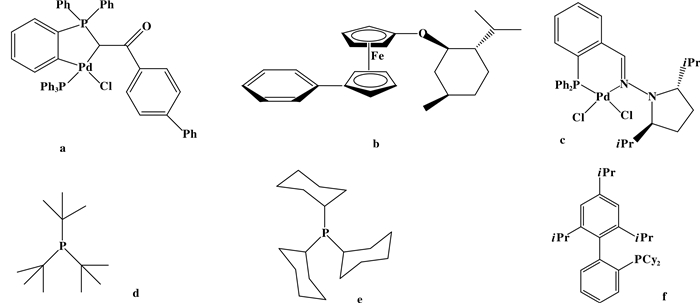
|
图 4 Suzuki偶联反应中的磷配体 Fig.4 Phosphorusligands in Suzuki coupling reaction |
研究发现, 钯和有一定位阻的烷基膦合成的配合物, 在交叉偶联反应中活性很高, 特别是含有高稳定性的金刚烷基的膦作为配体格外引人关注. Carrow等[23]合成了金刚烷基膦(PAd3), 以乙酰苯胺为原料得到的钯环和金刚烷膦配位, 合成了一种新型催化剂.该催化剂具有特殊的活性:极少量的催化剂在室温下成功地催化了芳基氯化物与芳基硼酸的偶联反应.此外, 这种催化剂挑战包括较大空间受阻和杂环取代的反应底物, 得到了良好的产率, 也成功地催化了带有供电子取代基的芳基氯化物和烷基硼酸的偶联反应(如图 5).

|
图 5 金刚烷膦钯环配合物催化的Suzuki反应 Fig.5 Suzuki reaction catalyzed by amantadine phosphine with palladium ring |
与之前的均相催化剂相比, 多相催化剂易于从反应混合物中分离, 且具有良好的可回收循环性, 因此在合成化学中应用非常广泛.将贵金属催化剂负载在碳、磁性材料、二氧化硅、无机氧化物, 沸石、功能化的纳米材料、金属有机骨架(MOF)、有机聚合物、粘土矿物和生物载体等不溶性固体载体的表面, 有助于克服均相催化剂的难分离和带入性污染等缺点.然而, 大多数多相催化剂的选择性不高, 但可以依赖于金属负载量来调节反应, 最终避免产物污染, 使分离变得容易.下面我们将讨论不同固体载体负载的纳米颗粒制备纳米多相催化剂在Suzuki反应中的应用, 以及这些催化系统的优缺点.
近年来, 由于金属纳米颗粒具有更好的性能和成本效益, 人们越来越感兴趣把它们作为催化剂的应用.研究人员一直致力于控制金属纳米粒子的表面性质和化学活性.由于[24-25]纳米粒子体积小、表面积大, 因此比特定的金属纳米粒子具有更高的反应活性.因此, 多相催化剂活性金属大多以纳米颗粒的形式存在.钯纳米粒子是Suzuki偶联反应的催化剂, 通常是负载表面改性制备在固体载体上, 如铁、二氧化硅、二氧化钛、琥珀酸盐或提供高表面积的类似载体.
2.1 Pd在多孔离子液体中催化Suzuki偶联反应最近几年, 离子液体(ILs)作为载体的纳米钯催化剂得到了广泛的应用, 因为这种方法允许我们同时实现避免高毒性溶剂和高效地回收利用催化剂.此外, 由于离子对催化活性中心物质性质的影响也依赖于阳离子和阴离子的结构, 因此, 许多研究[26-27]表明离子液体的催化剂辅助作用比单纯的增溶试剂更大. Nacci研究组[28]已经提出, 在四烷基胺基离子液体中, 钯纳米颗粒可以作为芳基卤化物Suzuki偶联反应的催化剂.将Pd(OAc)2在90 ℃, 用醋酸四丁基铵还原成钯纳米颗粒.有趣的是, 实验结果表明, 以四丁基氢氧化铵(TBAB)为介质可以显著提高催化效率, 并且可以在温和的温度下进行反应.这些结果可以用四烷基铵阳离子在水相中浓度较高来解释.通过分配平衡, 使离子液中的阳离子浓度保持恒定, 从而保护纳米粒子的保护壳层, 溴化四庚铵(THeptAB)取代TBAB, 其侧链更长, 催化Suzuki反应的能力增强, 这可能是由于长链离子液体提供的钯纳米颗粒具有更强的稳定性(如图 6).以4-溴甲苯为原料, 在Na2CO3存在下进行循环实验, 结果表明, 该催化体系重复使用3次后, 产物收率略有下降.

|
图 6 钯纳米颗粒在离子液体催化的Suzuki偶联反应 Fig.6 Suzuki coupling reaction catalyzed by palladiumnanoparticles in ionic liquid |
2011年, Huang等[29]通过自由基共聚, 用乙烯基咪唑与二乙烯基苯反应制备了多孔聚合物离子液体(如图 7).新合成的多孔聚合物离子液(PIC)热稳定性可达390 ℃, 可作为Pd(OAc)2的固体载体, 由Pd(OAc)2/PIC原位还原制备非均相钯纳米催化剂, 催化剂由叔丁基溴化铵作为稳定剂.制备好的钯纳米粒子催化剂在碳酸钠或氢氧化钠存在下, 以水为反应介质, 在空气中催化了溴代芳烃和氯代芳烃与芳基硼酸的偶联反应.在相同的反应条件下, 该方法同样适用于反应困难的芳基氯化物, 但需要碱性较高的氢氧化钠.从本质上说, 这种高活性的纳米催化剂已经显现出了好的可回收性和与各种官能团的高度兼容性, 如甲氧基, 腈基, 硝基, 酮基, 醛基和酯基等.
|
图 7 钯纳米颗粒在多孔离子液体中的Suzuki偶联反应 Fig.7 Suzuki coupling reaction of palladiumnanoparticles in porous ionic liquids |
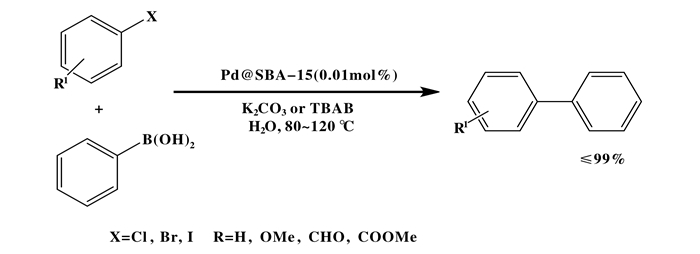
二氧化硅(SiO2)和MCM-41作为多相催化剂的载体, 由于其高效、稳定、高比表面积和可回收性而得到广泛的应用.这些材料含有硅羟基基团, 进行功能化后可以负载不同的过渡金属. 2013年, Speziali等[30]研究了以MCM-41和SiO2为载体, 负载钯和钯金纳米颗粒的多相催化体系, 并成功将纳米催化剂应用于氢氧化钾存在下, 在80 ℃水中无配体Suzuki偶联反应. (如图 8)他们根据所用催化剂的类型得到了由低到高收率的偶联产物(26%~95%).与MCM-41相比, SiO2作为Pd和Pd-Au纳米颗粒的催化剂载体其产率相对较低, 相比之下MCM-41具有较大的比表面积和孔体积, 从而改善了催化剂的分散性, 增加了活性金属与反应底物的接近性.金纳米颗粒的加入被认为可以改变活性金属钯的电子结构,因此, 双金属催化剂的收率较高.催化剂通过循环重复性测试重复使用几次后, 其催化活性并没有显著降低.
|
图 8 Pd/SiO2, Au- Pd/SiO2, Pd/ MCM-41, Au- Pd/ MCM-41催化Suzuki偶联反应 Fig.8 Suzuki coupling reaction catalyzed by Pd/SiO2, Au-Pd /SiO2, Pd/ McM-41, Au-Pd/McM-41 |
磁性纳米粒子由于其低毒、高比表面积、超顺磁性和易磁化等特点, 引起了人们极大的兴趣.通过外加磁场从反应混合物中除去, 因此, 磁性纳米粒子是制备可回收的多相催化剂能够很好地负载贵金属的优良载体.
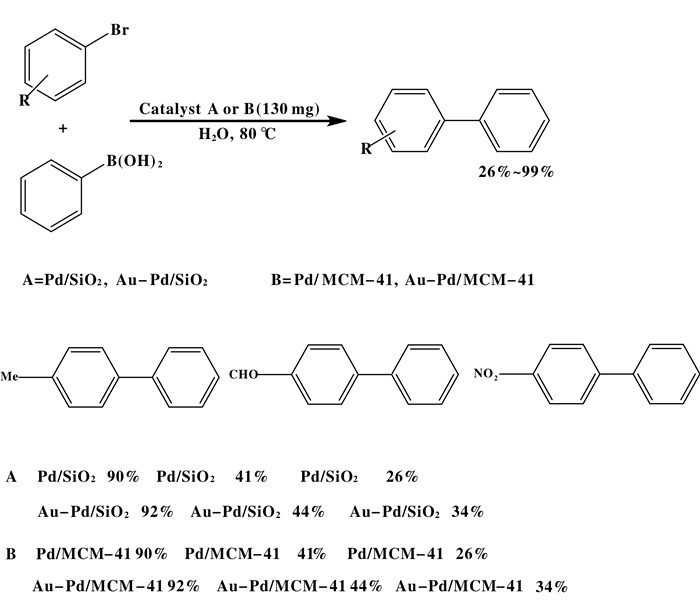
Waghmode等[31]利用表面修饰的镍铁氧体(NiFe2O4)作为钯纳米颗粒的催化剂的载体, 在多相钯催化剂领域又取得了一项重要发现(如图 9).在无配体条件下, 这种新型多相催化剂在水和DMF混合溶剂中催化了芳基卤化物和芳基硼酸的Suzuki反应, 其产率高达70%~98%.研究发现, 温度是影响负载纳米钯催化剂催化活性的一个重要因素, 在以Na2CO3为助剂的90 ℃下, 负载纳米钯催化剂的催化活性最佳; 然而, 将催化剂负载从0.5%(摩尔百分比)降低到0.005%(摩尔百分比)后, 转化率明显降低, 该催化剂成功地催化了NO2、CHO、Me、Cl、OMe、OH、NH2、Ac等取代的芳基卤化物, 该方法也成功地以二卤代芳基卤化物为底物合成了三苯基化合物.同时需要注意的是具有供电子基团的底物需要更长的反应时间以及更高催化剂负载量来提供和其他产物相似的收率, 以芳基硼酸为例, 供电子基团和吸电子基团均能使双环芳烃的产率达到75%~96%, 而杂环芳基硼酸的反应时间较长, 这可能是由于芳基环的杂原子与钯金属的强配位.从本质上讲, 该方法的催化剂具有相似的优点也具有缺点, 如易于回收、水或半水反应溶剂和芳基氯化物的反应活性低.
|
图 9 改性的镍铁氧体负载钯催化剂催化Suzuki反应 Fig.9 Suzuki coupling reaction catalyzed by modified NiFe2O4 supported palladium catalyst |
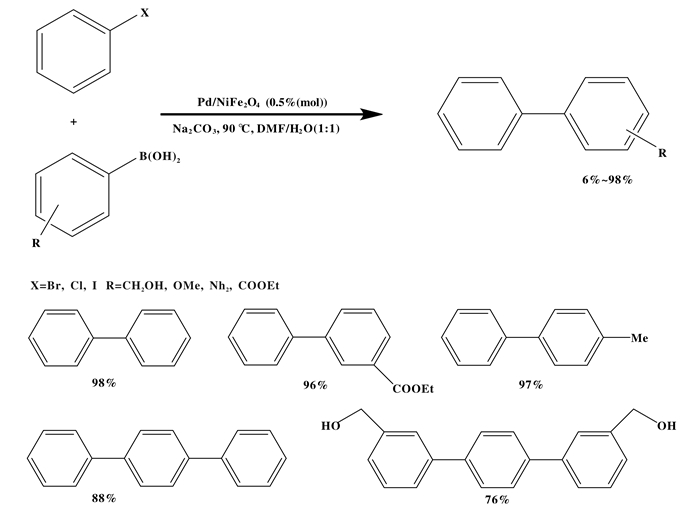
固体载体催化剂的使用提供了易于回收和可循环利用的优点, 从而提供了一个可持续和低成本的制造平台.钯碳(Pd/C)催化剂不仅在各种类型加氢催化剂反应中具有广泛的应用, 而且还被广泛应用在交叉偶联反应中[32]. Liu等[33]报道了一种在温和无配体条件下, 以Pd/C (3%(摩尔百分比))为催化剂, 以水和乙醇的混合物为溶剂, 碱为碳酸钾, 在室温下空气中芳基溴代物与芳基硼酸偶联的好方法.双环芳烃的产率很高(87%~99%)(如图 10), 然而, 缺电子基团的芳基溴需要更长的反应时间才能在室温下获得更高的产率.此外, 芳基硼酸上的吸电子基团的存在, 由于金属转移化, 提高了收率, 缩短了反应时间.该方法也成功地用于氟化液晶化合物的合成.
|
图 10 钯碳催化Suzuki反应 Fig.10 The palladium - carbon catalyzed Suzuki reaction |
Nasrollahzadeh组[34]通过两个简单的步骤合成了以碳为载体的铜钯双金属纳米粒子催化剂.先将PdCl2溶液滴入C-Cu纳米粒子表面, 然后干燥冷却至室温.这种双金属纳米粒子催化剂被有效地用于无配体Suzuki交叉偶联反应和硝基芳烃的还原反应中(如图 11).溴代芳烃、碘代芳烃化合物与苯硼酸偶联的最佳反应条件是在碳酸钾存在下, 乙醇为溶剂, 在高温下反应, 得到的双环芳烃收率较高(86%~93%).和其他Suzuki反应一样, 芳基碘化物的反应性比芳基溴化物更强, 但芳基氯的反应性没有被研究.这种非均相催化剂稳定性好, 被重复使用了4个循环钯的损失率小于0.2%, 没有显著的催化活性损失.从溶剂、高收率、催化剂制备、可回收性等方面, 为双芳基的合成提供了良好的绿色策略.
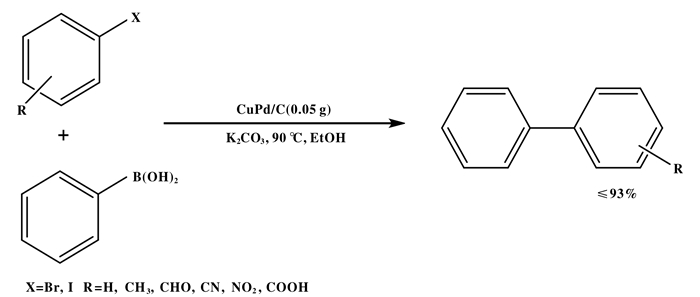
|
图 11 铜钯双金属纳米粒子负载碳催化Suzuki反应 Fig.11 Suzuki reaction catalyzed by copper palladium bimetallicnanoparticles |
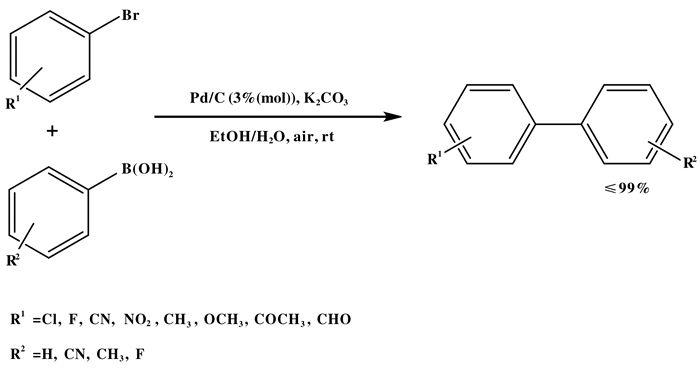
天然生物聚合物, 如壳聚糖, 纤维素和羊毛已被有效地用于许多钯催化的有机反应中.其中大多数需要进一步修饰, 在适当的内径, 聚合度和交联度下, 对其表面实现更高的金属负载量.同样, 凝胶的使用在捕获纳米颗粒方面也变得越来越重要, 最引人注目的凝胶, 如琼脂糖、纤维素、明胶和离子液体修饰的干凝胶已被用作捕获金、铁、银、Pd和Pt纳米颗粒的载体. 2011年, Firouzabadi等[35]将琼脂糖水凝胶作为钯纳米颗粒的载体和生物有机配体, 在水中的Suzuki偶联反应中得到了有效的应用. Lei等[36]研究了天然动物纤维(羊毛)作为载体, 这种载体不需要任何修饰, 但在纤维表面负载了均匀分布的纳米钯颗粒(如图 12), NH2基团和S原子与钯纳米粒子形成配位共价键或离子键, 从而起到内部分子间作用力的作用, 阻止钯纳米粒子的团聚.该催化剂在水和K2CO3存在的情况下, 在空气中催化Suzuki反应是非常有效和高效的.这种催化剂的优点是: (1)不需要额外的修饰; (2)空气条件下在水中反应; (3)多相催化剂不溶于水; (4)高稳定、容易分离和再循环能力强.尽管如此, 芳基卤化物的反应活性与之前的Suzuki偶联反应结果相似, 但芳基碘化物的反应性比芳基溴化物更强, 后者需要10倍以上的催化剂负载量.
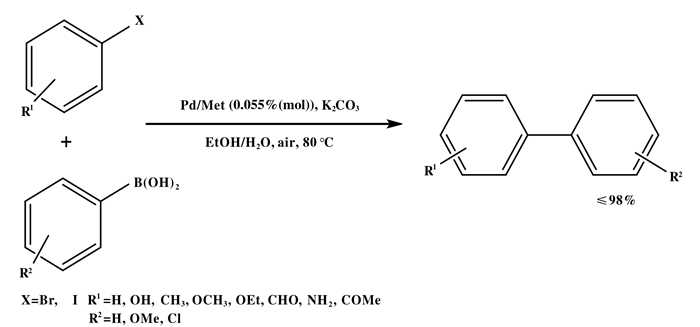
|
图 12 羊毛作为载体的Suzuki反应 Fig.12 Suzuki reaction of wool as supporter |
金属有机骨架材料(MOFs)是一类非常有前途的非均相催化剂载体, 因为其具有较高的比表面积和良好的孔结构.例如, 将直径为3 nm的钯纳米颗粒负载在MIL-53(Al)-NH2(氨基对苯二甲酸阴离子和铝阳离子组成), 就制备了一种新型催化剂.该催化剂可以成功地用于各种芳基卤化物Suzuki偶联反应, 但芳基氯化物的产率较低[37].催化剂中负载钯量为0.5%(摩尔百分比), 在较温和的条件下把它用于苯硼酸与芳基溴化物, 包括失活的2-和4-甲氧基溴苯, 反应在较短的时间内成功地完成(图 13).该催化剂反复循环测试结果较好, 在5次循环中回收, 反应产率几乎不变.
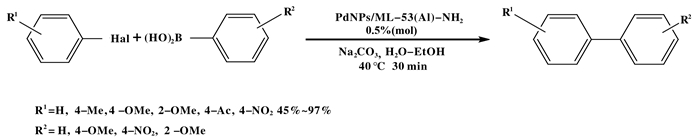
|
图 13 MOF材料为载体催化的Suzuki-Miyaura反应 Fig.13 Suzuki-Miyaura reaction catalyzed by MOF material |
Suzuki偶联反应在化工、医药等领域得到了广泛的应用, 我们所讨论的方法为Suzuki偶联反应构建C—C键的提供了多种绿色途径.在较温和的反应条件下, 使用活性更强、选择性更强的催化剂来催化偶联反应, 并且选择更具挑战性的底物, 最近变得越来越普遍.纳米催化剂的使用越来越多, 与传统均相催化剂相比具有许多优点, 包括良好的活性、选择性, 甚至增强了稳定性.同时, 纳米催化剂和绿色技术, 如使用温和的溶剂(例如:水)可以提高偶联反应绿色高效性.然而, 大多数催化体系虽然已经考虑到绿色化学的要求, 但仍具有以下缺点:(1)反应的产率不适用于所有底物; (2)需要相对地添加表面活性剂/或共溶剂; (3)大多数情况下芳基氯化物的反应活性较低; (4)活性贵金属负载量高.进一步的纳米颗粒原位生成催化体系的力学研究以及它们在水和空气条件下的应用, 降低催化剂的使用量或大大减少活性贵金属的负载量, 提高芳基氯化物的反应活性并利用可再生资源作为载体负载纳米粒子等都是未来Suzuki反应催化研究的热点.
| [1] |
a. Sonogashira K, Negishi E. Handbook of organopalladium chemistry for organic synthesis[M]. by E.-i. Negishi, John Wiley & Sons, Inc., New York, 2002. 1: 493. b. Kang Zhen-wei(康振伟), Gao Zhan-chen(高占臣), Sun Wei-Peng(孙维朋), et al. Preparation of silicon nanosheet supported palladium as sustainable catalyst for suzuki reactions(硅纳米片负载钯催化剂的制备及其催化Suzuki反应研究)[J]. J Mol Catal(China)(分子催化), 2018, 32(1): 18-26. c. Chen Jun(陈君), Long Ji-lan(隆继兰). Bi-centered MOFs-derived Co-ZnO@CN nano-materialas efficient electrocatalyst for oxygen reduction reaction(双中心MOFs衍生的Co-ZnO@CN纳米材料作为电化学催化剂用于氧还原反应的研究)[J]. J Mol Catal(China)(分子催化), 2017, 31(5): 463-471. |
| [2] | Nicolaou K C, Snyder S A. Classics in total synthesis Ⅱ[M]. Weinheim: Wiley, 2003. |
| [3] | Hassan J, Sevignon M, Gozzi C, et al. Aryl-aryl bond formation one century after the discovery of the Ullmann reaction[J]. Chem Rev, 2002, 102(5): 1359–1469. |
| [4] | Suzuki A. Cross-coupling reactions via organoboranes[J]. J Org Chem, 2002, 653(1/2): 83–90. |
| [5] | Johansson Seechurn C C C, Kitching M O, Colacot T J, et al. Palladiumkatalysierte kreuzkupplungen: eine historische perspektive im kontext der nobel-preise 2010[J]. Angew Chem, 2012, 124(21): 5150–5174. |
| [6] | Li H, Johansson Seechurn C C C, Colacot T J. Development of preformed Pd catalysts for cross-coupling reactions, beyond the 2010 Nobel Prize[J]. ACS Catal, 2012, 2(6): 1147–1164. |
| [7] | Liu C, Li X. Oxygen-promoted Suzuki-miyaura reaction for efficient construction of biaryls[J]. Chem Rec, 2016, 16(1): 84–97. |
| [8] | Bykov V V, Bumagin N A. Effective heterogeneous palladium catalysis of the reactions of organoboron compounds with aryl halides[J]. Russ Chem B, 1997, 46(7): 1344–1346. |
| [9] | Liu N, Liu C, Jin Z. An efficient protocol for a Pd (OAc)2-catalyzed ligand-free suzuki reaction in toluene[J]. Chin J Catal, 2010, 31(11/12): 1316–1320. |
| [10] | Liu L, Zhang Y, Xin B. Synthesis of biaryls and polya- ryls by ligand-free Suzuki reaction in aqueous phase[J]. J Org Chem, 2006, 71(10): 3994–3997. |
| [11] | Da Conceição Silva A, Senra J D, Aguiar L C S, et al. Ligand-free Suzuki-Miyaura reactions in PEG 300[J]. Tetra Lett, 2010, 51(30): 3883–3885. |
| [12] | Liu C, Ni Q, Hu P, et al. Oxygen-promoted PdCl2-catalyzed ligand-free Suzuki reaction in aqueous media[J]. Org Biomol Chem, 2011, 9(4): 1054–1060. |
| [13] | Liu L, Zhang Y, Wang Y. Phosphine-free palladium acetate catalyzed Suzuki reaction in water[J]. J Org Chem, 2005, 70(15): 6122–6125. |
| [14] | Zhou W J, Wang K H, Wang J X, et al. Ligand-free, atom-efficient Suzuki-Miyaura type cross-coupling reactions at room temperature[J]. Tetrahedron, 2010, 66(38): 7633–7641. |
| [15] | Arentsen K, Caddick S, Cloke F G N. On the efficiency of two-coordinate palladium (0) N-heterocyclic carbene complexes in amination and Suzuki-Miyaura reactions of aryl chlorides[J]. Tetrahedron, 2005, 61(41): 9710–9715. |
| [16] | Liu C, Ni Q, Hu P, et al. Oxygen-promoted PdCl2-catalyzed ligand-free Suzuki reaction in aqueous media[J]. Org Biomol Chem, 2011, 9(4): 1054–1060. |
| [17] | Liu C, Ni Q, Bao F, et al. A simple and efficient protocol for a palladium-catalyzed ligand-free Suzuki reaction at room temperature in aqueous DMF[J]. Green Chem, 2011, 13(5): 1260–1266. |
| [18] | Adrio L A, Nguyen B N, Guilera G, et al. Speciation of Pd (OAc)2 in ligandless Suzuki-Miyaura reactions[J]. Catal Sci Technol, 2012, 2(2): 316–323. |
| [19] | Karami K, Rizzoli C, Salah M M. Synthesis and application of ortho-palladated complex of (4-phenylbenzoyl- methylene) triphenylphosphorane as a highly active catalyst in the Suzuki cross-coupling reaction[J]. J Organ Chem, 2011, 696(4): 940–945. |
| [20] | Schaarschmidt D, Lang H P. O-Ferrocenes in Suzuki-Miyaura C, C couplings[J]. ACS Catal, 2011, 1(4): 411–416. |
| [21] | Chung K H, So C M, Wong S M, et al. An efficient palladium-benzimidazolyl phosphine complex for the Suzuki-Miyaura coupling of aryls mesylates: facile ligand synthesis and metal complex characterization[J]. Cheml Commun, 2012, 48(14): 1967–1969. |
| [22] | Fleckenstein C A, Plenio H. Sterically demanding trialkylphosphines for palladium-catalyzed cross coupling reactions-alternatives to PtBu3[J]. Chem Soc Rev, 2010, 39(2): 694–711. |
| [23] | Carrow B P, Chen L. Tri (1-adamantyl) phosphine: Exceptional catalytic effects enabled by the synergy of che- mical stability, donicity, and polarizability[J]. Synlett, 2017, 28(03): 280–288. |
| [24] | Calo V, Nacci A, Monopoli A, et al. Pd nanoparticles as efficient catalysts for Suzuki and Stille coupling reactions of aryl halides in ionic liquids[J]. J Org Chem, 2005, 70(15): 6040–6044. |
| [25] | Choudary B M, Madhi S, Chowdari N S, et al. Layered double hydroxide supported nanopalladium catalyst for Heck-, Suzuki-, Sonogashira-, and Stille-type coupling reactions of chloroarenes[J]. J Am Chem Soc, 2002, 124(47): 14127–14136. |
| [26] | Gu Y, Shi F, Deng Y. Ionic liquid as an efficient promoting medium for fixation of CO2: Clean synthesis of α-methylene cyclic carbonates from CO2 and propargyl alcohols catalyzed by metal salts under mild conditions[J]. J Org Chem, 2004, 69(2): 391–394. |
| [27] | Dupont J, Spencer J. On the noninnocent nature of 1, 3-dialkylimidazolium ionic liquids[J]. Angew Chem Int Edit, 2004, 43(40): 5296–5297. |
| [28] | Calo V, Nacci A, Monopoli A, et al. Pd nanoparticles as efficient catalysts for Suzuki and Stille coupling reactions of aryl halides in ionic liquids[J]. J Org Chem, 2005, 70(15): 6040–6044. |
| [29] | Yu Y, Hu T, Chen X, et al. Pd nanoparticles on a po- rous ionic copolymer: a highly active and recyclable catalyst for Suzuki-Miyaura reaction under air in water[J]. Chem Commun, 2011, 47(12): 3592–3594. |
| [30] | Speziali M G, da Silva G M, de Miranda D M V, et al. Air stable ligandless heterogeneous catalyst systems based on Pd and Au supported in SiO2 and MCM-41 for Suzuki-Miyaura cross-coupling in aqueous medium[J]. Appl Catal A: Gen, 2013, 462: 39–45. |
| [31] | Wimmer L, Rycek L, Koley M, et al. Metal Catalyzed Cross-Coupling Reactions in the Decoration of Pyrimidine, Pyridazine, and Pyrazine[M]//Synthesis and Modification of Heterocycles by Metal-Catalyzed Cross-coupling Reactions. Springer, Cham, 2014. 61-157. |
| [32] | Felpin F X, Ayad T, Mitra S. Pd/C: an old catalyst for new applications-its use for the Suzuki-Miyaura reaction[J]. Eur J Org Chem, 2006, 2006(12): 2679–2690. |
| [33] | Liu C, Rao X, Zhang Y, et al. An aerobic and very fast Pd/C-catalyzed ligand-free and aqueous Suzuki reaction under mild conditions[J]. Eur J Org Chem, 2013, 2013(20): 4345–4350. |
| [34] | Nasrollahzadeh M, Jaleh B, Ehsani A. Preparation of carbon supported CuPd nanoparticles as novel heterogeneous catalysts for the reduction of nitroarenes and the phosphine-free Suzuki-Miyaura coupling reaction[J]. New J Chem, 2015, 39(2): 1148–1153. |
| [35] | Firouzabadi H, Iranpoor N, Gholinejad M, et al. Agarose hydrogel as an effective bioorganic ligand and support for the stabilization of palladium nanoparticles. Application as a recyclable catalyst for Suzuki-Miyaura reaction in aqueous media[J]. RSC Adv, 2011, 1(6): 1013–1019. |
| [36] | Ma H, Cao W, Bao Z, et al. Biopolymer-metal complex wool-Pd as a highly active catalyst for Suzuki reaction in water[J]. Catal Sci Technol, 2012, 2(11): 2291–2296. |
| [37] | Huang Y, Zheng Z, Liu T, et al. Palladium nanoparticles supported on amino functionalized metal-organic frameworks as highly active catalysts for the Suzuki-Miyaura cross-coupling reaction[J]. Catal Commun, 2011, 14(1): 27–31. |
 2019, Vol. 33
2019, Vol. 33


