2. 中国科学院兰州物理化学研究所 羰基合成与选择氧化国家重点实验室, 甘肃 兰州 730000
2. State Key Laboratory for Oxo Synthesis & Selective Oxidation, Lanzhou Institute of Chemical Physics, Chinese Academy of Science, Lanzhou 730000, China
绿色化学也称为可持续化学, 是研究学者们多年来孜孜不倦的追求目标.绿色催化作为绿色化学中的一个重要的分支, 近年来在绿色催化反应的研究中已向前迈进一大步.酶催化的反应是化学反应中最环境友好的方法, 这种具有高催化活性的生物催化剂可以在温和的条件下进行催化, 避免使用挥发性有机溶剂、有毒试剂, 拒绝危险或苛刻的反应条件, 作为一种高效、绿色环保的方法目前已经有超过100种的生物转化过程发展到工业规模[1-3].
从广义上来说, 催化过程可以分为两种, 均相催化及非均相催化[4].当反应底物及催化活性中心处于同相中(气态或液态), 则为均相催化体系.该体系中各组分混合均匀, 催化效率高, 产物转化率大, 易于进行体系的优化, 并且可通过改变催化剂的结构来改变催化剂的化学选择性、区域选择性及对映体选择性等.虽然这种催化体系具有较高的催化效率, 但在某些特定条件下不稳定、易失活, 反应结束后产物和催化剂的分离纯化困难.尽管可以根据物质的极性等物理性质的不同实现简单分离, 但是仍有痕量催化剂在产物中残留, 造成重金属污染, 难以满足药品及制药工业等领域的要求[5].克服这种问题有效的方法就是通过催化剂异质化(Heterogenization)来构建非均相催化体系, 使反应物及催化剂处于不同相(催化剂是固态, 反应物是气态或液态)中.一般通过在固体载体(例如二氧化硅、氧化铝、二氧化铈等)的表面或内部通过物理吸附或共价结合捕获催化活性分子来实现, 但是一般情况下只有多孔固体外表面上的位点可用于催化反应, 因此反应中的活性位点不像均相体系中那样易得, 催化剂的活性通常会降低.因此我们需要一种催化体系, 不仅具有高活性和选择性(如均相体系), 而且还具有催化剂分离和回收的简便性(如非均相体系), 这些目标可以通过纳米金属催化来实现, 纳米金属催化可以缩小均相催化和多项催化之间的差距, 保留两种体系的理想属性.
我们针对纳米金属杂化酶的设计及合成方法进行汇总说明, 内容包括几种不同的纳米金属杂化酶的合成策略, 用于合成杂化酶的金属纳米粒子种类, 纳米金属杂化酶的表征方法, 以及纳米金属杂化酶的特性及应用.这些方法在一定程度上增加酶的稳定性, 增强酶的生物活性及选择性, 有些方法甚至扩大酶的底物适应性, 扩大了酶的应用范围, 希望可以为学者们提供新的思路和思考, 促进多学科的融合发展.
1 非均相纳米金属杂化酶的设计纳米颗粒指在纳米尺度范围(1~100 nm)内非常小的颗粒, 特殊的晶层排布结构赋予了它独特的性质, 包括表面效应、量子尺寸效应、久保效应等特性等[6].纳米颗粒几乎在所有领域都具有潜在用途, 例如药物、电子产品、分析检测、化工等, 也可应用于催化领域[7].纳米催化, 一般指具有催化性质的物质或材料无论是内部或是外部结构至少具有一个纳米级尺寸, 通过调整纳米材料的尺寸、形状、组成、电子结构及热、化学稳定性可以帮助设计具有更优良活性、更高选择性、更高稳定性的催化剂.
基于纳米金属(包括纳米金属氧化物)所具有的多种特性, 可以将其与生物酶结合来制备具有特殊功能和特性的纳米金属杂化酶.由于纳米金属具有较大比表面积, 可以将酶分子固定在纳米金属表面, 得到的纳米金属杂化具有多酶催化活性中心, 多活性中心产生的协同效应可以大大提高杂化酶的催化效率.同时纳米金属还具有良好的导电性能, 在氧化还原酶的催化过程中可以提高电子翻转速率, 进一步提高杂化酶的催化效率.根据纳米粒子合成方法的不同将其分为两类, 一种是将制备好的单分散纳米粒子通过物理吸附或共价结合等方式引入到生物酶表面[8].另一种是将生物酶分散于金属盐溶液中, 通过原位还原作用形成纳米金属粒子, 合成的纳米金属粒子以均匀[9]或非均匀[10]的方式固定在蛋白质的孔隙中形成非均相纳米金属杂化酶[11-13].
1.1 直接合成法制备纳米金属杂化酶将单分散的纳米金属或金属氧化物通过物理吸附或共价结合来固定生物酶是构建纳米金属杂化酶的一种方法.其中生物酶与纳米金属的结合方式是十分关键的, 一般情况下生物酶中需要含有对金属纳米粒子在亲疏水性或电荷正负性方面具有亲和力的氨基酸, 同时相邻氨基酸需要具有一定还原能力.共价结合的方式由于其能够在更加苛刻的条件下进行并且结合稳定而备受青睐, 这种结合方式可以实现反应物和催化剂分离的最大化, 并且可重复使用数次.
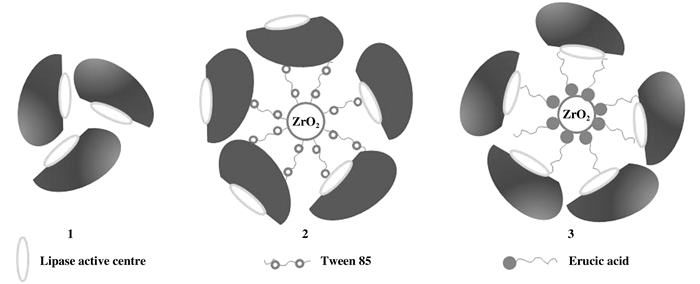
通过疏水性相互作用来构建纳米金属酶, 由于环境中疏水性的改变, 酶活性及选择性也会随之发生改变.脂肪酶是目前生物催化和有机化学中最常用的酶, 具有较为广泛的底物适应性、区域选择性及对映体选择性, 被大量应用于催化不对称反应中.脂肪酶具有独特的“盖子”结构, 盖子结构表面亲水, 内部疏水, 同时催化位点位于“盖子”结构内部, 在传统反应体系中, 活性中心很难暴露, 产物转化率较低[14]. Chen等[15]使用具有长烷基链的羧酸表面活性剂(吐温85和芥子酸)改性的氧化锆纳米粒子通过疏水性的物理吸附作用对脂肪酶Candida rugosa(CRL)和Pseudomonas cepacia(PCL)进行固定(图 1), 将固定后的酶用于(R, S)-布洛芬和(R, S)-苯基乙醇的动力学拆分.研究发现芥子酸改性的氧化锆纳米粒子固定化的效果较好, 固定化后的酶活性有明显提高, 通过在异辛烷溶液中动力学拆分(R, S)-布洛芬的研究发现芥子酸改性氧化锆后固定酶的活性(0.167 μmol/mg/h)远大于通过吐温85改性氧化锆固定的酶的活性(0.005 μmol/mg/h), 其相对活性分别为214%、6%(CRL粗酶活性为100%).认为脂肪酶与改性的纳米颗粒表面具有一定的相互作用, 疏水性的氧化锆纳米粒子有利于使脂肪酶疏水性一侧有方向性的排列在纳米粒子表面, 使亲水性的活性中心暴露在反应介质中, 进而提高酶的活性.该研究表明, 以亲水性表面为特征的无机氧化锆纳米颗粒可以在疏水性载体(使用具有长烷基链的表面活性剂)中改性并显着提高脂肪酶活性.
|
图 1 游离脂肪酶CRL及ZrO2固定化脂肪酶CRL示意图 Fig.1 A crude CRL and surfactant-modifiedzirconia nanoparticle after lipase immobilization (1. a crude CRL powder; 2; CRL immobilized on Tween modified nanoparticles; 3. CRL immobilized on Erucic zirconia nanoparticles) |
可以通过纳米粒子与生物酶之间的电荷相互作用构建纳米金属杂化酶. Andrade等[16]利用超磁纳米粒子将洋葱伯克霍尔德氏菌脂肪酶(Burkholderia cepacia lipase, BCL)进行固定化, 首先使用共沉淀法合成直径约为10 nm的Fe3O4纳米粒子(MagNP), 然后将磁性纳米颗粒用β-氨丙基三乙氧基硅烷(APTS)进行丙氨酸化, 使铁纳米粒子和Si之间有结构稳定的强键, 同时末端含有功能性位点γ-氨丙基, 产生的APTS-MagNP通过3种方式固定脂肪酶, 第1种方法是通过带有正电荷的纳米颗粒APTS-MagNP和带有负电荷的脂肪酶通过离子相互作用, 将脂肪酶简单吸附到磁性纳米粒子的γ-氨丙基上.第2种方法是将APTS-MagNP用4-羧基苯甲醛修饰, 得到羧基-APTS-MagNP, 然后把活化后的脂肪酶通过共价结合的方式固定到羧基-APTS-MagNP上.第3种方法使用戊二醇修饰APTS-MagNP, 然后与脂肪酶进行共价结合得到BCL-Glu-APTS-MagNP.通过拆分外消旋手性前体药物2-溴-苯基乙醇来验证固定化效果, 发现固定化后杂化酶的E值有了明显提升(E游离酶 < 30, E固定化酶>200), 脂肪酶的立体选择性得到了明显的改善, 比较3种固定方法发现第2种及第3种固定化酶的热稳定性更优良, 在52 ℃下依然表现出较好的拆分能力.
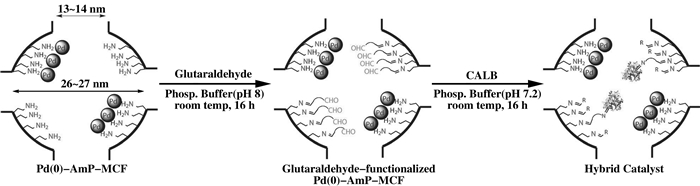
借助有孔隙的固定化材料也可以合成纳米金属杂化酶.在这个过程中, 纳米材料的选择显得尤为重要, 材料的材质、粒径、亲疏水性等因素都会影响杂化酶的活性.有机纳米材料有助于酶和固定化材料的吸附, 但成本较高, 无机纳米材料具有较高的机械强度, 化学稳定性好且成本低, 因此多被用于合成杂化酶.纳米材料的大小会影响酶的担载量, 过小的材料不能有效的吸附脂肪酶.合适的孔径有助于提高酶的稳定性, 亲疏水性会影响酶在纳米颗粒上排列方向, 进而影响酶活性. Karin等[17]选择将纳米钯固定在氧化硅介孔泡沫材料上, 然后经戊二醛处理后, 将Candida antarctica脂肪酶A(CALA)固定在其中, 制造一种人工合成的金属杂合酶(图 2).在该混合催化剂中, 每个孔都可以看作是一个金属酶, 其中包含固定化脂肪酶形式的氨基酸组分和钯纳米颗粒, 可充分发挥各杂化酶之间的协同作用.使用该金属酶进行外消旋伯胺的手性拆分实验, 产物对映体过量值达到99%.
Sujoy等[18]利用纳米二氧化硅进行金属杂化酶的构建(图 3).利用米根霉(Rhizopus oryzae)蛋白提取物上羧基、羟基、胺基等功能基团将其固定于纳米二氧化硅的介孔环境中, 将其置于AgNO3溶液中进行原位合成, Ag+通过静电相互作用迅速吸附在带有负电荷的蛋白质表面, 由于金属离子与蛋白质官能团之间的电子转移导致Ag+的还原并形成AgNPs, 宏观上表现为溶液颜色由白色到深棕色的变化.合成后的金属杂化酶结构稳定, 热稳定性好, 在催化对硝基苯酚的加氢反应中表现出良好的催化活性.
1.2 原位还原法制备纳米金属杂化酶将生物酶分散于金属盐溶液中会形成一种非均相的纳米金属杂化催化剂.合成过程主要分两个步骤, 首先酶快速吸附溶液中的金属离子, 然后在不存在任何外源还原剂的条件下原位还原金属离子, 合成纳米金属粒子.在这个过程中生物酶不仅作为纳米金属的载体, 同时也是还原剂、稳定剂.由于纳米粒子的存在, 酶的活性及立体选择性都有很大提高, 而且纳米金属性质稳定, 在水溶液中能够保持3个月以上不发生聚集、沉降.
原位还原法得到的纳米金属杂化酶的活性与纳米金属的形态及粒径密切相关[19]. San等[9]以来自肺炎链球菌的细菌氨肽酶(PepA)为生物模板, 以K2PtCl4的硼氢化钠溶液作为金属盐溶液, 原位合成纳米铂(PtNPs)杂化的细菌氨肽酶(PepA-PtNPs), 合成PtNPs被包裹在PepA正四面体十二聚体复合物的内部(图 4).通过在不同反应介质中测定PepA-PtNPs的肽酶活性和加氢活性证明PtNPs的粒径与两种活性呈反比, 即粒径越小, PepA-PtNPs的肽酶活性和加氢活性越大, 同时PepA-PtNPs在不同有机溶剂中表现出不同活性.后将合成的纳米复合物用于催化谷氨酸-对硝基苯胺的水解和氢化反应, 得到了良好的催化效果.
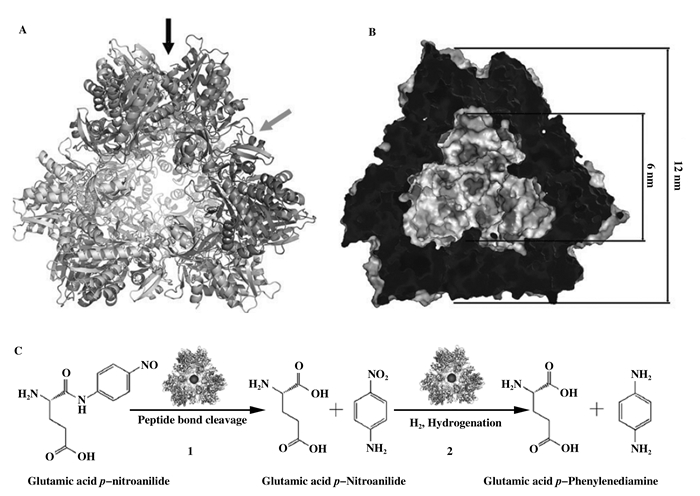
|
图 4 PepA的构型及PepA-PtNPs催化的连级反应路线图[9] Fig.4 Crystal structure of PepA and the multistep reaction catalyzed by the PepA-PtNP[9] |
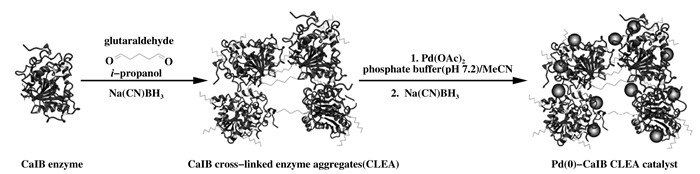
交联酶聚集体(Cross-linked enzyed aggregate, CLEA)是一种有趣的方法, 通过特殊的交联剂将单位酶交联在一起可以避免每单位酶活的降低. Tamás等[20]利用这种方法成功的合成了纳米钯杂化酶, 利用含有戊二醇和氰化硼氢化钠的异丙醇溶液作为交联剂, 成功交联南极假丝酵母脂肪酶B(Candida antartica lipase B, CalB)制得交联化的CalB(CalB-CLEA)(图 5).将CalB-CLEA置于含有Pd(OAc)2的磷酸盐缓冲溶液中原位还原形成纳米钯杂化的CalB-CLEA(Pd(0)-CalB-CLEA).经元素分析确定杂化酶中纳米钯的含量达到4.7%(重量百分数), 扫描电子显微镜(scanningelectron microscopy; SEM)及高角度环形暗场扫描透射电子显微镜(high-angle annular dark-field scanning transmission electron microscopy; HAADF-STEM)表征证明纳米钯粒子呈无定型形态, 粒径2~4 nm, 均匀的分布于交联后的酶结构中.研究表明, 无定型形态的纳米钯没有降低酶活, 在后来的一步法4-戊炔酸的环化反应中表现出良好的立体选择性和稳定性, 在酶活没有明显损失的条件下可循环使用5次.
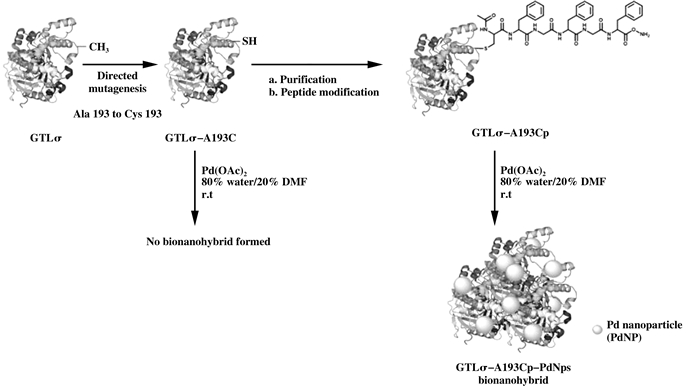
原位还原法中构建稳定的氧化还原环境是十分重要的. David等[10]采用一种绿色、快捷的方法合成新型的纳米钯和脂肪酶共固定化的金属杂化酶(图 6).通过基因工程手段引入特定的含半胱氨酸的小肽对嗜热杆菌脂肪酶(Geobacillus thermocaten-ulatus lipase, GTL)变体进行修饰, 为超小粒径钯纳米粒子的合成创造稳定的氧化还原环境, 合成后的纳米钯粒子跟蛋白质分子亲和结合形成金属杂合酶.该杂合酶具有良好的稳定性和催化特性, 可以在65 ℃、二甲基甲酰胺(DMF)为介质的条件下通过Heck反应合成反式肉桂酸乙酯, 最佳条件下的产物转化率达到86%, 产物对映体过量值在99%以上.重复使用5次后, 还能保持90%的催化活性.
杂化酶的回收再利用是评价催化剂效果十分重要的特征, 大多数的非均相催化剂需要将反应后的混合物通过反复的离心、过滤等复杂操作将催化剂分离开来.超磁纳米金属催化剂的出现为我们解决了这个难题, 基于催化载体的顺磁性可以用外部磁体回收磁性负载的催化剂, 便于催化剂的重复使用. Rocio等[21]报道了一种在温和条件下(25 ℃, 大气压下)水性介质中直接合成超薄蛋白碳酸铁纳米线(FeCO3-NRs)杂化酶的方法.向Candida antartica B脂肪酶中添加不同浓度的(NH4)2Fe(SO4)2溶液, 使用不同pH的缓冲溶液调节体系的pH值, 避免在溶液中形成杂质氧化铁纳米颗粒.反应16 h后有固体析出, 用缓冲液反复清洗后可得到杂化酶. ICP-OES显示杂化酶中的铁含量达到47%, TEM显示形成纳米线的大小为7×59 nm, XRD和XPS显示固形物质大部分是碳酸铁, 含有少量氧化铁杂质.该纳米生物混合物可用作具有较强活性和稳定性的超顺磁性非均相纳米催化剂, 用于硝基芳烃还原及氧化过程, 并且还适用于C—H键官能化.
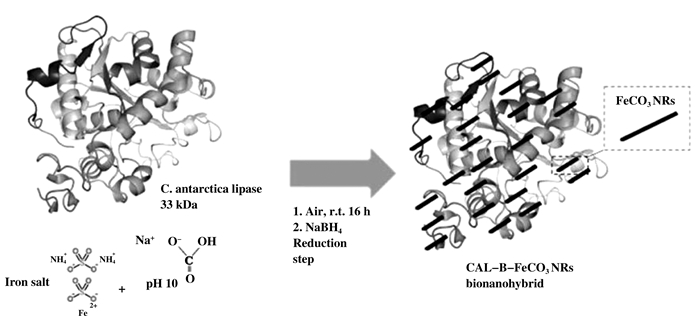
|
图 7 CAL-B-FeCO3-NRs杂化酶合成过程[22] Fig.7 Graphic illustration of the synthesis of CAL-B-FeCO3 hybridase[22] |
在纳米金属杂化酶中纳米金属(包括金属氧化物)的选择十分重要, 其中比较常见的是Au、Pd、Pt, 也有使用其他贵金属来合成纳米金属杂化酶的例子(表 1).不同纳米金属对于酶活性的提高程度不尽相同, 其原因可能与纳米金属的粒径有关. Marco等[22]以脂肪酶Candida antarctica B (CAL-B)为载体, 在水溶液中分别还原Pd(OAc)2、AgNO3、HAuCl4制备CALB-PdNPs、CALB-AgNPs、CALB-AuNPs 3种纳米金属杂化酶, 研究发现在几乎相同的条件下合成的3种纳米金属粒径有所不同, PdNPs的粒径为1.3 nm, 而AgNPs和AuNPs的粒径在8~10 nm之间.通过一步法合成4-氨基苯酚来评价3种杂化酶的催化活性, 其中CALB-PdNPs表现出了最佳酶活(约为47%).
| 表 1 纳米金属杂化酶的实例 Table 1 Examples of nano metal hybridase |
早在1956年, Akabori等[30]就在Nature上报道了将钯纳米颗粒固定在丝蛋白纤维上, 用于催化肟和恶唑酮的非均匀不对称氢化反应. Wilson和Whitesides[31]在1978年报道了第一种以人工有机金属酶作为均相催化剂来催化不对称烯烃加氢的反应.但是由于分析及检测方法的限制, 那时候还无法实现产物的表征及催化特性的优化等.近年来, 随着生物技术、电子传感、纳米技术、定向进化等领域的发展, 已有多种分析检测的手段可用于纳米金属杂化酶的检测及表征.
纳米金属杂化酶的表征检验, 首先要确定的就是在已知基底蛋白中是否有目标纳米金属的存在, 存在的纳米金属的种类、形态、粒径大小、密度等都是需要考证的问题.一般通过透射电子显微镜可以观察到是否有纳米粒子形成及纳米粒子的形状, 经数据处理后能够得到纳米金属的粒径等相关信息, 扫描电子显微镜、原子力显微镜能够得到纳米粒子与蛋白质结合的表面形态, 应用拉曼光谱和傅里叶变换红外光谱能够有效的辨别纳米金属与蛋白质的结合方式、结合位点、结合官能团等, 电感耦合等离子体发射光谱能够计算出纳米金属在蛋白质中的相对含量, X-射线衍射能够分析出金属纳米粒子的组分和结构, X射线元素映射分析及电化学分析等可进一步分析纳米金属的合成过程及在介孔纳米材料上的组装行为.
4 纳米金属催化体系的特点与应用纳米催化剂表现出的优良特性与纳米材料独一无二的特性密不可分[32].对于任何发生的化学反应, 反应物质和催化剂都需要彼此接触, 由于颗粒的纳米尺寸, 纳米催化剂活性组分具有较高的比表面积, 显著的增加了反应物与催化剂之间的接触, 使得非均相催化体系能够实现接近均相催化体系的反应速率.同时当催化材料以纳米粒度产生时, 即获得了纳米粒子所具有的特殊性质, 这些性质有助于提高纳米催化性能和能力, 并赋予生物酶新的特性.例如纳米材料具有良好的电磁特性, 可以增加氧化还原反应中电荷传递速度, 提高反应速率[33-34]; 可以以纳米材料作为转运体将酶运送至细胞中[35-36]; 利用纳米材料的光学或物理特性可以控制催化反应进程[37-38].
4.1 纳米催化材料可提高酶的活性及稳定性Garcia等[29]利用生物硅化的脂肪酶Candida antarctica B (CAL-B)为载体, 在氯化金、氯化钯、氯化钌溶液中进行原位还原合成非均相纳米杂化催化剂, 通过考察不同温度下油酸和乙醇的酯化反应来评价杂化酶的催化活性和稳定性.研究发现, 与游离酶相比, 杂化酶的稳定性有了显著提高, 游离酶在超过50 ℃时酶活性开始下降, 而杂化酶可以承受55 ℃的温度, 并且纳米钯杂化酶可以在65 ℃下进行催化反应且活性没有下降.在不同极性溶剂中进行的酯化反应得到纳米金杂化酶的催化活性最佳, 与游离脂肪酶相比酶活性提高约63%, 并且在不同极性反应介质中表现出的耐受性不同.
除催化活性及热稳定性外, 纳米金属材料还可以提高酶的立体选择性及区域选择性[10, 16].合成的纳米金属杂化酶可用于催化多种反应, 例如催化C-C偶联反应(Suzuki耦合反应[19, 22]、Heck反应[8])、加氢甲酰化[18]及烯烃复分解反应等等.
4.2 纳米金属材料可以介导电荷的传递氧化还原酶与电极之间的电子传递现象是安培生物传感器和生物燃料电池发展过程中起到关键作用的重要研究. 2003年, Xiao等[39]将具有氧化还原活性的生物酶(葡萄糖氧化酶glucose oxidase; GOx)结合到金纳米颗粒(AuNPs)上, 将AuNPs作为将电子传递到电极上的电子继电器来构建电化学传感器.该电化学传感器的构建有两种方法, 一是将FAD结合到功能化的AuNPs上, 然后加入GOx构建金属杂化酶, 经STEM确认酶与金属结合良好后将其组装于金电极上构建电化学传感器; 另一种方法是将经FAD修饰的功能化AuNPs结合到金电极上, 然再加入GOx.经两种方法构架的杂化酶在氧化葡萄糖方面都表现出了良好的催化活性.该研究结果发表在《Nature》上, 开启了将酶的识别和催化特征与纳米粒子的电子特征相结合的全新研究领域, 开发了一种构建电活性生物材料的方法, 为纳米生物电子研究开启了全新的篇章.
4.3 纳米金属材料可以介导生物酶的转运Partha Ghosh等[40]做过一项有趣的研究, 借用纳米金易于表面功能化的特性, 通过一系列操作将一段特定肽连接到AuNPs表面制备功能化AuNPs, AuNPs上的特定肽基团在细胞递送过程中具有多种作用, 易于被细胞识别、结合, 并且可以提高纳米颗粒的稳定性, 将其与β-半乳糖苷酶(β-galactosidase, β-Gal)结合构建纳米金属酶(AuNPs-β-Gal), 在被特定肽功能化AuNPs的帮助下, β-Gal可被转运到各种细胞系中, 并且能够在细胞内保持活性.该研究证明利用纳米金属大的比表面积和易于表面功能化的特性, 使其可以作为一种纳米转运载体被细胞识别和利用.这种可以通过膜受体特异性识别的选择性细胞标记的高效纳米金属催化系统, 可应用于单克隆抗体及具有靶向性的药物研制中[41].
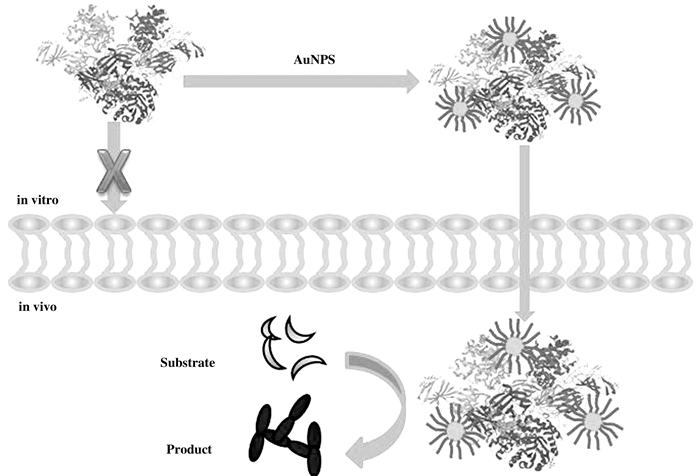
|
图 8 AuNPs介导的β-半乳糖苷酶的细胞内外转运示意图 Fig.8 Scheme ofAuNPs-mediated intracellular and extracellular transport of β-galactosidase |
利用纳米颗粒的光热特性, 可以将其作为光热反应的控制开关应用到肽构象的变化、DNA的杂交等生理生化过程中.纳米粒子能够吸收电磁辐射能并将其转化为热量, 然后转移到纳米粒子表面结合的生物大分子(DNA寡聚体、蛋白质等)上, 导致蛋白质的解离或酶的失活.这种光热法与其他控制生物大分子反应进程的方法相比: 1)不需要添加其他的化学品或进行机械操作就可以实现远程控制; 2)激光束可以以亚微米级的分辨率进行聚焦, 能够实现准确的空间控制; 3)可在亚细胞水平上进行操作; 4)使用脉冲激光能够实现快速加热或快速冷却; 5)激光强度比非破坏性荧光显微镜的激光强度低一个数量级, 因此可以避免对细胞的光化学损伤. Bretschneider等[25]将柠檬酸钠法制备的纳米金与1 mg/mL的辣根过氧化物酶(horseradish peroxidase, HPR)混合培养3 d制备纳米金杂化的过氧化物酶, 以2, 2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)为反应底物进行催化反应, 通过控制532 nm波长下激光强度来控制酶活性, 利用紫外-可见光吸收光谱原位检测酶活性的变化.研究结果表明激光照射导致酶的活性下降, 并且活性下降的速率随着激光功率的增加而增加.尽管没能验证经激光处理后酶失活的过程是否可逆, 但是得到了酶活性可以通过光热来控制这一重要结论, 这一重要结论可应用于更加复杂的催化系统中, 向其中添加稳定性良好的纳米金粒子后, 酶活性可以通过远程和高度局部的方式进行光热微调.
5 展望对于纳米金属催化的研究有很多, 都在为构建良好稳定性、较高催化活性、易于工业化生产的催化剂而不懈努力.尽管还存在贵金属价格昂贵、难以实现纳米颗粒粒径的精准控制等问题, 但是基于纳米金属杂化催化剂良好的特性, 未来的发展将会向着更高活性、更好操作、更加低廉转变, 开发出具有多功能、安全绿色的催化剂, 在靶向药物开发、生物传感器制备、多种化工原料的合成等等诸多领域继续发展.
| [1] |
a. Polshettiwar V, Varma R S. ChemInform abstract: Aqueous microwave chemistry: A clean and green synthetic tool for rapid drug discovery[J]. Chem Soc Rev, 2008, 37(8): 1546-1557. b. Chen Lin-lin(陈林林), Wang Zhen-xing(王振兴), Dou Bo-xin(窦博鑫), et al. Electrochemical performance of modified electrode by methanobaction functionalized gold nanoparticle for SOD simulation(甲烷氧化菌素功能化纳米金修饰电极模拟SOD的电化学性能研究)[J]. J Mol Catal(China)(分子催化), 2018, 32(6): 574-580. c. Liu Feng-yuan(刘丰源), Xin Jia-ying(辛嘉英), Sun Li-rui(孙立瑞), et al. High density culture of methane oxidizing bacteria and its application in biodiesel refining(甲烷氧化菌的高密度培养及其在生物柴油炼制中的应用)[J]. J Mol Catal(China)(分子催化), 2018, 32(4): 370-381. |
| [2] |
a. Silva R R D. Bacterial and fungal proteolytic enzymes: Production, catalysis and potential applications[J]. Appl Biochem & Biotechnol, 2017, 183(1): 1-19. b. Lin Hui-ying(林惠颖), Xin Jia-ying(辛嘉英), Li Chun-yu(李春雨), et al. Progress on isolation and purification of particulate methane monooxygenase(颗粒性甲烷单加氧酶分离纯化方法的研究进展)[J]. J Mol Catal(China)(分子催化), 2018, 32(1): 90-98. c. Dou Bo-xin(窦博鑫), Xin Jia-ying(辛嘉英), Wang Zhen-xing(王振兴), et al. Multilayer self-assembly modified electrode of methanobactin functionalized gold nanoparticle to catalytic reduction of hydrogen peroxide(甲烷氧化菌素功能化金纳米层层自组装修饰电极上过氧化氢的催化还原)[J]. J Mol Catal(China)(分子催化), 2017, 31(6): 534-543. d. Zheng Li-na(郑丽娜), Xin Jia-ying(辛嘉英), Wang Yan(王艳), et al. Research progress on the influence of microwave on enzyme-catalyzed reactions and the microwave effect(微波对酶催化反应的影响及其微波效应的研究进展)[J]. J Mol Catal(China)(分子催化), 2017, 31(6): 567-574. |
| [3] |
a. Ji Y B, Wang S W, Yu M, et al. Research status and development of application fields in enzyme technology[J]. IOP Confer Series: Mater Sci Engineer, 2018, 292: 012120. b. Li Chun-yu(李春雨), Xin Jia-ying(辛嘉英), Lin Hui-ying(林惠颖), et al. Study on functionalized gold nanoparticles of methanobactin by copper ion coordination uesd as simulated peroxidase(铜离子配位甲烷氧化菌素功能化纳米金模拟过氧化物酶的研究)[J]. J Mol Catal(China)(分子催化), 2017, 31(5): 480-485. |
| [4] | Polshettiwar V, Luque R, Fihri A, et al. Magnetically recoverable nanocatalysts[J]. Chem Rev, 2011, 111(5): 3036–3075. |
| [5] | Sebastian W, Alexander S T, Grass R N, et al. A recyclable nanoparticle-supported palladium catalyst for the hydroxycarbonylation of aryl halides in water[J]. Angew Chem Inter Edit, 2010, 49(10): 1697–1697. |
| [6] | Dou Bo-xin(窦博鑫), Xin Jia-ying(辛嘉英), Fan Hong-chen(范洪臣), et al. Functionalself-assembly gold nanoparticle modified electrodes and application in the field of biosensors with enzyme immobilization(功能化金纳米修饰电极自组装及其在固定化酶生物传感器中应用)[J]. J Mol Catal(China)(分子催化), 2016, 30(4): 391–400. |
| [7] | Li Shu-shuang(李舒爽), Tao Lei(陶磊), Zhang Qi(张奇), et al. Recent advancesin nano-gold-catalyzed green synthesis and clean reactions(纳米金催化的绿色合成与清洁反应研究新进展)[J]. Acta Phys Chim Sin(物理化学学报), 2016, 32(1): 61–74. |
| [8] | Filice M, Marciello M, Morales M P, et al. Synthesis of heterogeneous enzyme-metal nanoparticle biohybrids in aqueous media and their applications in C-C bond formation and tandem catalysis[J]. Cheminform, 2013, 49(61): 6876–6878. |
| [9] | San B H, Kim S, Moh S H, et al. Platinum nanoparticles encapsulated by aminopeptidase: a multifunctional bioinorganic nanohybrid catalyst[J]. Angew Chem Inter Edit, 2011, 50(50): 11924–11929. |
| [10] | Lopez-Tejedor D, Blanca D L R, Palomo J M. Ultra-small Pd (0) nanoparticles into a designed semisynthetic lipase: An efficient and recyclable heterogeneous biohybrid catalyst for the heck reaction under mild conditions[J]. Molecules, 2018, 23(9): 2358–2373. |
| [11] | Ueno T, Watanabe Y. Coordination chemistry in protein cages: principles, design, and applications[M]. John Wiley & Sons, 2013. |
| [12] | Krämer R. Coordination chemistry in protein cages. principles, design and applications. Herausgegeben von takafumi ueno und yoshihito watanabe[J]. Angew Chem, 2014, 126(6): 1503–1504. |
| [13] | Ueno T, Abe S, Yokoi N, et al. Coordination design of artificial metalloproteins utilizing protein vacant space[J]. Coord Chem Rev, 2007, 251(21): 2717–2731. |
| [14] | Li Quan-hui(李泉荟), Xin Jia-ying(辛嘉英), Wang Yan(王艳), et al. Lipase-catalyzed synthesis of starch ferulate in non-aqueous system(非水相脂肪酶催化阿魏酸淀粉酯的合成)[J]. Fine Chem(精细化工), 2016, 33(11): 1266–1271. |
| [15] | Chen Y Z, Yang C T, Chi B C, et al. Immobilization of lipases on hydrophobilized zirconia nanoparticles: Highly enantioselective and reusable biocatalysts[J]. Langm Acs J Surf & Coll, 2008, 24(16): 8877–8884. |
| [16] | Andrade L H, Rebelo L P, Netto C G C M, et al. Kinetic resolution of a drug precursor by Burkholderia cepacia lipase immobilized by different methodologies on superparamagnetic nanoparticles[J]. J Mol Catal Enzy, 2010, 66(1): 55–62. |
| [17] | Engström K, Johnston E V, Verho O, et al. Co-immobilization of an enzyme and a metal into the compartments of mesoporous silica for cooperative tandem catalysis: An artificial metalloenzyme[J]. Angew Chem, 2013, 52(52): 14006–14010. |
| [18] | Das S K, Motiar M, Khan R, et al. Bio-inspired fabrication of silver nanoparticles on nanostructured silica: Characterization and application as a highly efficient hydrogenation catalyst[J]. Green Chem, 2013, 15(9): 2548–2557. |
| [19] | Das S K, Parandhaman T, Pentela N, et al. Understanding the biosynthesis and catalytic activity of Pd, Pt, and Ag nanoparticles in hydrogenation and Suzuki coupling reactions at the nano-bio interface[J]. J Phys Chem C, 2014, 118(42): 24623–24632. |
| [20] | Görbe T, Gustafson K P J, Verho O, et al. Design of a Pd(0)-CalB CLEA biohybrid catalyst and its application in a one-pot cascade reaction[J]. ACS Catal, 2017, 7(3): 1601–1605. |
| [21] | Benavente R, Lopeztejedor D, Palomo J M. Synthesis of a superparamagnetic ultrathin FeCO3 nanorods-enzyme bionanohybrid as a novel heterogeneous catalyst[J]. Chem Commun, 2018, 54(49): 6256–6259. |
| [22] | Marco F, Marzia M, Morales M D P, et al. Synthesis of heterogeneous enzyme-metal nanoparticle biohybrids in aqueous media and their applications in C-C bond formation and tandem catalysis[J]. Cheminform, 2013, 49(61): 6876–6878. |
| [23] | Fischer N O, Mcintosh C M, Simard J M, et al. Inhibition of chymotrypsin through surface binding using nanoparticle-based receptors[J]. Proce Nat Acad Sci Unit Sta Ameri, 2002, 99(8): 5018–5023. |
| [24] | Fischer N O, Verma A, Goodman C M, et al. Reversible "irreversible" inhibition of chymotrypsin using nanoparticle receptors[J]. J Am Chem Soc, 2003, 125(44): 13387–13391. |
| [25] | Bretschneider J C, Maximilian R, Gero V P, et al. Photothermal control of the activity of HRP-functionalized gold nanoparticles[J]. Small, 2010, 5(22): 2549–2553. |
| [26] | Zayats M, Baron R, Popov I, et al. Biocatalytic growth of au nanoparticles: From mechanistic aspects to biosensors design[J]. Nano Lett, 2005, 5(1): 21–25. |
| [27] | Blankschien M D, Pretzer L A, Huschka R, et al. Light-triggered biocatalysis using thermophilic enzyme-gold nanoparticle complexes[J]. ACS Nano, 2013, 7(1): 654–663. |
| [28] | Cuenca T, Filice M, Palomo J M. Palladium nanoparticles enzyme aggregate (PANEA) as efficient catalyst for Suzuki-Miyaura reaction in aqueous media[J]. Enzy Micro Technol, 2016, 95(1): 242–247. |
| [29] | Garcia C, Junior I I, De Souza R O, et al. Novel nanoparticle/enzyme biosilicified nanohybrids for advanced heterogeneously catalyzed protocols[J]. Catal Sci & Technol, 2015, 5(3): 1840–1846. |
| [30] | Akabori S, Sakurai S, Izumi Y, et al. An asymmetric catalyst[J]. Nature, 1956, 178(4528): 323–324. |
| [31] | Wilson M E, Whitesides G M. ChemInform abstract: Conversion of a protein to a homogeneous asymmetric hydrogenation catalyst by site-specific modification with a diphosphinerhodium(i) moiety[J]. Chem Infor, 1978, 9(17): 306–307. |
| [32] | Lin Y, Chen Z, Xiang Y L. Using inorganic nanomaterials to endow biocatalytic systems with unique features[J]. Trends Biotechnol, 2016, 34(4): 303–315. |
| [33] | Willner I, Basnar B, Willner B. Nanoparticle-enzyme hybrid systems for nanobiotechnology[J]. FEBS J, 2007, 274(2): 302–309. |
| [34] | Zayats M, Willner B, Willner I. Design of amperometric biosensors and biofuel cells by the reconstitution of electrically contacted enzyme electrodes[J]. Electroanalysis, 2010, 20(6): 583–601. |
| [35] | Kobsa S, Saltzman W M. Bioengineering approaches to controlled protein delivery[J]. Pedia Res, 2008, 63(5): 513–519. |
| [36] | Chang F P, Hung Y, Chang J H, et al. Enzyme encapsulated hollow silica nanospheres for intracellular biocatalysis[J]. Acs Appl Mater Interf, 2014, 6(9): 6883–6890. |
| [37] | Dr G M, Dr A H. Biologically active molecules with a "Light Switch"[J]. Angew Chem Int Edit, 2006, 45(30): 4900–4921. |
| [38] | Kohse S, Neubauer A, Pazidis A, et al. Photoswitching of enzyme activity by laser-induced pH-jump[J]. J Am Chem Soc, 2013, 135(25): 9407–9411. |
| [39] | Yi X, Fernando P, Eugenii K, et al. "Plugging into enzymes": Nanowiring of redox enzymes by a gold nanoparticle[J]. Science, 2003, 299(5614): 1877–1881. |
| [40] | Partha G, Xiaochao Y, Rochelle A, et al. Intracellular delivery of a membrane-impermeable enzyme in active form using functionalized gold nanoparticles[J]. J Am Chem Soc, 2010, 132(8): 2642–2645. |
| [41] | Miriam C, Serena M, Veronica C, et al. Protein-assisted one-pot synthesis and biofunctionalization of spherical gold nanoparticles for selective targeting of cancer cells[J]. Angew Chem Int Edt, 2012, 51(37): 9272–9275. |
 2019, Vol. 33
2019, Vol. 33