2. 南阳理工学院 生物与化学工程学院, 河南 南阳 473004
2. Nanyang Institute of Technology, College of Biological and Chemical Engineering, Nanyang 473004, China
燃油中的有机硫化物燃烧产生的硫氧化物不仅会造成酸雨、空气污染和危害人类健康, 而且会使汽车尾气净化系统中的三效催化剂中毒进一步污染环境.为此, 燃油的深度脱硫已迫在眉睫, 受到越来越多的科研工作者关注[1-3].传统的加氢脱硫(HDS)能够高效的去除硫醇、硫醚和二硫化物, 但对苯并噻吩(BT)、二苯并噻吩(DBT)和4, 6-二甲基苯并噻吩(4, 6-DMDBT)的脱除效果不够理想[4-6].为了解决燃油深度脱硫问题, 许多非加氢脱硫方法, 如生物脱硫、吸附脱硫、萃取脱硫和光氧化脱硫等方法相继被开发[7-8].其中氧化脱硫(ODS)因其具有反应条件温和, 不消耗氢气且操作简单, 对噻吩类硫化物达到超深度脱硫等优点一直备受关注, 在众多脱硫方法中被认为是最具有应用前景的方法之一.氧化脱硫过程中, 需要将燃油中的硫化物氧化成极性较高的亚砜或砜, 常用的催化剂包括钛硅沸石、离子液体、多金属氧酸盐或金属氧化物等, H2O2是一直以来所追求的绿色氧化剂[9-13].因此, 开发一类高效的、稳定的用于氧化脱硫体系的绿色环保的催化剂是一种挑战和重要目标.
多金属氧酸盐(POMs), 具有可调控的配位结构、酸碱性、氧化还原性、较好的热稳定性等在氧化脱硫体系中较好的催化活性[14-15].例如, 薛刚林等[16]制备了不同过渡金属取代的磷钼酸铯盐, 在以H2O2为氧化剂条件下, DBT的去除率达到了99.8%.此外, 在氧化脱硫体系中磷钨酸因其酸性优于其它多金属氧酸盐而被广泛研究, 如李灿等[17]合成了缺位的[C18H37N(CH3)3]5Na2[PW11O39]微乳液催化剂, 该催化剂在反应温度为30 ℃条件下BT的脱除率高达98%.近年来, 过渡金属取代金属氧酸盐中的钨或钼原子可以从分子水平对金属氧酸盐的电荷、氧化还原性及酸碱性进行调节, 使过渡金属取代的金属氧酸盐在催化领域占据非常重要的地位[18-19].然而, 金属氧酸盐催化剂在固液反应体系中易于溶解, 不利于分离和回收且无法循环使用.另外, 金属氧酸盐较低的比表面积和自身容易聚集的特点也限制了它们在催化领域的应用[20].因此, 科研研究者利用后修饰嫁接等方法将金属氧酸盐通过共价键或静电相互作用固载到固体载体上, 制备了一系列负载型多酸催化剂.王安杰等[21]合成了一类杂化材料[Bmin]3PMo12O40/SiO2, 该材料作为催化剂在60 ℃条件下, DBT的去除率为100%, 且易分离, 在循环7次后没有失去活性. Balula等[22]制备了纳米尺寸的多相催化剂PW11Zn-APTES@SiO2, 在表现出较高的催化活性的同时也能够多次循环使用.二氧化钛(TiO2)由于其较好的物理和化学稳定性、低毒、无腐蚀性和较低成本等优点, 有望成为理想候选载体被广泛研究[23].然而, 大多数负载型的金属氧酸盐催化剂合成步骤复杂, 甚至需要焙烧, 不利于实际应用. Zuhra等[24]利用溶胶-凝胶法制备了无需焙烧的PW12@TiO2催化剂, 该催化剂的催化活性与焙烧的PW12@TiO2催化剂相比具有相似的催化活性, 且循环10次依然保持其催化活性, 进一步说明了TiO2在负载型多酸催化剂制备方面是一类性能稳定的固体载体.在我们早期的工作中采用简单高效的一步模板合成法, 合成出具有核壳结构的PW12@TiO2催化剂, 该催化剂对DBT的脱除率达到99.9%, 且循环7次后催化活性几乎没有发生改变[25].作为前期工作的拓展, 我们在此工作中利用过渡金属取代的磷钨酸盐为模板剂, 硫酸钛为钛源制备了PW11M(M=Cu、Co)@TiO2催化剂, 在乙腈为溶剂, H2O2为氧化剂, 催化剂进行了模拟油的氧化脱硫催化性能评价.结果表明所制得催化剂在温和反应条件下, 对DBT的氧化脱硫性能表现出较好的催化活性和选择性.循环实验结果表明催化剂PW11Co@TiO2经过简单的分离洗涤处理后可以被连续循环使用5次, 且催化活性没有明显下降, 表明该催化反应是真正的多相反应过程.
1 实验部分 1.1 试剂与仪器硫酸钛[Ti(SO4)2·9H2O]、氯化钾(KCl)和磷钨酸(H3PW12O40·xH2O)购自天津化学试剂公司; 苯并噻吩(C8H6S)、二苯并噻吩(C12H8S)、4, 6-二甲基二苯并噻吩(C14H12S)、正辛烷(C8H18)和十四烷(C14H30)购自阿拉丁(上海)试剂有限公司; 过氧化氢(H2O2, 30 wt%)和乙腈(C2H3N)购自天津市化学试剂供销公司; 硫酸钴(CoSO4·7H2O)和硫酸铜(CuSO4)购自天津市大茂化学试剂厂.以上所有试剂均为分析纯且直接使用没有进一步提纯.
采用KBr压片, 在Nicolet Impact 410型红外光谱仪(日本岛津公司)上进行红外光谱分析, 波数扫描范围400~4000 cm-1; 拉曼光谱是在532 nm激发源下HR电子拉曼系统(日本HORIBA公司)上进行的; X-射线粉末衍射分析在Shimadzu XRD-6000型(日本岛津公司)上完成, Cu-Kα靶, 在5°~70°范围扫描速度为6°/min; XPS测定是在Thermo ESCALAB 250型谱仪(美国赛默飞公司)上完成, C 1s校准, Mg-K (1253.6 eV)为靶源; 在Shimadzu SSX-550型(日本岛津公司)扫描电子显微镜和TEMH-8100IV型(日本电子珠式会社)透射电显微镜上表征催化剂的形貌; 氮气吸附-脱附测试在液氮温度77 K, 氮气为吸附质条件下的MicromeriticsASA 2010型分析仪(美国麦克仪器公司)上实施.
1.2 实验过程 1.2.1 PW11M(M=Cu、Co)催化剂的制备将1.0 mmol磷钨酸和1.0 mmol硫酸铜、硫酸钴加入到250 mL烧瓶中, 加入30 mL去离子水, 在50 ℃水浴条件下磁力搅拌, 逐滴加入1.0 mol/L NaHCO3溶液, 调至溶液的pH值为4.0~5.0之间, 持续搅拌30 min, 在80 ℃下蒸发部分溶液, 过滤, 重结晶、烘干、备用[26].
1.2.2 PW11M(M=Cu、Co)@TiO2的制备将硫酸钛(20.0 mmol)与30 mL去离子水混合, 搅拌30 min形成溶液Ⅰ; 分别将6.0 mmol KCl与1.7 mmol PW11M (M=Cu、Co)加入到45 mL去离子水中, 超声30 min, 形成溶液Ⅱ 随后, 将溶液Ⅰ和II转移至250 mL烧瓶中, 磁力搅拌, 油浴130 ℃, 回流10 h后, 静置8 h、抽滤、去离子水洗涤、80 ℃烘干制得PW11M(M=Cu、Co)@TiO2催化剂.元素分析(ICP): PW11Cu@TiO2, P, 0.01, W, 0.63, Cu, 0.03, Ti, 0.02; PW11Co@TiO2, P, 0.01, W, 0.69, Co, 0.02, Ti, 0.02.
1.2.3 催化剂的性能测试典型反应的步骤:将催化剂(40 mg), 模拟油(5.0 mL)和乙腈(6.0 mL)依次加入20 mL单口圆底烧瓶中, 待反应温度加热到60 ℃, 加入4.0 mmol H2O2, 磁力搅拌.随时间变化有规律的移取上层油相样品并进行过滤, 用配有HP-5毛细管柱(30 m×0.25 μm×0.25 μm)岛津GC-14C型FID检测器气相色谱对反应物和产物进行定量检测.气化室和检测室温度均为280 ℃, 毛细管柱升温程序: 80 ℃保留1 min, 升温速率为10 ℃/min, 升至260 ℃, 保留1 min.
以十四烷为内标, 考察硫化物的脱除率和砜的选择性评价催化剂的催化活性.模拟油(500 mg/kg)由一定量的硫化物(BT、DBT、4, 6-DMDBT)和正辛烷配制而成.硫化物的脱除率计算公式如下:
| $ \text { S Removal }(\%)=\left(\frac{\mathrm{C}_{\mathrm{o}}-\mathrm{C}_{\mathrm{t}}}{\mathrm{C}_{\mathrm{o}}}\right) \times 100 \% $ |
式中: Co为硫化物在正辛烷的初始浓度; Ct为反应一定时间后油相中硫化物的浓度.
2 结果与讨论 2.1 催化剂的结构表征 2.1.1 FT-IR分析图 1为催化剂PW11Cu、PW11Co, PW11Cu@TiO2和PW11Co@TiO2的红外谱图, 催化剂PW11Cu@TiO2和PW11Co@TiO2在810、891、966和1066 cm-1处都出现了W-Oe-W、W-Ob-W、W=Ot和P-O的特征峰, 与PW11Cu、PW11Co的特征峰相似, 说明PW11Cu和PW11Co已经负载到了TiO2载体上, 且结构没有发生变化[17].另外, 催化剂PW11Cu@TiO2和PW11Co@TiO2分别与PW11Cu、PW11Co相比部分特征峰出现偏移, 可能是由于金属氧酸盐与二氧化钛相互作用的结果.
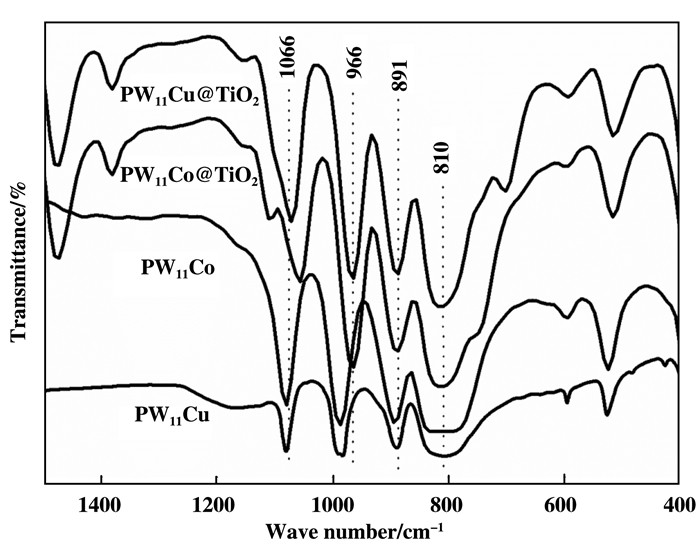
|
图 1 催化剂PW11Cu、PW11Co、PW11Cu@TiO2和PW11Co@TiO2的红外光谱图 Fig.1 The FT-IR spectra of catalyst PW11Cu, PW11Co, PW11Cu@TiO2 and PW11Co@TiO2 |
对催化剂TiO2、PW11Cu、PW11Co、PW11Cu@TiO2和PW11Co@TiO2进行拉曼表征, 由图 2可知, PW11Cu@TiO2和PW11Co@TiO2均在14、204、385和523 cm-1处出现了TiO2的特征峰, 在908、983和1058 cm-1处为PW11M(Cu、Co)的特征峰, 与催化剂TiO2、PW11Cu和PW11Co的特征峰相吻合, 进一步证实了多金属氧酸盐成功负载到了TiO2的载体上[22].表明催化剂PW11Cu@TiO2和PW11Co@TiO2结构中既有PW11Cu、PW11Co Keggin型结构又存在TiO2结构相, 说明已经制备出了PW11Cu@TiO2和PW11Co@TiO2催化剂.
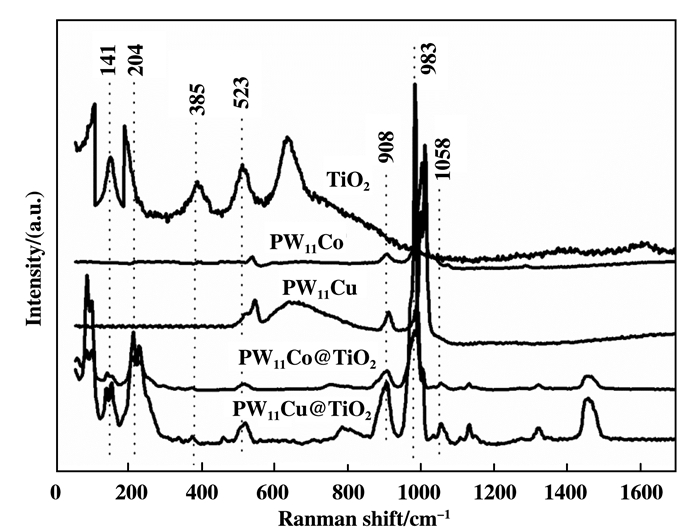
|
图 2 催化剂TiO2、PW11Cu、PW11Co、PW11Cu@TiO2和PW11Co@TiO2的拉曼光谱图 Fig.2 Raman spectra of catalyst TiO2, PW11Cu, PW11Co, PW11Cu@TiO2 and PW11Co@TiO2 |
图 3为TiO2、PW11Cu、PW11Co、PW11Cu@TiO2和PW11Co@TiO2的XRD谱图, 从图 3中可以看出, PW11Cu@TiO2和PW11Co@TiO2在2θ=11.8°、18.8°、25.2°和30.3°处为Keggin型多酸特征衍射峰(卡片号: 50-0657), 与PW11Cu和PW11Co的特征峰相一致. 2θ=58.5°、35.9°和42.7°、51.1°处分别为钴和铜元素的衍射特征峰, 表明催化剂中含有钴和铜两种过渡金属元素.此外在催化剂PW11Cu@TiO2和PW11Co@TiO2中也出现了TiO2的特征峰, 进一步说明催化剂中含有PW11Cu、PW11Co和TiO2结构相[20, 27].
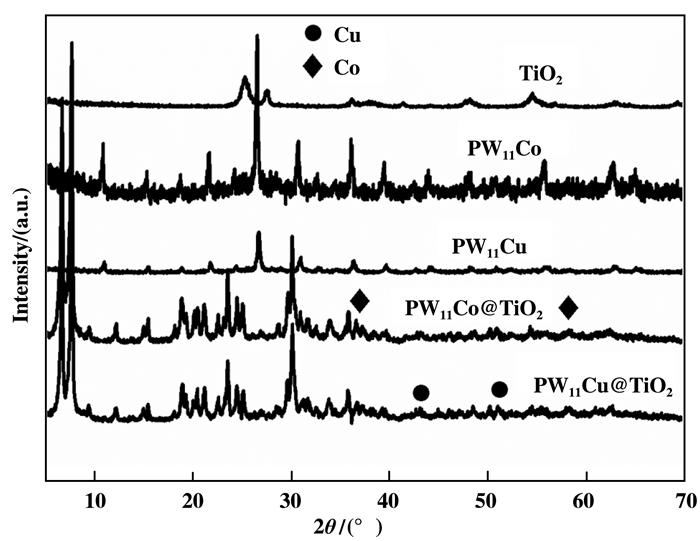
|
图 3 TiO2、PW11Cu、PW11Co、PW11Cu@TiO2和PW11Co@TiO2 XRD谱图 Fig.3 XRD patterns of TiO2, PW11Cu, PW11Co, PW11Cu@TiO2 and PW11Co@TiO2 |
图 4为催化剂PW11Co@TiO2和PW11Cu@TiO2的XPS谱图, 由图 4可见, 在781.4、798.1 eV处归属Co(Ⅱ) 2p1/2和Co(Ⅱ) 2p3/2的电子结合能; 结合能在932.3、952.2 eV处归属于Cu (Ⅱ) 2p1/2和Cu (Ⅱ) 2p3/2的信号峰.此外, 两种催化剂都在462.2、468.1 eV处出现了特征峰, 归属于Ti 2p的电子结合能.以上结果表明催化剂中的过渡金属(Cu、Co)是以2价形式存在, 且钛元素为4价的形式存在于晶体结构中的[28].
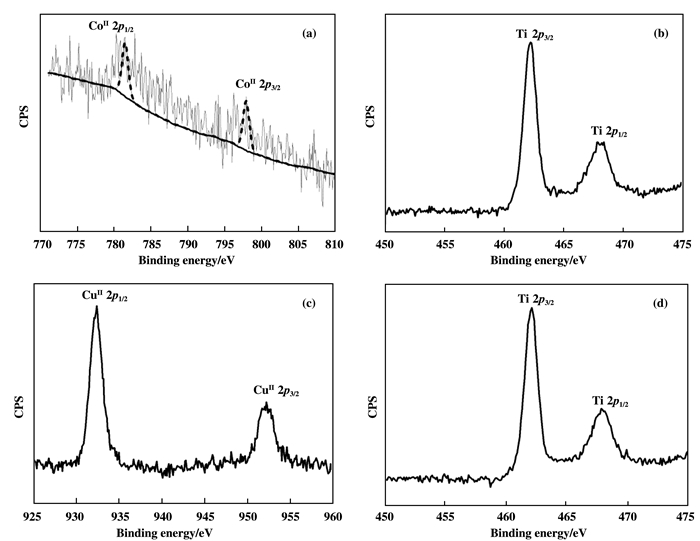
|
图 4 催化剂的XPS谱图 Fig.4 XPS spectra of catalyst a. PW11Co@TiO2; b. Co 2p, Ti 2p; c. PW11Cu@TiO2, Cu 2p; d. Ti 2p |
图 5是催化剂PW11Co@TiO2的吸附-脱附等温线和BJH孔分布图, 如图 5所示, 催化剂PW11Co@TiO2在P/P0为0.4~0.9范围内出现了封闭的滞后环, 依据IUPAC标准, 曲线归属为典型的Ⅳ等温线, 是介孔材料.另外, 采用传统的BET算法, 催化剂PW11Co@TiO2具有相对较高的比表面积72.4 m2/g和平均孔径尺寸为3.3 nm.
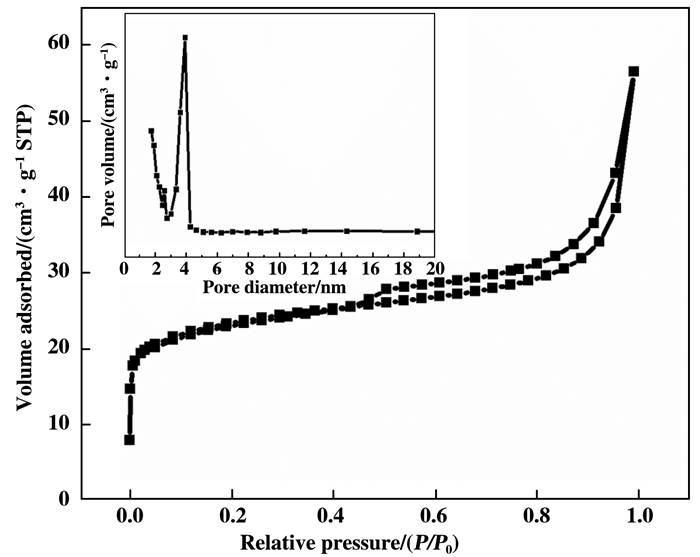
|
图 5 催化剂PW11Co@TiO2的N2吸附-脱附等温线和孔径分布图 Fig.5 N2 adsorption-desorption isotherm and pore size distribution of catalyst PW11Co@TiO2 |
图 6为催化剂PW11Co@TiO2的SEM和TEM照片, 由图 6(A)可知, 催化剂PW11Co@TiO2形貌约为尺寸120 nm左右的大小均一的球形结构.而图 6(B)进一步表明, 催化剂PW11Co@TiO2具有核壳结构.原因可能是在材料合成过程中硫酸钛以PW11Co为模板进行水解形成了以二氧化钛为壳, PW11Co为核的核壳结构.

|
图 6 催化剂PW11Co@TiO2的扫描电镜(A)和透射电镜(B)照片 Fig.6 SEM (A) and TEM (B) images of catalyst PW11Co@TiO2 |
表 1为不同催化剂在硫化物氧化脱硫反应中不同反应时间的催化性能.由表 1可见, PW11Co、PW11Cu、PW12@TiO2、PW11Co@TiO2和PW11Cu@TiO2在相似的反应条件下都表现出较高的催化活性, 且砜的选择性均接近100%.而TiO2是无活性的, 仅仅9.7%硫的脱除率来自于催化剂本身的物理吸附, 认为催化剂PW11Co@TiO2和PW11Cu@TiO2的活性物种分别为PW11Co和PW11Cu.此外, 也可以看出PW11Co@TiO2和PW11Cu@TiO2的催化活性高于PW11Co和PW11Cu, 一方面可能是由于多酸分布在载体内部避免了自身的聚集进而能够稳定存在较多的活性中心, 另一方面具有介孔结构大比表面积的球形结构更利于溶剂与底物的扩散, 增大了与活性中心接触的概率.进一步可知, PW12@TiO2的催化活性低于PW11Co@TiO2和PW11Cu@TiO2, 需要延长反应时间才能达到99.9%的脱除率, 推测可能是由于PW11Co@TiO2和PW11Cu@TiO2中存在多酸和过渡金属双活性中心的原因, 进而加快了催化剂的反应速度.
| 表 1 不同催化剂催化氧化脱硫性能影响 Table 1 Effect on catalytic oxidative desulfurization with different catalysts |
另外, 与PW11Cu@TiO2相比较, PW11Co@TiO2表现出更高的催化活性, 在反应进行40 min后, 对DBT的脱除率达到了99.7%.原因主要是由于过渡金属的氧化还原电位不同所引起的, CoⅡ>CuⅡ, 该值越大, 氧化能力俞强[29].在氧化脱硫体系中由于硫化物的性质影响脱除率, 因此, 催化剂PW11Co@TiO2对BT和4, 6-DMDBT的氧化脱硫性能进行了评价, 如表 1所示, 4, 6-DMDBT相比于BT更容易氧化, 在50 min后, 脱除率达到了99.8%, 该现象是由于硫元素的电子云密度和空间位阻所引起的, BT中硫元素较低的电子云密度不利于被氧化, 从而影响了本身的脱除效果[30-31].
2.2.2 催化反应机理推测催化剂PW11M(M=Cu、Co)@TiO2中磷钨酸与双氧水对DBT的氧化脱硫机理在先前的工作中已有报道[25], 起初W=O活性中心与双氧水反应形成{PO4[WO(O2)2]4}3-活性中间体, 该中间体进攻来自于油相中DBT硫化物的硫原子生成亚砜和再生W=O物种, 随后亚砜被活性中间体进一步氧化生成砜, W=O物种被再一次还原完成催化反应循环.由于催化剂中过渡金属的存在可能会伴随另一种可能的催化反应机理(Scheme 1), MⅡ (Co、Cu)与双氧水作用产生高价的过渡金属含氧位点(MⅢ=O), MⅢ=O与另一个双氧水进一步反应形成了过渡金属过氧化合物(MⅢ-O2), 接着MⅢ-O2与DBT反应生成砜, MⅢ-O2被还原为MⅡ.
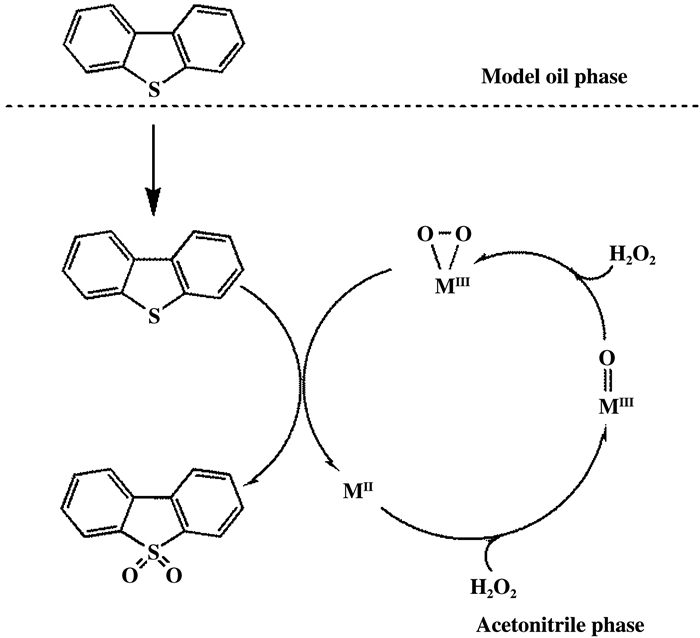
|
图示1 催化剂中过渡金属和双氧水对DBT氧化脱硫反应的机理推测 Scheme 1 Proposed mechanism for the oxidative desulfurization of DBT by hydrogen peroxide and the transition metal |
以催化剂PW11Co@TiO2为例, 进行该催化剂在反应过程中稳定性的测试, 图 7为催化剂PW11Co@TiO2对DBT的氧化脱硫反应中断实验.由图 7(b)可知, 当反应进行10 min后, 经热过滤除去反应体系中的固体催化剂, 得到澄清反应溶液, 将该溶液在相似的反应条件下继续反应30 min, DBT的脱除率基本没有发生变化, 由此可以得出, 催化剂PW11Co@TiO2在DBT氧化脱硫体系中表现出良好的稳定性, 可以作为一类多相催化剂应用到氧化脱硫反应中.催化剂PW11Co@TiO2能够稳定存在的一个主要的原因可能归因于多酸被包埋于TiO2中, 形成核壳结构, 限制了活性组分的流失, 从而使PW11Co@TiO2能够作为多相催化剂使用.
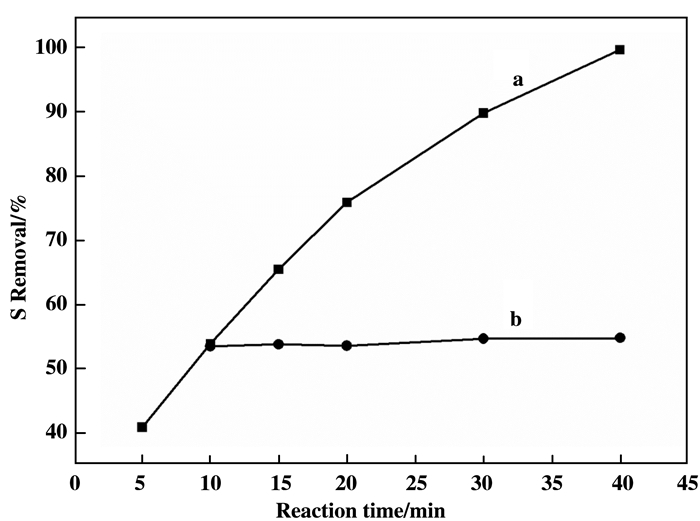
|
图 7 催化剂PW11Co@TiO2对DBT氧化脱硫的动力学曲线 Fig.7 Kinetic profiles of oxidative desulfurization of DBT over catalyst PW11Co@TiO2 Reaction conditions: DBT model oil (500 mg/kg of S) 5.0 mL; H2O2 4.0 mmol; Catalyst 40 mg; MeCN 6.0 mL; Temperature 60 ℃; All selectivities for the sulfone were nearly 100%. |
催化剂能否循环使用是评价催化剂稳定性的一个重要指标.以DBT氧化脱硫反应为模型, 在与图 7相同的反应条件下对催化剂PW11Co@TiO2进行了循环反应评价.每次评价完成后, 用乙腈洗涤过滤后的催化剂, 在80 ℃下干燥, 接着进行下一次循环实验.从图 8中可以看出, 在相似的反应条件下进行5次循环反应, 每次反应进行到40 min时催化剂对DBT的脱除率和砜的选择性均未发生明显改变.结果表明, 催化剂PW11Co@TiO2具有良好的循环使用性.
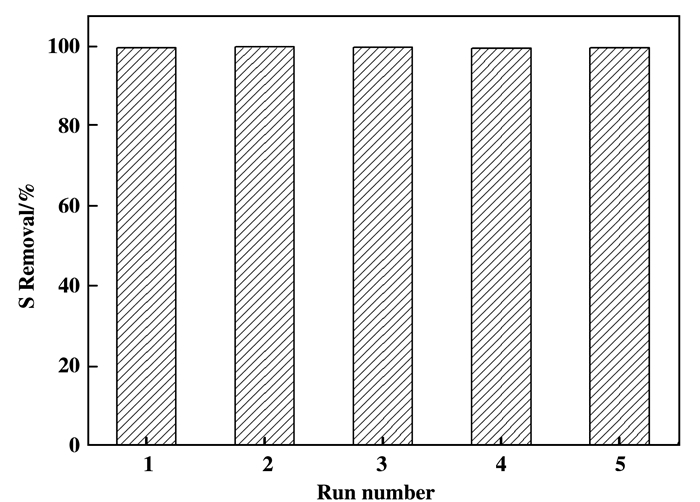
|
图 8 催化剂PW11Co@TiO2对DBT氧化脱硫的循环实验 Fig.8 Recycling experiments of catalyst PW11Co@TiO2 for the removal of DBT after 40 min reaction |
综上所述, 采用一种简单有效的方法合成了具有球形结构的适用于氧化脱硫反应体系的一类多酸基催化剂.由于催化剂PW11Co@TiO2中存在多酸和过渡金属双活性中心以及较高的Co的氧化还原值, 使其在DBT氧化脱硫反应体系中表现出最高的催化活性.此外, PW11Co@TiO2作为多相催化剂通过过滤能够很容易的从反应体系中分离、回收, 且在5次循环测试中表现出较好的催化活性. PW11Co被包埋于TiO2球中, 形成核壳球形结构, 限制了活性组分的流失是催化剂PW11Co@TiO2能够作为多相催化剂使用的一个主要原因.
| [1] |
Xu Li-li, Wang Yang, Xu Ting-ting, et al. Exfoliating polyoxometalate-encapsulating metal-organic framework into two-dimensional nanosheets for superior oxidative desulfurization[J]. Chem Cat Chem, 2018, 10(23): 5386–5390.
|
| [2] |
Weigand B C, Friend C M. Model studies of the desulfurization reactions on metal surfaces and in organometallic complexes[J]. Chem Rev, 1992, 92: 491–504.
DOI:10.1021/cr00012a001 |
| [3] |
Lian Chen-shuai(连晨帅), Dai Rong(代蓉), Tian Ren(田韧), et al. The effect of preparation method on catalytic properties over Ni-Cu bimetallic catalysts for steam reforming of ethanol(Ni-Cu双金属催化剂上乙醇水蒸气重整制氢研究-制备方法对催化性能的影响)[J]. J Mol Catal (China)(分子催化), 2019, 33(4): 297–308.
|
| [4] |
Wang Han-lu(王寒露), Yu Si-yu(余思钰), Peng Jing(彭晶), et al. Quantum chemical study on TS-1oxidation of thiophene and methylthiophene reaction mechanism(含缺陷位TS-1催化氧化噻吩及甲基噻吩反应机理的量子化学研究)[J]. J Mol Catal (China)(分子催化), 2015, 29(5): 458–466.
|
| [5] |
Galano A, Rodriguez-Gattorno R. Oxidative desulfurization (ODS) of organosulfur compounds catalyzed by peroxo-metallate complexes of WOx-ZrO2: Thermochemical, structural, and reactivity indexes analyses[J]. J Catal, 2011, 282: 201–208.
DOI:10.1016/j.jcat.2011.06.010 |
| [6] |
Mu Jin-cheng(穆金城), Yu Hai-feng(于海峰), Tian Wei-liang(田维亮), et al. Preparation and characterization of CeO2 modified SiO2-CuO composite oxide catalysts and its catalytic oxidation desulfurization performance(CeO2改性SiO-CuO复合氧化物的制备和表征以及催化氧化脱硫性能)[J]. J Mol Catal (China)(分子催化), 2017, 31(1): 92–100.
|
| [7] |
Masoomi M Y, Bagheri M, Morsali A. Application of two cobalt-based metal-organic frameworks as oxidative desulfurization catalysts[J]. Inorg Chem, 2015, 54: 11269–11275.
DOI:10.1021/acs.inorgchem.5b01850 |
| [8] |
Shu Cheng-hua, Sun Dong-hua, Zhang Hong-bo, et al. A novel process for gasoline desulfurization based on extraction with ionic liquids and reduction by sodium borohydride[J]. Fuel, 2014, 121: 72–78.
DOI:10.1016/j.fuel.2013.12.037 |
| [9] |
Ye Gan, Qi Hui, Li Xiao-lin, et al. Enhancement of oxidative desulfurization performance over UiO-66(Zr) by titanium ion exchange[J]. Chem Phys Chem, 2017, 18: 1903–1908.
DOI:10.1002/cphc.201700182 |
| [10] |
Zhu Wen-shuai, Wang Chao, Li Hong-ping, et al. One-pot extraction combined with metal-free photochemical aerobic oxidative desulfurization in deep eutectic solvent[J]. Green Chem, 2015, 17: 2464–2472.
DOI:10.1039/C4GC02425G |
| [11] |
Wang Xiao-jing, Li Fa-tang, Liu Ji-xing, et al. Preparation of TiO2 in ionic liquid via microwave radiation and in situ photocatalytic oxidative desulfurization of diesel oil[J]. Energy & Fuels, 2012, 26: 6777–6782.
|
| [12] |
Zhu Hou-yu, Guo Wen-yue, Li Ming, et al. Density functional theory study of the adsorption and desulfurization of thiophene and its hydrogenated derivatives on Pt(111): implication for the mechanism of hydrodesulfurization over noble metal catalysts[J]. ACS Catal, 2011, 1: 1498–1510.
DOI:10.1021/cs2002548 |
| [13] |
Li Si-wen, Gao Rui-ming, Zhao Jian-she. Deep oxidative desulfurization of fuel catalyzed by modified heteropolyacid: the comparison performance of three kinds of ionic liquids[J]. ACS Sus Chem Eng, 2018, 6(11): 15858–15866.
DOI:10.1021/acssuschemeng.8b04524 |
| [14] |
Coronado E, Gómez-García C J. Polyoxometalate-based molecular materials[J]. Chem Rev, 1998, 98(1): 273–296.
DOI:10.1021/cr970471c |
| [15] |
Müller A, Peters F, Pope M T. Polyoxometalates: very large clusters nanoscale magnets[J]. Chem Rev, 1998, 98(1): 239–272.
DOI:10.1021/cr9603946 |
| [16] |
Zhang Yan-jie, Gu Yi-fan, Dong Xin-bo, et al. Deep oxidative desulfurization of refractory sulfur compounds with cesium salts of mono-substituted phosphomolybdate as efficient catalyst[J]. Catal Lett, 2017, 147(7): 1811–1819.
DOI:10.1007/s10562-017-2078-5 |
| [17] |
Zhang Yong-na, Lü Hong-ying, Wang Lu, et al. The oxidation of benzothiophene using the Keggin-type lacunary polytungstophosphate as catalysts in emulsion[J]. J Mol Catal A: Chem, 2010, 332: 59–64.
DOI:10.1016/j.molcata.2010.08.021 |
| [18] |
Long De-liang, Burkholder E, Cronin L. Polyoxometalate clusters, nanostructures and materials: From self assembly to designer materials and devices[J]. Chem Soc Rev, 2007, 36: 105–121.
DOI:10.1039/B502666K |
| [19] |
Kozhevnikov I V. Catalysis by heteropoly acids and multicomponent polyoxometalates in liquid-phase reactions[J]. Chem Rev, 1998, 98(1): 171–198.
DOI:10.1021/cr960400y |
| [20] |
Ma Yuan-yuan, Tan Hua-qiao, Wang Yong-hui, et al. Polyoxometalate-based metal-organic coordination networks for heterogeneous catalytic desulfurization[J]. Cryst Eng Comm, 2015, 17: 7938–7947.
DOI:10.1039/C5CE01533B |
| [21] |
Zhang Jian, Wang Ai-jie, Li Xiang, et al. Oxidative desulfurization of dibenzothiophene and diesel over [Bmim]3PMo12O40[J]. J Catal, 2011, 279: 269–275.
DOI:10.1016/j.jcat.2011.01.016 |
| [22] |
Nogueira L S, Ribeiro S, Granadeiro C M, et al. Novel polyoxometalate silica nano-sized spheres: efficient catalysts for olefin oxidation and the deep desulfurization process[J]. Dalton Trans, 2014, 43: 9518–9528.
DOI:10.1039/C3DT53444H |
| [23] |
Yan Xue-min, Mei Ping, Lei Jia-heng, et al. Synthesis and characterization of mesoporous phosphotungstic acid/TiO2 nanocomposite as a novel oxidative desulfurization catalyst[J]. J Mol Catal A: Chem, 2009, 304: 52–57.
DOI:10.1016/j.molcata.2009.01.023 |
| [24] |
Zuhra Z, Lei Huan, Zhao Zi-peng, et al. Necessity of calcination in the preparation of phosphotungstic acid@TiO2 composites. A case study on the facile sol-gel synthesis of nanospheres and their superior performance in catalytic oxi-desulfurization[J]. New J Chem, 2017, 41: 8382–8389.
DOI:10.1039/C7NJ01234A |
| [25] |
Gao Hong-cheng, Wu Xiao-nan, Sun Dong-mei, et al. Preparation of core-shell PW12@TiO2 microspheres and oxidative desulfurization performance[J]. Dalton Trans, 2019, 48: 5749–5755.
DOI:10.1039/C9DT00203K |
| [26] |
Zonnevijlle F, Tourne C M, Tourne G F. Preparation and characterization of iron (Ⅲ)-and rhodium (Ⅲ)-containing heteropolytungstates. Identification of novel oxo-bridged iron (Ⅲ) dimmers[J]. Inorg Chem, 1982, 21: 2751–2757.
DOI:10.1021/ic00137a042 |
| [27] |
Longoni G, Cabrera R L P, Polizzi S, et al. Shape-controlled TiO2 nanocrystals for Na-ion battery electrodes: the role of different exposed crystal facets on the electrochemical properties[J]. Nano Lett, 2017, 17: 992–1000.
DOI:10.1021/acs.nanolett.6b04347 |
| [28] |
Shi Zhi-qiang, Dong Zheng-ping, Sun Jian. Filled cobalt nanoparticles into carbon nanotubes as a rapid and high-efficiency catalyst for selective epoxidation of styrene with molecular oxygen[J]. Chem Eng J, 2014, 237: 81–87.
DOI:10.1016/j.cej.2013.09.107 |
| [29] |
Pathan S, Patel A. Transition-metal-substituted phosphomolybdates: catalytic and kinetic study for liquid-phase oxidation of styrene[J]. Indus Eng Chem Res, 2013, 52: 11913–11919.
DOI:10.1021/ie400797u |
| [30] |
Ding Yu-xiao, Zhu Wen-shuai, Li Hua-ming, et al. Catalytic oxidative desulfurization with a hexatungstate/aqueous H2O2/ionic liquid emulsion system[J]. Green Chem, 2011, 13: 1210–1216.
DOI:10.1039/c0gc00787k |
| [31] |
Duarte T A G, Pires S M G, Santos I C M S, et al. A Mn(Ⅲ) polyoxotungstate in the oxidation of organosulfur compounds by H2O2 at room temperature: an environmentally safe catalytic approach[J]. Catal Sci Technol, 2016, 6: 3271–3278.
DOI:10.1039/C5CY01564B |
 2019, Vol. 33
2019, Vol. 33


