2. 东南大学能源与环境学院 能源热转换及其过程测控教育部重点实验室, 江苏 南京 210096
2. Key laboratory of Energy Thermal Conversion and Control of Ministry of Education, school of energy and environment, Southeast University, Nanjing 210096, China
氨法选择性催化还原(NH3-SCR)是目前公认的最有效的脱硝技术, 广泛用于火电厂、柴油发动机等的尾气处理[1].催化剂性能的优劣直接决定了SCR脱硝工艺的可靠性.其中, V2O5-WO3/TiO2催化剂是最受青睐的商用催化剂, 其工作温度约为350~410 ℃, 需布置于燃煤烟气脱硫除尘装置之前, 此段烟气中SO2浓度高并且含有大量的粉尘, 会严重损害、毒化催化剂.通常含有大量的碱金属(Na、K等), 碱土金属(Mg、Ca等)和重金属(As、Pb、Cu、Zn等), 导致SCR催化剂中毒失活, 最终缩短催化剂的运行时间[2-3].烟气中的重金属(如As、Pb等)对其SCR性能有很大的中毒作用, 而目前催化剂重金属中毒失活研究多集中于As氧化物, 针对Pb、Cu和Zn等其他重金属的研究较少[4-5]. Larsson等[6]发现Zn元素的引入会造成催化剂空隙堵塞、比表面积减小, 且其认为催化剂失活的一个重要原因是亚微米级Zn物种的渗透. Yu等[7]研究发现Pb物种的引入会导致商业SCR脱硝催化剂Brønsted酸位点减少和物理结构破坏, 从而造成催化剂中毒失活. Khodayari等[8]发现随着Pb含量的增加, 催化剂脱硝活性和NH3吸附能力显著降低, 失活的主要原因是致毒物质在酸性位点的竞争性吸附. Jiang等[9]发现Pb中和V基催化剂表面的酸性位点, 并抑制了NH3分子的活化.他们还发现Pb的沉积导致V5+/V4+的数量减少, 因此SCR催化剂逐渐失活.研究发现烟气中的ZnCl2气溶胶颗粒扩散到催化剂的孔隙中, 阻塞了孔隙和中孔, 或者形成了多孔层结构并沉积在催化剂表面上, 导致外部扩散阻力增加, 催化剂活性降低[10].催化剂的更换是SCR系统维护成本的主要部分, 因此, 我们研究的目的是基于实验结果, 探究比较Pb、Zn和Cu对商业催化剂的失活机理.
浸渍法已广泛用于重金属对催化剂活性影响的研究. Guo等[11]采用浸渍法制备了Zn和Pb中毒Ce/TiO2催化剂, 并比较了其对性能测试的毒性影响以及催化剂微观结构和性能的变化. Raziyeh等[8]研究了蜂窝状V2O5-WO3/TiO2催化剂Pb中毒机理.在大多数研究中, 只模拟了SCR催化剂的金属毒性机理, 而没有考虑实际应用过程中重金属的含量.因此, 我们采用浸渍法制备了高Pb、Cu、Zn含量的商业催化剂, 并结合XRD、BET、SEM、NH3/NO-TPD、H2-TPR以及in situ DRIFTS等方法对催化剂催化活性和理化性能进行了系统的研究与分析.
1 实验部分 1.1 新鲜催化剂新鲜商业V2O5-WO3/TiO2催化剂具体含量如表 1所示.活性组分由5%WO3和2%V2O5组成, 基于TiO2(锐钛矿)载体.
| 表 1 新鲜V2O5-WO3/TiO2催化剂的组分 Table 1 Composition of fresh V2O5-WO3/TiO2 catalyst |
采用浸渍法制备重金属(Pb、Cu和Zn)中毒脱硝催化剂:将蜂窝状商业脱硝催化剂(来源于某电厂自留的催化剂)(V2O5-WO3/TiO2)切成长32、宽32、高40 mm的块状, 分别以Pb(CH3COO)2、Cu(NO3)2和Zn(CH3COO)2(均为标准溶液)为重金属前驱体, 浸渍不同质量分数的Pb、Cu和Zn, 其中Pb的质量分数分别为4.0%、6.0%和8.0%; Cu的质量分数分别为0.07%、0.14%和0.28%; Zn的质量分数分别为0.4%、0.8%和1.2%.先将重金属前驱体溶解于去离子水中, 然后加入块状商业脱硝催化剂浸泡12 h, 将浸泡后的催化剂110 ℃烘干, 马弗炉450 ℃焙烧4.5 h即得到重金属中毒的商业脱硝催化剂.制得的不同重金属中毒的商业脱硝催化剂分别记为4.0% Pb、6.0% Pb、8.0% Pb; 0.07% Cu、0.14% Cu、0.28% Cu; 0.4% Zn、0.8% Zn、1.2% Zn.此外, 新鲜催化剂记为Fresh.
1.3 催化活性测试在固定床石英反应器中测试催化剂的活性, 每次测试催化剂用量约为100 mg(0.450~0.280 mm).实验混合气由0.08%NO、0.08%NH3、5%O2组成, N2作为平衡气, 气时空速(GHSV)为6000 mL·g-1·h-1.通过烟气分析仪检测出口处的各反应气体浓度(NO、NO2和O2), 催化剂活性通过NO转化率(%)评估.
催化剂对NOx的转化率由公式(1)计算:
| $ {\rm{N}}{{\rm{O}}_{x{\rm{ Conversion }}}} = \frac{{{\rm{C}}{{\left( {{\rm{N}}{{\rm{O}}_x}} \right)}_{{\rm{in}}}} - {\rm{C}}{{\left( {{\rm{N}}{{\rm{O}}_x}} \right)}_{{\rm{out }}}}}}{{{\rm{C}}{{\left( {{\rm{N}}{{\rm{O}}_x}} \right)}_{{\rm{in }}}}}} \times 100\% $ | (1) |
式(1)中, NOxConversion表示NOx转化率, C(NOx) = C(NO) + C(NO2), C(NOx)in和C(NOx)out分别表示入口和出口NOx浓度.
1.4 催化剂表征催化剂比表面积分析选用的是北京金埃谱科技有限公司生产的V-Sorb2800型比表面积分析仪.首先通过预处理消除催化剂中水以及杂质对测定结果的影响, 然后以N2为吸附质, 在-196 ℃液氮下进行催化剂比表面积测定.
催化剂的晶型变化情况采用日本Ultima IV型号的X射线衍射仪测试. X射线源为铜(Cu)靶, 加速电压设置为40 kV, 加速电流为80 mA, 2θ/θ偶合连续扫描, 扫描速度为0.05°/秒, 步长0.02°角度为10°~80°.
使用日本HitachiS-3000N型号的扫描电子显微镜(SEM)研究催化剂的微观结构和形态.在获取图像之前, 采用喷金预处理以增强催化剂样品表面的导电性.放大倍率在5~300 000之间, 设定的加速电压为15.0 kV.
通过原位漫反射傅立叶红外光谱仪对NH3和NO在催化剂表面吸附情况进行研究.采用美国赛默飞公司制造的原位反应池和美国热电公司生产的Nicolet6700型红外装置组装进行原位红外实验, 其光谱范围为1000~2000 cm-1, 分辨率为4 cm-1, 扫面次数为32次/min.
NH3/NO-TPD和H2-TPR都采用浙江泛泰仪器有限公司FINSORB3010型程序升温化学吸附仪. NH3/NO-TPD实验测试:催化剂用量为70 mg, 采用石英棉固定在U形石英管中, 载气为氦气, 流量为20 mL/min并升温至100 ℃预处理20 min, 然后降至常温通入20 min 5% NH3/N2(或5% NO/N2)至吸附饱和; 再用He对样品进行吹扫, 以10 ℃/min的速率升温至800 ℃, 进行程序升温脱附, 最终获得NH3/NO-TPD图谱.
H2-TPR实验测试:称取20 mg催化剂装填在U形石英管并用耐高温石英棉进行固定, 样品的预处理在Ar气氛下升温至200 ℃稳定35 min后冷却至常温, 10% H2/Ar还原气流量设置为20 mL/min, 以10 ℃/min的速率升温至800 ℃进行程序升温还原, 采集TCD检测器信号并最终得到H2-TPR图谱.
2 结果与讨论 2.1 催化活性测试如图 1所示, Fresh催化剂表现出较高的催化活性, 在450 ℃时, NOx转化率高达95%.相比之下, Pb中毒催化剂的NOx转化率明显降低, 且毒化作用随Pb含量的增加而增强.在测试温度范围内, 8.0% Pb催化剂对NOx的转化率均低于20%.但是, 如图 1(b-c)所示, 0.28% Cu或1.2% Zn催化剂依然保持着较高的脱硝活性, 在450 ℃时其活性均超过75%.在实际的燃煤电厂中, 由Cu或Zn引起的催化剂失活比由Pb引起的催化剂失活轻.结果表明, 实际运行过程中催化剂表面重金属积累到一定程度才会使催化剂脱硝效果显著下降, 且含量多的重金属对催化剂中毒的影响更大.
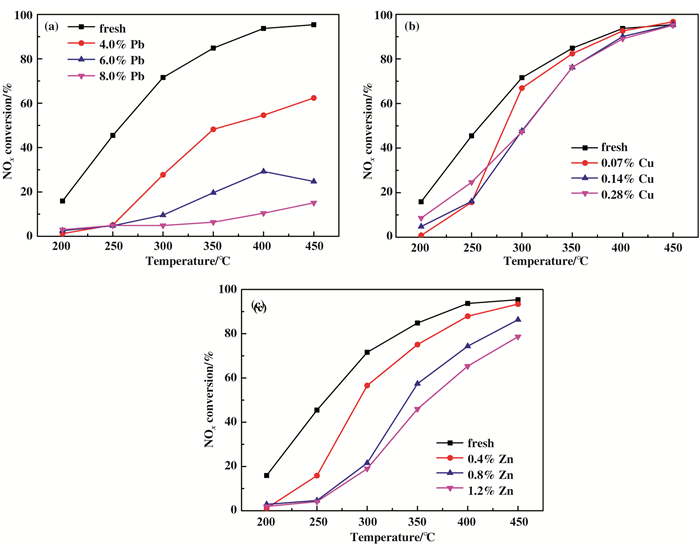
|
图 1 新鲜催化剂和重金属中毒催化剂的NOx转化率 Fig.1 NOx conversion of fresh and heavy metal poisoned catalysts (a) Pb-poisoned; (b) Cu-poisoned; (c) Zn-poisoned |
从表 2可以看出, Fresh催化剂的BET表面积为48.26 m2·g-1, 而不同Pb, Cu和Zn含量浸渍后, 催化剂表面积均明显减小. 8.0% Pb、0.28% Cu和1.2% Zn中毒催化剂的BET表面积分别仅为34.38、36.37和44.75 m2·g-1.这表明重金属的存在可能导致催化剂孔隙堵塞, 且堵塞情况随着重金属含量的增加而加剧.
| 表 2 催化剂的BET表面积 Table 2 BET surface area of the catalyst |
图 2为Fresh、8.0% Pb、0.28% Cu和1.2% Zn催化剂的XRD衍射图谱.结果表明, 检测到的主要特征峰归属于锐钛矿TiO2(PDF#21-1272), 而未检测到VOx和WOx物种对应的衍射峰.这表明重金属Pb、Cu、Zn的存在并未导致活性组分VOx和WOx在以TiO2为载体的商业脱硝催化剂上的结晶度显著增强.此外, 在8.0%Pb和0.28%Cu催化剂中分别检测到少量由Pb氧化物和Cu氧化物引起的弱特征峰, 而1.2%Zn催化剂的图谱与新鲜催化剂几乎相同, 可能由于Zn含量较低且分散性较好或均以小晶粒存在.相比于Fresh催化剂, 重金属中毒催化剂中TiO2载体的衍射峰强度不受3种重金属的影响, 同时, 催化剂表面仍然存在高分散非晶态的VOx和WOx.因此, 重金属如Pb、Cu和Zn的存在并未对商业催化剂中VOx、WOx和TiO2的结晶度以及活性组分的分散性造成明显影响[12].
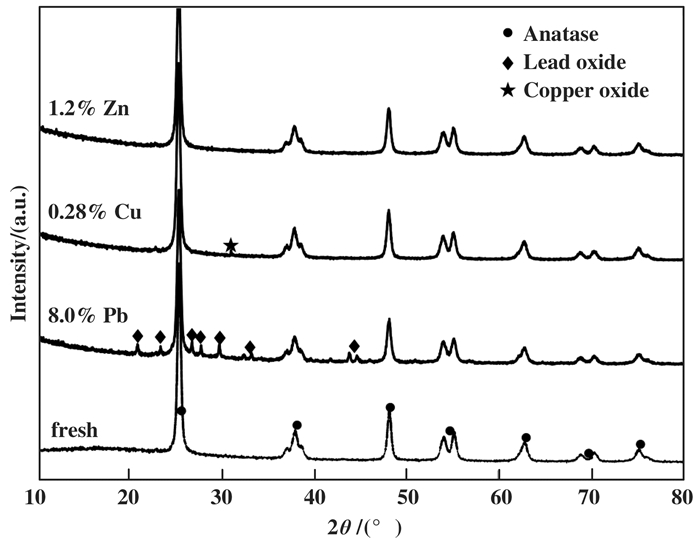
|
图 2 Fresh、8.0% Pb、0.28% Cu和1.2% Zn催化剂XRD图 Fig.2 XRD patterns of Fresh, 8.0% Pb, 0.28% Cu and 1.2% Zn catalysts |
Fresh催化剂和重金属中毒催化剂的SEM结果如图 3所示.可以发现, Fresh催化剂表面活性组分分布均匀, 而重金属中毒后的催化剂均发生团聚, 在相同放大倍率下, 中毒催化剂的颗粒明显大于Fresh催化剂, 其中以8.0%Pb催化剂团聚现象最为明显, 且大量PbO会阻塞催化剂孔隙, 催化剂比表面积减小, 这与催化剂比表面积分析结果一致.结果表明, 重金属中毒催化剂表面沉积的重金属氧化物会阻塞催化剂的孔结构, 引起催化剂团聚, 导致催化活性大幅降低.

|
图 3 (a) Fresh, (b) 8.0% Pb, (c) 0.28% Cu和(d) 1.2% Zn催化剂SEM图 Fig.3 SEM patterns of (a) fresh, (b) 8.0% Pb, (c) 0.28% Cu, and (d) 1.2% Zn catalysts |
不同催化剂NH3吸附in situ DRIFTS测试结果如图 4所示, 较为深入地阐述了重金属Pb、Cu、Zn对催化剂表面NH3吸附活性位点的影响. Fresh催化剂的特征峰主要出现在1671、1595、1446和1193 cm-1处, 其中, 1671和1446 cm-1附近的特征峰分别归因于与Brønsted酸位点结合的NH4+的对称以及不对称变形振动, 1595和1193 cm-1处的特征峰是由Lewis酸位点上吸附的NH3的对称和不对称变形振动引起[13-14], 而1595 cm-1处的特征峰强度相对较弱.可以发现随着温度的升高, 各酸强度均有所减弱.当温度升至400 ℃时, 1671和1446 cm-1处的带明显减弱甚至完全消失, 而1193 cm-1处的特征峰仍然存在, 这表明吸附在Lewis酸位点的NH3更稳定[15-16].另外, 如图 4所示, Brønsted酸位点为催化剂表面NH3吸附活性主要活性位[17].图 4(b-d)显示了不同含量的Pb中毒催化剂的NH3吸附光谱.与Fresh催化剂相比, 4.0% Pb催化剂在1200 cm-1附近的Lewis酸强度明显减弱, 且随着Pb含量的增加, 1200 cm-1附近的Lewis酸位点的强度显著减弱甚至完全消失, 且其他位置酸性位点均逐渐减弱.可以发现, 当Pb含量为8.0%(重量百分比)时, 仅1644和1456 cm-1处弱Brønsted酸位点存在于催化剂表面, 而当脱附温度升至250 ℃时, 8.0%Pb催化剂表面的Brønsted和Lewis酸位点的NH3吸附完全解吸.这表明Pb的添加会导致催化剂的酸强度降低, 对Brønsted酸位点的影响尤其明显, 最终导致NH3吸附能力减弱, 催化剂的脱硝性能降低.图 4(e-g)揭示了Cu对催化剂NH3吸附能力的影响, 可以发现, 与Pd作用相似的是催化剂表面的酸强度均有所减弱, 但在1200 cm-1处的Lewis酸强度随着Cu含量的增加, 该处NH3吸附峰的减弱趋势相比于1450 cm-1处Brønsted酸位点处缓慢, 这说明Cu对Brønsted酸的影响更明显, 导致催化剂表面上的酸位点强度降低.值得注意的是, 当温度升至250 ℃时, 吸附在Lewis酸位点上的NH3的1200 cm-1特征峰依旧存在, 而吸附在Brønsted酸位点上的NH3谱带完全消失.这再次证实吸附在Lewis上的NH3物种更稳定[18].如图 4(h-j))所示, 由于Zn的加入使催化剂表面1671 cm-1附近的特征峰消失, 1610 cm-1处的特征峰增强, 表明Zn对Brønsted酸中心的影响更明显.综合分析表明, 重金属的存在显著削弱了催化剂对NH3的吸附能力, Pb对催化剂表面的Brønsted酸位点和Lewis酸位点均有明显的毒化作用, 而Cu和Zn对Brønsted酸位点影响显著.
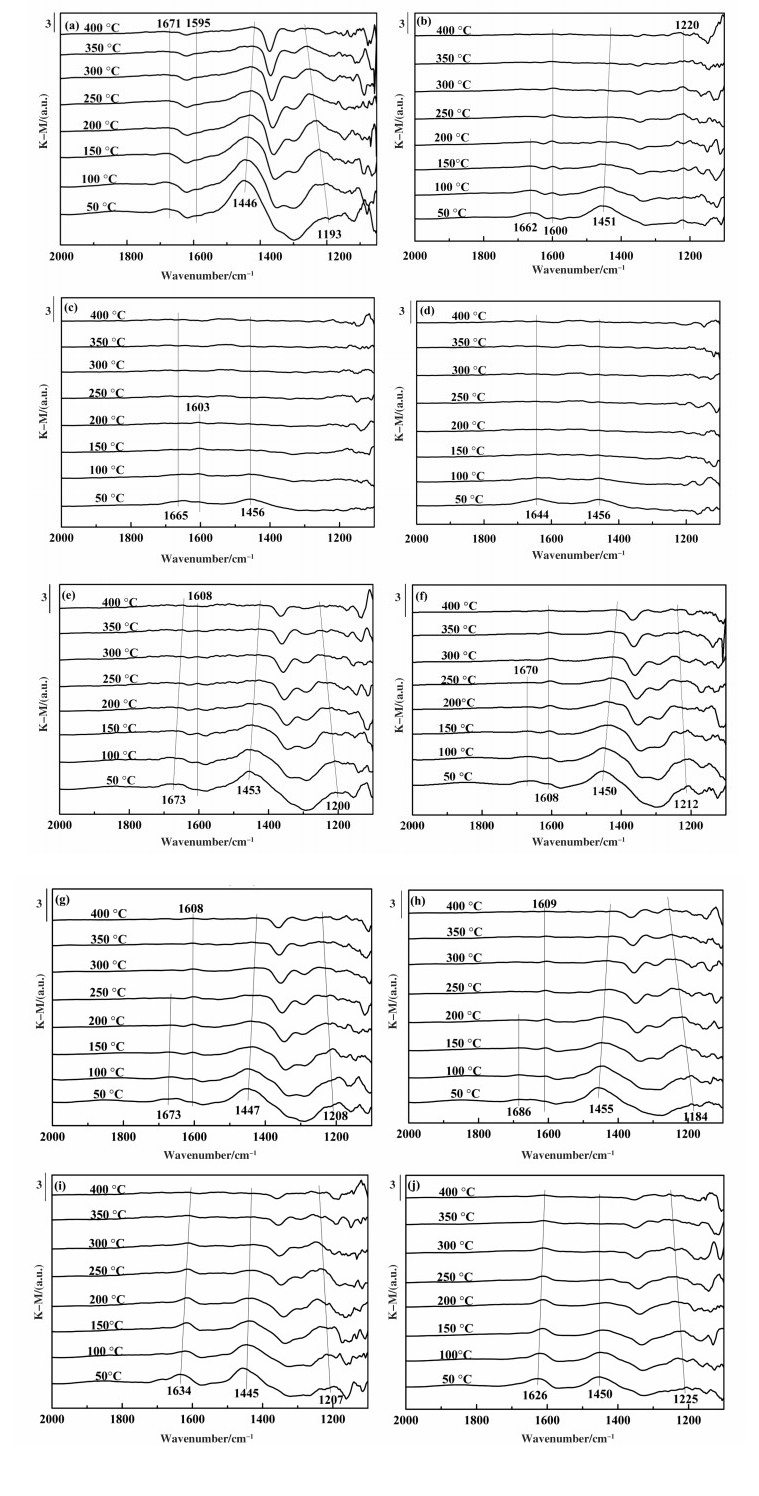
|
图 4 Fresh和重金属中毒催化剂NH3吸附in situ DRIFTS光谱 Fig.4 Fresh and heavy metal poisoned catalysts NH3 in situ DRIFTS adsorption spectra (a) fresh; (b) 4.0% Pb; (c) 6.0% Pb; (d) 8.0% Pb; (e) 0.07%Cu; (f) 0.14%Cu; (g) 0.28%Cu; (h) 0.4%Zn; (i) 0.8% Zn; (j) 1.2%Zn |
图 5显示了Fresh催化剂和不同浓度重金属中毒催化剂的NH3饱和吸附结果.经过对比可以发现, 重金属(Pb、Cu、Zn)使催化剂NH3吸附的饱和时间缩短. Fresh催化剂NH3吸附饱和所需时间为25 min, 而不同含量Pb的存在使饱和时间变为10 min, 不同含量Cu和Zn的存在使饱和时间变为20 min.更重要的是, 重金属中毒催化剂于1205、1446、1595和1671 cm-1处的特征峰均有所减弱, 表明在重金属的影响下, 催化剂表面的Brønsted和Lewis酸含量大大减少.此外, 2062和2015 cm-1处的吸附峰分别归属于2 ν(V = O)和2 ν(W = O)的泛频峰段. Pb, Cu和Zn明显削弱了V = O和W = O吸附峰, 表明由于重金属的存在, 活性位V = O和W = O减少.它还进一步证明了重金属的中毒作用不仅反映在催化剂的NH3吸附能力减弱, 而且对活性位点的影响同样十分明显.
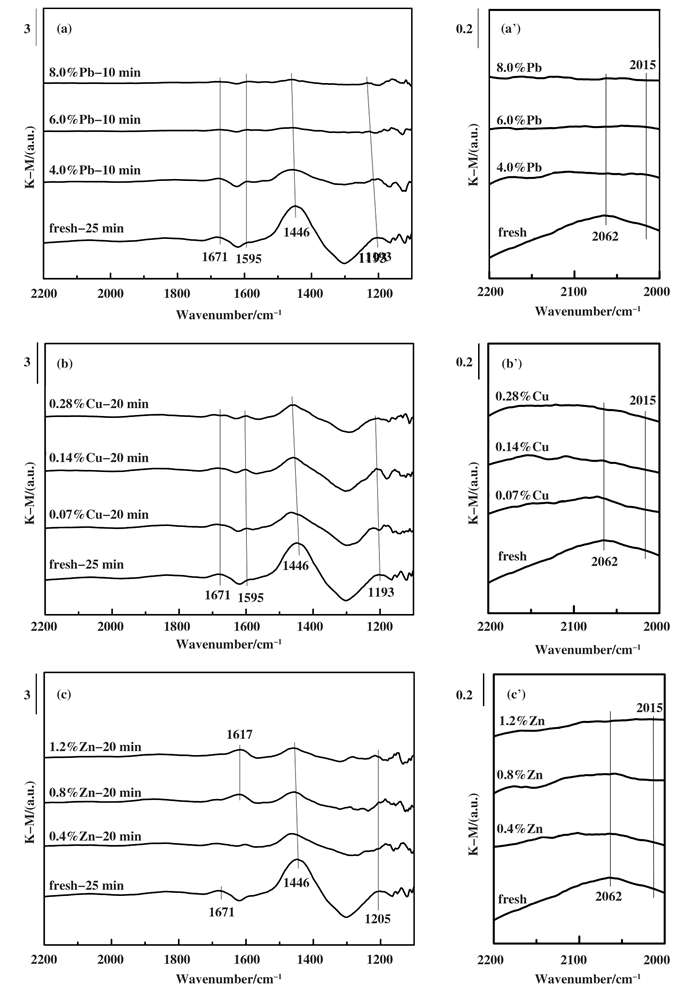
|
图 5 NH3饱和吸附重金属中毒和新鲜催化剂的in situ DRIFTS光谱 Fig.5 NH3 adsorption saturated infrared spectrum of heavy metal poisoned and fresh catalysts (a) Pb-poisoned; (b) Cu-poisoned; (c) Zn-poisoned and (a') (b') and (c') are partial enlargement of (a) (b) and (c) |
图 6所示为不同温度下NO在催化剂表面的吸附状态, 常温下, 预吸附NO 1 h后进行升温脱附. Fresh催化剂表面NOx的吸附峰主要位于1619、1368和1225 cm-1处, 重金属(Pb、Cu、Zn)的添加使催化剂表面NOx的吸附峰有所偏移, 主要位于1614~1600、1368、1291~1281、1244和1229 cm-1附近. 1619 cm-1处的带属于吸附的NO2[21], 1225 cm-1处的带可以指定为硝酸盐[22].在1368 cm-1处的特征峰归因于在250 ℃下出现的二亚硝酸盐, 其强度随着温度的进一步升高而增强, 表明二亚硝酸盐可以稳定地存在于催化剂表面[23].然而, 随着温度的升高, 吸附在1619 cm-1附近的NO2和在1225 cm-1处的桥接硝酸盐峰的吸附峰强度显著降低.此外, 图 6(b-d)显示, 随着Pb含量的增加, 1614~1600 cm-1处的特征峰增强, 当温度升至400 ℃时, 表现出良好的吸附NO2稳定性.对于8.0%Pb催化剂, 1481 cm-1处的带被指定为单点硝酸盐[24].图 6(e-g)显示Cu的存在导致1225 cm-1处特征峰消失, 而1244 cm-1处出现新的特征峰, 其可归属于硝酸盐, 表明Cu改变了催化剂表面上SCR反应的中间产物.随着Cu含量的增加, 1614 cm-1处的谱带强度逐渐增强.如图 6(h-j)所示, 催化剂表面NO的吸附受Zn的影响较小.类似地, 当Zn含量增加时, 1614 cm-1处的特征峰强度增强.
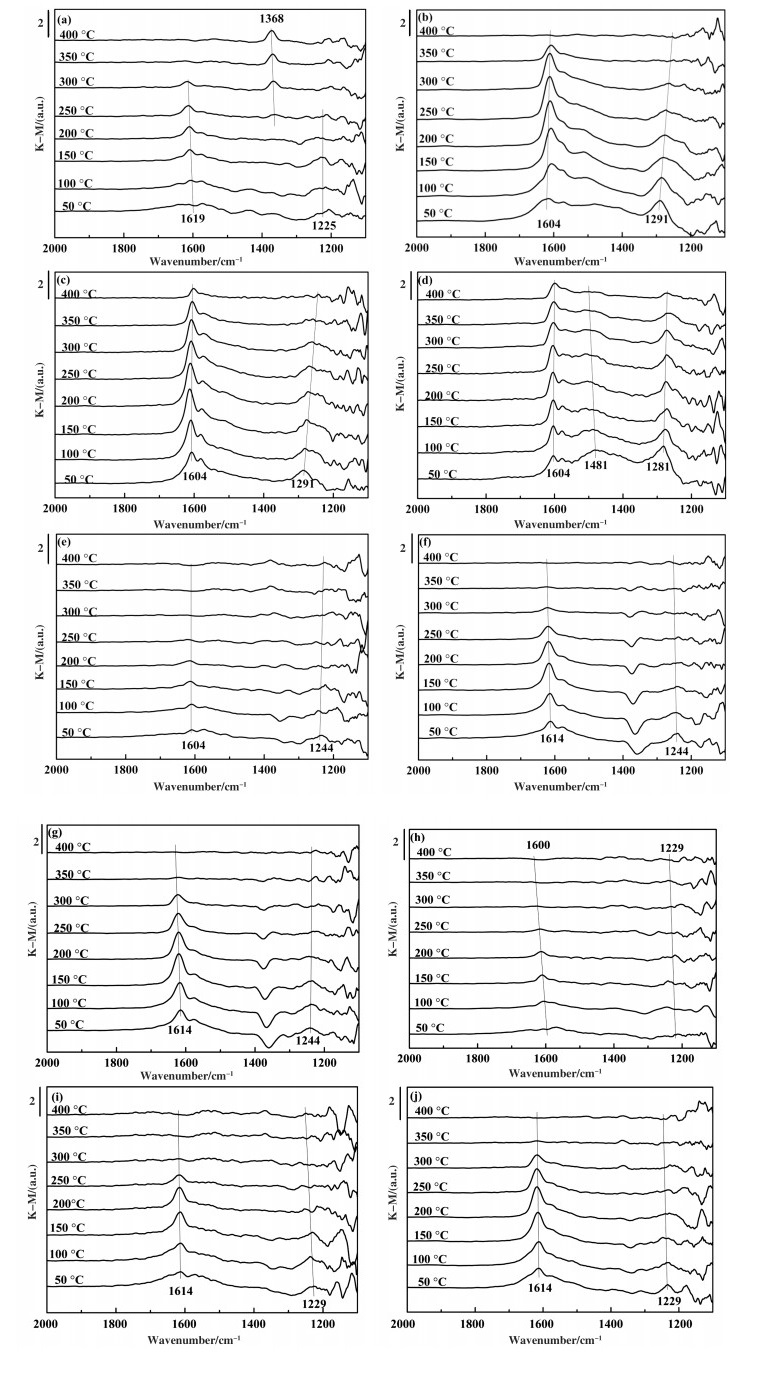
|
图 6 催化剂上NO吸附in situ DRIFTS光谱 Fig.6 In situ DRIFTS of NO adsorption on catalysts (a) Fresh; (b) 4.0% Pb; (c) 6.0% Pb; (d) 8.0% Pb; (e) 0.07% Cu; (f) 0.14% Cu; (g) 0.28% Cu; (h) 0.4% Zn; (i) 0.8% Zn; (j) 1.2% Zn |
综上所述, 重金属的存在对催化剂表面吸附的NO形态有一定影响.不同重金属的作用稍有不同, Pb、Cu、Zn主要使催化剂表面吸附态NO2的吸附峰强度增加(尤其是中高温段的吸附更加稳定), 重金属的含量增加使得这种趋势更为显著.
图 7为常温下NO在不同催化剂表面的吸附饱和in situ DRIFTS测试结果, 对比发现, 重金属Pb和Cu使得催化剂对NO吸附饱和时间增加, 而Zn没有. Fresh催化剂和Zn中毒催化剂NO吸附饱和所需时间为30 min, Pb和Cu中毒催化剂的时间为40 min, 虽然Zn中毒并未使得催化剂NO吸附饱和时间发生改变, 但可以发现Pb、Cu、Zn的存在使不同形式的NO吸附峰强度发生变化.此外, 重金属含量的增加使催化剂表面NO吸附能力增强, 尤其是1604 cm-1附近的NO2吸收峰.然而, 一些研究[25-26]报道在SCR反应中NO2的氧化能力强于O2, 更容易氧化NH3最终生成N2O, 一些学者[27]进一步指出NO2与NH3反应的N2O形成率快于N2.因此, 尽管NO2的存在有利于加速SCR反应, 但易促进N2O的形成, 且亚硝酸盐酰基的增强吸附形式也有利于NO2的形成(亚硝酸盐ac是NO氧化成NO2的第一步)[28], 而重金属Pb、Cu、Zn增加了催化剂表面NO2的生成, 因此对SCR脱硝反应中NOx的脱除产生了负面影响.
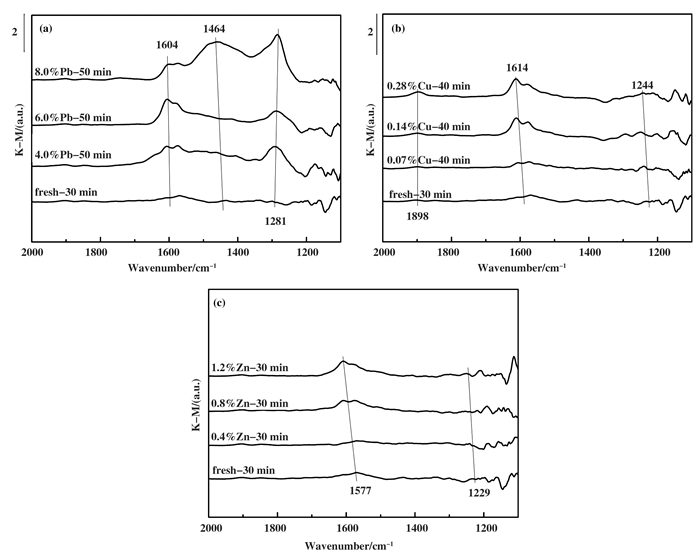
|
图 7 重金属中毒和新鲜催化剂NO饱和吸附的in situ DRIFTS图谱 Fig.7 NO adsorption saturated infrared spectrum of heavy metal poisoned and Fresh catalysts (a) Pb-poisoned; (b) Cu-poisoned; (c) Zn-poisoned |
图 8显示了在50~650 ℃的温度范围内测得的Fresh和重金属中毒催化剂的NH3-TPD曲线.如图 8所示, 催化剂的NH3脱附峰分别位于100~200、200~400和400~600 ℃的温度范围内, 这可分别归因于催化剂表面的物理吸附NH3、Brønsted酸位点[29-30]NH4+以及Lewis酸位点NH3的解吸[30-31].与Fresh催化剂相比, 在图 8(a)中, Pb中毒催化剂的NH3脱附峰强度均有所降低.值得注意的是, 400~600 ℃之间的脱附峰完全消失, 同时200~400 ℃之间的脱附峰也逐渐降低, 表明Pb抑制了NH3在催化剂表面的吸附, 催化剂表面Brønsted酸位点也逐渐减少, 最终造成Pb中毒催化剂对NOx脱除性能有所降低.图 8(b)显示了Cu中毒催化剂表面NH3的脱附峰减弱, 但更为显著的影响是400~600 ℃温度段的脱附峰向低温段偏移, 表明在Cu中毒催化剂的Lewis酸位点上吸附的NH3与Fresh催化剂相比, Cu中毒催化剂更易脱附.从图 8(c)可以看出, Zn中毒催化剂该温度段的脱附峰逐渐变小, 尤其是400~600 ℃温度段的酸位点, 表明NH3吸附量越来越少. NH3-TPD分析结果与催化剂的NH3吸附及饱和情况红外分析结果具有较好的一致性.
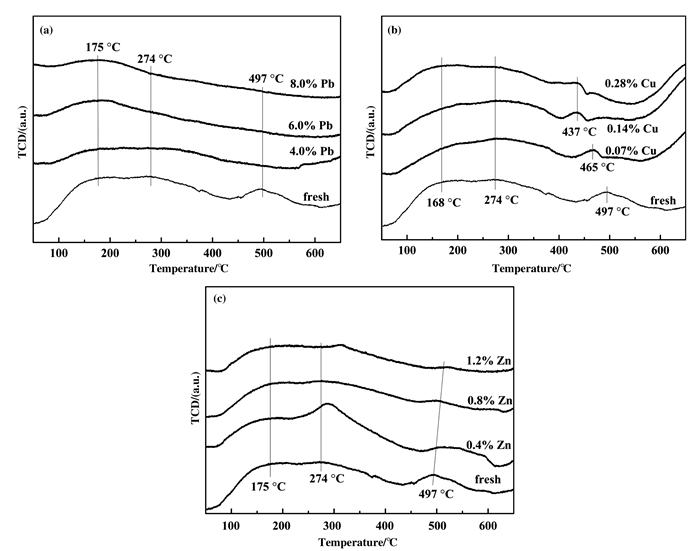
|
图 8 Fresh和中毒催化剂的NH3-TPD曲线 Fig.8 NH3-TPD profiles of fresh and poisoned catalysts (a) Pb-poisoned; (b) Cu-poisoned; (c) Zn-poisoned |
Fresh和重金属中毒催化剂在50~650 ℃范围内的NO-TPD曲线如图 9所示. NO-TPD图谱上在不同温度段出现了NO不同吸附态的脱附峰, 表明不同吸附态的氮氧化物具有不同的热稳定性. NOx在催化剂表面脱附形态根据热稳定性排序主要有:以分子形式吸附的NO(脱附温度低于150 ℃)以及亚硝酸酰基物种(脱附温度低于300 ℃), 以及高温段的硝酸盐物种[32-33].由图 9(a)可以看出, Pb中毒催化剂的硝酸盐物种在495~550 ℃范围内的弱脱附峰向低温方向移动.同时, 中高温段(200~400 ℃)的脱附峰强度及面积随着Pb含量的增加而增大, 这表明Pb使亚硝酸酰基物种的吸附形态增加, 使得硝酸盐的脱附温度降低.在图 9(b)中, 对于Cu中毒催化剂, 随着Cu含量的增加, 亚硝酸盐在495~550 ℃范围内的脱附峰逐渐消失, 中温脱附峰的强度和面积略有增加, 但中高温段脱附峰数量及脱附温度变化较小, 这可能与中毒催化剂中Cu含量较低有关.由图 9(c)可以发现, 相比于Fresh催化剂, Zn中毒催化剂在200~300 ℃范围内脱附峰的强度和面积显著增加, 说明Zn的存在使NO多以亚硝酸酰基物种的形式存在于催化剂表面, 硝酸盐的存在形式有所减少. Kijlstra等[34]研究发现SCR反应过程中亚硝酸酰基类持续与吸附态的NH3反应, 而硝基类在低温SCR条件下能稳定存在, 占据催化剂的部分活性中心, 有可能降低催化活性.亚硝酸盐酰基不仅可以与NH3反应形成N2, 而且可以被氧化成稳定的硝酸盐.对于商业脱硝催化剂(V2O5/WO3-TiO2)而言, 在温度高于300 ℃时其脱硝性能优良, 通过NO-TPD图谱也可发现新鲜商业脱硝催化剂的亚硝酸酰基脱附峰强而硝酸盐类脱附峰较弱, 但Pb、Cu、Zn中毒催化剂的硝酸盐类(300~500 ℃)脱附峰强度及峰面积都有所增大, 即中毒催化剂表面硝酸盐类物种较多, 导致催化剂失活.其中, Pb中毒催化剂表现最明显, 结合NO吸附原位红外分析结果, 进一步揭示了重金属Pb、Cu、Zn中毒催化剂活性降低原因, 且与中毒催化剂活性测试结果一致.
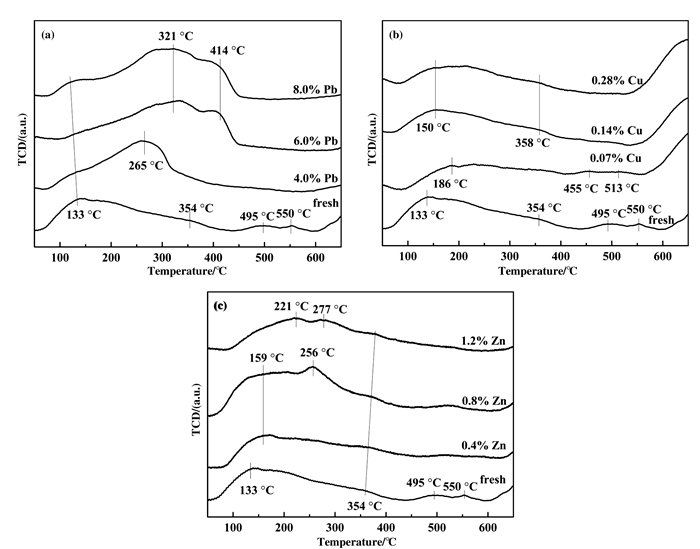
|
图 9 Fresh和中毒催化剂的NO-TPD曲线 Fig.9 NO-TPD profiles of fresh and poisoned catalysts (a) Pb-poisoned; (b) Cu-poisoned; (c) Zn-poisoned |
采用H2-TPR技术催化剂样品的还原性进行评估, 测试结果如图 10所示.均可观察到3个还原峰(peak I, II和III), 分别对应于V5+→V4+, W6+→W4+和V4+→V3+的部分还原[35-36].相比于Fresh催化剂, Pb中毒催化剂的还原温度略有升高, 同时氧化还原能力有所增强. Pb含量的增加使V5+→V4+的还原温度逐渐升高, 而W6+→W4+和V4+→V3+的还原温度不随Pb含量的增加而上升(图 10(a)), 表明Pb含量的增加对V氧化还原能力影响较大, 且PbOx本身具有一定的氧化性, 表面上会增加催化剂的氧化还原能力, 但这仅仅是因为催化剂表面的金属氧化物消耗了氢气, 实际上与催化剂表面的活性组分存在竞争氧化氢气.图 10(b)中Cu中毒催化剂则具更优的氧化还原能力和较低的还原温度, 可以发现各温度段的还原峰都向低温段偏移, 这是由于CuO本身的还原温度较低, 因而当催化剂Cu中毒后受CuO影响最终使催化剂氧化还原能力增加, 还原温度降低.但随着Cu含量的增加, V5+→V4+的还原峰面积逐渐减小, 表明Cu对V的还原有抑制作用. Zn中毒催化剂的还原峰面积虽然有所增大, 但低温段V5+→V4+的能力增强, 高温段V4+→V3+的能力减弱, 同时还原温度整体向高温段偏移[37-38], 表明Zn中毒使催化剂更难被还原.
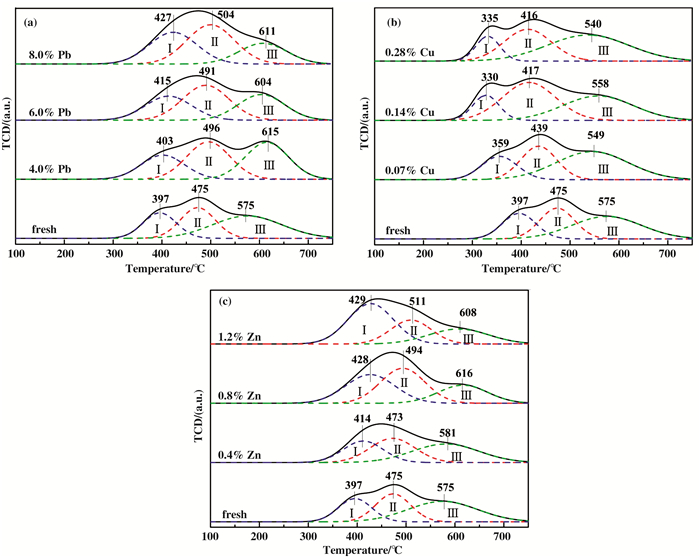
|
图 10 Fresh和重金属中毒催化剂的H2-TPR谱 Fig.10 H2-TPR spectrum of fresh and heavy metal poisoned catalysts (a) Pb-poisoned; (b) Cu-poisoned; (c) Zn-poisoned |
综上, 重金属中毒所形成的金属氧化物会增加催化剂的氧化还原能力, 但这主要是源于重金属氧化物本身的氧化还原能力.催化剂的还原温度普遍向高温移动, 说明重金属使催化剂中活性组分更难参与反应, Cu除外.这主要由于CuO的还原温度较低有利于催化剂SCR反应的进行[39-40].
| 表 3 催化剂H2-TPR分析结果 Table 3 Analysis results of catalyst H2-TPR |
重金属对催化剂的致毒作用主要包括物理作用和化学作用两方面.物理作用体现在重金属会沉积在催化剂表面堵塞孔隙同时覆盖活性位点阻碍NH3和NO与活性位的接触, 导致催化剂发生团聚, 比表面积减小, 从而降低催化剂活性; 而化学作用是使催化剂中毒的主要原因, 重金属能直接进入催化剂内部与催化剂活性位发生反应, 且由于Pb, Cu和Zn的存在会降低催化剂表面上Brønsted酸和Lewis酸的强度, 其中对Brønsted酸位点的影响尤其明显, 重金属中毒催化剂对NH3的吸附能力显著降低.同时, 重金属会使催化剂表面吸附的NOx向不利于脱硝反应的进行, 不仅使NO吸附形式中硝酸盐类物种增多, 而且促进了N2O的生成.重金属氧化物的存在使催化剂中的活性组分更难参与SCR反应, 最终导致催化剂失活.
3 结论重金属催化剂中毒失活是由化学和物理中毒的耦合作用导致的, 尤其是Pb中毒催化剂.与Fresh催化剂相比, Pb, Cu和Zn的加入导致微孔和中孔阻塞, 进而降低了催化剂比表面积, 且中毒催化剂的BET比表面积随着重金属含量的增加而缓慢下降.与新鲜催化剂相同, 重金属中毒催化剂结晶度和分散性没有变化, 中毒后催化剂中TiO2载体依然以锐钛矿相存在, 但催化剂的活性位点被覆盖. Pb, Cu和Zn的存在会降低催化剂表面上Brønsted酸和Lewis酸的强度, 尤其是Brønsted酸, 这最终会削弱NH3吸附和活化的能力.吸附的NO2对重金属中毒催化剂表面的吸附峰强度增强, 随着重金属含量的增加, 增长趋势更明显, 而NO2的增加有可能促进N2O的形成. H2-TPR结果表明, 形成的金属氧化物(Cu除外)增加了催化剂的氧化还原能力, 但催化剂的还原温度通常转向高温, 表明重金属使催化剂中的活性组分更难参与SCR反应.因此, 重金属中毒催化剂的脱硝活性明显降低.
| [1] |
a. Li X, Li J H, Peng Y, et al. Regeneration of commercial SCR catalysts: Probing the existing forms of arsenicoxide[J]. Environ Sci Technol, 2015, 49 (16): 9971-9978. b. Zhou Jin-hui(周锦晖), Li Guo-bo(李国波), Wu Peng(吴鹏), et al. The As poisoning mechanism over commercial V2O5 -WO3/TiO2 catalyst (商业V2O5 -WO3/TiO2脱硝催化剂砷中毒机理)[J]. J Mol Catal(China)(分子催化), 2018, 32 (5): 444-453. c. Kong Ling-peng(孔令朋), Miao Jie(苗杰), Li Ming-hang(李明航), et al. Performances of selective catalytic reduction of NO with CO over CuMnCeLa-O /γ-Al2O3 catalyst (CuMnCeLa-O /γ-Al2O3催化剂助燃脱硝性能研究)[J]. J Mol Catal(China)(分子催化), 2018, 32 (4): 295-304. |
| [2] |
a. Jiang Y, Gao X, Wu W, et al. Review of the deactivation of selective catalytic reduction denitration catalysts[J]. P CSEE, 2013, 33 (14): 18-31. b. Fang Qi-long(方祺隆), Zhu Bao-zhong(朱宝忠), Sun Yun-lan(孙运兰), Study on the performance of low temperature de-NOx based on Mn-Fe / Al2O3 catalysts(Mn-Fe / Al2O3催化剂的低温脱硝性能研究)[J]. J Mol Catal(China)(分子催化), 2018, 32 (4): 305-314. c. Tang Nan(唐南), Huang Yan(黄妍), Li Yuan-yuan(李元元), et al. Low temperature selective catalytic reduction of NO with NH3 over Fe-Mn catalysts prepared by hydrothermal method(水热法制备铁锰催化剂脱硝性能及抗水抗硫性能研究)[J]. J Mol Catal(China)(分子催化), 2018, 32 (3): 240-248. |
| [3] |
Li X, Li J, He X, et al. Poisoning mechanism and regeneration process of the denitration catalyst[J]. Chem Ind Eng Progr, 2015, 12(34): 4129–4138.
|
| [4] |
Kong M, Liu Q, Wang X, et al. Performance impact and poisoning mechanism of arsenic over commercial V2O5-WO3/TiO2 SCR catalyst[J]. Catal Commun, 2015, 72: 121–126.
DOI:10.1016/j.catcom.2015.09.029 |
| [5] |
Gao X, Du X S, Fu Y C, et al. Theoretical and experimental study on the deactivation of V2O5 based catalyst by lead for selective catalytic reduction of nitric oxides[J]. Catal Today, 2013, 25(1): 625–630.
|
| [6] |
Larsson A C, Einvall J, Andersson A, et al. Targeting by comparison with laboratory experiments the SCR catalyst deactivation process by potassium and zinc salts in a large-scale biomass combustion boiler[J]. Energy Fuel, 2006, 20(4): 1398–1405.
DOI:10.1021/ef060077u |
| [7] |
Yu Y, Wang J, Chen J, et al. Regeneration of commercial selective catalyst reduction catalysts deactivated by Pb and other inorganic elements[J]. J Environ Sci, 2016, 47(9): 100–108.
|
| [8] |
Khodayari R, Odenbrand C. Deactivating effects of lead on the selective catalytic reduction of nitric oxide with ammonia over a V2O5/WO3/TiO2 catalyst for waste incineration applications[J]. Ind Eng Chem Res, 1998, 37(4): 1192–1202.
|
| [9] |
Jiang Y, Gao X, Zhang Y, et al. Effects of PbCl2 on selective catalytic reduction of NO with NH3 over vanadia-based catalysts[J]. J Hazard Mater, 2014, 274: 270–278.
DOI:10.1016/j.jhazmat.2014.04.026 |
| [10] |
Sun J, Wang L, Zhang S, et al. ZnCl2/phosphonium halide: An efficient lewis acid/base catalyst for the synthesis of cyclic carbonate[J]. J Mol Catal A-Chem, 2006, 256(1/2): 295–300.
|
| [11] |
Guo R, Lu C, Pan W, et al. A comparative study of poisoning effect of Zn and Pb on Ce/TiO2 catalyst forlow temperature selective catalytic reduction of NO with NH3[J]. Catal Commun, 2015, 59: 136–139.
DOI:10.1016/j.catcom.2014.10.006 |
| [12] |
Jiang Y, Gao X, Zhang Y, et al. Effects of PbCl2 on elective catalytic reduction of NO with NH3 over vanadia-based catalysts[J]. J Hazard Mater, 2014, 274: 270–278.
DOI:10.1016/j.jhazmat.2014.04.026 |
| [13] |
Tsyganenko A, Pozdnyakov D, Filimonov V. Infrared study of surface species arising from ammonia adsorption on oxide surfaces[J]. J Mol Struct, 1975, 29(2): 299–318.
DOI:10.1016/0022-2860(75)85038-1 |
| [14] |
Lange F, Schmelz H, Knozinger H. Infrared-spectroscopic investigations of selective catalytic reduction catalysts poisoned with arsenic oxide[J]. Appl Catal B-Environ, 1996, 8: 245–265.
DOI:10.1016/0926-3373(95)00071-2 |
| [15] |
Amores J, Escribano V, Ramis G, et al. An FI-IR study of ammonia adsorption and oxidation over anatase-supported metal oxides[J]. Appl Catal B-Environ, 1997, 13(1): 45–58.
|
| [16] |
Lietti L, Forzatti P, Ramis G, et al. Chemical, structural and mechanistic aspects on NOx SCR over commercial and model oxide atalysts[J]. Catal Today, 1998, 42(1/2): 101–116.
|
| [17] |
Inomata M, Miyamoto A, Murakami Y. Mechanism of the reaction of NO and NH3 on vanadium oxide catalyst in the presence of oxygen under the dilute gas condition[J]. J Catal, 1980, 62(1): 140–148.
|
| [18] |
Liu Q, Liu Z, Li C. Adsorption and activation of NH3 during selective catalytic reduction of NO by NH3[J]. Chin J Catal, 2006, 27(7): 636–646.
DOI:10.1016/S1872-2067(06)60035-1 |
| [19] |
Vuurman M, Stufkens D, Oskam A, et al. Combined raman and IR study of MO(x)-V2O5/Al2O3 (MO(x)=MoO3, WO3NiO, CoO) catalysts under dehydrated conditions[J]. J Chem Soc Faraday Trans, 1996, 92(17): 3259–3265.
DOI:10.1039/FT9969203259 |
| [20] |
Liu Y, Liu Z, Mnichowicz B, et al. Chemical seactivation of commercial vanadium SCR catalysts in diesel emission control application[J]. Chem Eng J, 2016, 287: 680–690.
DOI:10.1016/j.cej.2015.11.043 |
| [21] |
Yeom Y, Wen B, Sachtler W, et al. NOx reduction from diesel emissions over a non transition metal zeolite catalyst: Amechanistic study using FTIR spectroscopy[J]. J Phy Chem B, 2004, 108(17): 5386–5404.
DOI:10.1021/jp037504e |
| [22] |
Nicosia D, Czekaj I, Cher O. Chemical deactivation of V2O5/WO3-TiO2 SCR catalysts by additives and impurities from fuels, Lubrication Oils and Urea Solution: Part Ⅱ. characterization study of the effect of alkali and alkaline earth metals[J]. Appl Catal B-Environ, 2008, 77(3): 228–236.
|
| [23] |
Koebel M, Madia G, Raimondi F, et al. Enhanced reoxidation of vanadia by NO2 in the fast SCR reaction[J]. J Catal, 2002, 209(1): 159–165.
DOI:10.1006/jcat.2002.3624 |
| [24] |
Cerruti L, Modone E, Guglielminotti E, et al. Infrared study of nitric oxide adsorption on magnesium oxide[J]. J Chem Soc Faraday Trans, 1974, 70(4): 729–739.
|
| [25] |
Tang X, Li J, Sun L, et al. Origination of N2O from NO reduction by NH3 over β-MnO2 and α-Mn2O3[J]. Appl Catal B-Environ, 2010, 99(1): 156–162.
|
| [26] |
Koebel M, Madia G, Raimondi F, et al. Enhanced reoxidation of vanadia by NO2 in the fast SCR reaction[J]. J Catal, 2002, 209(1): 159–165.
DOI:10.1006/jcat.2002.3624 |
| [27] |
Koebel M, Elsener M, Kleemann M. Urea-SCR: Apromising technique to reduce NOx emissions from automotive diesel engines[J]. Catal Today, 2000, 59(3): 335–345.
|
| [28] |
Tang N, Liu Y, Wang H, et al. Mechanism study of NO catalytic oxidation over MnOx/TiO2[J]. Catal J Phy Chem C, 2011, 115(16): 8214–8220.
DOI:10.1021/jp200920z |
| [29] |
Pena D, Uphade B, Smirniotis P. TiO2-Supported metal oxide catalysts for Low-Temperature selective catalytic reduction of NO with NH3I. Evaluation and characterization of first row transition metals[J]. J Catal, 2004, 221(2): 421–431.
DOI:10.1016/j.jcat.2003.09.003 |
| [30] |
Roy S, Viswanath B, Hegde M, et al. Low-temperature selective catalytic reduction of NO with NH3 over Ti0.9- M0.1O2-Delta (M = Cr, Mn, Fe, Co, Cu)[J]. J Phy Chem C, 2008, 112(15): 6002–6012.
DOI:10.1021/jp7117086 |
| [31] |
Lonyi F, Valyon J, Engelhardt J, et al. Characterization and catalytic properties of sulfated ZrO2-TiO2 mixed oxides[J]. J Catal, 1996, 160(2): 279–289.
|
| [32] |
She X, Flytzani-Stephanopoulos M. The role of AgO alspecies in silver-alumina catalysts for the selective catalytic reduction of NOx with methane[J]. J Catal, 2006, 237(1): 79–93.
|
| [33] |
Zhang R, Alamdari H, Kaliaguine S. Catalytic conversion of NO and C3H6 in exhaust gases over silver catalysts under stoichiometric or excess oxygen[J]. Catal Lett, 2007, 119(1/2): 108–119.
|
| [34] |
Kijlstra W, Brands D, Smit H, et al. Mechanism and kinetic modeling of the selective catalytic reduction of NO with NH3 over MnOx/Al2O3 at low temperatures[J]. Div Petrol Chem, 1997, 42(3): 634–638.
|
| [35] |
Peng Y, Si W, Li X, et al. Comparison of MoO3 and WO3 on arsenic poisoning V2O5/TiO2catalyst: DRIFTS and DFT study[J]. Appl Catal B-Environ, 2016, 181: 692–698.
DOI:10.1016/j.apcatb.2015.08.030 |
| [36] |
Wang X, Shi A, Duan Y, et al. Catalytic performance and hydrothermal durability of CeO2-V2O5-ZrO2/WO3-TiO2 based NH3-SCR catalysts[J]. Catal Sci Technol, 2012, 2(7): 1386–1395.
DOI:10.1039/c2cy20140b |
| [37] |
Koranne M, Goodwin J, Marcelin G. Characterization of silica- and alumina-supported vanadia catalysts using temperature programmed reduction[J]. J Catal, 1994, 148(1): 369–377.
DOI:10.1006/jcat.1994.1217 |
| [38] |
Held A, Kowalska-Ku J, Nowińska K. Epoxidation of propene on vanadium species supported on silica supports of different structure[J]. Catal Commun, 2012, 17(5): 108–113.
|
| [39] |
Li X, Li J, Peng Y, et al. Regeneration of commercial SCR catalysts: Probing the existing forms of arsenic oxide[J]. Environ Sci Technol, 2015, 49(16): 9971–9978.
DOI:10.1021/acs.est.5b02257 |
| [40] |
Peng Y, Li J, Si W, et al. Deactivation and regeneration of a commercial SCR catalyst: Comparison with alkali metals and arsenic[J]. Appl Catal B-Environ, 2015, 168/169: 195–202.
DOI:10.1016/j.apcatb.2014.12.005 |
 2019, Vol. 33
2019, Vol. 33


