2. 武汉理工大学 材料科学与工程学院, 湖北 武汉 430070
2. School of Materials Science and Engineering, Wuhan University of Technology, Wuhan 430070, China
随着社会经济的快速发展, 化石能源的需求不断增加, 其燃烧引起的二氧化碳(CO2)排放量也随之增加.截至目前, 大气中的CO2浓度已达到了415 mg·kg-1 (据2019年5月15日美国国家海洋和大气管理局统计), 逼近其极限值(450 mg·kg-1)[1].目前, 因CO2的过量排放引起的全球变暖及一系列环境问题日益严重.然而从化学的角度审视, CO2是一种廉价易得, 安全无毒, 绿色环保, 储量丰富且可再生的优质碳源, 将CO2转化为高附加值的精细化工品是一条极具潜力和应用前景的合成途径.因此, 这一领域已经成为绿色化学和合成化学的研究热点[2-8].
氨基甲酸酯类化合物是一类用途广泛的有机化合物, 在农药领域中可用作杀虫剂、除草剂、杀菌剂等[9-11], 具有环境污染小、降解快、非目标生物毒性低、不易产生耐药性等特点.另一方面, 由于其结构中含有多种活性基团, 因此常作为化学反应中间体, 可以与醛酮、不饱和烃和多元醇等化合物反应生成异氰酸酯[12]、碳酸二烷基酯[13]、聚乙烯胺[14]以及各种杂环化合物[15].此外, 氨基甲酸酯可用作氨基的保护基团, 特别是在多肽合成过程中, 可以有效地抑制聚合反应的发生, 令其难以形成肽键[16].
氨基甲酸酯的传统制备方法是通过光气等与相应的胺类化合物反应合成, 但这些制备方法产率较低, 原料毒性大, 反应过程中会产生氯代产物(HCl等), 对设备要求高、成本大, 且极易造成安全隐患和环境污染.近些年来, 采用CO2作为光气的代替品合成氨基甲酸酯取得了不少进展, 其研究成果主要分为两类: CO2、胺与亲电试剂的三组分反应, 如炔烃[17]、醇[18]、卤代烃[19-21]、碳酸二甲酯[22]等; CO2与偶联试剂的二组分反应, 如氨基醇、邻氨基苯炔、联烯胺等[23-25].其中炔丙醇、CO2、仲胺三组分反应合成β-羰基氨基甲酸酯的途径具有原子经济性高、原料廉价易得、操作步骤简单、反应过程绿色无污染等诸多优点, 在近些年来备受关注.目前已经开发出了: Ag[26-31]、Cu[32-33]、Fe[34]、Ru[35]、7-甲基-三氮杂环十二烯(MTBD)[36]等几种策略.然而, 这些策略普遍需要高压高温等苛刻的反应条件, 并且回收和再利用反应中的催化剂较为困难.
离子液体(ILs)是指完全由阴阳离子组成的液体, 具有熔点低、溶解能力强、热稳定性好、性质可调的特点, 在CO2的吸附与活化方面有着独特的应用[37-44].此前, 我们课题组曾开发了AgBr/离子液体催化体系[44], 能够在常压下将一系列具有不同取代基的底物转化为目标氨基甲酸酯, 并且该体系循环5次之后催化活性没有明显下降.基于此, 我们试图发展廉价易得、环境友好的Cu(Ⅱ)来代替Ag(Ⅰ)作为催化剂, 在低温常压下将多种炔丙醇与仲胺与CO2通过简单的“一锅法”合成β-羰基氨基甲酸酯.
1 实验部分 1.1 试剂和仪器如无特殊说明, 本实验所使用CuCl2、CuBr2、CuSO4、Cu(OAc)2等铜催化剂购买于Aladdin公司, 纯度高于99%, 底物炔丙醇和仲胺以及后处理所用到的溶剂购买于Aladdin、Sigma-Aldrich、TCI、Macklin、Alfa和安耐吉公司, 且均直接使用.反应中用到的CO2是由武汉市翔云工贸有限责任公司生产, 气体纯度为99.999%.
NMR数据均由Bruker Avance Ⅲ HD(德国Bruker公司, 500 MHz)测得, 1H NMR的化学位移以TMS(0)为标准, 13C NMR的化学位移以CDCl3(77.0)作为标准. ICP数据由全谱直读等离子体发射光谱仪Prodigy 7测得(美国利曼-莱伯斯公司).
1.2 实验方法 1.2.1 CuCl2/[Emim][OAc]体系催化CO2、炔丙醇、胺三组分反应生成β-羰基氨基甲酸酯将体积为10 mL的Schlenk瓶置于100 ℃的烘箱中干燥4 h后, 分别加入CuCl2(13.4 mg, 0.1 mmol)、炔丙醇(5.0 mmol)、咪唑型离子液体(IL, 2 mmol), 仲胺(5.0 mmol), 然后通入CO2, 将瓶内的气体置换3次, 保持体系内CO2气压为0.1 MPa, 随后在45 ℃的恒温条件下搅拌反应12 h.反应完成后, 用20 mL乙醚萃取3次, 将上层无水乙醚萃取液收集, 用旋转蒸发仪除去溶剂, 得到粗产品, 将粗产品通过柱色谱分离得到目标产物, 洗脱剂均采用石油醚/乙酸乙酯, 比例为100:1~20:1, 所有产物均经NMR及质谱确认无误[33, 44], 数据表征如下:
吡咯烷-1-羧酸2-羰基-3-甲基丁-2-醇酯(3aa), 无色油状液体, 1H NMR (500 MHz, CDCl3) δ 3.43-3.38 (m, 4H), 2.18 (s, 3H), 1.94-1.87 (m, 4H), 1.49 (s, 6H). 13C NMR (126 MHz, CDCl3) δ208.0, 153.9, 82.9, 46.1, 46.0, 25.8, 25.0, 23.9, 23.7. HRMS (ESI): m/z C10H18NO3 [M+H]+的理论值: 200.128 12;实测值: 200.128 19.
吡咯烷-1-羧酸2-羰基-3-甲基戊-3-醇酯(3ba), 浅黄色液体, 1H NMR (500 MHz, CDCl3) δ 3.44-3.38 (m, 4H), 2.17 (s, 3H), 1.94-1.70 (m, 6H), 1.50 (s, 3H), 0.92 (t, J = 7.8 HZ, 3H). 13C NMR (126 MHz, CDCl3) δ 208.2, 153.8, 85.4, 46.0, 29.7, 25.8, 24.9, 24.2, 20.1, 7.6. HRMS (ESI): m/z C11H20NO3 [M+H]+的理论值: 214.143 77;实测值: 214.143 80.
吡咯烷-1-羧酸2-羰基-3-环己基丙-3-醇酯(3ca), 无色油状液体. 1H NMR (500 MHz, CDCl3) δ 3.46 (t, J = 6.7 Hz, 2H), 3.37 (t, J = 6.7 Hz, 2H), 2.14 (s, 3H), 2.08-2.05 (m, 2H), 1.95-1.87 (m, 4H), 1.66-1.63 (m, 5H), 1.54-1.50 (m), 1.28-1.22 (m, 1H, ). 13C NMR (126 MHz, CDCl3) δ 208.5, 153.6, 84.1, 46.1, 46.1, 31.1, 25.8, 25.2, 25.0, 23.7, 21.5. HRMS (ESI): m/z C13H22NO3 [M+H]+的理论值: 240.159 42;实测值: 240.159 48.
吡咯烷-1-羧酸2-羰基-3-苯基丁-3-醇酯(3ea), 白色固体. 1H NMR (500 MHz, CDCl3) δ 7.49-7.47 (m, 2H), 7.40-7.37 (m, 2H), 7.33-7.30 (m, 1H), 3.69-3.60 (m, 2H), 3.42 (t, J = 6.7 Hz, 2H), 2.04-2.00 (m, 5H), 1.99- 1.93 (m, 2H), 1.88(s, 3H). 13C NMR (126 MHz, CDCl3) δ 204.5, 153.3, 139.7, 128.6, 127.9, 124.7, 86.8, 46.3, 46.2, 25.8, 24.9, 23.8, 23.7. HRMS (ESI): m/z C15H20NO3 [M+H]+的理论值: 262.143 77;实测值: 262.143 82.
吗啡啉-1-羧酸2-羰基-3-甲基丁-2-醇酯(3ab), 黄色固体. 1H NMR (500 MHz, CDCl3) δ 3.69 (t, J = 5.0 MHz, 4H), 3.51-3.47 (m, 4H), 2.16 (s, 3H), 1.49 (s, 6H). 13C NMR (126 MHz, CDCl3) δ 207.3, 154.2, 83.5, 66.7, 44.7, 43.8, 23.7, 23.6. HRMS (ESI): m/z C10H18NO4 [M+H]+的理论值: 216.123 03;实测值: 216.123 10.
N, N-二乙基氨基甲酸2-羰基-3-甲基丁-3-醇酯(3ac), 淡黄色油状液体. 1H NMR (500 MHz, CDCl3) δ 3.28 (s, 4H), 2.12 (s, 3H), 1.45 (s, 6H), 1.16-1.12 (m, 6H). 13C NMR (126 MHz, CDCl3) δ 207.7, 154.7, 82.9, 41.8, 41.6, 23.7, 23.4, 14.2, 13.5. HRMS (ESI): m/z C10H20NO [M+H]+的理论值: 202.143 77;实测值: 202.143 80.
N, N-二正丁基氨基甲酸2-羰基-3-甲基丁-3-醇酯(3ad), 黄色油状液体. 1H NMR (500 MHz, CDCl3) δ 3.20 (t, J = 7.2 MHz, 4H), 2.12 (s, 3H), 1.55-1.44 (m, 4H), 1.35 (s, 6H), 1.34-1.25 (m, 4H), 0.96-0.89 (m, 6H). 13C NMR (126 MHz, CDCl3) δ 207.7, 155.0, 82.9, 47.0, 46.7, 30.8, 30.2, 23.6, 23.3, 19.9, 19.9, 13.8. HRMS (ESI): m/z C14H28NO3 [M+H]+的理论值为: 258.206 37;实测值: 258.206 43.
1.2.2 CuCl2/[Emim][OAc]体系的循环实验前期的配样、反应以及萃取与上述提到的步骤一致.随后, 用无水乙醚萃取3次后, 将下层棕色液体收集, 在高真空条件下保持40 min以除去萃取过程中残留的无水乙醚以及体系中溶解的CO2, 并将之直接用于下一次的催化反应.
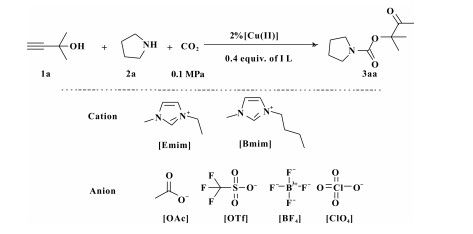
2 结果与讨论 2.1 反应条件优化在45 ℃, 1个CO2标准大气压的条件下, 以2-甲基-3-丁炔-2-醇(1a)、吡咯烷(2a)和CO2的三组分反应为模板反应, 将多种2价铜催化剂与离子液体进行配对, 以期得到最优催化体系(表 1).首先, 当2价铜催化剂与离子液体分别被单独用于催化该反应时, 均未观测到有目标产物生成(表 1, Entry 1-2), 但是在相同条件下, 将二者组合可得到73%产率的3aa(Entry 3), 该实验结果说明, 2价铜催化剂与离子液体均不可或缺.在2价铜盐考察中(Entry 3 vs Entry 4-7), CuCl2具有着最好的催化效果, Cu(OAc)2, CuBr2也有70%左右的产率, Cu(OTf)2则产率较低, 仅有35%, 而纳米CuO加入反应体系后没有目标产物生成, 这可能是CuO在离子液体中无法溶解导致的.基于此, 我们选取CuCl2为催化体系的最佳铜盐来进行后续的考察.随后我们研究了不同种类的离子液体对催化体系活性的影响(Entry 3 vs Entry 8-12), 同为咪唑/醋酸型离子液体但侧链为丁基的[Bmim][OAc]催化活性略低于[Emim][OAc], 而在阳离子相同的情况下, 用溴离子、高氯酸根离子、四氟硼酸根离子等代替醋酸根阴离子时3aa产率明显下降.由此可得[Emim][OAc]为最优的选择.
| 表 1 反应条件的考察a Table 1 Screening of the reaction conditionsa |
在确定最佳的反应体系为CuCl2/[Emim][OAc]之后, 反应时间(Entry 3 vs Entry 13-16)对于催化活性的影响也被探究.随着时间的延长, 3aa产率逐渐升高, 但在反应时间达到24 h后, 延长反应时间并不能很好地提高产率, 因此从经济和效率的角度考虑, 可以将反应时间确定为24 h.
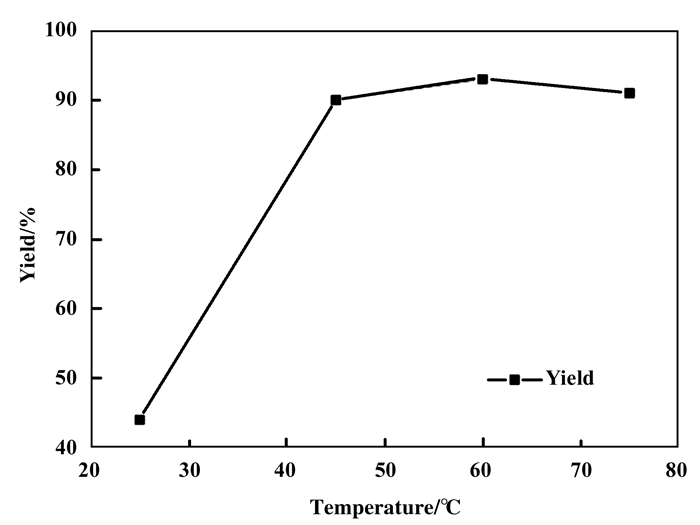
随后, 我们探究了温度对于反应产率的影响(图 1), 在0.1 MPa CO2气压下, 采用CuCl2/[Emim] [OAc]催化体系, 分别在室温, 45、60、75 ℃的条件下催化反应24 h, 结果显示该催化体系在室温下就可以催化反应进行, 但是3aa产率仅有44%, 随着反应温度升高到45 ℃, 产率逐渐升高, 但是进一步提高温度, 产率升高不明显.因此综上所述, 最佳反应条件: CuCl2(0.02 equiv.), [Emim][OAc](0.4 equiv.), 反应温度为45 ℃, CO2气压为0.1 MPa, 反应时间为24 h.
|
图 1 反应温度的影响 Fig.1 Effect of reaction temperature |
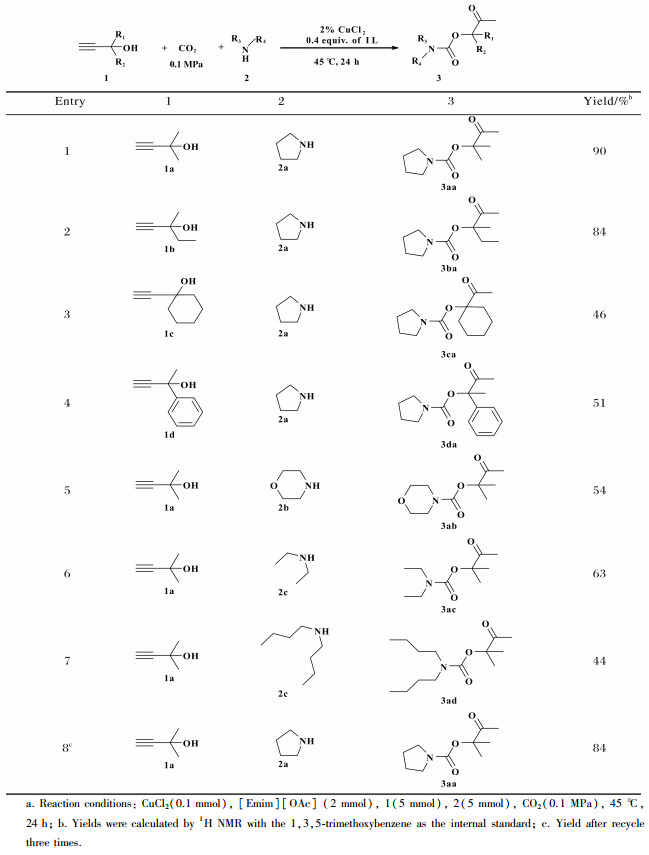
在最优条件下, 我们通过改变炔丙醇的R1、R2基团和仲胺的R3、R4基团来进一步拓展底物的适用性范围(表 2).首先, 我们将一系列含有不同取代基的炔丙醇(如甲基、乙基、六元环及苯环)的炔丙醇应用于与吡咯烷、CO2的三组分反应中, 在CuCl2/[Emim][OAc]催化下均能顺利地转变为相应的β-羰基氨基甲酸酯产物(Entry 1-7).其中, 甲基或乙基等空间位阻较小的底物的产率为90%和84%(Entry 1-2), 远高于六元环及苯环等大位阻底物产率(Entry 3-4), 这些实验结果表明炔丙醇取代基的空间位阻效应对反应活性的影响很大.随后, 我们选择吗啡啉、二乙胺、二正丁胺等具有代表性的仲胺替代吡咯烷, 也均可成功地转化为对应的产物(Entry 5-7).最后, 我们以2-甲基-3-丁炔-2-醇, 吡咯烷和CO2的反应为模板进行了循环实验, 该体系循环3次后, 3aa产率并没明显下降(Entry 8), 表明该催化体系具有良好的循环利用性能.
| 表 2 底物普适性的拓展a Table 2 The expansion of substrate scopea |
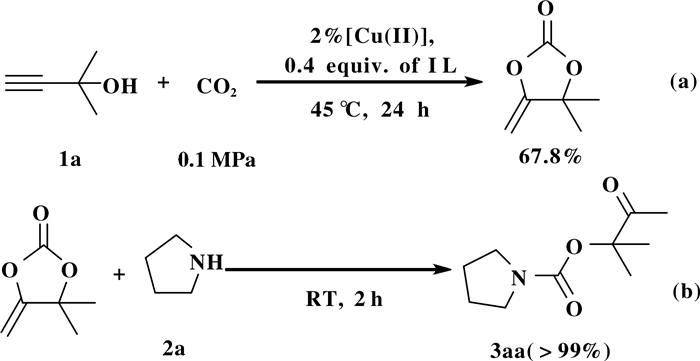
首先, 我们用分步法的方法证明炔丙醇、仲胺与CO2合成β-羰基氨基甲酸酯的反应可以分为两个步骤(图 2), 在最优条件下, CuCl2/IL催化1a和CO2环合得到68%的α-亚甲基环碳酸酯(图 2a).随后将上述得到的环碳酸酯, 加入等当量吡咯烷, 室温下反应2 h, 即可以高于99%的产率得到了β-羰基氨基甲酸酯3aa(图 2b), 这也和前人所报道的α-亚甲基环碳酸酯是这个三组分反应关键中间体的结论一致[26, 28, 33].
|
图 2 分步实验 Fig.2 Muti-step experiments |
然后我们通过羟基信号在1H NMR中的形状和化学位移来探究离子液体在反应过程中所起的作用(图 3).图 3a为2-甲基-3-丁炔-2-醇, 图 3b为2-甲基-3-丁炔-2-醇与[Emim][OAc]的混合液.两图对比可以看出, 在[Emim][OAc]中, 2-甲基-3-丁炔-2-醇的羟基氢的峰变钝而且化学位移也从5.29变为6.47, 这表明OAc-对炔丙醇中羟基起到了一定的活化作用, 与实验结果相符.另一方面, 根据Steckel报道[45], [Emim][OAc]对CO2也有一定的活化作用(图 4), 醋酸根离子可以将部分负电荷传递给了CO2分子, 同时使CO2分子的键角弯曲, 从而提高了CO2分子的反应活性.
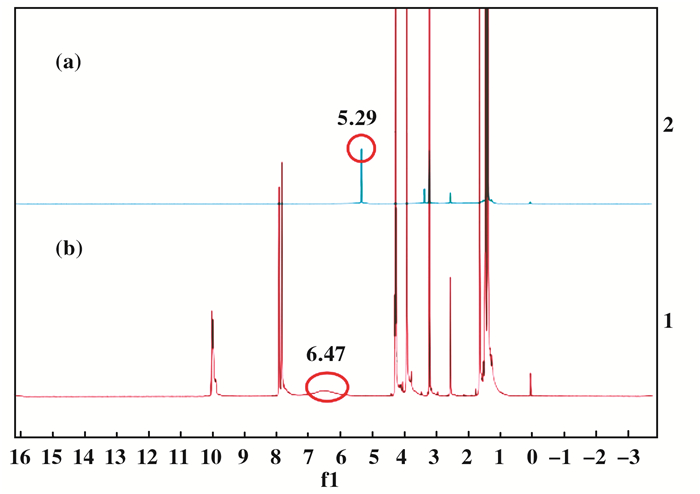
|
图 3 [Emim][OAc]对羟基质子的活化 Fig.3 Activation of hydroxyl proton accomplished by [Emim][OAc] |
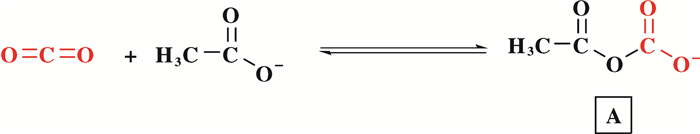
|
图 4 OAc-对CO2的活化 Fig.4 Activation of CO2 accomplished by OAc- |
基于上述实验结果以及前人的经验, 我们推测CuCl2/[Emim][OAc]催化炔丙醇、仲胺与CO2三组分反应生成β-羰基氨基甲酸酯的催化机理(图 5).
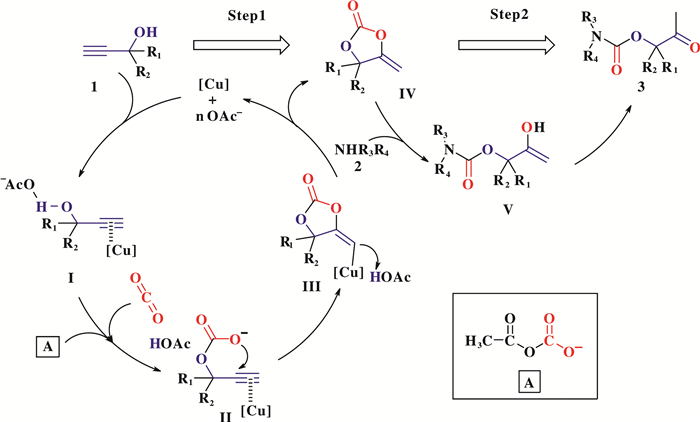
|
图 5 CuCl2/[Emim][OAc]体系可能的反应机理 Fig.5 The proposed catalytic mechanism of the CuCl2/[Emim][OAc] system |
第一步, 高浓度的OAc-活化炔丙醇底物的羟基, 增强了其对CO2分子的亲核性, 形成了中间体Ⅰ.同时OAc-对CO2分子进行捕捉和活化形成中间体A(图 5), 中间体A中带正电的碳原子与炔丙醇上的羟基氧原子成键形成中间体Ⅱ, 在[Cu]组分的作用下发生亲核环合反应形成中间体Ⅲ, 之后中间体Ⅲ的[Cu]被质子取代得到关键中间体α-亚甲基环碳酸酯(中间体Ⅳ), 同时重新释放出催化剂完成循环; 第二步, 仲胺进攻中间体Ⅳ的羰基产生中间体Ⅴ, 经过烯醇互变异构化得到相应的最终产物β-羰基氨基甲酸酯.
3 结论我们开发了一种CuCl2/[Emim][OAc]催化体系, 用于催化炔丙醇、仲胺和CO2的3组分偶联反应.该催化体系采用了廉价易得的氯化铜做催化剂, 突破了传统的高温高压的条件限制, 以较低的催化当量, 通过“一锅法”的简单途径将多种类型的炔丙醇和仲胺转化为目标产物, 且该体系可多次循环利用.这些表明该催化体系对于β-羰基氨基甲酸酯的工业化生产具有很高的潜在价值.
| [1] |
a. Vooradi R, Bertran M O, Frauzem R, et al. Sustainable chemical processing and energy-carbon dioxide management: Review of challenges and opportunities[J]. Chem Eng Res Des, 2018, 131 : 440-464. b. Shi Xiao-yu(时晓羽), Li Hui-peng(李会鹏), Zhao Hua(赵华). Solid-state Z-scheme photocatalytic systems to splitting water and photo-reduce carbon dioxide(全固态Z-Scheme光催化材料应用于二氧化碳还原和光催化分解水研究进展)[J]. J Mol Catal(China)(分子催化), 2019, 33 (4): 391-397. c. Han Wei-li(韩微莉), Wang Wen-zhen*(王文珍), Lin Wei(蔺伟). Research progress of catalysts for copo- lymerization of carbon dioxide and epoxides(二氧化碳与环氧化物共聚催化剂研究进展)[J]. J Mol Catal(China)(分子催化), 2017, 31 (6): 575-593. |
| [2] |
Sun Y, Wei W. Preface tospecial column on the 15th international conference on carbon dioxide utilization (ICCDU XV)[J]. Chin J Catal, 2018, 39(8): 1282.
DOI:10.1016/S1872-2067(18)63126-2 |
| [3] |
Yuan Y, Chen C, Zeng C, et al. Carboxylation of terminal alkynes with carbon dioxide catalyzed by an in situ Ag2O/N-heterocyclic carbene precursor system[J]. ChemCatChem, 2017, 9(5): 882–887.
DOI:10.1002/cctc.201601379 |
| [4] |
Kar S, Kothandaraman J, Goeppert A, et al. Advances in catalytic homogeneous hydrogenation of carbon dioxide to methanol[J]. J CO2 Util, 2018, 23: 212–218.
DOI:10.1016/j.jcou.2017.10.023 |
| [5] |
Yuan Y, Xie Y, Zeng C, et al. A simple and robust AgI/KOAc catalytic system for the carboxylative assembly of propargyl alcohols and carbon dioxide at atmospheric pressure[J]. Catal Sci Technol, 2017, 7(14): 2935–2939.
DOI:10.1039/C7CY00696A |
| [6] |
Yuan Y, Xie Y, Song D, et al. One-pot carboxylative cyclization of propargylic alcohols and CO2 catalysed by N-heterocyclic carbene/Ag systems[J]. Appl Org Chem, 2017, 31(12): e3867.
DOI:10.1002/aoc.3867 |
| [7] |
Kong Xiu-qin(孔秀琴), Tang Xing-jiang(唐兴江), Xu Shan(许珊), et al. Preparation of CuO-ZnO/Al2O3 by sol-gel auto-combustion method and its catalytic property for methanol synthesis from CO2 hydrogenation(溶胶-凝胶自燃烧法制备的CuO-ZnO/Al2O3及催化二氧化碳加氢制甲醇的性能研究)[J]. J Mol Catal(China)(分子催化), 2013, 27(2): 159–165.
|
| [8] |
Vessally E, Mohammadi R, Hosseinian A, et al. Three component coupling of amines, alkyl halides and carbon dioxide: An environmentally benign access to carbamate esters (urethanes)[J]. J CO2 Util, 2018, 24: 361–368.
DOI:10.1016/j.jcou.2018.01.015 |
| [9] |
Liu Yun-ping(刘允萍), Yang Ji-chun(杨吉春), Chai Bao-shan(柴宝山), et al. A novel fungicide benthiavalicarb-isopropyl(新型杀菌剂苯噻菌胺)[J]. Agrochemicals(农药), 2011, 50(10): 756–758.
DOI:10.3969/j.issn.1006-0413.2011.10.019 |
| [10] |
Ghosh A K, Brindisi M. Organic carbamates in drug design and medicinal chemistry[J]. J Med Chem, 2015, 58(7): 2895–2940.
DOI:10.1021/jm501371s |
| [11] |
King K, Hauser A T, Melesina J, et al. Carbamates as potential prodrugs and a new warhead for HDAC inhibition[J]. Molecules, 2018, 23(2): 321.
|
| [12] |
Uriz P, Serra M, Salagre P, et al. A new and efficient catalytic method for synthesizing isocyanates from carbamates[J]. Tetrahedron Lett, 2002, 43(9): 1673–1676.
DOI:10.1016/S0040-4039(02)00094-1 |
| [13] |
Khanna S, Moniruzzaman M, Sundararajan P R. Influence of single versus double hydrogen-bonding motif on the crystallization and morphology of self-assembling carbamates with alkyl side chains: Model system for polyurethanes[J]. J Phys Chem B, 2006, 110(31): 15251–15260.
DOI:10.1021/jp0619843 |
| [14] |
Tbal H, Le Maguer D, Morcellet J, et al. Chelating resins based on polyvinylamine and divinylbenzene or ethylene glycol dimethacrylate[J]. Rea Polym, 1992, 17(2): 207–217.
DOI:10.1016/0923-1137(92)90153-S |
| [15] |
Yang T, Lin C, Fu H, et al. Copper-catalyzed synthesis of medium- and large-sized nitrogen heterocycles via N-arylation of phosphoramidates and carbamates[J]. Org Lett, 2005, 7(21): 4781–4784.
DOI:10.1021/ol052126c |
| [16] |
Vauthey I, Valot F, Gozzi C, et al. An environmentally benign access to carbamates and ureas[J]. Tetra Lett, 2000, 41(33): 6347–6350.
DOI:10.1016/S0040-4039(00)01051-0 |
| [17] |
Mahe R, Sasaki Y, Bruneau C, et al. Catalytic synthesis of vinyl carbamates from carbon dioxide and alkynes with ruthenium complexes[J]. J Org Chem, 1989, 54(7): 1518–1523.
DOI:10.1021/jo00268a008 |
| [18] |
Chaturvedi D, Kumar A, Ray S. A high yielding one-pot, novel synthesis of carbamate esters from alcohols using Mitsunobu's reagent[J]. Tetra Lett, 2003, 44(41): 7637–76399.
DOI:10.1016/j.tetlet.2003.08.018 |
| [19] |
Mcghee W, Riley D, Christ K, et al. Carbon dioxide as a phosgene replacement: Synthesis and mechanistic studies of urethanes from amines, CO2, and alkyl chlorides[J]. J Org Chem, 1995, 60(9): 2820–2830.
DOI:10.1021/jo00114a035 |
| [20] |
Salvatore R N, Shin S I, Nagle A S, et al. Efficient carbamate synthesis via a three-component coupling of an amine, CO2, and alkyl halides in the presence of Cs2CO3 and tetrabutylammonium iodide[J]. J Org Chem, 2001, 66(3): 1035–1037.
DOI:10.1021/jo001140u |
| [21] |
Kong D L, He L N, Wang J Q. Polyethylene glycol-enhanced chemoselective synthesis of organic carbamates from amines, CO2, and alkyl halides[J]. Synth Commun, 2011, 41(22): 3298–3307.
DOI:10.1080/00397911.2010.517890 |
| [22] |
Selva M, Tundo P, Perosa A. The synthesis of alkyl carbamates from primary aliphatic amines and dialkyl carbonates in supercritical carbon dioxide[J]. Tetra Lett, 2002, 43(7): 1217–1219.
DOI:10.1016/S0040-4039(01)02390-5 |
| [23] |
Qi C R, Jiang H F. Efficient synthesis of β-oxopropylcarbamates in compressed CO2 without any additional catalyst and solvent[J]. Green Chem, 2007, 9(12): 1284–1286.
DOI:10.1039/b707893e |
| [24] |
Peterson S L, Stucka S M, Dinsmore C J. Parallelsynthesis of ureas and carbamates from amines and CO2 under mild conditions[J]. Org Lett, 2010, 12(6): 1340–1343.
DOI:10.1021/ol100259j |
| [25] |
Riemer D, Hirapara P, Das S. Chemoselective synthesis of carbamates using CO2 as carbon source[J]. ChemSusChem, 2016, 9(15): 1916–1920.
DOI:10.1002/cssc.201600521 |
| [26] |
Song Q W, Yu B, Li X D, et al. Efficient chemical fixation of CO2 promoted by a bifunctional Ag2WO4/Ph3P system[J]. Green Chem, 2014, 16(3): 1633–1638.
DOI:10.1039/c3gc42406e |
| [27] |
Song Q W, Zhou Z H, Yin H, et al. Silver(Ⅰ)-catalyzed synthesis of β-oxopropylcarbamates from propargylic alcohols and CO2 surrogate: A gas-free process[J]. ChemSusChem, 2015, 8(23): 3967–3972.
DOI:10.1002/cssc.201501176 |
| [28] |
Song Q W, Chen W Q, Ma R, et al. Bifunctional silver(Ⅰ) complex-catalyzed CO2 conversion at ambient conditions: Synthesis of α-methylene cyclic carbonates and derivatives[J]. ChemSusChem, 2015, 8(5): 821–827.
DOI:10.1002/cssc.201402921 |
| [29] |
Song Q W, Liu P, Han L H, et al. Upgrading CO2 by incorporation into urethanes through silver-catalyzed one-pot stepwise amidation reaction[J]. Chin J Chem, 2018, 36(2): 147–152.
DOI:10.1002/cjoc.201700572 |
| [30] |
Zhao Q N, Song Q W, Liu P, et al. Ag(Ⅰ)/(C2H5)4NCl cooperation catalysis for fixing CO2 or its derivatives into β-oxopropylcarbamates[J]. Chem Select, 2018, 3(24): 6897–6901.
|
| [31] |
Wang Q, Xiong W, Deng X, et al. Silver-nanowire-catalyzed three-component coupling of carbon dioxide, Amines and propargylic alcohols for the synthesis of β-oxopropyl carbamates[J]. Asian J Org Chem, 2019, 8(1): 179–184.
|
| [32] |
Kim H S, Kim J W, Kwon S C, et al. Catalytic formation of carbamates and cyclic carbonates by copper complex of 2, 5, 19, 22-tetraaza[6, 6](1, 1')ferrocenophane-1, 5-diene X-ray crystal structure of[Cu(Ⅰ)]PF6[J]. J Org Chem, 1997, 545/546: 337–344.
DOI:10.1016/S0022-328X(97)00366-5 |
| [33] |
Li Xue-dong(李雪冬), Lang Xian-dong(郎咸东), Song Qing-wen(宋清文), et al. Cu(Ⅰ)-catalyzed three-component reaction of propargylic alcohol, secondary amines and atmospheric(CO2(铜(Ⅰ)催化的常压二氧化碳, 炔丙醇和仲胺三组分反应)[J]. Chin J Org Chem(有机化学), 2016, 36: 744–751.
|
| [34] |
Kim T J, Kwon K H, Kwon S C, et al. Iron complexes of 1, 1'-bis(diphenylphosphino)ferrocene (BPPF) as efficient catalysts in the synthesis of carbamates. X-ray crystal structure of (BPPF)Fe(CO)3[J]. J Org Chem, 1990, 389(2): 205–217.
|
| [35] |
Bruneau C, Dixncuf P H. Catalytic synthesis of O-β-oxoalkylcarbamates[J]. Tetra Lett, 1987, 28(18): 2005–2008.
DOI:10.1016/S0040-4039(00)96031-3 |
| [36] |
Ca N D, Gabriele B, Ruffolo G, et al. Effective guanidine-catalyzed synthesis of carbonate and carbamate derivatives from propargyl alcohols in supercritical carbon dioxide[J]. Adv Synth Catal, 2011, 353(1): 133–146.
DOI:10.1002/adsc.201000607 |
| [37] |
Zhao Bin(赵彬), Chen Dian-jun(陈殿军), Li Yong-lu(李永路), et al. Synthesis of polyether modified quaternary ammonium ionic liquids and their catalysis on the cycloaddition of CO2 to epichlorohydrin(聚醚季铵离子液体合成及其催化CO2与环氧烷加成反应)[J]. J Mol Catal(China)(分子催化), 2008, 22(6): 487–490.
|
| [38] |
Fu Ge-hong(付格红), Lv Gong-xuan(吕功煊), Ma Jian-tai(马建泰). The effect of surfactant modification of MCM-41 on supporting ionic liquid for CO2 adsorption(表面活性剂修饰对MCM-41负载离子液体吸附CO2影响的研究)[J]. J Mol Catal(China)(分子催化), 2013, 27(03): 218–226.
|
| [39] |
Wang Xiao-chen(王晓晨), Liu An-qiu(刘安求), Dong Qiang(董强), et al. Synthesis of mesoporous poly(ionic liquid)s towards atmospheric fixation of carbon dioxide into carbonates(介孔聚离子液体的可控合成及在常压CO2环加成反应中应用)[J]. J Mol Catal(China)(分子催化), 2019, 33(02): 181–189.
|
| [40] |
Klankermayer J, Wesselbaum S, Beydoun K, et al. Selective catalytic synthesis using the combination of carbon dioxide and hydrogen: Catalytic chess at the interface of energy and chemistry[J]. Angew Chem Int Edit, 2016, 55(26): 7296–7343.
DOI:10.1002/anie.201507458 |
| [41] |
Bates E D, Mayton R D, Ntai I, et al. CO2 capture by a task-specific ionic liquid[J]. J Am Chem Soc, 2002, 124(6): 926–927.
DOI:10.1021/ja017593d |
| [42] |
Wang C, Luo X, Luo H, et al. Tuning the basicity of io- nic liquids for equimolar CO2 capture[J]. Angew Chem Int Edit, 2011, 50(21): 4918–4922.
DOI:10.1002/anie.201008151 |
| [43] |
Sarmad S, Mikkola J P, Ji X. Carbon dioxide capture with ionic liquids and deep eutectic solvents: A new generation of sorbents[J]. ChemSusChem, 2017, 10(2): 324–352.
DOI:10.1002/cssc.201600987 |
| [44] |
Song D, Li D, Xiao X, et al. Synthesis of β-oxopropylcarbamates in a recyclable AgBr/ionic liquid catalytic system: An efficient assembly of CO2 under ambient pressure[J]. J CO2 Util, 2018, 27: 217–222.
DOI:10.1016/j.jcou.2018.07.021 |
| [45] |
Steckel J A. Ab initio calculations of the interaction between CO2 and the acetate Ion[J]. J Phys Chem A, 2012, 116(47): 11643–11650.
DOI:10.1021/jp306446d |
 2019, Vol. 33
2019, Vol. 33