在过去几十年里, 温室效应以及全球气候变暖已经成为全世界所关注的问题, 而导致这一现象的元凶就是CO2[1].所以关于CO2的吸附问题已经成为了一门热门的研究.捕获与储存技术(CCS)由此而生, 并在几年里获得了迅猛的发展[2].离子液体(ILs)由于其蒸气压低, 热稳定性较高, 不易挥发等优点被广泛运用于各个领域.较高的溶解性使其成为CO2的良好溶剂, 其中咪唑类离子液体具有更强的CO2吸收能力. Athony等[3]在其研究中显示了在8.3 MPa时CO2在离子液体中的溶解度能达到0.75(摩尔分数), 利用此性质可实现离子液体从超临界CO2中萃取其他物质. Dong等[4]通过量子化学得出, 咪唑类离子液体上的C2-H可与CO2形成部分氢键, 因此CO2在咪唑型离子液体中有较强的溶解度.由于CO2与离子液体之间相互作用主要以物理吸附为主, 所以阴阳离子种类、体积、吸附位置、压力等因素都影响CO2的溶解性. Aki等[5]发现离子液体中阴离子对吸收CO2影响较大, 当采用相同阳离子时, 不同阴离子对CO2的吸附能力大不相同.当压力值增大时, 这种差别会更加明显.
离子液体优点众多, 但仍存在缺点, 液态和高粘性的性质阻碍了其应用.为了克服上述的弊端众多研究提出以多孔材料作为载体, 将离子液体负载到载体中.这不仅降低了离子液体的粘性与流失, 也提高了多孔材料的吸附性能.多孔材料作为优秀的气体吸附材料被广泛运用于CO2的吸附[6]与储存. SiO2作为多孔材料的一种, 具有多孔性、高分散、质轻、化学稳定性好, 耐高温、不燃烧和电绝缘性好等优异性能, 并且易于合成[7].在过去几年里, 利用SiO2捕捉CO2获得了极大的关注.与其他多孔材料相比, 其比表面积大稳定性高的优点, 使其得到了广泛的研究.已经有了许多关于其对CO2捕捉的实验[8-15].对于CO2吸附机理的计算, 能够深入的了解其微观行为[16].
MCM-41作为性能良好的介孔氧化硅材料, 在药物传递[17-20]、气体分离与捕获[21]、催化[22-27]等方面有着广泛的应用研究.研究以MCM-41为载体的限域离子液体具有极大的意义.
限域离子液体与自由离子液体的性质之间有着不小的差异. Luo等[28]采用金属有机骨架材料MIL-101合成限域HSO4-类路易斯酸离子液体, 并将之用于苯甲醛缩醛反应, 获得了非常好的催化活性, 限域离子液体与纯净离子液体相比具有更高的催化反应活性和选择性. Chaban等[29]专门研究了CNT中的液体, 他们发现液体的沸点和物理性质在自由状态和限域状态下完全不同. Li等[30]采用X射线吸收精细结构谱(XAFS)对纳米多孔二氧化硅颗粒中[Emim]Br进行研究, 发现阴阳离子距离缩小并且发生了电子转移. Fehér等[31]对负载SO3H-类路易斯酸离子液体催化异丁烯聚合生成Cl2烷烃反应研究发现, 采用介孔二氧化硅为载体的限域离子液体具有非常好的催化活性和选择性.综上所述, 研究限域离子液体是一项很重要的工作.
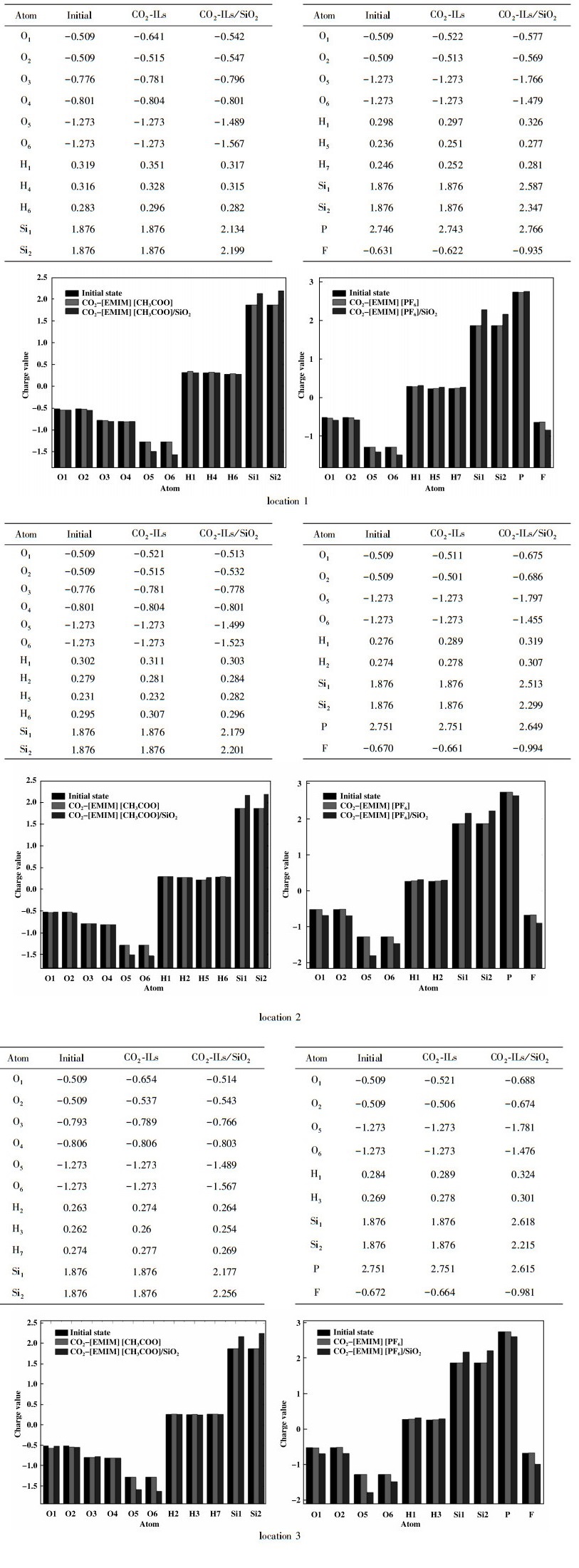
我们采用量子化学B3LYP密度泛函理论方法构建并优化了一个结构与MCM-41相似的SiO2载体(图 1).由于众多研究表明咪唑类离子液体吸附CO2的能力要高于其他离子液体, 并且亲水与疏水离子液体吸附CO2的能力也有所不同[16], 因此我们选取3种咪唑类亲水离子液体([EMIM][Br], [EMIM][Cl], [EMIM][CH3COO])与咪唑类疏水离子液体([EMIM] [PF6])作为研究对象.研究了单纯离子液体与限域离子液体两种环境下吸附行为的区别.到目前为止还没有密度泛函理论(DFT)对ILs-SiO2复合结构对CO2吸附进行具体的研究, 我们的研究有助于寻找合适的限域离子液体来捕获和储存二氧化碳, 并为进一步研究限域离子液体对CO2的吸附提供新思路.
|
图 1 优化后的SiO2结构 Fig.1 Optimized structure of SiO2 |
所有几何优化和定量计算均采用Gaussian 09软件中的B3LYP方法进行计算.采用密度泛函理论(DFT)中的B3LYP/6-31+G*方法对CO2和离子液体以及限域离子液体进行结构优化, 并且进行了振动分析, 确定无虚频.通过方程(1)得出相互作用能.
| $ \Delta {\rm E} = {\rm E}\left( {{\rm A}{\rm B}} \right) - {\rm E}\left( {\rm A} \right) - {\rm E}\left( {\rm B} \right) + {\rm{ }}\Delta ZPVE $ | (1) |
ΔZPVE是零点振动能. E(AB)是复合材料的总能量. E(A)、E(B)分别是A和B在复合材料中的能量.
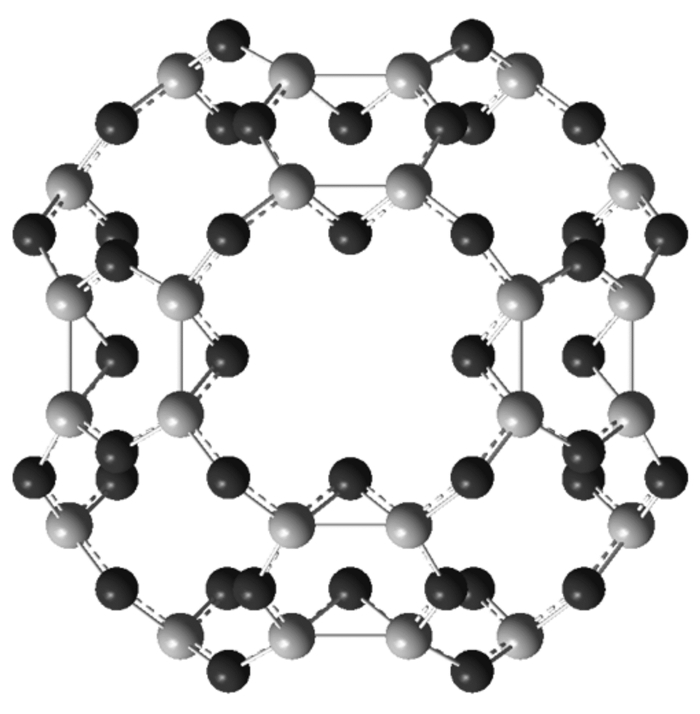
2 结果与讨论 2.1 CO2-ILs的结构优化以及能量变化图 2为优化后的4种咪唑类的离子液体.从优化结构中可以看出阴离子主要位于阳离子咪唑环上的H附近.

|
图 2 离子液体的优化结构 Fig.2 Optimized structure of the ionic liquids |
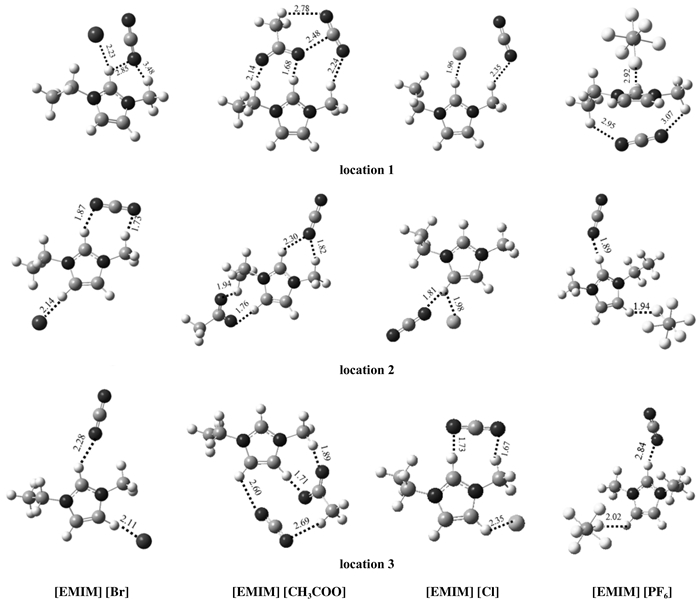
图 3是CO2-ILs的优化结构, 并且显示了它们相互作用距离最小值(Å).计算结果得出的CO2与各种离子液体的相互作用能与最小相互作用距离都列在表 1中.根据计算发现CO2与离子液体的相互作用与负载位置有很大关系, 当CO2中的两个O同时靠近阳离子上的H时他们之间的相互作用能要大于只有一个O靠近阳离子上H的时候, 而当CO2靠近阴离子时CO2与离子液体的相互作用能要明显大于其他几个位置, 所以可以得出离子液体的吸附情况取决于离子液体中的阴离子.而且我们发现在所有的结构中CO2总是与[EMIM]+平行.另外从图中可以看出CO2也都靠近阳离子咪唑环上的H.这是由于CO2上的O与阳离子上的H形成了氢键.
|
图 3 CO2-ILs体系优化后的结构以及相互作用的最小距离(Å) Fig.3 The optimized structure of CO2-ILs system and the minimum distance of the interaction(Å) |
| 表 1 CO2-ILs体系中CO2与ILs的相互作用能和相互作用的最小值 Table 1 Interaction energy and minimum value of CO2 and ILs in CO2-ILs system |
在[EMIM] [CH3COO]体系中, 当CO2靠近阴离子时与之发生了相互作用, 这是由阴离子中CH3上的H所引起的, 此时的CO2与[EMIM] [CH3COO]的相互作用能要大于其他几种离子液体.在[EMIM] [PF6]体系中CO2与[EMIM] [PF6]相互作用距离要大于其它3种离子液体.由于亲水离子液体具有较强的极性与电负性, 使其更容易与CO2形成氢键.这就解释了[EMIM][Br], [EMIM][Cl], [EMIM][CH3COO]这3种亲水离子液体对CO2吸附能力要大于[EMIM] [PF6].
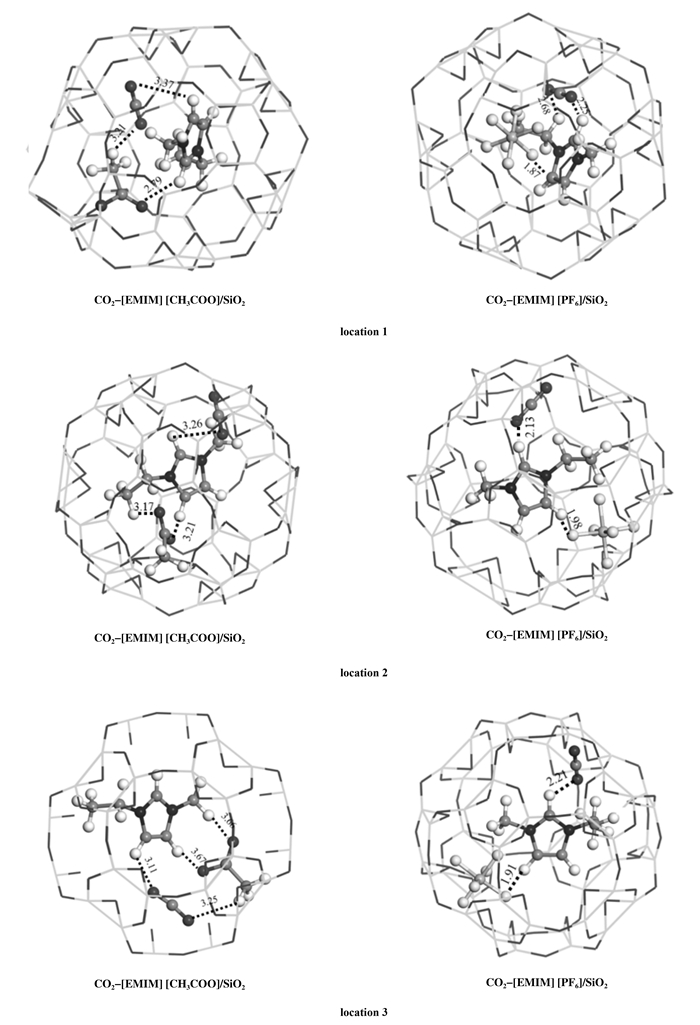
2.2 CO2-ILs/SiO2的结构优化以及能量变化为了研究CO2与ILs在限域情况下的吸附情况, 选取效果最好的亲水离子液体[EMIM] [CH3-COO]与疏水离子液体[EMIM] [PF6], 并优化了他们的结构(图 4).计算得出的CO2与各种离子液体在限域环境下的相互作用能与最小相互作用距离都列在表 2中.结果可知, CO2与ILs在限域情况下的吸附情况与单独CO2与ILs吸附情况有所不同.这是由于限域结构干扰了离子对的强度, 改变了离子液体对CO2的吸附能.
|
图 4 优化后的限域离子液体结构以及相互作用的最小值(Å) Fig.4 The optimized structure of confined ILs and the minimum distance of the interaction(Å) |
| 表 2 CO2-ILs/SiO2体系中的CO2与ILs/SiO2的相互作用能和相互作用最小值 Table 2 Interaction energy and minimum value of CO2 and ILs/SiO2 in CO2-ILs/SiO2 system |
从表 2中看出, 在限域环境下亲水离子液体与CO2之间的相互作用减小, 阴阳离子之间的相互作用能也有所减弱, 而[EMIM] [PF6]与CO2之间的相互作用则增强.这些改变由于载体的疏水性造成的, 疏水性SiO2与疏水性离子液体之间有着较强的吸引力, 对离子液体起到了良好的分散作用, 增加了离子液体吸附CO2活性位.
2.3 电荷分布为了进一步了解CO2的吸附情况, 首先对CO2和离子液体本身进行了电荷分析, 之后分析了CO2-ILs中(表 3)的电荷变化.最后选取了CO2-ILs/SiO2体系中几个参与作用的位置(图 5)以及与他们相邻SiO2载体上的原子(Si1、O5靠近阴离子, Si2、O6靠近CO2)进行了电荷分析.所得出的计算结果都列在了表 3中.
| 表 3 两种离子液体的电荷值变化 Table 3 Change in charge value of two ionic liquids |
|
图 5 体系中参与作用的重要位置 Fig.5 Important participation in the System |
从表 3可以看出CO2-ILs体系中, 对于亲水离子液体[EMIM][CH3COO]来说.处于位置1和3时(CO2靠近阴离子), 其中离阴离子较近的O1电荷值减小较大, 靠近阳离子的O2电荷值减小较小.处于位置2时(CO2靠近阳离子), CO2中O电荷值变化不大.这说明CO2与阴离子之间存在较多的电荷转移, 他们之间存在较强的相互作用.而与阳离子之间却很少有电荷转移, 他们之间的相互作用也就小.这解释了上文中当CO2靠近阴离子时相互作用大于CO2靠近阳离子.对于疏水离子液体[EMIM][PF6]来说, CO2与ILs的电荷值变化都不大, 他们之间的电荷转移很少.这就验证了上文中[EMIM][PF6]与CO2之间相互作用能较小.而当负载进SiO2载体中时, 所有位置CO2与阴离子以及阳离子中的H的电荷转移减小, 而此时阴离子电荷值却增大, 阴离子附近的Si1、O5电荷值也有变化, 另外CO2中的O以及相邻的Si2、O6之间也存在电荷转移.由此可知, 当负载进载体中时, 由于载体对CO2以及ILs的相互作用力, 导致了上文中限域离子液体中ILs与CO2相互作用能减少.对于疏水离子液体来说, 负载进载体后, 阴离子及相邻的Si1、O5电荷的变化明显增大, 这就证明了疏水离子液体与疏水载体之间有较强的相互作用.离子液体与载体较强的相互作用使得阴阳离子之间相互作用减弱, 从而引起阴离子中F的电子云密度增大, 使其与CO2作用更加容易.这也验证了上文疏水离子液体负载进载体后ILs与CO2之间相互作用能增大的结论.
3 结论采用密度泛函理论(DFT)分析了不同离子液体捕获CO2的特性以及在限域环境下的改变.研究发现, 单独离子液体(ILs)对CO2的吸附行为与在限域环境中的吸附行为区别较大. ILs中的阴离子对吸附CO2起到了关键性作用, 当CO2靠近阴离子时ILs对其的吸引力明显大于其靠近阳离子.另外处于限域环境下的亲水离子液体对CO2的吸附能力明显下降, 而疏水离子液体的吸附能力反而增加.这是由于所选离子液体与SiO2载体共同具有疏水的特性.我们的理论研究有助于为CO2捕集和储存应用选择合适的ILs复合材料, 为进一步研究限域离子液体吸附CO2打下了坚实基础.
| [1] |
a. Solomon S, Plattner G K, Knutti R, et al. Irreversible climate change due to carbon dioxide emissions[J]. Proce Nat Acade Sci Un Sta Am, 2009, 106 (6): 4-9. b.Wang Xiao-chen(王晓晨), Liu An-qiu(刘安求), Dong Qiang(董强), et al. Synthesis of mesoporous poly(ionic liquid) s towards atmospheric fixation of carbon dioxide into carbonates(介孔聚离子液体的可控合成及在常压CO2环加成反应中应用)[J]. J Mol Catal(China)(分子催化), 2019, 33 (2): 181-189. c. Li Rui-yun(李瑞云), Song Da-yong(宋大勇), Song He-yuan(宋河远), et al. Brønsted acidic ionic liquids as efficient and recyclable catalysts for the acetalization of aldehyde with alcohol(Brønsted酸性离子液体在醛醇缩合反应中的应用) [J]. J Mol Catal(China)(分子催化), 2017, 31 (4): 305-315. |
| [2] |
Yang Z, He C, Sui H, et al. Recent advances of CO2-responsive materials in separations[J]. J CO2 Util, 2019, 30: 79–99.
DOI:10.1016/j.jcou.2019.01.004 |
| [3] |
Anthony J L, Anderson J L, Maginn E J, et al. Anion effects on gas solubility in ionic liquids[J]. J Phys Chem B, 2015, 109(13): 66–74.
|
| [4] |
Dong K, Dong X, Jiang Q. How renewable energy consumption lower global CO2 emissions? Evidence from countries with different income levels[J]. World Economy, 2019, 12: 13–25.
|
| [5] |
Aki S, Mellein B R, Saurer E M, et al. High-pressure phase behavior of carbon dioxide with imidazolium-based ionic liquids[J]. J Phys Chem B, 2014, 108(52): 55–65.
|
| [6] |
Sjostrom S, Krutka H. Evaluation of solid sorbents as a retrofit technology for CO2 capture[J]. Fuel, 2010, 89(6): 298–306.
|
| [7] |
Sarkar C, Basu J K, Samanta A N. Synthesis of MIL-53(Fe)/SiO2 composite from LD slag as a novel photo-catalyst for methylene blue degradation[J]. Chem Eng J, 2019, 377: 119–621.
|
| [8] |
Ataeivarjovi E, Tang Z, Chen J. Study on CO2 desorption behavior of a PDMS-SiO2 hybrid membrane applied in a novel CO2 capture process[J]. ACS Appl Mater & Inter, 2018, 10(34): 8992–9002.
|
| [9] |
Cho M S, Lee S C, Chae H J, et al. Optimum design and characteristics of potassium-based sorbents using SiO2 for post-combustion CO2 capture[J]. Renewable Energy, 2019, 144: 7–15.
|
| [10] |
Jena K K, Panda A P, Verma S, et al. MWCNTs-ZnO-SiO2 mesoporous nano-hybrid materials for CO2 capture[J]. J Alloy Comp, 2019, 800: 79–85.
|
| [11] |
Jiang H, Guo H, Li P, et al. Preparation of CaMgAl-LDHs and mesoporous silica sorbents derived from blast furnace slag for CO2 capture[J]. RSC Adv, 2019, 9(11): 54–63.
|
| [12] |
Kong H S, Kim B J, Kang K S. Synthesis of CaCO3-SiO2 composite using CO2 for fire retardant[J]. Mater Lett, 2019, 238: 78–80.
|
| [13] |
Popa A, Sasca V, Verdes O, et al. Effect of the amine type on thermal stability of modified mesoporous silica used for CO2 adsorption[J]. J Ther Anal Calor, 2018, 134(1): 69–79.
|
| [14] |
Wang H, Zhang J, Wang G, et al. High-temperature capture of CO2 by Li4SiO4 prepared with blast furnace slag and kinetic analysis[J]. J Ther Anal Calor, 2018, 133(2): 1–9.
|
| [15] |
Zhang H, Goeppert A, Kar S, et al. Structural parameters to consider in selecting silica supports for polyethy- lenimine based CO2 solid adsorbents. Importance of pore size[J]. J CO2 Util, 2018, 26: 46–53.
|
| [16] |
Thomas A, Prakash M. Tuning the CO2 adsorption by the selection of suitable ionic liquids at ZIF-8 confinement: A DFT study[J]. Appl Surf Sci, 2019, 491: 3–9.
|
| [17] |
Ananthanarayanan K, Selvaraju C, Natarajan P. Novel excited state proton transfer reaction observed for proflavine encapsulated in the channels of modified MCM-41[J]. Micro Mes Mater, 2007, 99(3): 19–27.
|
| [18] |
Asfadeh A, Haddadi-asl V, Salami-alajahi M, et al. Investigating the effect of MCM-41 nanoparticles on the kinetics of atom transfer radical polymerization of styrene[J]. Nano, 2013, 8(2): 1–11.
|
| [19] |
Gao Y, Chen H, Tay-agbozo S, et al. Photo-induced electron transfer of carotenoids in mesoporous sieves (MCM-41) and surface modified MCM-41: The role of hydrogen bonds on the electron transfer[J]. J Photochem Photobiol Chem, 2017, 341: 1–11.
DOI:10.1016/j.jphotochem.2017.03.013 |
| [20] |
Sarkar S M, Yusoff M M, Rahman M L. Asymmetric transfer hydrogenation catalyzed by mesoporous MCM-41-supported chiral Ru-complex[J]. J Chin Chem Soc, 2015, 62(2): 77–81.
|
| [21] |
Dos Santos T C, Bourrelly S, Llewellyn P L, et al. Adsorption of CO2 on amine-functionalised MCM-41: Experimental and theoretical studies[J]. Phys Chemis Chem Phys, 2005, 17(16): 95–102.
|
| [22] |
Carvalho W A, Wallau M, Schuchardt U. Iron and copper immobilised on mesoporous MCM-41 molecular sieves as catalysts for the oxidation of cyclohexane[J]. J Mol Catal Chem, 1999, 144(1): 1–9.
DOI:10.1016/S1381-1169(98)00311-2 |
| [23] |
Dong C, Li X, Wang A, et al. Influence of nanoscale distribution of Pd particles in the mesopores of MCM-41 on the catalytic performance of Pd/MCM-41[J]. Catal Commun, 2017, 100: 19–22.
DOI:10.1016/j.catcom.2017.06.024 |
| [24] |
Feng Z, Xiang L I, Anjie W, et al. Hydrodesulfurization of dibenzothiophene catalyzed by CoNiMo/MCM-41[J]. Acta Petrolei Sinica Petroleum Proce Sec, 2008, 24(5): 1–5.
|
| [25] |
Ferraris G, Moretti G, Fierro G, et al. Structural properties of Cu-MCM-41 and Cu-Al-MCM-41(Si/Al=30) catalysts[J]. Character Por Sol Vi, 2002, 31(25): 77–84.
|
| [26] |
Ping C, Jiping M A O, Hongfang M A, et al. Liquid-phasehydrogenationofbenzeneover Ru/MCM-41 catalysts[J]. Acta Petrolei Sin (Petro Proce Sec), 2006, 22(5): 7–13.
|
| [27] |
Yuan C A O, Yinghao B A I, Chun Z. Study on synthesis, characterization and catalytic properties of mesporous material Pd-MCM-41[J]. Chem World, 2008, 49(11): 41–66.
|
| [28] |
Luo Q X, Ji M, Lu M H, et al. Organic electron-rich N-heterocyclic compound as a chemical bridge: Building a bronsted acidic ionic liquid confined in MIL-101 nanocages[J]. J Mater Chem A, 2013, 1(22): 1–4.
|
| [29] |
Chaban V V, Prezhdo V V, Prezhdo O V. Confinement by carbon nanotubes drastically alters the boiling and critical behavior of water droplets[J]. ACS Nano, 2012, 6(3): 66–73.
|
| [30] |
Li C, Guo X, He Y, et al. Compression of ionic liquid when confined in porous silica nanoparticles[J]. RSC Adv, 2013, 3(25): 18–21.
|
| [31] |
Feher C, Krivan E, Hancsok J, et al. Oligomerisation of isobutene with silica supported ionic liquid catalysts[J]. Green Chem, 2012, 14(2): 3–9.
|
 2019, Vol. 33
2019, Vol. 33