现代制药行业的快速发展使难降解大分子有机废水的处理量日益增大, 传统的生化处理法无法去除废水中难生化降解的物质, 并且容易引起对环境的二次污染, 因此研究如何处理难降解废水显得很有必要.制药废水中的一种典型药物:对乙酰氨基酚(n-acetyl-p-aminophenol, 以下统称为APAP), 又名扑热息痛, 在医学中是一种最常见解热镇痛药, 是乙酰苯胺类药物中最好的品种. APAP进入人体后大部分会在肝脏代谢, 中间代谢产物能造成肝脏、肾脏、血液系统、神经系统的毒副反应[1].因此对于含对乙酰氨基酚制药废水的管控近年来得到了人们的广泛关注.
自2000年来, 基于SO4·-的高级氧化过程(Sulfate Radical-based Advanced Oxidation Processes, SR-AOPs)成为了水处理领域的新热点[2-3].硫酸根自由基(SO4·-)的高级氧化过程具有氧化能力强(氧化还原电位的范围在不同pH下达2.5~3.1 V)[4-6]、选择性强、pH适应范围大(一般在3~10范围内都有很强的氧化能力)等优点, 在有机污染物的降解中有着良好的应用前景.
硫酸根自由基SO4·-、SO5·-可以由过硫酸盐活化产生,但由于过硫酸盐制备成本较高, 且本身就具有持久毒性和很强的氧化性, 反应余渣也可能会造成二次环境污染, 近年来研究者开始寻求更为环保的替代物—亚硫酸盐, 其优点很突出:与金属有很好的反应能力, 并且自身低毒, 价格也更低廉.研究发现:空气中的铁分子可以催化亚硫酸盐自发氧化, 产生硫酸根自由基[7].由于亚硫酸盐活化技术的研究相对较晚, 所以较之于过硫酸盐活化, 有关的报道相应较少, 不过近几年基于亚硫酸盐活化的高级氧化技术已经成为了新的发展趋势.除了前文介绍的过渡金属均相催化的Fe, 还有Mn, Co等离子[8-10], 也有一些多相催化的反应体系.
基于钴离子在常温常压下活化亚硫酸根产生具有强氧化性的硫酸根自由基, 来氧化水中微量的大分子有机物的原理, 采用浸渍法将钴离子负载到SBA-15介孔分子筛上, 采用非均相催化氧化方式, 防止金属离子直接溶解入水体, 对水体产生二次污染.以APAP为研究对象, 考察了亚硫酸盐体系降解过程的降解机理及催化剂投加量、溶液pH值、反应中通氧量、反应温度等因素对APAP降解的影响.研究结果表明: 1)钴离子在非均相条件下诱导亚硫酸盐体系对APAP的降解效果较好, 降解率能达到91%; 2)提高钴离子催化剂的投加量能增加APAP的降解效率, 降解反应在30 min之内反应完全; 3) APAP在亚硫酸盐体系中有较宽的pH范围, 以中性为最佳向酸性和碱性逐渐降低; 4)提高反应时通入氧气的含量能增加APAP的降解率, 当含氧量大于50%以后降解速率开始降低; 5) APAP的降解率随反应温度的升高而增加, 在55 ℃时达到最佳, 继续升温会导致降解率降低.
1 材料与方法 1.1 实验试剂与仪器KSL-1200X型马弗炉, BE-52AA型旋转蒸发仪, GZX-9140MBE型鼓风干燥箱, DF-101S型集热式恒温加热磁力搅拌器, FA2204B型电子天平, GWA-UN1-20型超纯水机, PHS-3C型pH计, JES-FA200型电子自旋共振光谱仪.
| 表 1 所用药品 Table 1 Chemicals |
2% Co/SBA-15催化剂的Co负载量可以通过式(1.2.1)计算出来.采用浸渍法制备催化剂, 即选用六水硝酸钴为供钴体, 将一定量的六水硝酸钴溶解到100 mL无水乙醇里面使之溶解均匀.后往硝酸钴溶液里投加2 g SBA-15分子筛载体, 用磁力搅拌器搅拌5 h.随后在室温条件下水平静置24 h使之晶化.接下来将烧杯里的溶液和SBA-15均装入旋转蒸发仪中于60 ℃条件下旋蒸2 h.最后, 将所得固体转移到马弗炉中, 于450 ℃焙烧5 h.
| $ \begin{array}{l} {\rm{Co}}\;\;{\rm{ loading }} = \frac{{{{\rm{m}}_{{\rm{Co}}}}}}{{{{\rm{m}}_{{\rm{SBA}} - 15}}}} \times 100\% = \frac{{{{\rm{m}}_{{\rm{cobalt }}\;\;{\rm{nitrate}}\;\;{\rm{ hexaluydrate }}}}}}{{{{\rm{m}}_{{\rm{SBA}} - 15}}}} \times \\ \frac{{{{\rm{M}}_{{\rm{Co}}}}}}{{{\rm{ Mcobait}}\;\;{\rm{ nitrate}}\;\;{\rm{ hexahydrate }}}} \times 100\% \end{array} $ |
APAP溶液(0.02 mmol/L)跟亚硫酸钠溶液(2 mmol/L)各取50 mL于200 mL烧杯中, 放入恒温水浴锅预热至一定温度.调节pH, 通氧量, 加入一定量催化剂后立即开始计时.分别于0, 1, 2.5, 5, 10, 30 min取1 mL溶液于离心管中.后立即用100 μL进样针抽取20 μL以上待测溶液注入高效液相色谱进行检测.
1.3 分析方法试剂: 0.02 mmol/L APAP溶液(现配)、1 mmol/L亚硫酸钠溶液(现配), 2%的Co/SBA-15(提前制备), 稀硫酸, 氢氧化钠, 盐酸.材料: 0.22 μm有机相滤头、1 mL针头注射器、100 μL进样针.
2 结果与分析 2.1 性能实验结果对不同条件下APAP降解率的研究采用正交试验设计, 取四因素五水平, 采用L25-(56)正交试验表设计实验; 因素分别为溶液初始pH, 水浴温度, 催化剂投加量(以所投加催化剂中钴浓度与亚硫酸钠浓度的比值为评价因素, 简称钴硫比)和实验中所通气体中氧气含量, 共计25组实验.
| 表 2 APAP正交实验的因素水平表 Table 2 Factor level table of orthogonal experiment of APAP |
| 表 3 APAP正交实验设计表及数据 Table 3 Orthogonal design table and data of APAP |
由极差分析可以看出钴硫比的极差最大, 含氧量次之, pH和温度较低, 也就是说钴硫比的影响最大, 含氧量的影响次之, pH和温度对脱除率的影响相对较小.
2.1.1 方差分析其中, 偏差平方和, 自由度, F比, F临界值的计算较为繁琐, 使用软件正交试验助手II v3.1处理此部分数据, 如表 4所示.
| 表 4 APAP正交实验的方差分析表 Table 4 Anova table of orthogonal experiment |
方差分析表明, 钴硫比的改变对APAP脱除率有显著影响(F比大于10%置信度下的F临界值), 结合直观分析可知, 选取钴硫比2效果最好; pH、温度、含氧量对APAP脱除率无显著影响, 在最佳实验条件中, 取pH=7、温度45 ℃、含氧量21%为好.
2.1.2 最优条件下平行试验选取最优条件: pH=7, 温度45 ℃, 钴硫比2, 含氧量21%进行5组平行试验, 得到降解率如表 5.
| 表 5 五组最优条件下对乙酰氨基酚降解率 Table 5 The degradation rate of acetaminophen in the five groups was optimized |
方差: 0.223 29
5次平行试验, APAP降解率在92.60%~94.00%变化, 平均值93.18%, 方差0.223 29, 重现性良好.
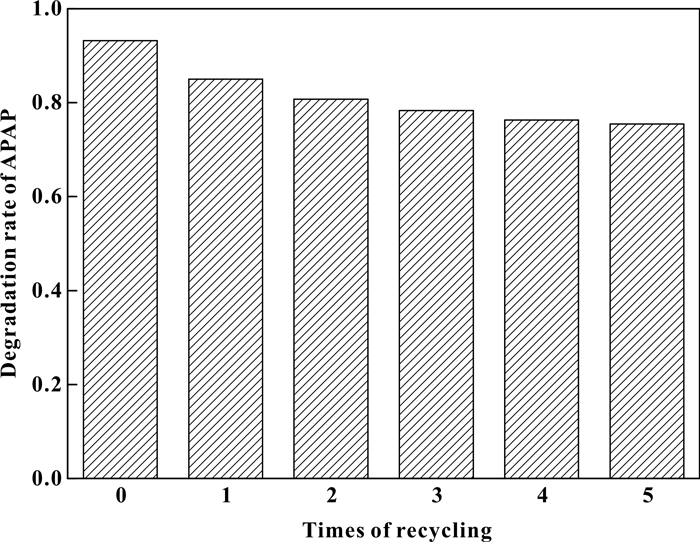
2.1.3 催化剂重复使用性能对于非均相自由基氧化体系而言, 催化剂的使用次数可以在一定程度上反映该体系的实用性和可推广性.在进行氧化降解实验后, 对过程中所使用的催化剂进行离心分离, 再经去离子水反复洗涤, 最后将其放入烘箱中进行干燥脱水, 且同时进行多组平行实验以确保催化剂的损耗可得到及时补充.我们对Co/SBA-15催化剂共进行了5次循环使用, 每次反应均选取最优条件: pH=7, 温度45 ℃, 钴硫比2, 含氧量21%, 反应30 min后对APAP的最终降解情况如图 1所示.
|
图 1 催化剂循环使用次数对APAP降解率的影响 Fig.1 Effect of catalyst cycle times on the degradation rate of APAP |
从图 1可看出, 催化剂在经过5次循环使用后依旧保持着较高的活性.在首次使用时, 30 min后可降解93.18%的APAP, 在第1次循环使用后, 降解率下降为85.03%, 之后的每次循环使用后降解率都有更小程度的下降, 当催化剂回收循环使用到第5次时, 30 min后可降解75.45%的APAP.随着循环次数的增加, 整体的降解效果相差不大.主要原因可能是在前几次循环使用时, 载体表面负载不太牢固的Co有一定脱落.但从循环使用效果来看, 我们所制得的催化剂具有长期的稳定性和可循环使用性, 具有潜在的实际应用价值.
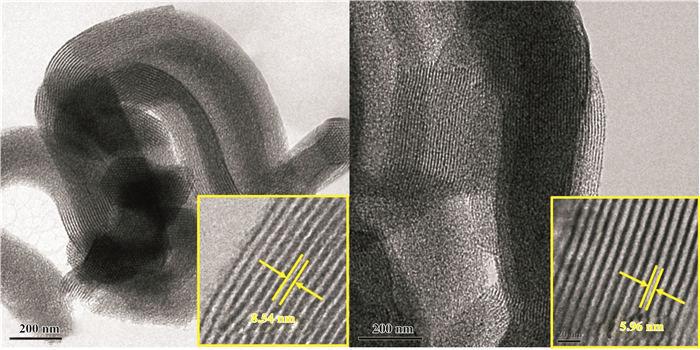
2.2 表征结果随着Co的浸渍, SBA-15表面形成凸起, 变得粗糙(图 2);但形态结构仍保持二维六方孔道, 孔体积及孔径逐渐减小(图 2)[11].
|
图 2 (a) SBA-15 TEM; (b) Co-SBA-15 TEM Fig.2 (a) TEM of SBA-15;(b) TEM of Co-SBA-15 |

|
图 3 Co-SBA-15的SEM图 Fig.3 SEM of Co-SBA-15 |
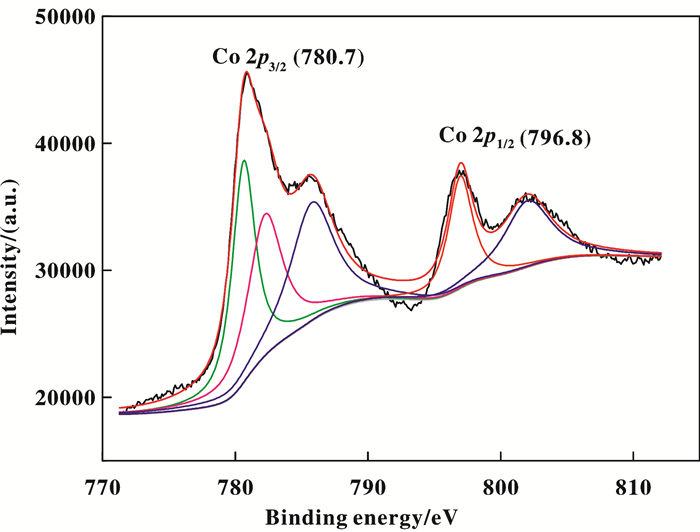
在光谱范围内可以看到有两个明显的峰, 峰位置分别在780.7和796.8 eV.说明了Co的成功负载, 且其中Co的主要存在形式是Co2+.
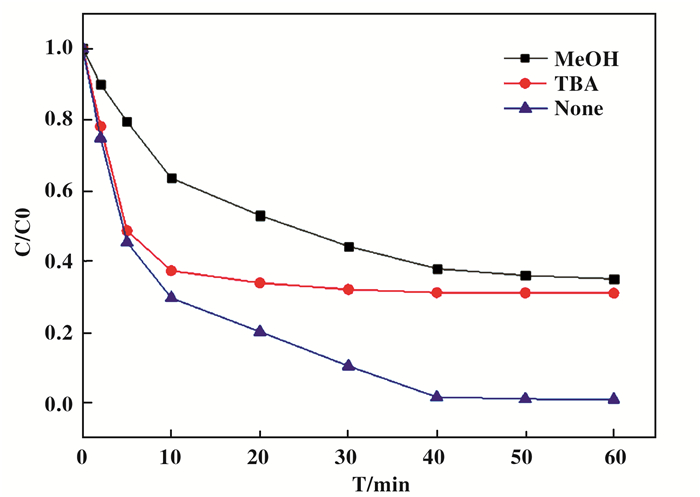
2.3 机理探究 2.3.1 自由基检测为了探究降解过程中具体是何种自由基起主要作用, 我们做了自由基淬灭实验.该实验基于不同性质的醇类(甲醇MeOH和叔丁醇TBA)与HO·和SO4·-的二阶反应速率常数有数量级的差别, (kMeOH/HO·=(1.2-2.8)×109 m-1s-1, kMeOH/ = (1.6-7.7)×109 m-1s-1, kTBA/HO·=(3.8-7.6)×108 m-1s-1, kTBA/SO4·- = (4-9.1)×105 m-1s-1).
|
图 4 Co-SBA-15的XPS图谱 Fig.4 XPS of Co-SBA-15 |
|
图 5 自由基淬灭实验 Fig.5 Free radical quenching experiment |
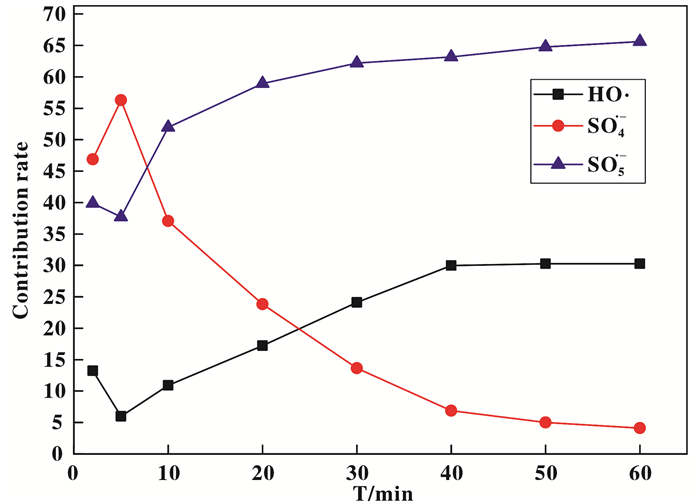
假设向体系中投加0.5 mmol/L的MeOH后, 体系中的HO·和SO4·-被全部淬灭; 投加0.5 mmol/L的TBA后, HO·被全部淬灭, APAP的降解主要是SO4·-和SO5·-的作用效果.故可通过相应时间内APAP降解率的改变量估算这几种自由基对APAP降解的理论贡献率.
通过计算, 各个自由基对降解反应的贡献率如表 6.
| 表 6 自由基贡献率 Table 6 Contribution rate of free radicals |
|
图 6 各自由基贡献率 Fig.6 Contribution rate of free radicals |
由计算结果可知, 体系中主要起作用的自由基为SO5·-, 随着时间的推移SO4·-对体系的贡献率逐渐降低,HO·的贡献率逐渐升高.
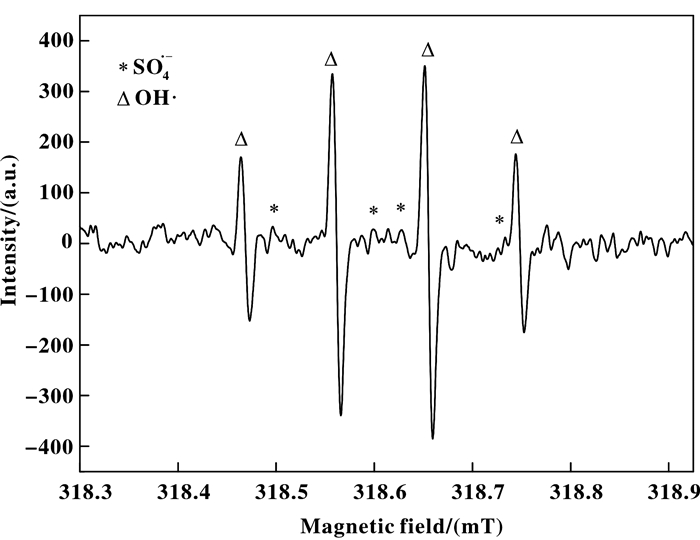
2.3.2 电子自旋共振(Electron Spin-resonance spectroscopy, ESR)检测结果无光照、水溶液条件下, 捕获剂DMPO浓度为100 mmol/L, 使用JES-FA200电子自旋共振光谱仪得到ESR谱图如图 7所示.
|
图 7 ESR谱图 Fig.7 ESR spectrum |
通过计算和cwESR软件处理得到磁场中心值g=2.001 38, 与DMPO生成的第1个加和物产生了信号强度比为1:2:2:1的四线谱, αN=αf=1.493 mT等信息确定此加合物为DMPO-OH·, 证明此体系中产生了羟基自由基OH·[12-15].
DMPO加和物的形成途径有两种, 第1种情况,SO4·-可在体系中直接产生, 然后与DMPO反应形成DMPO-SO4·-.第2种情况为在DMPO-OH·和Na2SO4同时存在的情祝下, SO4·-和DMPO-OH·之间可通过亲核取代反应形成DMPO-SO4·- [16].但是, DMPO-SO4·-加合物由于其灵敏度低, 存活时间短而只能检测到如图 7所示较为微弱的信号值[17].而SO5·-的检测在文献中少有涉及.
2.3.3 降解过程钴离子很好地分散在SBA-15分子筛表面和孔道内部, 为反映提供了良好的平台.在弱碱性条件下, 钴离子在水溶液中形成配合物C为(II)-SO3[18], 配合物再在氧气和亚硫酸根共同作用下产生硫酸根自由基SO3·- [19-20], 这是后续连锁反应的第一步; 在氧气作用下, SO3·-再生成SO4·-和SO5·-.
| $ \begin{aligned} &\mathrm{Co}(\mathrm{II})+\mathrm{H}_{0} \rightarrow \mathrm{Co}(\mathrm{II})-\mathrm{OH} \text { alkaline pH }\\ &\mathrm{Co}(\mathrm{II})-\mathrm{OH}+\mathrm{SO}_{3}^{2-} \rightarrow \mathrm{Co}(\mathrm{II})-\mathrm{SO}_{3}+\mathrm{H}_{2} \mathrm{O}\\ &\mathrm{Co}(\mathrm{II})-\mathrm{SO}_{3}+\mathrm{O}_{2} \rightarrow \mathrm{Co}(\mathrm{III})-\mathrm{SO}_{3}^{+}\\ &\mathrm{Co}(\mathrm{III})-\mathrm{SO}_{3}^{+}+\mathrm{SO}_{3}^{2-} \rightarrow \mathrm{Co}(\mathrm{II})-\mathrm{SO}_{3}+\mathrm{SO}_{3}^{-} \end{aligned} $ |
| $ \begin{aligned} &\mathrm{SO}_{3}^{\cdot-}+\mathrm{O}_{2} \rightarrow \mathrm{SO}_{5}^{\cdot-}\\ &\mathrm{SO}_{5}^{\cdot-}+\mathrm{SO}_{3}^{2-} \rightarrow \mathrm{SO}_{4}^{2-}+\mathrm{SO}_{4}^{\cdot-}\\ &\mathrm{SO}_{5}^{\cdot-}+\mathrm{HSO}_{3}^{-} \rightarrow \mathrm{HSO}_{4}^{-}+\mathrm{SO}_{4}^{\cdot-}\\ &\mathrm{SO}_{5}^{\cdot-}+\mathrm{SO}_{3}^{2-} \rightarrow \mathrm{SO}_{5}^{2-}+\mathrm{SO}_{3}^{\cdot-}\\ &\mathrm{SO}_{5}^{\cdot-}+\mathrm{HSO}_{3}^{-} \rightarrow \mathrm{HSO}_{5}^{-}+\mathrm{SO}_{3}^{\cdot-}\\ &\mathrm{SO}_{4}^{\cdot-}+\mathrm{SO}_{3}^{2-} \rightarrow \mathrm{SO}_{4}^{2-}+\mathrm{SO}_{3}^{\cdot-}\\ &\mathrm{SO}_{4}^{\cdot-}+\mathrm{HSO}_{3}^{-} \rightarrow \mathrm{HSO}_{4}^{-}+\mathrm{SO}_{3}^{\cdot-} \end{aligned} $ |
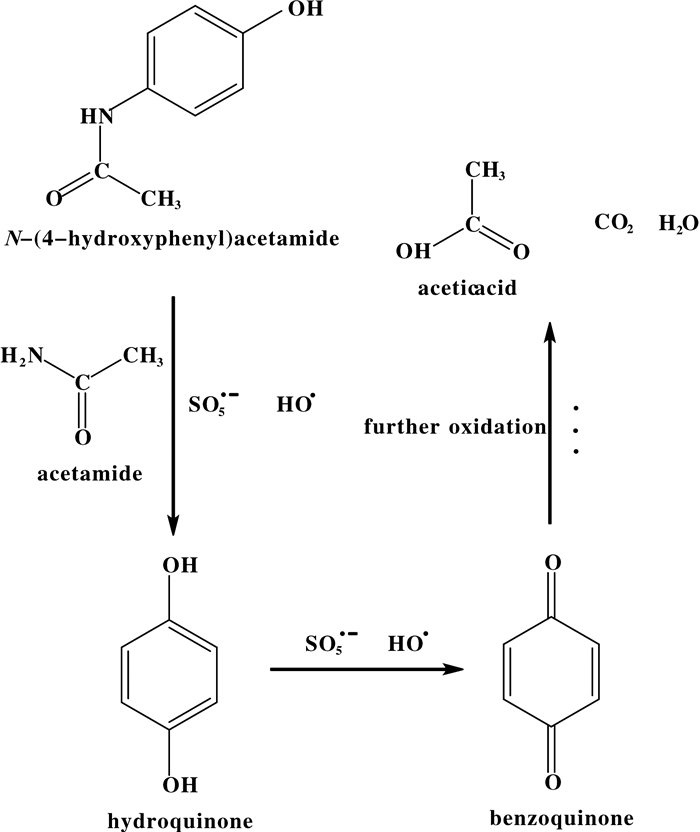
在产生的硫氧自由基和羟基自由基的作用下, 产生如图 8所示的降解过程[21-24].
|
图 8 APAP可能的降解过程 Fig.8 Possible degradation processes |
钴硫比的改变对APAP脱除率有显著影响, 结合方差分析可知, 选取钻硫比2效果最好.
3.2pH、温度、含氧量对APAP脱除率无显著影响, 在最佳钴硫比下, 取pH=7、温度45 ℃、含氧量为21%的最优条件下进行5次平行试验, 最终得到的降解率均值为93.18%.在对各参数的机理分析中, 我们发现:含氧量过高过低都会使降解率下降, 原因可能与自由基产生的链式反应和催化剂表面的CoO3重生有关[25-26]; 温度过高过低也不利于污染物的降解, 主要与温度引起的有效碰撞原理有关; 高的钴硫比相较于低钴硫比来说更有利于反应进行, 但是过高的钴硫比可能会引发自由基清除反应; pH在中性和弱碱性(7~8)范围为佳, 这主要受各物质在不同pH下存在形态的影响[27].
经过实验发现, 体系中主要起作用的自由基为SO5·-、SO4·-和HO·, 经ESR实验也证实了在本体系中产生了SO4·-和HO·;经时间推移SO4·-对体系的贡献逐渐降低,HO·的贡献率逐渐升高. APAP大分子经过反应产生的各种自由基被氧化, 逐步被降解, 最终被降解为乙酸、二氧化碳和水.同时亚硫酸盐相比于过硫酸盐PMS等其他可提供硫氧自由基的物质来讲, 价格相对低廉.我们在文中介绍的方法为水中低浓度大分子有机污染物的降解提供了新的思路.
| [1] |
Suarez S, Ramill M, Omil F, et al. Removal of pharmaceutically active compounds in nitrifying-denitrifying plants[J]. Water Sci Technol, 2005, 52(8): 9–14.
DOI:10.2166/wst.2005.0214 |
| [2] |
Anipsitakis G P, Dionysiou D D. Radical generation by the interaction of transition metals with common oxidants[J]. Environ Sci Technol, 2004, 38: 3705–3712.
DOI:10.1021/es035121o |
| [3] |
Anipsitakis G P, Dionysiou D D, Gonzales M. Cobalt-mediated activation of peroxymonosulfate and sulfate radical attack on phenolic compounds. Implications of chloride ions[J]. Environ Sci Technol, 2006, 40: 1000–1007.
DOI:10.1021/es050634b |
| [4] |
Matzek L W, Carter K E. Activated persulfate for organic chemical degradation: A review[J]. Chemosphere, 2016, 151: 178–188.
DOI:10.1016/j.chemosphere.2016.02.055 |
| [5] |
Oh W D, Dong Z, Lim T T. Generation of sulfate radical through heterogeneous catalysis for organic contaminants removal: Current development, challenges and prospects[J]. Appl Catal B Environ, 2016, 194: 169–201.
DOI:10.1016/j.apcatb.2016.04.003 |
| [6] |
Hu P, Long M. Cobalt-catalyzed sulfate radical-based advanced oxidation: A review on heterogeneous catalysts and applications[J]. Appl Catal B Environ, 2016, 181: 103–117.
DOI:10.1016/j.apcatb.2015.07.024 |
| [7] |
Zhou D N, Chen L, Li J J, et al. Transition metal catalyzed sulfite auto-oxidation systems for oxidative decontamination in waters: A state-of-the-art minireview[J]. Chem Eng J, 2018, 346: 726–738.
DOI:10.1016/j.cej.2018.04.016 |
| [8] |
Ikechukwu A Ikea, Lindenb Karl G, Orbella John D, et al. Critical review of the science and sustainability of persulphate advanced oxidation processes[J]. Chem Eng J, 2018, 338: 651–669.
DOI:10.1016/j.cej.2018.01.034 |
| [9] |
Xiaoguang Duana, Stacey Indrawirawan, Jian Kang, et al. Synergy of carbocatalytic and heat activation of persulfate for evolution of reactive radicals toward metal-free oxidation[D]. Catalysis Today. Available online 21 February 2019.
|
| [10] |
Guan Y H, Ma J, Li X C, et al. Influence of pH on the formation of sulfate and hydroxyl radicals in the UV/peroxymonosulfatesystem[J]. Environ Sci Technol, 2011, 45(21): 9308–9314.
DOI:10.1021/es2017363 |
| [11] |
Lidong Wang, Tieyue Qi, Siyu Wu, et al. A green and robust solid catalyst facilitating themagnesium sulfite oxidation in the magnesiadesulfurization process[J]. J Mater Chem A, 2017, 5: 8018.
DOI:10.1039/C7TA01513E |
| [12] |
Yu C, Wu Z, Liu R, et al. Novel fluorinated Bi2MoO6 nanocrystals for efficient photocatalytic removal of water organic pollutants under different light source illumination[J]. Appl Catal B Environ, 2017, 209: 1–11.
DOI:10.1016/j.apcatb.2017.02.057 |
| [13] |
Song Y, Tian J, Gao S, et al. Photodegradation of sulfonamides by g-C3N4 under visible light irradiation: Effectiveness, mechanism and pathways[J]. Appl Catal B Environ, 2017, 210: 88–96.
DOI:10.1016/j.apcatb.2017.03.059 |
| [14] |
Sun R, Shi Q, Zhang M, et al. Enhanced photocatalytic oxidation of toluene with a coral-like direct Z-scheme BiVO4/g-C3N4 photocatalyst[J]. J Alloy Compd, 2017, 714: 619–626.
DOI:10.1016/j.jallcom.2017.04.108 |
| [15] |
Yang M, Yang Q, Zhong J, et al. Enhanced photocataly- tic performance of Ag20/BiOF composite photocatalysts originating from efficient interfacialcharge separation[J]. Appl Surf Sci, 2017, 416: 666–671.
DOI:10.1016/j.apsusc.2017.04.206 |
| [16] |
Fontmorin J M, Castillo R C B, Tang W Z, et al. Stability of 5, 5-dimethyl-l-pyrroline-N-oxide as a spin-trap for quantification of hydroxyl radicals in processes based on Fenton reaction[J]. Water Res, 2016, 99: 24–32.
DOI:10.1016/j.watres.2016.04.053 |
| [17] |
Ranguelova K, Rice A B, Khajo A, et al. Formation of reactive sulfite-derived free radicals by the activation of human neutrophils: An ESR study[J]. Free Radic Biol, Med, 2012, 52: 1264–1271.
DOI:10.1016/j.freeradbiomed.2012.01.016 |
| [18] |
Hoekman S Kent. Speciated measurements and calculated reactivities of vehicle exhaust emissions from conventional and reformulated gasolines[J]. Environ Sci Technol, 1992, 26(6): 1206–1216.
DOI:10.1021/es50002a610 |
| [19] |
Yanan Yuan, Dan Zhao, Jinjun Li, et al. Gilles mailhot, rapid oxidation of paracetamol by Cobalt(Ⅱ) catalyzed sulfite at alkaline pH[J]. Catal Today, 2018, 313: 155–160.
DOI:10.1016/j.cattod.2017.12.004 |
| [20] |
Chen Y, Li M, Tong Y, et al. Radical generation via sulfite activation on NiFe2O4 surface for estriol removal: Performance and mechanistic studies[J]. Chem Eng J, 2019, 323: 495–503.
|
| [21] |
Wu D, Ye P, Wang M, et al. Cobalt nanoparticles encapsulated in nitrogen-rich carbon nanotubes as efficient catalysts for organic pollutants degradation via sulfite activation[J]. J Hazardous Mater, 2010, 380: 148–156.
|
| [22] |
Jing Xu, Wei Ding, Feng Wu, et al. Rapid catalytic oxidation of arsenite to arsenate in an iron(Ⅲ)/sulfitesystem under visible light[J]. Appl Catal B: Environ, 2016, 186: 56–61.
DOI:10.1016/j.apcatb.2015.12.033 |
| [23] |
Niu X, Yu J, Wang L, et al. Enhanced photocatalytic performance of TiO2 nanotube based heterojunction photo-catalyst via the coupling of graphene and FTO[J]. Appl Surf Sci, 2017, 413: 7–15.
DOI:10.1016/j.apsusc.2017.03.220 |
| [24] |
Criquet J, Leitner N K V. Reaction pathway of the degradation of the phydroxybenzoic acid by sulfate radical generated by ionizing radiations[J]. Radiat Phys Chem, 2015, 106: 307–314.
DOI:10.1016/j.radphyschem.2014.07.016 |
| [25] |
Lee C, Gong J, Huong C V, et al. Macroporous alginate substrate-bound growth of Fe0 nanoparticles with high redox activities for nitrate removal from aqueous solutions[J]. Chem Eng J, 2016, 298: 206–213.
DOI:10.1016/j.cej.2016.03.113 |
| [26] |
El-Ghenymy A, Centellas F, Garrido J A, et al. Decolorization and mineralization of Orange G azo dye solutions by anodic oxidation with a boron-doped diamond anode in divided and undivided tank reactors[J]. Electrochim Acta, 2014, 130: 568–576.
DOI:10.1016/j.electacta.2014.03.066 |
| [27] |
Jing D, Ge Y, Tan C, et al. Degradation of ciprofloxacin using α-MnO2 activated peroxymonosulfate process: Effect of water constituents, Degradation intermediates and to- xicity evaluation[J]. Chem Eng J, 2017, 330: 1390–1400.
DOI:10.1016/j.cej.2017.07.137 |
 2019, Vol. 33
2019, Vol. 33


