2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
全球性的能源和环境问题, 使得人们对清洁、可持续能源的需求日益增长[1].取之不尽的太阳能是目前地球上最大的能源来源, 而半导体材料能够利用太阳能将水分解为H2和O2[2].自从Fujishima和Honda利用TiO2进行电化学光解水以来[3], 光电化学(PEC)分解水被认为是一种环境友好、可持续的氢燃料制备技术.
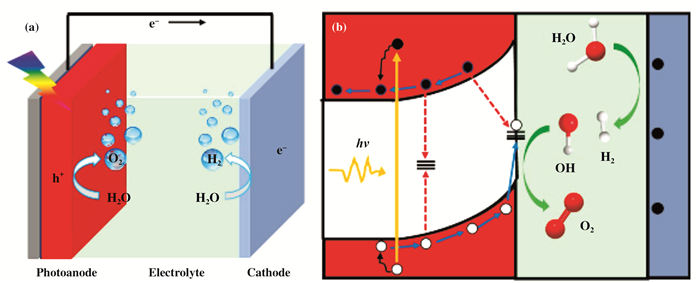
图 1a示意了PEC分解水单室电解池的基本结构, 其中包括一个n型半导体光阳极和一个金属阴极, 这两个电极分别浸在电解液中并通过导线连接[2, 4].在太阳光照射下, 半导体光阳极中的电子被激发并从价带(VB)跃迁到未被占据的导带(CB). 在大部分光生电子和空穴瞬间复合的同时, 一部分光生电子迁移到阴极表面, 并将质子(从水分子中分离出来)还原为氢气(H2), 而光生空穴则迁移到光阳极表面, 并将水分子氧化为氧气(O2)[5-6].当光电极与电解液接触时, 半导体与电解液之间的电荷迁移会导致带弯向上(光阳极)或向下(光阴极)弯曲, 这有利于促进光生电子和空穴的分离, 从而阻止不必要的复合[7-8].因此, 将n型和p型半导体分别作为光阳极和光阴极是比较合理的.每个电极上发生的氧化还原反应如下式所示[2]:
|
图 1 (a) 光阳极PEC水分解电解池的示意图;(b)Fe2O3光阳极PEC水氧化的过程 Fig.1 (a) Schematic illustration of a typical photoanode based PEC water splitting cell; (b) The process of hematite photoanode for PEC water oxidation |
阴极:
| $ 2{{\rm{H}}^ + } + {\rm{ }}2{{\rm{e}}^ - } \to {\rm{ }}{{\rm{H}}_2}E_{red}^0 = {\rm{ }}0\;{\rm{V}} $ | (1) |
光阳极:
| $ 2{{\rm{H}}_2}{\rm{O}} + 4{{\rm{h}}^ + } \to {{\rm{O}}_2} + 4{{\rm{H}}^ + }E_{red}^0 = + 1.23\;{\rm{V}} $ | (2) |
根据方程可知, 分解水的最小电压为1.23 V, 因此激发产生一个电子所需的能量理论上最小为1.23 eV.为了满足这一要求, 光电极所吸收的光的光子能量必须等于或大于1.23 eV[8].事实上, 由于能量损失, 该光子能量应该远大于这个理论值, 例如电极/导线接触处的电压损耗和过电位引起的能量损耗[2, 8-11].此外, 相比于析氢反应(HER), 析氧反应(OER, 生成一个氧气分子需要4个电子)被认为是水分解的决速步骤.因此, 为了实现高效的太阳能水分解, 半导体光阳极材料的选择对PEC研究至关重要.
到目前为止, 人们已经开发了许多n型半导体材料作为PEC水氧化的光阳极, 包括TiO2[12]、ZnO[13]、BiVO4[14-16]、Ta3N5[17]、WO3[18]、和Si[19].然而, 这些材料存在带隙过宽或者稳定性不好等缺点.赤铁矿(α-Fe2O3)作为一种n型半导体, 其价带位置低, 存储量大, 稳定性好并且无毒性[20].赤铁矿的带隙约为1.9~2.2 eV, 因此它可以吸收40%的太阳光, 太阳能-氢转化效率(STH)的理论最大值为15.5%.尽管如此, Fe2O3光阳极目前最高的STH仅为3.4%[21], 仍远低于理论效率.这种性能上的差异反映了Fe2O3的几个问题(图 1b).首先, 表面捕获态使得Fe2O3表面的电荷发生严重的复合[22-23].这导致Fe2O3光电阳极表现出低的表面反应动力学和高的光电流起始电压, 通常高于0.8 V(相对于可逆氢电势, VRHE), 该值远高于Fe2O3的平带电位(0.3 VRHE).其次, Fe2O3中激发态载流子的寿命仅为3×10-12~10×10-12 sec.极短的载流子寿命和迟钝的载流子迁移率导致Fe2O3的空穴扩散长度只有2~4 nm.因此, 大多数光生电子和空穴在到达基底或表面空间电荷层之前就会复合.最后, 光生电子在Fe2O3/基底界面的复合损失.通常情况下, 基底为金属材料, 如金[24]、铁[25]、或透明的导电氧化物(TCO), 如氟掺杂的氧化锡(FTO)和铟掺杂的氧化锡(ITO).基底与Fe2O3之间晶格的不匹配可能导致界面缺陷态的形成, 从而使得电荷在界面处极易复合[26].以上涉及Fe2O3表面和体相、赤铁矿/基底界面等方面, 直接决定了Fe2O3光阳极的PEC性能.
这里, 我们着重介绍用于PEC水氧化的Fe2O3光阳极的最新研究进展.我们首先介绍促进Fe2O3表面的水氧化反应的途径, 包括表面钝化减少表面的电荷复合和负载助催化剂来加速表面反应.然后, 讨论提高体相电导率和电荷传输的策略, 例如元素掺杂、构建异质结和纳米结构调控.最后, 对Fe2O3光电阳极的发展前景进行了展望.
1 促进Fe2O3表面的水氧化反应Fe2O3光阳极较差的析氧反应动力学是限制其太阳能转换效率的主要因素之一, 因此需要较大的偏压来驱动水的氧化.这是由于光生空穴只有在高偏压下才能有效地从电极表面迁移到电解质溶液(空穴注入).因为在低偏压下, 导带中的电子容易与表面的氧化态发生严重复合[27-28].尽管这些表面态的性质和作用仍然存在争议, 最近的几个研究表明, 表面态对Fe2O3固有的起始电压有非常大的影响[27-28].迄今为止, 制备具有低起始电压的Fe2O3光阳极仍然是一个巨大的挑战.很多研究认为, Fe2O3固有的起始电压在1 mol/L NaOH电解液中为0.7~1.1 VRHE[29-31]. Fe2O3较高的过电位可以通过抑制表面电荷复合或提高空穴从光电极到反应物分子的迁移速率来改善[32].前者可以通过钝化表面电子捕获态来实现, 例如表面沉积钝化层[30].后者可以通过负载OER助催化剂来实现.
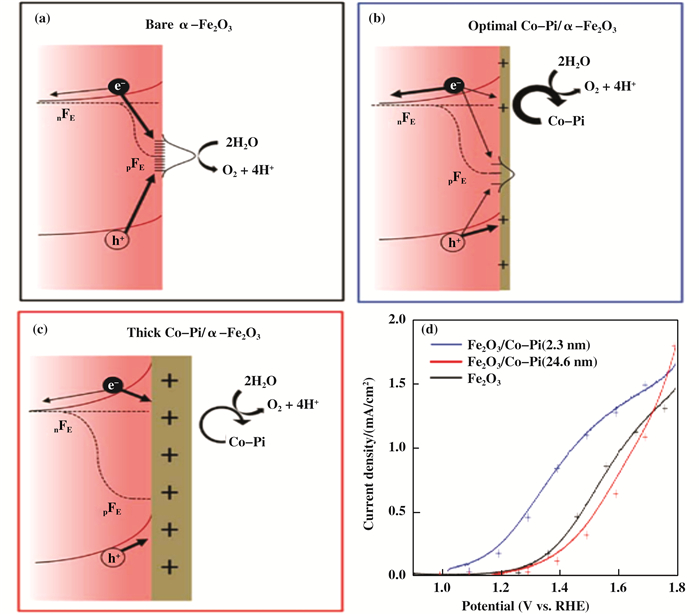
1.1 Fe2O3光阳极表面的水氧化动力学贵金属氧化物IrOx是一种价格昂贵但性能优良的低过电位电催化剂. Tilley等[34]首次报道了Fe2O3/IrOx光阳极, 其光电流密度达到了3 mA/cm2. IrOx是在低pH电解液中唯一稳定的电催化剂[35]. Li等[36]通过沉积IrOx薄层解决了赤铁矿在酸性环境中的稳定性问题.该光阳极在酸中(pH=1.01)可稳定5 h, 并且光电流起始电压降低到0.6 VRHE.尽管氧化铱是最好的水氧化催化剂之一, 但铱是一种昂贵的稀有元素.在此背景下, 近年来, 有关地球上丰富的过渡金属(Co、Ni、Fe)基OER助催化剂的研究取得了进展. Kanan和Nocera[37]通过在含钴(Ⅱ)离子的磷酸盐缓冲溶液中电沉积, 首次制备了Co-Pi电催化剂. Zhong等[38]通过光辅助电沉积(PED)法改进了Co-Pi的沉积过程.相比于Co-Pi的电沉积或Co2+的溶液浸渍, PED使Co-Pi在Fe2O3表面的分布更加均匀, 最终导致起始电压负移170 mV并且1.23 VRHE时的光电流密度达到2.8 mA/cm2.在水氧化过程中, Co-Pi催化剂可以有效地收集和储存来自Fe2O3的光生空穴, 促进电荷分离, 减少表面复合[39]. Carroll等[33, 40]发现, Fe2O3光阳极的PEC性能易受Co-Pi催化剂层厚度的影响(图 2). 当Co-Pi的厚度大于最佳值时, 由于导带上的电子与Co-Pi层中累积的空穴之间严重的界面复合, 导致光电流下降.对于Ni基OER助催化剂, Hwang团队报道了NiOOH修饰的Sn, Zr共掺杂的Fe2O3光阳极.与未修饰的共掺杂光电阳极相比, 光电流起始电压负移了160 mV, 并且电荷注入效率(ηinj)提高了1.6~9.5倍.作者采用的光辅助电沉积技术有助于沉积一个更均匀紧凑的NiOOH层并且具有最佳的负载量[41].有报道称Ni(OH)2也是一种高效的Fe2O3光阳极水氧化助催化剂. Young等[42]利用ALD技术将NiO沉积在Fe2O3薄膜电极上, 用于PEC分解水.作者认为, 沉积NiO的光电化学环境将其转换成了Ni(OH)2, 导致光电流起始电压降低300 mV, 并使1.23 VRHE时的光电流密度提高了两倍. Ni(Ⅱ)助催化剂水氧化的催化机理分为两步, Ni2+快速氧化为Ni3+, 随后Ni3+缓慢氧化为Ni4+, 而Ni4+被认为是水氧化的活性物种[43]. Ni(OH)2在Fe2O3光电极上的催化作用被认为是来源于光致充电效应的抑制[43].常见的Fe基OER助催化剂只有FeOOH. Kim等[44]通过简单的热水浴法在Fe2O3纳米结构表面生长的超薄的无定型FeOOH纳米层.表面修饰FeOOH后, Fe2O3光阳极的水氧化光电流密度提高了约2倍, 同时起始电位负移了0.12 VRHE.作者认为, PEC性能的提高是由于水氧化动力学的促进和Fe2O3表面缺陷态的钝化.
|
图 2 不同厚度的Co-Pi纳米层修饰的Fe2O3光阳极的电荷复合和迁移示意图 Fig.2 Schematic illustration of the charge recombination and transfer pathways of Fe2O3 photoanodes with (a) no; (b) a thin; and (c) a thick Co-Pi layer on their surfaces; (d) PEC current-voltage (J-V) curves measured for Fe2O3 photoanodes with various Co-Pi loading (a)未修饰; (b)超薄; (c)厚的Co-Pi纳米层; (d)不同厚度的Co-Pi纳米层修饰的Fe2O3光阳极的J-V曲线[33] |
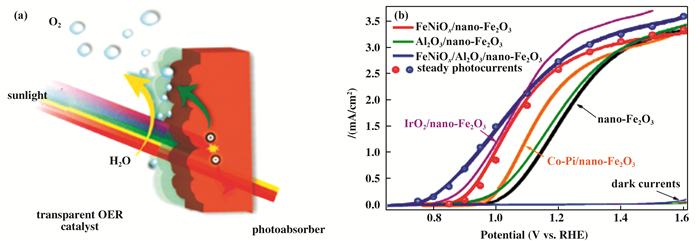
FeNiOx双过渡金属助催化剂因其在碱性溶液中具有良好的OER活性而备受关注[46]. Hu等人利用光电化学法制备了透明的FeNiOx助催化剂, 其负载量仅为几毫克每平方厘米(图 3). FeNiOx催化剂的光学透明度可以实现无辅助的太阳能水分解, STH效率达到1.9%.另外, 利用Al2O3超薄层(< 1 nm)钝化界面捕获态后, NiFeOx/Al2O3层将Fe2O3光阳极的起始电压降至0.7 VRHE, 该性能明显优于IrO2和Co-Pi助催化剂.类似地, CoFeOx被报道可以消除水氧化动力学的瓶颈.与Co-Pi相比, CoFeOx表现出更低的竞争性光吸收, 更高的电荷分离和稳定性[47].在Zhang等[48]的工作中, 利用光电化学阻抗谱和强度可调的光电流谱揭示了CoFeOx与Fe2O3半导体之间相互作用的本质.结果显示, CoFeOx薄层主要抑制了表面电荷的复合, 而超薄层促进了电荷转移动力学.
|
图 3 (a) 透明的OER助催化剂修饰的Fe2O3光阳极PEC水氧化示意图; (b)不同助催化剂和超薄Al2O3修饰的Fe2O3光阳极的J-V曲线[45] Fig.3 (a) Schematic illustration of Fe2O3 photoanodes modified with transparent OER catalyst for PEC oxidation; (b) J-V curves of Fe2O3 photoanodes coated with different cocatalysts and ultrathin Al2O3 |
光生空穴从Fe2O3电极体相迁移到电极/电解质界面仍然容易因与光生电子在表面位点发生复合而损失[27, 49-52].研究发现, 参与水氧化的空穴主要是表面捕获的空穴, 而不是直接来自价带上的空穴.因此, 空穴开始在表面位点积累的时候, 光电流开始出现[27].通过使用助催化剂或钝化层, 可以改善从电极到电解质界面缓慢的空穴迁移(注入).这两种方法在促进空穴迁移方面有着根本不同的机理.表面钝化(非催化过程)意味着Fe2O3表面缺陷的减少, 从而降低空穴-电子复合速率.而助催化剂通常意味着通过助催化剂中金属元素的氧化来促进空穴从Fe2O3表面迁移到电解质[50].
Le Formal等[51]发现, 通过原子层沉积(ALD)在Fe2O3表面形成一层超薄的Al2O3(0.1~2 nm), 使得PEC水氧化的过电位降低了100 mV. Al2O3可以填补Fe2O3表面捕获光生空穴的氧空位.之后, 他们进一步研究了一系列氧化物覆盖层, 包括Al2O3, Ga2O3和In2O3[53]. 500 ℃焙烧后, 这些覆盖层可以转变为与赤铁矿相同的晶体结构(刚玉).这些覆盖层消除了赤铁矿的晶格应变, 降低了表面态的密度.
ZnO[54]、TiO2[55]、Ta2O5[56]、或SiOx[57]等宽带隙的金属氧化物也可作为表面钝化层.用醋酸锌溶液对赤铁矿表面进行处理后形成了一层超薄的氧化锌.结果显示, 光电流密度提高了40%, 起始电压降低了170 mV.作者认为, ZnO覆盖层改变了赤铁矿的平带电位并且减少了表面缺陷[54]. Fe2O3表面生长的TiO2超薄层使得起始电压降低了100 mV. TiO2的修饰使得光阳极在暗态和光照条件下的表面态电容分别降低20%和45%.因此, TiO2钝化表面后, 光电压从230提高到290 mV[55]. Ahn等[57]在Fe2O3纳米孔光阳极表面生长了2.5 nm厚的Ti掺杂的SiOx钝化层.由于钛的掺杂, 该Ti-SiOx钝化层具有良好的电荷提取能力和导电性.最终得到的Fe2O3光阳极在1.23 VRHE时的光电流密度为2.44 mA/cm2.
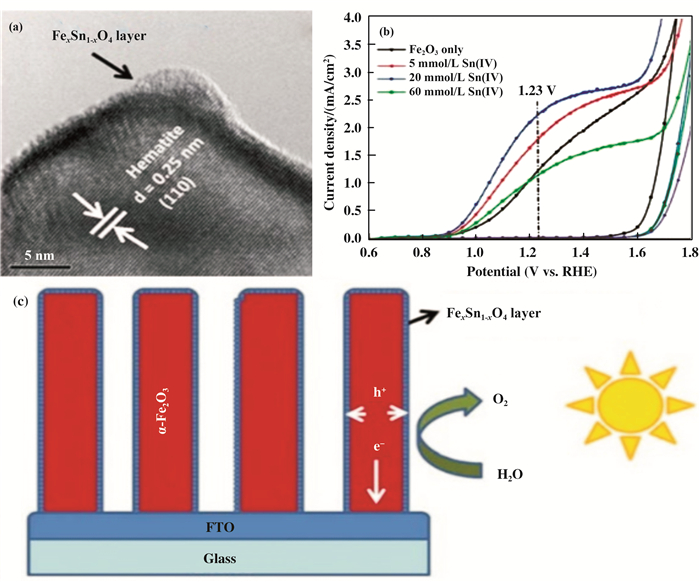
表面掺杂金属离子也被证实能够通过促进电荷迁移或形成掺杂覆盖层来催化表面的水氧化反应实现α-Fe2O3光阳极PEC性能的提升.例如, 表面Sn掺杂的Fe2O3纳米棒阵列光电流的提高主要是由于FexSn1-xO4层的形成抑制了Fe2O3/电解质界面的电子-空穴复合[52].首先, 用Sn(Ⅳ)的水溶液对水热生长的FeOOH纳米棒阵列处理, 然后在空气中750 ℃退火30 min.焙烧过程中, 随着溶液蒸发, Fe2O3纳米棒的表面形成了SnO2薄层.经过固态扩散反应, Sn(Ⅳ)逐渐与Fe2O3结合, 形成FexSn1-xO4层(图 4).该薄层的存在被认为是钝化了表面缺陷[52].与这种方法类似, 在α-Fe2O3纳米管光阳极的表面覆盖一层超薄的NixFe2-xO3, 与纯的α-Fe2O3纳米管光阳极相比, 其光转换效率提高了约280%[58].这种增强是由于NixFe2-xO3促进了电荷迁移, 加速了表面的析氧反应, 并抑制了半导体-液体交界处的电荷复合.值得注意的是, 镍掺杂的样品的光电流起始电压也发生大约100 mV的负移, 并且光电流曲线的斜率是纯样品的2~3倍.为了阐明NixFe2-xO3的表面促进作用, 作者在纯样品表面修饰Ni基催化剂作为对比样品.他们认为NixFe2-xO3层钝化了表面捕获态以及促进了OER过程, 从而抑制了电子-空穴复合.以上结果表明, 利用表面钝化层和助催化剂可以分别解决表面电荷复合和反应动力学缓慢的问题[49].
|
图 4 (a) 20 mmol/L Sn(Ⅳ)的水溶液对Fe2O3表面处理后的高分辨透射电镜图; (b)Sn(Ⅳ)表面处理和未处理的Fe2O3光阳极的J-V曲线; (c)Sn(Ⅳ)表面处理后Fe2O3纳米棒阵列进行高效PEC水氧化的示意图[52] Fig.4 (a) HRTEM image of hematite after treatment with 20 mmol/L Sn(Ⅳ) solution; (b) J-V curves of hematite photoanode with and without Sn(Ⅳ) treatment; (c) Schematic effect of Sn(Ⅳ) treated hematite nanorod arrays for efficient water oxidation |
带隙为2.1 eV的Fe2O3理论上的STH大约为15.3%.然而, 非常短的激发态寿命(3×10-12~10×10-12 sec)和较小的空穴扩散长度(2~4 nm)导致Fe2O3的电荷分离效率较低, 从而使其实际的PEC性能受到了严重的限制.迄今为止, 已有各种方法被用来提高Fe2O3光阳极的电荷分离效率, 例如掺杂, 构建异质结以及纳米结构调控.
2.1 元素掺杂许多研究已经证实, 掺杂能够提高大多数半导体体相的载流子密度, 从而提高其电导率和电荷分离效率.由于体相中自然存在的氧空位, Fe2O3被认为是n型半导体. 4价和5价金属离子的掺杂能提升施主能级, 从而使Fe2O3保持n型不变, 而1价或2价离子掺杂会增加正电荷载流子, 因此Fe2O3将变为p型.掺杂大于3价的单原子离子会引入额外的多数载流子, 并产生更陡的电势梯度(较薄的空间电荷层), 从而促进电荷分离.而掺杂氧化态为1价或2价的金属原子会将Fe2O3转化为p型半导体, 即在光照时电子将传输到电极/电解液界面而不是空穴.
将4价阳离子引入Fe2O3是实现n型掺杂最常见的途径. Lukowski等[62]报道了利用热氧化法合成Si掺杂的Fe2O3纳米线.对于Si的掺杂, 首先通过化学气相沉积将SiH4包覆在纳米线表面, 然后进行退火处理.他们发现, Si掺杂后, Fe2O3光阳极法的电阻率得到了显着提高.由于Ti4+的半径小于高自旋Fe3+, Ti的掺入会引起晶格收缩, 单位细胞体积减小, 从而提高载流子的跃迁几率[63-64].因此, 钛的掺杂受到了广泛关注. Wang等[59]通过简便的沉积退火法, 制备了高光活性的Ti掺杂的Fe2O3光阳极, 其光电流密度在1.23 VRHE时高达2.8 mA/cm2(图 5a).如此高的性能归因于Ti掺杂提高了施主密度和延长了载流子的寿命.根据相关报道, 在高温退火过程中, Sn将从FTO基底自发扩散到Fe2O3纳米结构中, 这也显著提高了生长在FTO基底上的Fe2O3纳米结构的电导率.这种自发的Sn掺杂充当电子给体, 并提高了Fe2O3的载流子密度. Tamirat等[65]的研究发现Sn的扩散形成了典型的梯度分布, 进而导致了多频带弯的形成.除了提高载流子浓度之外, 这种梯度的Sn掺杂还会导致向上的多频带弯区域, 这有助于形成内建电场, 以促进少数载流子向电极/电解质界面迁移.此外, Li等[60]提出了一种硅封装策略, 不仅实现了Sn在Fe2O3纳米线上的均匀分布, 而且在高温焙烧后仍然保持了一维结构, 最终得到的光阳极在1.23 VRHE时获得了2.2 mA/cm2的光电流密度(图 5b).
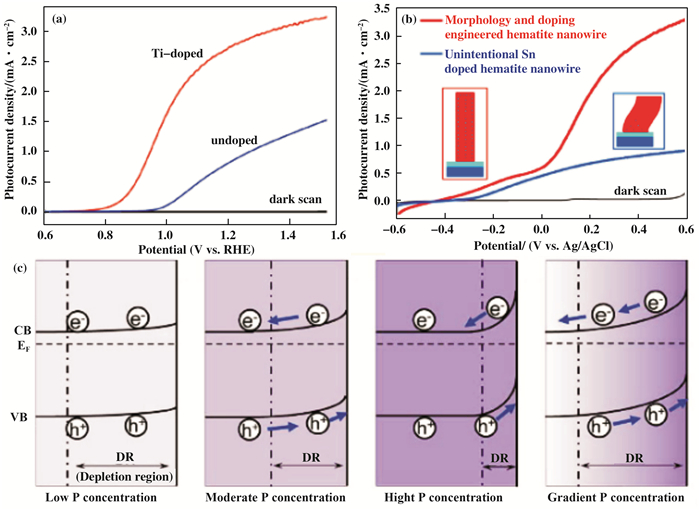
|
图 5 (a) Ti掺杂Fe2O3光阳极的J-V曲线[59]; (b)不同的Sn掺杂和形貌对Fe2O3光阳极光电流密度的影响[60]; (c)P元素的掺杂浓度对Fe2O3能带的影响[61] Fig.5 (a) J-V curves of Fe2O3 films with Ti-doping; (b) Comparison of photocurrent densities of Fe2O3 photoanodes with different Sn-doping and morphology; (c) The effect of P concentration on the band bending in hematite |
除此之外, 常见的掺杂元素还有P.磷原子比Si, Ti和Sn具有更多的价电子, 并且P—O键比Si—O具有更强的共价性.因此, P掺杂有望在Fe2O3中提供更多的电子载流子以及避免深电子捕获位点的形成[66].利用简单的浸渍-焙烧法将非金属P掺杂在Fe2O3的体相内, P掺杂后的光阳极在1.23 VRHE时的光电流密度达到了2.7 mA/cm2, 是纯Fe2O3光阳极的3.3倍.理论计算和电化学阻抗谱的结果表明光电流密度的显著提高是由于P掺杂大幅度提高了光阳极的电子迁移率[66].另外, Luo等[61]也通过相似的方法(滴涂-焙烧法)在Fe2O3光阳极上实现了P的梯度掺杂.如图 5c所示, 当P的掺杂浓度较低时, Fe2O3的能带弯曲度很小, 激发态的电子/空穴无法有效分离.随着P掺杂浓度的增加, 能带的弯曲度增大, 促进了电子/空穴对的分离, 但是耗尽宽度减小.而过多的P掺入会导致电荷分离的耗尽区过窄, 影响光催化效率.相比之下, P元素在Fe2O3中的梯度分布不仅改善了光阳极的导电性, 而且在比较宽的区域内引起了更向上的能带弯曲, 进而提高了光阳极的电荷分离效率.
最后, 氧空位的自掺杂也是提高Fe2O3光阳极PEC性能的另一种可行途径.在Fe2O3中, 氧空位被认为是施主掺杂剂.一个氧空位的产生会留下两个电子, 这可以增加多数载流子的密度, 从而提高电导率. Ling等[68]发现, 与在空气中焙烧相比, 在550 ℃的缺氧环境(N2+空气)中对FeOOH纳米线阵列进行焙烧, 可以显著改善水氧化的光电流. PEC性能的提高是由于氧空位的形成增加了施主密度.最近, Wang等[67]在N2气氛中焙烧FeOOH阵列, 并通过调节焙烧时间得到了不同氧空位浓度的Fe2O3光阳极(图 6).研究结果显示, 氧空位的存在可以促进表面的水氧化反应, 提高载流子浓度以增强电荷转移和抑制体相复合.另一方面, 氧空位也会在表面形成捕获态, 导致严重的界面电荷复合, 降低光电转化效率.通过调节Fe2O3光阳极中氧空位的浓度来平衡氧空位造成的有利和不利影响, Fe2O3光阳极的光电流密度最终提高了8倍.
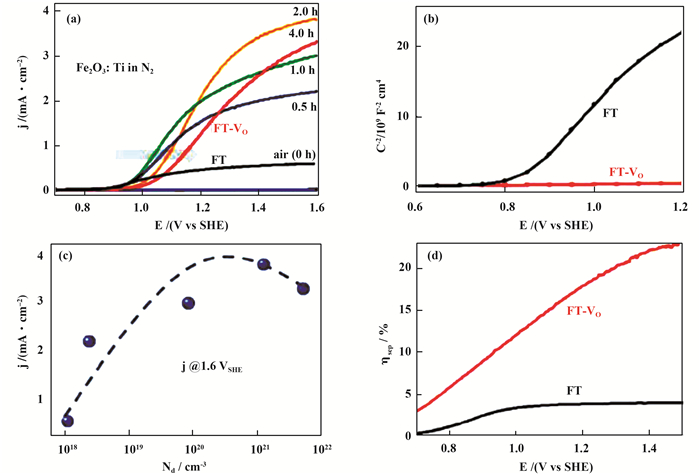
|
图 6 (a) Fe2O3:Ti光阳极经过不同N2处理时间的光电流密度; (b)FT和FT-VO光阳极的Mott-Schottky曲线; (c)偏压为1.6 VSHE时, 载流子浓度和光电流密度之间的关系; (d)光阳极体相内的电荷分离效率[67] Fig.6 (a) The photocurrent densities of Fe2O3:Ti photoanodes with different N2 treatment times; (b) The Mott-Schottky curves for FT and FT-VO photoanodes; (c) The relationship between carrier concentration (Nd) and photocurrent density at 1.6 VSHE; (d) The bulk charge separation efficiencies (ηsep) of the corresponding photoanodes |
构建异质结是促进Fe2O3中电子空穴对分离, 提高光电转换效率的另一种有效策略.异质结的形成具有3个主要作用, 即:提高可见光吸收率, 促进电荷分离以及延长电荷载流子的寿命. 图 7为交错型(staggered)异质结和Z型(Z-scheme)异质结的示意图.在交错型异质结中(图 7a), 半导体2(sem2)的CB和VB位置都略高于半导体1(sem1).能带弯曲后, 形成的内建电场将驱动光生电子从半导体2向半导体1迁移, 而光生空穴从半导体1向半导体2迁移, 最终实现电子和空穴在异质结的两侧空间分离.对于Z型异质结(图 7b), 半导体1的CB位置接近半导体2的VB位置, 导致半导体1的光生电子与半导体2的空穴在界面发生复合.该复合将产生正向的电流, 而总的光电压是半导体1和半导体2的光电压之和[70].
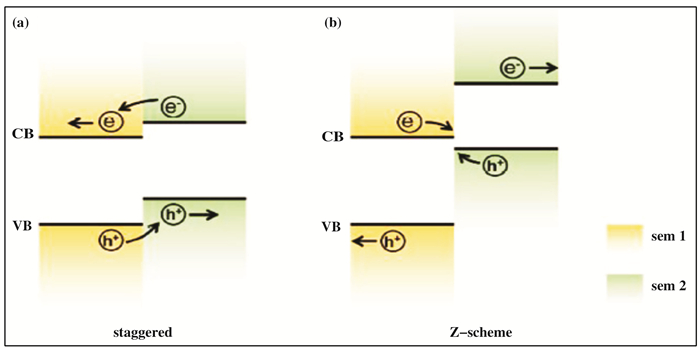
|
图 7 两种异质结的能带结构 Fig.7 Band structure of two kinds of heterojunction (a)交错型; (b)Z型[69] (a) Staggered junction; (b) Z-scheme junction |
Fe2O3与一些FeMxOy材料可以形成良好的交错异质结, 其中FeMxOy是一种三元氧化物半导体, 通常是由Fe2O3和另一种金属氧化物材料(MOz)之间的固态反应形成的. Li等[71]发现, 在Fe2O3和TiO2之间形成的Fe2TiO5可以与Fe2O3形成更好的异质结. Fe2O3/Fe2TiO5异质结光阳极是通过简单的水热法, 以及ALD和空气退火制备的(图 8a). Fe2O3和Fe2TiO5之间良好的能带匹配在界面上形成了交错型异质结, 有效地促进了电子-空穴分离. Fe2O3/Fe2TiO5复合电极在1个模拟太阳光照(100 mW/cm2)下, 1.23 VRHE时的光电流密度为1.63 mA/cm2, 该值是纯Fe2O3电极的3.5倍.沉积NiFeOx助催化剂后, 该光阳极的起始电压为0.8 VRHE, 在1.23 VRHE处的光电流密度提升至2.7 mA/cm2. Hou等[72]报道了3D树枝状的Co-Fe2O3/MgFe2O4异质结(图 8b).该异质结的制备过程是首先在Ti网上水热生长Co掺杂的Fe2O3纳米阵列, 随后通过简单的浸渍法沉积MgFe2O4, 然后进行退火.该异质结光电极在0.8 V vs. Ag/AgCl时的光电流密度为3.34 mA/cm2, 分别是Fe2O3, Co-Fe2O3和Fe2O3/MgFe2O4光电阳极的2.69, 1.95和1.78倍. Mcdonald和Miao等[75-76]都对Fe2O3/ZnFe2O4异质结光阳极进行了研究.结果表明, 与单独的Fe2O3电极相比, Fe2O3/ZnFe2O4异质结光阳极表现出显著增强的光电流响应.电子-空穴的有效分离是由于ZnFe2O4的导、价带位置比Fe2O3更负(~200 mV). Zhang等[73]通过混合微波热处理法在Fe2O3纳米棒表面生长了FeNbO4纳米层, 形成Fe2O3/FeNbO4异质结构(图 8c). 修饰NiFeOx助催化剂后, 复合光阳极在1.23 VRHE时的光电流密度达到了2.71 mA/cm2, 并且分解水产氢的法拉第效率达到了100%.作者认为, 大幅度提升的PEC水氧化活性是由于异质结的形成, Nb和Sn的共掺杂以及FTO导电性和纳米棒结构的保持.该团队之后利用同样的方法制备了Fe2O3/FeTaO4核壳异质结光阳极(图 8d)[74]. FeOOH助催化剂修饰后, FeOOH/Fe2O3/FeTaO4复合光阳极的光电流密度达到了2.86 mA/cm2(1.23 VRHE), 并且表面和体相的电荷分离效率分别达到了85%和24%.
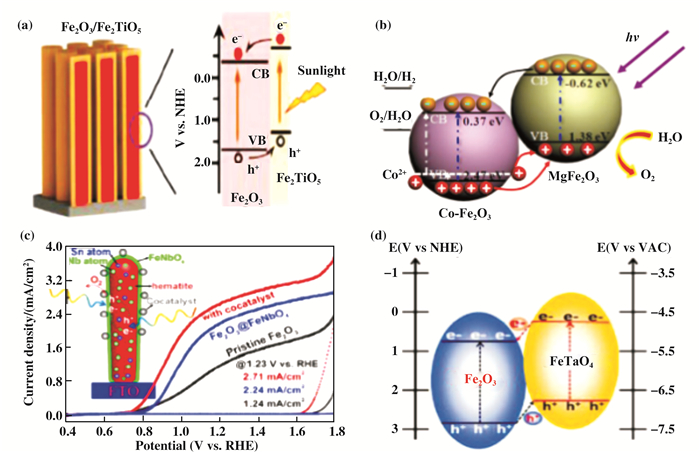
|
图 8 异质结光阳极的能带结构 Fig.8 Band diagram of heterojunction photoanode a)Fe2O3/Fe2TiO5[71]; (b)Co-Fe2O3/MgFe2O4[72]; (d)Fe2O3/FeTaO4[73]; (c)Fe2O3/FeNbO4异质结光阳极的纳米结构和J-V曲线[74] (a) Fe2O3/Fe2TiO5; (b) Co-Fe2O3/MgFe2O4; (d) Fe2O3/FeTaO4; (c) Nanostructure and J-V curves of Fe2O3/FeNbO4 heterojunction photoanode |
相比于光的穿透深度(波长λ为550 nm时, α-1 = 118 nm), Fe2O3的空穴扩散长度非常短(2~4 nm)[26, 60], 这将导致电子-空穴在半导体内迅速复合, 从而大大限制了其PEC性能.纳米结构的调控可以确保足够的太阳光吸收, 同时缩短光生载流子的迁移路径.对于Fe2O3, 常见的纳米结构包括纳米管[77]、纳米棒[71]、纳米树枝[34, 78]、纳米片[79].以及多维(或三维)纳米结构[80-81].另一种纳米结构是将Fe2O3薄膜沉积在特殊的导电基底上.
由于高温焙烧能够提高Fe2O3光阳极的结晶度, 并且使得FTO中的Sn扩散到Fe2O3体相之后实现Sn掺杂, 因此高温焙烧是提高Fe2O3光阳极PEC性能的关键因素[82-83].然而, Fe2O3纳米结构在高温下容易发生变形, 从而对光的吸收和光生载流子的迁移产生影响.为了解决这一难题, Li等[77]设计并合成了一种能够经受高温焙烧的Fe2O3纳米管光阳极.将ZrO2纳米层包裹在FeOOH纳米棒表面, 并在800 ℃下焙烧得到了纳米管阵列.该Fe2O3纳米管阵列保持了良好的一维结构, 因此显示出比纳米棒阵列更高的PEC水氧化活性.此外, Feng等[84]以ZnO纳米棒阵列为模板, 在Sb-SnO2基底上合成了取向性好、高密度、高纵横比的Fe2O3纳米管阵列.该纳米管光阳极不仅克服了Fe2O3一维纳米结构在高温焙烧时产生的结构坍塌, 而且由于其高取向性的管状结构、高的光吸收和丰富的表面活性位, 在1.23 VRHE时的光电流密度达到1.2 mA/cm2.
近年来, Fe2O3多维纳米结构的设计和构建受到了广泛关注.多维结构能够弥补因Fe2O3较小的薄膜厚度而导致的较低的光子吸收, 并且提高了载流子的收集效率(由于缩短了空穴扩散长度). Kang等[80]通过阳极氧化Fe箔制备了多维的Fe2O3框架结构(图 9).该Fe2O3光阳极在1.55 VRHE时的光电流密度达到了5.5 mA/cm2.他们将优异的PEC水氧化性能归因于光阳极大的表面积和低的电阻. Tang等[81]采用低成本的方法设计并制备了一种新型的三维赤铁矿纳米棒@纳米碗阵列.这种独特的纳米结构可以增强光的吸收, 促进光生电荷的有效分离.沉积NiFeOx助催化剂后, 光阳极的光电流密度达到了3.41±0.2 mA/cm2(1.23 VRHE), 是平面结构光阳极的2.35倍.
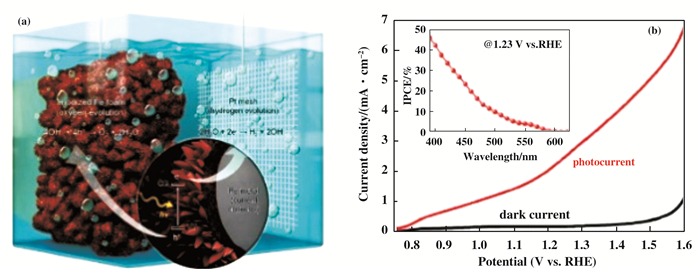
|
图 9 (a) Fe2O3光阳极PEC水分解反应的示意图; (b)Fe2O3光阳极的J-V曲线, 插图为IPCE数据[80] Fig.9 (a) Schematic image of the PEC water splitting reaction based on the Fe2O3 photoanode; (b) J-V curves of the Fe2O3 photoanode. Inset shows the IPCE data |
将超薄的Fe2O3膜沉积在三维的纳米光子结构表面后, 载流子最长的传输距离就是薄膜的厚度, 并且三维纳米光子结构能够提供优异的光捕获能力. Gao等[24]报道了在金纳米柱上生长Fe2O3超薄膜的研究(图 10a).首先利用纳米打印技术制备金纳米柱阵列.然后, 通过电子束将金属铁蒸发并沉积在金表面, 最后在纯氧中450 ℃退火约1 h.包覆在金纳米柱阵列上的Fe2O3薄膜光阳极的光电流密度的提高(图 10b), 主要是由于纳米结构中的表面等离子体共振和光子结构引起的光吸收的增加.通过改变Fe2O3薄膜的厚度, 也可以将等离子体的共振调节到一个理想的波长. Li等[85]也报道了一个类似的方法, 即利用光子结构和等离子体能量转移增强技术来提高Fe2O3的PEC性能.他们报道了一种独特的复合结构, 该复合结构由生长在等离子体金纳米孔阵列上的Fe2O3纳米棒组成(图 10c).当Fe2O3纳米棒填满金纳米孔阵列时, 在纳米棒阵列内部将产生一个类似于“光纤”一样的约束结构, 这种结构在捕获入射光的同时增强了光吸收.作者认为, 这种复合结构不仅降低了电荷的复合率, 而且在较宽的紫外-近红外光谱区同时增强了光子和等离子体的能量转移.该体系中, 光阳极在0.23 V vs. Ag/AgCl时的光电流密度提高了10倍(图 10d). Qiu等[86]也将超薄的Fe2O3膜沉积在三维纳米光子结构上, 得到了新型的PEC光阳极结构.他们认为, 纳米光子结构可以大大提高超薄活性材料的光吸收能力并为缓慢的表面水氧化反应提供大的表面积.最终, 这种纳米光子结构的光阳极在1.23 VRHE时的光电流密度达到了3.05 mA/cm2, 大约是平面光电极的3倍.

|
图 10 (a) Fe2O3包覆的金纳米柱阵列的示意图; (b)Fe2O3平面电极和纳米柱阵列的J-V曲线; (c)Fe2O3纳米棒和Au纳米孔阵列的SEM图, 标尺为200 nm; (d)AM 1.5G(100 mW/cm2)照射下的J-V曲线[24, 85] Fig.10 (a) Schematic illustration of Fe2O3 coated Au nanopillar arrays and (b) J-V curves of the pattern and nanopillar Fe2O3 electrode; (c) SEM images of the Au nanohole array with the hematite nanorods with a scale bar of 200 nm; (d) J-V curves under the illumination of AM 1.5G full-spectrum solar light with a power density of 100 mW/cm2 |
我们回顾了提高赤铁矿光阳极PEC水氧化性能的各种策略, 并着重介绍了目前最突出的研究进展.随着国内外研究的不断深入, Fe2O3光阳极的PEC水氧化性能比十年前提高了一个数量级.然而, 到目前为止, Fe2O3光阳极的STH转化效率仍然远低于实际应用的水平.根据我们前面的介绍, 将Fe2O3薄膜沉积在导电的纳米结构上似乎被认为是最有前途的Fe2O3光阳极结构之一.因为, 这种复合结构可以平衡光吸收和短的载流子迁移长度之间的矛盾.但这种Fe2O3薄膜仍然存在表面、体相和界面等方面的问题.因此, 开发高度匹配的电荷传输层或导电基底、可靠的Fe2O3薄膜制备手段(ALD)以及合理的助催化剂选择和沉积方法对获得真正适用的赤铁矿光电极具有重要意义.此外, 大量新型的表征分析手段, 如瞬态吸收光谱(TAS)、理论计算(DFT)、原位的红外光谱(FTIR)和光电子能谱(XPS)、同步辐射(XAFS)以及电化学-原子力显微镜(EC-AFM)、扫描电化学显微镜(SECM)、球差电镜(HAADF)将为深入理解光阳极PEC水氧化的机理提供关键的技术支持.我们相信在不久的将来, 通过研究人员的不断努力, 赤铁矿总有一天会成为太阳能转化领域非常重要的材料之一.
| [1] |
Chu S, Cui Y, Liu N. The path towards sustainable energy[J]. Nat Mater, 2017, 16(1): 16–22.
|
| [2] |
Walter M G, Warren E L, Mckone J R, et al. Solar water splitting cells[J]. Chem Rev, 2010, 110(11): 6446–6473.
DOI:10.1021/cr1002326 |
| [3] |
Fujishima A, Honda K. Electrochemical photolysis of water at a semiconductor electrode[J]. Nature, 1972, 238(5358): 37–38.
|
| [4] |
Chen H M, Chen C K, Liu R S, et al. Nano-architecture and material designs for water splitting photoelectrodes[J]. Chem Soc Rev, 2012, 41(17): 5654–5671.
DOI:10.1039/c2cs35019j |
| [5] |
Tachibana Y, Vayssieres L, Durrant J R. Artificial photosynthesis for solar water-splitting[J]. Nat Photon, 2012, 6(8): 511.
DOI:10.1038/nphoton.2012.175 |
| [6] |
Grätzel M. Photoelectrochemical cells[J]. Nature, 2001, 414(6861): 338–344.
DOI:10.1038/35104607 |
| [7] |
Lin Y, Yuan G, Liu R, et al. Semiconductor nanostructure-based photoelectrochemical water splitting:A brief review[J]. Chem Phys Lett, 2011, 507(4/6): 209–215.
|
| [8] |
Bak T, Nowotny J, Rekas M, et al. Photo-electrochemical hydrogen generation from water using solar energy. Materials-related aspects[J]. Int J Hydro Energy, 2002, 27(10): 991–1022.
|
| [9] |
Ling Y, Li Y. Review of Sn-doped hematite nanostructures for photoelectrochemical water splitting[J]. Part Syst Charct, 2014, 31(11): 1113–1121.
DOI:10.1002/ppsc.201400051 |
| [10] |
Turner J A. A realizable renewable energy future[J]. Science, 1999, 285(5428): 687–689.
DOI:10.1126/science.285.5428.687 |
| [11] |
Werner J H, Kolodinski S, Queisser H J. Novel optimization principles and efficiency limits for semiconductor solar cells[J]. Phys Rev Lett, 1994, 72(24): 3851.
DOI:10.1103/PhysRevLett.72.3851 |
| [12] |
Wang G, Wang H, Ling Y, et al. Hydrogen-treated TiO2 nanowire arrays for photoelectrochemical water splitting[J]. Nano Lett, 2011, 11(7): 3026–3033.
DOI:10.1021/nl201766h |
| [13] |
Li C, Wang T, Luo Z, et al. Transparent ALD-grown Ta2O5 protective layer for highly stable ZnO photoelectrode in solar water splitting[J]. Chem Commun, 2015, 51(34): 7290–7293.
DOI:10.1039/C5CC01015B |
| [14] |
Chang X, Wang T, Zhang P, et al. Enhanced surface reaction kinetics and charge separation of p-n heterojunction Co3O4/BiVO4 photoanodes[J]. J Am Chem Soc, 2015, 137(26): 8356–8359.
DOI:10.1021/jacs.5b04186 |
| [15] |
Kim T W, Choi K S. Nanoporous BiVO4 photoanodes with dual-layer oxygen evolution catalysts for solar water splitting[J]. Science, 2014, 343(6174): 990–994.
DOI:10.1126/science.1246913 |
| [16] |
Lee D K, Choi K S. Enhancing long-term photostability of BiVO4 photoanodes for solar water splitting by tuning electrolyte composition[J]. Nat Energy, 2018, 3(1): 53–60.
|
| [17] |
Liu G, Ye S, Yan P, et al. Enabling an integrated tantalum nitride photoanode to approach the theoretical photocurrent limit for solar water splitting[J]. Energy Environ Sci, 2016, 9(4): 1327–1334.
|
| [18] |
Hou Y, Zuo F, Dagg A P, et al. Branched WO3 nanosheet array with layered C3N4 heterojunctions and CoOx nanoparticles as a flexible photoanode for efficient photoelectrochemical water oxidation[J]. Adv Mater, 2014, 26(29): 5043–5049.
DOI:10.1002/adma.201401032 |
| [19] |
Hu S, Shaner M R, Beardslee J A, et al. Amorphous TiO2 coatings stabilize Si, GaAs, and GaP photoanodes for efficient water oxidation[J]. Science, 2014, 344(6187): 1005–1009.
DOI:10.1126/science.1251428 |
| [20] |
Dias P, Vilanova A, Lopes T, et al. Extremely stable bare hematite photoanode for solar water splitting[J]. Nano Energy, 2016, 23: 70–79.
DOI:10.1016/j.nanoen.2016.03.008 |
| [21] |
John R A, Boix P P, Yi C, et al. Atomically altered hematite for highly efficient perovskite tandem water-splitting devices[J]. ChemSusChem, 2017, 10(11): 2449–2456.
DOI:10.1002/cssc.201700159 |
| [22] |
Le Formal F, Pendlebury S R, Cornuz M, et al. Back electron-hole recombination in hematite photoanodes for water splitting[J]. J Am Chem Soc, 2014, 136(6): 2564–2574.
DOI:10.1021/ja412058x |
| [23] |
Dotan H, Sivula K, Grätzel M, et al. Probing the photoelectrochemical properties of hematite (α-Fe2O3) electrodes using hydrogen peroxide as a hole scavenger[J]. Energy Environ Sci, 2011, 4(3): 958–964.
|
| [24] |
Gao H, Liu C, Jeong H E, et al. Plasmon-enhanced photocatalytic activity of iron oxide on gold nanopillars[J]. ACS Nano, 2012, 6(1): 234–240.
DOI:10.1021/nn203457a |
| [25] |
Han J, Zong X, Wang Z, et al. A hematite photoanode with gradient structure shows an unprecedentedly low onset potential for photoelectrochemical water oxidation[J]. Phys Chem Chem Phys, 2014, 16(43): 23544–23548.
DOI:10.1039/C4CP03731F |
| [26] |
Cho I S, Han H S, Logar M, et al. Enhancing low-bias performance of hematite photoanodes for solar water splitting by simultaneous reduction of bulk, interface, and surface recombination pathways[J]. Adv Energy Mater, 2016, 6(4): 1501840.
|
| [27] |
Klahr B, Gimenez S, Fabregat-Santiago F, et al. Water oxidation at hematite photoelectrodes:The role of surface states[J]. J Am Chem Soc, 2012, 134(9): 4294–4302.
DOI:10.1021/ja210755h |
| [28] |
Klahr B, Gimenez S, Fabregat-Santiago F, et al. Electrochemical and photoelectrochemical investigation of water oxidation with hematite electrodes[J]. Energy Environ Sci, 2012, 5(6): 7626–7636.
DOI:10.1039/c2ee21414h |
| [29] |
Du C, Yang X, Mayer M T, et al. Hematite-based water splitting with low turn-on voltages[J]. Angew Chem Int Ed, 2013, 52(48): 12692–12695.
DOI:10.1002/anie.201306263 |
| [30] |
Li M, Deng J, Pu A, et al. Hydrogen-treated hematite nanostructures with low onset potential for highly efficient solar water oxidation[J]. J Mater Chem A, 2014, 2(19): 6727–6733.
DOI:10.1039/c4ta00729h |
| [31] |
Riha S C, Klahr B M, Tyo E C, et al. Atomic layer deposition of a submonolayer catalyst for the enhanced photoelectrochemical performance of water oxidation with hematite[J]. ACS Nano, 2013, 7(3): 2396–2405.
DOI:10.1021/nn305639z |
| [32] |
Katz M J, Riha S C, Jeong N C, et al. Toward solar fuels:Water splitting with sunlight and "rust"[J]. Coordin Chem Rev, 2012, 256(21/22): 2521–2529.
|
| [33] |
Carroll G M, Gamelin D R. Kinetic analysis of photoelectrochemical water oxidation by mesostructured Co-Pi/α-Fe2O3 photoanodes[J]. J Mater Chem A, 2016, 4(8): 2986–2994.
DOI:10.1039/C5TA06978E |
| [34] |
Tilley S D, Cornuz M, Sivula K, et al. Light-induced water splitting with hematite:Improved nanostructure and iridium oxide catalysis[J]. Angew Chem Int Ed, 2010, 49(36): 6405–6408.
DOI:10.1002/anie.201003110 |
| [35] |
Blakemore J D, Schley N D, Olack G W, et al. Anodic deposition of a robust iridium-based water-oxidation catalyst from organometallic precursors[J]. Chem Sci, 2011, 2(1): 94–98.
|
| [36] |
Li W, Sheehan S W, He D, et al. Hematite-based solar water splitting in acidic solutions:Functionalization by mono-and multilayers of iridium oxygen-evolution catalysts[J]. Angew Chem Int Ed, 2015, 54(39): 11428–11432.
DOI:10.1002/anie.201504427 |
| [37] |
Kanan M W, Nocera D G. In situ formation of an oxygen-evolving catalyst in neutral water containing phosphate and Co2+[J]. Science, 2008, 321(5892): 1072–1075.
DOI:10.1126/science.1162018 |
| [38] |
Zhong D K, Cornuz M, Sivula K, et al. Photo-assisted electrodeposition of cobalt-phosphate (Co-Pi) catalyst on hematite photoanodes for solar water oxidation[J]. Energy Environ Sci, 2011, 4(5): 1759–1764.
|
| [39] |
Klahr B, Gimenez S, Fabregat-Santiago F, et al. Photoelectrochemical and impedance spectroscopic investigation of water oxidation with "Co-Pi"-coated hematite electrodes[J]. J Am Chem Soc, 2012, 134(40): 16693–16700.
DOI:10.1021/ja306427f |
| [40] |
Carroll G M, Zhong D K, Gamelin D R. Mechanistic insights into solar water oxidation by cobalt-phosphate-modified α-Fe2O3 photoanodes[J]. Energy Environ Sci, 2015, 8(2): 577–584.
|
| [41] |
Tamirat A G, Su W N, Dubale A A, et al. Photoelectrochemical water splitting at low applied potential using a NiOOH coated codoped (Sn, Zr) α-Fe2O3 photoanode[J]. J Mater Chem A, 2015, 3(11): 5949–5961.
DOI:10.1039/C4TA06915C |
| [42] |
Young K M, Hamann T W. Enhanced photocatalytic water oxidation efficiency with Ni(OH)2 catalysts deposited on α-Fe2O3 via ALD[J]. Chem Commun, 2014, 50(63): 8727–8730.
DOI:10.1039/C4CC02598A |
| [43] |
Wang G, Ling Y, Lu X, et al. A mechanistic study into the catalytic effect of Ni(OH)2 on hematite for photoelectrochemical water oxidation[J]. Nanoscale, 2013, 5(10): 4129–4133.
DOI:10.1039/c3nr00569k |
| [44] |
Kim J Y, Youn D H, Kang K, et al. Highly conformal deposition of an ultrathin FeOOH layer on a hematite nanostructure for efficient solar water splitting[J]. Angew Chem Int Ed, 2016, 55(36): 10854–10858.
DOI:10.1002/anie.201605924 |
| [45] |
Morales-Guio C G, Mayer M T, Yella A, et al. An optically transparent iron nickel oxide catalyst for solar water splitting[J]. J Am Chem Soc, 2015, 137(31): 9927–9936.
DOI:10.1021/jacs.5b05544 |
| [46] |
Mccrory C C, Jung S, Peters J C, et al. Benchmarking heterogeneous electrocatalysts for the oxygen evolution reaction[J]. J Am Chem Soc, 2013, 135(45): 16977–16987.
DOI:10.1021/ja407115p |
| [47] |
Xu Y F, Wang X D, Chen H Y, et al. Toward high performance photoelectrochemical water oxidation:Combined effects of ultrafine cobalt iron oxide nanoparticle[J]. Adv Funct Mater, 2016, 26(24): 4414–4421.
DOI:10.1002/adfm.201600232 |
| [48] |
Zhang J, García-Rodríguez R, Cameron P, et al. Role of cobalt-iron (oxy) hydroxide (CoFeOx) as oxygen evolution catalyst on hematite photoanodes[J]. Energy Environ Sci, 2018, 11(10): 2972–2984.
DOI:10.1039/C8EE01346B |
| [49] |
Sivula K. Metal oxide photoelectrodes for solar fuel production, surface traps, and catalysis[J]. J Phys Chem Lett, 2013, 4(10): 1624–1633.
DOI:10.1021/jz4002983 |
| [50] |
Liu R, Zheng Z, Spurgeon J, et al. Enhanced photoelectrochemical water-splitting performance of semiconductors by surface passivation layers[J]. Energy Environ Sci, 2014, 7(8): 2504–2517.
DOI:10.1039/C4EE00450G |
| [51] |
Le Formal F, Tetreault N, Cornuz M, et al. Passivating surface states on water splitting hematite photoanodes with alumina overlayers[J]. Chem Sci, 2011, 2(4): 737–743.
|
| [52] |
Xi L, Chiam S Y, Mak W F, et al. A novel strategy for surface treatment on hematite photoanode for efficient water oxidation[J]. Chem Sci, 2013, 4(1): 164–169.
|
| [53] |
Hisatomi T, Le Formal F, Cornuz M, et al. Cathodic shift in onset potential of solar oxygen evolution on hematite by 13-group oxide overlayers[J]. Energy Environ Sci, 2011, 4(7): 2512–2515.
DOI:10.1039/c1ee01194d |
| [54] |
Xi L, Bassi P S, Chiam S Y, et al. Surface treatment of hematite photoanodes with zinc acetate for water oxidation[J]. Nanoscale, 2012, 4(15): 4430–4433.
DOI:10.1039/c2nr30862b |
| [55] |
Yang X, Liu R, Du C, et al. Improving hematite-based photoelectrochemical water splitting with ultrathin TiO2 by atomic layer deposition[J]. ACS Appl Mater Inter, 2014, 6(15): 12005–12011.
DOI:10.1021/am500948t |
| [56] |
Forster M, Potter R J, Yang Y, et al. Stable Ta2O5 overlayers on hematite for enhanced photoelectrochemical water splitting efficiencies[J]. ChemPhotoChem, 2018, 2(3): 183–189.
DOI:10.1002/cptc.201700156 |
| [57] |
Ahn H J, Yoon K Y, Kwak M J, et al. A titanium-doped SiOx passivation layer for greatly enhanced performance of a hematite-based photoelectrochemical system[J]. Angew Chem Int Ed, 2016, 55(34): 9922–9926.
DOI:10.1002/anie.201603666 |
| [58] |
Cheng W, He J, Sun Z, et al. Ni-doped overlayer hematite nanotube:A highly photoactive architecture for utilization of visible light[J]. J Phys Chem C, 2012, 116(45): 24060–24067.
DOI:10.1021/jp306738e |
| [59] |
Wang G, Ling Y, Wheeler D A, et al. Facile synthesis of highly photoactive α-Fe2O3-based films for water oxidation[J]. Nano Lett, 2011, 11(8): 3503–3509.
DOI:10.1021/nl202316j |
| [60] |
Li M, Yang Y, Ling Y, et al. Morphology and doping engineering of Sn-doped hematite nanowire photoanodes[J]. Nano Lett, 2017, 17(4): 2490–2495.
DOI:10.1021/acs.nanolett.7b00184 |
| [61] |
Luo Z, Li C, Liu S, et al. Gradient doping of phosphorus in Fe2O3 nanoarray photoanodes for enhanced charge separation[J]. Chem Sci, 2017, 8(1): 91–100.
|
| [62] |
Lukowski M A, Jin S. Improved synthesis and electrical properties of Si-doped α-Fe2O3 nanowires[J]. J Phys Chem C, 2011, 115(25): 12388–12395.
DOI:10.1021/jp203764e |
| [63] |
Zhao B, Kaspar T, Droubay T, et al. Electrical transport properties of Ti-doped Fe2O3 (0001) epitaxial films[J]. Phys Rev B, 2011, 84(24): 245325.
DOI:10.1103/PhysRevB.84.245325 |
| [64] |
Huda M N, Walsh A, Yan Y, et al. Electronic, structural, and magnetic effects of 3d transition metals in hematite[J]. J Appl Phys, 2010, 107(12): 123712.
DOI:10.1063/1.3432736 |
| [65] |
Tamirat A G, Su W N, Dubale A A, et al. Efficient photoelectrochemical water splitting using three dimensional urchin-like hematite nanostructure modified with reduced graphene oxide[J]. J Power Sour, 2015, 287: 119–128.
DOI:10.1016/j.jpowsour.2015.04.042 |
| [66] |
Zhang Y, Jiang S, Song W, et al. Nonmetal P-doped hematite photoanode with enhanced electron mobility and high water oxidation activity[J]. Energy Environ Sci, 2015, 8(4): 1231–1236.
|
| [67] |
Wang Z, Mao X, Chen P, et al. Understanding the roles of oxygen vacancies in hematite-based photoelectrochemical processes[J]. Angew Chem Int Ed, 2019, 131(4): 1042–1046.
DOI:10.1002/ange.201810583 |
| [68] |
Ling Y, Wang G, Reddy J, et al. The influence of oxygen content on the thermal activation of hematite nanowires[J]. Angew Chem Int Ed, 2012, 51(17): 4074–4079.
DOI:10.1002/anie.201107467 |
| [69] |
Li C, Luo Z, Wang T, et al. Surface, bulk, and interface:Rational design of hematite architecture toward efficient photo-electrochemical water splitting[J]. Adv Mater, 2018, 30(30): 1707502.
DOI:10.1002/adma.201707502 |
| [70] |
Zhou P, Yu J, Jaroniec M. All-solid-state Z-scheme photocatalytic systems[J]. Adv Mater, 2014, 26(29): 4920–4935.
DOI:10.1002/adma.201400288 |
| [71] |
Li C, Wang T, Luo Z, et al. Enhanced charge separation through ALD-modified Fe2O3/Fe2TiO5 nanorod heterojunction for photoelectrochemical water oxidation[J]. Small, 2016, 12(25): 3415–3422.
DOI:10.1002/smll.201600940 |
| [72] |
Hou Y, Zuo F, Dagg A, et al. A three-dimensional branched cobalt-doped α-Fe2O3nanorod/MgFe2O4 heterojunction array as a flexible photoanode for efficient photoelectrochemical water oxidation[J]. Angew Chem Int Ed, 2013, 52(4): 1248–1252.
DOI:10.1002/anie.201207578 |
| [73] |
Zhang H, Kim Y K, Jeong H Y, et al. A few atomic FeNbO4 overlayers on hematite nanorods:Microwave-induced high temperature phase for efficient photoelectrochemical water splitting[J]. ACS Catal, 2018, 9(2): 1289–1297.
|
| [74] |
Zhang H, Noh W Y, Li F, et al. Three birds, one-stone strategy for hybrid microwave synthesis of Ta and Sn codoped Fe2O3@FeTaO4 nanorods for photo-electrochemical water oxidation[J]. Adv Funct Mater, 2019, 29(11): 1805737.
DOI:10.1002/adfm.201805737 |
| [75] |
Mcdonald K J, Choi K S. Synthesis and photoelectrochemical properties of Fe2O3/ZnFe2O4 composite photoanodes for use in solar water oxidation[J]. Chem Mater, 2011, 23(21): 4863–4869.
DOI:10.1021/cm202399g |
| [76] |
Miao C, Ji S, Xu G, et al. Micro-nano-structured Fe2O3:Ti/ZnFe2O4 heterojunction films for water oxidation[J]. ACS Appl Mater Interfaces, 2012, 4(8): 4428–4433.
DOI:10.1021/am3011466 |
| [77] |
Li C, Li A, Luo Z, et al. Surviving high-temperature calcination:ZrO2-induced hematite nanotubes for photoelectrochemical water oxidation[J]. Angew Chem Int Ed, 2017, 56(15): 4150–4155.
DOI:10.1002/anie.201611330 |
| [78] |
Kay A, Cesar I, Grätzel M. New benchmark for water photooxidation by nanostructured α-Fe2O3 films[J]. J Am Chem Soc, 2006, 128(49): 15714–15721.
DOI:10.1021/ja064380l |
| [79] |
Peerakiatkhajohn P, Yun J H, Chen H, et al. Stable hematite nanosheet photoanodes for enhanced photoelectrochemical water splitting[J]. Adv Mater, 2016, 28(30): 6405–6410.
DOI:10.1002/adma.201601525 |
| [80] |
Kang J S, Noh Y, Kim J, et al. Iron oxide photoelectrode with multidimensional architecture for highly efficient photoelectrochemical water splitting[J]. Angew Chem Int Ed, 2017, 56(23): 6583–6588.
DOI:10.1002/anie.201703326 |
| [81] |
Tang S, Li M, Huang D, et al. 3D hierarchical nanorod@nanobowl array photoanode with a tunable light-trapping cutoff and bottom-selective field enhancement for efficient solar water splitting[J]. Small, 2019, 15(14): 1804976.
DOI:10.1002/smll.201804976 |
| [82] |
Kim J Y, Magesh G, Youn D H, et al. Single-crystalline, wormlike hematite photoanodes for efficient solar water splitting[J]. Sci Rep, 2013, 3: 2681.
DOI:10.1038/srep02681 |
| [83] |
Jang J W, Du C, Ye Y, et al. Enabling unassisted solar water splitting by iron oxide and silicon[J]. Nat Commun, 2015, 6(1): 1–5.
|
| [84] |
Feng C, Fu S, Wang W, et al. High-crystalline and high-aspect-ratio hematite nanotube photoanode for efficient solar water splitting[J]. Appl Catal B, 2019, 257: 117900.
DOI:10.1016/j.apcatb.2019.117900 |
| [85] |
Li J, Cushing S K, Zheng P, et al. Plasmon-induced photonic and energy-transfer enhancement of solar water splitting by a hematite nanorod array[J]. Nat Commun, 2013, 4(1): 1–8.
|
| [86] |
Qiu Y, Leung S F, Zhang Q, et al. Efficient photoelectrochemical water splitting with ultrathin films of hematite on three-dimensional nanophotonic structures[J]. Nano Lett, 2014, 14(4): 2123–2129.
DOI:10.1021/nl500359e |
 2020, Vol. 34
2020, Vol. 34


