2. 中国科学院兰州化学物理研究所 羰基合成与选择氧化国家重点实验室, 甘肃 兰州 730000
2. State Key Laboratory for Oxo Synthesis and Selective Oxidation, Lanzhou Institute of Chemical Physics, Chinese Academy of Sciences, Lanzhou 730000, China
天然酶, 是一类具有专一化学选择性、立体选择性和区域选择性的生物大分子, 其催化过程是在温和的条件下(接近标准大气压、人体生理pH值和室温温度)进行的高效、便于控制、无毒、无二次污染[1]的过程, 也是在食品、生物医药、有机化工等方面具有广泛用途的生物催化剂[2-3].但其应用经常会受到限制, 主要是因为从反应体系中回收较难、不能多次循环使用.纳米颗粒材料的大小与酶的大小相同, 因此可以利用纳米颗粒材料所拥有的多种特性, 如:体积效应、表面效应、量子尺寸效应、宏观量子隧道效应等, 与天然酶相结合去构建纳米杂化酶[4], 与天然酶相比, 纳米杂化酶有利于工业化应用, 操作方便, 容易回收和循环使用, pH值和温度范围更宽, 热稳定性较优.
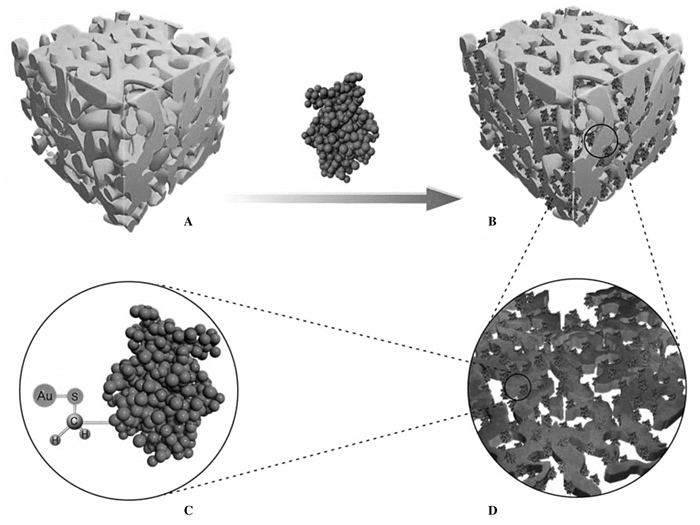
截止目前, 已有文献报道的可用于构建杂化酶体系的纳米材料有:纳米金属及纳米金属氧化物, 如:磷酸铜[Cu3(PO4)2][5]、磷酸氢钙(CaHPO4)[6]等.最近几年, 纳米金(NanoGoldparticles, AuNPs)这一新型纳米颗粒材料逐渐走进学者们的视野.它具有以下优良的性能: (1)可以很容易地回收和再次使用; (2)结构为开放的三维海绵状, 同时还有相当高的比表面积, 有较强的吸附性, 并能承受较高的酶负载量; (3)粒径尺寸从几纳米到几微米, 适合于具有特定分子量和功能的大范围酶分子; (4)拥有一个生物相容性、清洁性和活性的表面, 可有效地减轻酶的变性; (5)可以选择性的控制反应发生、使催化过程高效简便、对终产物的获取率高.综上, 纳米金的特性很符合绿色化学这一理念[7].
我们将从纳米金杂化酶的种类、制备方法、优势以及应用等方面对纳米金杂化酶的研究进展进行概述.以方便研究者们更深入地了解和应用纳米金杂化酶,并为他们提供更多方案和思路.
1 纳米金杂化酶的种类杂化酶与溶液中游离酶相比, 可以展现出更强的活性, 对环境变化的抗性也更强.更重要的是, 杂化酶体系的异质性使得酶和产物很容易回收, 酶可以实现多次重复利用. 表 1详细列举了可应用于纳米金杂化酶体系构建的酶类.
| 表 1 纳米金杂化酶的种类 Table 1 The type of nanogold particles-enzyme biohybrid |
利用纳米金粒子具有的优良性能—最小扩散限制、最大表面积和高酶负载量, 将纳米金粒子与酶结合去构建纳米金杂化酶, 可以很好的体现出杂化酶的稳定性提高以及循环利用次数增加等优势.虽然体系内的相互作用和催化机制是复杂的, 但纳米金粒子的尺寸、表面化学性质以及酶的结构、定向和密度都是影响酶-纳米金复合物性能的因素[20].已报道的制备纳米金杂化酶的方法有:物理吸附法、共价耦合法、原位还原法和交联酶聚集体法[21], 但不同制备方法对纳米金杂化酶的性能等方面有很大的影响.
2.1 物理吸附法(physical adsorption)将酶通过物理方法吸附固定在纳米金的表面, 操作简单快速, 与游离酶相比, 酶活性、稳定性以及酶的负载量均有显著提高. Qiu等[22]用物理吸附法将漆酶吸附在纳米金表面(图 1), 然后研究了不同粒径大小的纳米金对漆酶吸附的效果, 结果显示, 当纳米金的粒径为40~50 nm时效果最佳.接着以玻碳电极为载体, 利用漆酶在纳米金表面具有优异的物理化学性质, 构建了酶-纳米金玻碳生物电极, 然后进行高效的直接电化学研究.在4 ℃下保存30 d, 电极反应无明显变化.
Venditti等[23]研究了2-二乙氨基乙硫醇盐酸盐(DEA)(Au DEA@CRL)和3-巯基-1-丙磺酸钠(3MPS)(Au-3MPS@CRL)功能化的纳米金粒子固定化玫瑰假丝酵母脂肪酶(CRL), 从而制备了AuNPs@CRL生物复合物.研究了酶的负载量和脂溶活性(以自由CRL活性的百分比表示), 并与游离酶进行比较, 结果显示, Au-DEA@CRL生物复合物表现出了更好的性能, 可以获得65%~72%的酶负载率和高达95%的脂解活性, 而Au-3MPS@CRL只有53%~61%的酶负载率和45%的残留脂解活性.
纳米金表面可以适应不同分子量和尺寸的大分子, 并根据大分子的性质提供其在内外表面吸附的可能性. Wang等[24]用物理吸附法成功地将不同分子大小的假单胞菌脂肪酶、过氧化氢酶和辣根过氧化物酶固定在纳米金上, 构建了酶-纳米金生物复合体(图 2).然后用Bradford蛋白浓度测定法分别测量这3种酶的负载量, 结果为3.6、3.1和0.8 mg·g-1.在连续20次的连续反应后, 酶活性分别保持在74%、78%和53%.
此外, 纳米金的粒径大小和吸附时间对脂肪酶-纳米金生物复合材料的稳定性和可重用性有很大影响. Du等[25]通过物理吸附法合成了脂肪酶-纳米金生物复合体, 用扫描电子显微镜(SEM)对脂肪酶负载前和后纳米金的形态和组成进行了表征.研究还评价了脂肪酶-纳米金生物复合材料的可重用性, 粒径为35 nm的纳米金合成的脂肪酶-纳米金生物复合材料, 在吸附时长分别经过72和84 h后进行10次循环反应, 催化活性无变化, 而吸附时长为60 h的复合物在进行6次循环反应后催化活性显著下降, 原因可能是弱键和不定向连接导致生物复合材料的催化效率低、稳定性差, 亦或是大部分脂肪酶只吸附在纳米金的外表面, 而不是包裹在孔隙中, 在循环使用过程中导致稳定性差.粒径为100 nm的纳米金合成的脂肪酶-纳米金生物复合材料, 吸附时长分别经过60、72和84 h后进行循环反应, 催化活性均表现出显著的下降, 这可能是由于脂肪酶从粒径较大的纳米金中浸出, 活性丧失.
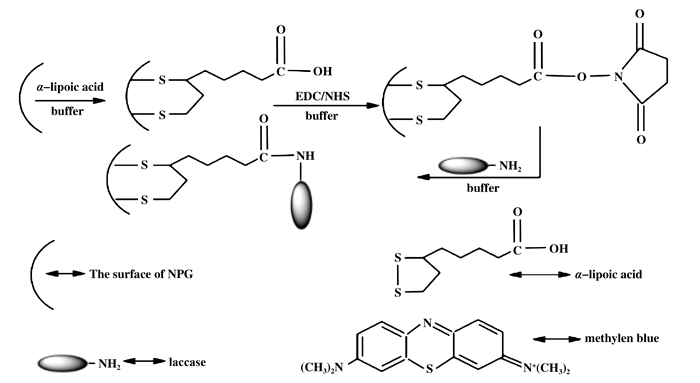
2.2 共价耦合法(covalent coupling)共价耦合法制备的纳米金杂化酶虽然可以减少酶的浸出, 但仍会受到酶定向和覆盖相关效应的影响.故了解酶的大小、赖氨酸残基的位置和活性位点对于了解酶在纳米金表面可能的取向是有价值的.其中, 赖氨酸残基是特别重要的, 因为它们可以通过有吸引力的金-胺相互作用提供相当强的耦合作用, 亦或是与羧酸端接的SAMs的共价接合.此外, 纳米金具有生物相容性和活性表面, 为硫醇基自组装单层技术进行共价结合提供了机会.在Qiu等[26]的研究中, 通过Au—S键形成α-硫辛酸自组装单层; 然后在水溶性EDC存在的条件下羧酸基团经酯化反应被NHS激活; 最后, 末端的NHS基团替换为漆酶表面的氨基基团, 从而获得了漆酶-纳米金复合体(图 3).实验还研究了纳米金的粒径尺寸大小与酶负载量和酶动力学之间的关系.当粒径变小时, 更多的漆酶能够被耦合; 动力学研究结果显示, 破碎后的纳米金有利于漆酶活性位点的暴露, 从而很容易与底物结合, 即:破碎能促进漆酶催化效率的提高.
有研究表明, 共价耦合法制备的酶-纳米金生物复合物不仅在多次循环后可以保留较高的初始催化活性, 而且可以提高催化反应速率. Yang等[27]提出利用共价耦合法构建脂肪酶-纳米金生物复合材料, 先用α-硫辛酸激活纳米金表面, 再用NHS碳酸盐激活, 通过共价键耦合获得脂肪酶-纳米金生物复合材料(图 4).然后通过傅里叶变换红外光谱图像对游离脂肪酶和脂肪酶-纳米金生物复合体进行观察分析, 结果显示在1600~1700 cm-1范围内的带可归因于脂肪酶的一个氨基的吸光度, 脂肪酶-纳米金复合物样品也显示出相同的吸光度峰值, 这证明了脂肪酶在纳米金上成功结合.接着研究了共价耦合和物理吸附两种制备方法对脂肪酶-NPG生物复合材料的催化活性和稳定性的影响.当脂肪酶通过共价耦合与纳米金连接时, 其残留活性占其初始活性的85%以上, 说明该生物复合物具有良好的可重用性, 而经物理吸附制备的脂肪酶-纳米金催化活性明显降低, 10次重复使用后残留活性仅保持60%.对于储存稳定性, 共价耦合法30 d后催化活性下降很小, 而物理吸附法活性在同一时期下降到50%.分析其原因, 虽然Au-S共价反应存在于物理吸收过程中, 但吸附和电等物理效应在24 h内起着关键作用.事实上, 脂肪酶的一小部分悬浮在载体表面, 再加上脂肪酶与纳米金之间的薄弱连接, 导致了脂肪酶的浸出, 储存稳定性下降.
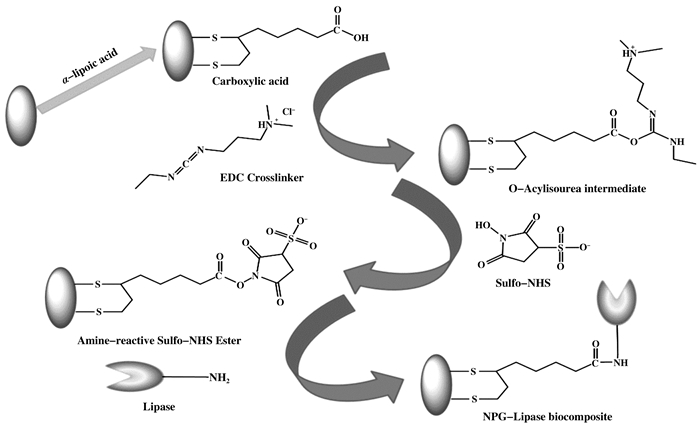
|
图 4 纳米金-酶生物复合物制备的原理图[27] Fig.4 A schematic diagram of the preparation of AuNPs-enzyme Biocmposite[27] |
Stine等[28]发现纳米金可用于生物分子的杂化, 尤其是酶类.研究发现通过在纳米金上形成带有末端反应官能团的自组装单层, 然后通过酰胺键连接赖氨酸残基与酶结合来实现纳米金杂化酶的构建.实验还分别利用EDC/ NHS共价耦合反应、乙腈共价耦合反应、戊二醛共价耦合反应来验证.并根据所选择的测定方法与蛋白质的相容性, 用BCA或Bradford蛋白浓度测定法测定酶的负载量.
Ardao等[29]利用功能化纳米金与硫醇、羧酸和胺的多重弱相互作用, 把从大肠杆菌中获得的鼠甘露糖-1-磷酸醛缩酶(RhuA)固定在纳米金表面, 研究了其催化磷酸二羟丙酮(DHAP)和(S)-Cbz-alaninal之间的立体选择性醛醇加成合成亚胺环醇前体的反应, 利用表面等离子体共振(SPR)位移和强度、动态光散射(DLS)和透射电镜(TEM)对酶的负载情况进行了表征, 在两个反应周期中, 在相同的反应条件下, 保持酶浓度一致, 醇醛加成反应的初始反应速率为4.5 mmol·L-1·h-1, 与游离酶反应速率1.1 mmol·L-1·h-1相比, 提高了4倍.
2.3 原位还原法(in situ reduction)将两种不同但具有互补的催化活性的酶-金属纳米粒子结合起来制备非均相纳米杂化酶催化剂, 在多次循环利用后, 其催化性能保持完好.而酶在其中的作用有以下3个: (1)纳米粒子形成的还原剂; (2)稳定剂和支持剂(避免纳米粒子发生聚集); (3)生物催化剂.
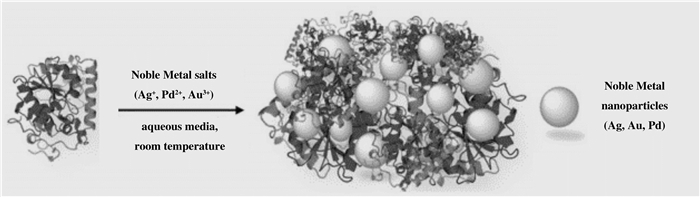
根据酶-金属纳米杂化物形成的机制:可溶性金属离子在酶上的第一次快速吸附, 降低其溶解度, 令其作为酶分子之间的交联剂(初始快速沉淀); 在没有任何外源还原剂存在的条件下, “原位”还原金属盐离子. Marco等[30]以脂肪酶Candida antarctica B (CAL-B)为载体, 在水溶液介质中, 温和的条件下分别还原Pd(OAc) 2、AgNO 3、HAuCl 4, 制备了CALB-PdNPs、CALB-AgNPs、CALB-AuNPs 3种纳米金属杂化酶(图 5).研究发现, 制备的金属纳米粒子在水溶液中非常稳定, 颗粒大小和形貌3个月内没有任何变化.实验还在4-硝基苯基丁酸酯的水解反应中进一步测验了CALB-金属杂化物的催化性能, 结果显示CALB-PdNPs生物杂交体中酶活性约47%、CALB-AgNPs生物杂交体中几乎没有酶活性、而在CALB-AuNPs生物杂交体中恢复了25%的初始酶活性.
由于在反应介质中形成的纳米金的稳定性是其有效收集和利用的一个重要标准, 利用各种条件和物质制备稳定的纳米金也受到了广泛的研究. Chinnadayyala等[31]报道了在碱性条件(pH 8.5)下, 利用醇氧化酶(AOx)蛋白自身驱动的自然反应过程, 原位还原HAuCl4生成纳米金粒子, 制备了纳米金杂化酶, 然后用于开发安培酒精生物传感器.实验发现, 纳米金杂化醇氧化酶的催化效率与游离酶相比提高了18%.
近年来, 随着人们对利用多种生物材料进行绿色合成途径的关注, 利用微生物进行纳米材料的生物合成是工业微生物学的一个新兴领域. Gholami-Shabani等[32]在DEAE Sephadex A-50上用离子交换色谱法从大肠杆菌中分离纯化了α-NADPH-依赖性的亚硫酸盐还原酶, 然后通过还原HAuCl4水溶液合成出大小可控、产率高、形状均匀、稳定性好的无毒抗菌纳米金粒子.在研究中, 用于纳米金合成的亚硫酸盐还原酶纯化率为13.5%, 纯化指数为9.1倍.当纳米金粒子的尺寸减小时, 其表面原子相互作用增加, 这可能是微小纳米粒子(1~10 nm)能够与生物系统相互作用的原因.
此外, 交联酶聚集体(Cross-linked enzymed aggregate, CLEAs)也是酶固定的方法.由蛋白质的水溶液与有机溶剂、非离子聚合物或盐类混合产生的酶通过交联剂聚集而成.利用各种不同的化学功能、反应性和大小的交联试剂, 改变酶的功能构象, 从而形成多动且稳定的生物催化剂[33].目前还未查到有相关文献中利用到纳米金的, 不过这一方法为工业过程中开发稳定可靠和可回收的生物催化剂提供了更多可能.
3 纳米金杂化酶的优势利用纳米金本身的优良性质, 与酶结合后构建的纳米金杂化酶, 与其他杂化酶相比能够表现出更好的优势, 如:催化效果好、杂化效率高等. Garcia等[34]以生物硅化的脂肪酶Candidaantarctica B (CAL-B)为载体, 分别以氯化金、氯化钯、氯化钌为前体, 通过原位还原制备了3种纳米杂化酶催化剂, 然后以油酸和乙醇为底物进行酯化反应, 通过计算脂肪酸向酯的转化, 确定了比酯化活性(mmol·min-1·g), 然后根据定义每小时每毫克蛋白质的微摩尔来评价各杂化酶的催化活性和稳定性, 并与游离酶进行了比较.结果显示, 在不同极性溶剂中进行的酯化反应, 所有生物纳米杂化物的杂化效率良好, 但以纳米金杂化脂肪酶效果最优(82%).在对比纳米杂化酶的酯化活性方面, 相比较于游离脂肪酶, 活性均有提高, 且在不同极性反应介质中表现出不同的耐受性.在金属方面, 酯化活性排列顺序为: Au > Pd ≈ CAL-B > Ru, 纳米金粒子的弱酸性性质(本质上是Lewis酸性)可以简单地解释这一排序结果[35], 并为在连续流动条件下以及更多催化反应中的应用开辟了新的前景.
4 纳米金杂化酶的应用纳米金由于其固有的惰性, 加上价格昂贵和难以分散等缺陷, 直到最近10年才得到广泛的应用, 可以通过脱合金法或是生物介导法获得.其具有的独特的物理化学特性, 如:易制备、良好的生物相容性、比表面积大和导电性强等, 在酶基生物传感器构建中可作为连接酶的活性位点和底层电极的桥梁, 因此可以将酶的生物催化特性与纳米金的这一独特性质结合起来构建纳米金杂化酶, 并广泛应用于电化学领域[36]. Wu等[37]将脂肪酶固定到纳米金表面, 再用脂肪酶-纳米金生物复合体对玻碳电极进行修饰, 制备了纳米金杂化脂肪酶-玻碳生物电极.为了验证电极的实际性能, 实验尝试检测人血清中甘油三酯的浓度, 发现自动生化分析仪给出的值与实验的结果很吻合, 很好的验证了制备的生物电极对实际人血清中甘油三酯浓度的测定是有效的. Wu等[38]将葡萄糖氧化酶固定在纳米金表面, 再用葡萄糖氧化酶-纳米金生物复合体对氧化石墨烯进行修饰, 制备了纳米金杂化葡萄糖氧化酶-氧化石墨烯电极.随后用其测定了人血清中的葡萄糖水平, 结果表明, 该方法与全自动生化分析仪测定结果的一致性误差范围在5%以内或更好. Siepenkoetter等[39]将胆红素氧化酶通过碳二胺偶联与重氮修饰的纳米金电极共价连接, 在磷酸缓冲盐溶液和人工血清中, 得到了500 nm厚、发电功率为17.5 μW·cm-2的酶-纳米金燃料电池.与平面金电极相比, 胆红素氧化酶修饰的纳米金电极的半衰期是其4倍, 稳定性明显提高.在经过8 h的连续运行后, 仍保持了60%以上的初始功率密度.
有文献表明, 纳米金杂化酶还可应用于催化酯类的合成. Wang等[40]将HAuCl4通过脂肪酶Novozym435直接原位还原成纳米金, 制备了纳米金杂化酶, 然后用其催化淀粉与阿魏酸乙酯的酯交换反应, 结果表明, 与游离酶Novozym435相比, 该杂化酶表现出良好的稳定性和耐溶剂性, 在回收5次后, 无活性损失.
此外, 利用纳米金配合物可以设计模拟酶.李春雨等[41]通过铜离子配位甲烷氧化菌素得到了纳米金-甲烷氧化菌素(Mb)-铜配合物, 构建天然辣根过氧化物模拟酶.设定反应温度、pH值、过氧化氢、催化剂摩尔比4个单因素, 通过其催化H2O2氧化对苯二酚, 验证模拟酶的活性.最终实验结果表明该模拟酶符合生物催化剂一般动力学规律, 与生物酶相比, 体现出更高的热稳定性.
5 酶的动力学测量酶的动力学是研究酶催化反应过程的科学, 它可以很好地表明酶的催化机制. 20世纪初, Michaelis和Menten根据催化蔗糖水解成葡萄糖和果糖的酶的动力学反应, 建立了Michaelis-Menten方程, 此后这一方程就应用于描述酶动力学反应过程的机制.虽然这一方法经常用于分析固定化杂化酶活性, 但其对状态的适用性受到限制.
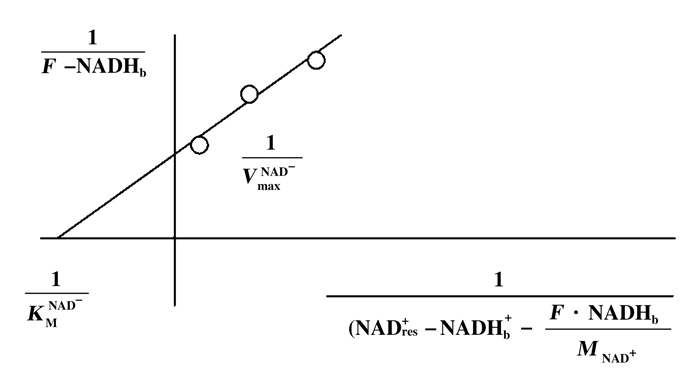
Cooney等[42]讨论了固定化杂化状态下的酶活性和动力学, 并提出新的方案来解决固定化障碍所带来的一些限制.其中一种方法是:先假设固定化杂化酶在整个反应过程中没有浸出.然后了解公式(1)中的未知量有: KMNAD+ (mmol/L)、MNAD+(cm3/min)和VmaxNAD+(μmol/min).依据公式(1), 先假定MNAD+的数值, 以Lineweaver - Burk图的形式绘制数据, 便可求出剩下的两个未知量(图 6).假设KMNAD+的值与游离溶液中酶的Km值不变, 那么可以选择MNAD+的值来生成KMNAD+的值, 该值等于游离溶液中确定的值.然后从Y轴截距上就可以读取Vmax的值, 这样3个未知量就都知道了.如果进一步假定固定过程不影响固定化杂化酶的流动率(相对于其在游离溶液中的活性), 那么这个Vmax值, 就代表所有酶的总活性, 可用于估计杂化酶的总量.
| $ F\cdot{\rm{NAD}}{{\rm{H}}_{\rm{b}}} = \frac{{V_{{\rm{max}}}^{{\rm{NA}}{{\rm{D}}^ + }}\cdot\left( {{\rm{NAD}}_{{\rm{res}}}^ + - {\rm{NAD}}{{\rm{H}}_{\rm{b}}} - \frac{{F\cdot{\rm{NAD}}{{\rm{H}}_{\rm{b}}}}}{{{M_{{\rm{NA}}{{\rm{D}}^ + }}}}}} \right)}}{{K_{\rm{M}}^{{\rm{NA}}{{\rm{D}}^ + }} + \left( {{\rm{NAD}}_{{\rm{res}}}^ + - {\rm{NADH}}_{\rm{b}}^ + - \frac{{F\cdot{\rm{NAD}}{{\rm{H}}_{\rm{b}}}}}{{{M_{{\rm{NA}}{{\rm{D}}^ + }}}}}} \right)}} $ | (1) |
|
图 6 Lineweaver-Burk解决方案到Eq.1的图形化描述[42] Fig.6 Graphical depiction of the Lineweaver-Burk solution to Eq.1[42] |
纳米技术、生物技术、电子技术的完美结合将推出新一轮具有广泛适用性的新型多功能结构体.纳米技术的最新进展增加了将工程纳米材料纳入生物催化剂的可能性, 纳米金杂化酶的合成产生了新的杂化催化剂, 为有机金属化学与生物催化的结合提供了更多途径.虽然目前具有独特功能的纳米金杂化酶的开发尚处于相对早期阶段, 多集中在氧化还原酶和水解酶上, 但可以预见, 其他类型的酶如裂解酶、异构酶以及RNA基或DNA基酶等也可能适用于纳米金的杂化, 未来这些方向的研究值得期待.另外, 我们在研究发展这些领域的同时, 还需要解决以下挑战: (1)纳米材料调节更多其他酶的潜力; (2)将更复杂和控制良好的纳米结构掺入酶中, 以引入更具吸引力的特性; (3)合理的设计纳米材料的表面功能性; (4)合理设计纳米颗粒材料的粒径尺寸、形状、形貌和组成的研究.
| [1] |
Sheldon R A, Van Pelt S. Enzyme immobilisation in biocatalysis:why, what and how[J]. Chem Soc Rev, 2013, 42(15): 6223–6235.
DOI:10.1039/C3CS60075K |
| [2] |
Salihu A, Alam M Z. Solvent tolerant lipases:A review[J]. Pro Biochemi, 2015, 50(1): 86–96.
|
| [3] |
Stergiou P Y, Foukis A, Filippou M, et al. Advances in lipase-catalyzed esterification reactions[J]. Biotechnol Adv, 2013, 31(8): 1846–1859.
DOI:10.1016/j.biotechadv.2013.08.006 |
| [4] |
Hwang E T, Gu M B. Enzyme stabilization by nano/microsized hybrid materials[J]. Eng Life Sci, 2013, 13(1): 49–61.
|
| [5] |
Ge J, Lei J, Zare R N. Protein-inorganic hybrid nanoflowers[J]. Nat Nanotechnol, 2012, 7(7): 428–432.
DOI:10.1038/nnano.2012.80 |
| [6] |
Wang L B, Wang Y C, He R, et al. A new nanobiocatalytic system based onallosteric effect with dramatically enhanced enzymatic performance[J]. Am Chem Soc, 2013, 135(4): 1272–1275.
DOI:10.1021/ja3120136 |
| [7] |
Li Shu-shuang(李舒爽), Tao Lei(陶磊), Zhang Qi(张奇), et al. Recent advancesin nano-gold-catalyzed green synthesis and clean reactions(纳米金催化的绿色合成与清洁反应研究新进展)[J]. Acta Phys Chim Sin(物理化学学报), 2016, 32(1): 61–74.
|
| [8] |
Wu C, Sun H, Li Y, et al. Biosensor based on glucose oxidase-nanoporous gold co-catalysis for glucose detection[J]. Biosens Bioelectron, 2015, 66: 350–355.
DOI:10.1016/j.bios.2014.11.037 |
| [9] |
Bretschneider J C, Maximilian R, Gero V P, et al. Photothermal control of the activity of HRP-functionalizedgold nanoparticles[J]. Small, 2010, 5(22): 2549–2553.
|
| [10] |
Hou C, Yang D, Liang B, et al. Enhanced performance of a glucose/O2 biofuel cell assembled with laccase-covalently immobilized three-dimensional macroporous gold film-based biocathode and bacterial surface displayed glucose dehydrogenase-based bioanode[J]. Anal Chem, 2014, 86(12): 6057–6063.
DOI:10.1021/ac501203n |
| [11] |
Salaj-Kosla U, Pöller S, Beyl Y, et al. Direct electron transfer of bilirubin oxidase (Myrothecium verrucaria) at an unmodified nanoporous gold biocathode[J]. Electrochem Comm, 2012, 16(1): 92–95.
|
| [12] |
Ding J, Zhang H, Jia F, et al. Assembly of carbon nanotubes on a nanoporous gold electrode for acetylcholinesterase biosensor design[J]. Sensor Actuator B Chem, 2014, 199: 284–290.
DOI:10.1016/j.snb.2014.04.012 |
| [13] |
Xiao X, Wang M, Li H, et al. Non-enzymatic glucose sensors based on controllable nanoporous gold/copper oxide nanohybrids[J]. Talanta, 2014, 125: 366–371.
DOI:10.1016/j.talanta.2014.03.030 |
| [14] |
Yan X, Wang X, Zhao P, et al. Xylanase immobilized nanoporous gold as a highly active and stable biocatalyst[J]. Micro Mesopor Mater, 2012, 161: 1–6.
DOI:10.1016/j.micromeso.2012.05.017 |
| [15] |
Siepenkoetter T, Salaj-Kosla U, Magner E. The immobilization of fructose dehydrogenase on nanoporous gold electrodes for the detection of fructose[J]. Chem Electro Chem, 2017, 4(4): 905–912.
|
| [16] |
Benavente R, Lopeztejedor D, Palomo J M. Synthesis of a superparamagnetic ultrathin FeCO3nanorods-enzyme bionanohybrid as a novel heterogeneous catalyst[J]. Chem Commun, 2018, 54(49): 6256–6259.
DOI:10.1039/C8CC02851F |
| [17] |
Zhang C, Zeng G, Huang D, et al. Combined removal of di(2-ethylhexyl) ph-thalate (DEHP) and Pb(Ⅱ) by using a cutinase loaded nanoporous gold-Polyethyleneimineadsorbent[J]. RSC Adv, 2014, 4: 55511–55518.
DOI:10.1039/C4RA09563D |
| [18] |
Pandey B P, Demchenko A V, Stine K J. Nanoporous gold as a solid support for an electrochemical immunoassay for prostate specificantigen (PSA) and carcinoembryonic antigen (CEA)[J]. Microchim Acta, 2012, 179(1/2): 71–81.
|
| [19] |
Pandey B, Bhattarai J B, Pornsuriyasak P, et al. Square-wave voltammetry assays for glycoproteins on nanoporous gold[J]. Electro Chem, 2014, 717/718: 47–60.
DOI:10.1016/j.jelechem.2014.01.009 |
| [20] |
Johnson B J, Russ Algar W, Malanoski A P, et al. Understanding enzymatic acceleration at nanoparticleinterfaces:approaches and challenges[J]. Nano Today, 2014, 9(1): 102–131.
DOI:10.1016/j.nantod.2014.02.005 |
| [21] |
Mohamad N R, Marzuki N H, Buang N A, et al. An overview of technologies for immobilization of enzymes and surface analysis techniques for immobilized enzymes[J]. Biotechnol & Biotechnol Eq, 2015, 29(2): 205–220.
|
| [22] |
Qiu H, Xu C, Huang X, et al. Adsorption of laccase on the surface of nanoporous gold and the direct electron transfer between them[J]. Phys Chem C, 2008, 112(38): 14781–14785.
DOI:10.1021/jp805600k |
| [23] |
Iole Venditti, Cleofe Palocci, Laura Chronopoulou, et al. Candida rugosa lipase immobilization on hydrophilic charged gold nanoparticles as promising biocatalysts:Activity and stability investigations[J]. Coll Surf B:Biointerfaces, 2015, 131: 93–101.
DOI:10.1016/j.colsurfb.2015.04.046 |
| [24] |
Wang X, Liu X, Yan X, et al. Enzyme-nanoporous gold biocomposite:excellent biocatalyst with improved biocatalytic performance and stability[J]. Plos One, 2011, 6(9): e24207.
DOI:10.1371/journal.pone.0024207 |
| [25] |
Du X, Liu X, Li Y, et al. Effificient biocatalyst by encapsulating lipase into nanoporous gold[J]. Nanoscale Res Lett, 2013, 8(1): 1–6.
DOI:10.1186/1556-276X-8-1 |
| [26] |
Qiu H, Xu C, Huang X, et al. Immobilization of laccase on nanoporous gold:Comparative studies on the immobilization strategies and particle size effects[J]. Phys Chem C, 2009, 113(6): 2521–2525.
DOI:10.1021/jp8090304 |
| [27] |
Yang X N, Huang X B, Hang R Q, et al. Improved catalyticperformance of porcine pancreas lipase immobilized onto nanoporous gold viacovalent coupling[J]. Mater Sci, 2016, 51: 6428–6435.
DOI:10.1007/s10853-016-9940-5 |
| [28] |
Stine Keith J, Jefferson Kenise, Shulga Olga V. Nanoporous gold for enzyme immobilization[J]. Meth Mol Biology (Clifton, N.J.), 2017, 1504: 37–60.
|
| [29] |
Ardao I, Comenge J, Benaiges M D, et al. Rational nanoconjugation improves biocatalytic performance of enzymes:aldol addition catalyzed by immobilizedrhamnulose-1-phosphate aldolase[J]. Langmuir, 2012, 28: 6461–6467.
DOI:10.1021/la3003993 |
| [30] |
Marco F, Marzia M, Morales M D P, et al. Synthesis of heterogeneous enzyme-metal nanoparticle biohybrids in aqueous media and their applications in C-C bond formation and tandem catalysis[J]. Chem Inform, 2013, 49(61): 6876–6878.
|
| [31] |
Chinnadayyala S R, Santhosh M, Singh N K, et al. Alcohol oxidase protein mediated in situsynthesized and stabilized gold nanoparticles for developing amperometric alcohol biosensor[J]. Biosen Bioelec, 2015, 69: 151–161.
|
| [32] |
Gholami-Shabani M, Shams-Ghahfarokhi M, Gholami-Shabani Z, et al. Enzymatic synthesis of gold nanoparticles using sulfite reductase purifiedfrom escherichia coli:A green eco-friendly approach[J]. Process Biochem, 2015, 50: 1076–1085.
DOI:10.1016/j.procbio.2015.04.004 |
| [33] |
Guauque M P, Torres M L, Foresti M L, et al. CLEAs of candida antarctica lipase B (CALB) with a bovine serum albumin (BSA) cofeeder core:Study of their catalytic activity[J]. Biochem Eng J, 2014, 90: 36–43.
DOI:10.1016/j.bej.2014.05.004 |
| [34] |
Garcia C, Junior I I, De Souza R O, et al. Novel nanoparticle/enzyme biosilicified nanohybrids for advanced heterogeneously catalyzed protocols[J]. Catal Sci & Technol, 2015, 5(3): 1840–1846.
|
| [35] |
Ntho T, Aluha J, Gqogqa P, et al. Au/γ-Al2O3 catalysts for glycerol oxidation:the effect of support acidity and gold particle size[J]. Rea Kinetics, Mec Catal, 2013, 109(1): 133–148.
DOI:10.1007/s11144-013-0542-9 |
| [36] |
Ahmadalinezhad A, Chen A. High-performance electrochemical biosensor for the detection of total cholesterol[J]. Biosen & Bioelect, 2011, 26(11): 4508–4513.
|
| [37] |
Wu C, Liu X, Li Y, et al. Lipase-nanoporous gold biocomposite modified electrode for reliable detection of triglycerides[J]. Biosen Bioelect, 2014, 53: 26–30.
DOI:10.1016/j.bios.2013.09.040 |
| [38] |
Wu C, Sun H, Li Y, et al. Biosensor based on glucose oxidase-nanoporous gold co-catalysis for glucose detection[J]. Biosen Bioelect, 2015, 66: 350–355.
DOI:10.1016/j.bios.2014.11.037 |
| [39] |
Siepenkoetter T, Salaj-Kosla U, Xiao X, et al. Immobilization of redox enzymes on nanoporous gold electrodes:Applications in biofuel cells[J]. Chem Plus Chem, 2017, 82(4): 553–560.
|
| [40] |
Wang Yan, Gao Peng, Xue Ye, et al. Novozym435-Gold nanoparticles biohybrids as an efficient catalyst for synthesis of ferulic acid starch ester[J]. J Nanosci Nanotechnol, 2020, 20(2): 1066–1073.
|
| [41] |
Li Chun-yu(李春雨), Xin Jia-ying(辛嘉英), Lin Hui-ying(林惠颖), et al. Study on functionalized goldnanoparticles of methanobactin by copper ion coordinationuesd as simulated peroxidase(铜离子配位甲烷氧化菌素功能化纳米金模拟过氧化物酶的研究)[J]. J Mol Catal (China)(分子催化), 2017, 31(5): 480–485.
|
| [42] |
Cooney , Kinetic M J. Measurements for enzyme immobilization[J]. Met Mol Biology, 2017, 1504: 215–232.
|
 2020, Vol. 34
2020, Vol. 34