2. 中化近代环保化工(西安)有限公司, 陕西 西安 710201
2. Sinochem Modern Environmental Protection Chemicals(Xi'an) Co. LTD., Xi'an 710201, China
随着中国煤炭消耗量及机动车保有量的增加, NOx的排放量迅速攀升, 由此引起的环境问题日益突出[1]. NOx对人体及环境危害巨大:它不仅对人体的呼吸系统造成危害, 同时也参与形成酸雨、光化学烟雾和破坏臭氧层等[2].目前, 消除NOx的技术主要包括NOx直接催化分解, NOx存储-还原催化净化, 等离子体技术, 非催化选择性还原及选择性催化还原(Selective Catalytic Reduction, SCR)等[3-6].其中, 氨的选择性催化还原技术(NH3-SCR)是近年来成功商用的主流技术, 该法以NH3为还原剂, 选择性地将NOx还原为N2.然而, 随着国家排放法规日益严格, 特别是2016年10月17日发布的国VI柴油车尾气排放法规, 不仅进一步降低了NOx的排放限值, 更为重要的是, 检测方法首次加大了发动机在低速、低负荷工况下(尾气温度低)的排放占比[7], 表明未来脱硝技术的发展趋势在于低温脱硝催化剂的开发.
近年来国内外对低温SCR脱硝催化剂进行了广泛而深入的研究, 其中催化剂活性组分组主要集中在过渡金属的氧化物, 如MnOx、FeOx、CoOx、CuOx等[8-9].锰氧化物由于存在多种价态, 具有较高的低温脱硝活性, 热稳定性和经济性等特点而受到广泛关注[10-12].然而, 锰氧化物的热稳定性比较差, 易烧结, 制约了其应用前景.为了解决上述问题, 常用的策略是采用载体进行负载.以往的研究表明, 载体不仅可以有效分散锰氧化物, 提高其热稳定性, 而且载体与活性组分氧化锰的相互作用, 能够影响其脱硝性能[12].目前, 负载型锰基催化剂的载体主要集中在Al2O3, SiO2, TiO2, CeO2, ZrO2, 活性炭及分子筛等[13-24].其中, TiO2由于具有优异的热稳定性、自身的酸碱性以及较强的活性组分与载体之间的相互作用, 被广泛应用于SCR催化剂的载体[16-17, 24].
Ettireddy[16]将锰负载于SiO2, γ-Al2O3和TiO2上, 其脱硝性能顺序如下: TiO2 (anatase) > SiO2> TiO2 (rutile) > TiO2 (anatase, rutile) > γ-Al2O3.其中, 20MnOx/TiO2 (anatase)在空速8000 h-1, 温度120 ℃下即可使NO完全转化为N2.进一步研究发现MnOx/TiO2优异的脱硝性能与载体TiO2具有较高的Lewis酸性有关.此外, 本课题组[14]前期研究了载体TiO2的颗粒尺寸对脱硝性能的影响规律.表征结果显示, TiO2颗粒尺寸能够显著影响锰基催化剂的氧化还原性, 表面酸碱性, 表面晶格氧及Mn4+浓度.利用in situ DRIFTS研究发现, NO在催化剂表面形成的吸附物种的反应活性为:桥式硝酸根>双齿硝酸根>单齿硝酸根, 且在Mn4+上吸附形成的桥式硝酸根具有最高的低温反应活性, 揭示了不同载体尺寸对其脱硝性能影响的根本原因.
Jiang等[25]采用浸渍法, 共沉淀法及溶胶-凝胶法制备MnOx/TiO2催化剂, 发现溶胶-凝胶法制备的催化剂具有更高的脱硝活性和抗硫性, 这源于该方法制备的催化剂具有更大的比表面积, 更强的Mn与Ti相互作用, 更高的表面羟基浓度. Zhang等[26]则采用超声辅助浸渍法合成MnOx/TiO2, 与常规浸渍法和溶胶-凝胶法相比具有更高的脱硝活性, 空速24 000 h-1, 反应温度100 ℃下NO转化率即可达到90%.表征结果表明更强的锰钛相互作用, 更高的锰氧化物分散度, 表面酸量和Mn原子浓度是其高的催化活性的关键. Li等[27]和Xie等[28-29]分别采用溶胶-凝胶法和模板法合成纳米棒结构的MnOx/TiO2催化剂, 均表现出极高的催化活性.作者将催化剂的高活性归因于其具更强的还原性和更高的MnOx分散度.黄海凤等[30]对比了浸渍法, 沉积法和共沉淀法制备的MnOx/TiO2催化剂的活性, 发现共沉淀法制备的催化剂表现出最好的低温脱硝活性, 这主要归因于该催化剂的比表面积, 孔容和总酸量最大, MnOx可以在载体表面高度分散.
Kim等[31]分别采用溶胶-凝胶法和浸渍法制备了不同负载量MnOx/TiO2催化剂,作者发现, 溶胶-凝胶法制备的催化剂低温脱硝活性远高于浸渍法, 并且随着Mn负载量增加活性显著提高.溶胶-凝胶法制备催化剂过程中Mn进入TiO2晶格从而形成高分散的锰钛催化剂, 而通过浸渍法制备的催化剂, 仅在载体表面形成了晶态MnO2.这些结果表明, 高分散的氧化锰是提高脱硝活性的关键. Putluru等[24]采用浸渍法和沉积沉淀法合成不同负载量Mn/TiO2催化剂, 两种制备方法所得催化剂在NH3-SCR反应中的活性趋势类似:催化剂活性先随Mn负载量增加而升高, 达到特定值后则随Mn负载量增加而下降;沉积沉淀法的低温脱硝活性更高. Park等[32]发现, 不同负载量的MnOx/TiO2催化剂中20MnOx/TiO2的脱硝性能最好, 该催化剂表面的Mn4+含量最高, Mn4+含量是影响催化剂脱硝性能的关键.
综上所述, MnOx/TiO2的脱硝活性不仅仅与载体的本身的性质(如酸碱性、尺寸等)有关, 还与制备方法等相关.其中锰的负载量在不同制备方法中往往表现出不同的脱硝催化活性和影响规律.为了更进一步研究锰的负载量对催化剂脱硝性能的影响, 我们采用工业上常用的浸渍法, 制备不同Mn负载量nMnOx/ TiO2(n = 2.5%, 5%, 10%, 15%)(质量分数)催化剂, 通过N2物理吸附、XRD、H2-TPR、NH3-TPD, XPS等表征手段, 系统研究Mn负载量对锰基催化剂脱硝性能的影响, 揭示催化剂脱硝性能与催化剂结构之间的关系.
1 实验部分 1.1 试剂与仪器 1.1.1 试剂二氧化钛(质量分数99.99%)购于阿拉丁试剂有限公司, 硝酸锰溶液(质量分数50%)购于天津市福晨化学试剂厂.
1.1.2 XRF样品的组成采用德国布鲁克公司S8 TIGERX型X射线荧光光谱仪. X射线管用Rh靶, 最大功率4 kW, 最大激发电压60 kV, 最大电流170 mA;测角仪最小步长0.0005°, 角度重现性 < +/-0.0001°.
1.1.3 XRD样品的晶相结构采用SHIMADZU公司XRD-6100型X射线粉末衍射仪进行测定, CuKα为辐射源(λ = 0.154 06 nm), 管电压30 kV, 管电流40 mA, 扫描范围2θ = 10°~80°, 步长为0.1°/s.
1.1.4 N2物理吸附/脱附N2吸附/脱附等温线由BELSORP-Max自动吸附比表仪测定, 吸附温度为-196 ℃.测定样品前, 先用BELPREP-vacⅡ在300 ℃脱气处理3 h.采用吸附等温线数据, BET法计算样品比表面积, BJH法计算孔径分布.
1.1.5 SEM扫描电镜采用美国MAIA3 LMH型扫描电子显微镜测试, 工作电压15 kV.
1.1.6 H2-TPR氢气程序升温还原(H2-TPR)在美国康塔公司的Autosorb-iQC-TPX全自动化学吸附仪上进行.具体步骤如下:取100 mg样品, 室温下5% (体积分数) O2 + Ar气氛下吹扫10 min, 流量30 mL/min;以10 ℃/min速率升温至500 ℃, 恒温30 min, 继续保持在流动的5% (体积分数) O2 + Ar气氛下降温至50 ℃;切换气体为He, 吹扫30 min;最后切换气体5%(体积分数) H2 + He, 打开TCD检测器, 吹扫30 min, 以10 ℃/min升温至800 ℃, 恒温30 min, N2吹扫下降至室温.
1.1.7 NH3-TPD氨气程序升温脱附(NH3-TPD)在美国康塔公司的Autosorb-iQC-TPX全自动化学吸附仪上进行.具体步骤如下:取100 mg样品, 室温下He吹扫10 min, 流量30 mL/min;以10 ℃/min速率升温至500 ℃, 恒温60 min, 自然冷却至50 ℃;保持流量不变, 切换气体5% (体积分数) NH3 + He, 吹扫60 min后, 再切换为He吹扫60 min.打开TCD检测器, 以10 ℃/min升温至800 ℃, 在800 ℃保持30 min.
1.1.8 XPSX-射线光电子能谱在Kratos公司AXIS Ultrabld型X射线光电子能谱仪上进行, 采用单色Al Kα射线(hν = 1253.6 eV), 加速功率15 kW.测试之前对样品进行抽真空脱气, 真空度达到5×10-7 Pa即可.样品的结合能采用粘污碳的C 1s进行校准(284.8 eV).采用Casa XPS对曲线进行拟合, 背景扣除方式为Shirley背景.
1.2 催化剂制备催化剂全部采用浸渍法制备.以锰载量10%(质量分数)催化剂为例, 取2.0 g锐钛矿型TiO2, 准确量取0.84 mL 50%(质量分数)硝酸锰溶液, 加入100 mL去离子水, 室温下搅拌24 h.用旋转蒸发仪在-0.09 MPa, 60 ℃条件下除去溶剂水, 所得产物在110 ℃过夜干燥.将干燥后的产物置于马弗炉内, 以1 ℃/min速率升温至500 ℃, 恒温5 h, 即得Mn负载量为10%(质量分数)催化剂, 记为10MnOx/TiO2.按照同样过程, 分别制备2.5MnOx/TiO2, 5MnOx/TiO2和15MnOx/TiO2.上述样品, 锰的负载量均通过XRF测定.
1.3 脱硝性能测试催化剂脱硝性能在固定床不锈钢管反应器(L= 60 cm, Φin = 7 mm)中进行.用石英棉将100 mg催化剂固定于反应器恒温区, 每次反应之前, 催化剂在400 ℃下, 流动的5%(体积分数) O2 + Ar气氛(流量66.7 mL/min)中预处理1 h.待温度降至50 ℃, 切换为NH3-SCR反应气体进行反应: NO 0.05%(体积分数), NH3 0.05%(体积分数), O2 5%(体积分数), Ar为平衡气.空速为40 000 mL/(h·g-cat), 设置起始温度65 ℃, 升温步长25 ℃, 升温速率2 ℃/min, 升至465 ℃.为了确保每个温度点反应都达到稳态, 每个温度都恒温保持1 h.反应器排出的尾气直接连接烟气分析仪(AFRISO, M60), 实时记录NO浓度变化.根据反应器进出口NO浓度差值, 计算NO转化率, 具体如下:
| $ \begin{array}{l} {\rm{NO}}\;{\rm{Conversion = }}\left\{ {{{\left[ {{\rm{NO}}} \right]}_{{\rm{in}}}}{\rm{ - }}{{\left[ {{\rm{NO}}} \right]}_{{\rm{out}}}}} \right\}{\rm{/}}\\ \;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;{\left[ {{\rm{NO}}} \right]_{{\rm{in}}}}{\rm{ \times 100\% }}\\ {\left[ {{\rm{NO}}} \right]_{{\rm{in}}}}{\rm{:反应器进口NO浓度, \% }}\left( {\rm{体积分数}} \right);\\ {\left[ {{\rm{NO}}} \right]_{{\rm{out}}}}{\rm{:反应器出口NO浓度, \% }}\left( {\rm{体积分数}} \right). \end{array} $ |
图 1a给出了不同Mn负载量nMnOx/TiO2(n = 2.5%, 5%, 10%, 15%)(质量分数)催化剂的NO转化率随着反应温度的变化曲线.催化剂床层温度由65 ℃上升至265~300 ℃, NO转化率逐渐上升;继续升温直至465 ℃, 转化率缓慢下降.催化剂的脱硝活性随反应温度升高呈现先升高后降低的规律, 主要是由于NH3-SCR反应路径不同造成的.前期研究表明[33-36], SCR反应路径可分为(1)标准SCR反应, (2)快速SCR反应和(3)慢速SCR反应, 3种反应路径取决于NO2/NOx摩尔比.在反应的起始阶段, 反应气氛中以NO为主, 反应主要以标准SCR反应路径进行;随着温度升高, NO氧化为NO2的速率增大, 导致NO2浓度升高, NO2/NOx摩尔比增加, 反应逐渐以快速SCR路径进行;温度继续上升, 当NO2/NOx摩尔比大于1后, 反应路径由快速SCR部分转变为慢速SCR.进一步升高温度, 由于NO氧化生成NO2反应的化学平衡限制(2NO + O2
| $ {{\rm{4N}}{{\rm{H}}_{\rm{3}}}{\rm{ + 4NO + }}{{\rm{O}}_{\rm{2}}} \to {\rm{4}}{{\rm{N}}_{\rm{2}}}{\rm{ + 6}}{{\rm{H}}_{\rm{2}}}{\rm{O}}} $ | (1) |
| $ {{\rm{4N}}{{\rm{H}}_{\rm{3}}}{\rm{ + 2NO + 2N}}{{\rm{O}}_{\rm{2}}} \to {\rm{4}}{{\rm{N}}_{\rm{2}}}{\rm{ + 6}}{{\rm{H}}_{\rm{2}}}{\rm{O}}} $ | (2) |
| $ {{\rm{4N}}{{\rm{H}}_{\rm{3}}}{\rm{ + 2N}}{{\rm{O}}_{\rm{2}}}{\rm{ + 3}}{{\rm{O}}_{\rm{2}}} \to {\rm{3}}{{\rm{N}}_{\rm{2}}}{\rm{ + 6}}{{\rm{H}}_{\rm{2}}}{\rm{O}}} $ | (3) |
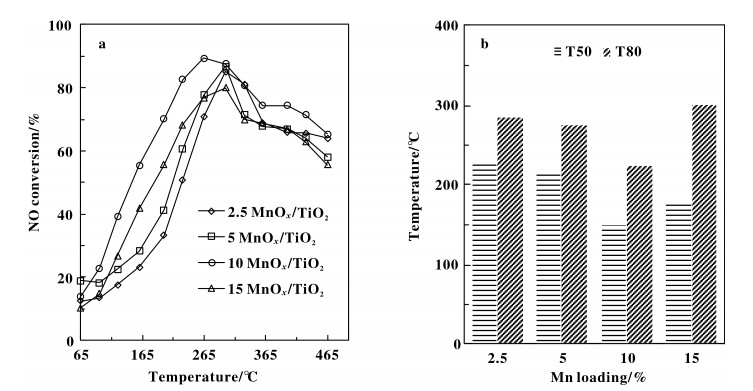
|
图 1 nMnOx/TiO2催化剂脱硝性能 Fig.1 The catalytic activity of nMnOx/TiO2 catalysts a. NOx conversion; b. T50 and T80 |
图 2给出了载体及nMnOx/TiO2的XRD谱图.图 2a中在25.3°, 37.8°, 48.0°, 53.9°, 55.1°, 62.8°及75.2°出现的衍射峰归属为锐钛矿型TiO2(JCPDS, 65-5714), 分别对应其(101), (004), (200), (105), (211), (204)和(215)晶面.而28.7°, 37.3°和56.5°的衍射峰归属则为MnO2(JCPDS, 24-0735), 分别对应(110), (101)和(211)晶面, 其中28.7°为最强衍射峰.负载锰之后, 催化剂的衍射峰位置不变, 衍射强度增大.这说明TiO2负载Mn之后经过高温焙烧, TiO2结晶度提高. 图 2b为2θ = 28.0°~29.6°对应衍射谱图, 当Mn负载量小于2.5%(质量分数), 锰氧化物处于高分散或无定形状态;大于2.5%(质量分数), 开始出现MnO2, 并且随着Mn负载量增大其衍射峰强度逐渐增大. Fang等[38]同样采用浸渍法, 改变锰前驱物制备了一系列MnOx/TiO2催化剂.他们发现, 经过500 ℃焙烧后, 以硝酸锰为前驱物, 所得催化剂中锰氧化物为MnO2.这与我们的结果一致. Amores等[39]用浸渍法制备TiO2负载锰基催化剂, 并计算得到锰氧化物达到单层分散时的负载量为3.6%(质量分数).可见, Mn负载量大于2.5%(质量分数)的3个催化剂均超过了单层分散值, 载体表面的MnOx聚集形成晶态的MnO2.然而, XRD对晶体直径的最小检测限为4 nm[40], 低于此值则无法检测到.由此推断, 在Mn负载量大于2.5%(质量分数)的3个催化剂表面, 由于高温焙烧, MnO2颗粒逐渐聚集形成晶体颗粒, 并随着Mn负载量增大而逐渐长大.通过Scherer公式计算MnO2晶粒尺寸.当Mn负载量为15%(质量分数)时, MnO2晶粒尺寸为20.5 nm;Mn负载量低于10%(质量分数)时, MnOx的晶粒尺寸受限于衍射峰太弱而无法使用Scherer公式计算得到, 说明锰以高分散或者无定形的MnOx形式存在.
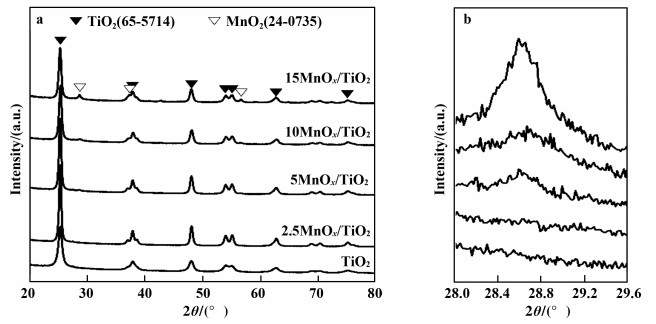
|
图 2 nMnOx/TiO2催化剂XRD谱图 Fig.2 XRD patterns of nMnOx/TiO2 catalysts a. 2θ = 20°~80°; b. 2θ = 28.0°~29.6° |
为了研究催化剂的孔结构及孔径分布等织构性质, 对催化剂及载体TiO2进行了N2吸/脱附实验. 图 3给出了催化剂的N2吸附/脱附等温线及BJH孔径分布.由图 3a可知, 催化剂等温线均属Ⅳ型等温线, 表明催化剂的孔结构均为介孔, 这些介孔结构是由颗粒聚集挤压形成的[41-42].根据IUPAC的分类, 各等温线的回滞环可归属为H1型, 表明催化剂由孔径分布较窄的圆柱形均匀介孔组成. 图 3b给出了催化剂及载体的孔径分布曲线, 载体TiO2的最可几孔径为40 nm, 当负载2.5%(质量分数)和5%(质量分数)锰之后, 最可几孔径增大至50 nm;随着Mn负载量增加至10%(质量分数)和15%(质量分数), 最可几孔径又减小至40 nm.载体及其负载锰催化剂的比表面积, 孔容和平均孔径汇总于表 1.载体TiO2的比表面积和孔径分别为184.3 m2·g-1和14.6 nm, 当负载锰之后, 催化剂比表面积减小, 平均孔径增大.这可能是由于在浸渍法制备过程中, 锰的前驱体硝酸锰进入孔道后, 占据孔道, 焙烧后沉积于载体表面, 使得比表面积减小.另一方面, 孔道中的硝酸锰在焙烧过程中释放出气体, 起到了扩孔的作用.值得注意的是, 在本工作中所有负载型锰基催化剂的孔径均远大于NH3-SCR反应分子(NO, O2和NH3)的动力学直径, 说明反应分子的扩散不受孔径影响.此外, 所有锰基催化剂的比表面积都相差不大, 这些结果表明, 不同锰基催化剂具有类似的织构性质.
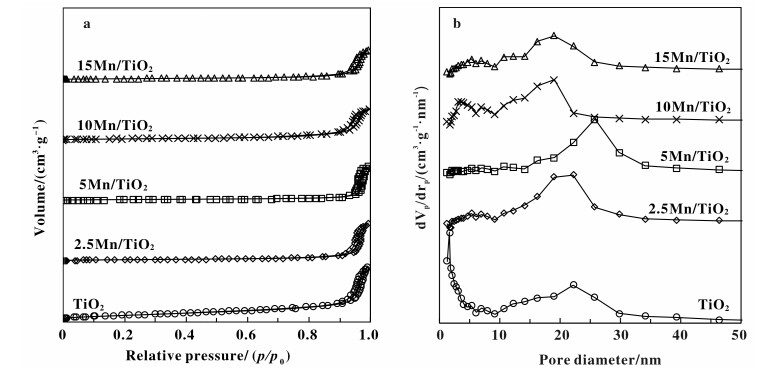
|
图 3 nMnOx/TiO2催化剂 Fig.3 a. N2 adsorption/desorption isotherms; b. BJH pore distribution curves |
| 表 1 nMnOx/TiO2比表面积, 孔容及平均孔径 Table 1 BET specific surface area, total pore volume and average pore diameter |
为了研究催化剂颗粒的表面形貌, 对nMnOx/TiO2进行了SEM测试, 如图 4所示.当锰负载量为2.5%(质量分数), 载体颗粒表面出现少量锰氧化物颗粒;锰负载量增加到5%(质量分数), 载体表面锰氧化物增加且分布均匀;当锰负载量提高至10%(质量分数), 锰氧化物完全覆盖载体表面, 且出现轻微的聚集现象;锰负载量达到15%(质量分数), 锰氧化物在载体颗粒表面聚集成较大的颗粒, 分散均匀性下降.可见, 10MnOx/TiO2表面锰氧化物分散相对较均匀, 这样有利于NO及NH3的吸附与反应, 从而获得较好的低温脱硝性能.

|
图 4 nMnOx/TiO2催化剂SEM图 Fig.4 SEM images of nMnOx/TiO2 a. 2.5MnOx/TiO2; b. 5MnOx/TiO2; c. 10MnOx/TiO2; d. 15MnOx/TiO2 |
为了研究催化剂的氧化还原性能, 对所有催化剂进行了H2-TPR表征. 图 5a给出了催化剂在100~800 ℃的H2-TPR曲线.所有催化剂均出现2个还原峰, 分别为在350~500 ℃的低温还原峰和在500~650 ℃的高温还原峰.其中低温还原峰可归属为表面的Ti4+和Mn4+还原为Ti3+与Mn3+[16, 24], 而高温还原峰归属为Mn3+还原至Mn2+[43-44].一般而言, TiO2在1000 ℃以内不会被H2还原, 但由于MnOx与TiO2强相互作用, 使该TiO2能够被还原.对于低温峰, 起始还原峰温与催化剂上表面氧的活性直接相关, 起始温度越低, 表面氧的活性越高. NH3-SCR反应遵循L-H或E-R反应机理, Marban等[45]证实在低温条件下, L-H机理活化能为25.1 kJ/mol, 而E-R机理活化能高达56.4 kJ/mol.因此, 在低温条件下反应更易以L-H机理进行.而表面氧的活性与NOx的吸附与活化紧密相关, 更高的表面氧活性意味着更快的NOx活化速率.可见, 提高催化剂对NOx的吸附及氧化活化能力, 促进反应以L-H机理进行, 有利于提高催化剂低温脱硝性能.在所有催化剂中, 起始还原温度的顺序为10MnOx/TiO2(196 ℃) < 15MnOx/TiO2(262 ℃) < 5MnOx/TiO2 (278 ℃) < 2.5MnOx/TiO2(364 ℃), 即对应于表面氧的活性顺序为10MnOx/TiO2 > 15MnOx/TiO2> 5MnOx/ TiO2> 2.5MnOx/TiO2.该顺序与催化剂的活性顺序一致, 说明表面氧的活性对催化剂的脱硝活性的提高起着重要的作用.为了进一步量化表面氧的含量, 在催化剂比表面积相近的情况下, 表面氧和体相氧的比例能够直接量化表面氧的含量.通过面积归一化法计算了H2-TPR曲线的峰面积及低温/高温峰面积比例, 汇总于表 2.随着Mn负载量由2.5%(质量分数)增加至15%(质量分数), 表面氧的比例分别为0.39, 0.72, 1.99和1.63.以低温峰/高温峰面积(SⅠ/SⅡ)为横坐标, T50为纵坐标作图, 如图 5b所示.随着SⅠ/SⅡ增大, 即催化剂表面氧含量的增加, T50温度逐渐下降, 且两者呈线性关系.由此可见, 表面氧含量是催化剂活性提高的根本原因, 其表面氧含量越高脱硝性能越好.前期研究表明, 表面氧的活性与锰和载体之间的相互作用直接相关, 特别是表面锰的价态.为了进一步研究催化剂的表面状态, 即表面价态和表面组成, 对所有样品进行了XPS表征.
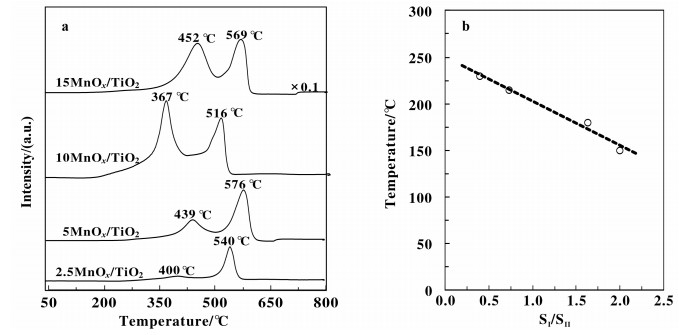
|
图 5 a. nMnOx/TiO2催化剂H2-TPR曲线; b. Mn4+含量对T50作图 Fig.5 a. H2-TPR profiles of nMnOx/TiO2 catalysts; b. T50 plot with SⅠ/SⅡ |
| 表 2 nMnOx/TiO2催化剂H2-TPR定量分析 Table 2 Quantitative analysis of H2-TPR for the nMnOx/TiO2 catalysts |
图 6a给出了5MnOx/TiO2, 10MnOx/TiO2和15MnOx/TiO2 3个催化剂的Mn 3s谱图, 2.5MnOx/TiO2由于Mn负载量较小, Mn 3s谱图信噪比较差, 故未列出.关于锰的价态, 单质锰和锰氧化物Mn 2p峰结合能差异明显(~3 eV), 很容易进行分辨, 但是锰的不同价态氧化物的Mn 2p峰差别比较小, 需要别的方式进行辅助识别.如Mn 2p的卫星峰, 或者Mn 3s峰.值得一提的是, 由于Mn 3s电子光电效应的末态不同, 所以表现出独特的双峰结构行为.这种双峰结构的间距会随着锰价态不同而有差别, 因此可以作为锰氧化态的判据.对于MnO (Mn2+), Mn2O3 (Mn3+)和MnO2 (Mn4+), 其Mn 3s的双峰间距分别为5.8, 5.3~5.4和4.7~4.8 eV[40].上述3个催化剂Mn 3s双峰间距分别为5.0, 5.1和4.9 eV, 表明负载于TiO2表面的锰氧化物并非单一价态, 而是存在Mn3+与Mn4+两种价态.
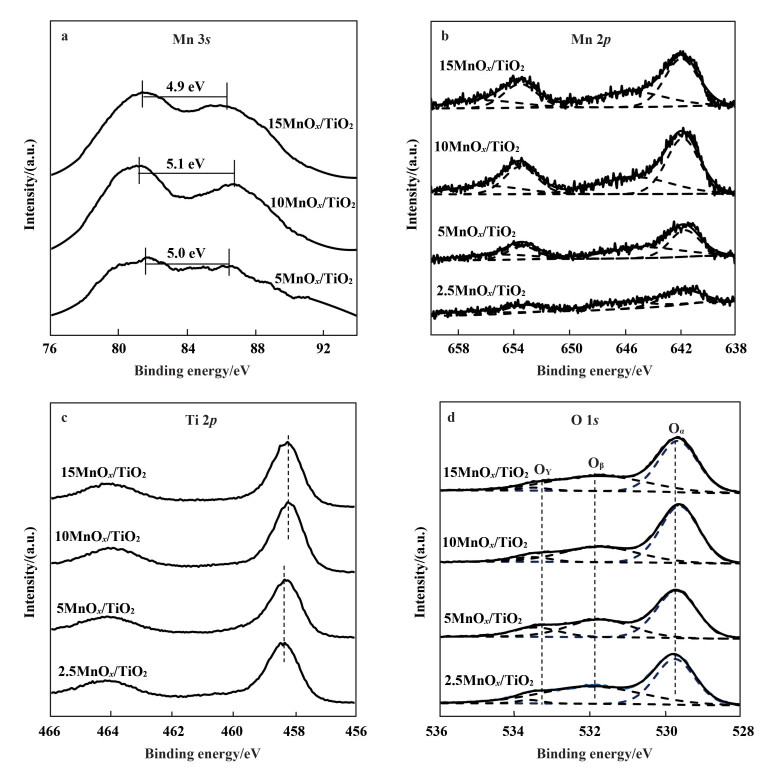
|
图 6 nMnOx/TiO2催化剂XPS谱图 Fig.6 XPS spectra of nMnOx/TiO2 a. Mn 3s; b. Mn 2p; c. O 1s; d. Ti 2p |
为进一步确定催化剂表面锰的价态及浓度, 对Mn 2p谱图分峰拟合(图 6b).锰基催化剂的Mn 2p3/2均可分为两个峰, 其中641.7~642.0 eV可归属为Mn3+, 而644.7~645.7 eV可归属为Mn4+[43, 46-49].为了定量比较催化剂中表面组成和价态, 对拟合得到的峰积分后, 汇总于表 3.随着负载量增加, 催化剂表面Mn4+浓度分别为43.6%, 49.8%, 59.5%和58.5%.即随Mn负载量增加, 表面Mn4+浓度逐渐升高, 当负载量10%(质量分数)达到最大值, 继续提高负载量, Mn4+浓度下降.值得指出的是, 催化剂表面Mn4+浓度顺序为10MnOx/TiO2>15MnOx/TiO2>5MnOx/TiO2>2.5MnOx/TiO2, 该结果与H2-TPR中表面氧的活性顺序一致.更为重要的是, 这些结果与催化剂活性顺序完全一致.
| 表 3 nMnOx/TiO2催化剂XPS结果汇总 Table 3 XPS results of nMnOx/TiO2 |
图 6c给出了nMnOx/TiO2催化剂的Ti 2p谱图, 随着锰负载量提高, Ti 2p1/2的结合能分别为458.4, 458.4, 458.3和458.3 eV. 10MnOx/TiO2和15MnOx/TiO2的Ti 2p1/2结合能比纯TiO2的Ti4+结合能(458.4 eV)低0.1 eV.这可能是MnOx与TiO2之间通过Mn—O—Ti键产生强的相互作用(如电子通过如下方式迁移: Mn3+ + Ti4+
图 6d给出了O 1s谱图的分峰拟合结果, 分别归属为表面晶格氧Oα(529.6~529.8 eV), 化学吸附氧Oβ(531.7~532.0 eV)和表面羟基Oγ(533.4 ~533.6 eV).化学吸附氧对NO氧化为NO2有促进作用, 从而提升快速SCR反应.此外, TiO2负载锰基催化剂中的MnO2可以通过还原为Mn2O3的途径释放氧物种, 后者也会参与到NO氧化为NO2的反应当中, 即晶格氧的存在有益于快速SCR反应的进行. 表 3给出了催化剂表面晶格氧的含量, 其顺序为10MnOx/TiO2>15MnOx/TiO2>5MnOx/TiO2>2.5MnOx/TiO2.不难发现, 表面晶格氧的含量与催化剂脱硝性能呈正相关, 即催化剂表面晶格氧含量越高, 催化剂脱硝性能越强. Lee等[43]研究了MnOx/TiO2催化剂中Mn的氧化态及晶格氧对催化剂低温脱硝性能的影响, 认为晶格氧对于低温下NO氧化为NO2有重要作用. Lou等[50]发现, 晶格氧能够在一定程度上提高锰基催化剂的活性, 具有更多晶格氧的催化剂表现出更高的脱硝性能. Deraz[49]也指出, 晶格氧能够提升反应过程中的氧循环.对于SCR反应, 这意味着提高催化剂对NO和O2的活化能力, 有助于反应以快速SCR进行, 进而提高反应活性.
此外, O 1s谱图还可用于估算锰的价态.据文献[51]报道, Oα对应氧物种为Mn-O-Mn, Oβ对应氧物种为Mn-O-H, 而Oγ则归属于H-O-H.由于所有Mn原子均与O原子键合, Mn-O-Mn的XPS信号强度由两种物种贡献, Mn-OH和MnO2.因此, 与Mn4+相关的XPS信号可以通过Mn-O-Mn信号强度减掉Mn-OH信号强度进行计算, 即:
| $ \begin{array}{l} {{\rm{O}}_x}{\rm{state = }}\left( {{{\rm{4}}^{\rm{*}}}\left( {{{\rm{S}}_{{\rm{Mn - O - Mn}}}}{\rm{ - }}{{\rm{S}}_{{\rm{Mn - O - H}}}}} \right){\rm{ + }}{{\rm{3}}^{\rm{*}}}{{\rm{S}}_{{\rm{Mn - O - H}}}}} \right)/\\ \;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;{{\rm{S}}_{{\rm{Mn - O - Mn}}}} \end{array} $ |
其中SMn-O-Mn为Oα的信号强度, SMn-O-Mn为Oβ的信号强度.
经过计算得知, 2.5MnOx/TiO2, 5MnOx/TiO2, 10MnOx/TiO2和15MnOx/TiO2的Mn平均价态分别为3.46, 3.48, 3.57及3.54. Mn平均价态由高到低为: 10MnOx/TiO2>15MnOx/TiO2>5MnOx/TiO2>2.5MnOx/TiO2.上述结果与Mn 2p谱图及H2-TPR中表面氧的浓度完全一致.基于物质的电中性原理, 结合O和Mn的XPS谱图以及H2-TPR的结果, 可以得到不同Mn负载量的MnOx/TiO2催化剂表面上由于Mn4+浓度的差别, 导致表面氧活性的不同, 进而影响了NO氧化为NO2的能力, 改变了快速SCR路径的比例, 最终影响了催化剂的脱硝性能.更重要的是, 在我们前期的工作中[14], 通过in situ DRIFTS研究发现, Mn4+还有助于NO的吸附.综上可知, 不同Mn负载量的MnOx/TiO2催化剂的脱硝性能不同, 根本原因在于表面氧及表面Mn4+浓度存在差异.
2.7 NH3-TPDSCR催化剂的脱硝过程, 不仅与氧化还原活性位对NO和O2的吸附活化有关, 还与表面酸性对于NH3的吸附活化有关[52].为了研究催化剂的表面酸性, 通过NH3-TPD对nMnOx/TiO2进行了表征. 图 7给出了载体及负载锰基催化剂在100~500 ℃范围内NH3的脱附峰, 在此温度范围内, 载体及催化剂均出现一个宽峰.为了更好地比较各样品中酸强度及酸量的差别, 对NH3-TPD曲线进行拟合分峰, 发现载体及锰基催化剂均可分为3个脱附峰, 脱附峰温度分别记为TⅠ, TⅡ和TⅢ, 各脱附峰对应的峰面积分别记为SⅠ, SⅡ和SⅢ. TⅠ, TⅡ和TⅢ对应的NH3脱附峰可分别归属为NH3物种从催化剂弱酸中心, 中强酸中心及强酸中心脱附[6, 53]. 表 4给出了各脱附峰的温度及其对应酸量.载体TiO2的酸量最高, 达到284 μmol/g;负载锰之后, 催化剂表面酸量出现大幅下降, 并且催化剂表面酸量随着Mn负载量的增加逐渐降低.这是由于催化剂表面酸量主要由载体TiO2提供, 而随着Mn的负载量增加, TiO2表面酸性位点在经历过催化剂的制备过程浸渍和焙烧后, 被MnOx覆盖所致, 这些结果与之前的文献结果一致[54].但值得注意的是, 虽然具有最佳低温脱硝性能的10MnOx/TiO2表面酸量并非最大, 但其与15MnOx/TiO2弱酸中心的数量是最多的, 均达到29 μmol/g.弱酸中心有利于催化剂在低温条件下对NH3的吸附活化, 进而表现出更高的低温脱硝性能. 5MnOx/TiO2和2.5MnOx/TiO2上弱酸量的顺序与脱硝性能不一致, 原因可能是两者的氧化还原性存在巨大的差异. H2-TPR结果表明, 5MnOx/TiO2催化剂中表面氧的量是2.5MnOx/TiO2催化剂的4倍, 综合可得5MnOx/TiO2的脱硝活性优于2.5MnOx/TiO2.综合以上结果可知, 对于不同Mn负载量的脱硝性能, 不仅与催化剂中弱酸位的酸量有关, 更为重要的是与催化剂表面氧的活性和表面Mn4+浓度有关.
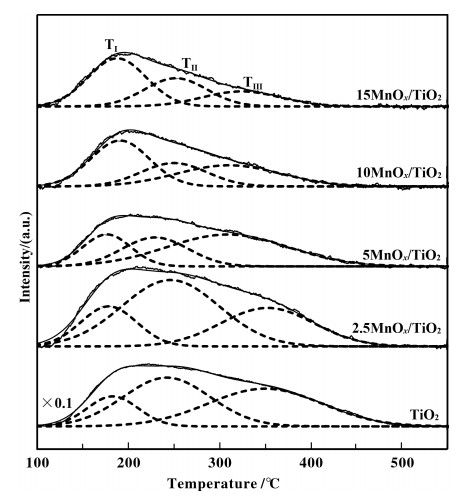
|
图 7 nMnOx/TiO2催化剂NH3-TPD曲线 Fig.7 NH3-TPD profiles of the nMnOx/TiO2 catalysts |
| 表 4 nMnOx/TiO2催化剂NH3-TPD定量分析 Table 4 Quantitative analysis of NH3-TPD for the nMnOx/TiO2 catalysts |
通过浸渍法制备了一系列Mn负载量的nMnOx/TiO2 (n = 2.5%, 5%, 10%, 15%)(质量分数), 结果发现不同Mn负载量的脱硝性能随着Mn负载量的增加, 呈现“火山型”曲线, 具体为: 10MnOx/TiO2>15MnOx/TiO2>5MnOx/TiO2>2.5MnOx/TiO2.进一步考察催化剂的氧化还原性和酸性发现, 对于催化剂的酸性, 催化剂的弱酸酸量可以影响低温脱硝性能.对于催化剂的氧化还原性, 通过H2-TPR和XPS结果发现:当Mn负载量由2.5%(质量分数)增加到10%(质量分数), nMnOx/TiO2催化剂表面氧的比例和表面Mn4+的浓度逐渐提高.然而进一步提高Mn负载量至15%(质量分数)时, 催化剂表面氧的比例和表面Mn4+的浓度反而下降.并且催化剂表面氧的比例和表面Mn4+的浓度顺序为: 10MnOx/TiO2>15MnOx/TiO2>5MnOx/TiO2>2.5MnOx/TiO2, 该变化顺序与催化剂脱硝性能的强弱顺序一致.更为重要的是, 将表面氧的浓度与T50关联发现, 催化剂表面氧的比例与T50呈线性关系.这些结果说明, 表面氧的比例是不同Mn负载量催化剂脱硝活性差异的关键.
| [1] |
Liu X, Zhang Y, Han W, et al. Enhanced nitrogen deposition over China[J]. Nature, 2013, 494(7438): 459–462.
DOI:10.1038/nature11917 |
| [2] |
Li Guo-liang(李国亮). Hazards of nitrogen oxide to the environment and pollution control technology(氮氧化物对环境的危害及污染控制技术)[J]. Shanxi Chem Ind(山西化工), 2019, 39(05): 123–124.
|
| [3] |
Gu Wei-rong(顾卫荣), Zhou Ming-ji(周明吉), Ma Wei(马薇). Technology status and analysis on coal-fired flue gas denitrification(燃煤烟气脱硝技术的研究进展)[J]. Chem Ind Eng Process(化工进展), 2012, 31(9): 2084–2093.
|
| [4] |
Fan Gai-xiao(樊改肖). Talking about the purification technologies of nitrogen oxides in vehicle exhaust gas(浅谈机动车尾气中氮氧化物减排技术的发展)[J]. Internal Combustion Eng & Parts(内燃机与配件), 2019, 13: 258–259.
|
| [5] |
Wang Hai-qiang(王海强), Wu Zhong-biao(吴忠标). Technique of NOx pollution control for flue gas(烟气氮氧化物脱除技术的特点分析)[J]. Eng Environ(能源与环境), 2004, 2004(3): 27–30.
|
| [6] |
Hu Zhun(胡准), Sun Ke-qiang(孙科强), Xu Bo-qing(徐柏庆). NOx storage-reduction catalysis and structure-performance relationship of Pt-BaO catalyst(Pt-BaO催化剂的NOx储存-还原化学及结构-性能关系)[J]. Chin J Catal(催化学报), 2011, 32(1): 17–26.
|
| [7] |
Zhao Guo-bin(赵国斌), Gai Yong-tian(盖永田), Geng Shuai(耿帅), et al. Experimental comparison and study of WHSC/WHTC and ESC/ETC test cycles(WHSC/WHTC与ESC/ETC测试循环的试验比较与研究)[J]. Chin J Auto Eng(汽车工程学报), 2015, 5(1): 29–34.
|
| [8] |
Busca G, Lietti L, Ramis G, et al. Chemical and mechanistic aspects of the selective catalytic reduction of NOx by ammonia over oxide catalysts:A review[J]. Appl Catal B:Environ, 1998, 18(1): 1–36.
|
| [9] |
Zhao Kun(赵堃), Han Wei-liang(韩维亮), Zhang Guo-dong(张国栋), et al. Review of metal oxide catalysts for diesel exhaust purification(柴油车SCR脱硝金属氧化物催化剂研究进展)[J]. J Mol Catal(China)(分子催化), 2015, 29(5): 494–504.
|
| [10] |
Liu F, Yu Y, He H. Environmentally-benign catalysts for the selective catalytic reduction of NOx from diesel engines:Structure-activity relationship and reaction mechanism aspects[J]. Chem Commun, 2014, 50(62): 8445–8463.
DOI:10.1039/C4CC01098A |
| [11] |
Shan W P, Song H. Catalysts for the selective catalytic reduction of NOx with NH3 at low temperature[J]. Catal Sci Technol, 2015, 5(9): 4280–4288.
DOI:10.1039/C5CY00737B |
| [12] |
Yang S, Qi F, Xiong S, et al. MnOx supported on Fe-Ti spinel:A novel Mn based low temperature SCR catalyst with a high N2 selectivity[J]. Appl Catal B:Environ, 2016, 181: 570–580.
DOI:10.1016/j.apcatb.2015.08.023 |
| [13] |
Song Zhong-xian(宋忠贤), Ning Ping(宁平), Li Hao(李昊), et al. Effect of Ce/Mn molar ratios on the low-temperature catalytic activity of CeO2-MnOx catalyst for selective catalytic reduction of NO by NH3(不同Ce/Mn摩尔比对CeO2-MnOx催化剂低温NH3选择性催化还原NO的影响)[J]. J Mol Catal(China)(分子催化), 2015, 29(5): 422–430.
|
| [14] |
Yang Y, Hu Z, Mi R, et al. Effect of initial support particle size of MnOx/TiO2 catalysts in the selective catalytic reduction of NO with NH3[J]. RSC Adv, 2019, 9(9): 4682–4692.
DOI:10.1039/C8RA10077B |
| [15] |
Jin R, Liu Y, Wu Z, et al. Low-temperature selective catalytic reduction of NO with NH3 over Mn-Ce oxides supported on TiO2 and Al2O3:A comparative study[J]. Chemosphere, 2010, 78(9): 1160–1166.
DOI:10.1016/j.chemosphere.2009.11.049 |
| [16] |
Ettireddy P R, Ettireddy N, Mamedov S, et al. Surface characterization studies of TiO2 supported manganese oxide catalysts for low temperature SCR of NO with NH3[J]. Appl Catal B:Environ, 2007, 76: 123–134.
DOI:10.1016/j.apcatb.2007.05.010 |
| [17] |
Smirniotis P G, Sreekanth P M, Peña D A, et al. Manganese oxide catalysts supported on TiO2, Al2O3, and SiO2:A comparison for low-temperature SCR of NO with NH3[J]. Ind & Eng Chem Res, 2006, 45(19): 6436–6443.
|
| [18] |
Singoredjo L, Korver R, Kapteijn F, et al. Alumina supported manganese oxides for the low-temperature selective catalytic reduction of nitric oxide with ammonia[J]. Appl Catal B:Environ, 1992, 1(4): 297–316.
DOI:10.1016/0926-3373(92)80055-5 |
| [19] |
Tang X, Hao J, Yi H, et al. Low-temperature SCR of NO with NH3 over AC/C supported manganese-based monolithic catalysts[J]. Catal Today, 2007, 126(3/4): 406–411.
|
| [20] |
Yao X, Kong T, Yu S, et al. Influence of different supports on the physicochemical properties and denitration performance of the supported Mn-based catalysts for NH3-SCR at low temperature[J]. Appl Surf Sci, 2017, 402: 208–217.
DOI:10.1016/j.apsusc.2017.01.081 |
| [21] |
Ye Y, Shen F, Wang H, et al. SSZ-13-supported manganese oxide catalysts for low temperature selective catalytic reduction of NOx by NH3[J]. J Chem Sci, 2017, 129(6): 765–774.
DOI:10.1007/s12039-017-1299-x |
| [22] |
Fang Qi-long(方祺隆), Zhu Bao-zhong(朱宝忠), Sun Yun-lan(孙运兰), et al. Study on the performance of low temperature De-NOx based on Mn-Fe/Al2O3 catalysts(Mn-Fe/Al2O3催化剂的低温脱硝性能研究)[J]. J Mol Catal(China)(分子催化), 2018, 32(4): 305–314.
|
| [23] |
Zi Zhao-hui(訾朝辉), Zhu Bao-zhong(朱宝忠), Sun Yun-lan(孙运兰), et al. Low-temperature selective catalytic reduction of NOx with ammonia over MnOx/Al2O3 catalysts(MnOx/Al2O3催化剂低温SCR脱硝性能)[J]. J Mol Catal(China)(分子催化), 2018, 32(3): 249–260.
|
| [24] |
Putluru S S R, Schill L, Jensen A D, et al. Mn/TiO2 and Mn-Fe/TiO2 catalysts synthesized by deposition precipitation-promising for selective catalytic reduction of NO with NH3 at low temperatures[J]. Appl Catal B:Environ, 2015, 165: 628–635.
DOI:10.1016/j.apcatb.2014.10.060 |
| [25] |
Jiang B, Liu Y, Wu Z. Low-temperature selective catalytic reduction of NO on MnOx/TiO2 prepared by different methods[J]. J Hazard Mater, 2009, 162(2/3): 1249–1254.
|
| [26] |
Zhang Y, Zhao X, Xu H, et al. Novel ultrasonic-modified MnOx/TiO2 for low-temperature selective catalytic reduction (SCR) of NO with ammonia[J]. J Coll Inter Sci, 2011, 361(1): 212–218.
DOI:10.1016/j.jcis.2011.05.012 |
| [27] |
Li F, Xie J, Cui H, et al. Performance regulation of Mn/TiO2 catalysts by surfactants for the selective catalytic reduction of NO with NH3 at low temperatures[J]. React Kinet, Mech Catal, 2018, 125: 647–661.
DOI:10.1007/s11144-018-1433-x |
| [28] |
Xie J, Fu Z, He F, et al. Synthesis, characterization and catalytic activities of MnOx/TiO2 in NO selective catalytic reduction with NH3[J]. Asian J Chem, 2013, 25(8): 4416–4418.
DOI:10.14233/ajchem.2013.14006 |
| [29] |
Xie J L, Fu Z B, He F, et al. Low temperature selective catalytic reduction of NOx with NH3 over MnOx/TiO2 catalyst[J]. Appl Mech Mater, 2013, 295/298: 364–369.
DOI:10.4028/www.scientific.net/AMM.295-298.364 |
| [30] |
Huang Hai-feng(黄海凤), Zhang Feng(张峰), Lu Han-feng(卢晗锋), et al. Effect of preparation methods on structures and performance of MnOx/TiO2 catalyst for 1ow-temperature NH3-SCR(制备方法对低温NH3-SCR脱硝催化剂MnOx/TiO2结构与性能的影响)[J]. Ciesc J(化工学报), 2010, 61(1): 80–85.
|
| [31] |
Kim Y J, Kwon H J, Nam I, et al. High NOx performance of Mn/TiO2 catalyst by NH3[J]. Catal Today, 2010, 151(3/4): 244–250.
|
| [32] |
Park K H, Lee S M, Kim S S, et al. Reversibility of Mn valence state in MnOx/TiO2 catalysts for low-temperature selective catalytic reduction for NO with NH3[J]. Catal Lett, 2013, 143(3): 246–253.
DOI:10.1007/s10562-012-0952-8 |
| [33] |
Li J, Chang H, Ma L, et al. Low-temperature selective catalytic reduction of NOx with NH3 over metal oxide and zeolite catalysts-A review[J]. Catal Today, 2011, 175(1): 147–156.
|
| [34] |
Damma D, Ettireddy P R, Reddy B M, et al. A review of low temperature NH3-SCR for removal of NOx[J]. Catalysts, 2019, 9(4): 349.
DOI:10.3390/catal9040349 |
| [35] |
Grossale A, Nova I, Tronconi E, et al. The chemistry of the NO/NO2-NH3 "fast" SCR reaction over Fe-ZSM5 investigated by transient reaction analysis[J]. J Catal, 2008, 256(2): 312–322.
DOI:10.1016/j.jcat.2008.03.027 |
| [36] |
Fu M, Li C, Lu P, et al. A review on selective catalytic reduction of NOx by supported catalysts at 100~300℃-catalysts, mechanism, kinetics[J]. Catal Sci Tech, 2013, 4(1): 14–25.
|
| [37] |
Yang N Z, Guo R T, Wang Q S, et al. Deactivation of Mn/TiO2 catalyst for NH3-SCR reaction:Effect of phosphorous[J]. RSC Adv, 2016, 6: 11226–11232.
DOI:10.1039/C5RA27713B |
| [38] |
Fang D, He F, Xie J, et al. Effects of atmospheres and precursors on MnOx/TiO2 catalysts for NH3-SCR at low temperature[J]. J Wuhan Univer Tech-Mater. Sci Ed,, 2013, 28(5): 888–892.
DOI:10.1007/s11595-013-0787-1 |
| [39] |
Gallardo-Amores J M, Armaroli T, Ramis G, et al. A study of anatase-supported Mn oxide as catalysts for 2-propanol oxidation[J]. Appl Catal B:Environ, 1999, 22(4): 249–259.
DOI:10.1016/S0926-3373(99)00055-7 |
| [40] |
Li B, Li S, Li N, et al. Structure and acidity of Mo/ZSM-5 synthesized by solid state reaction for methane dehydrogenation and aromatization[J]. Micro Meso Mater, 2006, 88(1/3): 244–253.
|
| [41] |
Xiao X, Sheng Z, Yang L, et al. Low-temperature selective catalytic reduction of NOx with NH3 over a manganese and cerium oxide/graphene composite prepared by a hydrothermal method[J]. Catal Sci Technol, 2016, 6(5): 1507–1514.
DOI:10.1039/C5CY01228G |
| [42] |
Zhang L, Cui S, Guo H, et al. The poisoning effect of potassium ions doped on MnOx/TiO2 catalysts for low-temperature selective catalytic reduction[J]. Appl Sur Sci, 2015, 355: 1116–1122.
DOI:10.1016/j.apsusc.2015.07.026 |
| [43] |
Lee S M, Park K H, Kim S S, et al. Effect of the Mn oxidation state and lattice oxygen in Mn-based TiO2 catalysts on the low-temperature selective catalytic reduction of NO by NH3[J]. J Air Waste Manag Assoc, 2012, 62(9): 1085–1092.
DOI:10.1080/10962247.2012.696532 |
| [44] |
Fang D, Xie J, Hu H, et al. Identification of MnOx species and Mn valence states in MnOx/TiO2 catalysts for low temperature SCR[J]. Chem Eng J, 2015, 271: 23–30.
DOI:10.1016/j.cej.2015.02.072 |
| [45] |
Marban G, Fuertes A B. Kinetics of the low-temperature selective catalytic reduction of NO with NH3 over activated fiber carbon composite-supported iron oxides[J]. Catal Lett, 2002, 84(1/2): 13–19.
DOI:10.1023/A:1021008113948 |
| [46] |
You X, Sheng Z, Yu D, et al. Influence of Mn/Ce ratio on the physicochemical properties and catalytic performance of graphene supported MnOx-CeO2 oxides for NH3-SCR at low temperature[J]. Appl Sur Sci, 2017, 423: 845–854.
DOI:10.1016/j.apsusc.2017.06.226 |
| [47] |
Wang X, Du L, Du M, et al. Catalytically active ceria-supported cobalt-manganese oxide nanocatalysts for oxidation of carbon monoxide[J]. Phy Chem Chem Phy, 2017, 19(22): 14533–14542.
DOI:10.1039/C7CP02004J |
| [48] |
Yang L, You X, Sheng Z, et al. The promoting effect of noble metal (Rh, Ru, Pt, Pd) doping on the performances of MnOx-CeO2/graphene catalysts for the selective catalytic reduction of NO with NH3 at low temperatures[J]. New J Chem, 2018, 42: 11673–17681.
DOI:10.1039/C8NJ01417E |
| [49] |
Deraz N M. Physicochemical, surface, and catalytic properties of pure and ceria-doped manganese/alumina catalysts[J]. Chin J Catal, 2008, 29(8): 687–695.
DOI:10.1016/S1872-2067(08)60066-2 |
| [50] |
Lou X, Liu P, Li J, et al. Effects of calcination temperature on Mn species and catalytic activities of Mn/ZSM-5 catalyst for selective catalytic reduction of NO with ammonia[J]. Appl Sur Sci, 2014, 307: 382–387.
DOI:10.1016/j.apsusc.2014.04.041 |
| [51] |
Masami I, Chigane M. Manganese oxide thin film preparation by potentiostatic electrolyses and electrochromism[J]. J Electro Soc, 2000, 147(6): 2246–2251.
DOI:10.1149/1.1393515 |
| [52] |
Liang Z, Sun Y, Fan C, et al. Kinetics for the oxygen evolution reaction and application of the Ti/SnO2+RuO2+MnO2 Electrode[J]. J Solution Chem, 2009, 38(9): 1119–1127.
DOI:10.1007/s10953-009-9432-1 |
| [53] |
Yao X, Zhao R, Chen L, et al. Selective catalytic reduction of NOx by NH3 over CeO2supported on TiO2:Comparison of anatase, brookite, and rutile[J]. Appl Catal B:Environ, 2017, 208: 82–93.
DOI:10.1016/j.apcatb.2017.02.060 |
| [54] |
Zhang X L, Shi B W, Wu X P, et al. A novel MnOx supported palygorskite SCR catalyst for lower temperature NO removal from flue gases[J]. Adv Mater Res, 2011, 356/360: 974–979.
DOI:10.4028/www.scientific.net/AMR.356-360.974 |
 2020, Vol. 34
2020, Vol. 34


