硫化氢(H2S)作为典型的硫化物气体, 是毒性最强、腐蚀性最高的废气之一, 主要起源于煤化工、生物质气化、天然气开采、原油加氢脱硫等各种工业过程[1-2]. 硫化氢作为一种恶臭和有毒物质, 已经对人类健康产生危害, 暴露于微量的硫化氢(约300 mg/m3)可使人失去意识. 此外, 在许多化学工程中生成H2S是不可避免的. 消除H2S气体引起了包括化学工程、材料和环境科学等各个科学领域的持续关注. 因此, 研究H2S在材料表面的吸附分解行为具有十分重要的意义.
MXene作为一种新的二维过渡金属碳化物、氮化物, 自2011年首次发现以来[3], 由于其独特的物理和化学特性, 引起了极大的兴趣和广泛的研究与应用[4-5]. 其化学通式为Mn+1XnTx(n = 1、2、3), M代表早期过渡金属, 如Ti、Zr、V、Mo等, X代表C或N元素, Tx为表面官能团, 通常为-OH, -O, -F和-Cl[6-10]. 然而, 最近的研究表明, 在高温处理下, -F被消除[11-12]、-OH被转化为-O[13], 因此, 含O的官能团可以在MXene表面稳定存在. 目前, MXene已广泛应用于气体传感[14]、生物传感[15]、催化[16-17]、储能[18-19]、氢生成[20]和水净化[21]等领域. 此外MXene材料由于具有高导电性、较大的比表面积、大量的表面基团、可控的层间距等优点, 被广泛应用于气体传感器[22-24]. 由于MXene材料的吸附能力良好, 近年来, 已经有部分学者研究了MXene材料对一些气体的吸附行为. Lee等[25]报道了Ti3C2Tx在挥发性有机化合物气体传感器中的首次应用, 用Ti3C2Tx传感器检测C2H6O、CH3OH、C3H6O和NH3, 其中NH3的响应最高, C3H6O的响应最低, 表明Ti3C2Tx对氨具有较高的敏感性. Wang等[26]通过实验制备出了大的比表面积和高容量的插层Ti3C2Tx, 大大提高了Ti3C2Tx MXene对CO2的吸附能力. Yu等[27]发现Ti2CO2可以作为NH3的高灵敏传感器. Zhang等[28]通过密度泛函理论计算发现室温下甲醛分子可以在Ti3C2O2上稳定吸附, 同时通过热处理可以将甲烷释放, 表明Ti3C2O2可以作为去除室内甲醛的理想材料. Choi等[29]报道了TiO2/Ti3C2传感器对NO2的灵敏度比原始的Ti3C2 MXene高出13.7倍, 表明TiO2/Ti3C2 MXene对NO2气体有比较强的吸附作用. Wang等[30]的研究发现, 在外加电场的作用下, Ti2CO2对H2S气体的吸附能力显著增强. 与碳化物MXene材料相比, 氮化物由于其较高的电子导电性, 过渡金属氮化物被认为有希望应用于等离子体、电化学电容器、光学和超导器件[31-33]. 由于氮化物MXene的一些良好特性, 不少科研人员研究了氮化物MXene材料对气体的吸附能力. Li等[34]采用第一性原理计算研究了Ti2N和Ti2NT2(T=O、F、OH)单分子层的储氢性能. 在对H2的吸附和解吸过程中, Ti2N和Ti2N(OH)2表现良好, 可以作为常温常压下良好的可逆储氢候选材料. Raul等[35]的研究表明, CO2在M2N(M = Ti, Zr, Hf, V, Nb, Ta, Cr, Mo及W)上的吸附能要比在M2C上的吸附能值显著增大, 这表明氮化物MXene比碳化物MXene更适合吸附CO2气体. 然而, 与碳化物MXene相比, 氮化物MXene的实验制备相对比较困难, 目前关于气体分子在氮化物MXene上吸附的研究还相对较少, H2S气体分子在氮化物MXene上的吸附行为尚未见报道.
研究表明, 通过过渡金属修饰可以明显提高二维材料对气体分子的吸附性能. Ma等[36]通过密度泛函理论对比研究了NO2、NH3、CO及O2等气体分子在原始石墨烯和Pd掺杂的石墨烯上的吸附行为. 结果表明, 经过Pd修饰的石墨烯对上述气体分子为化学吸附, 相较于原始石墨烯, 吸附能力更强. Hussain等[37]的研究发现, 单独的C3N4对CO2气体的吸附能力一般, 而经过渡金属原子(Sc、Ti、V、Cr、Mn、Fe、Co、Ni、Cu及Zn)修饰的C3N4对CO2的吸附能力则显著增强. Xu等[38]通过理论计算研究了原始C3N4和Mo嵌入的C3N4对HCN、SO2、H2S及NO等气体的吸附行为. 实验数据表明, 与原始C3N4相比, 以上气体分子在Mo嵌入C3N4上的吸附能更大, 电荷转移更多. 然而, 目前关于金属修饰MXene(特别是氮化物MXene)对气体分子吸附的研究却鲜有报道.
基于此, 采用第一性原理计算的方法分别研究了H2S分子在Ti2NO2 MXene和过渡金属Sc、V修饰的Ti2NO2 MXene表面的吸附、分解行为. 相关研究结果对设计高效的H2S气体吸附、分解材料, 减少H2S气体的危害具有一定的理论指导和现实意义.
1 计算方法所有计算采用Dmol3软件包进行. 交换相关泛函和基组分别采用GGA-PBE和DNP. 内核电子采用DSPPs方法处理. 范德华力的影响采用了基于Grimme的DFT-D方法进行校正. 最大位移和原子间作用力的收敛标准分别为5×10-4 nm和0.02 Ha·nm-1. 为了加速收敛, 采用0.005 Ha的拖尾值.
采用Complete LST/QST和NEB方法研究H2S在Ti2NO2表面的最优解离路径. 计算时采用3×3×1的Ti2NO2超晶胞. 为消除周期性层间相互作用的影响, 该晶胞的C轴尺寸设置为4 nm. 几何优化和态密度计算时, k点网格分别为3×3×1和5×5×1. 采用Hirshfeld电荷分布分析电荷转移情况.
金属原子在Ti2NO2表面的结合能(Eb)及H2S在Ti2NO2表面的吸附能(Eads)将通过以下公式计算:
| $ {{E_b} = {E_{metal/MXene}} - {E_{MXene}} - {E_{metal}}} $ | (1) |
| $ {{E_{ads}} = {E_{system}} - {E_{substrate}} - {E_{adsorbate}}} $ | (2) |
式(1)中的Emetal/MXene、EMXene和Emetal分别代表表面修饰了金属原子的Ti2NO2的总能量、单独Ti2NO2体系以及单独金属原子的总能量. 而式(2)中的Esystem、Esubstrate以及Eadsorbate则分别代表表面含金属原子的Ti2NO2吸附H2S后的总能量、表面含金属原子的Ti2NO2的能量以及H2S分子的能量.
用式(3)和式(4)来计算反应过程中的反应热(ΔE)和反应势垒(Ebar):
| $ {\Delta E = {E_{FS}} - {E_{IS}}} $ | (3) |
| $ {{E_{bar}} = {E_{TS}} - {E_{IS}}} $ | (4) |
其中的EIS、ETS及EFS分别代表体系的初始状态能量、过渡态能量以及终态能量.
2 结果与讨论 2.1 H2S分子在单层Ti2NO2上的吸附为了研究H2S分子在单层Ti2NO2上的吸附状态, 首先研究了H2S分子在单层Ti2NO2上最稳定的吸附构型. 考虑了H2S分子的5种不同的取向(见图 1): S-H键垂直于基底所在平面朝下(a); S-H键垂直于基底所在平面朝上(b); H2S分子所形成的平面与基底平行, 即3个原子都在同一水平面上(c); H2S分子所形成的平面垂直于基底所在平面呈“V”字型(d); H2S分子所形成的平面垂直于基底所在平面呈倒“V”字型(e). 同时考虑到H2S分子在Ti2NO2上不同吸附位点的吸附行为可能会有所不同, 还研究了H2S分子在Ti2NO2表面上不同的吸附位置的表现状态, 如图 2所示. 其中位点“1”位于单层Ti2NO2上3个相邻官能团的O原子中心, 即N原子正上方; 位点“2”位于O原子的正上方; 位点“3”则位于Ti原子的正上方. 表 1列出了H2S分子在单层Ti2NO2上的吸附能以及Hirshfeld电荷分布. 从表中可知, c取向的吸附能绝对值相较于其他取向最大, 这表明H2S分子更容易以平行的取向吸附于基底表面. 分析表 1的数据可以得出结论: 当硫化氢分子吸附在位点“3”时, H2S分子的吸附能结果最负, 为-0.349 eV, 这表明位点“3”是硫化氢气体分子的最佳吸附位置. 以上计算结果虽然表明硫化氢气体分子可以在Ti2NO2表面进行吸附, 但其吸附能数值均比较小, 说明H2S分子在单层Ti2NO2上的吸附为较弱的物理吸附. 这与H2S分子在二维层状AsP(-0.144 eV)[39]、硅烯(-0.19 eV)[40]、GeSe(-0.208 eV)[41]及锡烯(-0.471 eV)[42]上吸附强度接近.
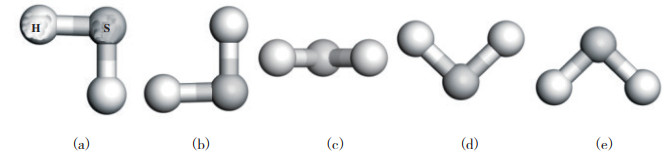
|
图 1 H2S分子的不同取向模型 Fig.1 Different orientations of H2S |
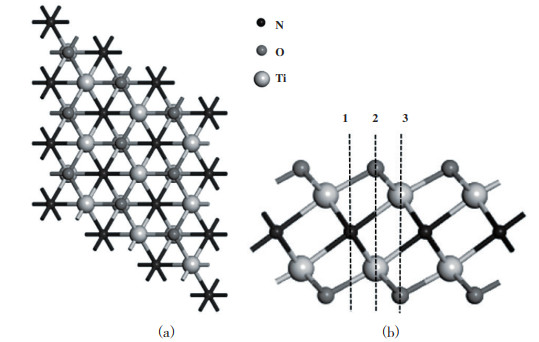
|
图 2 3×3×1Ti2NO2超胞俯视图(a)与侧视图(b) Fig.2 Top (a) and side (b) View of the Ti2NO2 with 3×3×1 supercell |
| 表 1 不同构型的H2S在单层Ti2NO2表面的吸附能(Eads)与电荷转移(CT) Table 1 Adsorption energy (Eads) and Charge transfer (CT) of H2S with different configurations on the Ti2NO2 monolayer |
众多文献研究结果表明, 通过金属原子修饰/掺杂可以显著提高材料的吸附性能[36-38, 43]. 由于H2S分子在单层Ti2NO2上属于弱的物理吸附, 因此我们考虑采用过渡金属Sc和V对Ti2NO2进行修饰, 进一步研究其对H2S分子的吸附行为. 首先研究了Sc和V在Ti2NO2表面的稳定性. 考虑了Sc和V在Ti2NO2表面的3个摆放位点, 如图 2所示.
为了研究过渡金属原子在基底Ti2NO2上的稳定性, 计算了金属Sc和V原子与Ti2NO2的结合能和Hirshfeld电荷分布, 同时将结合能分别与金属Sc和V的内聚能进行了对比(见表 2). 从表 2中可知: 1)与位点“2”和“3”相比, Sc和V在“1”位点的结合能数值最负, 分别为-6.948和-4.781 eV, 这表明位点“1”(N原子的正上方)是Sc和V原子最稳定的吸附位点. 2)Sc(V)吸附在位点“1”时, 其与基底Ti2NO2的结合能数值小于(大于)Sc(V)金属的内聚能, 这表明, 金属Sc原子可以在Ti2NO2 MXene表面稳定存在, 而金属V则存在着团聚的可能.
| 表 2 Sc(V)与Ti2NO2之间的结合能(eV)、Hirshfeld电荷分布(|e|))以及原子的内聚能 Table 2 The Binding energie (eV), Hirshfeld charge (|e|) from Sc(V) to Ti2NO2 and the Cohesive energy of the atom |
虽然热力学的研究结果表明金属V原子在Ti2NO2 MXene表面可能会发生团聚, 但原子是否在Ti2NO2 MXene发生团聚还要考虑动力学的影响. 因此, 采用过渡态搜索的方法研究了金属原子在Ti2NO2表面上的扩散过程. 计算的结果见图 3. Sc原子从最稳定的吸附位点“1”(图 3中的IS状态)扩散到距离最近的另一个位点“1”(图 3中的FS状态)时, 需要先途径临近的吸附位点“3”(图 3中MS状态). V原子的扩散路径与Sc类似. 从图中可以看出两个原子的扩散都是一个吸热过程, 原子扩散时需要跨越的能垒分别高达1.03 eV(Sc原子)和0.93 eV(V原子), 这表明从动力学角度来看, Sc和V原子很难在Ti2NO2表面发生扩散, 形成团簇. 综上所述, 可以认为, Sc和V原子能够在Ti2NO2 MXene表面稳定存在.
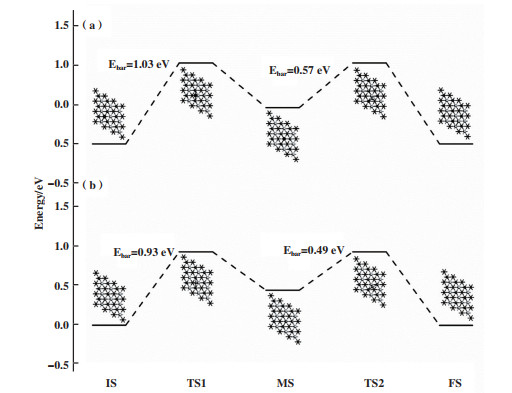
|
图 3 Sc(a)和V(b)原子在Ti2NO2表面上扩散能量路径图 Fig.3 The energy diffusion pathway diagram of Sc(a) and V(b) on Ti2NO2 surface |
为了更为详细地了解Sc原子和V原子与单层Ti2NO2的相互作用关系, 进行了PDOS分析. 图 4(a)是Ti2NO2 MXene表面上与Sc原子成键的3个氧原子的O-2p轨道和Sc原子的3d轨道PDOS图, 从图中可以明显地看到, Sc-3d轨道和O-2p轨道在-6、-0.5和0.7 eV左右的位置有明显的重叠峰, 这表明Ti2NO2表面与过渡金属Sc原子之间的相互作用较强, Sc原子能稳定存在于Ti2NO2表面上. 以同样的方式分析V-3d轨道与O-2p轨道可知, 其在-5、-1和0.5 eV附近V-3d轨道与O-2p轨道有明显的重叠峰(见图 4b). d带中心理论表明, 金属原子的d轨道越靠近费米能级. 则金属原子与气体分子之间的相互作用越强, 反之, 距离费米能级越远, 则它们之间的相互作用就越弱. 由于V原子的3d轨道的主峰更接近费米能级, 因此, V/Ti2NO2与H2S分子之间的相互作用可能会较强.
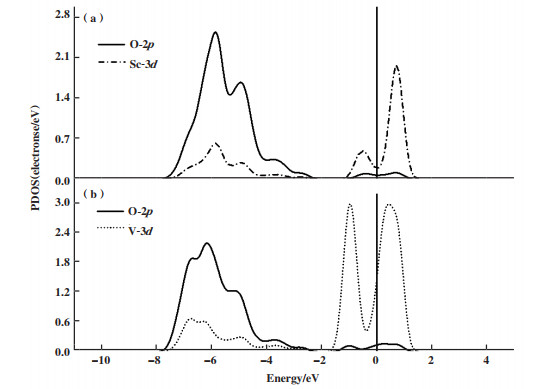
|
图 4 Sc(a)和V(b)原子与Ti2NO2之间相互作用的O(2p), Sc(3d), V(3d)部分PDOS图 Fig.4 The PDOS plot of O(2p), Sc(3d), V(3d) of the interaction between Sc(a) and V(b) with Ti2NO2 |
为了研究H2S在Sc/Ti2NO2和V/Ti2NO2上的吸附行为, H2S的初始取向与其在原始Ti2NO2上的吸附取向一致(见图 1), 吸附位置为Sc和V原子的上方. 表 3列出了不同构型的H2S分子在Sc/Ti2NO2和V/Ti2NO2上的吸附能(Eads)与电荷转移(CT)数值. 可以看出, 无论是Sc/Ti2NO2还是V/Ti2NO2, 其对不同构型H2S分子的吸附能均为负值, 这表明硫化氢气体分子的这5种吸附构型和3个吸附位点在基底表面均能存在. 对比单层Ti2NO2(无金属原子修饰)与H2S分子之间的相互作用可以看出, 经Sc和V修饰的Ti2NO2对H2S分子的吸附能远高于单层Ti2NO2对H2S的吸附能(-0.3 eV左右). 这进一步表明, Sc和V的修饰明显提高了Ti2NO2对H2S的吸附能力. 此外还可以发现, c构型的H2S吸附在基底时的吸附能是最负的, 即H2S分子的3个原子在同一水平面时, 最容易吸附. 更值得关注的是, c取向的H2S分子吸附在Sc/Ti2NO2和V/Ti2NO2表面时, 进行结构优化后H2S分子可以直接解离成HS*和H*, 其中HS*与Sc或V结合, H*与基底表面的氧官能团结合, 形成OH基团.
| 表 3 不同构型的H2S在基底上的吸附能(Eads)与电荷转移(CT) Table 3 Adsorption energy (Eads) and Charge transfer (CT) of H2S with different configuration on substrates |
为了研究H2S分子在Sc/Ti2NO2和V/Ti2NO2表面上的解离情况, 采用过渡态搜索的方法来定位H2S分子在Sc/Ti2NO2和V/Ti2NO2表面上解离为S和H2的最小能量路径, 并绘制了相关的势能分布图(如图 5). H2S分子解离路径中每个状态的结构图见图 6. 从图 5和图 6中可知, H2S分子在Sc(V)修饰的Ti2NO2基底表面上自动解离为HS*和H*并释放出-1.87 eV(-1.92 eV)的热量, 进入IS状态. 而后在Sc(V)/Ti2NO2表面上, HS*中的H-S键断裂, 其中的H原子逐渐与之前分离出来的H*相结合形成H2, S原子则被过渡金属原子捕获. 从IS到FS的过程中, H2S分子在Sc/Ti2NO2和V/Ti2NO2表面上进一步解离需要跨越的能垒分别为2.07和1.69 eV. 同时还发现, H2S分子在Sc/Ti2NO2和表面分解时吸收的能量为1.34 eV, 而在V/Ti2NO2表面时吸收的能量仅为0.26 eV. 因此, H2S分子在V修饰的Ti2NO2表面分解要比在Sc/Ti2NO2上更容易. 此外, H2S气体在V/Ti2NO2表面分解所需的能量(1.69 eV)远低于文献报道的Fe/Graphene(1.95 eV)[43]体系. 综上所述, V/Ti2NO2分解H2S的能力较高, 有望作为分解H2S的材料.
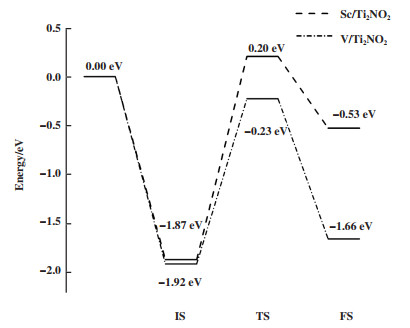
|
图 5 H2S分子在Sc/Ti2NO2和V/Ti2NO2表面解离的能量变化图 Fig.5 Energy changes of H2S molecules dissociated on the surface of Sc/Ti2NO2 and V/Ti2NO2 |
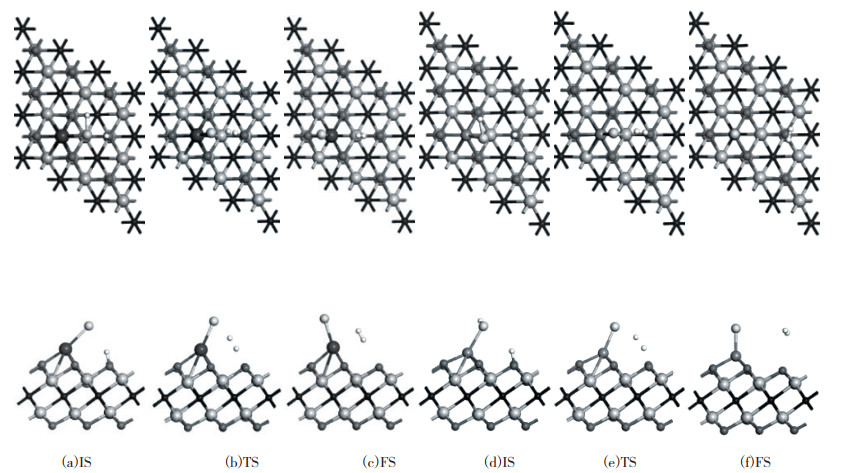
|
图 6 Sc/Ti2NO2(a-c)和V/Ti2NO2(d-f)表面H2S分子解离的反应路径示意图 Fig.6 Reaction pathways of the views of top and side of H2S dissociation on Sc/Ti2NO2 (a-c) and V/Ti2NO2 (d-f) |
| 表 4 H2S分子在Sc(V)/Ti2NO2 MXene表面上IS状态时的吸附能(eV), Sc(V)与硫原子之间的键长(nm)以及氢原子和硫原子之间的键长(nm) Table 4 The Adsorption energies (Eads), the Bond length between the Sc(V) and S atom and the Bond length of the H-S of H2S molecule in IS state on Sc(V)/Ti2NO2 MXene surface |
为更为详细地了解Sc(V)原子与H-S键之间的相互作用, 我们研究了H2S分子在Sc/Ti2NO2和V/Ti2NO2的自动解离为H*和H-S键时的PDOS图, 如图 7所示. 从图 7(a)中可以看出: H2S分子中的H-S键的成键轨道主要来源于H-1s和S-3p轨道的相互杂化作用. 对比研究各原子轨道在H2S分子、HS*吸附在Sc/Ti2NO2和V/Ti2NO2的PDOS图(图 7), 从图中可以看出, H-1s轨道在Sc原子的作用下, 相比于气体分子向左偏移了约0.5 eV, 在V原子的作用下相比于H2S分子中的H-1s轨道向左偏移了约0.7 eV. 在V原子的作用下, V-3d轨道与S-3p轨道在-3、-2.2、-1以及0.5 eV附近有明显重叠峰, 而在Sc原子作用下, Sc-3d轨道仅在-2.5 eV附近与S-3p轨道有一个重叠峰. 此外, 在费米能级附近, 在金属峰的作用下, S-3p轨道也被激活, 并且V原子的金属峰相较于Sc的金属峰来说, 更加靠近费米能级. 因此, 相较于Sc/Ti2NO2, V/Ti2NO2与H2S中的S原子相互作用更强, V/Ti2NO2更有利于H-S键的断裂, 从而有利于H2S分子解离过程的进行.
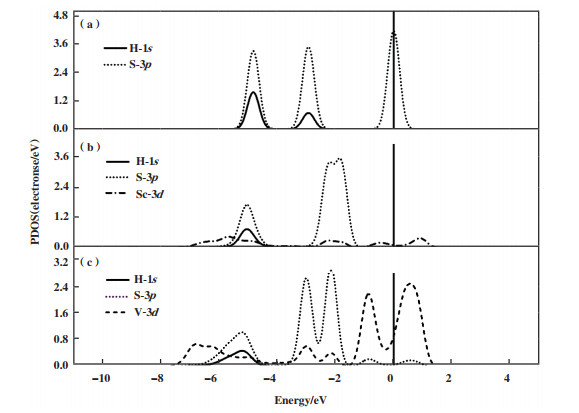
|
图 7 H2S分子(a)中H(1s)、S(3p)以及Sc/Ti2NO2(b)和V/Ti2NO2(c)表面吸附H2S分子后Sc(3d)和V(3d)的PDOS图 Fig.7 The PDOS plots of H(1s), S(3p) of H2S molecules (a) and the PDOS plot of Sc(3d) and V(3d) of the interaction between H2S adsorbed on Sc/Ti2NO2 (b) and V/Ti2NO2 (c) |
采用第一性原理计算的方法研究H2S气体分子在Sc/Ti2NO2和V/Ti2NO2表面的吸附和解离行为. 主要研究结论如下:
1)H2S气体在Ti2NO2表面的吸附属于物理吸附, Ti2NO2无法有效吸附H2S气体;
2)Sc和V可以在Ti2NO2表面上稳定存在, 不易发生团聚, 其最稳定吸附位点为N原子上方;
3)Sc、V修饰可以显著提高Ti2NO2对H2S的吸附性能. H2S分子在Sc/Ti2NO2和V/Ti2NO2表面直接解离为HS*和H*, 而后HS*中的H原子再与上步分解出的H*进一步结合形成H2, S原子则与过渡金属成键;
4)HS*在V/Ti2NO2表面解离的势垒为1.69 eV, 低于在Sc/Ti2NO2表面的2.08 eV, 表明V/Ti2NO2有望成为吸附、分解H2S气体的理想候选材料.
| [1] |
Shen L J, Cao Y N, Du Z J, et al. Illuminate the active sites of gamma-FeOOH for low-temperature desulfurization[J]. Appl Surf Sci, 2017, 425: 212–219.
DOI:10.1016/j.apsusc.2017.06.295 |
| [2] |
a. Zhang X, Tang Y Y, Qu S Q, et al. H2S-selective catalytic oxidation: Catalysts and processes[J]. ACS Catal, 2015, 5(2): 1053-1067. b. Sun Hou-xiang(孙厚祥), Zhang Hua-bing(张化冰). Research on properties of Sn and Si doped AlPO4-5 molecular sieve and its hydrodesulfurization reaction(Sn和Si掺杂AlPO4-5分子筛及其加氢脱硫反应性能研究)[J]. J Mol Catal(China)(分子催化), 2020, 34(5): 446-453. c. Zhang Liang-liang(张亮亮), Wang Lei(汪镭), Chen Xiao(陈霄), et al. Synthesis of Co2Si@C and its catalytic performance in the hydrodesulphurization of dibenzothiophene(Co2Si@C催化剂的合成及其加氢脱硫性能)[J]. J Mol Catal(China)(分子催化), 2020, 34(2): 116-124. |
| [3] |
Naguib M, Kurtoglu M, Presser V, et al. Two-Dimensional nanocrystals produced by exfoliation of Ti3AlC2[J]. Adv Mater, 2011, 23: 4248–4253.
DOI:10.1002/adma.201102306 |
| [4] |
Verger L, Natu V, Carey M, et al. MXenes: An introduction of their synthesis, select properties, and applications[J]. Trends Chem, 2019, 1(7): 656–669.
DOI:10.1016/j.trechm.2019.04.006 |
| [5] |
Alhabeb M, Maleski K, Anasori B, et al. Guidelines for synthesis and processing of two-dimensional titanium carbide (Ti3C2TxMXene)[J]. Chem Mater, 2017, 29(18): 7633–7644.
DOI:10.1021/acs.chemmater.7b02847 |
| [6] |
Srimuk P, Kaasik F, Krüner B, et al. MXene as a novel intercalation-type pseudocapacitive cathode and anode for capacitive deionization[J]. J Mater Chem A, 2016, 4: 18265–18271.
DOI:10.1039/C6TA07833H |
| [7] |
Zhao X, Zha X J, Tang L S, et al. Self-assembled core-shell polydopamine@MXene with synergistic solar absorption capability for highly efficient solar-to-vapor generation[J]. Nano Res, 2020, 13(1): 255–264.
DOI:10.1007/s12274-019-2608-0 |
| [8] |
Bian R J, Lin R Z, Wang G L, et al. 3D assembly of Ti3C2-MXene directed by water/oil interfaces[J]. Nanoscale, 2018, 10(8): 3621–3625.
DOI:10.1039/C7NR07346A |
| [9] |
Hu M M, Cheng R F, Li Z J, et al. Interlayer engineering of Ti3C2TxMXenes towards high capacitance supercapacitors[J]. Nanoscale, 2020, 12(2): 763–771.
DOI:10.1039/C9NR08960H |
| [10] |
Balakrishnan K, Mugilan N, Jun Y, et al. Construction of heterogeneous 2D layered MoS2/MXenenanohybrid anode material via interstratification process and its synergetic effect for asymmetric supercapacitors[J]. Appl Surf Sci, 2020, 534: 147644.
DOI:10.1016/j.apsusc.2020.147644 |
| [11] |
Naguib M, Kurtoglu M, Presser V, et al. Two-dimensional nanocrystals produced by exfoliation of Ti3AlC2[J]. Adv Mater, 2011, 23(37): 4248–4253.
DOI:10.1002/adma.201102306 |
| [12] |
Zha X H, Luo K, Li Q W, et al. Role of the surface effect on the structural, electronic and mechanical properties of the carbide MXenes[J]. Europhys Lett, 2015, 111(2): 26007.
DOI:10.1209/0295-5075/111/26007 |
| [13] |
Xie Y, Naguib M, Mochalin V N, et al. Role of surface structure on Li-ion energy storage capacity of two-dimensional transition-metal carbides[J]. J Am Chem Soc, 2014, 136(17): 6385–6394.
DOI:10.1021/ja501520b |
| [14] |
Chen J, Chen K, Tong D Y, et al. CO2 and temperature dual responsive "Smart" MXene phases[J]. Chem Commun, 2015, 51(2): 314–317.
DOI:10.1039/C4CC07220K |
| [15] |
Xu B Z, Zhu M S, Zhang W C, et al. Ultrathin MXene-micropattern-based field-effect transistor for probing neural activity[J]. Adv Mater, 2016, 28: 3333–3339.
DOI:10.1002/adma.201504657 |
| [16] |
Li N, Chen X Z, Ong W J, et al. Understanding of electrochemical mechanisms for CO2 capture and conversion into hydrocarbon fuels in transition-metal carbides (MXenes)[J]. ACS Nano, 2017, 11(11): 10825–10833.
DOI:10.1021/acsnano.7b03738 |
| [17] |
Azofra L M, Li N, MacFarlane D R, et al. Promising prospects for 2D d2-d4 M3C2 transition metal carbides (MXenes) in N2 capture and conversion into ammonia[J]. Energy Environ Sci, 2016, 9(8): 2545–2549.
DOI:10.1039/C6EE01800A |
| [18] |
Ren C E, Zhao M Q, Makaryan T, et al. Porous two-dimensional transition metal carbide (MXene) flakes for high-performance Li-ion storage[J]. ChemElectroChem, 2016, 3(5): 689–693.
DOI:10.1002/celc.201600059 |
| [19] |
Anasori B, Lukatskaya M R, Gogotsi Y. 2D metal carbides and nitrides (MXenes) for energy storage[J]. Nat Rev Mater, 2017, 2(2): 16098.
DOI:10.1038/natrevmats.2016.98 |
| [20] |
She Z W, Fredrickson K D, Anasori B, et al. Two-dimensional molybdenum carbide (MXene) as an efficient electrocatalyst for hydrogen evolution[J]. ACS Energy Lett, 2016, 1(3): 589–594.
DOI:10.1021/acsenergylett.6b00247 |
| [21] |
Zhang Q R, Teng J, Zou G D, et al. Efficient phosphate sequestration for water purification by unique sandwich-like MXene/magnetic iron oxide nanocomposites[J]. Nanoscale, 2016, 8(13): 7085–7093.
DOI:10.1039/C5NR09303A |
| [22] |
Zhang Y J, Wang L, Zhang N N, et al. Adsorptive environmental applications of MXene nanomaterials: A review[J]. RSC Adv, 2018, 8(36): 19895–19905.
DOI:10.1039/C8RA03077D |
| [23] |
Kim S J, Koh H J, Ren C E, et al. Metallic Ti3C2Tx MXene gas sensors with ultrahigh signal-to-noise ratio[J]. ACS Nano, 2018, 12(2): 986–993.
DOI:10.1021/acsnano.7b07460 |
| [24] |
Yang Z J, Liu A, Wang C L, et al. Improvement of gas and humidity sensing properties of organ-like MXene by alkaline treatment[J]. ACS Sens, 2019, 4(5): 1261–1269.
DOI:10.1021/acssensors.9b00127 |
| [25] |
Lee E, Mohammadi A V, Prorok B C, et al. Room temperature gas sensing of two-dimensional titanium carbide (MXene)[J]. ACS Appl Mater Inter, 2017, 9(42): 37184–37190.
DOI:10.1021/acsami.7b11055 |
| [26] |
Wang B X, Zhou A G, Liu F F, et al. Carbon dioxide adsorption of two-dimensional carbide MXenes[J]. J Adv Ceram, 2018, 7(3): 237–245.
DOI:10.1007/s40145-018-0275-3 |
| [27] |
Yu X F, Li Y C, Cheng J B, et al. Monolayer Ti2CO2: A promising candidate for NH3 sensor or capturer with high sensitivity and selectivity[J]. ACS Appl Mater Inter, 2015, 7(24): 13707–13713.
DOI:10.1021/acsami.5b03737 |
| [28] |
Zhang Y J, Zhou Z J, Lan J H, et al. Prediction of Ti3C2O2 MXene as an effective capturer of formaldehyde[J]. Appl Surf Sci, 2019, 469: 770–774.
DOI:10.1016/j.apsusc.2018.11.018 |
| [29] |
Choi J, Kim Y J, Cho S Y, et al. In situ formation of multiple schottky barriers in a Ti3C2 MXene film and its application in highly sensitive gas sensors[J]. Adv Funct Mater, 2020, 30(40): 2003998.
DOI:10.1002/adfm.202003998 |
| [30] |
Wang Yi-ran(王怡然), Wang Li-fang(王丽芳), Ma Shu-hong(马淑红), et al. Adsorption of molecular H2S on monolayer Ti2CO2: A first-principles study(二维Ti2CO2单层吸附H2S分子的第一性原理研究)[J]. J Atom Mol Phys(原子与分子物理学报), 2019, 36(4): 568–573.
DOI:10.3969/j.issn.1000-0364.2019.04.007 |
| [31] |
Morel A, Borjon-Piron Y, Porto R L, et al. Suitable conditions for the use of vanadium nitride as an electrode for electrochemical capacitor[J]. J Electro Chem Soc, 2016, 163(6): 1077–1082.
DOI:10.1149/2.1221606jes |
| [32] |
Wang D S, Gao Y, Liu Y H, et al. First-principles calculations of Ti2N and Ti2NT2(T=O, F, OH) monolayers as potential anode materials for lithium-ion batteries and beyond[J]. J Phys Chem C, 2017, 121: 13025–13034.
DOI:10.1021/acs.jpcc.7b03057 |
| [33] |
Urbankowski P, Anasori B, Makaryan T, et al. Synthesis of two-dimensional titanium nitride Ti4N3(MXene)[J]. Nanoscale, 2016, 8: 11385–11391.
DOI:10.1039/C6NR02253G |
| [34] |
Li Y M, Guo Y L, Chen W G, et al. Reversible hydrogen storage behaviors of Ti2N MXenes predicted by first-principles calculations[J]. J Mater Sci, 2019, 54: 493–505.
DOI:10.1007/s10853-018-2854-7 |
| [35] |
Raul M S, Ángel M G, Francesc V, et al. Two-dimensional nitrides as highly efficient potential candidates for CO2 capture and activation[J]. Phys ChemChem Phys, 2018, 20(25): 17117–17124.
DOI:10.1039/C8CP02746C |
| [36] |
Ma L, Zhang J M, Xu K W, et al. A first-principles study on gas sensing properties of graphene and Pd-doped graphene[J]. Appl Surf Sci, 2015, 343: 121–127.
DOI:10.1016/j.apsusc.2015.03.068 |
| [37] |
Hussain T, Vovusha H, Kaewmaraya T, et al. Graphitic carbon nitride nano sheets functionalized with selected transition metal dopants: An efficient way to store CO2[J]. Nanotechnology, 2018, 29(41): 415502.
DOI:10.1088/1361-6528/aad2ed |
| [38] |
Xu Y, Jiang S X, Yin W J, et al. Adsorption behaviors of HCN, SO2, H2S and NO molecules on graphitic carbon nitride with Mo atom decoration[J]. Appl Surf Sci, 2020, 501: 144199.
DOI:10.1016/j.apsusc.2019.144199 |
| [39] |
Zhang Y Y, Tan C J, Yang Q, et al. Arsenic phosphorus monolayer: A promising candidate for H2S sensor and NO degradation with high sensitivity and selectivity[J]. IEEE Electron Device Lett, 2017, 38(9): 1321–1324.
DOI:10.1109/LED.2017.2731367 |
| [40] |
Hussain T, Kaewmaraya T, Chakraborty S, et al. Defect and substitution induced silicene sensor to probe toxic gases[J]. J Phys Chem C, 2016, 120(40): 25256–25262.
|
| [41] |
Liu L, Yang Q, Ye H, et al. Adsorption of gases on monolayer GeSe: A first principle study[R]. Procedia: 201718th International Conference on Thermal, Mechanical and Multi-Physics Simulation and Experiments in Microelectronics and Microsystems (EuroSimE), 2017.
|
| [42] |
Chen X P, Tan C J, Yang Q, et al. Ab initio study of the adsorption of small molecules on stanine[J]. J Phys Chem C, 2016, 120(26): 13987–13994.
DOI:10.1021/acs.jpcc.6b04481 |
| [43] |
Zhang H, Luo X, Song H, et al. DFT study of adsorption and dissociation behavior of H2S on Fe-doped graphene[J]. Appl Surf Sci, 2014, 317: 511–516.
DOI:10.1016/j.apsusc.2014.08.141 |
 2021, Vol. 35
2021, Vol. 35


