2. 清华大学 烟气多污染物控制技术与装备国家工程实验室, 北京 100084;
3. 昆明理工大学 环境科学与工程学院, 云南 昆明 650500
2. National Engineering Laboratory for Flue Gas Pollutants Control Technology ang Equipment, Tsinghua University, Beijing 100084, China;
3. Faculty of Environmental Science and Engineering, Kunming University of Science and Technology, Kunming 650500, China
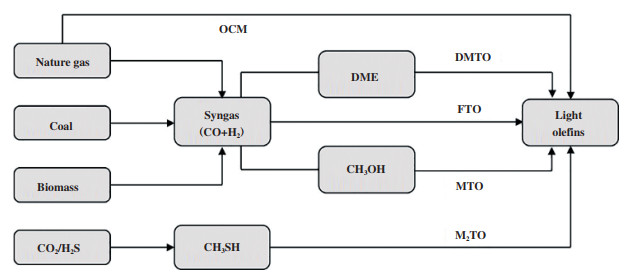
乙烯等低碳烯烃是化学工业中重要的基础化工原料, 传统工业中制备低碳烯烃主要依靠轻烃水蒸汽裂解[1]. 近年来, 以煤、天然气和生物质等资源为原料代替传统石油经甲醇制乙烯的工艺路线备受关注[2]. 其中, 以天然气为原料制乙烯的工艺路线具有良好的市场前景[3], 这是因为天然气来源广泛并且清洁环保. 然而, 目前世界范围内开采出的天然气常含有较高浓度的CO2和H2S等酸性气体[4-6](据统计, 世界范围内天然气中H2S的保有量约为9.911×1011 m3, CO2的含有量达4×1012 m3; 我国国内可开采气田中1/3以上伴随有较高浓度的CO2和H2S). 这些酸性气体的存在不仅会腐蚀管道和反应器等设备, 还会造成后续天然气利用过程中相关反应催化剂中毒[7-8]; 直接排放的话更会带来严重的环境污染问题[9]. 此外, 作为一个CO2排放大国, 2007~2012年间我国对全球碳排放增长的贡献率占50%, 我国面临巨大的碳减排压力[10]. 与此同时, 石油和化工等过程会产生大量H2S废气, 严控硫污染和实现硫减排已成为当前我国大气污染防控中一个重要课题.
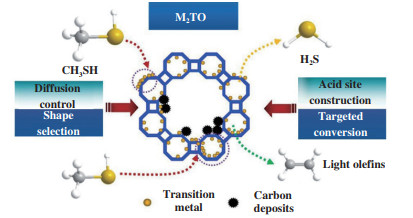
目前应用于天然气化工等过程的常规脱碳工艺主要是采用溶剂吸收或固体吸附剂吸附[11], 或分离富集后再进行封存以及化学转化[12-13], 其中以CO2为原料催化加氢制甲醇及下游烯烃产品近年来受到广泛关注[14-15]. 使用较多的脱硫技术主要是对H2S进行分离后, 采用克劳斯工艺使其选择性催化氧化生成单质硫产品[16-17]. 上述过程均为单一的脱碳或脱硫工艺, 未能实现二者的协同资源化利用. 近年来, CO2、H2S和H2直接合成CH3SH的技术发展为CH3SH的原料来源及后续资源化利用提供了前提保障[18-19], 如反应1所示. 事实上, CH3SH与CH3OH结构类似[20], 分别以其为原料制备低碳烯烃的反应具有相似性, 如反应2、3所示. 这为甲硫醇资源化催化制烯烃的实现提供了理论依据. 在此背景下, 以CO2和H2S出发合成CH3SH, 再经由CH3SH中间体资源化催化转化制低碳烯烃(M2TO)的工艺技术开发, 将会是一条绿色和环保型非石油路径制备低碳烯烃工艺路径, 具有重要的研究意义和应用前景, 如图 1所示.
| $ {{\rm{C}}{{\rm{O}}_{\rm{2}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{S + 3}}{{\rm{H}}_{\rm{2}}} \to {\rm{C}}{{\rm{H}}_{\rm{3}}}{\rm{SH + 2}}{{\rm{H}}_{\rm{2}}}{\rm{O}}} $ | (1) |
| $ {{\rm{MTO}}:{\rm{2C}}{{\rm{H}}_{\rm{3}}}{\rm{OH}} \to {{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{4}}}{\rm{ + 2}}{{\rm{H}}_{\rm{2}}}{\rm{O}}} $ | (2) |
| $ {{{\rm{M}}_{\rm{2}}}{\rm{TO}}:{\rm{2C}}{{\rm{H}}_{\rm{3}}}{\rm{SH}} \to {{\rm{C}}_{\rm{2}}}{{\rm{H}}_{\rm{4}}}{\rm{ + 2}}{{\rm{H}}_{\rm{2}}}{\rm{S}}} $ | (3) |
|
图 1 制备低碳烯烃的非石油路径 Fig.1 Non-petroleum route to light olefins |
然而, 当下M2TO反应由于烯烃选择性较差和反应温度过高等不足还未能完全解决, 这严重阻碍了该工艺技术开发及应用. 因此, 我们介绍了M2TO反应体系的发展历程及研究现状; 随后从反应机理层面出发对比分析了MTO和M2TO的差异; 重点探讨了反应温度、酸位密度、分子筛结构和甲硫醇甲基化能力对M2TO反应的影响并提出一些解决方法. 希望能够构筑高性能催化剂(高转化活性和烯烃选择性)实现M2TO反应, 并进一步探索M2TO反应机理, 促进M2TO工艺技术开发及工业化应用.
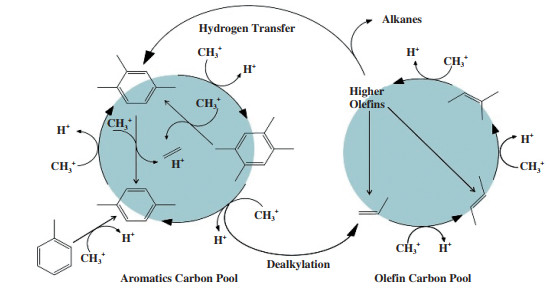
1 M2TO反应的发展历程早在20世纪70年代, Butter等[21]用H-ZSM-5沸石分子筛(硅铝比为12)对甲硫醇进行了催化转化研究; 在258 ℃的反应温度下, 其转化率达到了96.1%, 主产物为甲烷. Chang和Silvestri[22]也进行了类似的研究, 他们同样用H-ZSM-5作为催化剂, 研究了在482 ℃温度下甲硫醇的催化转化反应. 在该反应过程中, 甲硫醇首先转化为二甲基硫醚(DMS)继而转化为碳氢化合物(乙烯和丙烯占7%)和H2S, 这说明DMS可能是该反应的中间体. 随后, Mashkina和Charles等[23-24]又相继报道了甲硫醇在酸性催化剂上催化分解研究, 其主产物仍是以甲烷为主的碳氢化合物; 但在较低温度下发现了DMS产物, 这也再一次证明DMS是此类反应的中间体. 近年来, TOTAL把甲硫醇催化转化为碳氢化合物这一类的反应定义为M2TH反应, 他们重点研究了甲硫醇在不同的酸性分子筛上的催化转化反应[25-27], 发现不同温度下甲硫醇转化的产物不同, 300~400 ℃之间反应产物是DMS和H2S; 超过400 ℃产物转变为C1-C3的烷烃(甲烷、乙烷、丙烷)、BTX(苯、甲苯、二甲苯)、焦炭和H2S, 如图 2所示. 在此基础上, Baltrusaitis等[6]认为M2TH反应可以通过反应条件和催化体系的改变调控为富烯烃工艺(methyl mercaptan to olefins, M2TO)和富汽油工艺(methyl mercaptan to gasoline, M2TG), 从而生成更高附加值的化学品. 后来, 郝湖生等[28]以过渡金属Ce改性H-ZSM-5; He等[29-30]用稀土金属(Nd、Er、Y、Sm)改性H-ZSM-5, 随后将上述改性后的催化剂分别用于甲硫醇催化裂解反应, 主产物为甲烷和H2S. 实验结果表明经稀土金属改性后的催化剂其催化活性和稳定性显著提高, 这是因为金属杂原子的引入导致催化剂的还原性提高和酸性位密度降低, 促进了甲硫醇催化分解.
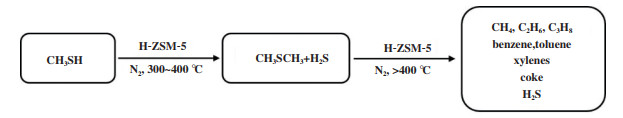
|
图 2 HZSM-5上甲硫醇催化转化为碳氢化合物的反应途径[27] Fig.2 Pathway of the catalytic transformation of CH3SH into hydrocarbons on HZSM-5[27] |
通过国内外相关学者对甲硫醇催化转化反应体系的研究发现, 如图 3所示, M2TH反应的主产物是以甲烷为主的低碳烷烃、芳烃和硫化氢, 基本没有烯烃的存在. 这让人非常困惑, 因为烯烃通常是形成芳烃的前驱体[31]. 同时, 这也导致了M2TH反应很难通过反应条件和催化体系的改变调控为M2TO反应. 为了解决这个问题, 促进M2TO工艺开发与应用. 下文中我们从反应机理层面出发分析了MTO与M2TO可能存在的差异, 探讨了M2TO较难实现的原因并提出一些解决方法
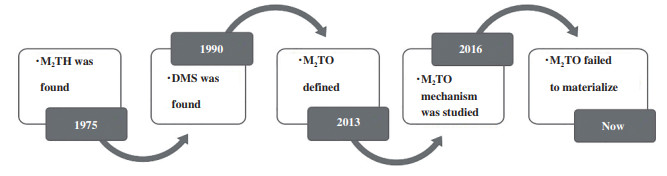
|
图 3 M2TO反应的发展历程 Fig.3 The development history of M2TO reaction |
相比于M2TO反应, MTO反应在催化剂体系、动力学关系和反应机理等方面被人们广泛研究, 现已实现了工业化生产. 当下, MTO反应机制分为“直接机制”以及“间接机制”. 间接机理是当下研究者广泛接受的MTO稳态反应阶段的催化理论, 但它很难解释第一个C-C键(初始烯烃)是怎么从甲醇或者二甲醚中形成[32-33]. 因此, 一些直接机理被提出来解释初始C-C键是怎么形成的.
2.1 直接机理差异第一个C-C键如何形成一直是MTO工艺中的重要研究方向. 在探索第一个C-C键形成机制的过程中, 已有二十多种直接机理被提出, 如: 卡宾机理[22, 34]、氧鎓叶立德机理[35]、甲基碳正离子机理[36]、甲烷-甲醛机理[37]等. 由于这些机理所涉及到的反应中间体很难监测, 导致直接机理自提出以来一直缺乏实验证据. 近年来, 大连化物所刘中民院士团队首次动态观察到MTO反应中C1物种的初始活化以及转化, 为第一个C-C键生成的直接机理提供了实验证据. 他们在反应初始阶段实时监测反应物和产物的组成及变化, 随后对催化剂进行液氮猝冷, 并对该催化剂进行固体核磁表征, 发现催化剂表面存在C1吸附物种(甲醇和二甲醚)和C1活性物种(表面甲氧基和三甲基氧鎓离子); 随后, 又进一步对MTO反应进行了原位固体核磁研究, 捕捉到二甲醚和C1活性物种反应生成的亚甲氧基物种[38](三甲基氧鎓内鎓盐、乙基二甲基氧鎓离子). 在此基础上, 他们提出了第一个C-C键的生成路径: 甲醇或二甲醚与表面甲氧基或三甲基氧鎓离子协助活化转化生成第一个C-C键. 该工作也进一步证明了MTO反应中第一个C-C键通过直接机理生成, 而反应稳定阶段则是通过间接机理生成乙烯、丙烯等产物.
很少有人研究甲硫醇制烯烃(M2TO)反应机理, 最具代表性的是Baltrusaitis等[20]在沸石分子筛B酸位点上对甲硫醇偶联制乙烯反应中初始C-C键的生成过程所做的密度泛函理论计算研究(DFT), 并在相同条件下与甲醇制乙烯反应进行了比较. 他们提出了游离机制和结合机制的反应路径, 如图 4所示. 游离机制的反应关键中间体是表面甲氧基(-OCH3)和氧鎓内鎓盐; 结合机制的关键中间体是二甲醚(DME)、乙醇(EtOH)、三甲基氧鎓离子(TMO)、甲乙醚(EtOMe)及乙基二甲基氧鎓离子(EDMO). 在甲硫醇偶联制乙烯反应过程中, 二甲基硫醚(DMS)和三甲基硫鎓离子(TMS)被证明是热力学上稳定存在的物种, 并且TMS复合物比甲醇偶联制烯烃过程中的TMO复合物更稳定, 这是因为硫的亲核性较高, 与氧相比, 其电负性较低. 在图 4给出所有可能的反应路径中, M2TO反应的各步活化能垒都比MTO反应的高. 这说明, 相比于MTO反应, M2TO反应要在高温、高压、或高酸性位密度的反应条件下, 克服其较高的热力学平衡限制才能发生.
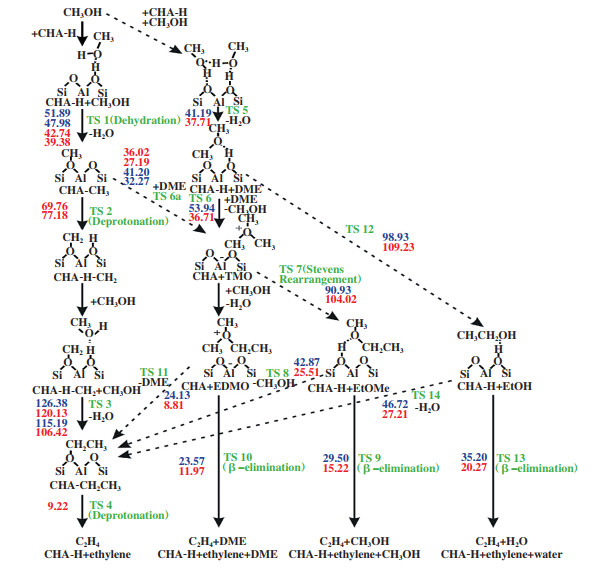
|
图 4 甲醇和甲硫醇转化为乙烯的反应机理 Fig.4 Reaction mechanism of catalytic conversion of methanol and methyl mercaptan to ethylene (蓝色值表示CH3SH途径, 而红色值表示CH3OH途径[20]) (blue values are for CH3SH pathways whereas red ones are for CH3OH pathways[20]) |
间接机理又称烃池机理, 它对反应稳定阶段甲醇如何生成烯烃给出了合理的解释. 早在1990年, Dahl和Kolboe提出了烃池机理[39], 如图 5所示. 他们认为, MTO反应初期甲醇在分子筛上先形成烃池物种(CH2)n, 反应进入稳定阶段后, 甲醇与烃池物种反应生成轻质烯烃, 如乙烯、丙烯和丁烯; 然后这些烯烃通过缩合、烷基化、环化和氢转移等反应生成高聚物烯烃、烷烃和芳香烃等烃类化合物[40-41]. Haw等[42]提出了超分子催化剂的概念. 他们认为分子筛自身的骨架结构和酸性位密度等性质与烃池物种共同决定了超分子催化剂在MTO反应中的催化活性.
后来, Svelle等[44]在烃池机理的基础上又提出了烃池双循环机制, 它由烯烃基循环和芳烃基循环构成, 并且这两个循环相互关联, 如图 5所示. 在烯烃基循环中, 烯烃通过甲基化产生较高的烯烃, 然后裂解形成低碳烯烃, 或者通过环化和氢转移反应形成芳烃; 而在芳烃基循环中, 芳烃与甲醇或者二甲醚发生甲基化反应生成含有多个甲基取代基的芳烃化合物, 然后在经脱烷基化反应生成低碳烯烃[43, 45]. 甲基化反应和氢转移反应是烃池双循环机理中的核心反应. 其中, 甲基化反应是MTO反应中生成低碳烯烃的关键步骤, 它由烯烃甲基化和芳烃甲基化反应构成; 氢转移反应是生成烷烃和芳烃等副产物的主要途径. 现已经确定了两条独立的氢转移途径; 一条是烯烃与烯烃发生氢转移反应生成烷烃, 另一条是甲醇与烯烃反应生成烷烃和芳烃[46]. 由于甲醇是一种高效的甲基化试剂, 所以在MTO反应体系中甲基化反应占主导地位生成以烯烃为主的烃类化合物. 甲硫醇的甲基化能力很弱, 并且也没有相关文献证明甲硫醇能与烯烃或者芳烃发生甲基化反应[27]. 因此在M2TO反应体系中氢转移反应占主导生成烷烃和芳烃等碳氢化合物, 基本没有烯烃存在, 如反应4所示.
| $ {{\rm{C}}_\mathit{n}}{{\rm{H}}_\mathit{m}}{\rm{ + C}}{{\rm{H}}_{\rm{3}}}{\rm{SH}} \to {{\rm{C}}_\mathit{n}}{{\rm{H}}_{\mathit{m}{\rm{ - 2}}}}{\rm{ + C}}{{\rm{H}}_{\rm{4}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{S}} $ | (4) |
由于M2TO反应的活化能垒比MTO反应的高, 所以M2TO反应要在高温下突破其热力学平衡限制才能发生. 实际反应情况也印证了这一点, 甲硫醇催化转化的反应温度一般在450 ℃及以上, 而MTO的反应温度一般在350 ℃左右. 在高温反应条件下, M2TO反应体系中的其它副反应也会随之发生, 例如生成乙烯的关键中间体的DMS和TMS会发生过度裂解[20]; 已经生成的烯烃其C=C键会发生进一步断裂, 最终生成甲烷、乙烷等稳定型的小分子[47], 如反应5~7所示. 此外, M2TO反应温度过高也会造成分子筛结焦失活.
因此, 降低反应温度避免二次反应的发生, 有利于提高反应体系中烯烃产物的选择性, 使得M2TO反应得以实现, 如图 6所示. Ce、Cr和Mo等金属杂原子引入到分子筛上, 理论上可以使M2TO反应温度降低. 郝湖生等[28]用Ce来改性H-ZSM-5沸石后用于甲硫醇催化裂解反应, 发现其反应活性大大提高, 在400 ℃时甲硫醇转化率可以达到97%左右. He等[48]在Cr/MCM-41催化剂上研究了甲硫醇催化转化反应, 在350 ℃时其转化率可达95%左右. 这是由于过渡金属引入后, 分子筛的还原性和碱性提高, 促进了甲硫醇的催化转化. 此外, He又以Cr基催化剂用于丙烷非氧化脱氢反应过程中发现[49-50], 活性位点Cr在反应过程中主要用来吸附和活化丙烷分子中的C-H键, 从而避免烯烃产物中C=C键在分子筛酸性位点上的过度活化, 为丙烯等低碳烯烃的生成提供了保证.
| $ {{\rm{TMS + C}}{{\rm{H}}_{\rm{3}}}{\rm{SH}} \to {\rm{DMS + C}}{{\rm{H}}_{\rm{4}}}{\rm{ + C}}{{\rm{H}}_{\rm{2}}}{\rm{S}}} $ | (5) |
| $ {{\rm{TMS}} \to {\rm{DMS + C}}{{\rm{H}}_{\rm{4}}}} $ | (6) |
| $ {{\rm{DMS}} \to {\rm{C}}{{\rm{H}}_{\rm{4}}}{\rm{ + C}}{{\rm{H}}_{\rm{2}}}{\rm{S}}} $ | (7) |
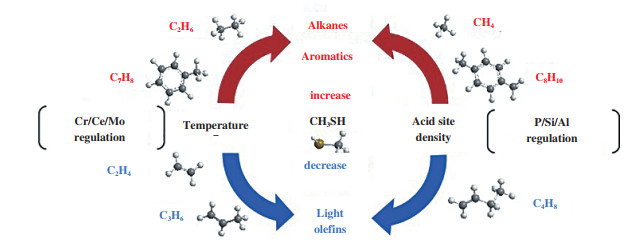
|
图 6 温度和酸性位密度对M2TO反应的影响 Fig.6 The influence of temperature and acid site density on M2TO reaction |
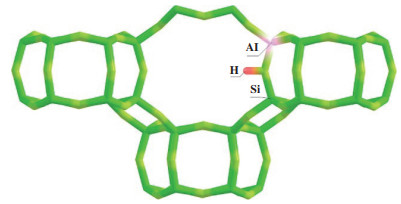
酸性沸石分子筛是甲硫醇催化转化反应中常用的催化剂. 甲硫醇制烯烃作为一个非常复杂的反应体系, 其反应机理与MTO反应相似但却又存在着一些差异. 在M2TO反应过程中, 它与MTO反应一样涉及到了多个反应步骤, 例如: 甲基化反应、重排反应、异构化反应、氢转移反应和烯烃裂解反应等. 这些反应发生在沸石酸性中心, 它们相互关联共同构筑成一个复杂的反应网络. 因此, 分子筛酸位密度被认为是调控M2TO反应产品选择性的一个关键点. 过高的酸位密度会促进M2TO反应体系中的氢转移反应生成烷烃和芳烃等产物, 甚至导致催化剂结焦失活. Hulea等[27]用H-ZSM-5(75, 酸密度低)和H-ZSM-5(15, 酸密度高)分别做甲硫醇催化裂解实验, 发现H-ZSM-5(75)对芳烃和焦炭的选择性较低. 这是因为过高的酸位密度可以减小酸性位点之间的距离, 从而提高反应物或中间体相互反应的可能性[51]. 因此, 降低酸性分子筛上的酸位密度会抑制氢转移反应, 导致产物中烷烃和芳烃的选择性降低, 烯烃选择性增大. 理论上这将有利于M2TO反应的发生, 如图 6所示. 分子筛酸位密度与其自身的硅铝比有关. 一般来说, 在分子筛中酸性中心是由铝产生的, 如图 7所示, 所以对于同种类型的分子筛硅铝比越大酸位密度越低. 另一方面, 过渡金属的引入和改性可以降低分子筛催化剂上的酸位密度, 这归因于金属杂原子的引入导致分子筛脱铝, 从而减少分子筛上的酸性位点的数量[52]. 因此, 提高分子筛的硅铝比, 或者引入一些有利于M2TO反应体系的金属杂原子(Ce、Cr等)改性分子筛使其酸位密度降低.
3.3 分子筛结构对M2TO的影响及解决方法在MTO反应体系中, 不同拓扑结构的分子筛对反应产物的选择性有较大的差异. 造成这种差异的原因是: 分子筛自身的孔道和空腔结构对反应中间体的约束, 限制了涉及该中间体的反应路径发生, 从而导致产物选择性的差异[38, 53]. ZSM-22催化MTO反应时, 由于自身狭窄的一维十元环孔道限制了芳烃基循环运行, 从而导致整个反应体系以烯烃基循环为主生成选择性较高的丙烯及C4+烯烃产物[54-56]. 在H-ZSM-5沸石上, 其二维十元环孔道(0.56 nm)较大, 高碳烯烃和芳烃等大分子中间体可以自由进出, 导致反应产物中芳烃选择性较高[57]. 而对于SAPO-34来说, 它的八元环孔道(0.38 nm)限制了芳烃等大分子碳氢化合物析出, 并使其聚集在腔内; 从而促进了芳烃基循环生成了选择性较高的乙烯及丙烯产物[58-59]. 因此, SAPO-34在甲醇制烯烃工艺中有着巨大的潜力, 目前是该工艺中使用最广泛且最有效的催化剂.
当SAPO-34用于M2TO反应体系中, 由于其择形选择性, 理论上可以提高乙烯等低碳烯烃的选择性促进M2TO反应发生. Mashkina和Hulea等[23, 27]在甲硫醇催化转化反应中发现, 随着反应产物的生成SAPO-34会快速失活. 这归因于SAPO-34上的八元环孔对芳烃中间体的限制不仅促进了芳烃基循环, 还阻碍了焦炭前体(聚芳烃)[60]扩散到外界, 从而覆盖活性位点导致分子筛快速结焦失活. 近年来, 相关学者在SAPO-34上引入介孔结构合成了一种多级孔SAPO-34分子筛可以有效解决其快速结焦失活问题[61-62]. 这是由于介孔结构的引入, 一方面可以加快反应物分子向活性位的扩散转移, 缩短产物分子在微孔间的扩散距离, 使得中间产物的二次反应得以抑制, 从而提高目标产物的选择性[63-64]; 另一方面, 还可以有效降低分子筛催化剂的酸性位密度(酸性质表征过程中, 中孔结构有利于NH3分子的扩散, 减少其在催化剂上的停留), 并且改变催化剂的积炭位置以及积炭容量, 避免积炭覆盖活性中心[65], 从而提高催化剂的稳定性能, 如图 8所示.
|
图 8 M2TO反应在多级孔SAPO-34上的反应示意图 Fig.8 Hierarchical SAPO-34 zeolite for M2TO reaction |
甲醇、甲硫醇和卤代甲烷(CH3X, X=Cl、Br、I)这一类物质都属于C1功能化分子, 其中甲醇和卤代甲烷是高效的甲基化试剂[66]. MTO反应遵循烃池双循环机制, 通过甲醇连续的甲基化反应生成以烯烃为主的烃类化合物. 卤代甲烷制烯烃反应是甲烷制备高附加值化学品工艺的间接路径之一. 它的反应机理与MTO反应的烃池机理相似[67-68], 也是通过卤代甲烷连续甲基化反应生成烯烃. 相比之下, 甲硫醇的甲基化能力较弱; 因此在M2TO反应中甲硫醇作为一种脱氢剂促进了氢转移反应生成了以烷烃和芳烃为主的烃类化合物. Li等[68]利用周期性密度泛函理论计算研究了C1功能化分子在H-SAPO-34中与乙烯、丙烯和丁烯等烯烃甲基化反应的活性, 发现烯烃与甲硫醇发生甲基化反应的动力学要求高于其它甲基化试剂与烯烃反应的动力学要求, 其反应的吉布斯自由能趋势如下: CH3SH>CH3Cl>CH3Br>CH3OH, 这说明甲硫醇很难与烯烃发生甲基化反应. 因此, M2TO反应较难实现的根本原因可能是甲硫醇的甲基化能力较弱, 导致整个M2TO反应以氢转移反应为主生成烷烃和芳烃等产物.
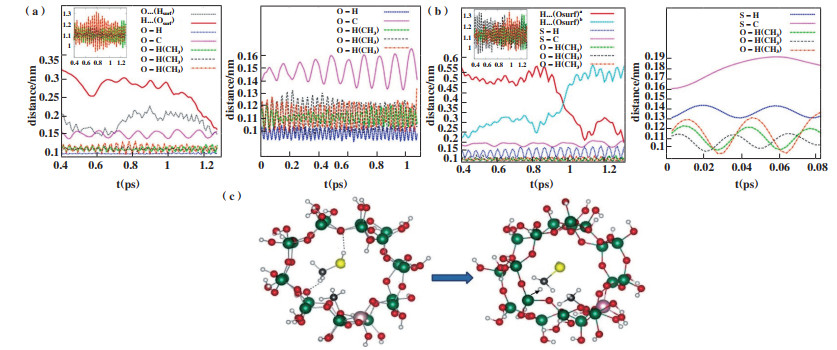
3.4.2 甲硫醇甲基化能力较弱原因分析及解决方法Reina等[66]利用密度泛函理论(DFT)和波恩-奥本海默分子动力学(BOMD), 研究了甲硫醇在H-ZSM-5分子筛中的甲基化作用并与用相同研究方法研究的甲醇甲基化作用进行了对比. 他们首先利用DFT对甲醇和甲硫醇在沸石腔内吸附、脱H2O或H2S、再形成甲氧基中间体的过程进行了计算研究, 发现两者并没有什么较大差异. 随后在550 ℃的实验温度下, BOMD模拟研究显示在有甲氧基中间体存在的情况下, 吸附在沸石腔内的甲硫醇上的甲基氢被快速提取生成·CH2SH自由基. 在相同温度下, 甲醇脱氢生成·CH2OH自由基的速率比·CH2SH自由基的生成速率慢10倍. 这是因为甲硫醇在沸石腔内其本身甲基氢和硫氢基(-SH)中的氢原子分别与沸石骨架中的氧原子形成氢键, 造成甲硫醇分子在这两个氢键之间摆动如图 9b所示, 从而限制了C-S键的自由旋转. 这种受阻旋转会使甲硫醇甲基中的碳原子轨道与3个氢原子非等效轨道耦合, 导致甲基中只有一个或者两个C-H键耦合成键, 而剩余的氢原子不会与甲基碳成键, 从而被快速解离. 当甲氧基中间体存在时, 由于其被吸附在酸性位点上导致甲硫醇在沸石腔内不会被酸性位点吸附, 更多的是被氢键吸附从而导致C-S键的自由旋转受到更大的限制更容易解离氢原子, 其模型结构如图 9c所示. 而甲醇在沸石腔内是甲基氢和羟基氧分别与沸石骨架中的氧原子和氢原子形成氢键如图 9a所示. 所以, 它不会在两个氢键之间摆动从而导致C-O键受阻旋转, 最终造成甲基氢容易解离.
|
图 9 BOMD模拟研究(a)CH3OH吸附在沸石腔内各键长变化; (b)CH3SH吸附在沸石腔内各键长变化; (c)甲氧基存在的情况下CH3SH的吸附情况[66] Fig.9 BOMD simulation research (a) CH3OH adsorption in the zeolite cavity changes in the bond length; (b) CH3SH adsorption in the zeolite cavity changes in the bond length; (c) the adsorption of CH3SH in the presence of methoxy[66] |
甲基化试剂(CH3-X)对甲基化反应活性的影响是基于甲基化试剂中C-X断裂的能力和其接受酸性质子的能力[68]. 对于甲硫醇来说, 其酸性强于甲醇, 所以甲硫醇难于接受酸性质子, 这在一定程度上削弱了甲硫醇的甲基化能力. 此外, C-S键的键能比C-O键的弱易于断裂[25], 这对甲硫醇甲基化反应是有利的. 但是, 在沸石腔内的甲硫醇, 由于其C-S键自由旋转受阻导致甲基氢原子易于解离和C-S键的空间位阻增大难于断裂. 因此甲硫醇在沸石腔内的甲基化能力很弱.
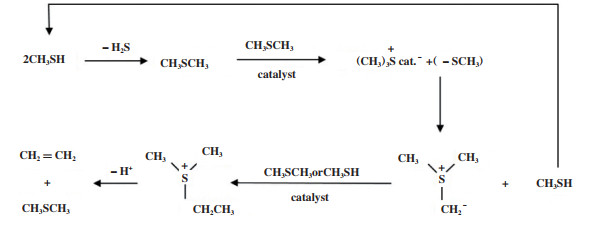
Ru、Fe和Pd等过渡金属被证明可以促进甲基化反应[69-70]. 将这些金属杂原子引入到分子筛中对其进行改性, 不仅可以促进甲基化反应发生; 同时还因为降低了分子筛的酸位密度抑制氢转移反应, 这将有利于M2TO反应发生. 此外, ThO2、WO3/Al2O3和TaF5/Al2O3等催化剂也可以用于M2TO反应体系[47, 71]. Olah等[47]用WO3-Al2O3催化剂, 在380 ℃下, 以M2TO反应中的中间体二甲基硫醚(DMS)为原料催化转化为碳氢化合物, 转化率为32%, 其中甲烷选择性为63.8%; 乙烯以及丙烯的选择性33%. 他们认为甲硫醇或二甲基硫醚转化为乙烯的过程与甲醇或二甲醚的转化过程非常相似, 并提出了甲硫醇在WO3-Al2O3催化剂上制烯烃的反应机理, 如图 10所示. 两分子甲硫醇脱H2S生成DMS, 随后两分子的DMS反应形成三甲基硫鎓离子(TMS), 脱氢后又形成三甲基硫鎓内鎓盐(DSMY), DSMY又发生甲基化反应生成乙基二甲基硫鎓离子(EDMS), 最后去质子化脱氢生成乙烯. 与M2TO反应相比, 该反应的烯烃选择性较高, 这可能是因为WO3/Al2O3酸性较弱促进了反应中间体发生甲基化反应生成低碳烯烃.
3.5 其他因素对M2TO的影响反应气氛对M2TO反应有较大的影响. Hulea等[27]在H-ZSM-5上考察了氮气、甲烷和水蒸气等反应气氛对甲硫醇催化转化反应的影响. 甲烷作为反应气氛时(CH3SH/CH4/N2, 混合进料), 催化剂寿命降低, 这归因于甲烷会和焦炭前体发生反应导致催化剂结焦失活. 水蒸气作为反应气氛时(CH3SH/H2O/N2), 催化剂寿命延长. 这可能是因为水和焦炭前体在强酸位点之间存在竞争性化学吸附, 一定程度上抑制了结焦反应; 也有其他学者认为是因为反应生成的焦炭与水蒸气发生重整反应去除了焦炭. 总之, 少量的水可以提高沸石催化中心的稳定性, 有利于M2TO反应的进行. 此外, 提高反应空速降低产物分子或反应中间体与催化剂活性中心的接触时间[72], 可以避免M2TO反应体系中二次反应发生, 从而提高烯烃选择性为实现M2TO反应提供了进一步的保障.
4 结论与展望分析了M2TO反应较难实现的原因, 重点探讨了影响M2TO反应的因素并提出一些解决方法. 在低温、低酸位密度和短停留时间的反应条件; Cr、Pd和Mo等过渡金属改性微孔-中孔复合型SAPO-34分子筛的催化体系下, 理论上有利于M2TO反应的实现. M2TO反应过程的实现将会促进以CO2和H2S出发合成甲硫醇(CH3SH), 再经由CH3SH催化转化制低碳烯烃的工艺技术开发, 并成为绿色和环保的非石油路径制备低碳烯烃的工艺路线. 目前国内外的相关学者对M2TO反应体系探究尚浅, 且没有明确M2TO反应机理及其动力学关系. 在未来的研究中需要重点关注以下方面: (1)影响乙烯和丙烯等低碳烯烃产物选择性调控的关键因素; (2)明确甲硫醇制烯烃的反应机理; (3)明晰催化剂结构及组成与活性的构效关系; (4)深入理解催化剂失活原因及再生过程. 上述过程的深入理解将有助于M2TO工艺的开发及工业化应用.
| [1] |
a. Wang Bao-jie(王宝杰), Zhao Hong-juan(赵红娟), Wang Jiu-jiang(王久江), et al. Comparative study of three zeolites with different topologies(SAPO-34, Al-ITQ-13 and ZSM-5) in MTO reaction (三种不同拓扑结构的分子筛在甲醇制烯烃反应中的性能对比)[J]. J Mol Catal(China)(分子催化), 2018, 32(6): 493-500. b. Zhang Qi(张琦), Tong Jin-hui(童金辉), Chou Ling-jun(丑凌军), et al. h-BN-Doped Na2WO4-Mn/SiO2 catalysts for oxidative dehydrogenation of ethane to ethylene(h-BN掺杂Na2WO4-Mn/SiO2催化剂用于乙烷氧化脱氢制乙烯)[J]. J Mol Catal(China)(分子催化), 2020, 34(6): 495-504. c. Nai Yong-ning(乃永宁), Gao Si-meng(高斯萌), Wei Xue-ying(魏雪莹), et al. Advances in quantum chemistry of ethylene selective tri/tetramerization catalyzed by Cr/PNP catalysts(Cr/PNP催化乙烯选择性三/四聚反应的量子化学研究进展)[J]. J Mol Catal(China)(分子催化), 2021, 35(3): 289-298. |
| [2] |
Zhu Yu-xiang(朱玉香), Xu Shi-jie(许史杰), Yang Jing(杨静), et al. Preparation and visible-light-induced photocatalytic activities of Co/C3N4 NTs(Co/C3N4 NTs复合纳米材料的制备及光催化性能)[J]. Chin J Inorg Chem(无机化学学报), 2019, 35(12): 2331–2336.
DOI:10.11862/CJIC.2019.261 |
| [3] |
Hu Xu-teng(胡徐腾). Technology progress and economy analysis on natural gas to ethylene(天然气制乙烯技术进展及经济性分析)[J]. Chem Ind Eng Prog(化工进展), 2016, 35(6): 1733–1738.
|
| [4] |
Chen Ying(陈颖), Yang He(杨鹤), Liang Hong-bao(梁宏宝), et al. Advances in research of decarbonization and desulfurization for nature gas(天然气脱硫脱碳方法的研究进展)[J]. Petrochem Technol(石油化工), 2011, 40(5): 565–570.
|
| [5] |
Taifan W, Baltrusaitis J. Minireview: Direct catalytic conversion of sour natural gas (CH4+H2S+CO2) components to high value chemicals and fuels[J]. Catal Sci Technol, 2017, 7(14): 2919–2929.
DOI:10.1039/C7CY00272F |
| [6] |
Baltrusaitis J, Graaf C D, Broer R, et al. H2S-mediated thermal and photochemical methane activation[J]. ChemPhysChem, 2013, 14(17): 3960–3970.
DOI:10.1002/cphc.201300828 |
| [7] |
Sá S S, Palm B B, Campuzano-jost P, et al. Influence of urban pollution on the production of organic particulate matter from isoprene epoxydiols in central Amazonia[J]. Atmos Chem Phys, 2017, 17(11): 6611–6629.
DOI:10.5194/acp-17-6611-2017 |
| [8] |
Huang C, T-raissi A. Liquid hydrogen production via hydrogen sulfide methane reformation[J]. J Power Sources, 2008, 175(1): 464–472.
DOI:10.1016/j.jpowsour.2007.09.079 |
| [9] |
Xu Xue-fei(徐学飞). Selection of natural gas desulfurization and decarbonization methods(天然气脱硫脱碳方法的选择)[J]. Chem Enterp Manage(化工管理), 2015, 2015(2): 227–228.
DOI:10.3969/j.issn.1008-4800.2015.02.195 |
| [10] |
Liu Zhu(刘竹), Guan Da-bo(关大博), Wei Wei(魏伟). Chinese CO2 emissions accounting(中国二氧化碳排放数据核算)[J]. Sci Sin: Terrae(中国科学: 地球科学), 2018, 48(7): 878–887.
|
| [11] |
Vieira R B, Moura P A S, Vilarrasa-García E, et al. Polyamine-Grafted magadiite: High CO2 selectivity at capture from CO2/N2 and CO2/CH4 mixtures[J]. J CO2 Util, 2017, 23: 29–41.
|
| [12] |
Li Pei-zhou, Wang Xiao-jun, Liu Jia, et al. A triazole-containing metal-organic framework as a highly effective and substrate size-dependent catalyst for CO2 conversion[J]. J Am Chem Soc, 2016, 138(7): 2142–2145.
DOI:10.1021/jacs.5b13335 |
| [13] |
Miguel C V, Soria M A, Mendes A, et al. A sorptive reactor for CO2 capture and conversion to renewable methane[J]. Chem Eng J, 2017, 322: 590–602.
DOI:10.1016/j.cej.2017.04.024 |
| [14] |
Kattel S, Ramirez P J, Chen J G, et al. Active sites for CO2 hydrogenation to methanol on Cu/ZnO catalysts[J]. Science, 2017, 355(6331): 1296–1299.
DOI:10.1126/science.aal3573 |
| [15] |
Rungtaweevoranit B, Baek J, Araujo J R, et al. Copper nanocrystals encapsulated in Zr-based metal-organic frameworks for highly selective CO2 hydrogenation to methanol[J]. Nano Lett, 2016, 16(12): 7645–7649.
DOI:10.1021/acs.nanolett.6b03637 |
| [16] |
Zhang Xin, Tang Yu-yin, Qu Si-qiu, et al. H2S-Selective catalytic oxidation: Catalysts and processes[J]. ACS Catal, 2015, 5(2): 1053–1067.
DOI:10.1021/cs501476p |
| [17] |
Zhan Ying-ying, Shen Li-juan, Xu Cong-bo, et al. MOFderived porous Fe2O3 with controllable shapes and improved catalytic activities in H2S selective oxidation[J]. Crystengcomm, 2018, 20(25): 3449–3454.
DOI:10.1039/C8CE00552D |
| [18] |
Zhu Ming-hui, Li Bing, Jehng J M, et al. Molecular structure and sour gas surface chemistry of supported K2O/WO3/Al2O3 catalysts[J]. Appl Catal B-Environ, 2018, 232: 146–154.
DOI:10.1016/j.apcatb.2018.03.044 |
| [19] |
Barrault J, Boulinguiez M, Forquy C, et al. Synthesis of methyl mercaptan from carbon oxides and H2S with tungsten-alumina catalysts[J]. Chem Inform, 1988, 33(2): 309–330.
|
| [20] |
Baltrusaitis J, Bucko T, Makkee W, et al. Catalytic methyl mercaptan coupling to ethylene in chabazite: DFT study of the first C-C bond formation[J]. Appl Catal B-Environ, 2016, 187: 195–203.
DOI:10.1016/j.apcatb.2016.01.021 |
| [21] |
Butter S A, Jurewicz A T, Kaeding W W. Conversion of alcohols, mercaptans, sulfides, halides and/or amines[P]. US: 3894107 A, 1975.
|
| [22] |
Chang C D, Silvestri A J. The conversion of methanol and other O-compounds to hydrocarbons over zeolite catalysts[J]. J Catal, 1977, 47(2): 249–259.
DOI:10.1016/0021-9517(77)90172-5 |
| [23] |
Mashkina A V, Grunvald V R, Nasteka V I, et al. Decomposition of alkanethiols to dialkyl sulfides and hydrogen sulfide[J]. React Kinet Catal Lett, 1990, 41(2): 357–362.
DOI:10.1007/BF02097894 |
| [24] |
Charles A C. Production of thioethers and saturated hydrocarbons from mercaptans[P]. US: 2051807, 1936.
|
| [25] |
Cammarano C, Huguet E, Cadours R, et al. Selective transformation of methyl and ethyl mercaptans mixture to hydrocarbons and H2S on solid acid catalysts[J]. Appl Catal B-Environ, 2014, 156: 128–133.
|
| [26] |
Huguet E, Coq B, Durand R, et al. A highly efficient process for transforming methyl mercaptan into hydrocarbons and H2S on solid acid catalysts[J]. Appl Catal B-Environ, 2013, 134: 344–348.
|
| [27] |
Hulea V, Huguet E, Cammarano C, et al. Conversion of methyl mercaptan and methanol to hydrocarbons over zeolites-a comparative study[J]. Appl Catal B-Environ, 2014, 144: 547–553.
DOI:10.1016/j.apcatb.2013.07.056 |
| [28] |
Hao Hu-sheng(郝湖生), He De-dong(何德东), Lu Ji-chang(陆继长), et al. Study on the surface properties of HZSM-5 zeolite modified by cerium and its catalytic degradation ofmethyl mercaptan(铈改性对HZSM-5分子筛表面性质及其催化降解甲硫醇(CH3SH)的研究)[J]. J Chin Rare Earth Soc(中国稀土学报), 2016, 34(3): 265–272.
|
| [29] |
He De-dong, Chen Ding-kai, Hao Hu-sheng, et al. Enhanced activity and stability of Sm-doped HZSM-5 zeolite catalysts for catalytic methyl mercaptan (CH3SH) decomposition[J]. Chem Eng J, 2017, 317: 60–69.
DOI:10.1016/j.cej.2017.02.067 |
| [30] |
He De-dong, Hao Hu-sheng, Chen Ding-kai, et al. Effects of rare-earth (Nd, Er and Y) doping on catalytic performance of HZSM-5 zeolite catalysts for methyl mercaptan (CH3SH) decomposition[J]. Appl Catal A-Gen, 2017, 533: 66–74.
DOI:10.1016/j.apcata.2017.01.011 |
| [31] |
Lunsford J H. Catalytic conversion of methane to more useful chemicals and fuels: A challenge for the 21st century[J]. Catal Today, 2000, 63(2/4): 165–174.
|
| [32] |
Wang W, Hunger M. Reactivity of surface alkoxy species on acidic zeolite catalysts[J]. Acc Chem Res, 2008, 41(8): 895–904.
DOI:10.1021/ar700210f |
| [33] |
Olsbye U, Svelle S, Lillerud K P. The formation and degradation of active species during methanol conversion over protonated zeotype catalysts[J]. Chem Soc Rev, 2015, 44(20): 7155–7176.
DOI:10.1039/C5CS00304K |
| [34] |
Klier K, Herman R G, Nunan J G, et al. Mechanism of methanol and higher oxygenate synthesis[J]. Stud Surf Sci Catal, 1988, 36: 109–125.
|
| [35] |
Hutchings G J, Watson G W, Willock D J. Methanol conversion to hydrocarbons over zeolite catalysts: Comments on the reaction mechanism for the formation of the first carbon-carbon bond[J]. Micropor Mesopor Mater, 1999, 29(1/2): 67–77.
|
| [36] |
Ono Y, Mori T. Mechanism of methanol conversion into hydrocarbons over ZSM-5 zeolite[J]. J Chem Soc, Faraday Trans 1, 1981, 77(9): 2209.
DOI:10.1039/f19817702209 |
| [37] |
Tajima N, Tsuned A T, Toyama F, et al. A new mechanism for the first carbon carbon bond formation in the MTG process: A theoretical study[J]. J Am Chem Soc, 1998, 120(32): 8222–8229.
DOI:10.1021/ja9741483 |
| [38] |
Xu Shu-tao, Zhi Yu-chun, Han Jing-feng, et al. Chapter two-advances in catalysis for methanol-to-olefins conversion[J]. Adv Catal, 2017, 61: 37–122.
|
| [39] |
Dahl I M, Kolboe S. On the reaction mechanism for propene formation in the MTO reaction over SAPO-34[J]. Catal Lett, 1993, 20(3): 329–336.
DOI:10.1007/BF00769305 |
| [40] |
Dahl I M, Kolboe S. On the reaction mechanism for hydrocarbon formation from methanol over SAPO-34: I. Isotopic labeling studies of the Co-reaction of ethene and methanol[J]. J Catal, 1994, 149(2): 458–464.
DOI:10.1006/jcat.1994.1312 |
| [41] |
Dahl I M, Kolboe S. On the reaction mechanism for hydrocarbon formation from methanol over SAPO-34[J]. J Catal, 1996, 161(1): 304–309.
DOI:10.1006/jcat.1996.0188 |
| [42] |
Haw J F, Marcus D M. Well-defined (supra) molecular structures in zeolite methanol-to-olefin catalysis[J]. Top Catal, 2005, 34(1/4): 41–48.
|
| [43] |
Ilias S, Bhan A. Tuning the selectivity of methanol-to-hydrocarbons conversion on H-ZSM-5 by co-processing olefin or aromatic compounds[J]. J Catal, 2012, 290(1): 186–192.
|
| [44] |
Svelle S, Olsbye U, Joensen F, et al. Conversion of methanol to alkenes over medium-and large-pore acidic zeolites: Steric manipulation of the reaction intermediates governs the ethene/propene product selectivity[J]. J Phys Chem C, 2007, 111(49): 151–157.
|
| [45] |
Wang Ning, Hou Yi-lin, Sun Wen-jing, et al. Modulation of b-axis thickness within MFI zeolite: Correlation with variation of product diffusion and coke distribution in the methanol-to-hydrocarbons conversion[J]. Appl Catal B-Environ, 2019, 243: 721–733.
DOI:10.1016/j.apcatb.2018.11.023 |
| [46] |
Mueller S, Liu Y, Kirchberger F M, et al. Hydrogen transfer pathways during zeolite catalyzed methanol conversion to hydrocarbons[J]. J Am Chem Soc, 2016, 138(49): 15994.
DOI:10.1021/jacs.6b09605 |
| [47] |
Olah G A, Doggweiler H, Felberg J D, et al. Onium ylide chemistry. 1. Bifunctional acid-base-catalyzed conversion of heterosubstitutedmethanes into ethylene and derived hydrocarbons. The onium ylide mechanism of the C1 fwdarw C2 conversion[J]. J Am Chem Soc, 1984, 15(28): 2143–2149.
|
| [48] |
He De-dong, Zhang Li-ming, Zhao Yu-tong, et al. Recycling spent Cr-adsorbents as catalyst for eliminating methylmercaptan[J]. Environ Sci Technol, 2018, 52(6): 3669–3675.
DOI:10.1021/acs.est.7b06357 |
| [49] |
He De-dong, Zhang Ya-Liu, Yang Shuang, et al. Investigation of the isolated Cr(VI) species in Cr/MCM-41 catalysts and its effect on catalytic activity for dehydrogenation of propane[J]. ChemCatChem, 2018, 10(23): 5354–5440.
|
| [50] |
He De-dong, Zhang Ya-Liu, Yang Shuang, et al. The development of a strategy to reuse spent Cr-adsorbents as efficient catalyst: From the perspective of practical application[J]. ACS Sustain Chem Eng, 2019, 7(3): 3251–3257.
DOI:10.1021/acssuschemeng.8b05206 |
| [51] |
Guisnet M, Costa L, Ribeiro F R. Prevention of zeolite deactivation by coking[J]. J Mol Catal A-Chem, 2009, 305(1/2): 69–83.
|
| [52] |
Jin Y J, Asaoka S, Zhang S D, et al. Reexamination on transition-metal substituted MFI zeolites for catalytic conversion of methanol into light olefins[J]. Fuel Process Technol, 2013, 115: 34–41.
DOI:10.1016/j.fuproc.2013.03.047 |
| [53] |
Yang Miao, Tian Peng, Wang Chan, et al. A top-down approach to prepare silicoaluminophosphate molecular sieve nanocrystals with improved catalytic activity[J]. Chem Commun, 2014, 50(15): 1845–1847.
DOI:10.1039/c3cc48264b |
| [54] |
Li Jin-zhe, Wei Ying-xu, Qi Yue, et al. Conversion of methanol over H-ZSM-22: The reaction mechanism and deactivation[J]. Catal Today, 2011, 164(1): 288–292.
DOI:10.1016/j.cattod.2010.10.095 |
| [55] |
Teketel S, Olsbye U, Lillerud K P, et al. Selectivity control through fundamental mechanistic insight in the conversion of methanol to hydrocarbons over zeolites[J]. Micropor Mesopor Mater, 2010, 136(1/3): 33–41.
|
| [56] |
Hemelsoet K, Nollet A, Vandichel M. The effect of confined space on the growth of naphthalenic species in a chabazite-type catalyst: A molecular modeling study[J]. ChemCatChem, 2009, 1(3): 373–378.
DOI:10.1002/cctc.200900208 |
| [57] |
Wu Wen-zhang, Guo Wen-yao, Xiao Wen-de, et al. Methanol conversion to olefins (MTO) over H-ZSM-5: Evidence of product distribution governed by methanol conversion[J]. Fuel Process Technol, 2013, 108: 19–24.
DOI:10.1016/j.fuproc.2012.05.013 |
| [58] |
Hereijgers B P C, Bleken F, Nilsen M H, et al. Product shape selectivity dominates the Methanol-to-Olefins (MTO) reaction over H-SAPO-34 catalysts[J]. J Catal, 2009, 264(1): 77–87.
DOI:10.1016/j.jcat.2009.03.009 |
| [59] |
Zhong Jia-wei, Han Jing-feng, Wei Ying-xu, et al. Recent advances of the nano-hierarchical SAPO-34 in the methanol-to-olefin (MTO) reaction and other applications[J]. Catal Sci Technol, 2017, 7(21): 4905–4923.
DOI:10.1039/C7CY01466J |
| [60] |
Han Lan-fang, Sun Ke, Jin Jie, et al. Some concepts of soil organic carbon characteristics and mineral interaction from a review of literature[J]. Soil Biol Biochem, 2016, 94: 107–121.
DOI:10.1016/j.soilbio.2015.11.023 |
| [61] |
Sun Qi-ming, Xie Zai-ku, Yu Ji-hong. The state-of-the-art synthetic strategies for SAPO-34 zeolite catalysts in methanol-to-olefin conversion[J]. Natl Sci Rev, 2018, 5(4): 542–558.
DOI:10.1093/nsr/nwx103 |
| [62] |
Bai Ri-sheng, Yue Song, Yi Li, et al. Creating hierarchical pores in zeolite catalysts[J]. Trends Chem, 2019, 1(6): 601–611.
DOI:10.1016/j.trechm.2019.05.010 |
| [63] |
Fernandez C, Stan I, Gilson J P, et al. Hierarchical ZSM-5 zeolites in shape-selective xylene isomerization: Role of mesoporosity and acid site speciation[J]. Chem-Eur J, 2010, 16(21): 6224–6233.
DOI:10.1002/chem.200903426 |
| [64] |
Pinilla-Herrero I, Olsbye U, Márquez-Álvarez C, et al. Effect of framework topology of SAPO catalysts on selectivity and deactivation profile in the methanol-to-olefins reaction[J]. J Catal, 2017, 352: 191–207.
DOI:10.1016/j.jcat.2017.05.008 |
| [65] |
Jiao Feng, Li Jing-jing, Pan Xiu-lian, et al. Selective conversion of syngas to light olefins[J]. Science, 2016, 351(6277): 1065–1068.
DOI:10.1126/science.aaf1835 |
| [66] |
Reina M, Martinez A, Cammarano C, et al. Conversion of methyl mercaptan to hydrocarbons over H-ZSM-5 zeolite: DFT/BOMD study[J]. ACS Omega, 2017, 2(8): 4647–4656.
DOI:10.1021/acsomega.7b00756 |
| [67] |
Wei Ying-xu, Zhang Da-zhi, Liu Zhong-min, et al. Methyl halide to olefins and gasoline over zeolites and SAPO Catalysts: A new route of MTO and MTG[J]. Chin J Catal, 2012, 33(1): 11–21.
DOI:10.1016/S1872-2067(10)60303-8 |
| [68] |
Li Qing-ming, Zhang Min, Wang Chuan-ming, et al. Effects of methylating agent and Bronsted acidity on methylation activity of olefins in CHA-structured zeolites: A periodic DFT study[J]. Mol Catal, 2018, 446: 106–114.
DOI:10.1016/j.mcat.2017.12.034 |
| [69] |
Rao Yu, Shan Gang, Yang Xing-lin. Some recent advances in transition-metal-catalyzed ortho SP2 C-H functionalization using Ru, Rh, and Pd[J]. Sci China Chem, 2014, 46(7): 930–944.
|
| [70] |
Yan G B, Borah A J, Wang L G, et al. Recent advances in transition metalcatalyzed methylation reactions[J]. Adv Synth Catal, 2015, 357(7): 1333–1350.
DOI:10.1002/adsc.201400984 |
| [71] |
Stauffer J E. Formation of olefins from methyl mercaptan[P]. US: 7649116 B1, 2010.
|
| [72] |
Sun Qi-ming(孙启明), Li Xu(李旭), Wang Ning(王宁), et al. Influence of temperature and space velocity on the MTO reactionover nano sheet-like SAPO-34 catalyst and the theoretical calculation(温度及空速对纳米SAPO-34分子筛在MTO反应中的影响及理论计算研究)[J]. Sci Sin: Chim(中国科学: 化学), 2015, 45(4): 383–390.
|
 2021, Vol. 35
2021, Vol. 35