2. 北京科技大学 钢铁冶金新技术国家重点实验室, 北京 100850;
3. 湖南大学 化学化工学院, 湖南 长沙 410082;
4. 东北师范大学 化学学院, 吉林 长春 130024;
5. 北京辐射医学研究所, 北京 100850
2. University of Science and Technology Beijing, State Key Laboratory of New Technology of Iron and Steel Metallurgy, Beijing 100850, China;
3. Hunan University, College of Chemistry and Chemical Engineering, Changsha 410082, China;
4. Northeast Normal University, College of chemistry, Changchun 130024, China;
5. Beijing Institute of Radiation Medicine, Beijing 100850, China
生物燃料电池(Biofuel cells, BFCs)可作为一种产能装置, 以生物发电的原理将储存在可生物降解物质中的化学能直接转化为电能[1], 该系统中起催化作用的物质主要涵盖微生物组织和氧化还原酶. 生物燃料电池根据使用不同的催化物质来划分, 主要有两种: 一种是将氧化还原酶作为催化物质的酶生物燃料电池(EBFCs), 另一种是直接使用微生物作为催化物质的微生物燃料电池(Microbial biofuel cells, MBFCs).
微生物燃料电池(MBFCs)是以微生物组织作为催化剂[2], 已经在医学相关领域上吸引了学者们的注意力并被深入研究. 然而, 由于MBFCs存在一定弊端(例如在使用过程中, 生物的细胞毒性会带来健康问题), 因此MBFCs作为可穿戴或植入设备在一些领域中的应用是受限的[3]. 而酶生物燃料电池是以酶作为催化剂将生物燃料的化学能转化为电能的电子器件, 相比较而言, 由于酶具有良好的生物相容性并且可在温和的条件下运行等优点, 使得酶生物燃料电池能够较合适地给植入式或可穿戴式微型化电子设备的运行提供电能[4]. 许多常见的物质均可以作为酶生物燃料电池的燃料, 例如葡萄糖、乳酸和丙酮酸盐等[3, 5], 这些物质能够在人体代谢过程中产生并存在于体液(汗液、泪液和血液)中, 这就为此电池在体内或体外利用燃料发电提供了可能[6].
尽管常规的人体供电系统(热电、摩擦电、压电)具有灵敏度高、结构简单等优点, 但是电压通常过低, 难以满足可穿戴和可植入设备长效稳定的能源供应(如表 1所示). 然而, EBFCs具有体积小、生物相容性好、能在温和条件下运行等优点, 并可作为体内植入或体外可穿戴式微型电子器件的潜在电源[7], 在医疗、国防等领域均具有广阔的应用前景, 有望成为未来燃料电池的理想电源. 在体酶生物燃料电池通常分为两类; 一类是体内植入式酶生物燃料电池, 如将生物燃料植入蟑螂[8]、蛤蜊[9]、蜗牛[10]体内, 通过动物体内的血液中的葡萄糖作为底物为生物燃料供电; 另一类是体外可穿戴式生物燃料电池, 如将生物燃料电池贴在皮肤表面[11-13], 通过人体汗液产生的乳酸作为底物为生物燃料供电. 因此我们基于体液发电的酶生物燃料电池进行了综述, 并对未来发展前景进行了展望.
| 表 1 人体供电方式系统 Table 1 Power supply system of human body |
EBFCs以血液中的葡萄糖为燃料, 通过葡萄糖的氧化来发电, 由于葡萄糖是生物体内必不可少且相对丰富的能量来源, 因此人们特别关注可植入式EBFCs的开发, 以便可在体内植入微型器件, 来监测人体的健康指标.
早在2002年, Mano和Heller[17]研究了一种在生理缓冲溶液中工作的微型生物燃料电池. 电池由两个直径7 μm的碳纤维电极组成, 葡萄糖被包覆在阳极上的葡萄糖氧化酶氧化成葡萄糖酸内脂, 氧分子被包覆在阴极上的胆红素氧化酶(BOD)还原成水. 然而, 在pH为7.2生理缓冲溶液中, BOD受到氯离子的抑制, 但它与氧化还原聚合物交联的静电加合物中, 即使在氯离子浓度高达1 mol/L时, BOD也不会受抑制. 当在人体体温下, 输出电压为0.78 V时, 输出功率为6 μW, 就可以为植入的硅片供电. 研究人员希望这种生物燃料电池能够为皮下植入的血糖仪提供电能, 从而监测血糖的变化.
在此基础上, Heller等[18]研制了一种精确无痛血糖仪, 利用燃料技术可以连续检测血糖的变化. 通过皮下间质液中的葡萄糖和溶解氧, 植入无膜和无壳的电池可进一步提高能量和容量. 随着糖尿病在世界范围内的流行程度越来越高, 糖尿病的治愈仍然难以实现, 但是人类可能会从血糖电化学检测的进展中进一步受益. 自从血糖检测仪问世之后, 随着生物电化学技术的进步, 越来越先进的血糖检测仪正在推出, 这不仅消除了糖尿病患者对监测血糖时的痛苦, 也减弱了糖尿病患者一直以来的担忧.
近年来, 以酶为催化剂的植入式生物燃料电池在医疗领域越来越受到人们广泛的关注. Coman等[19]在2009年报道了第一个基于直接电子转移的葡萄糖/O2生物燃料电池在人血清中运行的实例, 其运行的最佳pH值为4.5, 产生的开路电压为0.58 V, 输出功率为4 μW·cm-2. 早期Kim和Yoo[20]等人采用聚吡咯纳米线制备了功率密度更高的葡萄糖/O2生物燃料电池, 以葡萄糖氧化酶或葡萄糖脱氢酶修饰的电极作为阳极, 胆红素氧化酶或漆酶修饰的电极作为阴极. 在生理条件下, 生物催化剂表现出较高的催化活性. 然而, 由于酶稳定性差、生物燃料电池的功率密度低等缺点, 使其在实际应用中受到局限, 为了解决这个问题, 已经研究了一些策略. 例如, 使用固定化方式可以增强酶在电极上的负载以及提高酶的稳定性和生物燃料电池的电化学性能. 同时研究小组还构建了葡萄糖/O2生物燃料电池与流体通道, 生物燃料电池在流体通道内, 可以获得理想的功率密度和工作电压. Kim和Yoo等[21]通过改善阴极的方法, 进一步提高了生物燃料电池功率密度以及改善了稳定性差等问题. 目前已经报道在人血清中可稳定运行8 d, 在开路电位为0.34 V时, 产生的最大功率为0.64 mW·cm-2. 而在另一项研究中, 在含有10 mmol/L葡萄糖溶液的人血清中[22], 可产生最大功率约为0.11 mW·cm-2. 然而, Kwon团队[23]报道了一种含低浓度葡萄糖(7 mmol/L)的磷酸盐缓冲溶液(PBS)和人血清(HBS)中均产生~1 mW·cm-2高功率, 其稳定性可持续运行2 d. 由于生物燃料电池的功率依赖于葡萄糖浓度, 葡萄糖浓度也与植入设备的血流量有关. 因此研究小组进一步研究生物流体对BFCs功率输出的影响, 采用聚3, 4-乙基二氧噻吩(PEDOT)涂层多壁碳纳米管(MWNT)制备了双弯丝电极, 在生理条件下(含磷酸盐缓冲溶液和人血清)控制搅拌速度可达到功率范围为mW·cm-2的生物燃料电池. 经过实验证明, 一个以表面积纱线为基础的生物燃料电池, 在人类血清中连续工作20 d之后, 保留了超过70%的初始输出功率, 同时提供了约1.0 mW·cm-2的功率密度[4].
此外, Yazdi等[24]利用葡萄糖氧化酶阳极与固态普鲁士蓝(PB)薄膜阴极耦合, 制备了一种适合于体内应用的可充电的葡萄糖生物电池. 这种新型生物燃料电池能有效地在无膜结构中工作, 因为PB能降低某些氧化酶产生的过氧化物. 由于溶解氧浓度往往较低且不断波动会导致电池阴极燃料供应不足, 从而影响生物燃料电池的电化学性能. 然而使用呼吸式阴极和固态PB阴极可以解决电解液中溶解氧不足的问题, 时刻保持氧气的充足, 以此提高电池的整体性能.
Lee等[25]采用一种非侵入性方法将血糖传感器植入人体中测量血糖的浓度. 为了建立更灵敏的测量模式, 作者进行了广泛的研究, 通过改进电极结构、表面功能化技术和电化学分析方法开发了无痛无创血糖监测传感器, 使对糖尿病患者友好的治疗方式成为可能.
近几年来, 植入式酶生物燃料电池越来越受到人们的关注, 但是也有很多问题需要考虑, 如安全问题以及生物相容性等问题, 未来的发展方向应集中在安全、耐用、更换方便、成本低廉等.
2 基于泪液的酶生物燃料电池泪液是由泪腺分泌的透明液体构成. 其主要成分有乳酸、葡萄糖、溶菌酶、黏蛋白、抗坏血酸等分子[26], 其中葡萄糖和乳酸具有较高的含量, 可作为燃料给生物燃料电池供电.
随着人们生活水平的提高, 糖尿病患者越来越多, 测定血糖浓度通过一些侵入性技术采集血液, 如用针或其他设备等抽血检测. 然而, 为了减轻糖尿病患者的痛苦, 在2004年March[27]团队设计了一种无创隐形眼镜葡萄糖传感器, 首次详细描述了隐形眼镜葡萄糖传感器临床试验, 本次实验使用了一种基于配体荧光猝灭的竞争性结合葡萄糖监测方法来监测葡萄糖. 无荧光团的日常佩戴一次性眼镜已被证明对糖尿病患者是安全的, 这种无创传感器对血糖有较好的跟踪作用, 有望成为家用血糖监测仪. 虽然佩戴这些眼镜是很舒适的, 但这些隐形眼镜在佩戴之前, 还需要进行长期舒适度和毒性的研究. 因此还需要进一步的改进与研究.
另一个类似的系统是基于水凝胶贴片中嵌入光子晶体[28], 当水凝胶被照射时, 折射光的波长随葡萄糖浓度而变化, 可明显看出衍射颜色在整个可见光谱区域的变化. 改进后的光子葡萄糖传感器材料能检测到泪液中~100 μmol/L浓度范围内的葡萄糖, 其检测限为1 μmol/L. 这些新型葡萄糖传感器具有适用于糖尿病患者眼内植入物或诊断隐形眼镜等葡萄糖传感应用的特性.
为了更好地准确监测糖尿病人血糖浓度, Badugu等[29]研究了一次性隐形眼镜, 对眼内血糖进行监测. 使用的是新型水溶性、高荧光和葡萄糖敏感的含氟硼酸的镜片, 这种隐形眼镜可以很容易地跟踪泪液中的葡萄糖, 从而监测血糖水平, 利用简单的激发和发射监测装置就可以监测透镜的荧光响应. 与任何传感器一样, 有几个问题需要解决, 首先是确定合适的转导元件, 这些元件在葡萄糖的存在下可以产生合适的信号, 其次是设计矩阵以及传感器的灵敏度、响应时间等方面的优化. 为此, 作者在2004年首次研究了一次性、现成的塑料隐形眼镜葡萄糖传感器, 当糖尿病患者佩戴这种隐形眼镜时, 它可以直接检测葡萄糖水平[30-32]. 为了研究出更多的非浸入性的技术, 研究团队一直在开发隐形眼镜等领域不断前进.
Iguchi等[33]采用微加工的方法在平板塑料支架上制备电化学传感器, 由于这种传感器是柔性的、灵活的, 它们可以作为可穿戴的葡萄糖传感器, 用于泪液中葡萄糖的实时监测. 测试结果表明: 葡萄糖浓度与输出电流在0.025~1.475 mmol/L范围内的线性关系, 相关系数为0.998. Kagie等[34]采用丝网印刷的方法, 设计了一种小型柔性电化学生物传感器, 适用于插入泪小管对泪液中的生物标志进行微创安培检测. 以上两种方法都被证明对泪液中葡萄糖的监测具有足够的敏感性. 然而, 这两篇文献中都没有包含对泪液中存在的干扰电活性物质的准确性进行验证, 因此目前还不太清楚这种传感器的实际可行性.
近年来, 葡萄糖传感器研究在开发电极材料方面取得了重大突破, 可以直接监测葡萄糖, 不需要使用酶[35]. Yao等[36]研究了一种内置葡萄糖传感器的隐形眼镜, 用于监测泪液中葡萄糖水平, 提出了只需佩戴隐形眼镜就可以实时监测人体生理健康指标. 采用二氧化钛溶胶-凝胶膜固定葡萄糖氧化酶, 利用萘酚(Nafion)保护层降低泪膜中存在的干扰物质(如抗坏血酸、乳酸和尿素等). 经过一些测试, 该传感器具有高灵敏度(240 μA·cm-2·mmol/L)和良好的重现性. 但是仍然有很多地方需要改进, 如增强稳定性、更高效的生物相容性等问题.
在此基础上, Falk团队[37]设计了一种以“智能”电子隐形眼镜为电源的生物燃料电池(如图 1所示), 在人体泪液中以直接电子转移为基础的酶生物燃料电池可以产生大量的电能. 采用直径为100 μm的金线, 表面覆盖17 nm金纳米粒子, 分别以脱氢酶和胆红素氧化酶为电极的催化剂, 制备三维纳米结构的微电极. 记录了在人泪液中微型设备产生的以下特性: 0.5 V的开路电压, 产生约为1 μW·cm-2的功率密度, 稳定性可达20 h的工作半衰期. 后续Falk团队[38]设计使用了非酶阳极氧化泪液中的抗坏血酸, 在开路电压为0.25 V时, 产生功率为3.1 μW·cm-2. 两种设计均使用了改良的金线电极和酶阴极, 并证明了生物燃料电池可以从眼泪中产生能量. 但是值得注意的是, 电极材料的选择应具有柔性、导电性, 并且可以装载催化剂.
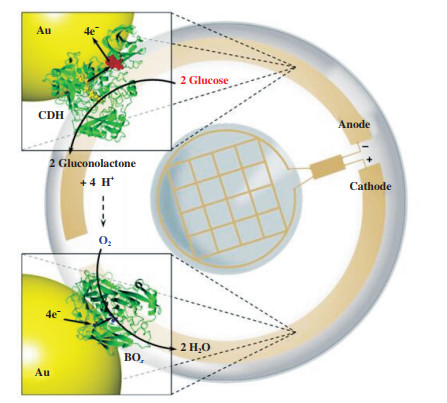
|
图 1 智能隐形眼镜的酶生物燃料电池原理示意图 Fig.1 Schematic diagram of enzyme biofuel cell for intelligent contact lens |
此外, Reid团队[39]采用巴克纸电极制备了一种隐形眼镜电池, 巴克纸阳极由聚亚甲基绿和水凝胶组成, 巴克纸阴极由1-吡啶甲基蒽-2羧酸盐进行改性, 通过人工合成泪液测试结果表明: 开路电压为0.413±0.06 V, 电流密度为61.3±2.9 μA·cm-2, 功率密度为8.01±1.4 μW·cm-2, 稳定性可长达17 h. 然而, 由于使用吸附的NAD+作为辅助因子, 聚甲基绿自身具有解吸作用, 导致了固有的不稳定性, 并增加了辅助因子扩散的复杂性. 因此, 为了酶生物燃料电池阴极不在受限制, 在2016年Reid团队[40]建立了一种计算模型来研究碳纳米管连通性和表面活性对生物燃料电池阴极电流密度的影响. 该装置产生的最大电流为22±4 μA·cm-2, 功率密度为2.4±0.9 μW·cm-2(电压为0.163 V), 开路电压为0.44±0.08 V. 我们提出的隐形眼镜生物燃料电池比之前报道[41]的原型更适合于戴在眼睛上.
最近, Xiao等[41]采用电化学脱碳法制备了柔性纳米多孔金电极(NPG), 电极分别被乳酸氧化酶和胆红素氧化酶修饰, 用作乳酸/O2酶生物燃料电池. 通过在人泪液(3 mmol/L乳酸)中进行测试可知, 最大功率密度为1.7 ± 0.1 μW·cm-2, 开路电压为380 ± 28 mV, 经过5.5 h的测试, EBFCs仍保持20%的最原始的输出功率. 此实验证明了开发一种自供电的隐形眼镜上的乳酸生物传感器成为可能, 并且EBFCs的功率密度可以与乳酸浓度相关.
近年来, 从泪液中获取能量来源的生物燃料电池或生物传感器得到了大家的广泛关注, 这类电池有望成为可穿戴电子设备的自主电源. 然而, 面临的主要挑战是电极材料的选择, 更重要的是还需要提供合适大小的电源.
3 基于汗液的酶生物燃料电池人体汗液含有丰富的人体健康状况信息, 是一种优良的生物液体, 汗液分析可作为其他疾病的重要诊断工具. 可穿戴式传感器在过去几年受到了广泛关注[42-44], 这些非侵入性设备为持续监测穿戴者的健康提供了可观的前景. 许多嵌入纺织品或直接贴在人体皮肤上的可穿戴设备都得到了证明.
Yang团队[45]是第一个将传感器直接印刷在内衣的腰带上, 该印花织物传感器具有较强的鲁棒性, 能够承受反复的弯曲和拉伸应力. 在此基础上, Guinovart团队[46]展示了一种基于绷带的打印pH传感器, 用于伤口监测(如图 2所示). 在测试的过程中, 值得注意的是广泛的动态响应, 缺乏滞后效应和抗机械应力, 因此还需要进一步地探索与研究. 这种pH敏感创可贴结合了柔性丝网印刷电极和固态电位法的最新进展, 为监测伤口愈合状况提供了一种新的、有吸引力的方法.
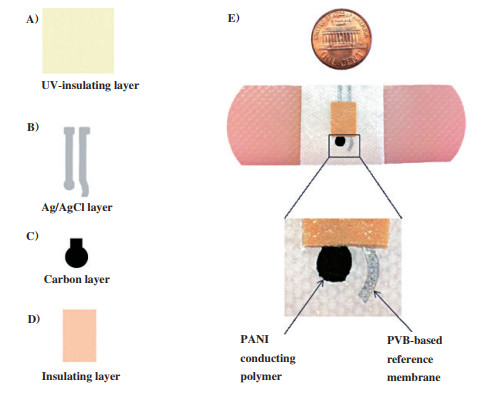
|
图 2 基于绷带的打印pH传感器 Fig.2 Printed pH sensor based on bandages |
在此基础上, Joseph团队[47]在2013年设计了一种以非浸入性的、连续的方式从人体汗液中产生大量能量的“临时转移纹身生物燃料电池(tBFCs)”. 采用丝网印刷技术将电池形状设计成“UC”, 阳极(U): CNT/TTF/LOx/Chitosan, 阴极(C): Pt黑修饰的碳电极. 经过测试可知, 功率密度可达70 μW·cm-2.
为了进一步提高可穿戴生物燃料电池的稳定性, Joseph团队[48]在2017年制造了一种柔软、可拉伸、高功率密度的电子皮肤生物燃料电池(如图 3所示)来获取汗液中能量. 通过独特的组合光刻图形可拉伸的电子框架与丝网印刷技术, 高密度填充三维碳纳米管为基础的生物阳极和阴极载体材料, 将EBFCs设计成一个可拉伸的“岛桥”结构. 然而, 一个关键的挑战是缺乏相应薄的可穿戴式电源, 一种有前途的解决办法就是开发一种可穿戴式能源收集器, 例如, 利用人体汗液作为燃料为可穿戴生物燃料电池发电, 在生理相关浓度的乳酸存在下, 可以产生1.2 mW·cm-2的功率. 此次设计展示了第一个柔软、可拉伸、高功率的可穿戴电子皮肤的例子, 在能源收集设备领域具有重大发现.
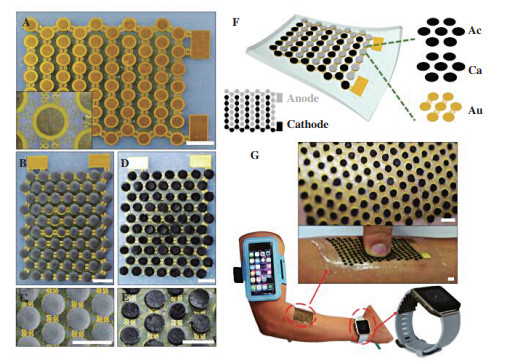
|
图 3 柔软、可伸缩的穿戴式生物燃料电池 Fig.3 A flexible, scalable wearable biofuel cell |
最近, Wang团队[49]采用紫外化学镀技术, 制备了一种基于对苯二甲酸乙二醇酯(PET)薄膜的金电极(PGE)葡萄糖传感器. 通过紫外照射等步骤, 在PET基片表面引入电极图案, 经测试和优化研究, 制备的生物传感器测定汗液中葡萄糖水平, 表现出良好的性能. 然而, Tolga等[50]首次采用硅烷法成功制备了不同厚度的Mn3O4薄膜, 在不同的人工汗液浓度下进行测试, 结果发现Mn3O4薄膜对不同汗液浓度非常敏感, 将有助于研究人员进一步探索这种新型材料的传感能力.
随着社会的发展, 以汗液为燃料的可穿戴式电子设备, 因其在医学等领域的广泛应用而引起了学术界和工业界的广泛兴趣. 然而, 在实际用例中面临着许多关键挑战, 如可穿戴生物燃料系统缺乏用于适形皮肤接触的柔软、可拉伸的特性, 在未来的研究中应试图通过开发可伸缩的生物燃料电池来解决皮肤的适形问题.
4 其它类型在体酶生物燃料电池酶生物燃料电池也可在动植物体内获取能量, 早在2003年, Mano团队[51]设计了一种微型无隔间葡萄糖/O2生物燃料电池, 将其植入葡萄中, 实验表明电池功率的输出达到0.35 μW·cm-2, 比早先报道相比其功率高12倍. 在此基础上, 此团队又进行了动物实验, 尝试将生物燃料电池植入大型蚱蜢体内, 结果实验失败了, 没有产生电力. 后来了解到, 许多昆虫体内的主要糖份是海藻糖, 海藻糖与葡萄糖不同, 海藻糖没有C1醇功能, 而C1醇的氧化作用是催化酶的作用. 因此, 在2006年Mano和Heller等[52]研究了一种以昆虫体液中的海藻糖为燃料的生物燃料电池, 迈向昆虫中起作用的一步. 接下来, Shoji K等[53]将酶生物燃料电池植入蟑螂体内, 通过循环伏安曲线(CV)进行电化学测试, 以此来分析燃料电池在体内的电化学反应.
此外, MacVittie等[54]将配对电极植入两只龙虾体内. 其中一只龙虾体内植入的一对电极产生的开路电压为550 mV, 不足以激活作为示例电子设备的电子表. 将电极植入两只龙虾体内并串联起来, 产生的双输出电压足以使手表正常工作. 将以酶为基础的生物燃料电池植入蛤蜊体内并串联起来也得到了类似的结果.
最近, BFCs被植入不同的动物体内, 如大鼠[55-59]、兔子[60]、龙虾[61]等动物, 两年前, Sales[55]等团队研究了一种输出功率密度高的葡萄糖/O2混合酶BFCs首次在留置导管的活体大鼠胸部植入手术. 在此基础上, Pereira等[61]采用柔性碳纤维电极将酶生物燃料电池微型化, 为植入体生物燃料电池提供动力. 将酶生物燃料电池植入大鼠和活蚂蚱体内, 用于环境监测, 目前正在进行研究.
第一个生物燃料电池从植物中丰富的“燃料”中提取能量的例子已经被报道, 因此Reuillard等[62]将酶生物燃料电池植入橙浆中(如图 4所示), 利用橙浆中的葡萄糖和果糖获取能量, 但需要注意的是, 利用丰富的生物燃料和氧作为电子受体时的生物燃料电池, 其开路电压在热力学上受到生物燃料氧化电位与还原电位差的限制. 此次实验延续了不同的可植入生物燃料电池用于激活电子设备的研究路线, 主要用来对环境进行监测.
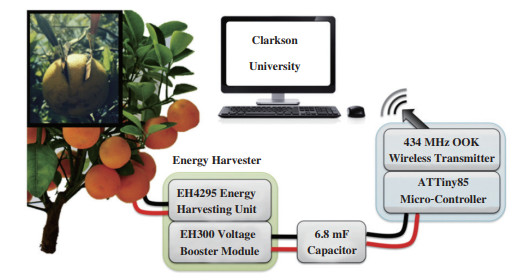
|
图 4 植入橙浆中的酶生物燃料电池 Fig.4 Enzyme biofuel cell implanted in orange pulp |
近年来, 人们对在体生物燃料电池的研究与发展越来越感兴趣. 然而对于植入或可穿戴式生物燃料电池来说面临着很多挑战:
(1)生物相容性问题: 植入式生物燃料电池在体内必须具有足够的生物相容性, 并且不会引起任何化学或生物上的不良反应;
(2)选择合适大小的电源: 可穿戴式电子设备在体外应具有薄的、柔软的、可伸缩等特性, 以便能够与人体皮肤进行共形整合, 而不会引起身体强烈的反应;
(3)生物电极的稳定性: 在体的酶生物燃料电池需要具有良好的稳定性, 可在活的生命体内进行长期的操作, 最终用于人类的应用.
6 总结与展望综述了近年来酶生物燃料电池在体液发电中的研究与进展, 生物燃料电池是一种很有前途的设备, 可以提供从生理资源中提取的电能. 然而, 通过一些应用, 也强调了在体酶生物燃料电池面临的挑战. 随着人们对在体酶生物燃料电池发展越来越感兴趣, 在不久的将来, 我们将会看到更多领域的实际应用.
| [1] |
Zhao C, Gai P, Song R, et al. Nanostructured materialbased biofuel cells: Recent advances and future prospects[J]. Chem Soc Rev, 2017, 46(5): 1545–1564.
DOI:10.1039/C6CS00044D |
| [2] |
Cooney M J, Roschi E, Marison I W, et al. Physiologic studies with the sulfate-reducing bacterium Desulfovibrio desulfuricans: Evaluation for use in a biofuel cell[J]. Enzyme Microb Technol, 1996, 18(5): 358–365.
DOI:10.1016/0141-0229(95)00132-8 |
| [3] |
a. Bandodkar A J. Wearable biofuel cells: Past, present and future[J]. J Electrochem Soc, 2016, 164(3): H3007. b. Cheng Rui-chen(程瑞琛), Liu Yan-li(刘艳丽), Dai Da-zhang(戴大章). Recent progress in computer aided design and engineering of glycosidases(计算机辅助糖苷酶分子设计与改造研究进)[J]. J Mol Catal (China) (分子催化), 2020, 34(5): 475-483. c. Zhang Can(张灿), Jiang Guo-fang(姜国芳), Yang Jiang-nan(杨江楠), et al. Research progress of immobilized lipase on porous materials(多孔材料固定化脂肪酶的研究进展)[J]. J Mol Catal (China)(分子催化), 2020, 34(4): 378-396. |
| [4] |
Kwon C H, Lee J A, Choi Y B, et al. Stability of carbon nanotube yarn biofuel cell in human body fluid[J]. J Power Sources, 2015, 286: 103–108.
DOI:10.1016/j.jpowsour.2015.03.140 |
| [5] |
a. Bandodkar A J, Wang J. Wearable biofuel cells: A review[J]. Electroanalysis, 2016, 28(6): 1188-1200. b. Liu Qing-yun(刘青云), Xin Jia-ying(辛嘉英), Sun Li-rui(孙立瑞), et al. Research progress of nanogold particles enzyme biohybrid(纳米金杂化酶研究进展)[J]. J Mol Catal (China)(分子催化), 2020, 34(3): 252-260. |
| [6] |
Huang Xing-can, Zhang Li-li, Zhang Zhao, et al. Wearable biofuel cells based on the classification of enzyme for high power outputs and lifetimes[J]. Biosens Bioelectron, 2019, 124: 40–52.
|
| [7] |
Calabrese Barton S, Gallaway J, Atanassov P. Enzymatic biofuel cells for implantable and microscale devices[J]. Chem Rev, 2004, 104(10): 4867–4886.
DOI:10.1021/cr020719k |
| [8] |
Rasmussen M, Ritzmann R E, Lee I, et al. An implantable biofuel cell for a live insect[J]. J Am Chem Soc, 2012, 134(3): 1458–1460.
DOI:10.1021/ja210794c |
| [9] |
Szczupak A, Halámek J, Halámková L, et al. Living battery-biofuel cells operating in vivo in clams[J]. Energy Environ Sci, 2012, 5(10): 8891–8895.
DOI:10.1039/c2ee21626d |
| [10] |
Halámková L, Halámek J, Bocharova V, et al. Implanted biofuel cell operating in a living snail[J]. J Am Chem Soc, 2012, 134(11): 5040–5043.
DOI:10.1021/ja211714w |
| [11] |
Jeerapan I, Sempionatto J R, Pavinatto A, et al. Stretchable biofuel cells as wearable textile-based selfpowered sensors[J]. J Mater Chem A, 2016, 4(47): 18342–18353.
DOI:10.1039/C6TA08358G |
| [12] |
Chen Xiao-hong, Yin Lu, Lv Jian, et al. Stretchable and flexible buckypaper-based lactate biofuel cell for wearable electronics[J]. Adv Funct Mater, 2019, 29(46): 1905785.
DOI:10.1002/adfm.201905785 |
| [13] |
Silva C A, Lv Jian, Yin Lu, et al. Liquid metal based island-bridge architectures for all printed stretchable electrochemical devices[J]. Adv Funct Mater, 2020, 30(30): 2002041.
DOI:10.1002/adfm.202002041 |
| [14] |
Kim S J, We J H, Cho B J. A wearable thermoelectric generator fabricated on a glass fabric[J]. Energy Environ Sci, 2014, 7(6): 1959–1965.
DOI:10.1039/c4ee00242c |
| [15] |
Dagdeviren C, Yang B D, Su Ye-wang, et al. Conformal piezoelectric energy harvesting and storage from motions of the heart, lung, and diaphragm[J]. Proc Natl Acad Sci, 2014, 111(5): 1927–1932.
DOI:10.1073/pnas.1317233111 |
| [16] |
Wang Jie, Li Sheng-ming, Yi Fang, et al. Sustainably powering wearable electronics solely by biomechanical energy[J]. Nat Commun, 2016, 7: 1–8.
|
| [17] |
Mano N, Mao F, Heller A. A miniature biofuel cell operating in a physiological buffer[J]. J Am Chem Soc, 2002, 124(44): 12962–12963.
DOI:10.1021/ja028514g |
| [18] |
Heller A, Feldman B. Electrochemical glucose semsor and their applications in diabetes management[J]. Chem Rev, 2008, 108(7): 2482–2505.
DOI:10.1021/cr068069y |
| [19] |
Coman V, Vaz-Domínguez C, Ludwig R, et al. A membrane-, mediator-, cofactor-less glucose/oxygen biofuel cell[J]. Phys Chem Chem Phys, 2008, 10(40): 6093–6096.
DOI:10.1039/b808859d |
| [20] |
Kim J, Kim S I, Yoo K H. Polypyrrole nanowire-based enzymatic biofuel cells[J]. Biosens Bioelectron, 2009, 25(2): 350–355.
DOI:10.1016/j.bios.2009.07.020 |
| [21] |
Kim J, Yoo K H. Glucose oxidase nanotube-based enzymatic biofuel cells with improved laccase biocathodes[J]. Phys Chem Chem Phys, 2013, 15(10): 3510–3517.
DOI:10.1039/c3cp00074e |
| [22] |
Ammam M, Fransaer J. Glucose oxidase and 1-butyl-3-methylimidazolium deposited by AC-electrophoresis on Pt as a glucose bioanode for biofuel cells[J]. Electrochim Acta, 2012, 81: 129–137.
DOI:10.1016/j.electacta.2012.07.084 |
| [23] |
Kwon C H, Lee S H, Choi Y B, et al. High-power biofuel cell textiles from woven biscrolled carbon nanotube yarns[J]. Nat Commun, 2014, 5(1): 1–7.
|
| [24] |
Yazdi A A, Preite R, Milton R D, et al. Rechargeable membraneless glucose biobattery: Towards solid-state cathodes for implantable enzymatic devices[J]. J Power Sources, 2017, 343: 103–108.
DOI:10.1016/j.jpowsour.2017.01.032 |
| [25] |
Lee H, Hong Y J, Baik S, et al. Enzyme-based glucose sensor: From invasive to wearable device[J]. Adv Healthcare Mater, 2018, 7(8): 1701150.
DOI:10.1002/adhm.201701150 |
| [26] |
Bandodkar A J, Wang J. Non-invasive wearable electrochemical sensors: A review[J]. Trends Biotechnol, 2014, 32(7): 363–371.
DOI:10.1016/j.tibtech.2014.04.005 |
| [27] |
March W F, Mueller A, Herbrechtsmeier P. Clinical trial of a noninvasive contact lens glucose sensor[J]. Diabetes Technol Ther, 2004, 6(6): 782–789.
DOI:10.1089/dia.2004.6.782 |
| [28] |
Alexeev V L, Sasmita D, Finegold D N, et al. Photonic crystal glucose-sensing material for noninvasive monitoring of glucose in tear fluid[J]. Clin Chem, 2004, 50(12): 2353–2360.
DOI:10.1373/clinchem.2004.039701 |
| [29] |
Badugu R, Lakowicz J R, Geddes C D. Enhanced fluorescence cyanide detection at physiologically lethal levels: Reduced ICT-based signal transduction[J]. J Am Chem Soc, 2005, 127(10): 3635–3641.
DOI:10.1021/ja044421i |
| [30] |
Badugu R, Lakowicz J R, Geddes C D. The noninvasive continuous monitoring of physiological glucose using a novel monosaccharide-sensing contact lens[J]. Anal Chem, 2004, 76(3): 610–618.
DOI:10.1021/ac0303721 |
| [31] |
Badugu R, Lakowicz J R, Geddes C D. A glucose sensing contact lens: A non-invasive technique for continuous physiological glucose monitoring[J]. J Fluoresc, 2003, 13: 371–374.
DOI:10.1023/A:1026103804104 |
| [32] |
Badugu R, Lakowicz J R, Geddes C D. Ophthalmic glucose sensing: A novel monosaccharide sensing disposable and colorless contact lens[J]. Analyst, 2004, 129(6): 516–521.
DOI:10.1039/b314463c |
| [33] |
Iguchi S, Kudo H, Saito T, et al. A flexible and wearable biosensor for tear glucose measurement[J]. Biomed Microdevices, 2007, 9(4): 603–609.
DOI:10.1007/s10544-007-9073-3 |
| [34] |
Kagie A, Bishop D K, Burdick J, et al. Flexible rolled thick-film miniaturized flow-cell for minimally invasive amperometric sensing[J]. Electroanalysis, 2008, 20(14): 1610–1614.
DOI:10.1002/elan.200804253 |
| [35] |
Toghill K E, Xiao L, Phillips M A, et al. The nonenzymatic determination of glucose using an electrolytically fabricated nickel microparticle modified boron-doped diamond electrode or nickel foil electrode[J]. Sens Actuators B, 2010, 147(2): 642–652.
DOI:10.1016/j.snb.2010.03.091 |
| [36] |
Yao H, Shum A J, Cowan M, et al. A contact lens with embedded sensor for monitoring tear glucose level[J]. Biosens Bioelectron, 2011, 26(7): 3290–3296.
DOI:10.1016/j.bios.2010.12.042 |
| [37] |
Falk M, Andoralov V, Blum Z, et al. Biofuel cell as a power source for electronic contact lenses[J]. Biosens Bioelectron, 2012, 37(1): 38–45.
DOI:10.1016/j.bios.2012.04.030 |
| [38] |
Mate D M, Gonzalez-Perez D, Falk M, et al. Blood tolerant laccase by directed evolution[J]. Chem Biol, 2013, 20(2): 223–231.
DOI:10.1016/j.chembiol.2013.01.001 |
| [39] |
Reid R C, Minteer S D, Gale B K. Contact lens biofuel cell tested in a synthetic tear solution[J]. Biosens Bioelectron, 2015, 68: 142–148.
DOI:10.1016/j.bios.2014.12.034 |
| [40] |
Reid R C, Jones S R, Hickey D P, et al. Modeling carbon nanotube connectivity and surface activity in a contact lens biofuel cell[J]. Electrochim Acta, 2016, 203: 30–40.
DOI:10.1016/j.electacta.2016.04.012 |
| [41] |
Xiao X, Siepenkoetter T, Conghaile P O, et al. Nanoporous gold-based biofuel cells on contact lenses[J]. ACS Appl Mater Interfaces, 2018, 10(8): 7107–7116.
DOI:10.1021/acsami.7b18708 |
| [42] |
Windmiller J R, Wang J. Wearable electrochemical sensors and biosensors: A review[J]. Electroanalysis, 2013, 25(1): 29–46.
DOI:10.1002/elan.201200349 |
| [43] |
Kim D H, Lu N, Ghaffari R, et al. Inorganic semiconductor nanomaterials for flexible and stretchable biointegrated electronics[J]. NPG Asia Mater, 2012, 4(4): e15.
DOI:10.1038/am.2012.27 |
| [44] |
Hammock M L, Chortos A, Tee B C K, et al. 25th Anniversary article: The evolution of electronic skin (e-skin): Abrief history, design considerations, and recent progress[J]. Adv Mater, 2013, 25(42): 5997–6038.
DOI:10.1002/adma.201302240 |
| [45] |
Yang Yang-Li, Chuang Min-Chen, Lou Shyh-Liang, et al. Thick-film textile-based amperometric sensors and biosensors[J]. Analyst, 2010, 135(6): 1230–1234.
DOI:10.1039/b926339j |
| [46] |
Guinovart T, Valdés-Ramírez G, Windmiller J R, et al. Bandage-based wearable potentiometric sensor for monitoring wound pH[J]. Electroanalysis, 2014, 26(6): 1345–1353.
DOI:10.1002/elan.201300558 |
| [47] |
Jia W, Valdés-Ramírez G, Bandodkar A J, et al. Epidermal biofuel cells: Energy harvesting from human perspiration[J]. Angew Chem Int Ed, 2013, 52(28): 7233–7236.
DOI:10.1002/anie.201302922 |
| [48] |
Bandodkar A J, You J M, Kim N H, et al. Soft, stretchable, high power density electronic skin-based biofuel cells for scavenging energy from human sweat[J]. Energy Environ Sci, 2017, 10(7): 1581–1589.
DOI:10.1039/C7EE00865A |
| [49] |
Wang Yu-sheng, Wang Xiao-qi, Lu Wei, et al. A thin film polyethylene terephthalate (PET) electrochemical sensor for detection of glucose in sweat[J]. Talanta, 2019, 198: 86–92.
DOI:10.1016/j.talanta.2019.01.104 |
| [50] |
Sahin B, Aslan B, Kaya T. A novel amperometric sweat sensor approach through characterization of Hausmannite (Mn3O4) thin films[J]. Mater Sci Semicondu Process, 2019, 98: 1–6.
DOI:10.1016/j.mssp.2019.03.022 |
| [51] |
Mano N, Mao F, Heller A. Characteristics of a miniature compartment-less glucose/O2 biofuel cell and its operation in a living plant[J]. J Am Chem Soc, 2003, 125(21): 6588–6594.
DOI:10.1021/ja0346328 |
| [52] |
Mano N, Soukharev V, Heller A. A laccase-wiring redox hydrogel for efficient catalysis of O2 electroreduction[J]. J Phys Chem B, 2006, 110(23): 11180–11187.
DOI:10.1021/jp055654e |
| [53] |
Shoji K, Akiyama Y, Suzuki M, et al. Insect biofuel cells using trehalose included in insect hemolymph leading to an insect-mountable biofuel cell[J]. Biomed Microdevices, 2012, 14(6): 1063–1068.
DOI:10.1007/s10544-012-9706-z |
| [54] |
MacVittie K, Halámek J, Halámková L, et al. From "cyborg" lobsters to a pacemaker powered by implantable biofuel cells[J]. Energy Environ Sci, 2013, 6(1): 81–86.
DOI:10.1039/C2EE23209J |
| [55] |
Sales F C P F, Iost R M, Martins M V A, et al. An intravenous implantable glucose/dioxygen biofuel cell with modified flexible carbon fiber electrodes[J]. Lab Chip, 2013, 13(3): 468–474.
DOI:10.1039/C2LC41007A |
| [56] |
Cinquin P, Gondran C, Giroud F, et al. A glucose biofuel cell implanted in rats[J]. PloS One, 2010, 5(5): e10476.
DOI:10.1371/journal.pone.0010476 |
| [57] |
Zebda A, Cosnier S, Alcaraz J P, et al. Single glucose biofuel cells implanted in rats power electronic devices[J]. Sci Rep, 2013, 3(1): 1–5.
|
| [58] |
Cheng H, Yu P, Lu X, et al. Biofuel cell-based selfpowered biogenerators for online continuous monitoring of neurochemicals in rat brain[J]. Analyst, 2013, 138(1): 179–185.
DOI:10.1039/C2AN36385B |
| [59] |
Castorena-Gonzalez J A, Foote C, MacVittie K, et al. Biofuel cell operating in vivo in rat[J]. Electroanalysis, 2013, 25(7): 1579–1584.
DOI:10.1002/elan.201300136 |
| [60] |
Miyake T, Haneda K, Nagai N, et al. Enzymatic biofuel cells designed for direct power generation from biofluids in living organisms[J]. Energy Environ Sci, 2011, 4(12): 5008–5012.
DOI:10.1039/c1ee02200h |
| [61] |
Pereira A R, de Souza J C P, Iost R M, et al. Application of carbon fibers to flexible enzyme electrodes[J]. J Electroanal Chem, 2016, 780: 396–406.
DOI:10.1016/j.jelechem.2016.01.004 |
| [62] |
Reuillard B, Le Goff A, Agnès C, et al. Direct electron transfer between tyrosinase and multi-walled carbon nanotubes for bioelectrocatalytic oxygen reduction[J]. Electrochem Commun, 2012, 20: 19–22.
DOI:10.1016/j.elecom.2012.03.045 |
 2021, Vol. 35
2021, Vol. 35


