2. 河北省数据中心相变热管理技术创新中心, 河北 沧州 061000
2. Hebei Thchnology Innovation Center of Phase Change Thermal Management of Data Center, Cangzhou 061000, China
以碳为基础的化石燃料虽然为我们的日常生活提供了能源, 但同时也带来了环境的污染和全球气候变暖等问题, 因此有必要开发一种干净清洁可再生的新能源. 最近20年的研究发现, 氢气是非常理想的选择, 因其具有超高的能量密度, 且不会对环境造成威胁. 将能量储存在氢气当中, 不仅能够用于发电, 还能够被用于各种各样其它的领域, 例如精炼石油、生产液氨、为甲醇经济提供支持等[1-3]. 氢气的获取有多种途径, 其中最简单最有前途的方法就是电催化分解水[4-5]. 水的分解方法包括两个半反应: 析氢反应HER(2H++2e-=H2)还原反应和析氧反应OER(2H2O=4H++4e-+O2)氧化反应[6]. 我们所研究的是发生在阴极的析氢反应.
一种好的电催化材料应该具有高稳定性、低毒、易获得和低成本等特性. 铂是公认的最好的催化材料, 但因其昂贵的价格而没有被广泛使用. 镍、铅以及其合金等新材料都已经被研究过了, 他们在析氢反应中表现出了优秀的潜质[7-8]. 由于镍合金存在很多缺点[7], 其已被铅及其合金代替, 但是这些材料数量少而且价格贵[9-10]. 不久前, 研究者们致力于寻找资源丰富价格低廉的电催化材料. 许多有潜力的材料例如过渡金属、过渡金属氧化物、碳化物、磷化物、均相催化剂、黄铁矿型磷化钴和氮硼掺杂的石墨烯都已经被研究了[11-16]. 二维纳米材料由于其独特的优越性得到了极大的关注, 并且被证明是电化学中最有前途的催化剂. 这是由于二维材料一方面具有大量裸露的表面积, 这些表面积带来了大量的催化位点, 另一方面人们可以很容易通过化学方法改善其催化性能. 最近, 人们研究了很多二维材料例如石墨烯、MoS2、VS2、VSe2、WS2、PtS2、Mo2C、硼烯等都在析氢反应上展示出了很好的催化性能[14, 17-25].
对于过渡金属碳化物(TMCs)的研究要追溯到1973年, Levy等[26]首先研究了碳化钨的类铂催化性质, 之后便有很多关于过渡金属碳化物的催化性能的研究, 结果表明, TMCs既低廉又有很高的稳定性, 在许多反应中表现出有趣的晶体性质[27-29]. 块状TiC结构具有高熔点、高硬度、抗腐蚀、抗氧化等优点, 因此对其切面的HER研究也比较多. 2017年, Silveri F等[28]研究了TiC、VC、ZrC和NbC的(001)、(011)和(111)表面, 计算表明这4种结构的(001)表面均具备最优的催化潜能. 2019年, Lin等[29]也研究了TiC(100)表面的HER催化性能, 计算表明在低覆盖率下吉布斯自由能可达0.13 eV, 施加应力后可使其达到0 eV, 增加厚度也可以改善其HER的催化性能. TiC(100)表面是一个双层的二维片结构, 每个单层表面是平面结构, 且钛原子和碳原子结合成四角构型. 值得注意的是, 二维催化剂的选取往往都是通过块状结构的切面得到的, 鲜有研究单层稳定的二维结构的催化性能的. 2012年, Zhang等[30]构建了一种新奇的四角TiC单层片结构, 其表面是zigzag的, 该结构具有很高的结构稳定性和热稳定性. 基于该四角TiC单层片结构, 计算了其电子性质和能带结构. 选取了5个可能的H原子的配位点, 计算得到最合适的HER的催化位点, 并进一步着重研究该单层片在不同覆盖率下HER的催化性能及电子性质. 我们从一个新的角度给理论和实验工作者寻找合适的HER催化剂提供了思路, 为设计出高性能的HER催化剂提供了帮助.
1 计算方法运用基于密度泛函理论的第一性原理Quantum Espresso(QE)计算软件包[31], 计算中电子与电子间在相互作用中交换相关效应是通过广义梯度近似GGA的PBE计算方案来处理的, 电子波函数通过一平面波基矢组扩展[32]. 采用22的超胞计算时, Monkhorst-Pack型K点网格采用的是551, 电子平面波的能量截断能设置为了544 eV, 电荷密度截断能设置为2176 eV. 为了避免周期性层状结构之间的相互作用, 真空层设置为1.5 nm. 迭代过程中的能量的收敛阈值设成1.36×10-5 eV, 力的原子结构弛豫的收敛标准是1.36×10-2 eV/Broh. 能量计算都在倒易空间中进行. 为了得到稳定精确的计算结果, 笔者先优化晶胞的结构, 得到晶胞参数后, 再优化其内坐标, 在此基础上进行性质的计算.
HER反应中吸附位上的氢的吉布斯自由能用以下公式计算:
| $ \mathit{\Delta} G_{H^{*}}=E_{a d s}+\mathit{\Delta} E_{Z P E}-T \mathit{\Delta} S_{H} $ | (1) |
H*表示吸附在表面上的氢, Eads表示氢的吸附能, ΔEZPE表示吸附态氢原子和氢气分子零点能差, 这个值在0.0到0.04 eV之间浮动[32-35]. T代表室温. ΔSH表示吸附态氢原子和氢气分子熵差, 实验上氢气的取0.4 eV(可查阅NIST数据库), 而事实表明, 吸收位上的振动熵都很小, 可以忽略不计, 因此, ΔSH ≈ -1/2ΔSH0这里ΔSH0是氢气气态时的熵. 因此吉布斯自由能可以写成ΔGH* = Eads + 0.24 eV[34]. 吉布斯自由能的值越趋近于零, 越能表明该材料在HER反应中具有良好的催化性能[34]. 此外, 为了研究HER反应活性, 我们计算了氢在TiC二维片不同吸附位上的吸附能. 吸附能公式为
| $ E_{a d s}=E(\mathrm{TiC}+n \mathrm{H})-E(\mathrm{TiC}+(n-1) \mathrm{H})-\frac{1}{2} E\left(\mathrm{H}_{2}\right) $ | (2) |
其中E(TiC+nH)和E(TiC+(n-1)H)分别代表TiC二维片吸收n个H原子和n-1个H原子后的总能, E(H2)是气相H2的总能量.
2 结果与讨论 2.1 t-TiC单层片的晶格结构基于已有的计算结果, 选择了单层四角TiC二维片结构—t-TiC[30]. 结构性质的计算采用的是4×4×1的超包, 共16个原子. 图 1a是优化后得到的最稳定的t-TiC二维片结构, 其中紫色原子代表钛, 灰色原子代表碳. 超胞的晶格常数在a和b两个方向上分别是0.7516和0.8508 nm, 垂直于表面的真空层厚度选择为1.5. t-TiC结构中每一个碳原子都被周围4个钛原子包围着, 并形成了稳定的钛碳键, a方向上的钛碳键长约为0.203, 而b方向上的钛碳键长为0.212, 类似于有机分子中平面四角碳结构. 从仰视图中可以看到, t-TiC二维结构并不是平面结构, 而是在a方向上呈现出了zigzag结构, 其键角为131°, 因此侧视图呈现出了两层的结构, 且近乎平行. 图 1b是t-TiC片的差分电荷密度图, 绿色代表得到电子, 黄色代表失去电子, 从图中可以明显的看出电子的转移情况, 电子是从Ti原子转移到了C原子. Bader电荷分析表明, 大约有1.6 e的转移. 对于钛原子, 可以明显看出3d轨道结构, 钛原子通过3d轨道与周围的碳原子成键. 从Ti 3d电子态转移出来的自由电子并没有完全局域在C原子上, 而是在四周的Ti-C原子键间自由移动, 尤其是聚集在钛原子左右两侧zigzag原子键周围的最多. 此外可以看出C原子2p态上的电子大部分都聚集在钛碳原子键的上方. 这种非局域性的特点对该结构的稳定性起着关键性的作用, 它不仅降低了形成平面外原子键的活性, 而且增强了平面内Ti -C键的活性.
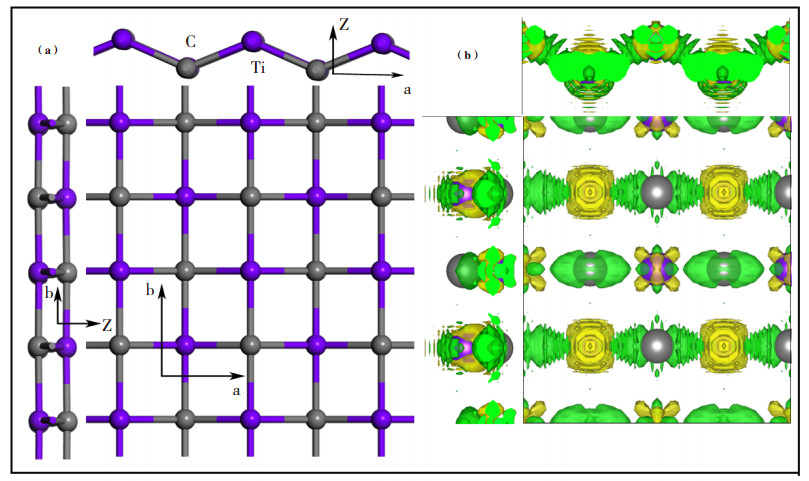
|
图 1 (a)t-TiC片结构的正视图(ab轴)、仰视图(az轴)和侧视图(zb轴)(紫色是钛原子, 灰色是碳原子); (b)t-TiC片结构的差分电荷密度图(绿色代表得电子, 黄色代表失电子, 等值曲面设置为0.02 e/Bohr3) Fig.1 (a) Top and side views of the t-TiC monolayer sheet Here Ti and C atoms are in perple and gray, respectively; (b) Deformation electron density of the t-TiC sheet, Charge accumulation and depletion regions are in green and yellow, respectively, with the isosurface set at 0.02 e/Bohr3 |
为了进一步研究t-TiC片结构的稳定性, 我们还计算了该结构每个原子的结合能, 其结合能计算公式为Ecoh =(E2TiC-E2Ti-E2C)/4, 计算结果表明其每个原子的结合能为-6.94 eV/atom, 负号表明该结构是稳定结构, 数值越大稳定性越高. 该结果比块状的六角TiC结构的-5.85 eV/atom还要低, 因此t-TiC片结构是比较稳定的. 以上结果与Zhang等[30]的计算结果基本一致.
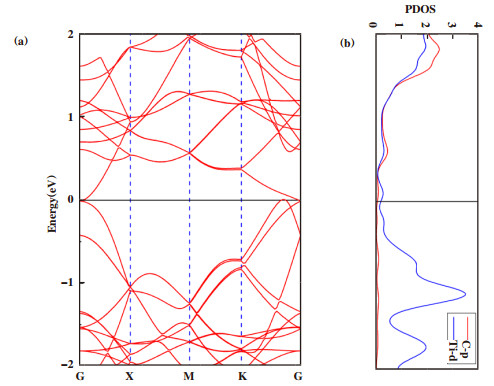
2.2 t-TiC单层片的电子性质下面我们研究了t-TiC片结构的电子性质. 基于PBE函数计算方案, 发现G点附近有能带穿过费米能级(见补充材料图S1a), 因此它具有金属性. 为了进一步研究它的金属行为, 我们计算了t-TiC片的分波态密度(PDOS)(见补充材料图S1b). 分波态密度计算表明, t-TiC片的金属性是Ti的3d轨道和C的2p轨道的共同贡献, 但主要是Ti的3d轨道的贡献. 在导带部分1~2 eV能量窗内, 可以看到C 2p和Ti 3d电子态有强烈的电子共振, 揭示了它们之间具有比较强的相互作用, 因此构成了p-d键, 这种p-d键有利于碳原子和钛原子之间四角结构的形成.
2.3 t-TiC的吸附位选取及其吸附能计算吸附能的大小可以体现H在催化剂表面吸附能力的强弱. 当吸附能小于零时, 说明H原子可以在催化剂表面自发吸附, 且吸附能的值越小, 催化剂表面对H的吸附能力越强. 当吸附能大于零时, 说明H原子不能在催化剂表面自发吸附, 此时吸附能越大, 催化剂表面对H的吸附能力越弱.
我们重点找出了5个吸附位如图 2(a)所示, 析氢反应计算采用的t-TiC基底是4×4超胞, #1位于仰视图中zigzag上层平面Ti原子的正上方(topTi1), #2位于zigzag下层平面Ti原子的正上方(topTi2), #3位于zigzag上层平面C原子的正上方(topC1), #4位于zigzag下层平面C原子的正上方(topC2), #5位于TiC原包的正中心处(center位). 图 2(b)分别是这5个吸附位吸附一个氢原子后的优化构型. 结果表明, topTi2吸附位点经过优化后, 氢原子自发吸附到了近邻topC1位, topTi1和center优化后氢原子均移动到了topC2位, 所考察的这5个位点中, 只有topC2的吸附位最稳定, 碳氢键长没有发生较大变化. 这表明topTi1位点、topTi2位点和center位点均不能有效的吸附氢原子, 对析氢反应呈现催化惰性, 不适宜作为析氢反应位点, 而topC1位和topC2位对析氢反应呈现一定的催化活性, 下面着重研究和探讨这两个吸附位的吸附特性.
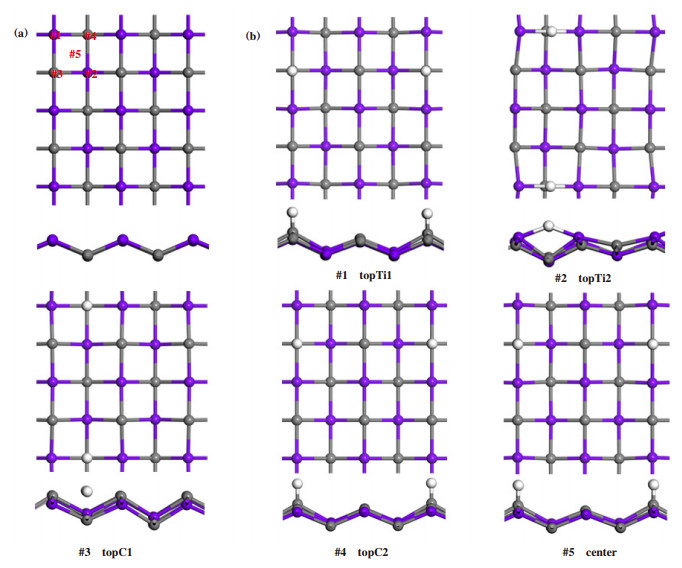
|
图 2 (a)441超胞结构及选取的5个氢原子吸附位点; (b)不同活性位点吸附氢原子的优化结构 Fig.2 (a) The 441 optimized supercell including five categories of hydrogen adsorption sites; (b) Optimized geometries of t-TiC adsorbed by hydrogen atoms (白色代表氢原子) The H is represented by white balls |
我们将t-TiC、Bilayer-TiC(100)、Monolayer-TiC(001)和TiC(011)二维片上Con top位点的吸附能、C-H键长、吉布斯自由能总结到了表 1中, 可以看到表中所列结构在吸附过程中均表现为放热, 其中t-TiC-topC2位的吸附能大小与单层TiC(001)的吸附能相近, 说明Con top位点可以对氢原子做有效吸附.
| 表 1 不同构型的TiC二维片上Con top位氢的吸附能、C-H键长和吉布斯自由能 Table 1 Adsorption energy of hydrogen adsorption distance of C-H and Gibbs free energy on TiC sheet |
大量研究表明, 吉布斯自由能ΔGH是判定催化活性的关键参数. 原则上, 当pH=0时, 吉布斯自由能的理想值应该是趋近于0. 当ΔGH远大于0时, 说明催化剂难以吸附H原子, 进而难以生成大量的H2, 当ΔGH远小于0时, 说明催化剂表面与H原子的结合能力太强, 导致大量H原子吸附在催化剂表面却难以脱附, 最终仍然无法生成H2分子. 因此只有当ΔGH近乎为0时, 才是析氢反应最好的催化剂材料. 我们计算了t-TiC片表面topC1和topC2吸附位点的吉布斯自由能(表 1). 可以看到, 当H吸附在topC1位点时, ΔGH的值最接近0, 表现出比topC2位点更好的HER催化活性. 这是由于topC2位点的吸氢能力比topC1位点吸氢能力强, 反过来说, topC2位点的脱附能力比topC1位点要弱, 因此topC1位点表现出比topC2位点更好的催化活性, 更容易产生H2.
2.4 不同氢覆盖率对析氢反应催化性能的影响接下来考虑不同氢覆盖率对析氢反应催化性能的影响. 图 3(a)和(b)分别显示了topC1位点和topC2位点被氢原子25%、50%、75%、100%吸附的优化结构. 其中θ代表氢的覆盖率, 定义为θ=nH/nsuface-c, 这里的代表被吸附在t-TiC片表面氢原子的个数, nsuface-c指的是等价吸附位的个数, 因为在4×4的超胞中有4个等价吸附位, 因此分母都是4, 覆盖率分别是1/4、2/4、3/4和4/4. 对于这两种吸附位, 正视图中显示基底结构在优化后都保持了原有的构型, 没有发生明显的形变, 但仰视图显示, 晶体拓扑构型均发生了一定的重构, 且t-TiC-topC1位点重构最为明显.
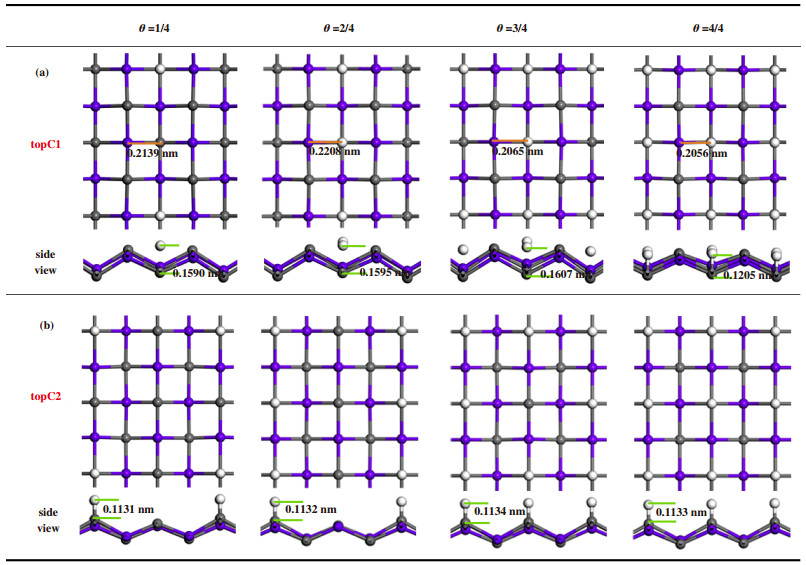
|
图 3 topC1位点和topC2位点在不同覆盖率下的优化构型 Fig.3 Optimized geometries of hydrogen-absorbed t-TiC sheets at different coverages |
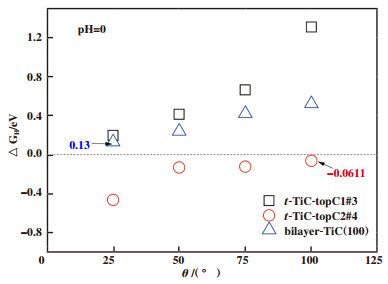
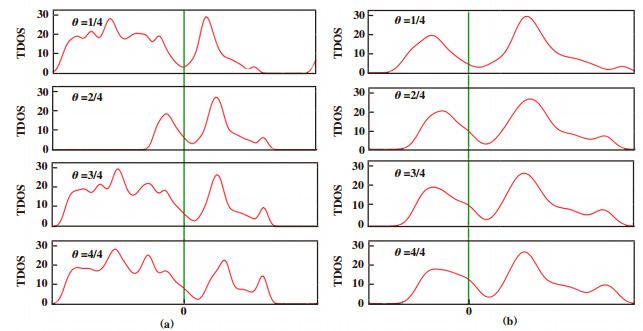
对于t-TiC-topC1位点图 3(a), 随着氢原子覆盖率从25%增至75%, C-H键长保持稳定. 当覆盖率增长为100%时, C-H键长由原来的0.1607左右减少到约0.1205. 以氢原子吸附在中心处topC1位点为例, 橘黄色短线代表的是此处的Ti-C键长, 可以发现当吸附率从25%增加至50%时, Ti-C键长会增加, 即氢原子的吸附会造成四周钛原子的远离, 当吸附率增至75%时, 由于边缘四角处氢原子的吸附, 影响了片内所有钛原子, 此时钛原子往中间偏移, Ti-C键长变短. 当吸附率增至100%时, 片内所有钛原子均处于两个氢原子的中间, 此时Ti-C键长最短. 从图 4(a)的差分电荷密度图中可以看出, 由于金属原子及结构畸变的存在, 电子转移呈现不同程度的非局域化特性, 在只有1个氢原子吸附(25%吸附率)时, 电子转移发生在被吸附碳原子、氢原子和被吸附碳原子四周的钛原子之间, 其他原子不受影响. 当吸附第2个和第3个氢原子后, 片内所有原子均发生了电荷转移, 主要集中在被吸附的碳原子和其四周的钛原子周围, 未被吸附的碳原子也伴有少量电子积聚, 呈现非局域的电子排布, 随着吸附氢原子进一步增加, 电子转移逐渐朝局域化过渡, 即每一个氢原子只与被吸附碳原子和四周的钛原子发生电荷转移, 未被吸附的碳原子几乎无电荷转移. 这4种氢吸附率对应的ΔGH*分别为0.200, 0.412, 0.661和0.891 eV(图 5). 25%的覆盖率具有最小的吉布斯自由能, 随着覆盖率的增加, 吉布斯自由能也在逐渐增加, 因此t-TiC-topC1位点在低覆盖率时表现出较好的HER催化性能. 有意思的是, 通过总态密度的计算可以看出(补充材料图S2), 与未吸附氢原子的t-TiC的态密度相比, 其仍然展示出很好的导电性. 我们得到了与Lin等[29]研究的关于TiC(100)的析氢反应类似的结论.
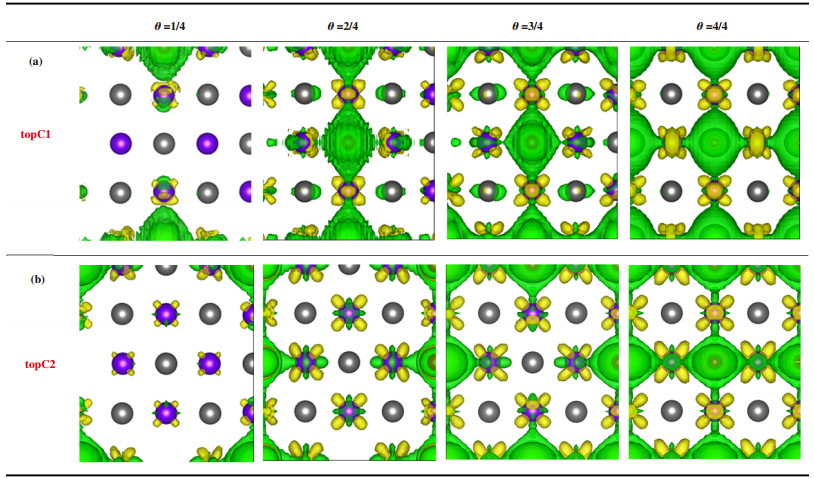
|
图 4 topC1位点和topC2位点在不同覆盖率下的差分电荷密度图 Fig.4 Deformation electron density with different hydrogen coverage (等值面为0.003 e/Bohr3) (with the isosurface set at 0.003 e/Bohr3) |
|
图 5 不同位点吸附氢原子吉布斯自由能 Fig.5 Gibbs free energy of hydrogen adsorbed at different sites |
对于t-TiC-topC2位点图 3(b), 随着氢原子覆盖率从25%增至100%, C-H键长基本不变, 在氢原子的吸附作用下, 被吸附碳原子均离开原位置有所上升. 差分电荷密度也显示出局域化特性(图 4(b)), C原子电子转移仅发生在C-H键附近, 未被吸附的碳原子几乎无电子转移, 在不同氢吸附率下, 电子密度相对均匀, 没有明显变化. 这与C-H键呈现相同的键长完全一致. Bader电荷分析表明, 吸附对表面电子影响很小, topC1和topC2吸附位上的氢原子各保留了一个电子, 且随着覆盖率的增加, topC2位点上氢原子的得电子数很稳定(补充材料表S1). 这4种氢吸附率对应的分别为-0.459, -0.129, -0.121和-0.061 eV(图 5). 在覆盖率为100%时, 吉布斯自由能的值非常接近于0, 这个结果比双层TiC(100)二维片的0.13 eV和Pt的-0.09 eV都要小. 通过总态密度的计算可以看出(补充材料图S2), 与未吸附氢原子的TiC单层片的态密度相比, 随着吸氢原子数量的增加, 导电性能在逐渐增加, 相比topC2位点, 其导电性能增加的更加明显. 因此t-TiC结构的topC2位点在高覆盖率时具有良好的催化性能. 有望成为析氢反应中良好的催化剂.
从上述原子和电子结构分析可以看出, 当氢原子与碳原子成键时的电荷转移呈现非局域化分布时, 吉布斯自由能偏离0 eV较大, 析氢性质较差, 而当电荷转移开始出现局域化分布时, 吉布斯自由能开始趋向于0 eV, 析氢性质较好. t-TiC结构的topC2位点有利于析氢反应的稳定进行. 有望成为析氢反应中良好的催化剂.
3 结论利用密度泛函理论, 优化了四角TiC单层片结构, 得出每个原子的结合能为-6.94 eV/atom, 该结果比块状的六角TiC结构的-5.85 eV/atom还要低, 因此四角TiC二维片是具有结构稳定性的. 能带结构和态密度结果表明四角TiC单层片具有一定的导电性, 因此其具有成为HER催化剂的可能性, 进而在TiC单层片表面选取了5个配位点, 优化后只有topC1位点和topC2位点比较稳定, 具有吸附氢原子的潜力. 最后计算了TiC单层片表面在topC1位点上和topC2位点上的不同氢覆盖率的吉布斯自由能, 并利用差分电荷密度计算系统分析了电荷转移与成键特性. 结果表明, topC2位点的电荷分布随着覆盖率的增加趋于局域化, 当覆盖率达到100%时, 吉布斯自由能达到-0.061 eV, 表明topC2位点在高覆盖率时具有很好的催化性能. 我们的研究为电化学还原水的析氢反应提供了一种有前景的二维催化剂材料.
补充材料Supplementary Information(SI)
|
S1 (a)结构能带图(b)分波态密度图 FigureS 1 Band structure (a) and PDOS (b) of the t-TiC sheet |
| 表 S1 不同覆盖率下的bader电荷分析 Table S1 Bader charge analysis under different hydrogen coverages |
|
S2 topC1和topC2在不同覆盖率下的总态密度图 FigureS 2 The TDOS of topC1 and topC2 under different hydrogen coverages |
| [1] |
Tachibana Y, Vayssieres L, Durrant J R. Artificial phot-osynthesis for solar water-splitting[J]. Nat Photonics, 2012, 6(8): 511–518.
DOI:10.1038/nphoton.2012.175 |
| [2] |
a. Datta A. Modelling doped (Ni, Pd, Pt) sulfur-nitrolic systems as new motifs for storage of hydrogen[J]. Phys Chem Chem Phys, 2009, 11(46): 11054-11059. b. Liu Hong-xia(刘洪霞), Lu Gong-xuan(吕功煊). Research progress for hydrogen evolution from form-aldehyde(甲醛催化制氢的研究进展)[J]. J Mol Catal(China)(分子催化), 2020, 34(3): 210-226. c. Wang Yu-ying(王玉营), Chen Jian-biao(陈建彪), Zhang Xu-qiang(张旭强), et al. Effects of different linear diamines on the performance of photocatalysts for hydrogen production of sensitized graphene(不同直链二胺对敏化石墨烯制氢光催化剂性能的影响)[J]. J Mol Catal(China)(分子催化), 2020, 34(1): 1-7. |
| [3] |
Tamburic B, Dechatiwongse P, Zemichael F W, et al. Process and reactor design for biophotolytichydrogen production[J]. Phys Chem Chem Phys, 2013, 15(26): 10783–10794.
DOI:10.1039/c3cp51866c |
| [4] |
Li X X, Zhao J, Yang J L. Semihydrogenated BN sheet: A promising visible-light driven photocatalyst for water splitting[J]. Sci Rep, 2013, 3: 1858.
DOI:10.1038/srep01858 |
| [5] |
Tan S M, Sofer Z, Luxa J, et al. Aromatic-exfoliated transition metal dichalcogenides: Implications for inherent electrochemistry and hydrogen evolution[J]. ACS Catal, 2016, 6(7): 4594–4607.
DOI:10.1021/acscatal.6b00761 |
| [6] |
Bhanvase B A, Sonawane S H. A review on graphene-TiO2 and doped graphene-TiO2 nanocomposite photocatalyst for water and wastewater treatment[J]. Environ Technol Rev, 2017, 6(1): 1–14.
DOI:10.1080/21622515.2016.1264489 |
| [7] |
Cao S, Chen Y, Wang C J, et al. Highly efficient photocatalytic hydrogen evolution by nickel phosphide nanoparticles from aqueous solution[J]. Chem Commun, 2014, 50(72): 10427–10429.
DOI:10.1039/C4CC05026F |
| [8] |
Safizadeh F, Ghali E, Houlachi G. Electrocatalysis developments for hydrogen evolution reaction in alkaline solutions-a Review[J]. Int J Hydrogen Energy, 2015, 40(1): 256–274.
DOI:10.1016/j.ijhydene.2014.10.109 |
| [9] |
Yang L J, Zhou W J, Hou D M, et al. Porous metallic MoO2-supported MoS2 nanosheets for enhanced elect-rocatalytic activity in the hydrogen evolution reaction[J]. Nanoscale, 2015, 7(12): 5203–5208.
DOI:10.1039/C4NR06754A |
| [10] |
Li H, Du M, Mleczko M J, et al. Kinetic study of hydro-gen evolution reaction over strained MoS2 with sulfur vacancies using scanning electrochemical microscopy[J]. J Am Chem Soc, 2016, 138(15): 5123–5129.
DOI:10.1021/jacs.6b01377 |
| [11] |
Wan C, Regmi Y N, Leonard B M. Multiple phases of mo-lybdenum carbide as electrocatalysts for the hydrogen evolution reaction[J]. Angew Chemie-Int Ed, 2014, 53(25): 6407–6410.
DOI:10.1002/anie.201402998 |
| [12] |
Kelly T G, Hunt S T, Esposito D V, et al. Monolay-erpalladium supported on molybdenum and tungsten carbidesubstrates as low-cost hydrogen evolution reaction (HER)electrocatalysts[J]. Int J Hydrogen Energy, 2013, 38(14): 5638–5644.
DOI:10.1016/j.ijhydene.2013.02.116 |
| [13] |
Das R K, Wang Y, Vasilyeva S V, et al. Extraordinary hydrogen evolution andoxidation reaction activity from carbon nanotubes andgraphitic carbons[J]. ACS Nano, 2014, 8(8): 8447–8456.
DOI:10.1021/nn5030225 |
| [14] |
Sathe B R, Zou X X, Asefa T. Metal-free B-doped graphene withefficient electrocatalytic activity for hydrogen evolutionreaction[J]. Catal Sci Technol, 2014, 4(7): 2023–2030.
DOI:10.1039/C4CY00075G |
| [15] |
Caban-Acevedo M, Stone M L, Schmidt J R, et al. Efficient hydrogen evolution catalysis usingternary pyrite-type cobalt phosphosulphide[J]. Nat Mater, 2015, 14(12): 1245–1251.
DOI:10.1038/nmat4410 |
| [16] |
Dolganov A V, Tarasova O V, Ivleva A Y, et al. Iron(Ⅱ) clathrochelates aselectrocatalysts of hydrogen evolution reaction at low pH[J]. Int J Hydrogen Energy, 2017, 42(44): 27084–27093.
DOI:10.1016/j.ijhydene.2017.09.080 |
| [17] |
Lukowski M A, Daniel A S, Meng F, et al. Enhanced hydrogen evolution catalysis from chemically exfoliated metallic MoS2 nanosheets[J]. J Am Chem Soc, 2013, 135(28): 10274–10277.
DOI:10.1021/ja404523s |
| [18] |
Qu Y J, Pan H, Kwok C T, et al. Effect of doping on hydrogenevolution reaction of vanadium disulfide mon-olayer[J]. Nanoscale Res Lett, 2015, 10(480): 1–7.
|
| [19] |
Li H L, Yu K, Tang Z, et al. Experimental and first-principles investigation of MoWS2 with high hydrogen evolution performance[J]. ACS Appl Mater Interfaces, 2016, 8(43): 29442–29451.
DOI:10.1021/acsami.6b09620 |
| [20] |
Chen X F, Yu K, Shen Y H, et al. Synergistic effect of MoS2 nanosheets and VS2 for the hydrogen evolution reaction with enhanced humidity-sensing performance[J]. ACS Appl Mater Interfaces, 2017, 9(48): 42139–42148.
DOI:10.1021/acsami.7b14957 |
| [21] |
Mir S H, Chakraborty S, Warna J, et al. A comparative study of hydrogen evolution reaction onpseudo-monolayer WS2 and PtS2: Insights based on the density functional theory[J]. Catal Sci Technol, 2017, 7(3): 687–692.
DOI:10.1039/C6CY02426B |
| [22] |
Mir S H, Chakraborty S, Jha P C, et al. Two-dimensional boron: Lightest catalyst for hydrogen andoxygen evolution reaction[J]. Appl Phys Lett, 2016, 109(5): 053903.
DOI:10.1063/1.4960102 |
| [23] |
Wu C. Inorganic two-dimensional nanomaterials[M]. Burlington House, Piccadilly, Westminster, London, W1J OBA: The Royal Society of Chemistry, 2017.
|
| [24] |
Eftekhari A. Electrocatalysts for hydrogen evolution reaction[J]. Int J Hydrogen Energy, 2017, 42(16): 11053–11077.
DOI:10.1016/j.ijhydene.2017.02.125 |
| [25] |
Min S X, Qin J Y, Hai W X, et al. Electrochemical growth of MoSx on Cu foam: A highly active and robust three-dimensional cathode for hydrogen evolution[J]. Int J Hydrogen Energy, 2018, 43(10): 4978–4986.
DOI:10.1016/j.ijhydene.2018.01.145 |
| [26] |
Levy R B, Boudart M. Platinum-like behavior of tungsten carbide in surface catalysis[J]. Science, 1973, 181(4099): 547–549.
DOI:10.1126/science.181.4099.547 |
| [27] |
Qi K Z, Wang G C, Zheng W J. A first-principles studyof CO hydrogenation into methane on molybdenum carbides catalysts[J]. Surf Sci, 2013, 614: 53–63.
DOI:10.1016/j.susc.2013.04.001 |
| [28] |
Silveri F, Quesne M G, Roldan A, et al. Hydrogen adsorption on transition metal carbides: A DFT study[J]. PhysChemChemPhys, 2019, 21(10): 5335–5343.
|
| [29] |
Lin X D, Zhou Y G. Titanium carbide sheet: Metallic 2D structure with intrinsic and high catalytic activity for the hydrogen evolution reaction[J]. J Physcondens Matter, 2019, 31(35): 355302.
DOI:10.1088/1361-648X/ab2306 |
| [30] |
Zhang Z H, Liu X F, Boris I Yakobson , et al. Two-dimensional tetragonal TiC monolayer sheet and nanoribbons[J]. J Am Chem Soc, 2012, 134(47): 19326–19329.
DOI:10.1021/ja308576g |
| [31] |
Giannozzi P, Baroni S, Bonini N, et al. QUANTUM ESPRESSO: A modular andopen-source software project for quantum simulations ofmaterials[J]. J Phys Condens Matter, 2009, 21(39): 395502–395521.
DOI:10.1088/0953-8984/21/39/395502 |
| [32] |
Perdew J P, Burke K, Wang Y. Generalized gradient approximation for the exchange-correlation hole of a many-electron system[J]. Phys Rev B, 1996, 54(23): 16533–16539.
DOI:10.1103/PhysRevB.54.16533 |
| [33] |
Rupp C J, Chakraborty S, Anversa J, et al. Rationalizing the hydrogen and oxygen evolution reaction activity of two-dimensional hydrogenated silicene and germanene[J]. ACS Appl Mater Interfaces, 2016, 8(2): 1536–1544.
DOI:10.1021/acsami.5b11513 |
| [34] |
Norskov J K, Bligaard T, Logadottir A, et al. Trends in the exchange current for hydrogen evolution[J]. J Electrochem Soc, 2005, 152(3): J23–J26.
DOI:10.1149/1.1856988 |
| [35] |
Tan T L, Wang L L, Johnson D D, et al. A comprehensive search for stable Pt-Pdnanoalloy configurations and their use as tunable catalysts[J]. Nano Lett, 2012, 12(9): 4875–4880.
DOI:10.1021/nl302405k |
 2022, Vol. 36
2022, Vol. 36

