芳烃是重要的化学原材料, 广泛应用于合成橡胶、化学纤维和塑料等石油化工制品. 目前, 国内90%以上芳烃的生产主要依赖于石油加工路线, 导致我国需要长期大量进口石油来满足工业需求[1-2].为了减少国家对石油资源的严重依赖, 保障国家能源安全, 开发非石油路线生产芳烃成为当前最为行之有效的途径之一[3-4]. 合成气来源十分广泛, 目前最主要的来源是煤制合成气, 其次是生物质解离以及工业生产的尾气. 因此, 合成气制芳烃不仅为我国煤炭清洁利用提供了新思路, 而且还可以极大地促进国内资源可持续性发展[5-7].
合成气直接制芳烃最初可以追溯到1979年[8], 此后, 众多研究者开始就合成气制芳烃所涉及的催化剂合成, 反应过程的优化和反应机理等问题做了大量的研究[9]. 合成气芳构化反应十分复杂, 不仅反应涉及合成气活化、环化脱氢以及芳烃烷基化等多个过程, 而且产物组分也较为复杂, 可能同时含多种烃类以及含氧化合物[10-11]. 根据催化反应的中间体产物不同, 可以将合成气制芳烃简单地分成费托路线和甲氧基物路线两种途径[12-13]. 费托路线, 催化剂反应活性较高, 轻质芳烃苯(B)、甲苯(T)、二甲苯(X)在芳烃产物中的占比较高, 但是由于催化剂加氢反应能力较强导致产物中CH4选择性较高, 进而导致催化产物中芳烃选择性相对较低(一般低于70%). 并且由于催化剂反应活性较高, 产物扩散受到影响, 部分大分子在催化剂中形成积碳导致催化剂失活[14-15]. 相较于费托路线, 甲氧基路线催化剂烷烃选择性低(尤其是CH4, 一般选择性低于4%), 产物中芳烃选择性可高达80%. 但是催化剂催化活性较低, 单程CO转化率较低(一般低于40%), 同时芳烃中轻质芳烃占比较低(一般在50%左右)[16-18]. ZrO2是一种具有多种化学和物理性质的无机多功能材料, 在还原气氛中可以产生较高浓度的氧空位, 经常在催化反应中充当催化剂或催化剂载体[19]. 虽然氧化锆在合成气催化中表现优异, 但是纯ZrO2的氢解离能力较低, 进而导致其在催化合成气的反应中反应活性较低[20]. 为了获得高活性和高选择性的ZrO2基催化剂, 在ZrO2中掺入其他金属离子制备复合金属氧化物MZrOx是一个具有可行性的方法[21-22]. 铋的氧化物具有多种氧化价态(一般包括+1至+5, 通常为+3), 这表明Bi是一种良好的催化促进剂[23-24]. Xiao等[25]报道了Pt-Bi双金属催化剂用于低温下甲醇氧化为甲醛, 结果表明Pt-Bi双金属催化剂中Bi为Bi3+, Bi从Pt表面分离, 起到位点阻断剂的作用, 吸附在Pt上的甲醇在Pt和Bi金属氧化物界面处氧化为水和甲醛. Gu等[26]使用Bi促进由碳纳米管负载铁催化剂合成FT, 使用原位技术对催化剂进行了深入表征, 结果表明, 在反应条件下, 催化剂在一氧化碳和合成气中的活化导致液态Bi金属物种生成, 铁界面的Bi经历了连续的氧化和还原循环, 促进了一氧化碳的解离, 反应速率和轻质烯烃的选择性大幅提高. 综上可以看出, Bi金属在催化反应中是一种具有潜质的催化剂助剂.
为了获得具有高反应活性、高选择性的合成气芳构化催化剂, 采用超临界法制备了不同Bi/Zr比的BiZrOx金属氧化物. 研究了BiZrOx金属氧化物的结构性质对BiZrOx金属氧化物、BiZrOx/ZSM-5双功能催化剂催化CO加氢性能的影响.
1 实验部分 1.1 材料五水硝酸铋(Bi(NO3)3·5H2O, AR), 阿法埃莎(中国)化学有限公司. 五水硝酸锆(Zr(NO3)4·5H2O, REO), 上海麦克林生化科技有限公司. 乙醇(CH3CH2OH, ≧99.7%, AR), 山西同杰化学试剂有限公司. 氨水(NH3·H2O, NH3含量25%~28%), 洛阳市化学试剂厂. ZSM-5分子筛(Si/Al=30), 南开大学化工试剂厂. 以上所用试剂均未进行进一步提纯处理.
1.2 催化剂的制备BiZrOx金属氧化物的制备: 取一定量的Bi(NO3)3·5H2O和Zr(NO3)4·5H2O溶解到乙醇溶剂中充分搅拌, 将稀释的氨水(VNH3·H2O∶VH2O=1∶3)缓慢的滴加到上述溶液中至pH=8左右, 快速搅拌得到溶胶. 取溶胶加入到高压反应釜中, 通过加热套5 ℃/min加热到240 ℃, 维持反应釜核心温度240 ℃不变, 通过泄压阀将乙醇蒸汽排出, 恢复常压, 冷却后, 将得到的BiZrOx前驱体取出, 置于烘箱中干燥, 然后置于马弗炉中430 ℃煅烧得到BiZrOx. 根据BiZrOx金属氧化物中Bi、Zr原子的比例, 依次记作Bi0Zr50Ox、Bi0.25Zr50Ox、Bi0.5Zr50Ox、Bi1Zr50Ox和Bi2Zr50Ox.
H型ZSM-5分子筛的制备: 取一定量的ZSM-5分子筛, 使用1 mol/L的NH4NO3溶液80 ℃搅拌6 h, 抽滤, 继续加入NH4NO3溶液, 搅拌抽滤, 该过程重复3次后取出, 烘干. 将烘干的ZSM-5分子筛置于马弗炉中, 在550 ℃下煅烧6 h, 取出备用. 后续文中所使用的ZSM-5分子筛, 如无特别指出, 均为此处所制备的H型ZSM-5分子筛.
复合催化剂的制备: 金属氧化物BiZrOx与ZSM-5在研钵中充分研磨混合均匀后压制成粒径0.450~0.280 mm的颗粒得到双功能催化剂, 其中金属氧化物与ZSM-5分子筛的质量比为1∶2, 依次记作Bi0Zr50/HZ、Bi0.25Zr50/HZ、Bi0.5Zr50/HZ、Bi1Zr50/HZ和Bi2Zr50/HZ. 同样, 将ZSM-5分子筛用石英砂代替制备的金属氧化物催化剂分别记作Bi0Zr50/Si、Bi0.25Zr50/Si、Bi0.5Zr50/Si、Bi1Zr50/Si和Bi2Zr50/Si.
1.3 催化剂样品的表征.采用日本理学的Smartlab型X射线衍射仪对所制备的氧化金属的物相及组分进行测试. 衍射光源为Cu(Kα)射线, 电压和电流分别为40 kV和30 mA. 测试范围为5°~70°, 10°/min.
采用日本株式会社的JEM-2001F场发射透射电子显微镜(TEM)观测样品形貌和晶粒尺寸.
采用美国麦克仪器公司型号为AutoChem П的全自动多功能吸附仪对样品的H2吸附能力进行测试(H2-TPD). 取0.1 g样品置于U型管中, 在200 ℃下通入Ar气体脱出金属氧化物中的杂质, 然后将Ar气体切换成10%H2/Ar, 同时将样品继续升温到400 ℃, 并保持4 h. 将温度降至50 ℃再次切换至Ar气氛进行吹扫1 h. 将Ar切换到10%H2/Ar使样品吸附饱和. 再次使用Ar气体吹扫至TCD基线稳定.
采用美国麦克仪器公司型号为AutoChemП的全自动多功能吸附仪对样品的CO吸附能力进行测试(CO-TPD). 取0.1 g样品置于U型管中, 在200 ℃下通入Ar气体脱出金属氧化物中的杂质, 然后将Ar气体切换成10%H2/Ar, 同时将样品继续升温到400 ℃, 并保持4 h. 将温度降至50 ℃再次切换至Ar气氛进行吹扫1 h. 将Ar切换到10%CO/Ar使样品吸附饱和. 再次使用Ar气体吹扫至极限稳定. 最后以10 ℃/min的升温速率升温至800 ℃, 同时记录脱出气体的信号值.
取0.5 g样品在合成气(CO和H2的比例为CO/H2=1∶2)的气氛下400 ℃进行反应4 h, 并持续通入合成气至冷却到室温. 密封后, 在真空手套箱中取出反应后的样品, 将粉末压入铟箔中. 然后, 通过真空盒将压制的样品转移至X射线电子能谱(XPS)样品池中. 采用美国Thermo Fisher Scientific公司的Thermo Kalpha型XPS在5×10-13 MPa的真空条件下对样品进行测试, 记录谱图. 所得谱图根据C 1s(284.6 eV)进行校正.
采用德国Bruker公司的VERTEX 70型红外光谱仪进行原位红外测试(In-Stiu IR). 取0.05 g样品置于原位池中, 200 ℃下Ar吹扫30 min, 在400 ℃下, 通入合成气CO∶H2=1∶2反应3 h. 以4 cm-1的分辨率扫描64次进行图谱采集.
1.4 催化剂的性能评价将上述催化剂置于内径为10 mm的不锈钢反应管中, 装填约4 g催化剂, 通入合成气(H2/CO/N2= 64∶32∶4)进行吹扫, 通过背压阀调节系统反应压力. 将反应条件设置为温度T= 400 ℃, 压力P= 3 MPa, 空速为2000 mL·h-1·g-1. 采用冷却分离的方式进行产物分析. 在线气相色谱仪(北京北分瑞利分析仪器(集团)有限责任公司, )的TCD和FID检测器检测H2、N2、CO、CO2和C1-C6的烃类. 冷肼分离的液相产物进行油水分离, 其中油相产物使用岛津NexisGC-2030型气相色谱(HP-INNOWAX型30 m×Φ0.25 mm×0.25 μm毛细管柱)FID检测器检测.
根据碳原子数计算CO转化率(XCO)和产物选择性(Ciselec.):
| $ X_{\mathrm{CO}}=\frac{\mathrm{CO}_{{inlet }}-\mathrm{CO}_{{outlet }}}{\mathrm{CO}_{{inlet }}} \times 100 \% $ | (1) |
| $ \mathrm{CO}_{2} { selec. }=\frac{\mathrm{CO}_{2\ { out }}}{\mathrm{CO}_{{inlet }}-\mathrm{CO}_{{inlet }}} \times 100 \% $ | (2) |
| $ \mathrm{C}_{i} { selec. }=\frac{{ Mole\ of }\ C_{i}\ { product } \times i}{\sum_{i=1}^{n} { Mole\ of }\ C_{i}\ { product } \times i} \times 100 \% $ | (3) |
COinlet、COoutlet和CO2 out分别代表进入的CO的摩尔量、尾气中CO的摩尔量和尾气中CO2的摩尔量. Ci代表流出产物的摩尔量, i代表产物类别.
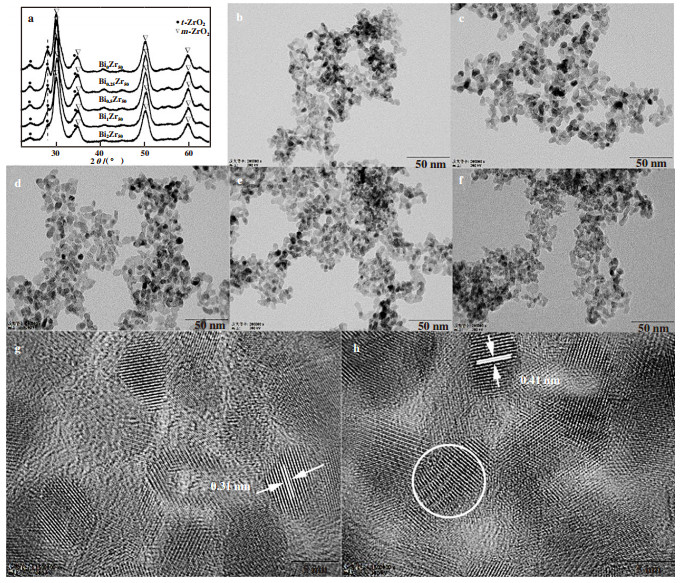
2 结果和讨论 2.1 催化剂的结构性质图 1为金属氧化物的结构特征. 由图 1(a)的结果可以看出, BiZrOx金属氧化物中主要包括四方相ZrO2(t-ZrO2)和单斜相ZrO2(m-ZrO2), 其中24.22°、28.25°和34.58°的特征衍射峰归属于m-ZrO2, 30.23°、35.28°、50.36°、59.96°处的特征峰则归属于t-ZrO2[27-28]. 在BiZrOx金属氧化物中并未检测到Bi物种的衍射峰, 可能是因为Bi离子在ZrO2中分布较为均匀或Bi金属离子与ZrO2形成了“固溶体”. 随着Bi掺入量的增加, BiZrOx金属氧化物在28.25°处的衍射峰强度逐渐降低. 为了进一步对比BiZrOx中t-ZrO2和m-ZrO2的含量变化, 通过K值法进行计算, 结果如表 1所示. 随着BiZrOx中Bi含量的不断增加, m-ZrO2的含量先降低后增加, 其中Bi1Zr50Ox中m-ZrO2的含量最低为2.66%. 图 1(b)-图 1(h)为BiZrOx金属氧化物的TEM照片. 由图 1(b)-图 1(f)的结果可以看出, BiZrOx金属氧化物颗粒主要呈现为不规则单颗粒分散状, 颗粒分散均匀, 粒径在5 nm左右. 对比Bi0Zr50Ox(图 1(g))和Bi1Zr50Ox(图 1(h)), 可以发现在Bi1Zr50Ox出现了较为明显的晶体位错, 这可能主要是由于Bi掺杂导致的.
|
图 1 金属氧化物的结构特征 Fig.1 Structural characteristics of metal oxides (a)XRD图谱; (b, g)、(c)、(d)、(e, h)和(f)依次为Bi0Zr50Ox、Bi0.25Zr50Ox、Bi0.5Zr50Ox、Bi1Zr50Ox和Bi2Zr50Ox的TEM照片 (a) XRD patterns; (b, g), (c), (d), (e, h) and (f) are TEM images of Bi0Zr50Ox, Bi0.25Zr50Ox, Bi0.5Zr50Ox, Bi1Zr50Ox, Bi2Zr50Ox |
| 表 1 金属氧化物的晶体结构性质 Table 1 Crystal structure properties of metal oxides |
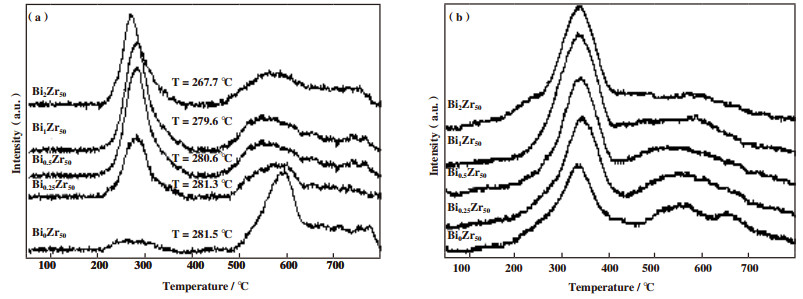
图 2为BiZrOx金属氧化物的H2-TPD和CO-TPD图. 结合表 2结果可以看出, 随着BiZrOx金属氧化物中Bi掺入量的不断增加, H2的脱附温度逐渐向低温偏移, 由Bi0Zr50Ox的281.5 ℃逐渐偏移到Bi2Zr50Ox的267.7 ℃, 同时H2脱附的脱附量先增加后降低, 较高的H2脱附量和降低的H2脱附温度将有助于提高CO的加氢反应. 金属氧化物BiZrOx在250~400 ℃之间均有一个CO的脱附峰, 随着Bi掺入量的不断增加, CO的脱附量先增加后降低, 其中Bi1Zr50Ox的CO脱附量最高为246.41 μmol/g. 对比金属氧化物BiZrOx中H2、CO脱附量可以看出, 在ZrO2中掺入Bi有助于提高BiZrOx对H2、CO的吸附能力.
|
图 2 BiZrOx金属氧化物的吸附性能 Fig.2 The adsorption performance of BiZrOx metal oxide (a) H2-TPD; (b) CO-TPD |
| 表 2 BiZrOx的H2、CO脱附温度及相应的脱附量 Table 2 Desorption temperature and corresponding desorption amount of H2 and CO of BiZrOx |
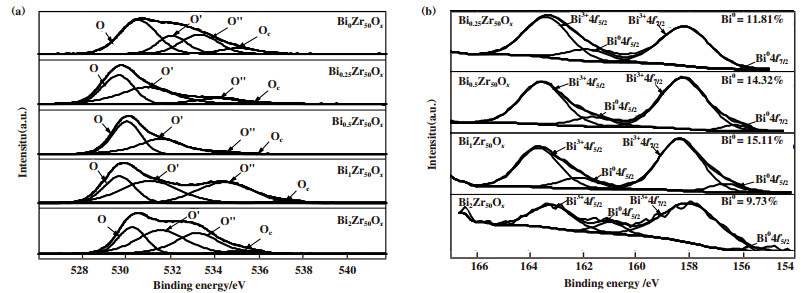
众多研究表明, 金属氧化物表面的氧空位是CO的吸附解离的活性位点[29-30]. Rahman等[31]在研究ZrO2表面氧空位电子性质的变化时提出可以将氧空位按照单电荷氧空位和双电荷氧空位进行拟合, 可以更加有效地观察氧空位电子性质的变化. 因此, 借鉴该方法将O 1s谱峰按照4种氧物种进行分峰拟合, 分峰结果如图 3所示. O 1s拟合结果依次记作: 晶格氧(O)、单电子氧空位(O’)、双电子氧空位(O”)和表面羟基/碳酸盐(Oc). 表 3为氧化物中O 1s的结合能及不同氧物种相对原子浓度. 结合表 3结果可以看出, Bi掺杂后的BiZrOx金属氧化物的氧空位浓度(I2+I3)显著增加, 其中Bi0Zr50Ox的氧空位浓度仅有45.65%, 而Bi1Zr50Ox却可以显著提高到73.53%. 对比Bi0Zr50Ox, Bi掺入的BiZrOx金属氧化物中双电子氧空位的结合能均向高结合能偏移, 因此导致氧空位的平均电荷密度较低, 氧空位表现为显著的缺电子性质, 这对于CO的吸附解离是有利的. 图 3(b)显示了Bi 4f的XPS光谱, 可将其拟合为与金属Bi和Bi的氧化态(Bi3+和Bi0)有关的4个峰[25]. 其中Bi0 4f5/2和Bi0 4f7/2归属于金属Bi0, Bi3+4f5/2和Bi3+4f7/2归属于+3的Bi. 随着Bi掺杂量的增加, Bi0金属占比由Bi0.25Zr50Ox的11.81%提高到Bi1Zr50Ox的15.11%, Bi2Zr50Ox中Bi0占比最低, 仅为9.73%. 在高温反应的过程中, 金属氧化物中的Bi3+越容易被还原成Bi0, 进而导致BiZrOx金属氧化物中Bi0含量增加, Bi0的占比与金属氧化物的H2吸附能力(H2-TPD)相关.
|
图 3 BiZrOx金属氧化物表面的XPS图谱 Fig.3 XPS patterns of BiZrOx metal oxide surfaces (a)O 1s; (b)Bi 4f信号 (a) O 1s; (b) Bi 4f signals |
| 表 3 BiZrOx金属氧化物中O 1s的结合能及不同氧空位相对浓度 Table 3 The binding energy and relative concentration of different oxygen vacancies of O 1s in BiZrOx metal oxide |
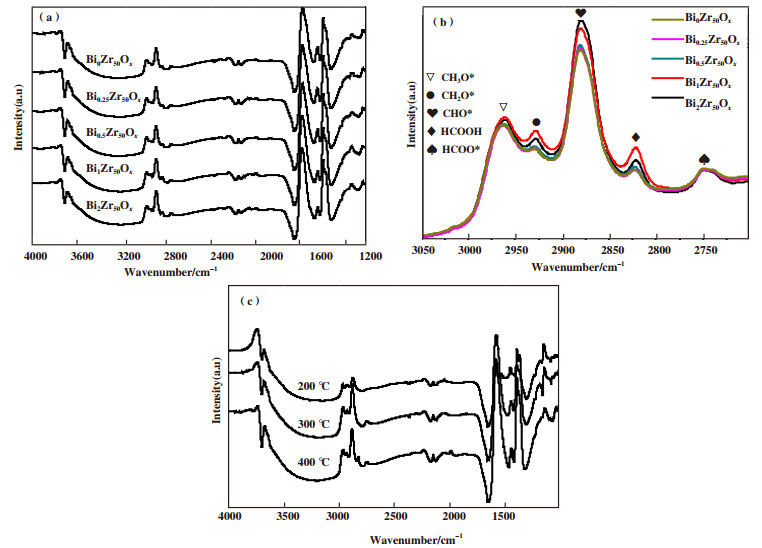
图 4为ZrBiOx金属氧化物在400 ℃的原位红外光谱. 3600 cm-1附近的峰归属于羟基(-OH)伸缩振动吸收峰, 在2822、2877、2929和2962 cm-1附近的峰依次为HCOOH(或H2COO*)、CHO*、CH2O*和CH3O*物种的特征吸收峰[32-33]. 根据CO加氢制甲醇的DFT研究结果表明[34], CO加氢的最优反应路线为CO→CHO*→CH2O*→CH3O*→CH3OH. 由图 4(a)的结果可以看出, BiZrOx金属氧化物均出现了相同的特征吸收峰, 因此可以说明BiZrOx金属氧化物具有相同的CO加氢反应路径和种类相同的中间体产物. 由图 4(b)中结果可以看出, CHO*的峰强度明显比CH3O*的峰强度高, 其主要原因是由于CO的加氢反应是逐步进行的, 其中CHO*加氢形成CH2O*是中速控制步骤. 对比BiZrOx中CHO*、CH2O*和CH3O*的峰强度可以看出, 随着BiZrOx中Bi含量的增加, CHO*峰强度不断增加, 其主要原因可能是Bi的掺入促进了CO的加氢反应. 同时, 在Bi1Zr50Ox中不仅CH2O*和CH3O*的峰强度最高, 而且在2748 cm-1附近的HCOO*峰强度也较高. 一般认为, CO经水煤气变化生成CO2, CO2在金属氧化物表面加氢生成HCOO*中间体产物. 综上所述, 可以看出Bi1Zr50Ox金属氧化物在催化CO加氢的反应中可以产生较多的中间体产物. 图 4(c)为不同温度下Bi1Zr50Ox的光谱图. 结果表明, 在200 ℃时, CO加氢能力较弱, 中间体产物的峰较低, 随着温度的不断增加, CHO*和CH3O*的峰强度不断增加. 反应温度300 ℃以上时, CH3O*峰增加明显, 因此可能存在CHO*加氢反应速率增加导致CHO*不再逐步加氢, 而是直接加氢生成CH3O*.
|
图 4 BiZrOx原位红外光谱(a)和(b)在400 ℃下; (c)Bi1Zr50Ox在不同温度下的光谱 Fig.4 In-situ infrared spectra of BiZrOx (a) and (b) at 400 ℃; (c) spectra of Bi1Zr50Ox at different temperatures |
图 5为金属氧化物催化剂和双功能催化剂催化性能结果. 由图 5(a)的结果可以看出, CO的转化率随着金属氧化物BiZrOx中Bi含量的增加先增加后降低, Bi0Zr50Ox/Si的选择性最低为11.23%, Bi1Zr50Ox/Si的转化率最高为15.56%, 因此Bi有助于提高金属氧化物BiZrOx催化CO加氢的反应活性. 在金属氧化物BiZrOx中, 随着Bi含量的增加, 催化产物中CH4和C5+的选择性不断增加, 而C2-C4烷烃(C2-C40)和甲醇的选择性不断降低, Bi1Zr50Ox中C2-C4烯烃(C2-C4=)的选择性最高为5.8%. 图 5(b)为双功能催化剂的催化性能结果, 相较于金属氧化物BiZrOx, 对应的双功能催化剂的CO转化率明显提高, 并且随着BiZrOx中Bi含量的增加而先增加后降低, 其中Bi0Zr50Ox/HZ和Bi1Zr50Ox/HZ的CO转化率分别为24.95%和35.76%, 因此可以说明双功能催化剂中ZSM-5分子筛的存在有助于提高CO加氢的反应活性. 其主要原因可能是金属氧化物BiZrOx表面形成的中间体产物扩散到ZSM-5分子筛中进行了反应消耗, 从而导致反应体系中中间体产物的浓度降低, 进而导致反应得以持续向正向移动. 对比金属氧化物和双功能催化剂中CH4和C2-C4烯烃的选择性可以看出, 双功能催化剂中CH4和C2-C4烯烃的选择性显著降低. 其主要原因可能是由于金属氧化物BiZrOx中产生的活性中间体产物CHxO(比如CHO*、CH2O*或CH3O*)直接扩散到ZSM-5分子筛中进行反应, 而不是在氧化金属表面进行持续的加氢反应形成CH4[5]. 双功能催化剂中C2-C4烯烃的选择性降低, 其主要原因则是金属氧化物中产生的烯烃扩散到ZSM-5分子筛中进行芳构化反应, 从而导致其选择性降低. 在双功能催化剂中, Bi1Zr50Ox/HZ的芳烃选择性最高为67.81%, 催化产物中并没有出现甲醇等含氧产物, 其主要原因可能是由于双功能催化剂中ZSM-5分子筛的含量较高, 同时ZSM-5分子筛的硅铝比较低, 含氧化合物均被反应消耗.
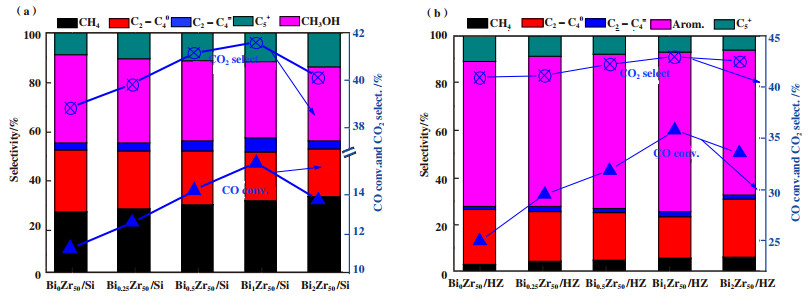
|
图 5 催化性能结果 Fig.5 The catalytic performance results (a)BiZrOx金属氧化物催化剂; (b)双功能催化剂 (a) BiZrOx metal oxide catalyst; (b) Bifuctional catalysts |
图 6为Bi1Zr50Ox/HZ双功能催化剂稳定性测试结果. 从图 6可以看出, 在400 ℃反应90 h后, CO的转化率仅由最初的35.6%下降至34.5%, CO转化率基本不变, 催化产物的分布保持稳定, CH4选择性 < 6%, 芳烃的选择性始终保持在67%左右. 由此可以看出, 在反应条件下催化剂的催化性能非常稳定, BiZrOx/HZ双功能催化剂用于合成气直接芳构化是具有潜在应用前景的.
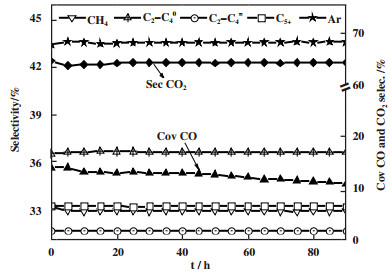
|
图 6 Bi1Zr50Ox/HZ双功能催化剂稳定性测试 Fig.6 Stability test of Bi1Zr50Ox/HZ bifunctional catalyst |
Bi掺入ZrO2导致金属氧化物BiZrOx的结构性质发生了显著变化. 在BiZrOx金属氧化物中, 除了t-ZrO2和m-ZrO2的相对含量发生变化, 金属氧化物的晶体结构也出现了明显的晶体位错. 晶体位错会直接导致金属氧化物的氧原子缺陷位点浓度增加[35], 这也就是BiZrOx金属氧化中随着Bi的掺入, 氧空位浓度显著增加的主要原因. 氧空位浓度以及氧空位结合能是CO吸附解离的活性位点[36-37], 其中Bi1Zr50Ox的氧空位浓度最高为73.53%, 氧空位结合能则为531.18和534.48 eV(Bi0Zr50Ox的为532.16和533.18 eV), 双电子氧空位的结合能显著向高结合能偏移, 从而导致Bi1Zr50Ox的氧空位呈现缺电子性质. 合成气中H2和CO的吸附和活化是反应进行的关键, 由于氧空位的缺电子性质导致吸附的CO中碳氧键电子向氧空位偏移, 从而弱化了碳-氧之间的作用, 最终导致CO的加氢反应活性增强. CO加氢反应生成CHO*、CH2O*和CH3O* 3种活性中间体产物, 对于金属氧化物催化剂, 中间体产物可以在BiZrOx金属氧化物表面进一步反应形成甲醇或短链烃类, 而对于双功能催化剂, 中间体产物则可以通过扩散进入ZSM-5分子筛中, 进行进一步反应后可以获得芳烃.
3 结论 3.1采用超临界法可以获得结构稳定的纳米金属氧化物, 颗粒尺寸在5 nm左右. Bi掺入ZrO2不仅导致BiZrOx中的晶相的相对含量发生变化, 还会导致金属氧化物的晶体位错形成较多的氧空位.
3.2BiZrOx中氧空位浓度和氧空位结合能的不同决定着CO的吸附解离能力, 金属氧化物Bi1Zr50Ox具有较高的氧空位浓度和较强的空位缺电子性质, 因此Bi1Zr50Ox/Si和Bi1Zr50Ox/HZ具有较高的CO转化率, 双功能催化剂Bi1Zr50Ox/HZ对芳烃的选择性达67.81%.
3.3双功能催化剂中ZSM-5分子筛有助于降低CO加氢反应中CH4的选择性, 提高CO的反应活性. 金属氧化物BiZrOx中产生的中间体产物CHxO*以及烯烃可以扩散到ZSM-5分子筛中进行反应, 从而形成芳烃化合物.
| [1] |
a. Yang T, Cheng L, Li N, et al. Effect of metal active sites on the product distribution over composite catalysts in the direct synthesis of aromatics from syngas[J]. Ind Eng Chem Res, 2017, 56(41): 11763-11772. b. Pan Yin-yin(潘茵茵), Song Guang-jie(宋广杰), XueKuan-rong(薛宽荣), et al. The development of hydro-formylation of alkenes and alkynes with syngas substitutes(非合成气法烯烃、炔烃氢甲酰化研究进展)[J]. J Mol Catal(China)(分子催化), 2021, 35(2): 166-177. |
| [2] |
Zhen H, Sheng W, Feng Q, et al. Ceria-zirconia/zeolite bifunctional catalyst for highly selective conversion of syngas into aromatics[J]. ChemCatChem, 2018, 10(20): 4519–4524.
DOI:10.1002/cctc.201800911 |
| [3] |
Fu Y, Ni Y, Chen Z, et al. Achieving high conversion of syngas to aromatics[J]. J Energy Chem, 2021, 66: 597–602.
|
| [4] |
Kasipandi S, Bae J W. Recent advances in direct synthesis of value-added aromatic chemicals from syngas by cascade reactions over bifunctional catalysts[J]. Adv Mater, 2019, 31(34): 1–18.
|
| [5] |
Zhou W, Shi S, Wang Y, et al. Selective conversion of syngas to aromatics over a Mo-ZrO2/H-ZSM-5 bifunctional catalyst[J]. ChemCatChem, 2019, 11(6): 1681–1688.
DOI:10.1002/cctc.201801937 |
| [6] |
Zhang P, Tan L, Yang G, et al. One-pass selective conversion of syngas to para-xylene[J]. Chem Sci, 2017, 8(12): 7941–7946.
DOI:10.1039/C7SC03427J |
| [7] |
Yang S, Li M, Nawaz M A, et al. High selectivity to aromatics by a Mg and Na Co-modified catalyst in direct conversion of syngas[J]. ACS Omega, 2020, 5(20): 11701–11709.
DOI:10.1021/acsomega.0c01007 |
| [8] |
Chang C D, Lang H L, Silvestri A J. Synthesis gas conversion to aromatic hydrocarbons[J]. J Catal, 1979, 56(2): 268–273.
DOI:10.1016/0021-9517(79)90113-1 |
| [9] |
AiSha·Nulahong(艾沙·努拉洪), Fang Ya-ping(方亚平), Gao Xi-rang(高希然), et al. Effect of ZSM-5 zeolites with different grains on carbonylation of syngas(不同晶粒ZSM-5沸石分子筛对合成气羰基化反应性能的影响)[J]. J Mol Catal(China)(分子催化), 2020, 34(2): 105-115.
|
| [10] |
Yang X, Su L, De C, et al. Direct conversion of syngas to aromatics: A review of recent studies[J]. Chin J Catal, 2020, 41(4): 561–573.
DOI:10.1016/S1872-2067(19)63346-2 |
| [11] |
Fujimoto K, Kudo Y, Tominaga H. Synthesis gas conversion utilizing mixed catalyst composed of CO reducing catalyst and solid acid: Ⅱ. Direct synthesis of aromatic hydrocarbons from synthesis gas[J]. J Catal, 1984, 87(1): 136–143.
DOI:10.1016/0021-9517(84)90176-3 |
| [12] |
Wang Gai(张晶), Sun Xian-feng(孙显锋), Qiao Qian(乔婧), et al. Research on syngas to aromatics(合成气制芳烃研究进展)[J]. Clean Coal Tech(China)(洁净煤技术), 2013, 19(5): 13-15.
|
| [13] |
Brosius R, Claeys M. Aromatics from syngas: CO taking control[J]. Chem, 2017, 3(2): 202–204.
DOI:10.1016/j.chempr.2017.07.005 |
| [14] |
Cheng L, Meng C, Yang T, et al. One-step synthesis of aromatics from syngas over K modified FeMnO/MoNi-ZSM-5[J]. Energy & Fuels, 2018, 32(9): 9756–9762.
|
| [15] |
Cheng Li-ke(程立科), Li Na(李娜), Yang Tian-hui(杨天慧), et al. FeMnO/MoNi-ZSM-5 composite catalyst for the direct synthesis of aromatics from syngas(FeMnO/MoNi-ZSM-5复合催化剂合成气直接制芳烃研究)[J]. Nat Gas Chem Ind(China)(天然气化工), 2019, 44(1): 1-5.
|
| [16] |
Arslan M T, Qureshi B A, Gilani S, et al. Single-step conversion of H2 -deficient syngas into high yield of tetramethylbenzene[J]. ACS Catal, 2019, 9(3): 2203–2212.
DOI:10.1021/acscatal.8b04548 |
| [17] |
Yan Q, Doan P H, Toghani H, et al. Synthesis gas to hydrocarbons over CuO-CoO-Cr2O3/H-ZSM-5 bifunctional catalysts[J]. J Phys Chem C, 2008, 112(31): 11847–11858.
DOI:10.1021/jp801640c |
| [18] |
Wang Xin-yao(王馨瑶), Xu Lu-lu(徐禄禄), Zhang Wei-ping(张维萍), et al. Catalytic performances of Mo/HZSM-5 zeolites in methane and methanol Co-aromatization after modification by tetrapropylammonium hydroxide(四丙基氢氧化铵改性Mo/HZSM-5催化甲烷甲醇共芳构化反应性能)[J]. J MolCatal(China)(分子催化), 2020, 34(5): 425-435.
|
| [19] |
Kattel S, Yan B, Yang Y, et al. Optimizing binding energies of key intermediates for CO2 hydrogenation to methanol over oxide-supported copper[J]. J Am Chem Soc, 2016, 138(38): 12440–12450.
DOI:10.1021/jacs.6b05791 |
| [20] |
Cheng K, Zhou W, Kang J, et al. Bifunctional catalysts for one-step conversion of syngas into aromatics with excellent selectivity and stability[J]. Chem, 2017, 3(2): 334–347.
DOI:10.1016/j.chempr.2017.05.007 |
| [21] |
Zhang X, Zhang A, Jiang X, et al. Utilization of CO2 for aromatics production over ZnO/ZrO2-ZSM-5 tandem catalyst[J]. J CO2 Util, 2019, 29: 140–145.
DOI:10.1016/j.jcou.2018.12.002 |
| [22] |
Xu H, Li M, Nawaz M A, et al. Doping of K and Zn elements in FeZr-Ni/ZSM-5: Highly selective catalyst for syngas to aromatics[J]. Catal Commun, 2019, 121: 95–99.
DOI:10.1016/j.catcom.2019.01.001 |
| [23] |
Mamedov E. Site isolation based design of selective oxidation catalysts[J]. Appl Catal A-Gen, 2014, 474: 34–39.
DOI:10.1016/j.apcata.2013.08.018 |
| [24] |
Zhang L, Ghimir P, Phuriragpitikhon J, et al. Facile formation of metallic bismuth/bismuth oxide heterojun-ction on porous carbon with enhanced photocatalytic activity[J]. J Colloid Interf Sci, 2018, 513: 82–91.
DOI:10.1016/j.jcis.2017.11.011 |
| [25] |
Xiao Y, Wang Y, Varma A. Low-temperature selective oxidation of methanol over Pt-Bi bimetallic catalysts[J]. J Catal, 2018, 363: 144–153.
DOI:10.1016/j.jcat.2018.04.016 |
| [26] |
Gu B, Peron D V, Barrios A J, et al. Mobility and versatility of the liquid bismuth promoter in the working iron catalysts for light olefin synthesis from syngas[J]. Chem Sci, 2020, 11(24): 6167–6182.
DOI:10.1039/D0SC01600D |
| [27] |
Wang J, Li G, Li Z, et al. A highly selective and stable ZnO-ZrO2 solid solution catalyst for CO2 hydrogenation to methanol[J]. Sci Adv, 2017, 3(10): e1701290.
DOI:10.1126/sciadv.1701290 |
| [28] |
Meng Zhi-yu(孟志宇), Zhang Yin(张因), Zhao Li-li(赵丽丽), et al. Liquid phase hydrogenation of maleic anhydride over Ni/TiO2 catalysts with different TiO2 polymorphs(不同晶型TiO2负载镍催化剂催化顺酐液相加氢)[J]. Chem J Chin Univer(China)(高等学校化学学报), 2015, 36(9): 1779-1785.
|
| [29] |
Anisur R M, Rout S, Thomas J P, et al. Defect-rich dopant-free ZrO2 nanostructures with superior dilute ferromagnetic semiconductor properties[J]. J Am Chem Soc, 2016, 138(36): 11896–11906.
DOI:10.1021/jacs.6b06949 |
| [30] |
Gray T J, Mccain C C, Masse N G. Defect structure and catalysis in the TiO2 system (Semi-conducting and magnetic properties)[J]. J Phys Chem C, 1959, 63(4): 472–473.
DOI:10.1021/j150574a006 |
| [31] |
Rahman M A, Rout S, Thomas J P, et al. Defect-rich dopant-free ZrO2 nanostructures with superior dilute ferromagnetic semiconductor properties[J]. J Am Chem Soc, 2016, 138(36): 11896–11906.
DOI:10.1021/jacs.6b06949 |
| [32] |
Liu X, Wang M, Zhou C, et al. Selective transformation of carbon dioxide into lower olefins with a bifunctional catalyst composed of ZnGa2O4 and SAPO-34[J]. Chem Commun, 2017, 54(2): 140–143.
|
| [33] |
Wang J, Li G, Li Z, et al. A highly selective and stable ZnO-ZrO2 solid solution catalyst for CO2 hydrogenation to methanol[J]. Sci Adv, 2017, 3(10): e1701290.
DOI:10.1126/sciadv.1701290 |
| [34] |
Yin K, Shen Y. Theoretical insights into CO2 hydrogenation to HCOOH over FexZr1-xO2 solid solution catalyst[J]. Appl Surf Sci, 2020, 528: 146926.
DOI:10.1016/j.apsusc.2020.146926 |
| [35] |
Sun W, Song Y, Gong X, et al. An efficiently tuned d-orbital occupation of IrO2 by doping with Cu for enhancing the oxygen evolution reaction activity[J]. Chem Sci, 2015, 6(8): 4493–4999.
|
| [36] |
Jiang F, Wang S, Liu B, et al. Insights into the influence of CeO2 crystal facet on CO2 hydrogenation to methanol over Pd/CeO2 catalysts[J]. ACS Catal, 2020, 10(19): 11493–11509.
DOI:10.1021/acscatal.0c03324 |
| [37] |
Li S, Wang N, Yue Y, et al. Copper doped ceria porous nanostructures towards a highly efficient bifunctional catalyst for carbon monoxide and nitric oxide elimination[J]. Chem Sci, 2015, 6(4): 2459–2500.
|
 2022, Vol. 36
2022, Vol. 36


