2. 潍坊市市政公用事业服务中心, 山东 潍坊 261000
2. Weifang Municipal Public Utility Service Center, Weifang 261000, China
甲烷氧化偶联制乙烯、乙烷(OCM)是天然气综合利用实现替代石油裂解路线的一个重要发展方向, 具有重要的学术研究意义和潜在的工业应用价值. 自上世纪80年代首次报道以来, 经过数十年的研究, 发展出了种类繁多的催化剂, 形成了非常庞杂的催化剂体系, 开发了超过2000种OCM催化剂. 甲烷氧化偶联的催化剂按其组成特征分为碱金属或碱土金属氧化物催化剂、过渡金属氧化物催化剂、稀土金属氧化物催化剂和复合金属氧化物催化剂[1-7].
大量的实验表明, 催化剂表面的碱性与甲烷氧化偶联的反应性能密切相关, 碱性越大, 相应的CH4转化率和C2选择性越好[8-11]. 但也有研究发现催化剂表面过多的强碱位会造成反应产物深度氧化, 甚至CO2中毒失活[12-13]. 适当地减少甲烷氧化偶联催化剂的表面强碱性位点对其催化反应是有利的, 如固体酸6%SO42-/ZrO2负载锂的催化剂, 6%SO42-/ZrO2减少了催化剂的碱性位点, 得到的催化剂甲烷偶联性能较好[14]. 甲烷氧化偶联是高温放热反应, SO42-在高温反应中易流失, Li/6%SO42-/ZrO2催化剂容易失活. 固体酸WO3/TiO2是一种常见的固体酸载体, 在高温条件下结构稳定[15]. 而W和Ti已经被证明在甲烷氧化偶联反应中具有促进作用[16]. 固体酸催化剂被广泛应用于催化领域, 但固体酸作为载体或催化剂用于选择性氧化反应的研究较少.
在深入理解甲烷氧化偶联反应机理的基础上, 设计制备了一系列固体酸WO3/TiO2负载锂锰(Li-Mn/WO3/TiO2)催化剂. Li-Mn/WO3/TiO2催化剂具有优异的甲烷氧化偶联催化性能, 能够在较低温度下获得很好的甲烷氧化偶联反应活性. 通过XRD、NH3-TPD、O2-TPD、CO2-TPD、H2-TPR、Raman和XPS等方法表征了催化剂的结构和物理化学性能, 并对其甲烷氧化偶联反应催化性能进行了考察.
1 实验部分 1.1 催化剂制备将计算量的偏钨酸铵溶解于去离子水中, 加入TiO2载体进行超声分散20 min, 之后在80 ℃下搅拌蒸干溶液, 于800 ℃焙烧180 min后, 研磨成粉末备用. 标记为x%WO3/TiO2, 其中x为WO3所占催化剂的质量百分数.
将计算量的LiNO3和Mn(NO3)2溶于适量的去离子水中, 浸渍固体酸WO3/TiO2载体, 得到的浸渍物在80 ℃下搅拌烘干, 然后将烘干物研磨成粉末, 在400 ℃下焙烧60 min, 继而升高到800 ℃下焙烧120 min制得Li-Mn/x%WO3/TiO2催化剂(Li: Mn: Ti = 2:1:17.2, mol), 粉碎压片后筛取粒径0.450~0.280 mm的催化剂备用. 用金红石型TiO2代替固体酸WO3/TiO2载体按上述步骤制备Li-Mn/TiO2(R)对比催化剂.
1.2 催化剂评价将1.0 g Li-Mn/x%WO3/TiO2催化剂(0.450~0.280 mm)装入微型固定床石英反应器(i.d. 10 mm)中. 甲烷氧化偶联反应开始前, 先向反应管中通入氧氮混合气(O2: N2=4:5, GHSV = 540 mL·g-1·h-1), 以10 ℃/min的速率升温至反应温度750 ℃后, 通入甲烷、氧气、氮气的混合气(N2: CH4: O2= 5:10:4, GHSV = 2280 mL·g-1·h-1)进行反应. 反应温度由平行置于反应管外壁的热电偶控制. 甲烷氧化偶联反应稳定30 min以上后, 产物由气相色谱仪(GC 2018, 岛津)进行在线监测与分析.
1.3 催化剂表征催化剂的比表面积由Autosorb-iQ比表面仪测定. 样品在200 ℃抽真空环境中脱气120 min, 以高纯氮气为吸附质, 液氮温度(-196 ℃)下进行吸附测量, 采用BET方法计算比表面积.
XRD分析在PANalytical公司的X’Pert PRO多功能衍射仪上进行, 采用Cu Kα辐射源(λ = 0.154 18 nm), 电流40 mA, 电压40 kV, 扫描范围2θ为10°~80°.
XPS表征采用ESCALAB250xi型X射线光电子能谱仪, 激发源为300 W Mg Kα射线. C 1s峰结合能284.6 eV作为标准, 用于分析催化剂表面的组成.
CO2-TPD、O2-TPD、H2-TPR和NH3-TPD的测试均在Quantachrome公司ChemBET Pulsar型全自动程序升温化学吸附仪上进行, 具体步骤如下:
CO2-TPD: 100 mg催化剂样品预先在300 ℃下用氦气(30 mL·min-1)处理60 min除去催化剂表面的吸附杂质和水分, 之后冷却至室温, 在CO2气氛(30 mL·min-1)中吸附60 min. 吸附完成后切换为氦气(30 mL·min-1)吹扫20 min脱去催化剂表面上物理吸附的CO2, 最后以25 ℃·min-1的升温速率, 升温至950 ℃, 采用TCD(热导池检测器)检测, 软件在线记录CO2随温度上升的脱附曲线.
O2-TPD: 100 mg催化剂样品预先在500 ℃下用氦气(30 mL·min-1)处理60 min除去催化剂表面的吸附杂质和水分, 然后冷却至室温, 在O2气氛(30 mL·min-1)中吸附60 min. 吸附完成后切换氦气(30 mL·min-1)吹扫20 min脱去催化剂表面上物理吸附的O2, 最后以10 ℃·min-1升温速率, 升温至950 ℃, 采用TCD(热导池检测器)检测, 软件在线记录O2随温度上升的脱附曲线.
H2-TPR: 15 mg催化剂样品预先在500 ℃下用氦气(30 mL·min-1)处理60 min除去催化剂表面的吸附杂质和水分, 然后冷却至40 ℃, 切换为10%H2/Ar混合气(30 mL·min-1)吹扫30 min, 最后以30 ℃·min-1升温速率, 在H2/Ar混合气氛中升温至900 ℃, 采用TCD(热导池检测器)检测, 软件在线记录H2随温度上升的变化曲线.
NH3-TPD: 100 mg催化剂样品预先在500 ℃下用氦气(30 mL·min-1)处理60 min除去催化剂表面的吸附杂质和水分, 然后冷却至100 ℃, 切换为10%NH3/He混合气(30 mL·min-1)吹扫20 min, 最后以10 ℃·min-1升温速率升温至600 ℃, 采用LC-D200M型质谱检测器(MS, TILON)检测m/e = 16离子随温度变化曲线.
拉曼光谱的测试使用美国Thermo Fisher Scientific显微拉曼光谱仪(ESCALAB250xi), 激发源为Mg Kα射线, 检测波长为532 nm可见光, 扫描范围为0~1300 cm-1.
2 结果与讨论 2.1 甲烷氧化偶联反应结果表 1详细列出了不同WO3含量的Li-Mn/x%WO3/TiO2催化剂的甲烷氧化偶联反应结果. 结果显示, 不含WO3的Li-Mn/TiO2和Li-Mn/TiO2(R)表现出较高的甲烷活化性能(CH4转化率20.3%), 然而其C2选择性较低且CO2选择性高达70%以上. 添加WO3明显提高了甲烷氧化偶联反应的催化性能, C2选择性和C2H4选择性明显得到提高, 深度氧化产物CO2选择性下降. 此外, 随着WO3的含量从5%增加到10%(质量分数), 催化剂的C2选择性不断增加, 而CH4转化率和C2产率呈下降的趋势. 进一步增加WO3的含量, 即当WO3的含量为12%(质量分数)时, CH4转化率急剧下降且C2选择性和C2H4选择性也同时降低, 这表明过多的WO3对甲烷氧化偶联反应是不利的. 上述实验结果表明最佳的WO3的含量为5%(质量分数), Li-Mn/5%WO3/TiO2催化剂上最高的C2产物收率约为16.3%.
| 表 1 Li-Mn/x%WO3/TiO2催化剂甲烷氧化偶联反应结果 Table 1 The performance of OCM reaction over different catalysts |
为了进一步探究不同WO3含量Li-Mn/x%WO3/TiO2催化剂的物理性质对其反应性能的影响, 对其进行了N2吸脱附测试, BET比表面积结果如表 1所示. 与不含WO3的Li-Mn/TiO2相比Li-Mn/WO3/TiO2催化剂的比表面积明显降低, 表明WO3的添加会造成催化剂结构的转变, 与XRD结果相一致. Li-Mn/WO3/TiO2催化剂的比表面积随WO3含量增加几乎不变, 而且比表面积均较小, 由此可知, 对于Li-Mn/WO3/TiO2催化剂, WO3对比表面积的影响并不是决定其甲烷氧化偶联性能的重要因素.
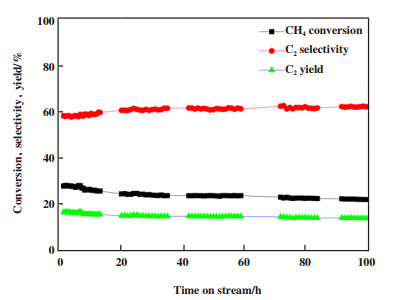
催化剂的稳定性是评价其应用前景的一个关键指标. 为此, 我们进行了Li-Mn/5%WO3/TiO2催化剂在较优反应条件下100 h的稳定性考察, 结果如图 1所示. 在100 h反应过程中, CH4转化率略有下降而C2选择性则略有升高, C2收率基本保持不变, 这表明该催化剂具有良好的稳定性.
|
图 1 Li-Mn/5%WO3/TiO2催化剂100 h稳定性研究 Fig.1 Long term stability test over Li-Mn/5%WO3/TiO2 catalyst Reaction conditions: 750 ℃, CH4: O2: N2= 10:4:5, GHSV = 2280 mL·g-1·h-1, 1 g catalyst |
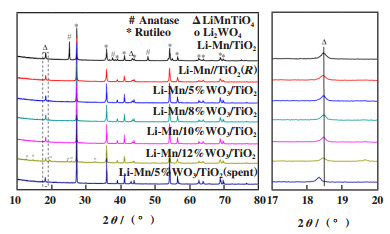
图 2是Li-Mn/x%WO3/TiO2系列催化剂的XRD谱图. 从图中可以看出, Li-Mn/WO3/TiO2催化剂均形成了金红石相TiO2(JCPDS No.89-4920)和LiMnTiO4(JCPDS No.40-0975)结构. 与Li-Mn/WO3/TiO2的催化剂相比, 未添加WO3的Li-Mn/TiO2催化剂存在锐钛矿相TiO2(JCPDS No.89-4921), 说明WO3的添加能够促使金红石型TiO2的形成. 锐钛矿的禁带宽度为3.2 eV, 金红石禁带宽度为3.0 eV, 锐钛矿型较大的禁带宽度使其电子空穴对具有更正或更负的电位, 因而锐钛矿型TiO2具有更强的氧化能力, 更易造成甲烷氧化偶联反应的深度氧化[17-18].但是Li-Mn/TiO2和Li-Mn/TiO2(R)具有相同反应性能, 表明TiO2晶型的转变不是影响催化剂反应性能的唯一因素. 随着WO3的含量增加, TiO2晶相的特征衍射峰2θ角并没有发生偏移, 说明W并未掺杂到TiO2的骨架中[19-20]. 对于Li-Mn/12%WO3/TiO2催化剂, 虽然也存在LiMnTiO4物相, 但需要注意的是与Li-Mn/(0~10)%WO3/TiO2相比, LiMnTiO4峰强度变弱, 且出现一个新的物相Li2WO4(JCPDS No.71-1735), Li2WO4的形成对催化剂的性能是不利的, 会造成催化剂甲烷氧化偶联活性的降低[21], 这与实验结果(表 1)相符. 反应后的Li-Mn/5%WO3/TiO2催化剂所表现出的晶相与新鲜Li-Mn/5%WO3/TiO2催化剂基本相同, 表明Li-Mn/WO3/TiO2催化剂结构稳定性良好. 对比所有新鲜的Li-Mn/x%WO3/TiO2催化剂, 发现LiMnTiO4的特征衍射峰(2θ= 18.5°)没有发生偏移, 这表明WO3添加没有改变Mn的价态, 而反应后的Li-Mn/5%WO3/TiO2催化剂的LiMnTiO4的特征衍射峰(2θ= 18.5°)向低角度偏移, 晶胞扩张, 这表明高价态Mn离子(Mn2+(R = 0.0067 nm)>Mn3+(R =0.0058 nm)>Mn4+(R = 0.0053 nm))在反应过程中被还原. 此结果与Hou等[22]关于Mn/Na2WO4/SiO2甲烷氧化偶联反应后Mn发生还原的研究结论一致.
|
图 2 Li-Mn/x%WO3/TiO2催化剂的XRD表征图 Fig.2 XRD patterns of Li-Mn/x%WO3/TiO2 catalysts |
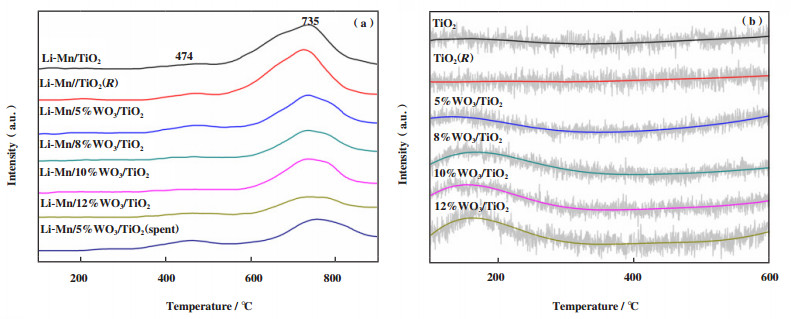
采用CO2-TPD对Li-Mn/x%WO3/TiO2催化剂表面碱性吸附位进行了测试, 其结果如图 3a所示. 一般认为, 位置在300~600 ℃的CO2脱附峰归属为中等强度碱性吸附位, 而在600 ℃以上的CO2脱附峰则归属为强碱性吸附位[23]. 比较不同WO3含量催化剂的CO2-TPD曲线可以看到, 随着WO3含量的增加, 催化剂表面的强碱性吸附位明显减少. 如NH3-TPD(图 3b)所示, 随着WO3含量的增加, x%WO3/TiO2载体的表面酸性吸附位增加, 表明WO3的添加能够在催化剂表面产生酸性, 从而中和强碱性位. 由上述实验结果可知, 固体酸WO3/TiO2载体有利于减少Li-Mn/WO3/TiO2催化剂的表面强碱性位, 强碱性位是活化CH4的活性位点, 强碱位越多CH4转化率越高, 而降低催化剂表面的强碱位能够抑制甲烷的深度氧化从而提高C2烃选择性[24], 这也就很好地解释了随着WO3含量的增加, CH4转化率降低, C2烃选择性提高的原因. 对比Li-Mn/TiO2和Li-Mn/TiO2(R), 发现Li-Mn/TiO2(R)拥有更多的强碱位, 结合催化剂评价反应结果(表 1)和XRD分析结果, 可以推断出, 适当的强碱位是决定催化剂甲烷氧化偶联反应性能的一个关键因素. 经历100 h甲烷氧化偶联反应后, Li-Mn/5%WO3/TiO2催化剂的强碱位略有降低, 结合稳定性实验的结果, 进一步证实了适当的强碱位是催化剂具有优异反应性能的重要条件.
|
图 3 (a) Li-Mn/x%WO3/TiO2催化剂的CO2-TPD图谱及(b) x%WO3/TiO2的NH3-TPD图谱 Fig.3 CO2-TPD patterns (a) of Li-Mn/x%WO3/TiO2 catalysts and NH3-TPD patterns (b) of x%WO3/TiO2 |
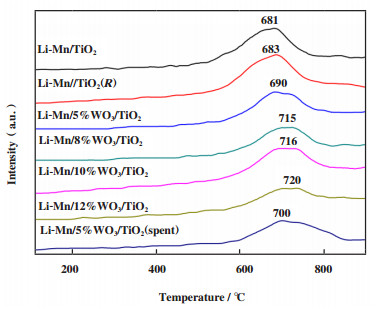
对于选择性氧化反应, 催化剂表面氧的状态对反应性能有着至关重要的影响, 通过O2-TPD对Li-Mn/x%WO3/TiO2催化剂表面氧物种特性进行了研究. 如图 4所示, 所有Li-Mn/x%WO3/TiO2催化剂表面都仅有一个明显的大于600 ℃的晶格氧脱附峰[25]. 不含WO3的Li-Mn/TiO2和Li-Mn/TiO2(R)表现出几乎相同的氧脱附峰, 表明载体TiO2的晶型对氧的吸脱附影响较小. 随着WO3含量的增加, 脱附峰向高温移动, 表明晶格氧的移动性降低. 结合表 1催化剂的评价结果可以看出, 除Li-Mn/12%WO3/TiO2催化剂性能突然降低外, CH4转化率的高低与催化剂表面晶格氧的移动性次序一致, 而C2选择性与晶格氧的移动性次序相反, 由此可以说明, 晶格氧的移动性降低有利于C2选择性的提高而不利于CH4的活化. 结合稳定性实验的结果, 经100 h甲烷氧化偶联反应后的Li-Mn/5%WO3/TiO2催化剂的晶格氧的移动性也略有降低, 进一步证实了上述结果.
|
图 4 Li-Mn/x%WO3/TiO2催化剂的O2-TPD图 Fig.4 O2-TPD patterns of Li-Mn/x% WO3/TiO2 catalysts |
利用H2-TPR表征对Li-Mn/x%WO3/TiO2催化剂的氧化还原特性进行了研究分析, 结果如图 5所示. 不含WO3的Li-Mn/TiO2和Li-Mn/TiO2(R)表现出几乎相同的Mn还原峰(600~750 ℃), 表明TiO2的晶型对Mn的还原影响较小. Li-Mn/WO3/TiO2催化剂在H2-TPR测试中均在670~790 ℃和790~900 ℃出现还原峰, 670~790 ℃之间的还原峰可以归属为Mn的氧化物还原峰, 而790~900 ℃之间的还原峰归属为Mn和W氧化物的还原峰或者是W氧化物的还原峰[26-29]. Mn和W氧化物的还原温度都较高, 这可能是高度分散的Mn和W氧化物与TiO2载体之间的强相互作用造成的. 随着WO3含量的增加, Mn和W氧化物的还原峰向高温移动, 表明晶格氧的移动性降低[30-34]. 经100 h反应后的Li-Mn/5%WO3/TiO2催化剂的晶格氧的移动性略有降低, 这一规律与O2-TPD显示的结果相一致.
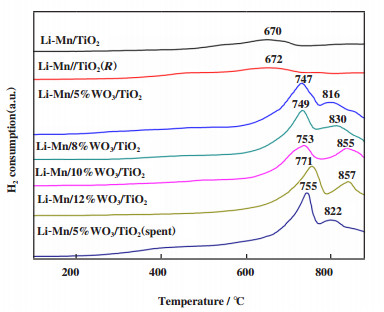
|
图 5 Li-Mn/x%WO3/TiO2催化剂的H2-TPR图 Fig.5 H2-TPR patterns of Li-Mn/x%WO3/TiO2 catalysts |
Raman光谱是一种探测样品表面信息的表征技术, 可用于表面物相晶体结构和表面物相组成的定性分析. 图 6为Li-Mn/x%WO3/TiO2催化剂的Raman表征结果, 142和515 cm-1谱峰为锐钛矿型TiO2的峰, 而238、443和610 cm-1谱峰归属为金红石型TiO2的Raman峰. 从图中可以看出, 未添加WO3的Li-Mn/TiO2催化剂存在锐钛矿型TiO2, 说明WO3的添加能够促进锐钛矿型TiO2向金红石型TiO2转变, 这一现象与XRD的结果相一致. 对于Li-Mn/WO3/TiO2催化剂, 其表面除金红石型TiO2信号以外还检测到了较强的MnTiO3(684 cm-1)信号, 而Li-Mn/TiO2和Li-Mn/TiO2(R)未出现MnTiO3的峰, 可能是由于WO3的添加促使了MnTiO3的生成. MnTiO3是一种低温氧化偶联活性物种, 能够提高催化剂的低温甲烷氧化偶联性能[35]. 因此, 结合催化剂评价反应结果(表 1)和Raman表征结果, 表面MnTiO3的“有无”与其甲烷氧化偶联反应性能“高低”相一致, 为WO3的添加促使了MnTiO3的生成从而提高了催化剂的低温催化性能提供了直接有力的支持. 100 h反应后的Li-Mn/5%WO3/TiO2催化剂的Raman谱图与新鲜Li-Mn/5%WO3/TiO2催化剂基本相同, 这也表明Li-Mn/WO3/TiO2催化剂具有良好的高温结构稳定性.
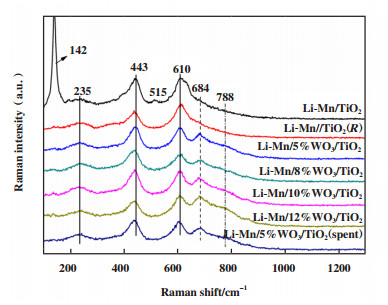
|
图 6 Li-Mn/x%WO3/TiO2催化剂的Raman谱图 Fig.6 Raman spectra of Li-Mn/x%WO3/TiO2 catalysts |
为了进一步研究催化剂表面各元素的化学状态, 对Li-Mn/x%WO3/TiO2催化剂进行了XPS表征, 如图 7所示. 随着WO3含量的增加, Li-Mn/x%WO3/TiO2催化剂表面元素如Mn、W和Ti的结合能值(BE)未发现明显的化学位移, 这表明WO3含量变化没有对催化剂表面Mn、W和Ti元素的电子状态产生影响, 催化剂表面Mn、W和Ti元素的价态未发生变化. 此外, Li-Mn/x%WO3/TiO2催化剂的O 1s分峰也没有随WO3含量变化而明显变化, 说明WO3并没有改变催化剂表面的氧物种相对含量, 未对催化剂的性能造成影响. 经100 h甲烷氧化偶联反应后, Li-Mn/5%WO3/TiO2催化剂的Mn 2p2/3峰向低BE方向位移了0.4 eV, 表明Mn氧化物在甲烷氧化偶联反应过程中被部分还原, 与XRD的分析结论一致.
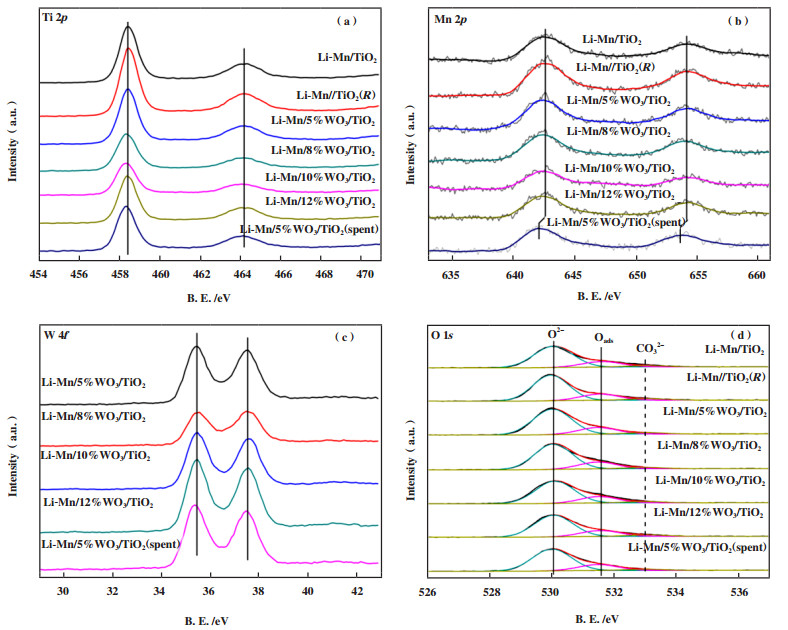
|
图 7 Li-Mn/x%WO3/TiO2催化剂的XPS表征图 Fig.7 XPS spectra for Ti 2p, Mn 2p, W 4f and O 1s for Li-Mn/x%WO3/TiO2 catalysts |
采用浸渍法制备了一系列不同WO3含量的Li-Mn/x%WO3/TiO2催化剂, 通过多种表征手段研究了催化剂的物理化学性质, 并探究了其与甲烷氧化偶联反应性能之间的关系, 得到以下结论:
(1) 添加WO3能显著地提高CH4转化率、C2选择性和收率, 抑制深度氧化反应的发生. 在所有Li-Mn/x%WO3/TiO2催化剂中, Li-Mn/5%WO3/TiO2催化剂显示出最佳的OCM反应性能, 在750 ℃, CH4: O2: N2= 10:4:5, GHSV = 2280 mL·g-1·h-1条件下, 可得到最高16.3%的C2产物收率.
(2) WO3的添加不仅促进锐钛矿型TiO2向金红石型TiO2转变而且能够减少催化剂表面的强碱位, 从而提高催化剂甲烷氧化偶联反应的C2选择性. 催化剂的BET表面积均很小且相差不大, 不是影响催化活性的主要因素.
(3) 随着WO3的添加量的增加, 催化剂表面晶格氧的移动性也随之降低, 有利于C2选择性的提高. 然而, 表面晶格氧的移动性降低不利于CH4的活化, 导致催化剂CH4转化率降低. Raman结果表明, WO3的添加促进了低温氧化偶联活性物种MnTiO3的产生, 从而提升了催化剂的甲烷氧化偶联反应性能.
| [1] |
Lee J S, Oyama S T. Oxidative coupling of methane to higher hydrocarbons[J]. Catal Rev, 1988, 30(2): 249–280.
DOI:10.1080/01614948808078620 |
| [2] |
Lunsford J H. The catalytic conversion of methane to higher hydrocarbons[J]. Catal Today, 1990, 6: 235–259.
DOI:10.1016/0920-5861(90)85004-8 |
| [3] |
Machocki A, Jezior R. Oxidative coupling of methane over a sodium-calcium oxide catalyst modified with chloride ions[J]. Chem Eng J, 2008, 137(3): 643–652.
DOI:10.1016/j.cej.2007.05.038 |
| [4] |
Park J H, Lee D W, Im S W, et al. Oxidative coupling of methane using non-stoichiometric lead hydroxyapatite catalyst mixtures[J]. Fuel, 2012, 94(1): 433–439.
|
| [5] |
Uzunoglu C, Leba A, Yildirim R. Oxidative coupling of methane over Mn-Na2WO4 catalyst supported by monolithic SiO2[J]. Appl Catal A, 2017, 547: 22–29.
DOI:10.1016/j.apcata.2017.08.020 |
| [6] |
Wang Zhong-lai(王仲来), Chen Long(陈龙), Luo Xu(雒旭), et al. Catalytic performance of MCl2-TiO2-SnO2(M=Mg, Ca, Sr, Ba) catalysts for oxidative coupling of methane(MCl2-TiO2-SnO2 (M=Mg, Ca, Sr, Ba)催化剂甲烷氧化偶联反应性能的研究)[J]. J Mol Catal (China)(分子催化), 2013, 27(2): 152–158.
|
| [7] |
Parishan S, Nowicka E, Fleischer V, et al. Investigation into consecutive reactions of ethane and ethene under the OCM reaction conditions over MnxOy-Na2WO4/SiO2 catalyst[J]. Catal Lett, 2018, 148(6): 1659–1675.
DOI:10.1007/s10562-018-2384-6 |
| [8] |
Zavyalova U, Holena M, Schlogl R, et al. Statistical analysis of past catalytic data on oxidative methane coupling for new insights into the composition of high-performance catalysts[J]. ChemCatChem, 2011, 3(12): 1935–1947.
DOI:10.1002/cctc.201100186 |
| [9] |
Papa F, Luminita P, Osiceanu P, et al. Acid-base properties of the active sites responsible for C2+ and CO2 formation over MO-Sm2O3 (M = Zn, Mg, Ca and Sr) mixed oxides in OCM reaction[J]. J Mol Catal A, 2011, 346(1/2): 46–54.
|
| [10] |
Jeon W, Lee J Y, Lee M, et al. Oxidative coupling of methane to C2 hydrocarbons on the Mg-Ti mixed oxide-supported catalysts at the lower reaction temperature: Role of surface oxygen atoms[J]. Appl Catal A, 2013, 464/465: 68–77.
DOI:10.1016/j.apcata.2013.05.020 |
| [11] |
Cong L, Zhao Y H, Li S G. Sr-doping effects on La2O3 catalyst for oxidative coupling of methane[J]. Chin J Catal, 2017, 38(5): 899–907.
DOI:10.1016/S1872-2067(17)62823-7 |
| [12] |
Jiang Z C, Yu C J, Fang X P, et al. Oxide/support interaction and surface reconstruction in the sodium tungstate(Na2WO4)/silica system[J]. J Phys Chem, 1993, 97(49): 12870–1287.
DOI:10.1021/j100151a038 |
| [13] |
Kus S, Otremba M, Taniewski M. The catalytic perf-ormance in oxidative coupling of methane and the surface basicity of La2O3, Nd2O3, ZrO2 and Nb2O5[J]. Fuel, 2003, 82(11): 1331–1338.
DOI:10.1016/S0016-2361(03)00030-9 |
| [14] |
Murata K, Hayakawa T, Fujita K. Excellent effect of lithium-doped sulfated zirconia catalysts for oxidative coupling of methane to give ethene and ethane[J]. Chem Commun, 1997, 2: 221–222.
|
| [15] |
Khan H, Rigamonti M G, Patience G S, et al. Spray dried TiO2/WO3 heterostructure for photocatalytic applications with residual activity in the dark[J]. Appl Catal B, 2018, 226: 311–323.
DOI:10.1016/j.apcatb.2017.12.049 |
| [16] |
Shubin A, Zilberberg I, Ismagilov I, et al. Hydrogen abstraction from methane on cristobalite supported W and Mnoxo complexes: A DFT study[J]. Mol Catal, 2018, 445: 307–315.
DOI:10.1016/j.mcat.2017.11.039 |
| [17] |
Martínez-Huerta M V, Fierro J L G, Banares M A. Monitoring the states of vanadium oxide during the transformation of TiO2 anatase-to-rutile under reactive environments: H2 reduction and oxidative dehydrogenation of ethane[J]. Catal Commun, 2009, 11(1): 15–19.
DOI:10.1016/j.catcom.2009.08.002 |
| [18] |
Wachs I E, Saleh R Y, Chan S S, et al. The interaction of vanadium pentoxide with titania (anatase): Part I. Effect on o-xylene oxidation to phthalic anhydride[J]. Appl Catal, 1985, 15(2): 339–348.
DOI:10.1016/S0166-9834(00)81848-5 |
| [19] |
Tobaldi D M, Pullar R C, Gualtieri A F, et al. Phase composition, crystal structure and microstructure of silver and tungsten doped TiO2 nanopowders with tuneable photochromic behavior[J]. Acta Mater, 2013, 61(15): 5571–5585.
DOI:10.1016/j.actamat.2013.05.041 |
| [20] |
Wu D X, Yin Z L, Chen Q Y, et al. Research on visible light photocatalytic performance of tungsten doped TiO2[J]. Adv Mater Res, 2011, 236/238: 399–402.
DOI:10.4028/www.scientific.net/AMR.236-238.399 |
| [21] |
Ji S F, Xiao T C, Li S B, et al. Surface WO4 tetrahedron: The essence of the oxidative coupling of methane over M-W-Mn/SiO2 catalysts[J]. J Catal, 2003, 220(1): 47–56.
DOI:10.1016/S0021-9517(03)00248-3 |
| [22] |
Song J J, Sun Y N, Ba R B, et al. Monodisperse Sr-La2O3 hybrid nanofibers for oxidative coupling of methane to synthesize C2 hydrocarbons[J]. Nanoscale, 2015, 7: 2260–2264.
DOI:10.1039/C4NR06660J |
| [23] |
Chu C Q, Zhao Y H, Li S G, et al. Correlation between the acid-base properties of the La2O3 catalyst and its methane reactivity[J]. PhysChemChemPhys, 2016, 18(24): 16509–16517.
|
| [24] |
Wang X, Liu D, Li J, et al. Clean synthesis of Cu2O@CeO2core@shellnanocubes with highly active interface[J]. NPG Asia Mater, 2015, 7(1): 7–19.
|
| [25] |
Fleischer V, Steuer R, Parishan S, et al. Investigation of the surface reaction network of the oxidative coupling of methane over Na2WO4/Mn/SiO2 catalyst by temperature programmed and dynamic experiments[J]. J Catal, 2016, 341: 91–103.
DOI:10.1016/j.jcat.2016.06.014 |
| [26] |
Palermo A, Vazquez J P H, Lee A F, et al. Critical influence of the amorphous silica-to-cristobalite phase transition on the performance of Mn/Na2WO4/SiO2 catalysts for the oxidative coupling of methane[J]. J Catal, 1998, 177(2): 259–266.
DOI:10.1006/jcat.1998.2109 |
| [27] |
Shahri S M K, Alavi S M. Kinetic studies of the oxidative coupling of methane over the Mn/Na2WO4/SiO2 catalyst[J]. J Nat Gas Chem, 2009, 18(1): 25–34.
DOI:10.1016/S1003-9953(08)60079-1 |
| [28] |
Jiang Z C, Gong H, Li S B. Methane activation over Mn2O3-Na2WO4/SiO2 catalyst and oxygen spillover[J]. Stud Surf Sci Catal, 1997, 112: 481–490.
|
| [29] |
Lomonosov V I, Gordienko Y A, Sinev M Y, et al. Thermochemical properties of the lattice oxygen in W, Mn-Containing mixed oxide catalysts for the oxidative coupling of methane[J]. Russ J Phys Chem A, 2018, 92(3): 430–437.
DOI:10.1134/S0036024418030147 |
| [30] |
Xiang X M, Zhao H H, Yang J, et al. Nickel based mesoporous silica-ceria-zirconia composite for carbon dioxide reforming of methane[J]. Appl Catal A, 2016, 520: 140–150.
DOI:10.1016/j.apcata.2016.04.020 |
| [31] |
Aika K, Moriyama T, Takasaki N, et al. Oxidative dimerization of methane over BaCO3, SrCO3 and these catalysts promoted with alkali[J]. J Chem Soc Chem Commun, 1986, 18: 1210–1211.
|
| [32] |
Xu X L, Liu F, Han X, et al. Elucidating the promotional effects of niobia on SnO2 for CO oxidation: Developing an XRD extrapolation method to measure the lattice capacity of solid solutions[J]. Catal Sci Technol, 2016, 6(14): 5280–5291.
DOI:10.1039/C5CY01870F |
| [33] |
Sun G B, Hidajat K, Wu X S, et al. A crucial role of sur-face oxygen mobility on nanocrystalline Y2O3 support for oxidative steam reforming of ethanol to hydrogen over Ni/Y2O3 catalysts[J]. Appl Catal B, 2008, 81(3): 303–312.
|
| [34] |
Wu X, Kawi S. Rh/Ce-SBA-15 : Active and stable catalyst for CO2 reforming of ethanol to hydrogen[J]. Catal Today, 2009, 148(3): 251–259.
|
| [35] |
Wang P W, Zhao G F, Wang Y, et al. MnTiO3-driven low-temperature oxidative coupling of methane over TiO2-doped Mn2O3-Na2WO4/SiO2 catalyst[J]. Sci Adv, 2017, 3(6): 1–9.
|
 2022, Vol. 36
2022, Vol. 36


 ,
,