2. 中国科学院大学, 北京 10049
2. University of Chinese Academy of Sciences, Beijing 100049, China
胺类化合物作为一种重要的化工原料和合成中间体, 可广泛应用于合成聚合物、药物、食品添加剂和表面活性剂等[1-3]. 目前, 传统的工业路线生产脂肪族胺和芳香胺以及氨基醇导致化石资源的枯竭和环境问题的日益凸显, 而利用丰富的生物质原料生产生物胺不仅可以减少对日益稀缺的化石资源的依赖, 而且可以很好地利用生物质中含氧官能团,在化石资源的(部分)替代和补充方面发挥巨大的潜力[3]. 生物质醇类化合物通过“借氢”机理胺化被认为是一种有前景且可持续的合成胺类化合物的石化路线替代方法, 整个反应过程的主要副产物为H2O, 环境友好[4-5]. 然而, 该过程通常需要较高的反应温度(150~250 ℃), 这不可避免地导致许多副产物的产生, 例如仲胺和叔胺以及一些含氮杂环化合物[6]. 相比而言, 羰基化合物的还原胺化反应可以在较低温度(≤ 120 ℃)下进行, 避免了较多副产物的产生[7-8]. 同时, 这些羰基中间体通常可以通过转化可再生木质纤维素及其衍生平台分子制备醇的过程中产生. 因此, 通过生物质衍生的羰基化合物合成高附加值的胺被认为是一种有效且可持续的途径.
近年来, 从生物质衍生的可再生羰基化合物来高效还原胺化合成胺,特别是伯胺已取得较大的进展. 例如, Liang等[9]首次报道了通过两步法在Ru/ZrO2催化剂上直接将纤维素转化为有价值的乙醇胺: 纤维素先水解转化为乙醇醛, 接着还原胺化转化为乙醇胺. 实现了纤维素在75 ℃下有效转化为高价值的乙醇胺, 产率达到10%, 若直接用乙醇醛为原料, 乙醇胺的收率可达到93%. Chatterjee等[10]使用贵金属Rh、Pt和Pd基催化剂将糠醛还原胺化为糠胺, 发现Rh-Al2O3催化剂在80 ℃可以获得91.5%的高选择性的糠胺. Deng等[11]报道Nb2O5负载的Ru催化剂可以在90 ℃下有效催化各种羰基化合物的还原胺化. 相比于高成本的贵金属催化剂, 非贵金属催化剂在羰基化合物的胺化反应中也表现出较高的活性和选择性. 如Dong等[12]报道了Ni-Al-O可以高效还原胺化糠醛到糠胺, 在100 ℃下实现了92%的高选择性, 性能甚至优于贵金属Rh、Ru和Pd基催化剂. Jagadeesh等[2]报道了一种石墨壳包裹的Co基催化剂(MOF@Co)可作为一种广泛有效的还原胺化催化剂, 在诸多醛/酮化合物的胺化反应中表现出色. 尽管目前生物质及其衍生的羰基化合物合成高附加值胺取得了一些较好的研究成果, 但开发高效稳定的非贵金属还原胺化催化剂仍然具有十分重要的意义.
由于5-氨基-1-戊醇(5-AP)分子中同时含有羟基和氨基官能团, 因此可作为药物的糖化与氨化中间体, 目前主要用作合成具有抗癌、抗炎等功效的生物碱Manzamine A的原料[13]. 最近, 我们研究组通过糠醛衍生的3, 4-二氢-2-吡喃自催化水合反应合成了环状半缩醛2-羟基四氢吡喃(2-HTHP), 基于2-HTHP在临氢临氨活化过程中可原位产生ω-羟基醛中间体, 在温和条件下(温度≤100 ℃, H2压力≤2 MPa)可被还原胺化为5-AP. 相比于传统石化基1, 5-戊二醇为原料先氯代再胺化路线, 生物质基2-HTHP路线更加绿色高效,为合成高附加值直链高碳氨基醇提供了新思路(图示 1). 在前期工作中以Ni/ZrO2和具有水滑石前体结构的Ni-Mg3AlOx为催化剂催化2-HTHP还原胺化, 在60~80 ℃, 2 MPa H2的较优化条件下可取得90.0%~90.8%的5-AP收率, 明显优于Raney Ni、Ru/C、Pd/C、Pt/C和Rh/C等常用的商业加氢催化剂[14-15]. 但由于催化剂的活性金属Ni组分的流失、烧结和表面氧化等原因, 其稳定性不是很理想, 如Ni/ZrO2催化剂固定床反应器中运行22 h开始失活[14], 而稳定性更好的Ni-Mg3AlOx催化剂运行~90 h开始失活[15]. 与单金属催化剂相比, 双金属催化剂由于存在的诸多积极效应(尺寸效定、电子效应、结构效应等)可以显著提高催化选择性和稳定性[16-17]. 其中Ni基催化剂对氢有良好的吸附活化性能而广泛应用于加氢胺化反应中, 但由于还原后的金属Ni极为活泼在反应中易于烧结和流失从而导致活性下降, 而掺入金属改性剂如金属Fe、Cu和La等可能会通过调节催化活性位点的性质(颗粒尺寸、电子状态、还原性)来改变催化性能[18-20]. 如Chieffi等[21]报道了一种FeNi/C双金属催化剂在生物基化合物(包括5-羟甲基糠醛、糠醛和氨基酸)的还原胺化方面显示出很高的潜力. Hong等[18]及其同事报道了一种共浸渍法合成含有不同Fe/Ni摩尔比的Ni-xFe/γ-Al2O3催化剂, 在异丙醇的还原胺化反应中表现出出色的活性和稳定性. 基于此, 我们采用共沉淀法制备了不同含量的金属Fe修饰的NiFe-Al-O双金属催化剂, 考察它们在2-HTHP还原胺化催化反应中的性能, 结合XRD、TEM、H2-TPR等表征手段揭示反应的构效关系, 并进一步对比研究了单、双金属催化剂在2-HTHP连续还原胺化反应中的稳定性.
|
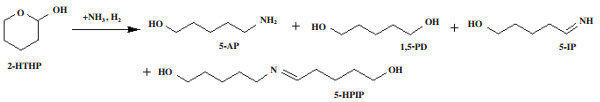
图示1 由生物糠醛衍生的二氢吡喃通过水合和还原胺化工艺合成5-AP Scheme 1 The synthesis of 5-AP from biofurfural-derived dihydropyran by hydration and reductive amination process |
采用共沉淀法制备了不同Fe/Ni摩尔比(0、0.125、0.25、0.5和0.75)的Al2O3负载型NiFe催化剂, 其中镍的含量保持在20%(质量分数)(Ni/(Ni+ Fe+Al2O3)). 通常, 将混合金属盐溶液(0.225 mol/L)包括Ni (NO3)2、Fe (NO3)3和Al (NO3)3与碱溶液NaOH (5 mol/L) + Na2CO3 (1.0 mol/L)在快速搅拌下并流滴入三口瓶中, 控制悬浮液的pH值在10 ±0.1. 在80 ℃下老化24 h后, 将沉淀物过滤并用去离子水洗涤至pH值为7, 然后在110 ℃下干燥过夜, 接着在马弗炉中500 ℃下煅烧4 h. 煅烧的样品被命名为NiFe(x)O-Al-O, 其中x表示Fe/Ni的摩尔比, 而还原后的活性催化剂被标记为NiFe(x)-Al-O. 通过与上述相同的方法制备20%(质量分数)Fe-Al-O催化剂.
1.2 催化剂表征采用X射线荧光光谱(XRF, PANalytical Magix PW 2403)检测样品中Ni、Fe的实际含量. 采用PANalytical X’pert Pro X-射线衍射仪进行样品的XRD谱采集. 该仪器采用Cu靶Kα (λ=1.054 06 nm)射线, 电压40 kV, 电流40 mA, 扫描范围为10°~80°, 扫描速度为6(°)/min. 催化剂样品的比表面积(SBET)在液氮温度(-196 ℃)下于Micromeritics TristarⅡ3020分析仪上测定. 测试之前, 称取~0.1 g样品在300 ℃下脱气4 h, 采用BET方程进行比表面积的计算, 基于P/P0=0.99单点吸附计算样品的孔容和孔径. H2-TPR表征在湖南华思仪器有限公司DAX-7000催化剂表征系统上进行. 在石英管中装入~0.02 g焙烧后的催化剂样品, 升温至200 ℃并恒温1 h进行He吹扫脱水, 然后降至室温, 在流速为40 mL·min-1的5%H2-Ar气流下进行TPR实验, 以-268 ℃· min-1的速率升温至800 ℃, 耗氢信号采用热导池检测.
1.3 催化剂活性及稳定性评价2-HTHP的还原胺化反应在100 mL不锈钢高压釜反应器中以800 r/min的搅拌速度进行. 在反应之前, 将煅烧的NiFe(x)O-Al-O催化剂于750 ℃下在纯H2中以80 mL· min-1的流速还原3 h. 典型的实验中, 将15 g的21.8%(质量分数)的2-HTHP水溶液与15 g的25%(质量分数)的浓氨水一起加入反应器中. 将密封在H2气氛中的还原催化剂迅速倒入反应溶液中以避免被氧化. 将密闭的反应器用氢气置换3次后, 先用氢气将反应器加压至2.0 MPa, 然后加热至80 ℃, 在反应过程中保持稳定. 催化剂稳定性评价在80 ℃和3 MPa H2下使用连续流动反应器(36 cm长和0.9 cm内径)评价所选催化剂的稳定性. 将粒径0.900~0.450 mm煅烧后催化剂(2.0 g)在催化剂床的两侧嵌入石英粉(粒径0.900~0.450 mm). 催化剂在750 ℃、H2中常压下以80 mL·min-1的流速预还原3 h. 冷却至反应温度后, 用H2将反应器加压至3.0 MPa, 然后将21.8%(质量分数)的2-HTHP水溶液和25%(质量分数)的氨水按1:1的质量比混合后以9 g·h-1的速度泵入反应器中. H2与2-HTHP的摩尔比为30. 每5至10 h从不锈钢气液分离器收集液体样品. 样品分析使用装备氢焰离子检测器(FID)和SE-54毛细管色谱柱(50 m × 0.25 mm × 0.25 μm)的Agilent 7890A GC气相色谱仪分析, 同时采用装备HP-5MS毛细柱的Agilent 7890A/5975C气质连用仪进行产物的定性分析. 检测到的液体产物为5-氨基-1-戊醇(5- AP)、1, 5-戊二醇(1, 5- PD)、5-亚氨基-1-戊醇(5- IP)、5-[(5-羟基戊基)亚胺]-1-戊醇(5- HPIP).
2 结果和讨论 2.1 催化剂理化性质表征表 1为不同Fe/Ni摩尔比的催化剂的结构性质. 采用XRF分析催化剂中Ni、Fe金属含量, 催化剂中Ni和Fe的实际负载量与理论负载量差别不大. 不同Fe/Ni摩尔比催化剂的比表面积随着金属Fe/Ni摩尔比的增加, 从Fe/Ni为0的297.2 m2·g-1下降到Fe/Ni≥0.25的~226.1 m2·g-1, 表明金属Fe的掺入造成催化剂比表面积一定程度的降低. 催化剂孔径从先增大后降低保持在6.1~8.5 nm之间, 这一结果可能与金属Fe与金属Ni和载体的相互作用有关, 在较高金属负载量下, 导致金属前体的不均匀分布, 从而使在低含量金属下仅部分堵塞的空隙在高含量金属下被完全堵塞[22-23].
| 表 1 不同Fe/Ni摩尔比的催化剂金属含量与理化性质 Table 1 Metal loadings and textural properties of NiFe(x)-Al-O catalyst samples with different Fe/Ni molar ratios |
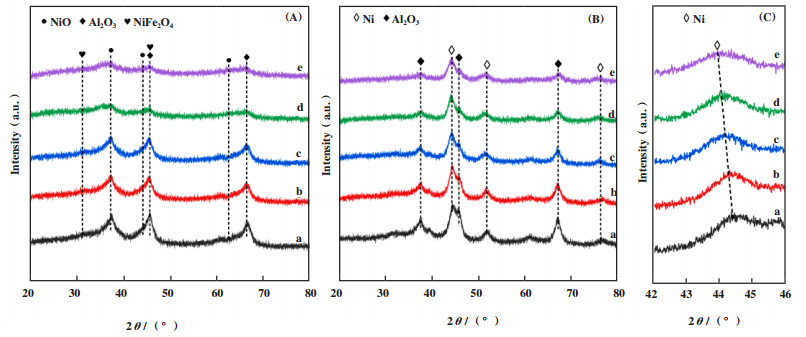
图 1为焙烧及还原后的NiFe双金属催化剂的XRD谱图. 图 1A可以观察到焙烧后催化剂在2θ=37.2°, 43.0°和63.0°处的衍射峰, 归属于NiO晶相(JPCDS 73-1519)[24], 在45.7°和66.7°处的衍射峰归属于γ-Al2O3 (JCPDS 29-0063), 同时也出现NiFe2O4相的衍射峰(2θ=37.2°, 43.3°). 随着Fe含量的增加, NiO的衍射峰强度逐渐减弱, NiFe2O4尖晶石相的衍射峰强度逐渐增加. 这一结果表明金属Ni和Fe之间存在相互作用, 少量Fe物种的添加在一定程度上促进了NiO晶粒在载体表面的分散[18]. 在含Fe催化剂中没有观察到Fe2O3晶相的衍射峰, 可能是以无定形存在或者具有高分散性[22, 25]. 使用H2气体还原后, NiO的衍射峰消失, 而在2θ=44.3°、51.8°和76.3°出现金属Ni的衍射峰分别归属于其(111)、(200) 和(220)晶面(JCPDS 04-0850), 并且与γ-Al2O3的衍射峰发生部分重叠(图 1B). 随着金属Fe的掺入, 可以看出金属Ni(111)晶面的衍射峰逐渐向低角度移动(图 1C), 表明可能形成Ni-Fe合金相, 导致Ni物种的晶格间距发生变化. 通过Scherrer公式计算的NiFe(x)-Al-O催化剂的金属晶粒尺寸列于表 1. 随着Fe/Ni摩尔比从0增加到0.25, 晶粒尺寸从4.1逐渐下降到3.5 nm, 而继续增大Fe的含量, Ni颗粒尺寸增大到4.2 nm, 表明适量Fe的加入可以促进金属位点的分散, 其中NiFe(0.25)-Al-O具有最优的金属颗粒分散性.
|
图 1
不同Fe/Ni摩尔比催化剂的XRD谱图
Fig.1
XRD patterns of samples with different Fe/Ni molar ratios:
a. 0; b. 0.125; c. 0.25; d. 0.5; e. 0.75 (A) NiFe(x)O-Al-O; (B) NiFe(x)-Al-O; (C) NiFe(x)-Al-O in the 2θ ranges of 42°~46° |
不同Fe/Ni摩尔比NiFe(x)-Al-O催化剂的TEM图和颗粒尺寸分布如图 2所示. 从TEM图可看出催化剂颗粒呈现近球状结构, 随着Fe/Ni摩尔比从0增加到0.25, 金属平均颗粒尺寸从4.1 nm略有下降, 减小到3.5 nm, Fe/Ni摩尔比进一步增加到0.75, 金属颗粒尺寸发生显著的增大, 从3.5增加到5.5 nm, 表现出与XRD一致的规律.

|
图 2 不同Fe/Ni摩尔比NiFe(x)-Al-O的TEM图 Fig.2 TEM images and metal particle size distributions of NiFe(x)-Al-O catalysts with different Fe/Ni molar ratios (a) 0; (b) 0.125; (c) 0.25; (d) 0.5; (e) 0.75 |
通过高角环形暗场(HAADF)STEM和元素能谱对NiFe(0.25)-Al-O催化剂的微观结构进行表征, 从图 3a-e可以看出, 在NiFe(0.25)-Al-O催化剂中金属Ni和Fe分布均匀, 并且两种金属同时分布在相同的位置, 随机选取其中颗粒进行能谱线扫, 可以看到金属Ni和Fe呈现相同的高斯正态分布(图 3f), 表明存在Ni-Fe合金结构. 接着对NiFe(0.25)-Al-O催化剂进行高分辨透射电镜的表征(HRTEM). 可以看出(图 3g), 相比于0.204 nm的Ni(111)标准晶面间距和0.203 nm的Fe(110)标准晶面间距, 存在部分0.174~0.178 nm的晶格收缩晶面, 表明双金属之间的相互作用使金属Fe掺入到Ni的晶格中, 发生晶格位错[18], 进一步证明在NiFe(0.25)-Al-O中形成Ni-Fe合金结构.

|
图 3 催化剂NiFe(0.25)-Al-O的HAADF-STEM图(a)以及元素能谱图(b)-(e), 线扫能谱图(f)和HRTEM图(g) Fig.3 HAADF-STEM image (a) of NiFe(0.25)-Al-O with the EDX elemental maps of Ni-K (b), Fe-K (c), Al-K (d), and O-K (e), and HAADF-STEM image EDX line spectra of Ni-K, Fe-K, Al-K and O-K along the red line (f) and HRTEM image (g) |
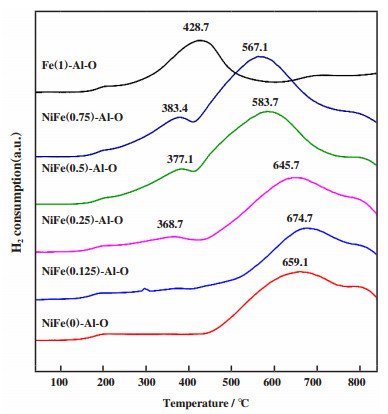
利用H2-TPR实验对不同NiFe (x)O-Al-O催化剂的还原行为、金属间相互作用以及金属与载体的作用进行表征(图 4). 单金属FeO-Al-O的还原峰出现在350~450 ℃之间, Fe2O3还原为FeO发生在500 ℃以下, 但完全还原为Fe0发生在700 ℃以上[22, 26-27].因此推测在350~450 ℃之间的还原峰为Fe氧化物的还原. 单金属NiO-Al-O的主还原峰位于450~700 ℃之间, 源于NiO与载体Al2O3的强相互作用下还原为Ni或者为NiAl2O4尖晶石的还原峰[22, 28]. NiFe双金属催化剂出现两个还原峰, 随着金属Fe氧化物的掺入, 低温还原峰逐渐向高温移动, 而高温还原峰向低温移动. 其中低温H2消耗峰(185~440 ℃)源于形成的NiFe2O4还原为Fe3O4, 并伴随着Fe2O3还原为Fe3O4[22]. 高温H2消耗峰(﹥440 ℃)源于NiFe2O4还原为Ni和Fe, 以及NiO与Al2O3不同程度的相互作用下还原为Ni[25]. H2-TPR结果表明, Fe掺入单金属Ni基催化剂中显著提高了NiO的还原性, 这主要是与XRD结果中描述的两种NiO物种的形成有关, 孤立的NiO与Al2O3强相互作用, 而在Fe2O3环境中的NiO物种(NiFe2O4)更易还原.
|
图 4 不同Fe/Ni摩尔比NiFe(x)-Al-O的H2-TPR图 Fig.4 Temperature-programmed reduction profiles of calcined NiFe(x)O-Al-O catalysts with different Fe/Ni molar ratios |
表 2显示了不同催化剂在60 ℃和2 MPa H2下2-HTHP与NH3在RA中的催化性能. 在没有催化剂的情况下获得91%以上的2-HTHP转化率, 取得42.6%的亚胺中间体5-IP, 这表明2-HTHP的高反应性, 存在环醚C-O-C键活化开环异构为ω-羟基醛, 在氨的存在下缩合为5-IP[29]. 对于无活性金属负载的Al2O3载体来说, 同样没有加氢活性, 只获得了与空白样相近的转化率和5-IP选择性. 负载单元活性金属Ni后, NiFe(0)-Al-O催化剂表现出100%的2-HTHP转化率和65.6% 的5-AP选择性. 其他产物是1, 5-PD、5-IP和5-HPIP, 选择性分别为1.9%、5.4%和16.9%. 加入金属Fe后, 2-HTHP转化率保持不变(100%). 而目标产物5-AP选择性发生明显变化, 选择性随着Fe负载量的增加呈现出先增加后下降的类似火山型变化趋势, 在NiFe(0.25)-Al-O时达到最大值84.4%, 然后逐渐下降至NiFe(0.75)-Al-O的57.5%. 这一发现表明, 加入适量Fe修饰(Fe/Ni摩尔比约为0.25)可以促进5-AP的生成, 而过量的金属Fe会抑制催化剂的胺化活性. 在60 ℃下, 5-AP相对于NiFe(0.25)-Al-O的时空产率为28.0 g5-AP·gcat-1· h-1, 分别是相同条件下报道的Ni/ZrO2、Ni-Mg3AlOx催化剂的4.9和1.7倍, 也明显大于Raney Ni及活性炭负载的Ru、Pd、Pt和Rh贵金属催化剂. 表明NiFe双金属催化剂在2-HTHP的还原胺化活性显著提高. 接着, 选择NiFe(0.25)-Al-O双金属催化剂进行进一步动力学研究.
| 表 2 不同催化剂在2-HTHP和氨的RA反应中的催化性能 Table 2 Catalytic conversions and selectivities of different catalysts in the RA of 2-HTHP with ammoniaa |
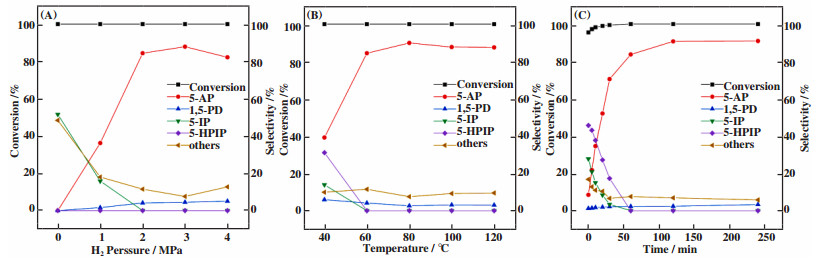
对催化剂NiFe (0.25)-Al-O考察动力学因素(压力、温度、时间)影响, 图 5 (A)可以看出, 所有实验中的2-HTHP转化率为100%, 随着H2压力从0增加到3 MPa时, 5-AP选择性从0增加到最高值87.5%, 5-IP选择性从51.6%下降到0, 表明5-IP易于加氢到5-AP, 继续加压至4 MPa时, 5-AP选择性略有下降至82.2%, 在持续加压的过程中, 1, 5-PD的选择性从0增加至5.0%, 表明C=O和C=N的加氢是竞争反应. 图 5(B)考察反应温度的影响, 可以看出随着温度从40 ℃升高到80 ℃, 5-AP的选择性从39.2%增加到89.9%, 5-IP和5-HPIP选择性从13.9% 和31.1% 急剧下降到0(70 ℃), 表明5-IP和5-HPIP在高温下更容易向目标产物5-AP转化. 继续增加反应温度(90 ℃), 形成更多的副产物导致5-AP选择性略有下降. 因此, 表明在80 ℃下, 2-HTHP的还原胺化可以获得较高的5-AP产率(~90%). 图 5(C)显示了在2-HTHP还原胺化中的催化转化率和选择性与反应时间的关系, 由于2-HTHP的高反应性, 在升温过程中已经发生转化, 当反应时间为0 min时, 2-HTHP转化率已达到95.5%, 主要产物为45.7%的5-HPIP和27.8%的5-IP. 在前60 min内, 5-AP的选择性从8.5% 增加到84.4%, 而5-IP和5-HPIP的选择性从27.8%和45.7%迅速降低到0, 这些结果表明5-IP和5-HPIP可能是产生5-AP的中间体.
|
图 5 催化剂NiFe(0.25)-Al-O在2-HTHP的RA反应中的反应因素影响 Fig.5 Effects of the reaction parameters on the reductive amination of 2-HTHP over the NiFe(0.25)-Al-O catalyst Reaction conditions: 15 g of 21.8% 2-HTHP aqueous solution and 15 g 25% concentrated ammonia (A) 0.1 g of NiFe(0.25)-Al-O, 60 ℃, 1 h; (B) 0.1 g of NiFe(0.25)-Al-O catalyst, 2 MPa, 1 h; (C) 0.1 g of NiFe(0.25)-Al-O, 60 ℃, 2 MPa H2 |
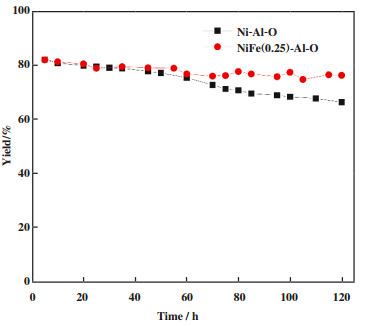
在还原胺化反应中, 催化剂在临氢临氨条件下稳定性不尽人意, 运行中由于活性金属颗粒的烧结、活性组分流失或表面氧化导致催化活性下降, 其中金属颗粒的烧结是催化剂失活的主要原因之一[30-31]. 图 6为催化剂Ni-Al-O和NiFe(0.25)-Al-O在2-HTHP还原胺化合成5-AP反应中的催化稳定性对比. 在运行120 h期间, 两种催化剂都实现了原料100%的转化, 源于原料2-HTHP的高反应性. 可以看出单金属Ni-Al-O在运行前40 h, 目标产物5-AP的产率从81.8% 缓慢下降77.5%, 而继续运行至120 h, 5-AP的产率快速下降至66.1%, 表现出较差的稳定性. 相比于单金属, NiFe(0.25)-Al-O双金属催化剂在运行120 h中5-AP产率稳定在81%~76%之间, 并未出现明显的下降, 表现出优异的催化稳定性. 也明显优于我们前期研究报道的Ni/ZrO2[14]和Ni-Mg3AlOx[15]单金属催化剂. 表明金属Fe的掺入可以明显改善Ni催化剂在2-HTHP的还原胺化反应的稳定性.
|
图 6 催化剂NiFe(0.25)-Al-O和Ni-Al-O在2-HTHP还原胺化的稳定性评价 Fig.6 2-HTHP reductive amination on Ni-Al-O and NiFe(0.25)-Al-O in a continuous flow reactor Reaction conditions: mixed solution of 21.8% 2-HTHP aqueous solution and 25% concentrated ammonia at a weight ratio of 1:1, 80 ℃, 2 MPa H2, WHSV of 2-HTHP = 0.5 h-1, and H2/2-HTHP molar ratio = 30 |
为了揭示金属Fe修饰后提高Ni催化剂稳定性的原因, 对固定床运行后的Ni-Al-O和NiFe(0.25)-Al-O催化剂进行了XRD和TEM表征, 如图 7所示. 通过XRD可以看出单金属Ni-Al-O催化剂在固定床运行120 h后Ni0的衍射峰变得更加尖锐(图 7a), 说明Ni0颗粒发生了明显的长大(从3.4长大到11.4 nm), 这应该是造成催化剂逐渐失活的主要原因之一. 金属Fe修饰的NiFe(0.25)-Al-O催化剂在运行120 h后Ni颗粒只出现略微的长大, 从3.0长大到6.0 nm(图 7b). TEM表征同样也可以看出单金属Ni-Al-O催化剂颗粒发生明显聚集长大, 而双金属催化剂只有略微长大.出现这种明显差异的原因在于双金属催化剂中Ni-Fe之间存在强相互作用, 形成Ni-Fe合金结构, 显著抑制了活性金属颗粒的长大, 使催化剂表现出良好的稳定性. 此外, 对收集的反应液进行ICP检测, 单金属Ni-Al-O的反应液检测到1.71 μg/g的Ni流失, 而双金属催化剂只有0.23 μg/g的Ni流失, 表明适当Fe修饰的掺入还可以明显抑制活性金属Ni的流失, 继而提高双金属催化剂的临氨反应稳定性.

|
图 7 固定床运行后催化剂的XRD和TEM图对比 Fig.7 XRD analysis of (a) Ni-Al-O, (b) NiFe(0.25)-Al-O catalysts and TEM analysis of (c) Ni-Al-O, (d) NiFe(0.25)-Al-O catalysts after 120 h time-on-stream at WHSV=0.5 h-1 along with freshly reduced catalysts |
采用共沉淀法制备了不同Fe/Ni摩尔比(0、0.125、0.25、0.5和0.75)的Al2O3负载型NiFe双金属催化剂, 并考察其在2-HTHP的还原胺化反应活性. 研究发现当Fe/Ni摩尔比为0.25时表现出最优的催化性能, 通过动力学条件优化反应, 在80 ℃, 2 MPa H2条件下取得接近90.0%的5-AP收率. 系列表征(BET、XRD、TEM和H2-TPR)发现适量金属Fe的掺入可以提高Ni颗粒的分散性和还原性, 并且由于Ni和Fe强相互作用的存在, 形成的Ni-Fe合金结构可以显著提高催化剂的催化活性, 并且有效抑制活性金属Ni颗粒的烧结和流失, 从而提高了双金属催化剂在2-HTHP连续还原胺化反应中的稳定性. 这项工作为利用生物质资源清洁、高效地合成高价值的氨基醇提供了一种双金属催化合成策略, 并且对其他羰基化合物的还原胺化具有一定指导意义.
致谢: 感谢国家自然科学基金(21872155, 21902164)、中国科学院战略性先导专项项目(XDA21010700)、中国科学院西部青年学者项目和兰州市城关区科技发展项目(2020JSCX0051)的经费支持.
| [1] |
a. Froidevaux V, Negrell C, Caillol S, et al. Biobased amines: From synthesis to polymers; present and future[J]. Chem Rev, 2016, 116(22): 14181-14224. b. Ge Wei-wei1(葛伟伟), Kong Fan-hua(孔凡华), Huang Li-hua(黄力华). Asymmetric synthesis of α-aryl-propanol compounds by chiral phosphoramide compounds catalysts(手性磷酰胺类化合物不对称催化合成α-芳基丙醇类化合物)[J]. J Mol Catal(China)(分子催化), 2022, 36(1): 22-31. c. Li Yu-dong(李玉东), Li Ying(李莹), Xia Chun-gu(夏春谷), et al. Recent advances in manganese-catalyzed hydrogenation reactions(锰配合物催化加氢反应的研究进展)[J]. J Mol Catal(China)(分子催化), 2022, 36(1): 71-80. d. Li Si-jie(李思洁), Wu Guo-xing(吴国星), Guo Yi-tong(郭益铜), et al. Effect of alkali and acid modific-ation on HY zeolite and its catalytic performance in liquid-phase beckmann rearrangement reaction of cyclohexanone oxime(酸、碱处理对HY沸石酸性和环己酮肟液相贝克曼重排反应的影响)[J]. J Mol Catal(China)(分子催化), 2021, 35(3): 201-214. |
| [2] |
a. Jagadeesh R V, Murugesan K, Alshammari A S, et al. MOF-derived cobalt nanoparticles catalyze a general synthesis of amines[J]. Science, 2017, 358(6361): 326-332. b. Yu Wei-chen(于伟臣), Li Shao-jie(李少杰), LuoJing-jie(罗靖洁), et al. Ni-Based catalysts for basic-free hydrogenation of adiponitrile to 1, 6-hexa-methylenediamine: A comparative study on synthesis method(无碱条件下己二腈加氢制1, 6-己二胺中Ni/Al2O3制备方法比较研究)[J]. J Mol Catal(China)(分子催化), 2021, 35(3): 252-262. c. Wu An-qi(武安奇), Liu Si-xin(刘四新), Wang Gui-ping(王桂平), et al. Study on preparation of palladium (0) catalyst by diazotization and its application in synthesis of aromatic amines(重氮化制备钯(0)催化剂及其用于合成芳香胺研究)[J]. J Mol Catal(China)(分子催化), 2021, 35(1): 40-47 d. Sun Bin(孙斌), Wang Jiang-lin(王江淋). Micro-wave-assisted two step one-potclick reactions in water catalyzed by made in situ water-soluble Salen-Cu(Ⅱ) complex(微波辅助原位生成水溶性Salen-Cu(Ⅱ)配合物催化水中的两步一锅法click反应)[J]. J Mol Catal(China)(分子催化), 2020, 34(6): 525-533. |
| [3] |
Pelckmans M, Renders T, Van de Vyver S, et al. Bio-based amines through sustainable heterogeneous catalysis[J]. Green Chem, 2017, 19(22): 5303-5331. b. Zhang Zheng-bing(张正兵), Xia Ji-bao(夏纪宝). Recent advance in transition-metal-catalyzed transfo-rmations of aromatic amines via neutral C-N bond cleavage(过渡金属催化芳香胺中性碳氮键活化与转化反应新进展)[J]. J Mol Catal(China)(分子催化), 2020, 34(6): 569-578. c. Cao Yan-wei(曹彦伟), Zhang Xue-hua(张雪华), He Lin(何林). Recent advance in synthesis of urea by oxidative carbonylation of amine(胺氧化羰基化合成脲的研究进展)[J]. J Mol Catal(China)(分子催化), 2020, 34(2): 182-192. |
| [4] |
Dobereiner G E, Crabtree R H. Dehydrogenation as a substrate-activating strategy in homogeneous transition-metal catalysis[J]. Chem Rev, 2010, 110(2): 681–703.
DOI:10.1021/cr900202j |
| [5] |
Yang Q, Wang Q, Yu Z. Substitution of alcohols by N-nucleophiles via transition metal-catalyzed dehydrogenation[J]. Chem Soc Rev, 2015, 44(8): 2305–2329.
DOI:10.1039/C4CS00496E |
| [6] |
Guillena G, Ramón D J, Yus M. Hydrogen autotransfer in the N-alkylation of amines and related compounds using alcohols and amines as electrophiles[J]. Chem Rev, 2010, 110(3): 1611–1641.
DOI:10.1021/cr9002159 |
| [7] |
Pelckmans M, Vermandel W, Van Waes F, et al. Low-temperature reductive aminolysis of carbohydrates to diamines and aminoalcohols by heterogeneous catalysis[J]. Angew Chem Int Ed, 2017, 56(46): 14540–14544.
DOI:10.1002/anie.201708216 |
| [8] |
Kumar R, Floden N J, Whitehurst W G, et al. A general carbonyl alkylative amination for tertiary amine synthesis[J]. Nature, 2020, 581(7809): 415–420.
DOI:10.1038/s41586-020-2213-0 |
| [9] |
Liang G, Wang A, Li L, et al. Production of primary amines by reductive amination of biomass-derived aldehydes/ketones[J]. Angew Chem Int Ed, 2017, 56(11): 3050–3054.
DOI:10.1002/anie.201610964 |
| [10] |
Chatterjee M, Ishizaka T, Kawanami H. Reductive amination of furfural to furfurylamine using aqueous ammonia solution and molecular hydrogen: An environmentally friendly approach[J]. Green Chem, 2016, 18(2): 487–496.
DOI:10.1039/C5GC01352F |
| [11] |
Deng D, Kita Y, Kamata K, et al. Low-temperature reductive amination of carbonyl compounds over Ru deposited on Nb2O5·nH2O[J]. ACS Sustainable Chem Eng, 2018, 7(5): 4692–4698.
|
| [12] |
Dong C, Wu Y, Wang H, et al. Facile and efficient synthesis of primary amines via reductive amination over a Ni/Al2O3 catalyst[J]. ACS Sustainable Chem Eng, 2021, 9(21): 7318–7327.
DOI:10.1021/acssuschemeng.1c01456 |
| [13] |
Jakubec P, Hawkins A, Felzmann W, et al. Total synthesis of manzamine A and related alkaloids[J]. J Am Chem Soc, 2012, 134(42): 17482–17485.
DOI:10.1021/ja308826x |
| [14] |
Li X, Tian J, Liu H, et al. Effective synthesis of 5-amino-1-pentanol by reductive amination of biomass-derived 2-hydroxytetrahydropyran over supported Ni catalysts[J]. Chin J Catal, 2020, 41(4): 631–641.
DOI:10.1016/S1872-2067(19)63471-6 |
| [15] |
Li X, Tian J, Liu H, et al. Efficient synthesis of 5-amino-1-pentanol from biomass-derived dihydropyran over hydrotalcite-based Ni-Mg3AlOx catalysts[J]. ACS Sustainable Chem Eng, 2020, 8(16): 6352–6362.
DOI:10.1021/acssuschemeng.0c00394 |
| [16] |
Sankar M, Dimitratos N, Miedziak P J, et al. Designing bimetallic catalysts for a green and sustainable future[J]. Chem Soc Rev, 2012, 41(24): 8099–8139.
DOI:10.1039/c2cs35296f |
| [17] |
Alonso D M, Wettstein S G, Dumesic J A. Bimetallic catalysts for upgrading of biomass to fuels and chemicals[J]. Chem Soc Rev, 2012, 41(24): 8075–8098.
DOI:10.1039/c2cs35188a |
| [18] |
Hong E, Bang S, Cho J H, et al. Reductive amination of isopropanol to monoisopropylamine over Ni-Fe/γ-Al2O3 catalysts: Synergetic effect of Ni-Fe alloy formation[J]. Appl Catal A Gen, 2017, 542: 146–153.
DOI:10.1016/j.apcata.2017.05.003 |
| [19] |
Wu Y, Yuan H, Shi F. Sustainable catalytic amination of diols: From cycloamination to monoamination[J]. ACS Sustainable Chem Eng, 2017, 6(1): 1061–1067.
|
| [20] |
Li S, Wen M, Chen H, et al. Amination of isopropanol to isopropylamine over a highly basic and active Ni/LaAlSiO catalyst[J]. J Catal, 2017, 350: 141–148.
DOI:10.1016/j.jcat.2017.02.009 |
| [21] |
Chieffi G, Braun M, Esposito D. Continuous reductive amination of biomass-derived molecules over carbonized filter paper-supported FeNi alloy[J]. ChemSusChem, 2015, 8(21): 3590–3594.
DOI:10.1002/cssc.201500804 |
| [22] |
Huang D, Ke M, Bao X, et al. Fe-Promoted Ni/Al2O3 thioetherification catalysts with enhanced low-temperature activity for removing mercaptans from liquefied petroleum gas[J]. Ind Eng Chem Res, 2016, 55(5): 1192–1201.
DOI:10.1021/acs.iecr.5b03797 |
| [23] |
Tian D, Liu Z, Li D, et al. Bimetallic Ni-Fe total-metha-nation catalyst for the production of substitute natural gas under high pressure[J]. Fuel, 2013, 104: 224–229.
DOI:10.1016/j.fuel.2012.08.033 |
| [24] |
Wang X, Li X, Sun X, et al. Nanostructured NiO electrode for high rate Li-ion batteries[J]. J Mater Chem, 2011, 21(11): 3571–3573.
DOI:10.1039/c0jm04356g |
| [25] |
Wu H, Guo L, Ma F, et al. Structure and surface characteristics of Fe-promoted Ni/Al2O3 catalysts for hydrogenation of 1, 4-butynediol to 1, 4-butenediol in a slurry-bed reactor[J]. Catal Sci Technol, 2019, 9(23): 6598–6605.
DOI:10.1039/C9CY01195A |
| [26] |
Li T, Wang H, Yang Y, et al. Study on an iron-nickel bimetallic Fischer-Tropsch synthesis catalyst[J]. Fuel Process Technol, 2014, 118: 117–124.
DOI:10.1016/j.fuproc.2013.08.015 |
| [27] |
Hu D, Gao J, Ping Y, et al. Enhanced investigation of CO methanation over Ni/Al2O3 catalysts for synthetic natural gas production[J]. Ind Eng Chem Res, 2012, 51(13): 4875–4886.
DOI:10.1021/ie300049f |
| [28] |
Cho J H, An S H, Chang T S, et al. Effect of an alum-ina phase on the reductive amination of 2-propanol to monoisopropylamine over Ni/Al2O3[J]. Catal Lett, 2016, 146(4): 811–819.
DOI:10.1007/s10562-016-1695-8 |
| [29] |
Brentzel Z J, Barnett K J, Huang K, et al. Chemicals from biomass: Combining ring-opening tautomerization and hydrogenation reactions to produce 1, 5-pentanediol from furfural[J]. ChemSusChem, 2017, 10(7): 1351–1355.
DOI:10.1002/cssc.201700178 |
| [30] |
Xie C, Song J, Wu H, et al. Ambient reductive amin-ation of levulinic acid to pyrrolidones over pt nano-catalysts on porous TiO2 nanosheets[J]. J Am Chem Soc, 2019, 141(9): 4002–4009.
DOI:10.1021/jacs.8b13024 |
| [31] |
Jiang S, Ma C, Muller E, et al. Selective synthesis of THF-derived amines from biomass-derived carbonyl compounds[J]. ACS Catal, 2019, 9(10): 8893–8902.
DOI:10.1021/acscatal.9b03413 |
 2022, Vol. 36
2022, Vol. 36