氮是所有生物不可或缺的元素. 人工固氮已成为仅次于光合作用的第二大重要化学反应. 传统的Haber-Bosch工艺具有能耗高、风险大、污染强等缺点, 已经不符合当代化工行业的标准. 因此, 寻求一种更节能、环保、低风险的固氮过程是当今科学界的研究热点. 随着化石燃料的减少, 太阳能已经成为人类能源利用的重要组成部分. 光催化反应是利用太阳能的有效途径之一, 其核心任务是寻找到在紫外或可见光下能长期稳定工作的光催化剂. 到目前为止, 已有数百种光催化剂相继被报道. 其中, 石墨相氮化碳(g-C3N4)以其优异的化学稳定性、独特的电子结构、制备成本低廉等优点吸引了越来越多的研究人员的关注[1-3]. 然而g-C3N4的带隙相对较大, 只能吸收波长小于460 nm的光, 这使得g-C3N4的光催化性能差强人意. 为了提高g-C3N4的光催化性能, 研究人员采用了多种方法来拓展g-C3N4的光响应范围, 包括金属离子掺杂、非金属离子掺杂和分子掺杂等[4-7]. 然而, 这些外来掺杂物也能作为光生电子空穴的复合中心, 降低了催化剂量子效率[8-9].
利用N原子上的孤对电子也能拓展催化剂的光响应范围[10-12]. 理论计算表明, g-C3N4上有两种可行的电子激发跃迁过程, 即π-π*和n-π*激发跃迁[13]. π-π*激发跃迁能在400 nm处产生强烈的吸收峰, 其吸收边界约为460 nm. 相比之下, n-π*跃迁是N原子上的孤对电子被激发所产生的, 其对应的吸收峰约为500 nm. 这种n-π*电子激发跃迁虽然可以大大拓展催化剂的光响应范围, 但是却鲜有相关报道. 这是因为在g-C3N4中, N原子的孤对电子不能在平面对称性的催化剂结构单元中被激发[14-15]. 因此, 如要实现n-π*电子激发跃迁, 需要一种有效的策略来破坏g-C3N4的平面对称结构. 此外, 根据Li等[16]的研究报道, 含缺陷态的g-C3N4催化剂是由不同尺寸和结构的聚合物分子组成, 其中包括低聚态的melem结构. 含有NH/NH2基团的g-C3N4分子通过氢键形成二维薄片结构, 进而由范德华力凝聚为三维立体结构. 而缺陷的含量对g-C3N4基催化剂的催化性能有显著影响[16-17].
通常, 双氰胺或三聚氰胺等原料在500~550 ℃下发生缩聚反应能得到g-C3N4. 此高温焙烧过程导致生成的g-C3N4团聚现象严重, 比表面积较低. 而比表面积的大小对催化剂性能将起到至关重要的作用. 微波加热是一种完全区别于其他常规方法的加热方式, 它依靠物体吸收微波能并将其转换成热能, 不须任何热传导过程就能使物料内外部达到同时升温的目的. 以氰尿酸、[Bmim]PF6和三聚氰胺为缩聚前体, 通过微波处理制备了具有优异光催化固氮性能的磷掺杂g-C3N4. 磷掺杂结合微波处理工艺能有效破坏催化剂的平面对称结构, 实现n-π*电子激发跃迁. 一方面, 3个前体可以通过氢键和π-π相互作用自组装成超分子聚合物[18]. 这种超分子聚合体可以直接聚合得到磷掺杂的g-C3N4催化剂. 离子液体[Bmim]PF6不仅是构建超分子聚合物的溶剂, 同时也是磷源, 导致g-C3N4结构单元的畸变[19-20]. 另一方面, 微波加热速率很快, 能在0.5 h内合成g-C3N4. 超分子聚合物在微波聚合过程中会释放出大量的气体, 这些快速释放的气体使得g-C3N4催化剂形成了特殊形貌, 导致了g-C3N4催化剂结构单元的变形. 以上两方面原因导致了g-C3N4的平面对称结构被破坏, 实现了n-π*电子激发跃迁, 提高了催化剂的光响应范围及催化性能.
1 实验部分 1.1 催化剂制备及表征将5 g的三聚氰胺和5 g的氰尿酸加入100 mL的[Bmim]PF6中, 在70 ℃下强烈搅拌. 所得的三聚氰胺-氰尿酸-[Bmim]PF6超分子聚合物用乙醇洗涤, 在80 ℃干燥过夜, 然后转移到25 mL的氧化铝坩埚中. 将此坩埚放入较大的氧化铝坩埚中, 并用氧化铜粉末填埋. 将此大干锅在微波炉(格兰仕G70D20CN1P-D2 1200W)中微波处理30 min, 得到产物记为P(M)-GCN. 当用乙醇代替[Bmim]PF6时, 采用上述相同的方法, 得到的产物记为M-GCN. 为了研究微波处理对光催化性能的影响, 将超分子聚合物在550 ℃下焙烧4 h, 得到的样品命名为P(A)-GCN. 直接将三聚氰胺在550 ℃下焙烧4 h, 得到的样品命名为GCN.
X射线衍射光谱(XRD)采用日本岛津公司的X射线衍射仪(XRD-7000)进行测定, 以Cu靶Kα1作为辐射电源, 工作电压40 kV, 工作电流30 mA. 氮气吸附等温线均是采用Micrometrics ASAP 2010物理吸附仪在-196 ℃下测得. 紫外可见光谱(UV-Vis)采用日本JASCA公司的紫外可见光谱仪(UV-550)进行测定. 采用扫描电子显微镜(SEM, JSM 5600LV)对制备的催化剂形貌进行表征. X射线光电子能谱(XPS)使用赛默飞世尔科技有限公司的Thermo ESCALAB 250光电子能谱仪进行测定. 荧光光谱(PL)使用FP-6300荧光分光光度计, Xe灯为激发光源进行测定. 电子自旋共振光谱(ESR)采用EMX-220型光谱仪测定(Bruker, USA). 电化学阻抗谱(EIS)采用AUTO-LAB PGSTAT30电化学工作站(瑞士万通公司)进行测定.
1.2 光催化性能评价采用特制的双层石英反应器进行光催化固氮反应[21-22]. 将0.2 g催化剂加入500 mL去离子水中强烈搅拌. 体系中加入乙醇(0.789 g/L)以捕获光生空穴. 采用250 W高压钠灯(400 nm < λ < 800 nm)作为可见光光源. 每隔一定的时间, 取出5 mL悬浊液, 离心分离得到液体样品. 用纳氏试剂分光光度法(JB7478-87)测定NH4+浓度[21-22].
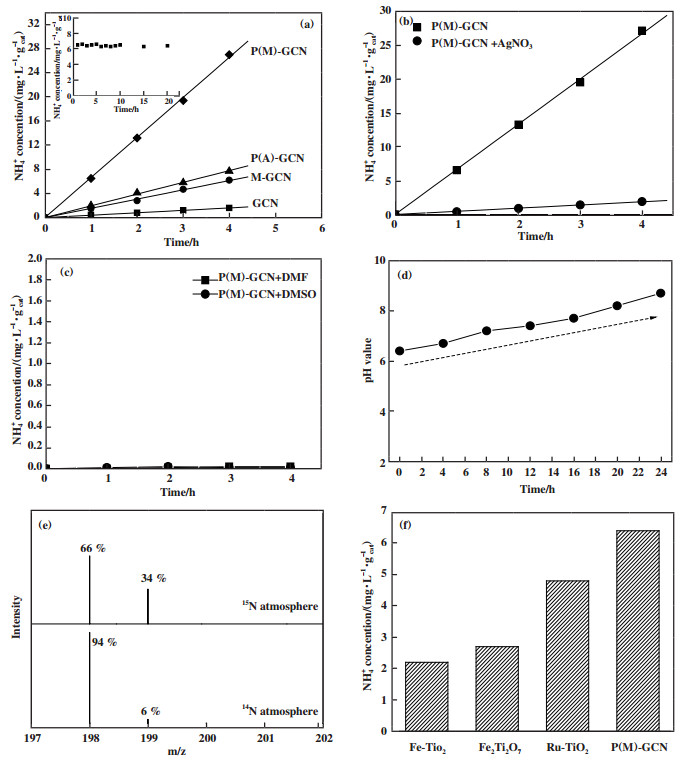
2 结果与讨论图 1a所示为GCN、P(A)-GCN、M-GCN和P(M)-GCN的光催化固氮性能. GCN的NH4+产率非常低, 仅为0.48 mg·L-1·gcat-1. P(A)-GCN和M-GCN的光催化固氮性能明显提高到2.0和1.5 mg·L-1·gcat-1. P(M)-GCN的NH4+产率最高, 为6.5 mg·L-1·gcat-1, 是GCN的13.5倍以上, 且具有良好的光催化稳定性, 反应20 h以上其固氮性能没有明显降低(图 1a插图). 在图 1b中, 加入AgNO3捕获光生电子后, P(M)-GCN的固氮性能急剧下降. 这说明光生电子是光催化固氮反应的主要活性物种. 采用DMF和DMSO作为非质子溶剂代替水加入反应体系, 发现几乎不生成NH4+(图 1c). 这说明反应体系中水是必要的质子源. 在图 1d中, 光催化固氮反应发生前, 悬浮液的pH值为6.4. 随着反应时间的延长, pH值逐渐增大, 24 h后达到8.7. 这是由于反应体系中H+的消耗导致的, 反应方程如下:
| $ \begin{array}{l} \mathrm{N}_{2}+6 \mathrm{H}^{+}+6 \mathrm{e}^{-} \rightharpoonup 2 \mathrm{NH}_{3} \\ \mathrm{NH}_{3}+\mathrm{H}_{2} \mathrm{O} \rightharpoonup-\mathrm{NH}_{3} \cdot \mathrm{H}_{2} \mathrm{O} \rightleftharpoons \mathrm{NH}_{4}^{+}+\mathrm{OH}^{-} \end{array} $ |
|
图 1 制备催化剂的固氮性能、性能对比及不同气氛下制备靛酚的质谱 Fig.1 The N2 photofixation ability over as-prepared catalysts (a), N2 photofixation ability of P(M)-GCN using AgNO3 as the electron scavenger (b) or in aprotic solvents DMF and DMSO (c), N2 photofixation ability of P(M)-GCN under different pH value (d), the mass spectra of the indophenol prepared from different atmosphere (e) and the comparison of N2 photofixation ability of P(M)-GCN and other catalysts (f) |
采用同位素示踪法确定NH4+中N元素的来源. 考察了P(M)-GCN催化剂在15N标记的N2下的光催化固氮反应. 用LC-MS分析形成的15N标记的吲哚酚, 结果如图 1e所示. 在198和199 m/z处显示两种吲哚酚阴离子信号. 该信号强度高于14N∶15N的自然丰度比, 证实了N2是产物NH4+中N元素的来源. 图 1f对比了P(M)-GCN与其他文献报道的催化剂的光催化固氮能力[22-24]. 结果显示, P(M)-GCN的光催化固氮能力明显优于其他的催化剂.
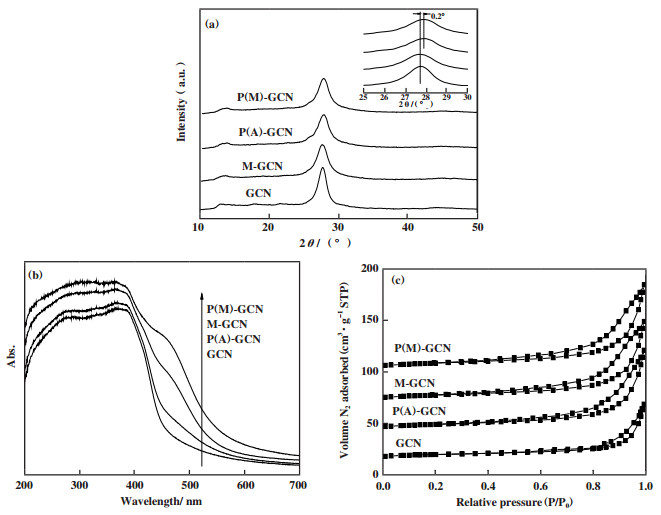
图 2a为GCN、P(A)-GCN、M-GCN、P(M)-GCN的XRD图谱. 所有催化剂显示了两个XRD衍射峰, 分别归属于g-C3N4的(002)和(100)晶面[25]. 所有样品的峰值强度没有显著差别, 而P(A)-GCN和P(M)-GCN在27.7°的衍射峰向高角度方向发生了明显位移. 这应该是由于磷掺杂后的晶格畸变所致, 这与此前的文献报道相一致[19-20].
|
图 2 制备催化剂的XRD谱图(a), UV-Vis谱图(b)及氮气吸附-脱附等温线(c) Fig.2 XRD patterns (a), UV-Vis spectra (b), and N2 adsorption-desorption isotherms (c) of as-prepared catalysts |
紫外可见光谱是n-π*电子跃迁的直接证据.如图 2b所示, GCN的吸收边界约为465 nm. P(A)-GCN吸收边界的波长略有增加, 且在450~600 nm区域的光吸收能力略有提高. 计算得出, GCN和P(A)-GCN的带隙能分别为2.67和2.64 eV. 对于M-GCN和P(M)-GCN, 可以观察到他们的吸收边界从465显著红移到600 nm附近. 此外, M-GCN和P(M)-GCN在490 nm附近有明显的吸收峰. 根据以前的报道, 该吸收峰应归属于n-π*电子跃迁[10]. 此结果表明微波处理能有效地激发氮化碳催化剂的n-π*电子跃迁. P(M)-GCN在490 nm处的吸收峰明显强于M-GCN, 说明磷掺杂可以扭曲g-C3N4晶格, 有利于激发n-π*电子跃迁. 计算得出, M-GCN和P(M)-GCN的带隙分别为2.21和2.18 eV. GCN、P(A)-GCN、M-GCN、P(M)-GCN的N2吸附-脱附等温线如图 2c所示. 所有样品的等温线均为经典的IV型. GCN的比表面积(SBET)很低, 只有9.2 m2·g-1. P(A)-GCN和M-GCN的SBET分别提高到14.2和16.5 m2·g-1. 而P(M)-GCN的SBET显著提高到26.9 m2·g-1, 暗示着P(M)-GCN可能具有特殊的形貌.
图 3所示为GCN、M-GCN、P(A)-GCN和P(M)-GCN的SEM图片, GCN为纳米片状结构. 这些g-C3N4纳米片相互堆叠在一起形成了无规则的块状结构, 如图 3a所示. 与GCN相比, M-GCN的粒径尺寸显著减小(图 3b). 这说明微波处理能将大片的g-C3N4撕裂成更小的纳米片, 这个过程会导致七嗪单元的变形, 使g-C3N4变成非平面对称结构[26]. P(A)-GCN显示出纳米颗粒的形貌, 其粒径约为40~50 nm, 且分布较窄(图 3c). 如图 3d所示, P(M)-GCN催化剂具有很多不规则的大孔, 这证实了上述对其形貌的猜测. 虽然这种特殊形貌的形成机理尚不清楚, 但可以确认的是, 引入掺杂剂[12, 27]和微波处理[28]都对催化剂的形貌有很大的影响.

|
图 3 GCN(a), M-GCN(b), P(A)-GCN(c)及P(M)-GCN(d)催化剂的扫描电镜图片 Fig.3 SEM images of GCN (a), M-GCN (b), P(A)-GCN (c) and P(M)-GCN (d) |
GCN、P(A)-GCN、M-GCN和P(M)-GCN在C 1s、N 1s和P 2p轨道的XPS光谱如图 4所示. 催化剂在C 1s轨道有3个结合能. 位于284.6 eV处的结合能归属于碳污染. 结合能为285.9 eV的峰归属于芳香环中sp2杂化的C原子. 288.5 eV处的结合能归属于芳香环中不完全缩聚生成的N=C(N)-NH和N=C(N)-NH2基团[29]. P(M)-GCN催化剂位于285.9 eV处的谱峰明显向低结合能方向移动, 这可能是由于P原子通过取代N原子形成P-C键掺入晶格导致的. 与N原子相比, P原子的供电子能力更强, 导致C原子的电子密度提高, 因此结合能降低. 通过元素分析计算得到的催化剂C/N比列入表 1. GCN和M-GCN的C/N比均为0.669. P(A)-GCN和P(M)-GCN的C/N比分别为0.678和0.686, 明显高于GCN和M-GCN. 此结果证实了磷原子通过取代晶格N原子的方式掺杂到晶格中, 而不是掺入g-C3N4的晶格间隙. P(M)-GCN具有最高的C/N比, 说明微波合成有助于磷原子掺入催化剂晶格.

|
图 4 GCN, P(A)-GCN, M-GCN及P(M)-GCN催化剂在C 1s(a), N 1s(b)及P 2p(c)轨道的X射线光电子能谱 Fig.4 XPS spectra of GCN, P(A)-GCN, M-GCN and P(M)-GCN in the region of C 1s (a), N 1s (b) and P 2p (c) |
| 表 1 采用元素分析计算得到的催化剂C/N比 Table 1 The C/N ratio of as-prepared catalysts calculated by element analysis |
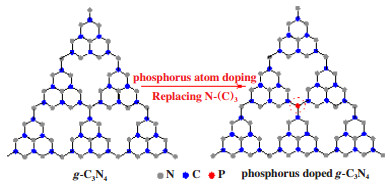
在图 4b中, 所有样品的N 1s光谱可以分成两个峰. 398.2和399.9 eV处的结合能分别归属于g-C3N4中的C-N=C(N2C)和N-(C)3(N3C)键[29]. 所有样品的结合能位置相同, 但是峰强度差异显著. XPS数据计算结果显示, GCN的N2C/N3C峰面积比为3.68. 微波处理使M-GCN晶格发生畸变, 导致其N2C/N3C比值(4.15)高于GCN[27-28]. P(A)-GCN的N2C/N3C比为4.24, 也高于GCN, 这可能是由于掺杂的P原子取代了N3C位置的N原子所致[30], 如图 5所示. P(M)-GCN的N2C/N3C比进一步提高到6.65, 表明微波处理和P掺杂的协同作用可使g-C3N4的结构单元进一步扭曲. 这个结果在理论上支持了n-π*电子跃迁的可行性. 在P 2p轨道(图 4c), P(A)-GCN和P(M)-GCN的结合能均在132 eV处. 根据报道, P-N和P-C键的结合能分别位于133.5和132 eV[6]. 由此推断, 磷掺杂在g-C3N4晶格中形成了P-C键. 这与上述的推测是一致的.
|
图 5 氮化碳和制备的磷掺杂氮化碳的可能的结构示意图 Fig.5 The diagram of possible structure of g-C3N4 and phosphorus doped g-C3N4 (c) |
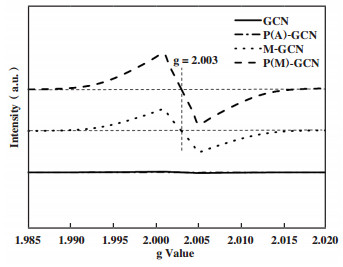
采用EPR对n-π*电子跃迁进行进一步确认, 结果如图 6所示. GCN和P(A)-GCN没有显示任何信号, 表明它们的结构单元中几乎不存在孤对电子[31-32]. M-GCN和P(M)-GCN在g=2.003处表现出明显的共振信号, 表明在M-GCN和P(M)-GCN中存在大量的局域孤对电子, 这些孤对电子可以通过n-π*电子跃迁被激发.
|
图 6 GCN, P(A)-GCN, M-GCN及P(M)-GCN的电子自旋共振光谱 Fig.6 ESR spectra of GCN, P(A)-GCN, M-GCN and P(M)-GCN |
制备催化剂的PL和EIS光谱如图 7所示. 所有的样品在460 nm处出现PL谱峰, 归属于π-π*电子激发跃迁[33-34]. GCN显示了最强的PL谱峰强度. M-GCN的PL强度低于GCN, 说明微波处理可以提高电子空穴对的分离效率. 这与此前的研究结果是一致的[27-28]. P(A)-GCN的PL强度也低于GCN. 由于掺杂和微波处理的协同作用, P(M)-GCN的PL强度远低于其他样品, 表明其具有最佳的电荷分离效率. 值得注意的是, 除了460 nm处的PL谱峰外, P(M)-GCN在520 nm处出现了一个肩峰, 应归属于电子的n-π*激发跃迁. 图 7b为制备催化剂的EIS谱图. 一般来说, EIS谱图中的弧半径反映了电子与空穴的分离效率[35-36]. 弧半径越小, 分离效率越高. 图中圆弧半径减小顺序为: GCN > P(A)-GCN > M-GCN > P(M)-GCN. 这与PL结果一致, 证实了P(M)-GCN具有最佳的电子空穴分离效率.
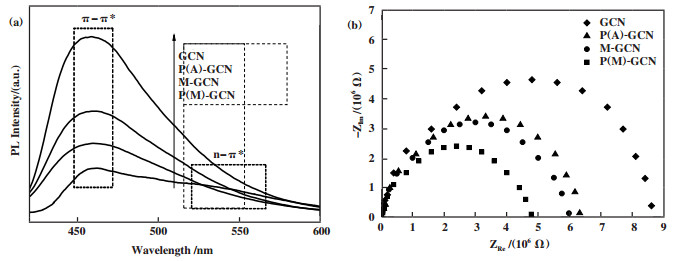
|
图 7 GCN, P(A)-GCN, M-GCN及P(M)-GCN的荧光光谱(a)及电化学阻抗谱(b) Fig.7 PL (a) and EIS (b) spectra of GCN, P(A)-GCN, M-GCN and P(M)-GCN |
上述结果表明, 掺杂和微波处理的协同作用提高了催化剂的电子空穴对分离效率和比表面积. 为了确定催化剂的光捕获能力对光催化性能的影响, 考察了GCN和P(M)-GCN在不同波长光照下的光催化固氮性能, 结果如图 8所示. 有趣的是, GCN和P(M)-GCN的光催化固氮性能与它们在UV-Vis光谱中表现出来的光吸收性能是一致的. 在滤去550 nm以下的光后, P(M)-GCN的NH4+产率仍为0.55 mg·L-1·gcat-1. 然而, 当使用了480 nm波长的滤光片后, GCN的NH4+产率非常低, 仅有0.17 mg·L-1·gcat-1.这一结果表明, 影响催化剂固氮性能的主要因素是催化剂的光捕获能力.
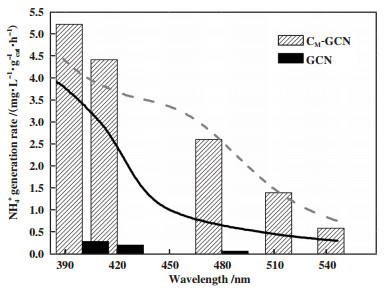
|
图 8 GCN和P(M)-GCN在不同波长光照下的光催化固氮性能 Fig.8 The N2 photofixation ability of GCN and P(M)-GCN under different wavelength |
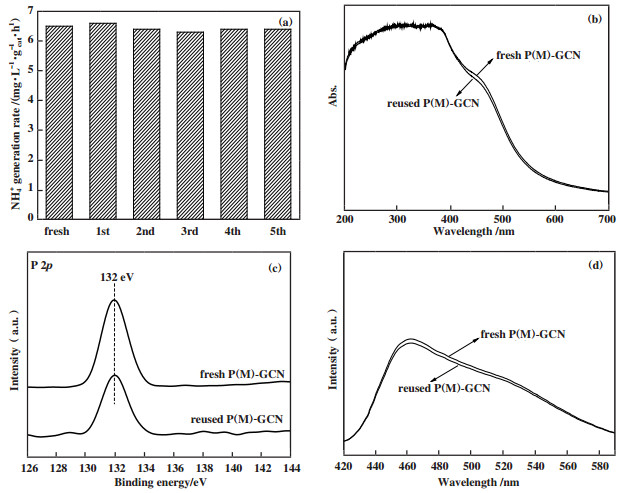
|
图 9 P(M)-GCN的光催化稳定性(a), 新鲜及使用过的P(M)-GCN催化剂的紫外-可见光谱(b), X射线光电子能谱(c)及荧光光谱(d) Fig.9 The photocatalytic stability of P(M)-GCN (a), the UV-Vis (b), XPS (c) and PL (d) spectra of fresh and reused P(M)-GCN |
图 9a为P(M)-GCN的光催化稳定性. 5次循环后NH4+的产率没有显著降低, 说明其具有良好的催化稳定性. 图 9b-d比较了新鲜的和重复使用的P(M)-GCN的UV-Vis、XPS和PL光谱. 结果显示两个催化剂的UV-Vis光谱、XPS和PL光谱没有显著差异. 这表明经过5次循环后, P(M)-GCN的光学性质和电子性质没有明显变化, 证明其具有良好的结构稳定性.
3 结论以氰尿酸、[Bmim]PF6和三聚氰胺为缩聚前体, 通过微波处理制备了具有优异光催化固氮性能的P掺杂g-C3N4. P掺杂与微波处理工艺相结合能破坏g-C3N4中平面对称性的结构单元, 激发了n-π*电子转移过程. 制备催化剂的吸收边界从465移动至600 nm处, 明显促进了对可见光的吸收. P(M)-GCN的NH4+产率达到6.5 mg·L-1·gcat-1, 是纯g-C3N4的13.5倍以上, 且具有良好的催化稳定性和结构稳定性. 影响催化剂固氮性能的主要因素是催化剂的光捕获能力.
| [1] |
a. Hu S Z, Li F Y, Fan Z P, et al. Band gap-tunable pot-assium doped graphitic carbon nitride with enhanced mineralization ability[J]. Dalton Trans, 2015, 44(3): 1084-1092. b. Qin Hong-yu(秦宏宇), Ke Yi-hu(柯义虎), Li Jing-yun(李景云), et al. Application of photo-thermal synergistic effect in catalytic reactions(光热协同效应在催化反应中的应用研究进展)[J]. J Mol Catal(China)(分子催化), 2021, 35(4): 375-389. c. Zhou Li-long(周理龙), Zeng Xiang-jie(曾祥杰), Li Zheng-jie(李正杰), et al. Application of carbon catalysts in catalytic reactions(碳催化剂在催化反应中的应用)[J]. J Mol Catal(China)(分子催化), 2021, 35(1): 76-102. |
| [2] |
Liu H H, Chen D L, Wang Z Q, et al. Microwave-assi-sted molten-salt rapid synthesis of isotype triazine-/heptazine based g-C3N4 heterojunctions with highly enhanced photocatalytic hydrogen evolution performance[J]. Appl Catal B Environ, 2017, 203: 300–313.
DOI:10.1016/j.apcatb.2016.10.014 |
| [3] |
Wang X, Maeda K, Thomas A, et al. A metal-free polymeric photocatalyst for hydrogen production from water under visible light[J]. Nat Mater, 2009, 8(1): 76–80.
DOI:10.1038/nmat2317 |
| [4] |
a. Zhang J S, Zhang M W, Lin S, et al. Molecular doping of carbon nitride photocatalysts with tunable bandgap and enhanced activity[J]. J Catal, 2014, 310: 24-30. b. Han Miao-miao(韩苗苗). Urea-formaldehyde resin derived P-doped tungsten carbide on N-carbon sheets (P-W2C@NC) as all pH HER catalyst(脲醛树脂衍生的含氮碳层包覆的磷掺杂碳化钨(P-W2C@NC)全pH析氢催化剂)[J]. J Mol Catal(China)(分子催化), 2020, 34(5): 454-461. |
| [5] |
Chen X F, Zhang J S, Fu X Z, et al. Fe-g-C3N4-Cata-lyzed oxidation of benzene to phenol using hydrogen peroxide and visible light[J]. J Am Chem Soc, 2009, 131(33): 11658–11659.
DOI:10.1021/ja903923s |
| [6] |
Zhang Y J, Mori T, Ye J H, et al. Phosphorus-doped carbon nitride solid: Enhanced electrical conductivity and photocurrent generation[J]. J Am Chem Soc, 2010, 132(18): 6294–6295.
DOI:10.1021/ja101749y |
| [7] |
Zhang G G, Zhang M W, Ye X X, et al. Iodine mod-ified carbon nitride semiconductors as visible light photocatalysts for hydrogen evolution[J]. Adv Mater, 2014, 26(5): 805–809.
DOI:10.1002/adma.201303611 |
| [8] |
Wen J, Xie J, Chen X, et al. A review on g-C3N4-based photocatalysts[J]. Appl Surf Sci, 2017, 391: 72–123.
DOI:10.1016/j.apsusc.2016.07.030 |
| [9] |
Zhou L, Zhang H, Sun H, et al. Recent advances in non-metal modification of graphitic carbon nitride for photocatalysis: A historic review[J]. Catal Sci Technol, 2016, 6(19): 7002–7023.
DOI:10.1039/C6CY01195K |
| [10] |
Zhang G G, Li G S, Lan Z A, et al. Optimizing optical absorption, exciton dissociation, and charge transfer of a polymeric carbon nitride with ultrahigh solar hydrogen production activity[J]. Angew Chem Int Ed, 2017, 56(43): 13445–13449.
DOI:10.1002/anie.201706870 |
| [11] |
Zhang G, Savateev A, Zhao Y, et al. Advancing the n-pi* electron transition of carbon nitride nanotubes for H2 photosynthesis[J]. J Mater Chem A, 2017, 5(25): 12723–12728.
DOI:10.1039/C7TA03777E |
| [12] |
Su F Y, Xu C Q, Yu Y X, et al. Carbon self-doping ind-uced activation of n-pi* electronic transitions of g-C3N4 nanosheets for efficient photocatalytic H2 evolution[J]. Chemcatchem, 2016, 8(22): 3527–3535.
DOI:10.1002/cctc.201600928 |
| [13] |
Deifallah M, McMillan P F, Cora F. Electronic and structural properties of two-dimensional carbon nitride graphenes[J]. J Phys Chem C, 2008, 112(14): 5447–5453.
DOI:10.1021/jp711483t |
| [14] |
Jorge A B, Martin D J, Dhanoa M T S, et al. H2 and O2 evolution from water half-splitting reactions by graphitic carbon nitride materials[J]. J Phys Chem C, 2013, 117(14): 7178–7185.
DOI:10.1021/jp4009338 |
| [15] |
Chen Y, Wang B, Lin S, et al. Activation of n- > pi* transitions in two-dimensional conjugated polymers for visible light photocatalysis[J]. J Phys Chem C, 2014, 118(51): 29981–29989.
DOI:10.1021/jp510187c |
| [16] |
Li Y X, He R C, Han P, et al. A new concept: Volume photocatalysis for efficient H2 generation - using low polymeric carbon nitride as an example[J]. Appl Catal B Environ, 2020, 279: 119379.
DOI:10.1016/j.apcatb.2020.119379 |
| [17] |
Xu J Y, Li Y X, Peng S Q, et al. Eosin Y-sensitized graphitic carbon nitride fabricated by heating urea for visible light photocatalytic hydrogen evolution: The effect of the pyrolysis temperature of urea[J]. Chem Chem Phys, 2013, 15(20): 7657–7665.
DOI:10.1039/c3cp44687e |
| [18] |
Shalom M, Inal S, Fettkenhauer C, et al. Improving carbon nitride photocatalysis by supramolecular preorganization of monomers[J]. J Am Chem Soc, 2013, 135(19): 7118–7121.
DOI:10.1021/ja402521s |
| [19] |
Hu S Z, Ma L, You J G, et al. A simple and efficient method to prepare a phosphorus modified g-C3N4 visible light photocatalyst[J]. RSC Adv, 2014, 4(41): 21657–21663.
DOI:10.1039/C4RA02284J |
| [20] |
Wang H, Bu Y D, Wu G, et al. The promotion of the photocatalytic nitrogen fixation ability of nitrogen vacancy-embedded graphitic carbon nitride by replacing the corner-site carbon atom with phosphorus[J]. Dalton Trans, 2019, 48(31): 11724–11731.
DOI:10.1039/C9DT01261C |
| [21] |
Li H, Shang J, Ai Z H, et al. Efficient visible light nitrogen fixation with BiOBr nanosheets of oxygen vacancies on the exposed {001} facets[J]. J Am Chem Soc, 2015, 137(19): 6393–6399.
DOI:10.1021/jacs.5b03105 |
| [22] |
Zhao W R, Zhang J, Zhu X, et al. Enhanced nitrogen photofixation on Fe-doped TiO2 with highly exposed (101) facets in the presence of ethanol as scavenger[J]. Appl Catal B Environ, 2014, 144: 468–477.
DOI:10.1016/j.apcatb.2013.07.047 |
| [23] |
Ranjit K T, Varadarajan T K, Viswanathan B. Photocatalytic reduction of dinitrogen to ammonia over noble-metal-loaded TiO2[J]. J Photochem Photobiol A Chem, 1996, 96(1/3): 181–185.
|
| [24] |
Rusina O, Linnik O, Eremenko A, et al. Nitrogen photofixation on nanostructured iron titanate films[J]. Chem Eur J, 2003, 9(2): 561–565.
DOI:10.1002/chem.200390059 |
| [25] |
Wang Y, Wang X C, Antonietti M. Polymeric graphitic carbon nitride as a heterogeneous organocatalyst: From photochemistry to multipurpose catalysis to sustainable chemistry[J]. Angew Chem Int Ed, 2012, 51(1): 68–89.
DOI:10.1002/anie.201101182 |
| [26] |
Wu D D, Hu S N, Xue H Y, et al. Protonation and micr-owave-assisted heating induced excitation of lone-pair electrons in graphitic carbon nitride for increased photocatalytic hydrogen generation[J]. J Mater Chem A, 2019, 7(35): 20223–20228.
DOI:10.1039/C9TA05135J |
| [27] |
Zhu Y P, Ren T Z, Yuan Z Y. Mesoporous phosphorus-doped g-C3N4 nanostructured flowers with superior photocatalytic hydrogen evolution performance[J]. ACS Appl Mater Interf, 2015, 7(30): 16850–16856.
DOI:10.1021/acsami.5b04947 |
| [28] |
Ma H Q, Shi Z Y, Li S, et al. Large-scale production of graphitic carbon nitride with outstanding nitrogen photofixation ability via a convenient microwave treatment[J]. Appl Surf Sci, 2016, 379: 309–315.
DOI:10.1016/j.apsusc.2016.04.085 |
| [29] |
Lei W, Portehault D, Dimova R, et al. Boron carbon nitride nanostructures from salt melts: Tunable water-soluble phosphors[J]. J Am Chem Soc, 2011, 133(18): 7121–7127.
DOI:10.1021/ja200838c |
| [30] |
Ma X G, Lv Y H, Xu J, et al. A strategy of enhancing the photoactivity of g-C3N4 via doping of nonmetal elements: A first-principles study[J]. J Phys Chem C, 2012, 116(44): 23485–23493.
DOI:10.1021/jp308334x |
| [31] |
Hu S Z, Li Y M, Li F Y, et al. Construction of g-C3N4/Zn0.11Sn0.12Cd0.88S1.12 hybrid heterojunction catalyst with outstanding nitrogen photofixation performance induced by sulfur vacancies[J]. ACS Sus Chem Eng, 2016, 4(4): 2269–2278.
DOI:10.1021/acssuschemeng.5b01742 |
| [32] |
Hu S Z, Chen X, Li Q, et al. Effect of sulfur vacancies on the nitrogen photofixation performance of ternary metal sulfide photocatalysts[J]. Catal Sci Technol, 2016, 6(15): 5884–5890.
DOI:10.1039/C6CY00622A |
| [33] |
Ge L, Han C. Synthesis of MWNTs/g-C3N4 composite photocatalysts with efficient visible light photocatalytic hydrogen evolution activity[J]. Appl Catal B Environ, 2012, 117: 268–274.
|
| [34] |
Dong G H, Jacobs D L, Zang L, et al. Carbon vacancy regulated photoreduction of NO to N2 over ultrathin g-C3N4 nanosheets[J]. Appl Catal B Environ, 2017, 218: 515–524.
DOI:10.1016/j.apcatb.2017.07.010 |
| [35] |
Xu Y, Xu H, Wang L, et al. The CNT modified white C3N4 composite photocatalyst with enhanced visible-light response photoactivity[J]. Dalton Trans, 2013, 42(21): 7604–7613.
DOI:10.1039/c3dt32871f |
| [36] |
Qu X Y, Hu S Z, Bai J, et al. Synthesis of band gap-tunable alkali metal modified graphitic carbon nitride with outstanding photocatalytic H2O2 production ability via molten salt method[J]. J Mater Sci Tech, 2018, 34(10): 1932–1938.
DOI:10.1016/j.jmst.2018.04.019 |
 2022, Vol. 36
2022, Vol. 36


