二氧化碳的排放急剧增加, 导致的气候变化和全球变暖对人类来说已经成为一项巨大挑战. 鉴于此, 我国提出“碳中和”和“碳达峰”远景目标. 甲醇(CH3OH)是工业化学品的关键原料, 可进一步转化为高分子替代液体燃料[1], 利用可再生的氢能源将温室气体CO2还原成高附加值的甲醇是实现“碳中和”的有效途径[2]. 2010年, 液化空气研发有限公司和鲁奇有限公司报道了工业Cu/ZnO/Al2O3催化剂CO2单程转化率在35%~45%之间, 催化剂在投产的前100 h内略有失活, 在随后的600 h内保持稳定运行, 甲醇的时空产率(STY)约为0.6 kg·Lcat-1·h-1. 2019年, 中石油与大连化学物理研究所合作开展了CO2制甲醇中试, CO2转化率大于20%, 甲醇选择性为70%[3]. 目前在工业上应用广泛的Cu-Zn催化剂, 仍然存在转化率、选择性较低, 寿命短的短板[4]. 因此, 高效催化剂的研究始终是CO2加氢制甲醇的关键, 而纳米材料因其量子尺寸效应在催化反应中有着独特的优势. 我们探讨了CO2加氢制甲醇的机理研究, 综述了纳米材料在CO2加氢制甲醇中的应用并给出研发高效催化剂可能的方向.
1 CO2加氢制甲醇机理研究了解反应机理是制备高效催化剂的关键, 现有关于CO2制甲醇合成机理大部分都是建立在Cu基催化剂的基础上[5-8], 按照反应途径及中间关键体上的区别可划为3类: HCOO*为关键中间体甲酸盐(HCOO*)机理[8-12]、CO为关键中间体的RWGS(逆水煤气)机理[13-14, 6, 15-17]及HCOOH*为关键中间体trans-HOCO*机理[18-20](如图 1).
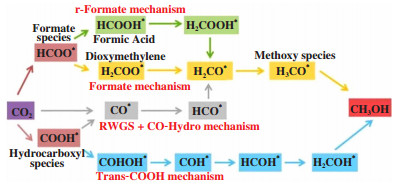
|
图 1 CO2加氢制甲醇反应机制[3] Fig.1 Proposed reaction mechanisms for methanol synthesis from CO2 hydrogenation[3] |
在早期探索中, Yoshihara等[21]在CO2制甲醇反应后, 发现Cu催化剂表面上被一整层吸附的甲酸盐覆盖, 且未检测到其他含碳或氧的化合物, 这也有力证明了在二氧化碳制甲醇的过程中, HCOO*是关键中间体[22]. 在以甲酸盐为中间体的路径中, CO2首先与表面H原子反应生成HCOO, 然后HCOO加氢生成二甲醛(H2COO), 随后进一步加氢生成甲氧基(H3CO), 最终生成甲醇(CH3OH)[23]. 因此, Yao等[24]推测的两个RDS(决速步骤): 吸附的CO2加氢生成甲酸盐中间体和甲氧基中间体加氢生成甲醇. Gogate等[25]通过同位素标记、示踪研究、表征和协同分析, 也表明甲酸盐是第一个反应中间体, 随后依次氢化为H2CO、H3CO及CH3OH. Kattel等[7]则通过DFT计算表明甲醇通过甲酸盐路径合成优先于RWGS途径, 这是因为RWGS+CO氢化路径上, CO为主要中间体, CO结合较弱, 阻碍了进一步氢化成*HCO.
在CO2加氢制甲醇的反应中, 往往伴随着RWGS反应的发生, 产物CO和H2O又为CO2加氢制甲醇的机理研究提供了新的思路. 有研究者证明了CO是CO2制甲醇的关键中间体(RWGS机理), 而不是CO2直接氢化得到的HCOO, 这也有效地解释了副产物CO的形成[26]. Tao等[14]采用DFT研究CO2加氢合成甲醇的反应机理时, 分别讨论了两种路线即CO路线和HCOOH路线, 其结果表明CO为中间体的RWGS机理更有优势, 因为中间产物trans-HOCO→HCOOH的放热量约为371.92 kJ/mol而trans-HOCO→CO的放热量为394.76 kJ/mol, 后者的形成能垒更低. Zhang等[15]通过DFT计算, 发现CO2直接解离为CO和O在Cu(111)面的势垒要比CO2加氢为COOH在Cu(211)势垒低, 因此HCOO被认为是旁观者, 反应机理是以CO为中间体的RWGS机理(如图 2所示), CO和甲酸盐的生成动力学障碍都低, 但CO才是进一步氢化的中间体[27].
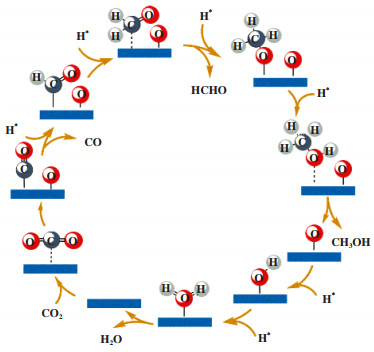
|
图 2 CO2在铜团簇和扩展表面上加氢制甲醇的反应机理[15] Fig.2 Reaction mechanism of CO2 hydrogenation to methanol on Cu cluster sand extended surfaces[15] |
Zhao等[19]探究H2O在CO2加氢制甲醇的反应网络中的作用时, 发现甲酸盐在Cu(111)上直接加氢合成甲醇是不可行的, 因为其进一步氢化能垒较高, 且H2O的存在会使CO2加氢生成trans-COOH在动力学上比甲酸盐更有利. Tao等[14]的研究也证明了这点, trans-COOH在构型上相比cis-COOH更有优势, 能垒更低. 在trans-COOH机理里, CO2加氢生成trans-COOH, trans-COOH随后通过二羟基亚甲基卡宾(COHOH)中间体转化为羟基亚甲基(COH), 然后通过3个连续氢化步骤形成羟亚甲基(HCOH)、羟甲基(H2COH)和甲醇[3]. 更重要的是, 其再次强调光谱观察到的表面物种通常不是关键反应中间体, 而是旁观者.
尽管Cu基催化剂在CO2加氢制甲醇工业化上有了广泛的应用, 非铜基活性组分如Zn[7, 25, 28-30]、Zr[31-35]、In[36-38]、Pd[39-41]等金属也在该反应上有着不俗的催化活性, 其中In基催化剂因其对CO2制甲醇反应上的高选择性而备受关注[42-43]. Ye等[9]通过DFT计算, 认为在理想的In2O3表面上, CO2加氢生成甲酸盐物种比质子化生成重碳酸盐物种更有利, 并且CO2加氢制甲醇是在In2O3(110)表面上通过HCOO*机理进行的. Frei等[44]在研究CO2在氧化铟催化下制备甲醇的反应机理时, 将实验与计算结合, 提出在In2O3的(111)表面, H2活化产生Hδ-氢化物并转移到化学吸附的CO2产生的甲酸盐(CHOO-)上, 表面的Hδ-替代转移合成了COOH, 后续的质子因为较高的吉布斯自由能而无法转移形成甲酸(ΔG= 1.95 eV), 随后第二个H2分子被异质吸附到与化学吸附的甲酸中间体相邻的In-O对上, 伴随着较低的活化能(ΔG= 0.29 eV)Hδ-再次插入到中间体上形成CH2OOH(图 3红色路径), 接下来便出现两种路径:
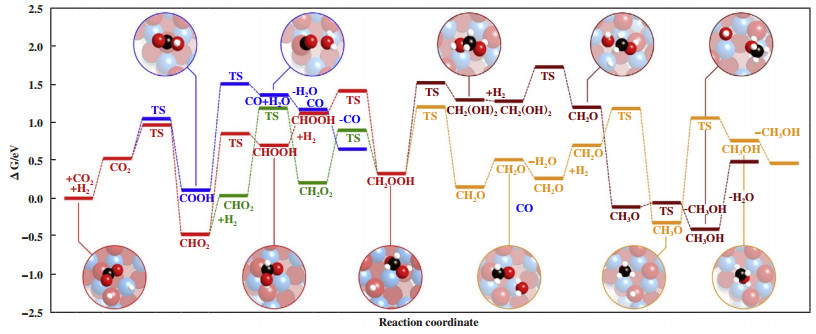
|
图 3 具代表性的CO2加氢反应吉布斯能量分布图[44] Fig.3 Gibbs energy profile for the hydrogenation of CO2 through the most representative paths (The hydrogenation of CO2 to CH2OOH is shown in red; The two possible routes to CH3OH from this species are depicted in orange and maroon; The alternative formation of CH2OOH from CHO2 through the co-adsorption of two H2 molecules is shown in green; The RWGS reaction is marked in blue. Conditions: P=5 MPa and T=300 ℃ In (blue), O (red), C(black), and H (white) TS=transition state[44] |
1. 与表面位置结合的CH2OOH的O被质子化(图 3栗色路径)
2. 其羟基质子化生成CH2O和H2O(图 3橙色路径)
途径1: CH2OOH质子化生成CH2(OH)2, 吸附第3个H2分子后, 羟基从中间体解离, 填补空位. 同时伴随着质子相表面氧转移产生物理吸附的甲醛. 甲醛与氢化物反应活化能可以忽略, 很容易生成甲醇, 最后甲醇被质子化后解析出来.
途径2: CH2OOH解离成CH2O和OH-, OH-质子化形成水并解析出来. 第3个H2分子在化学吸附的甲醛旁边的In-O对上解离, Hδ-转移到CH2O形成甲醇, 最后自发解吸. 总而言之, In2O3催化的CO2加氢反应机理可归纳为氢化物-质子转移, 其作用方式与含受阻路易斯酸碱对的氧化物的相似. 基于DFT计算结果, 控制选择性的反应步骤与竞争反应活化能之差为0.23 eV, 与0.29 eV的实验结果比较吻合.
在CO2加氢制甲醇反应中, 谁是参与者, 谁是旁观者一直存在争议, 有研究表明该过程可能为多途径同时作用或以操作条件变化而轮换. Studt等[5]的研究发现, Cu的CO覆盖率可高达0.1 mL, 而Zn的掺杂会使CO氢化位点失活, CO的覆盖率几乎为零, 且通过微量热测量实验表明, ZnO改性的Cu催化剂上CO结合较弱, 而Zn导致CO2加氢显著增强. Gaikwad等[45]则发现温度对反应途径有着重要影响, 甲醇在180 ℃下是由CO2直接加氢生成的, 而在260 ℃以上, 甲醇是由逆水煤气变换反应生成的CO中间体, 再次加氢合成的(如图 4).
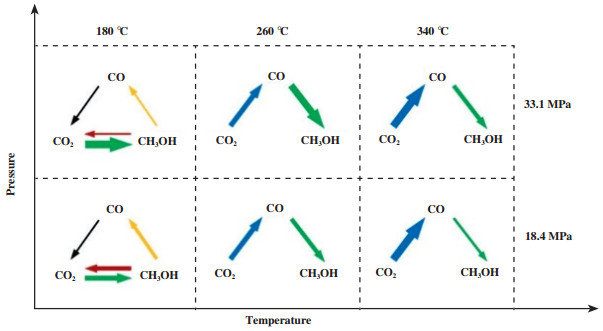
|
图 4 不同反应条件下, Cu/ZnO/Al2O3催化剂上高压CO2加氢的主要反应途径[45] Fig.4 Major reaction path ways in high-pressure CO2 hydrogenation over Cu/ZnO/Al2O3 catalyst at different reaction conditions 箭头的宽度显示一个物种向其他物种转化的数量 The width of the arrow shows the amount of one species transformation to others[45] |
综上所述, 尽管对不同金属催化的CO2制甲醇的催化机理有了较多的研究和报道, 然而就催化CO2加氢制甲醇中何者为参与者, 何者为旁观者, 即反应后包覆催化剂的是关键中间体还是不参与甲醇合成的中间体, 仍然没有明确.
2 纳米材料在CO2加氢制甲醇中的应用Zhang等[15]采用DFT和微观动力学模拟系统的研究了Cu团簇的大小对反应物和反应中间体结合强度的影响及CO2加氢过程中基本步骤的活化能垒. 结果表明中等大小的Cu19团簇表现出最高加氢活性, 这可归因于适度的CO2覆盖率和低的CO2解离能垒. 此外, 最佳的活性与反应中间体的键合强度有关. Cu颗粒尺寸效应来源于反应中间产物吸附能的变化, 这可能与Cu团簇的d带位置有关, d带中心的上移通常会加强金属与中间体之间的键合作用, 从而影响CO2还原活性. Karelovic等[46]的实验结果对Zhang等[15]关于粒径的研究给予了佐证, Karelovic等[46]采用(W/O)微乳液法调控合成了Cu的不同平均粒径(4~36 nm)的Cu/SiO2纳米催化剂, 对比了粒径大小对CO2制甲醇过程的影响. 结果表明大颗粒下(> 10 nm)甲醇和CO形成的本征速率比小颗粒(约4 nm)高3倍. 由观察到的类似动力学参数和H/D动力学同位素效应表明, 表面活性位点具有类似的拓扑结构, 而阶跃边缘中心可能是甲醇和CO催化活性中心, 该活性位点随着粒径的增加而增加, 实验结果还表明CO/CH3OH的生成速率比与H2分压成反比.
Sharma等[47]研究了TiO2纳米晶负载的Cu在CO2加氢制甲醇反应上的催化性能. 研究者分别采用水热合成法(HT)和初始浸渍法(IMP)合成了5%Cu-TiO2, Cu粒径平均分别为3.8和15.2 nm. 200 ℃和3.0 MPa下, Cu-TiO2HT催化剂表现出优异的催化活性、CO2转化率(~9.4%)和甲醇选择性(~96%), Cu-TiO2IMP催化剂的CO2转化率低(~6%), CO选择性高(~40%). 相对于较大的Cu颗粒(活化势垒127 kJ/mol), 较小Cu团簇上的Cu-TiO2界面以较小的CO2活化势垒(93 kJ/mol)通过COOH中间体为CO2活化提供了一个低障碍路径. 随着Cu负载量的增加, Cu颗粒尺寸增大(金属弥散减小), 活性Cu物种数量减少, 导致CO2转化率降低. 当温度从200升高到300 ℃时, CO2转化率增加, 但对甲醇的选择性降低, 对CO的选择性增加. 这是因为RWGS反应是吸热反应, 在高温下更容易发生. DFT计算结果表明, CO2直接加氢生成HCOO在动力学和热力学上都优于COOH, 然而, H2CO物种(甲酸途径中的中间物种)的低稳定性表明HCOO物种会在铜表面聚集导致甲醇产率有限. 尽管甲酸盐在动力学上有利, 但它很可能在CO2加氢途径中扮演旁观者的角色, 原位DRIFTS分析中观察到的双齿甲酸盐进一步支持了这种结论, 即甲酸不太可能参与甲醇的形成.
Jiang等[12]考虑到CeO2的晶面与其形貌密切相关, 采用水热合成法制备了棒状、立方体、多面体和八面体4种不同形貌的CeO2作为Pd金属的载体, 创建载体-金属界面位置, 并通过氧空位浓度、碱度或酸度等改变表面性质. H2在钯上的活化是很容易的, H2可以自发离解并在钯簇上形成两个吸附原子, 相比之下, CO2的活化要困难得多, 通常需要离解的氢原子的辅助. CO2的活化被认为是决定CO2加氢催化活性的因素, 而氧空位是CO2活化的活性位点. 一方面, 由于路易斯酸的性质, 氧空位可以通过路易斯酸碱相互作用, 与CO2中O原子的非成键电子相互作用; 另一方面表面氧空位有利于二氧化碳吸附和活化. 此外, CO2的活化不仅与氧空位的数目有关, 而且与它们的反应活性有关, 但这两个因素总是以反比的方式变化. 不同形状的CeO2具有不同的晶面, 从而表现出氧空位密度的变化, 其中棒状CeO2作为载体的Pd/CeO2-R催化剂的催化活性最高, 达到了最高的时空产率1.3 mmol·gcat-1 ·h-1. 这可以归因于棒状CeO2具有最高的氧空位密度和最多的氧空位, 并且Pd还促进了CeO2-R(110)面氧空位的形成和较高的氧迁移率.
Rui等[37]报道了一种In2O3负载的Au催化剂表现出优异CO2加氢制甲醇催化性能. 225 ℃下选择性达到100%, 275 ℃下选择性为70%, 300 ℃时达到67.8%, 产率达到0.47 gMeOH· gcat-1·h-1. 利用时间分辨X射线衍射(TR-XRD)、环境压力X射线光电子能谱(AP-XPS)和X射线吸收光谱(XAS)进行原位表征, 证实了金属与载体之间的强相互作用导致了具有活性的Auδ+-In2O3-x界面, 而Auδ+-In2O3-x界面位点是高效催化CO2活化并加氢生成甲醇的关键, 而不是CO的生成. Au与In2O3载体之间的强相互作用使其较于其他氧化物载体负载Au性能高出近20倍, Au-In2O3键合有利于贵金属的分散, 并防止其在高温反应条件下的烧结. 这也是目前Au催化CO2制甲醇性能最佳的报道.
Gutterϕd等[48]将Pt纳米颗粒负载在UiO Zr-MOFs材料上, 通过稳态和瞬态同位素交换实验和DFT计算研究了Pt-MOF界面的Zr缺陷节点的动态作用及H2O对CO2加氢反应的影响. 结果表明, 甲醇和甲烷生成速率随Zr节点缺陷数量增加而增加, 与更多的表面中间体数量联系起来. CO的生成速率几乎不随缺陷密度变化, 表明CO的限速步骤发生在Pt纳米颗粒上, 而甲醇和甲烷的生成发生在Pt-Zr节点界面上, 在脱水节点上甲醇和甲烷的生成速率均高于水合节点. 瞬态实验表明, H2O的引入使大量甲醇从催化剂中脱附, 而水的去除会引起再吸附, 且没有观察到H从H2O转移到解吸的甲醇, 说明解吸的原因是竞争吸附. 虽然水的加入促进了甲醇的脱附, 但水并不改变甲醇的稳态反应速率, 而对CH4的生成有明显的抑制作用, 这表明水可以提高反应对甲醇的选择性.
纳米材料粒径小, 表面能较高, 极易团聚失活. 因此, Cui等[49]采用水热合成法将CuZn-HKUST-1纳米颗粒包封于Na-ZSM-5中, 优化后的Cu/ZnOx@Na-ZSM-5催化剂的甲醇时空产率(STYMeOH)为44.88 gMeOH·gCu-1·h-1, 远高于相同条件下负载型的Cu/ZnOx/Na-ZSM-5催化剂的13.32 gMeOH·gCu-1·h-1和工业Cu/ZnO/Al2O3催化剂(8.46 gMeOH·gCu-1·h-1). 更重要的是, 商业Cu/ZnO/Al2O3催化剂在100 h的寿命测试中损失了一半的STYMeOH, 而包封的Cu/ZnOx@Na-ZSM-5催化剂活性几乎没变. 这可归因于后者的空间限制为活性相提供了紧密环境, 有效避免了Cu-ZnOx界面的分离, 同时还避免了活性相团聚造成的失活, 再次证明了限制效应在制备高效稳定催化剂中的重要性.
Hu等[50]采用水热合成制备了MoS2纳米片催化CO2制甲醇, 在180 ℃条件下, 该催化剂的CO2转化率为12.5%, 甲醇选择性达到了94.3%, 催化剂寿命测试表明, 催化剂的活性或甲醇选择性在3000 h内没有衰退迹象. 通过高灵敏度低能离子散射光谱(HS-LEIS)、X射线光电子能谱(XPS)、原位X射线吸收近边结构(XANES)谱、原位电子顺磁共振(EPR)谱结果表明H2预处理还原脱除S导致S空位的形成和配位不饱和Mo原子的暴露, 而S空位是影响CO2加氢制甲醇催化剂活性的关键因素, 且平面内S空位抑制CO2深度加氢生成甲烷, 从而驱动CO2选择性加氢生成甲醇. 研究者设计不同S空位浓度的MoS2纳米片催化剂, 实验结果也支持该结论. 为进一步研究S空位对甲醇选择性的影响, 设计合成了一种边缘活性中心丰富且S空位密度大于FL-MoS2的纳米孔MoS2催化剂(NP-MoS2), 但FL-MoS2始终表现出更高的甲醇选择性. 此外还采用31P魔角旋转核磁共振(MASNMR)和DFT计算证明了面内S空位密度与甲醇生成速率之间呈线性相关, 进一步验证了面内S空位比边缘S空位更有利于CO2加氢合成甲醇, 边缘S空位导致甲烷的生成.
CO2还原制备甲醇往往需要高温高压的操作条件(200~250 ℃, 5~10 MPa). Xiao等[51]首次报道了利用热电材料从温度变化中收集能量, 在接近于室温条件下实现CO2还原制甲醇. 采用水热合成法制备了Bi2WO6纳米板, 在黑暗环境下, NaHCO3溶液上悬浮催化剂粉末, 通入高纯度CO2后密封, 在一定温度范围下变换温度搅拌加热. 20次热循环后甲醇产率达到20.5 μmol·g-1, CH4和CO产率分别为11和0.20 μmol·g-1, 具有较高的甲醇选择性, 研究者通过类比光催化工程电子和空穴对催化效率的影响, 加入了Na2SO3以提供负电荷, 20次热循环后甲醇产率达到55.0 μmol·g-1, 产率提升了2.5倍. 恒定温度下几乎不能检测到甲醇或其他产物, 且甲醇产率随温度变换范围的增大而增加, 这归因于较大温度范围内可以产生更多的热释电荷, 从而获得了更好的热释电催化效果. 通过DFT等理论计算推测出催化机理(如图 5), a: 催化剂温度不变, 其自发极化与束缚电荷达到平衡; b: 温度的迅速上升打破了平衡, 从而引起了CO2还原反应; c: 在CO2还原反应后, 建立了新的平衡; d: 当温度下降时, 相反的电荷转移, 导致新的CO2减排过程. 这也为后续较低操作环境下CO2还原制甲醇提供了思路.
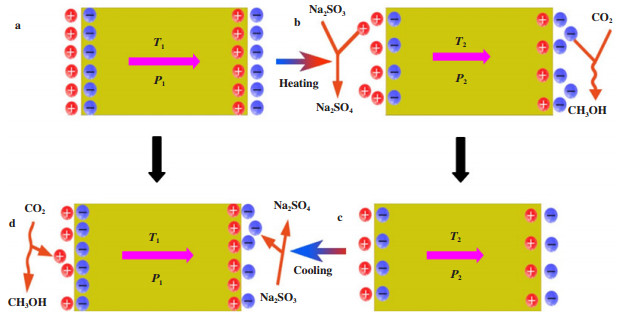
|
图 5 热释电Bi2WO6纳米板热催化CO2还原机理研究[51] Fig.5 The mechanism of pyro-catalytic CO2 reduction in duced by pyroelectric Bi2WO6 nanoplate[51] |
Meng等[52]通过调节与性能相关的电子-金属-载体相互作用(EMSI)制备了高活性高选择性分散均匀的InNi3C0.5/ZrO2纳米催化剂, InNi3C0.5平均粒径在16.0±0.5 nm. InNi3C0.5表现出强烈的ZrO2载体依赖性, InNi3C0.5/SiO2催化剂的甲醇选择性高达90%, 而CO2转化率仅为2.5%, 远低于热力学平衡转化率的11.6%. InNi3C0.5/m-ZrO2(m为单斜晶系)实现了11.2%的CO2转化率及85.4%的甲醇选择性, 而纯ZrO2和SiO2的CO2转化率均不超过0.7%. InNi3C0.5和ZrO2形成了一种特殊的EMSI, 从而提高了催化剂活性, 而EMSI显示出很强的ZrO2依赖性. 进一步研究发现EMSI增强了InNi3C0.5的电子密度, 且氧空位密度得到了改善, EMSI与富含氧空位的可还原氧化物紧密相关. 因此研究者采用Fe2O3来负载InNi3C0.5纳米颗粒, 最优条件下, CO2转化率达到18.8%, 甲醇选择性达到92.8%, 而且拥有极好的催化寿命, 测试500 h后未发现烧结和FeCx物质, 但这种与催化性能相关的EMSI的性质仍不清楚.
综上所述, 对CO2加氢制甲醇这种结构敏感型反应, 纳米催化剂因其量子尺寸效应有着独特的优势. 此外, 优异的催化活性似乎都离不开活性金属与载体之间的相互作用, 这种相互作用的内在机理却不明了. 同时, 研究者还实现了温和操作条件下CO2还原制甲醇, 这也为实现低能耗的绿色催化提供了路径.
3 结语鉴于中国“碳中和、碳达峰”的远景目标, 利用纳米材料将温室气体CO2进一步加氢制备成高附加值的甲醇是一条非常有前景和实际意义的路线. 当前最佳的纳米催化剂实现了18.8%的CO2转化率和92.8%甲醇选择性(尚未工业化), 且有报道实现了较低温下CO2加氢制甲醇, 但反应过程中的多金属催化剂的活性位点和催化机理的研究, 如何进一步兼顾反应中CO2转化率及甲醇选择性仍是重大挑战. 鉴于此, 未来CO2加氢制甲醇催化剂的研究关键可能包括几点:
(1)活性位点和CO2加氢制甲醇的机理研究. 明确活性位点及活性组分、助活性组分和载体之间的相互作用, 解析活性中心的几何和电子结构为高选择性和高活性的高效催化剂的制备有指导意义. 此外, 尽管现在对该反应机理的研究在理论计算和实验表征上有较多报道, 但仍然没有解释何为关键中间体, 何为旁观者, 内在催化机理尚不明确. 因此采用原位分析技术及DFT计算等检测技术与理论计算相结合来探索关键中间体及甲醇合成路线的研究工作仍是难点.
(2)纳米催化剂的制备方法. 纳米材料在CO2加氢制甲醇中表现出优异的催化性能, 但纳米材料的粒径及活性界面影响着催化活性, 纳米颗粒粒径越小越容易结合反应物和反应中间体, 纳米颗粒粒径增大后CO、OH、O的吸附能显著降低, 许多报道已证明活性位点可能存在拓扑结构. 因此, 粒径和形态可控的纳米催化剂的制备也是关键.
(3)多组分高效催化剂的探索. 工业应用广泛的Cu基催化剂, 催化活性、选择性和寿命仍不理想, 而许多研究表明Ce、Zr等活性金属在CO2加氢制甲醇上表现出不俗的催化性能, 因此, 利用多活性组分或金属载体之间的相互作用, 加速高效纳米催化剂的开发, 以调节转化率和选择性不能兼顾的矛盾. 此外, 降低反应对高温高压的操作要求, 采用经济环保的CO2还原方式以实现低能耗、高质量的绿色催化目标.
| [1] |
a. Nadeem S, Mumtaz A, Alnarabiji M S, et al. Highly porous Zr-MCM-48 immobilized Cu-porphyrin for photocatalytic reduction of CO2 to methanol in a slurry reactor[J]. J Mater Sci- Mater Electron, 2021, 32(17): 22060-22075. b. Pan Yin-yin(潘茵茵), Song Guang-jie(宋广杰), Xue Kuan-rong(薛宽荣), et al. The development of hydroformylation of alkenes and alkynes with syngas substitutes(非合成气法烯烃、炔烃氢甲酰化研究进展)[J]. J Mol Catal(China)(分子催化), 2021, 35(2): 166-177. c. Liang Zhi-ming(梁志铭), Nie Xiao-wa(聂小娃), Guo Xin-wen(郭新闻), et al. DFT Insight into the effect of ni doping on hydrocarbons synthesis from CO2 hydrogenation over Fe catalyst(镍掺杂对Fe催化剂上CO2加氢制烃影响的理论计算研究)[J]. J Mol Catal(China)(分子催化), 2020, 34(4): 293-303. d. Qi Zhi-fu(祁志福), Zhuo Zuo-xi(卓佐西), Hu Chen-hui(胡晨晖), et al. Synthesis of hollow-structured ZSM-5 using silicalite-1 as seeds(以纯硅silicalite-1为晶种制备空心结构ZSM-5沸石分子筛)[J]. J Mol Catal(China)(分子催化), 2021, 35(6): 495-502. |
| [2] |
a. Wang Jiang-tao(王江涛), Lu Xiao-bin(鹿晓斌). Together development of "methanol economy" and"hydrogen economy" driven by CO2 utilization(CO2促进"甲醇经济"与"氢经济"共同发展)[J]. Mod Chem Ind(现代化工), 2021, 41(07): 14-18+25. b. He Yu-mei(何玉梅), Liu Bing(刘冰), Li Jin-lin(李金林). The study of CO2 hydrogenation activity over CexZr1-xO2/Co/C-N catalysts(CexZr1-xO2/Co/C-N催化CO2加氢性能研究)[J]. J Mol Catal(China)(分子催化), 2021, 35(6): 561-570. c. Hou Zhen-jiang(侯振江), Zhao Yu(赵鹬), Dong Peng(董鹏), et al. Progress of synthesis of styrene by toluene - methanol side chain alkylation(甲苯-甲醇侧链烷基化合成苯乙烯的研究进展)[J]. J Mol Catal(China)(分子催化), 2021, 35(2): 188-199. d. Zhang Jun-jie(张俊杰), Tursun Yalkunjan(亚力昆江·吐尔逊), Talifu Dilinuer(迪丽努尔·塔力甫), et al. In situ synthesis of Ru doped hollow BiOBr microsphere as an efficient photocatalyst for photo-catalytic CO2 reduction and organic pollutant degradation(Ru掺杂BiOBr空心微球的原位合成及其光催化CO2还原和有机污染物降解性能研究)[J]. J Mol Catal(China)(分子催化), 2020, 34(1): 8-18. |
| [3] |
Zhong J, Yang X, Wu Z, et al. State of the art and perspectives in heterogeneous catalysis of CO2 hydro-genation to methanol[J]. Chem Soc Rev, 2020, 49(5): 1385–1413.
DOI:10.1039/C9CS00614A |
| [4] |
Guil-López R, Mota N, Llorente J, et al. Methanol synthesis from CO2: A review of the latest developments in heterogeneous catalysis[J]. Materials, 2019, 12(23): 3902.
DOI:10.3390/ma12233902 |
| [5] |
Studt F, Behrens M, Kunkes E L, et al. The mechanism of CO and CO2 hydrogenation to methanol over Cu‐based catalysts[J]. Chem Cat Chem, 2015, 7(7): 1105–1111.
|
| [6] |
Grabow L C, Mavrikakis M. Mechanism of methanol synthesis on Cu through CO2 and CO hydrogenation[J]. ACS Catal, 2011, 1(4): 365–384.
DOI:10.1021/cs200055d |
| [7] |
Kattel S, Ramírez P J, Chen J G, et al. Active sites for CO2 hydrogenation to methanol on Cu/ZnO catalysts[J]. Science, 2017, 355(6331): 1296–1299.
DOI:10.1126/science.aal3573 |
| [8] |
Yang Y, Evans J, Rodriguez J A, et al. Fundamental studies of methanol synthesis from CO2 hydrogenation on Cu(111), Cu clusters, and Cu/ZnO(000)[J]. Phys ChemChem Phys, 2010, 12(33): 9909.
DOI:10.1039/c001484b |
| [9] |
Ye J, Liu C, Ge Q. DFT Study of CO2 adsorption and hydrogenation on the In2O3 surface[J]. J Phys Chem C, 2012, 116(14): 7817–7825.
DOI:10.1021/jp3004773 |
| [10] |
Huš M, Dasireddy V D B C, StrahStefancic N, et al. Mechanism, kinetics and thermodynamics of carbon dioxide hydrogenation to methanol on Cu/ZnAl2O4 spinel-type heterogeneous catalysts[J]. Appl Catal B: Environ, 2017, 207(15): 267–278.
|
| [11] |
Hong Q J, Liu Z P. Mechanism of CO2 hydrogenation over Cu/ZrO2(212) interface from first-principles kinetics Monte Carlo simulations[J]. Surf Sci, 2010, 604(21/22): 1869–1876.
|
| [12] |
Jiang F, Wang S, Liu B, et al. Insights into the influence of CeO2 crystal facet on CO2 hydrogenation to methanol over Pd/CeO2 catalysts[J]. ACS Catal, 2020, 10(19): 11493–11509.
DOI:10.1021/acscatal.0c03324 |
| [13] |
Phongamwong T, Chantaprasertporn U, Witoon T, et al. CO2 hydrogenation to methanol over CuO-ZnO-ZrO2-SiO2 catalysts: Effects of SiO2 contents[J]. Chem Eng J, 2017, 316(15): 692–703.
|
| [14] |
Tao X, Wang J, Li Z, et al. Theoretical study on the reaction mechanism of CO2 hydrogenation to methanol[J]. Comput Theor Chem, 2013, 1023(1): 59–64.
|
| [15] |
Zhang X, Liu J X, Zijlstra B, et al. Optimum Cu nanoparticle catalysts for CO2 hydrogenation towards methanol[J]. Nano Energy, 2018, 43: 200–209.
DOI:10.1016/j.nanoen.2017.11.021 |
| [16] |
Wang W, Wang S, Ma X, et al. Recent advances in catalytic hydrogenation of carbon dioxide[J]. Chem Soc Rev, 2011, 40(7): 3703.
DOI:10.1039/c1cs15008a |
| [17] |
Goncalves R V, Vono L L R, Wojcieszak R, et al. Selective hydrogenation of CO2 into CO on a highly dispersed nickel catalyst obtained by magnetron sputtering deposition: A step towards liquid fuels[J]. Appl Catal B: Environ, 2017, 209(15): 240–246.
|
| [18] |
Li Y, Chan S H, Sun Q. Heterogeneous catalytic conversion of CO2: A comprehensive theoretical review[J]. Nanoscale, 2015, 7(19): 8663–8683.
DOI:10.1039/C5NR00092K |
| [19] |
Zhao Y F, Yang Y, Mims C, et al. Insight into methanol synthesis from CO2 hydrogenation on Cu(111): Complex reaction network and the effects of H2O[J]. J Catal, 2011, 281(2): 199–211.
DOI:10.1016/j.jcat.2011.04.012 |
| [20] |
Behrens M, Studt F, Kasatkin I, et al. The active site of methanol synthesis over Cu/ZnO/Al2O3 industrial catalysts[J]. Science, 2012, 336(6083): 893–897.
DOI:10.1126/science.1219831 |
| [21] |
Yoshihara J, Campbell C T. Methanol synthesis and reverse water-gas shift kinetics over Cu(110) model catalysts: Structural sensitivity[J]. J Catal, 1996, 161(2): 776–782.
DOI:10.1006/jcat.1996.0240 |
| [22] |
Wang Meng-lin(王梦琳). Controlled synthesis of metal nanocrystals for improved catalytic performance toward CO2 hydrogenation(金属纳米晶催化剂的可控合成及其二氧化碳加氢催化性能研究)[D]. Hefei(合肥): University of Science and Technology of China (中国科学技术大学), 2019.
|
| [23] |
Kanuri S, Roy S, Chakraborty C, et al. An insight of CO2 hydrogenation to methanol synthesis: Thermodynamics, catalysts, operating parameters, and reaction mechanism[J]. Int J Energy Res, 2022, 46(5): 5503–5522.
DOI:10.1002/er.7562 |
| [24] |
Yao L, Shen X, Pan Y, et al. Synergy between active sites of Cu-In-Zr-O catalyst in CO2 hydrogenation to methanol[J]. J Catal, 2019, 372(4): 74–85.
|
| [25] |
Gogate M R. Methanol synthesis revisited: Reaction mechanisms in CO/CO2 hydrogenation over Cu/ZnO and DFT analysis[J]. Pet Sci Technol, 2019, 37(5): 603–610.
DOI:10.1080/10916466.2018.1558248 |
| [26] |
Porosoff M D, Yan B, Chen J G. Catalytic reduction of CO2 by H2 for synthesis of CO, methanol and hydrocarbons: Challenges and opportunities[J]. Energy Environ Sci, 2016, 9(1): 62–73.
DOI:10.1039/C5EE02657A |
| [27] |
Kuhl K P, Cave E R, Abram D N, et al. New insights into the electrochemical reduction of carbon dioxide on metallic copper surfaces[J]. Energy Environ Sci, 2012, 5(5): 7050.
DOI:10.1039/c2ee21234j |
| [28] |
Kunkes E L, Studt F, Abild-Pedersen F, et al. Hydrogenation of CO2 to methanol and CO on Cu/ZnO/Al2O3: Is there a common intermediate or not?[J]. J Catal, 2015, 328: 43–48.
DOI:10.1016/j.jcat.2014.12.016 |
| [29] |
Zabilskiy M, Sushkevich V L, Newton M A, et al. Copper-zinc alloy-free synthesis of methanol from carbon dioxide over Cu/ZnO/faujasite[J]. ACS Catal, 2020, 10(23): 14240–14244.
DOI:10.1021/acscatal.0c03661 |
| [30] |
Marcos F C F, Lin L, Betancourt L E, et al. Insights into the methanol synthesis mechanism via CO2 hydrogenation over Cu-ZnO-ZrO2 catalysts: Effects of surfactant/Cu-Zn-Zr molar ratio[J]. J CO2 Util, 2020, 41: 101215.
DOI:10.1016/j.jcou.2020.101215 |
| [31] |
Rungtaweevoranit B, Baek J, Araujo J R, et al. Copper nanocrystals encapsulated in Zr-based metal-organic frameworks for highly selective CO2 hydrogenation to methanol[J]. Nano Lett, 2016, 16(12): 7645–7649.
DOI:10.1021/acs.nanolett.6b03637 |
| [32] |
Zhan H J, Shi X Y, Tang B, et al. The performance of Cu/Zn/Zr catalysts of different Zr/(Cu+Zn) ratio for CO2 hydrogenation to methanol[J]. Catal Commun, 2021, 149(15): 106264.
|
| [33] |
Tada S, Kayamori S, Honma T, et al. Design of interfacial sites between Cu and amorphous ZrO2 dedicated to CO2-to-methanol hydrogenation[J]. ACS Catal, 2018, 8(9): 7809–7819.
DOI:10.1021/acscatal.8b01396 |
| [34] |
Wang Y H, Gao W G, Wang H, et al. Structure–activity relationships of Cu-ZrO2 catalysts for CO2 hydrogenation to methanol: Interaction effects and reaction mechanism[J]. RSC Adv, 2017, 7(14): 8709–8717.
DOI:10.1039/C6RA28305E |
| [35] |
Stawowy M, Ciesielski R, Maniecki T, et al. CO2 Hydrogenation to methanol over Ce and Zr containing UiO-66 and Cu/UiO-66[J]. Catalysts, 2019, 10(1): 39.
DOI:10.3390/catal10010039 |
| [36] |
Wang J, Zhang G, Zhu J, et al. CO2 Hydrogenation to methanol over In2O3 -based catalysts: From mechanism to catalyst development[J]. ACS Catal, 2021, 11(3): 1406–1423.
DOI:10.1021/acscatal.0c03665 |
| [37] |
Rui N, Zhang F, Sun K, et al. Hydrogenation of CO2 to methanol on a Auδ+-In2O3-x catalyst[J]. ACS Catal, 2020, 10(19): 11307–11317.
DOI:10.1021/acscatal.0c02120 |
| [38] |
Jia X, Sun K, Wang J, et al. Selective hydrogenation of CO2 to methanol over Ni/In2O3 catalyst[J]. J Energy Chem, 2020, 50(11): 409–415.
|
| [39] |
Liu J, Qiao Q, Chen X, et al. PdZn bimetallic nano-particles for CO2 hydrogenation to methanol: Performance and mechanism[J]. Coll Surf A, 2021, 622(5): 126723.
|
| [40] |
Wu P, Zaffran J, Yang B. Role of surface species interactions in identifying the reaction mechanism of methanol synthesis from CO2 hydrogenation over intermetallic PdIn(310) steps[J]. J Phys Chem C, 2019, 123(22): 13615–13623.
DOI:10.1021/acs.jpcc.9b01847 |
| [41] |
Frei M S, Mondelli C, García-Muelas R, et al. Atomic-scale engineering of indium oxide promotion by palladium for methanol production via CO2 hydrogenation[J]. Nat Commun, 2019, 10(1): 3377.
DOI:10.1038/s41467-019-11349-9 |
| [42] |
Tsoukalou A, Abdala P M, Stoian D, et al. Structural evolution and dynamics of an In2O3 catalyst for CO2 hydrogenation to methanol: An operando XAS-XRD and in situ TEM study[J]. J Am Chem Soc, 2019, 141(34): 13497–13505.
DOI:10.1021/jacs.9b04873 |
| [43] |
Ye J, Liu C, Mei D, et al. Active oxygen vacancy site for methanol synthesis from CO2 hydrogenation on In2O3 (110): A DFT study[J]. ACS Catal, 2013, 3(6): 1296–1306.
DOI:10.1021/cs400132a |
| [44] |
Frei M S, Capdevila-Cortada M, García-Muelas R, et al. Mechanism and microkinetics of methanol synthesis via CO2 hydrogenation on indium oxide[J]. J Catal, 2018, 361: 313–321.
DOI:10.1016/j.jcat.2018.03.014 |
| [45] |
Gaikwad R, Reymond H, Phongprueksathat N, et al. From CO or CO2 : Space-resolved insights into high-pressure CO2 hydrogenation to methanol over Cu/ZnO/Al2O3[J]. Catal Sci Technol, 2020, 10(9): 2763–2768.
DOI:10.1039/D0CY00050G |
| [46] |
Karelovic A, Galdames G, Medina J C, et al. Mechanism and structure sensitivity of methanol synthesis from CO2 over SiO2-supported Cu nanoparticles[J]. J Catal, 2019, 369: 415–426.
DOI:10.1016/j.jcat.2018.11.012 |
| [47] |
Sharma S K, Banerjee A, Paul B, et al. Combined exper-imental and computational study to unravel the factors of the Cu/TiO2 catalyst for CO2 hydrogenation to methanol[J]. J CO2 Util, 2021, 50: 101576.
DOI:10.1016/j.jcou.2021.101576 |
| [48] |
Gutterod E S, Pulumati S H, Kaur G, et al. Influence of defects and H2O on the hydrogenation of CO2 to methanol over Pt nanoparticles in UiO-67 metal-organic framework[J]. J Am Chem Soc, 2020, 142(40): 17105–17118.
DOI:10.1021/jacs.0c07153 |
| [49] |
Cui W G, Li Y T, Yu L, et al. Zeolite-encapsulated ultra-small Cu/ZnOx nanoparticles for the hydrogenation of CO2 to methanol[J]. ACS Appl Mater Interfaces, 2021, 13(16): 18693–18703.
DOI:10.1021/acsami.1c00432 |
| [50] |
Hu J, Yu L, Deng J, et al. Sulfur vacancy-rich MoS2 as a catalyst for the hydrogenation of CO2 to methanol[J]. Nat Catal, 2021, 4(3): 242–250.
DOI:10.1038/s41929-021-00584-3 |
| [51] |
Xiao L, Xu X, Jia Y, et al. Pyroelectric nanoplates for reduction of CO2 to methanol driven by temperature-variation[J]. Nat Commun, 2021, 12(1): 318.
DOI:10.1038/s41467-020-20517-1 |
| [52] |
Meng C, Zhao G, Shi X R, et al. Oxygen-deficient metal oxides supported nano-intermetallic InNi3C0.5 toward efficient CO2 hydrogenation to methanol[J]. Sci Adv, 2021, 7(32): 6012.
DOI:10.1126/sciadv.abi6012 |
 2022, Vol. 36
2022, Vol. 36

