2. 中国科学院兰州化学物理研究所, 甘肃 兰州 730000;
3. 中国科学院青岛生物能源与过程研究所, 山东 青岛 266101
2. Lanzhou Institute of Chemical Physics, Chinese Academy of Sciences, Lanzhou 730000, China;
3. Qingdao Institute of Bioenergy and Bioprocess Technology, Chinese Academy of Sciences, Qingdao 266101, China
酶固有的高活性、选择性和特异性, 使得酶催化反应可以在环境友好的条件(水溶液、环境温度和压力、中性pH)下, 高效、高选择性地合成多种化学品[1]. 辅酶与酶催化反应紧密相关, 是酶催化反应过程中不可或缺的重要组成, 在氧化还原酶催化的反应中往往需要辅酶作为反应的氧化剂或还原剂.
辅酶包括烟酰胺类、泛醌、核黄素、维生素等, 其中, 烟酰胺腺嘌呤二核苷酸(NAD, cofactor I)参与的反应约占已知酶催化氧化还原反应的80%, 烟酰胺腺嘌呤二核苷酸磷酸(NADP, cofactor Ⅱ)参与的反应约占10%, 它们在生命体内参与了400多个重要的氧化还原反应, 即上述两种辅酶NAD和NADP参与了绝大多数的酶催化氧化还原反应, 是辅酶中最重要的一类[2].
如图 1所示, 上述两种烟酰胺辅酶存在着对应的氧化还原状态, 它们在反应中通过与底物发生反应, 转变为还原或氧化形态. NAD(P)H与NAD(P)+的可逆转化, 可以实现辅酶的高效利用[3]. NAD(P)+可以参与不同的酶催化反应, 例如: 在三羧酸循环中苹果酸生成草酰乙酸、丙酮酸生成乙酰辅酶A等过程中, NAD+会生成NADH, 即电子被储存在NADH分子中; 消耗NADH的反应如丙酮酸到乳酸、乙醛到乙醇等过程中, NADH作为电子给体, 给出电子, 生成NAD+; 在DNA和蛋白质的合成过程中, NADPH将氢转移给二氢叶酸, 从而催化生成四氢叶酸[4]; 在类固醇还原酶的作用下, NADPH作为电子给体, 还原雌激素和雄激素等类固醇底物[5]; 在脂肪酸合成过程中, NADPH可以在烯酰基载体蛋白还原酶的作用下参与还原不饱和硫酯[6]; 此外, 在糖酵解、脂肪酸的代谢、线粒体呼吸链中的生物氧化还原反应过程中, NAD(P)都起着重要作用, 是生物储备能量的基础[2, 6-7].

|
图 1 NAD(P)H与NAD(P)+的相互转化 Fig.1 Reversible interconversion of NAD(P)H and NAD(P)+ |
需要指出的是, 在细胞内, NAD(P)H / NAD(P)+可通过与底物代谢偶联而可逆地转化, 从而维持活细胞中的细胞内氧化还原平衡. 但在体外酶催化反应中往往需要适量或过量的NAD(P), 而NAD(P)高昂的价格使得外加辅酶没有经济可行性, 从而限制了其在酶催化领域的实际应用. 另外, 可以通过化学方法转化NAD(P), 从而调控酶反应, 为化学和生物过程之间搭建桥梁. 因此, 将辅酶再生体系引入酶催化反应, 不仅可以增加辅酶的利用效率而且可以帮助构建新型的人工生物转化(例如人工光合作用)[8].
化学家早在上世纪就已经着手研究辅酶的再生, 即通过催化方法实现NAD(P)+向NAD(P)H的转化. 目前催化再生NAD(P)的方法可以分为以下4类: 电化学法[9]、酶催化法[10]、化学催化法[11]和光催化法[12]. 其中, 酶法[13]、化学法[14]、电化学法[15]可应用于氧化型辅酶NAD(P)+和还原型辅酶NAD(P)H的再生, 而光催化法再生NAD(P)+的研究也引起了研究者的广泛关注: 1989年, Ruppert等[16]以[Ru(bpy)3]2+(其中bpy = 2, 2'-联吡啶)作为光敏剂, 甲基紫精(MV2+)作为电子受体, 实现了NAD(P)+的光电化学再生; 2011年, Gargiulo等[17]提出了一种氧化型烟酰胺辅酶NAD(P)+的光催化再生方法, 在可见光照射下, 黄素单核苷酸FMN介导的NAD(P)H氧化速率可以提高两个数量级, 即使在非优化条件下, 辅酶和FMN的TON分别可达170和340; 2017年, Rauch等[18]报道了一种基于蓝色LED光源的光催化再生体系, 实现NAD+的原位再生, 并且与可见光体系相比, 能耗更低, 效率更高; 2020年, Son等[19]将溶致变色染料刚果红(CR, Congo Red)与芴基保护的丙氨酸二肽(Fmoc-FF)杂化制备Fmoc-FF/CR水凝胶, 在可见光驱动下再生NAD+, 与酶促反应耦合高效地将乙醇氧化成乙醛, TON达42 953; Ma等[20]利用共轭微孔聚合物纳米颗粒作为无金属光敏剂, 在可见光照射下实现NAD+的高效再生; 2021年, Huang等[21]报道了一种水溶性、光稳定的香豆素功能化环金属铱配合物(Ir3), 能够催化NAD(P)H光氧化再生NAD(P)+, Ir3表现出了较高的体内生物相容性和光催化抗癌效率; 最近, Liao等[22]受NAD(P)H氧化酶的启发, 设计了一种再生NAD(P)+的光-生物催化反应体系, 该体系在NAD(P)H氧化过程中表现出较高的TOF和良好的pH及底物耐受性.
我们主要介绍其中的光催化再生NAD(P)H法, 主要包括其研究发展历史、最新进展及其中的关键问题. 需要指出的是, 在非酶催化NAD(P)H再生方法中, 产物有1, 4-、1, 2-、1, 6-NAD(P)H及NAD2二聚体等, 其中只有1, 4-NAD(P)H具有生物活性. 目前NAD(P)H的再生研究中, 仅有部分研究中会给出NAD(P)+转化率及NAD(P)H异构体选择性[6, 23]. 因此需要建立更详实可靠的评价方法, 但我们的综述范围仅针对光催化再生方法, 我们后续提到的再生效率均未区分1, 4-、1, 2-、1, 6-NAD(P)H及NAD2二聚体.
1 光催化NAD(P)H再生光催化NAD(P)H再生作为一种较为新颖的再生方法, 因其利用了太阳能而受到越来越多的关注, 特别是可见光催化方法具有反应可控、利用可见光等优点.
天然光合作用利用光系统I(Photosystem I, PS I)吸收光能, 并通过一系列蛋白质复合物介导光诱导电子转移过程. PS I是整合于光合膜上的由多个蛋白亚基组成的色素蛋白复合物, 它在光合电子传递链中催化电子从类囊体膜内的蛋白质体蓝素(PC)和细胞色素c6转移到类囊体膜外的还原铁氧化还原蛋白, 在铁氧化还原蛋白-NADP+还原酶(Ferredoxin NADP+ Reductase, FNR)的作用下, 电子最终被传递给NADP+[24]. 通过这种方式, 将光能以化学“货币”的形式储存起来, 使NADP+转化为其还原形式NADPH. 由于与PS I的相似性, 许多的光催化NAD(P)H再生过程被称为人工PS I.
|
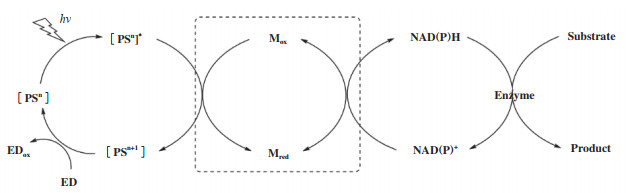
图式 1 存在或不存在M的条件下, 光催化再生NAD(P)H的示意图 Scheme 1 Schematic illustration of photocatalytic regeneration of NAD(P)H in the absence or presence of M ED: Electron donor; PS: Photosensitizer; M:Electron mediator |
如上图所示, 在光催化NAD(P)H再生过程中, 光敏剂(PS, Photosensitizer)经光照激发, 生成激发态分子PS*, PS* 从还原剂(电子给体, ED, Electron donor)中得到电子, 再将电子转移给电子介体(M, Mediator), M与质子结合, 以氢负离子(H- /(2e- + H+))的形式完成NAD(P)+到NAD(P)H的转化. 其中, 光敏剂是整个再生系统的核心, 开发稳定高效的光敏剂是目前研究的热点. 常用的光敏剂根据化学成分可以分为有机光敏剂和无机光敏剂.
1.1 有机光敏剂有机光敏剂包括低聚噻吩[25]、有机染料[26]、卟啉或金属卟啉[27]、硫堇[28]、苯甲胺蓝[1a]和共轭有机骨架[29]等.
1998年, Kim等[25]构建了一个新型光能转化系统, 该系统由低聚噻吩、MV2+和EDTA组成, 并与FNR结合使用. 其中, 低聚噻吩作为光敏剂, EDTA作为电子给体, MV2+作为电子介体. MV2+在低聚噻吩作用下生成MV·-自由基, 将电子传递给NADP+, 结合FDR催化将NADP+还原为NADPH. 该系统验证了在人工光敏电子转移反应中偶联酶作为催化剂的可行性, 为生物酶催化剂与光能转化系统耦合提供了新思路.
有机染料尤其是蒽基染料因具有良好的光氧化还原特性, 作为光敏剂在光催化方面得到了广泛的研究与应用[26b]. 利用有机染料分子吸收光能生成激发态分子, 进而氧化三乙醇胺(TEOA)得到电子, 将电子以氢负离子形式传递给NAD+, 生成NADH. 2009年, Lee等[26a]将染料曙红Y(Eosin Y)作为光敏剂引入再生体系中, 在电子介体[RhCp*(bpy)- H]+(M)、电子给体TEOA存在下, 实现了NADH的可见光光催化再生. 为寻找更多用于人工光系统的光敏剂, Lee等[26b]筛选了更多的有机染料,他们发现: 赤藓红B、曙红Y、孟加拉玫瑰红和荧光桃红B在光照下均可以高效再生NADH, 周转频率(TOF)为1144.8~1537.3 h-1. 同时, 他们发现这些染料的光化学性质受卤素原子取代的影响, 荧光素及其卤素取代衍生物再生NADH效率由小到大依次为: 荧光素、曙红Y(2, 4, 5, 7-Br取代)、赤藓红B(2, 4, 5, 7-I取代)、荧光桃红B(2, 4, 5, 7-Br、3′, 4′, 5′, 6′ -Cl取代)、孟加拉玫瑰红(2, 4, 5, 7-I、3′, 4′, 5′, 6′ -Cl取代), 原因是随着取代原子变重(H<Cl<Br<I), 染料的电负性减小, 给电子能力增强, 其还原电位也随之加强. 2013年, Lee等[26c]报道了与NADPH光化学再生相结合的细胞色素P450催化的间-癸烷基化反应, 其中, 曙红Y、TEOA和M分别作为光敏剂、电子给体和电子介体, 为可见光驱动的非酶促NADPH再生提供了一种高效新途径.
虽然这些光敏剂NAD(P)H再生效率较好, 但是有机小分子具有以下缺点: 难重复利用、结构不稳定和产物/ 光敏剂难分离等[30]. 因此, 需要通过物理固定或化学修饰来赋予它们新的特性, 以适应更具挑战性的光催化应用.
卟啉是一类具有4个吡咯环的大分子杂环化合物, 具有大的π共轭结构, 表现出光、电和热稳定性强、可见光吸收范围广等特点. 这些优异的性能使得卟啉材料成为光催化体系的理想材料.
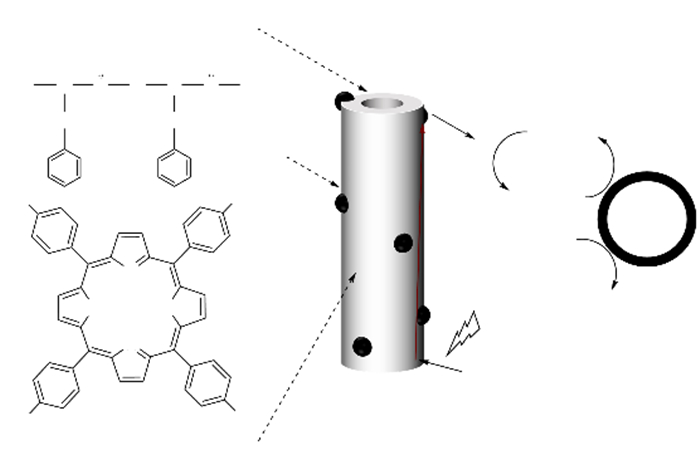
2011年, Lee等[27a]首次报道了用于模拟人工光合作用的集光(捕光)合成木材. 该研究利用物理包埋的方式固定有机光敏剂, 封装在木质纤维素基质中的水不溶性卟啉可以模拟自然光系统, 利用光能实现NADH的光催化再生, 从而可以通过依赖NADH的酶来生产精细化学品. 多孔的合成木材复合材料为卟啉的包封提供了微环境, 并且由于包含了氧化还原活性木质素成分, 还可以实现有效的光合作用. 在此基础上, Kim等[27b]设计了管状结构的光敏剂, 它可以降低空穴电子复合率. 如图 2所示, Park等通过苯丙氨酸二肽(FF)与对羟基苯基卟啉(THPP)的自组装, 合成了集光多肽纳米管, 并将Pt纳米粒子掺杂到纳米管表面, 从而可以显著促进FF/THPP/Pt中电子的分离和转移, 即高效地将电子传递给NAD+再生NADH, 同时该光催化体系具有良好的生物相容性, 可以与氧化还原酶结合催化α-酮戊二酸合成L-谷氨酸[27b].
固定光敏剂的方法中, 相较于传统的物理包埋法, 化学接枝法得到的光敏剂更为稳定、更为通用. 2012年, Yadav等[27c]报告了一种新型的基于石墨烯的可见光活性光敏剂的合成(图 3a): 该光敏剂将发色团多蒽醌取代的卟啉(MAQSP)与化学转化的石墨烯(CCG)共价键合, 既有发色团的捕光作用, 又有CCG非凡的电子传递性能, 可以实现光催化NADH的高效再生, 并与酶促反应偶联催化CO2制备甲酸, 其中MAQSP作为电子给体, CCG作为电子受体, M作为电子介体. 2014年, Yadav等[27d]在进一步的研究中, 结合两种发色团Isatin(靛红)和卟啉(记为IP), 与CCG共价结合, 合成了新开发的CCG-IP光敏剂(图 3b). 该光敏剂能够收集足够的可见光, 与多酶级联反应耦合后, 可以将CO2高选择性地还原为甲醇.
|
图 3 (a)CCGCMAQSP(化学转化石墨烯偶联的多蒽醌取代卟啉)光催化NADH再生[27c]; (b)CCGC-IP-bonded石墨烯纳米片光催化NADH再生[27d] Fig.3 (a) CCGCMAQSP photocatalyzed regeneration of NADH[27c]; (b) CCGC-IP-bonded graphene nanosheet photocatalyzed regeneration of NADH[27d] (图片引自文献并得到ACS授权) (Figures adapted from references with kind permission from American Chemical Society) |
NAD(P)H的再生和耦合的酶促反应主要发生在水溶液中, 卟啉的疏水性质导致未溶解的卟啉与水相之间形成相界面, 这对光生电子的传递起到了屏障作用[27a, 27e]. 为了增加卟啉的亲水性, Zhang等[27e]制备了多种含有羧基的离子型卟啉作为光敏剂, 在M作为电子介体, TEOA作为电子给体条件下, 含有锌的羧基卟啉(ZnTPyPBr)光敏剂具有最佳的NADH再生效率, 该体系可应用于甲醇的光酶催化合成.
有机光敏剂虽然能够有效地利用光生成激发态, 从而夺取还原剂的电子, 但是目前已知的光敏剂无法将两个电子同时传递NAD(P)+分子, 往往需要电子传递的媒介M经过Rh-H物种以氢负离子的形式实现两个电子向NAD(P)+的转移. M是一种广泛使用的电子介体, 能够将双电子从还原的光敏剂转移到氢化物形式的NAD(P)+, 选择性地生成1, 4-NAD(P)H. 除了光化学再生, M还可以在温和条件下催化甲酸与NAD(P)+的转移加氢[31].
为减少电子传递媒介M在反应体系中对于酶反应的影响, 同时降低酶对M的抑制, 有机光敏剂与M的固载研究受到了科学家的广泛关注. 2014年, Oppelt等[32]将M和光敏剂结合到一起, 合成了Rh-BipyE-PVab聚合物(联吡啶- 聚(亚芳基乙炔)- 聚(亚芳基乙烯)铑共聚物), 并负载到玻璃微球表面, 以TEOA作为电子给体, 实现非均相的光催化NADH再生体系, 该再生体系在可见光条件下生成NADH的TOF达到0.145 h-1, 与之前报道的非均相体系的结果接近, 该固定化方式缩短了Rh与光敏剂之间的距离, 避免了Rh的损失[32].
近年来, 共价有机骨架(Covalent organic frameworks, COFs)因为具有稳定可修饰的结构、大孔隙率、高比表面积和易于功能化等性质而受到了科学家们的广泛关注, 相关研究也成为近十年来材料科学和化学发展最快的领域之一.
2019年, Zhao等[29a]报道了一个以三嗪为中心平面单元, 由sp2 C = C键桥接而成的二维COF材料(TP-COF), 其孔隙结构呈镶嵌状六角形, 是一种优良的半导体材料, 表现出了前所未有的辅酶再生效率, 12 min L- 谷氨酸的产率达到97%. 这一结果证明了二维COFs材料可用于NAD(P)H再生, 这也是COFs材料第一次应用于人工PS I系统的报道.
在后续工作中, Wang等[29c]进一步制备了两种更稳定的全共轭COFs, 用于光催化NADH再生. 该工作中, 具有亚胺键的COFs经氧化环化转化为超稳定的π共轭芳香噻吩[3, 2-c]吡啶键连的二维COFs(B-COF-2、T-COF-2), 得益于其独特的二维分子结构和合适的电子性能, 具有三嗪单元的全π共轭结构的光敏剂T-COF-2在10 min内表现出良好的光催化NADH再生效率, 达到74%[29c]. 由于光敏剂和NADH之间的π -π叠加作用, 在没有M作为电子介体的情况下, NADH的再生也可以顺利完成.
上述工作表明, 通过控制COFs材料的形状、孔径、链接方式及后修饰, 功能化的COFs材料在光催化NAD(P)H再生领域具有较高的发展潜力.
作为新兴的有机多孔材料, 共轭微孔聚合物(Conjugated micro porouspolymers, CMPs)由于具有电子结构可调、合成方法多样、功能广泛等特点, 在光催化领域得到了广泛的研究. 2020年, Lan等[33]报道了一系列含有光敏单元的亲水性CMPs, 如二苯并[b, d]噻吩砜基聚合物(DBTS-CMP1), DBTS-CMP1作为非均相光敏剂, 在电子给体TEOA、电子介体M存在下, 45 min内光催化再生NADH效率为84%, 与醇脱氢酶YADH耦合时表现出较好的生物相容性, 95 min后甲醛选择性还原得到2.33 mmol/L的甲醇. 此外, 该工作还探究了再生过程中光生电子的传递路径, 为使用CMPs作为高效非均相光敏剂进行光催化NADH再生和光生物催化系统提供了很好的借鉴.
金属有机骨架(MetalOrganicFrameworks, MOFs)是由金属离子或金属离子团簇与有机配体通过配位键连接形成的一类新型的结晶多孔材料, 目前也被用于光催化领域. MIL-125-NH2是一种以钛为金属中心, 以2-氨基对苯二甲酸为有机连接配体的MOFs材料. Aguirre等[34]首次报道了将MIL-125- NH2作为光敏剂, 在没有M存在下实现NADH的光催化再生.
综上所述, 有机光敏剂具有高效的光催化再生NAD(P)H催化活性, 但是大多数有机光敏剂还不够稳定, 无法长时间重复使用. 目前, 固定化有机光敏剂是一种可行的解决方案, 在此背景下, 努力开发更高效、更稳定的有机光敏剂或固定化有机光敏剂的方法是光催化NAD(P)H再生的一个巨大挑战.
1.2 无机光敏剂除有机光敏剂外, 无机光敏剂, 如金属配合物[35]、TiO2材料[36]、半导体量子点[37]和氮化碳[38], 具有成本低、化学稳定性好、毒性低和光电性质分子可调等优势, 已成功用于NAD(P)H的光催化再生.
1.2.1 金属配合物早在1979年, Kirch等[39]报道了由三联吡啶钌配合物[Ru(bpy)3]2+作为光敏剂, [Rh(bpy)2H]作为金属氢化物再生催化剂, TEOA作为电子给体, 实现光还原水得到分子氢的反应. 1981年, Kiwi[40]报道了光催化还原再生NADH的首次尝试, 利用[Ru(bpy)3]2+作为光敏剂, 三乙胺作为电子给体, 实现了NADH的再生. 随后, Wienkamp和Steckan[35a]在此基础上, 利用了Kirch等[39]报道的体系实现了NADH的光催化再生, 他们还证明Kiwi等报道的体系中, 没有产生NADH, NAD+发生了自由基二聚生成了无活性的(NAD)2.
1984年, Mandler[35b]等报道了利用Ru(bpy)3Cl2作为光敏剂, 以MV2+作为电子介体, 实现NADPH的再生: 在光照条件下, 激发态三联吡啶钌夺取硫醇分子的电子, 将其传递给MV2+, 再由铁氧化还原蛋白-NADP+还原酶(Ferredoxin NADP+ Reductase, FDR)催化MV·+ 还原NADP+得到NADPH. 结果显示以Ru(bpy)3Cl2为光敏剂, 40 h后NADPH的TON为13. 用该光催化系统将丁酮酶催化还原为手性2- 丁醇, 光学纯度为100%. 1986年, Mandler等[35c]进一步报道了将光催化系统应用于丙酮酸还原制备乳酸、乙酰丙酸还原制备β - 羟基丁酸等反应. 尽管这些方法涉及多步电子传递过程, 但其利用金属配合物作为光敏剂实现NAD(P)H的再生, 为后续人工光系统I研究开辟了思路, 也为方兴未艾的光催化辅酶再生研究提供了先例.
从酶催化实际应用的角度来看, 目前利用金属配合物作为光敏剂来光催化NAD(P)H再生方法仍存在以下问题: (1)使用高浓度的有机胺(如TEOA、三乙胺、EDTA等)作为电子给体, 生成的产物为亚胺或醛, 反应的原子经济性较低, 产物复杂, 且这些叔胺对多吡啶配合物等光敏剂表现出强的淬灭能力, EDTA隔离金属离子的能力可能会影响含金属生物催化剂(如含铁的CYPs)的功能; (2)光敏剂无法将电子直接转移给NAD(P)+, 需要使用较高浓度的M或者MV2+作为媒介传递电子, 最终以氢负离子形式将电子转移给辅酶; (3)由于M与金属配合物光敏剂、硫醇和氨基的配位, 在氨基酸残基存在下,M会失活[41]; (4)光催化再生体系的效率需要继续提高: 虽然基于光敏剂分子计算的TOF较高, 但是考虑到反应体系中的M的用量, 实际反应效率仍然需要提高, 降低金属配合物的用量, 从而降低成本和对于酶反应的干扰.
为了克服氨基酸残基耐受性这个问题, 目前科学家们已经应用了“隔离”策略来避免金属配合物与酶中的配位残基接触. K¨ohler等[42]将具有生物素标签的半三明治Ir复合物掺入抗生物素蛋白链菌素中, 构建了人工金属酶, 并有效地分隔了Ir复合物和下游的NADH依赖性酶. 出于相同的目的, 半三明治Rh配合物已与用于光催化还原NAD+的聚光聚合物材料配合使用[32].
|
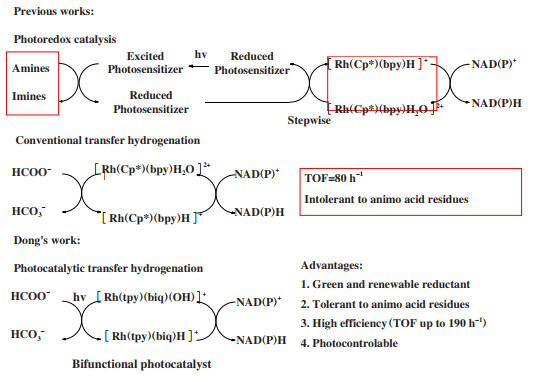
图式 2 NAD(P)+的可见光驱动转移氢化[35d] Scheme 2 The visible-light-driven transfer hydrogenation of NAD(P)+[35d] |
考虑到上述问题, 2020年, Dong等[35d]构建了一种能耐受氨基酸残基的NAD(P)H再生的有效光催化转移氢化体系, 该体系用Ru(tpy)(biq)Cl2作为光敏剂, 甲酸盐作为电子给体, 利用激发态Ru(tpy)(biq)Ln(L为配位阴离子或中性配体)物种容易解离配体的性质, 有效避免了氨基酸残基对于Ru中心的配位, 从而解决了氨基酸残基不耐受问题, 实现了NADH的高效再生, TOF值达159 h-1, 量子产率为7.9×10-3. 另外, 该体系的催化剂Ru(tpy)(biq)Cl2, 既是光敏剂又是电子介体, 可以直接将电子转移给NAD+, 从而避免使用昂贵的M作为电子介体. 同时, 该体系还可以用于NADPH、BNAH的高效再生, TOF分别为190、90 h-1.
1.2.2 TiO2作为一种广泛使用的无机半导体材料, TiO2也是第一例应用于光催化NAD(P)H再生的无机光敏剂. TiO2具有成本低、制备工艺简单、化学惰性、稳定性好以及耐光腐蚀和化学腐蚀等独特优势, 在光催化领域具有广阔的应用前景[43]. 然而, TiO2可见光吸收和光敏化能力较差, 即使在电子给体EDTA存在的情况下, 其催化效率也很低. 此外, TiO2一般需要用紫外光驱动, 但紫外光的能量较高, 容易造成蛋白质变性, 从而破坏酶等生物分子, 这使得TiO2光催化NADH再生不能与酶促反应耦合[44].
考虑到可见光占据太阳光的46%, 为了开发高效的光催化NADH再生体系, 需要光敏剂能够吸收可见光, 因此需要对TiO2进行改性, 掺杂是TiO2改性的常用方法. Jiang等[36a]将碳、硼及磷等元素掺杂到TiO2中, 用于可见光催化的NADH再生. 例如, 他们用乙酸、乙醇作为碳源, 通过酸催化溶胶- 凝胶法将碳掺杂入TiO2, 掺杂的碳大大增加了TiO2对可见光的吸收能力. 以巯基乙醇作为电子给体, M作为电子介体, 实现了NADH的高选择性再生: 在pH=6.0、37 ℃、NAD+初始浓度0.2 mmol/L、M初始浓度0.3 ~ 0.5 mmol/L的条件下, NADH的光再生率可达63.98%[36a]. 掺杂其他元素的TiO2结果类似.
2021年, Yin等[36b]利用TiO2纳米管作为光敏剂, 水作为氢供体, M作为氢转移催化剂, 实现光催化NADPH再生, 连续光照2 h后, NADPH产率为91.2%, 浓度高达3.64 mg·mL-1, 可以与ADH突变的交联酶协同催化合成(R)-[1-, 5-双(三氟甲基)苯基]乙醇, ee值超过99.99%, 这为制备其它手性醇药物中间体提供了参考.
与有机光敏剂相比, TiO2类光敏剂催化再生NADH的效率较低, 但作为第一代异构无机光敏剂, TiO2类光敏剂及其改性为进一步开发其他无机光敏剂打下了基础[30].
1.2.3 量子点(Quantum Dots, QDs)量子点具有尺寸光学可调、高的表面与体积比, 以及可低温便利合成等独特性能, 常用的量子点包括CdS、CdSe和CdTe等纳米晶体和碳纳米点(Carbon Nano Dots, CNDs)[30-36], 禁带宽度适合吸收可见光, 具有良好的光稳定性, 是继TiO2后得到研究人员广泛关注的一类无机光敏剂. Nam等[37a]通过热注入法制备了CdTe、CdSe和CdS纳米晶体, 在可见光(>420 nm)条件下, 产生激发电子, 这些电子被转移到电子介体M中, 驱动NAD+还原为NADH, 量子点的TOF由大到小依次为: CdTe、CdS、CdSe, 其中, CdTe纳米晶体的TOF(0.540 h-1)比磷掺杂的TiO2高约180倍, 但微米级CdTe、CdS和CdSe纳米粒子即使在高浓度下也不能实现NADH的再生, 由此可见, 纳米晶体越小, 表面活性位点增多, NADH产率越高, 光催化效率提高.
考虑到量子点晶体的纳米尺寸, 研究人员选择将其沉积到不同载体上, 比如SiO2、TiO2等. Lee等[37b]采用Stober法合成了胶体、微米尺寸的SiO2微珠, 通过硅前驱体的水解和成核反应, 得到了单分散球形二氧化硅纳米颗粒, 再通过CdSO4和Na2S的连续离子层吸附反应将CdS量子点沉积在SiO2微珠表面, 改变涂层循环次数可以在SiO2表面得到不同数量CdS纳米颗粒. 利用表面生长CdS的SiO2微珠作为光敏剂, 可以实现NADH的可持续光催化再生和L- 谷氨酸的酶促合成, 且在重复使用4次后, 依旧保持了较高的光催化NADH再生效率. CdS量子点包覆的SiO2可见光催化NADH再生的TOF为0.28 h-1, 比掺杂的TiO2高8~9倍. 该研究表明, 优化光敏剂表面形貌和电荷复合延迟是实现NADH光再生最佳性能的关键因素.
CNDs是一种碳基零维材料, 具有成本低、荧光性能好、生物相容性好及易修饰等特点, 已被广泛应用于光电子器件的开发. Yadav等[37c]采用反相微乳液法制备了SiO2/CNDs光敏剂, NADH再生效率为74.1%, 与酶促反应耦合由CO2生成甲酸. 这是将SiO2/CNDs应用于CO2利用的光生物催化体系的首例报道. Kim等[37d]以氮掺杂的CNDs作为光敏剂, TEOA作为电子给体, M作为电子介体, 实现了NADH及其类似物mNADHs的高效光催化再生, 进而促进了与老黄酶催化的不饱和烯烃的选择性还原.
石墨烯量子点(Graphene quantum dots, GQDs)是一种具有光学、化学和生物特性的半导体纳米材料, 在人工光合作用中发挥着重要的作用. Singh等[37e]从柠檬中提取柠檬酸, 与酸性品红染料加热反应制备花朵状基于品红的GQDs(GQDF), 以GQDF作为光敏剂, 抗坏血酸作为电子给体, M作为电子介体, 实现了NADH的光催化再生, NADH产率为72%, 是纯酸性品红染料的2.5倍. 该工作还可应用于CO2的利用.
1.2.4 基于石墨氮化碳(g-C3N4)的光敏剂2009年, Wang等[45]报道了聚合氮化碳作为一种常见的光敏剂, 可以实现无贵金属条件下的光解水制氢. 这种可见光驱动的光催化析氢能力, 使得g-C3N4材料得到了化学家的青睐. g-C3N4具有制备简单、带隙适宜、可以吸收可见光、稳定性好等特点, 因而被视为新一代的可见光光敏剂.
在电子给体和电子介体存在的情况下, g-C3N4光催化再生NADH的机理和上述有机光敏剂类似. Liu等[38a]报道了一种硅藻结构的石墨氮化碳(DEg-C3N4)光催化再生NADH的方法: 利用M作为电子介体, NADH产率可达100%; 此外, 在没有M时, g-C3N4和NAD+之间也可以直接进行电子转移, NADH再生产率可达50%. 该工作是无电子介体、无金属的光催化NADH再生的首次报道. 虽然介孔石墨氮化碳(mesoporous graphitic carbon nitride, mp g-C3N4)具有更高的比表面积, 但是硅藻状石墨氮化碳的再生效率有显著提高, 这是因为其硅藻状的结构可以增强捕光能力, 从而提高光催化效率. 然而, 由于没有M存在, NADH的再生是非特异性的, 选择性较差. 基于以上研究成果, Liu等进一步开发了牺牲模板法构建介孔g-C3N4微球(CNMS)和高通量法合成纳米g-C3N4棒(CNR)的方法, 这两种方法都可以实现NADH的高效再生.
虽然无金属g-C3N4因其优异的光、化学性能而等被广泛应用于各个领域, 但其仍存在比表面积小、可见光收集能力受限、电荷复合率高、电导率低等缺点, 阻碍了其在太阳能转换领域的进一步应用. 因此, 化学家们将g-C3N4与多种化合物(如金属、金属氧化物或硫化物、量子点和有机分子)结合制备了多相光敏剂, 使入射光可以在光敏剂中多次反射, 延长光保留时间, 从而提高其光催化NAD(P)H再生效率[46]. 例如, Yang等[38b]基于类囊体膜的光反应过程, 合成了一种二维异构光敏剂, 称为QDs@Flake g-C3N4, 用于可见光驱动的NADH再生, 然后将NADH再生体系与乙醇脱氢酶催化甲醛加氢反应耦合生产甲醇. 此外, Wu等[38c]将α-Fe2O3和碳引入g-C3N4表面制备g-C3N4@α-Fe2O3 /C核壳光敏剂, α-Fe2O3部分作为额外的光敏剂, 可以产生更多的光生电子, 而C部分则是一个桥梁, 促进电子从α-Fe2O3部分到g-C3N4或g-C3N4到C部分的转移, 因此, 光催化NADH再生的有效载流子显著增加, 其初始反应速率达到7.7 mmol·h-1·g-1.
2020年, 受单核金属酶的启发, Liu等[38e]将Co原子分散在超薄二维氮化碳纳米片上, 制备的单原子催化剂Co1/C3N4在M存在下, 可以实现NADH的高效光催化再生, 再生率高达99%. 原位再生的NADH与酶催化苯甲醛反应耦合生产苯甲醇, 产率达到100%, 而在非酶催化体系中, 通常需要在贵金属催化剂、高温高压条件下来实现醛的还原反应. 该结果表明, 单原子催化剂Co1/C3N4可以作为一种高效的光酶耦合反应催化剂. 通过将M与Co1/C3N4单原子催化剂反应, 得到的Co1/C3N4-Rh光敏剂仍然具有良好的NADH再生和酶催化还原性能, 在不添加额外的M条件下, 10 h后苯甲醇的产率可达95%. 不饱和Co位点可以与M的Cp* 环配合形成固定化催化体系, 虽然降低了光酶催化效率, 但该工作将均相、多相和酶催化有机结合起来, 为进一步构建光酶催化体系提供了新思路.
2020年, Tian等[38f]报道了一种将Rh配合物接枝到噻吩修饰的多孔g-C3N4纳米薄片(TPE-C3N4)上的集成人工PS I, 用于光催化NAD(P)H再生. TPE-C3N4作为光敏剂, 其光学及光电性能较g-C3N4有了显著提高, 能将电子快速转移给Rh配合物, 显著提高了电子- 空穴对的分离和光吸收能力, 从而增强了光催化NADH再生效率. 该体系的NADH再生速率达到9.3 μmol/L·min-1, 与封装在MOF中的甲酸脱氢酶(FDH)耦合, 可以光驱动CO2还原生成甲酸. 在此基础上, Tian等[38g]进一步找到了TPE-C3N4中噻吩的最优占比, 在最优条件下, NADH、NADPH的光催化再生效率分别可达59.00、40.99 μmol·L-1·min-1, 是g-C3N4的~ 84.3倍和24.7倍. 该体系进一步与酶促反应耦合, 以964和14.9 μmol·L-1·h-1的速度连续合成了L- 叔亮氨酸和氧化苯乙烯. 这些工作大大促进了光酶耦合体系的进一步发展.
最近, Yu等[38h]将羧基修饰的QDs(CdSe/ZnS)与g-C3N4一锅法反应制备了QDs/ g-C3N4纳米片光敏剂, 在QDs质量分数为5%、NAD+初始浓度为1 mmol/L的最优条件下, NADH产率为95.7%, 是g-C3N4作为光敏剂的两倍. 将该体系与ADH耦合, 催化糠醛选择性还原得到糠醇, 产量达0.6 mmol/L, 选择性约100%. 这为其它可再生资源中平台化合物的选择性加氢提供了借鉴.
此外, g-C3N4材料可以与微流控技术相结合, Huang等[38i]提出了一种有效再生NADH的基于氮化碳光敏剂的微流控芯片设计, 其分析过程简单, g-C3N4与Rh配合物的相互作用增强, 辅酶再生率较高. 该设计为今后制备高效的人工光系统提供了新的可能.
2 总结与展望依赖NAD(P)H的酶催化反应在各个领域应用方面越来越受到人们的关注, 基于其必要性和高成本, NAD(P)H的再生对于其实际应用至关重要. 光催化NAD(P)H再生具有多方面优势: 例如将可见光转化为化学能, 可以充分利用清洁、丰富的太阳能, 反应可控等. 通过合理的设计与调整, 可以有效提高光敏剂的捕光能力, 提高NAD(P)H再生效率.
自从1981年, Kiwi进行了光催化还原再生NADH的首次尝试, 科学家们开始广泛研究光催化NADH再生, 1983年, Wienkamp和Steckan首次实现了NADH的直接光再生. 有机光敏剂和无机光敏剂均已成功应用于光化学辅酶再生领域, 多样化的光敏剂为可见光催化NAD(P)H再生体系提供了更多的研究思路. 值得注意的是, 光敏剂仍存在以下不足: 有机染料如卟啉、钌配合物、黄嘌呤染料等容易发生光漂白而导致催化效率降低或者直接失活; 量子点纳米晶体通常含有毒重金属(如镉); g-C3N4已报道会与生物催化剂产生局部高浓度的自由基, 从而导致酶的失活[47]. 另一方面, 由于某些光敏剂的均质性, 将产物从反应混合物中分离出来是一个复杂而昂贵的过程.
以利用清洁、丰富、廉价的太阳能为目标, 开发稳定、吸收可见光、高效的光敏剂是其中的关键, 光催化NAD(P)H再生研究中需要重点关注以下几个方面: (1)物理固定和化学修饰可以赋予光敏剂新的特性(例如: 可以吸收可见光); (2)光能转换体系离不开高效的电子介体, 开发既能吸收可见光又能实现负氢转移的光敏剂, 避免昂贵电子介体M或有毒电子介体MV2+的使用; (3)解决光敏剂与酶生物相容问题, 实现光催化NAD(P)H的再生和酶促反应的耦合; (4)人工光系统需要电子给体来提供电子充当还原剂, 应当优先选择绿色、生物相容性好、可持续的电子给体.
| [1] |
a. Dilgin Y, Gorton L, Nisli G. Photoelectrocatalytic oxidation of NADH with electropolymerized toluidine blue O[J]. Electroanalysis, 2007, 19(2/3): 286-293. b. Wu Yi-zhou (伍一洲), Shi Jia-fu (石家福), Ding Fei (丁菲), et al. Integrated enzyme-photocatalysis system for carbon dioxide conversion (酶光耦合催化系统转化CO2研究进展)[J]. Sci Sin Chim (中国科学: 化学), 2017, 47(03): 315-329. |
| [2] |
Wu H, Tian C, Song X, et al. Methods for the regeneration of nicotinamide coenzymes[J]. Green Chem, 2013, 15(7): 1773–1789.
DOI:10.1039/c3gc37129h |
| [3] |
Huang Qiang (黄强). Study on hydrogenation of α, β-epoxy ketones and 1, 2-diketones catalyzed by a regenerable NAD+/NADH coenzyme model (辅酶NAD+/NADH模型物催化氢化α, β-环氧烷酮和1, 2-二酮类化合物的反应研究)[D]. Hefei (合肥): Hefei University of Technology (合肥工业大学), 2013.
|
| [4] |
Duff M R, Gabel S A, Pedersen L C, et al. The structural basis for nonsteroidal anti-inflammatory drug inhibition of human dihydrofolate reductase[J]. J Med Chem, 2020, 63(15): 8314–8324.
DOI:10.1021/acs.jmedchem.0c00546 |
| [5] |
Zhang Hong-yan (张红艳). Comparative study on steroid dehydrogenase of Rhodococcus (R. D-001)(红球菌(R. D-001)类固醇脱氢酶比较研究)[D]. Changchun (长春): Northeast Normal University (东北师范大学), 2020.
|
| [6] |
McSkimming A, Colbran S B. The coordination chemistry of organo-hydride donors: New prospects for efficient multi-electron reduction[J]. Chem Soc Rev, 2013, 42(12): 5439–5488.
DOI:10.1039/c3cs35466k |
| [7] |
a. Quinto T, Köhler V, Ward T R. Recent trends in biomimetic NADH regeneration[J]. Top Catal, 2014, 57(5): 321-331. b. Xu Hua-jan (许华建). Studies on reaction mechanism of coenzyme NADH models and application to organic synthesis (辅酶NADH模型物反应机理的研究及其在有机合成中的应用)[D]. Hefei (合肥): University of Science and Technology of China (中国科学技术大学), 2007. |
| [8] |
Kuk S K, Singh R K, Nam D H, et al. Photoelectrochemical reduction of carbon dioxide to methanol through a highly efficient enzyme cascade[J]. Angew Chem Int Ed, 2017, 56(14): 3827–3832.
DOI:10.1002/anie.201611379 |
| [9] |
Damian A, Maloo K, Omanovic S. Direct electrochemical regeneration of NADH on Au, Cu and Pt-Au electrodes[J]. Chem Biochem Eng Q, 2007, 21(1): 21–32.
|
| [10] |
a. Abril O, Whitesides G M. Hybrid organometallic/enzymic catalyst systems: Regeneration of NADH using dihydrogen[J]. J Am Chem Soc, 1982, 104(6): 1552-1554. b. Broussy S, Cheloha R W, Berkowitz D B. Enantioselective, ketoreductase-based entry into pharmaceutical building blocks: Ethanol as tunable nicotinamide reductant[J]. Org Lett, 2009, 11(2): 305-308. |
| [11] |
a. Maenaka Y, Suenobu T, Fukuzumi S. Efficient catalytic interconversion between NADH and NAD+accompanied by generation and consumption of hydrogen with a water-soluble iridium complex at ambient pressure and temperature[J]. J Am Chem Soc, 2012, 134(1): 367-374. b. Wagenknecht P S, Penney J M, Hembre R T. Transition-metal-catalyzed regeneration of nicotinamide coenzymes with hydrogen[J]. Organometallics, 2003, 22(6): 1180-1182. c. Wang M D, Ren X M, Guo M, et al. Chemoselective NADH regeneration: The synergy effect of TiOx and Pt in NAD+hydrogenation[J]. ACS Sustainable Chem Eng, 2021, 9(18): 6499-6506. |
| [12] |
a. van der Donk W A, Zhao H. Recent developments in pyridine nucleotide regeneration[J]. Curr Opin Biotechnol, 2003, 14(4): 421-426. b. Weckbecker A, Gröger H, Hummel W. Regeneration of nicotinamide coenzymes: Principles and applications for the synthesis of chiral compounds[M]. Berlin, Heidelberg: Springer Berlin Heidelberg, 2010. |
| [13] |
a. Hummel W, Riebel B. Isolation and biochemical characterization of a new NADH oxidase from Lactobacillus brevis[J]. Biotechnol Lett, 2003, 25(1): 51-54. b. Jia H Y, Zong M H, Zheng G W, et al. Myoglobincatalyzed efficient in situ regeneration of NAD (P)+and their synthetic biomimetic for dehydrogenase-mediated oxidations[J]. ACS Catal, 2019, 9(3): 2196-2202. |
| [14] |
a. Zhu C, Li Q, Pu L, et al. Nonenzymatic and metalfree organocatalysis for in situ regeneration of oxidized cofactors by activation and reduction of molecular oxygen[J]. ACS Catal, 2016, 6(8): 4989-4994. b. Tan Z T, Zhu C J, Fu J W, et al. Regulating cofactor balance in vivo with a synthetic flavin analogue[J]. Angew Chem Int Ed, 2018, 57(50): 16464-16468. |
| [15] |
a. Schrö oder I, Steckhan E, Liese A. In situ NAD+regeneration using 2, 2'-azinobis (3-ethylbenzothiazoline-6-sulfonate) as an electron transfer mediator[J]. J Electroanal Chem, 2003, 541: 109-115. b. Rahman G, Lim J, Jung K D, et al. Electrodeposited Ru nanoparticles for electrochemical reduction of NAD+to NADH[J]. Int J Electrochem Sci, 2011, 6: 2789-2797. c. Kochius S, Park J B, Ley C, et al. Electrochemical regeneration of oxidised nicotinamide cofactors in a scalable reactor[J]. J Mol Catal B: Enzym, 2014, 103: 94-99. |
| [16] |
Ruppert R, Steckhan E. Efficient photoelectrochemical in-situ regeneration of NAD (P)+coupled to enzymatic oxidation of alcohols[J]. J Chem Soc, Perkin Trans 2, 1989, 1989: 811–814.
|
| [17] |
Gargiulo S, Arends I W C E, Hollmann F. A photoenzymatic system for alcohol oxidation[J]. ChemCatChem, 2011, 3(2): 338–342.
DOI:10.1002/cctc.201000317 |
| [18] |
Rauch M, Schmidt S, Arends I W C E, et al. Photobiocatalytic alcohol oxidation using LED light sources[J]. Green Chem, 2017, 19(2): 376–379.
DOI:10.1039/C6GC02008A |
| [19] |
Son G, Kim J, Park C B. Interference of solvatochromic twist in amyloid nanostructure for light-driven biocatalysis[J]. ACS Appl Energy Mater, 2020, 3(1): 1215–1221.
DOI:10.1021/acsaem.9b02303 |
| [20] |
Ma B C, Caire da Silva L, Jo S M, et al. Polymer-based module for NAD+regeneration with visible light[J]. Chembiochem, 2019, 20(20): 2593–2596.
DOI:10.1002/cbic.201900093 |
| [21] |
Huang C, Liang C, Sadhukhan T, et al. In-vitro and invivo photocatalytic cancer therapy with biocompatible iridium (III) photocatalysts[J]. Angew Chem Int Ed, 2021, 60(17): 9474–9479.
DOI:10.1002/anie.202015671 |
| [22] |
Liao H X, Jia H Y, Dai J R, et al. Bioinspired cooperative photobiocatalytic regeneration of oxidized nicotinamide cofactors for catalytic oxidations[J]. ChemSusChem, 2021, 14(7): 1687–1691.
DOI:10.1002/cssc.202100184 |
| [23] |
Saba T, Li J W, Burnett J W H, et al. NADH regeneration: A case study of Pt-catalyzed NAD+reduction with H2[J]. ACS Catal, 2021, 11(1): 283–289.
DOI:10.1021/acscatal.0c04360 |
| [24] |
Guan Li-na(邓丽娜), Gu Pei-yu(顾培育). The recent development of research on photosystem I(光系统I研究概述)[J]. J Shandong Forestry Sci Technol(山东林业科技), 2008, 38(5): 90–92.
|
| [25] |
Kim Y, Ikebukuro K, Muguruma H, et al. Photogeneration of NADPH by oligothiophenes coupled with ferredoxinNADP reductase[J]. J Biotechnol, 1998, 59(3): 213–220.
DOI:10.1016/S0168-1656(97)00155-7 |
| [26] |
a. Lee S H, Nam D H, Kim J H, et al. Eosin Y-sensitized artificial photosynthesis by highly efficient visiblelight-driven regeneration of nicotinamide cofactor[J]. Chembiochem, 2009, 10(10): 1621-1624. b. Lee S H, Nam D H, Park C B. Screening xanthene dyes for visible light-driven nicotinamide adenine dinucleotide regeneration and photoenzymatic synthesis[J]. Adv Synth Catal, 2009, 351(16): 2589-2594. c. Lee S, Kwon Y C, Kim D M, et al. Cytochrome P450-catalyzed O-dealkylation coupled with photochemical NADPH regeneration[J]. Biotechnol Bioeng, 2013, 110(2): 383-390. d. Wang Yu-ying (王玉营), Chen Jian-biao (陈建彪), Zhang Xu-qiang (张旭强), et al. Effects of different linear diamines on the performance of photocatalysts for hydrogen production of sensitized graphene (不同直链二胺对敏化石墨烯制氢光催化剂性能的影响)[J]. J Mol Catal (China)(分子催化), 2020, 34(1): 1-7. |
| [27] |
a. Lee M, Kim J H, Lee S H, et al. Biomimetic artificial photosynthesis by light-harvesting synthetic wood[J]. ChemSusChem, 2011, 4(5): 581-586. b. Kim J H, Lee M, Lee J S, et al. Self-assembled lightharvesting peptide nanotubes for mimicking natural photosynthesis[J]. Angew Chem Int Ed, 2012, 51(2): 517-520. c. Yadav R K, Baeg J O, Oh G H, et al. A photocatalyst-enzyme coupled artificial photosynthesis system for solar energy in production of formic acid from CO2[J]. J Am Chem Soc, 2012, 134(28): 11455-11461. d. Yadav R K, Oh G H, Park N J, et al. Highly selective solar-driven methanol from CO2 by a photocatalyst/biocatalyst integrated system[J]. J Am Chem Soc, 2014, 136(48): 16728-16731. e. Zhang Z B, Tong J H, Meng X L, et al. Development of an ionic porphyrin-based platform as a biomimetic lightharvesting agent for high-performance photoenzymatic synthesis of methanol from CO2[J]. ACS Sustainable Chem Eng, 2021, 9(34): 11503-11511. |
| [28] |
Rickus J L, Chang P L, Tobin A J, et al. Photochemical coenzyme regeneration in an enzymatically active optical material[J]. J Phys Chem B, 2004, 108(26): 9325–9332.
|
| [29] |
a. Zhao Y J, Liu H, Wu C Y, et al. Fully conjugated twodimensional sp2-carbon covalent organic frameworks as artificial photosystem I with high efficiency[J]. Angew Chem Int Ed, 2019, 58(16): 5376-5381. b. Chen Y L, Li P, Zhou J W, et al. Integration of enzymes and photosensitizers in a hierarchical mesoporous metalorganic framework for light-driven CO2 reduction[J]. J Am Chem Soc, 2020, 142(4): 1768-1773. c. Wang Y C, Liu H, Pan Q Y, et al. Construction of fully conjugated covalent organic frameworks via facile linkage conversion for efficient photoenzymatic catalysis[J]. J Am Chem Soc, 2020, 142(13): 5958-5963. d. Kong Hai-yu (孔海宇), Chen Han-di (陈翰迪), Yu Rui (喻瑞), et al. A combination of DFT and solid-state NMR study on the relationship between framework Al distribution and BrönstedAcidity in SSZ-39 zeolite (密度泛函理论结合固体核磁共振谱学研究SSZ-39分子筛骨架铝分布与Brönsted酸性关系)[J]. J Mol Catal (China)(分子催化), 2021, 35(3): 215-225. |
| [30] |
a. Zou Hong-jian (邹红建). G-C3N1-based nanocomposites with excellent visible-light-driven NADH regeneration (利用g-C3N4基纳米复合材料光催化还原辅酶NADH再生)[D]. Tianjin (天津): Tianjin University (天津大学), 2017. b. Gao Wei (高薇), Lu Gong-xuan (吕功煊). The preparation of carbon quantum dots up-conversion materials and its application (碳量子点上转换材料的制备及其应用研究进展)[J]. J Mol Catal (China)(分子催化), 2020, 34(2): 150-164. |
| [31] |
Ruppert R, Herrmann S, Steckhan E. Very efficient reduction of NAD (P)+ with formate catalysed by cationic rhodium complexes[J]. J Chem Soc, Chem Commun, 1988, 1988: 1150–1151.
|
| [32] |
Oppelt K T, Gasiorowski J, Egbe D A M, et al. Rhodiumcoordinated poly (arylene-ethynylene)-alt-poly (arylene-vinylene) copolymer acting as photocatalyst for visiblelight-powered NAD+/NADH reduction[J]. J Am Chem Soc, 2014, 136(36): 12721–12729.
|
| [33] |
Lan F, Wang Q, Chen H, et al. Preparation of hydrophilic conjugated microporous polymers for efficient visible light-driven nicotinamide adenine dinucleotide regeneration and photobiocatalytic formaldehyde reduction[J]. ACS Catal, 2020, 10(21): 12976–12986.
|
| [34] |
a. Aguirre M E, Isla Naveira R, Botta P M, et al. Early instability of MIL-125-NH2 in aqueous solution and mediation of the visible photogeneration of an NADH cofactor[J]. New J Chem, 2021, 45(23): 10277-10286. b. Shen Hai-yu (申海玉), Zhao Hua-hua (赵华华), Yang Jian (杨建), et al. Progresses in the application of MOFs in selective hydrogenation of unsaturated aldehydes MOFs (在不饱和醛选择加氢中的应用研究进展)[J]. J Mol Catal (China)(分子催化), 2021, 35(6): 571-582. |
| [35] |
a. Wienkamp R, Steckhan E. Selective generation of NADH by visible light[J]. Angew Chem Int Ed, 1983, 22(6): 497. b. Mandler D, Willner I. Solar light induced formation of chiral 2-butanol in an enzyme-catalyzed chemical system[J]. J Am Chem Soc, 1984, 106(18): 5352-5353. c. Mandler D, Willner I. Photosensitized NAD (P) H regeneration systems; application in the reduction of butan-2-one, pyruvic, and acetoacetic acids and in the reductive amination of pyruvic and oxoglutaric acid to amino acid[J]. J Chem Soc, Perkin Trans 2, 1986, 1986(6): 805-811. d. Dong W J, Tang J, Zhao L J, et al. The visible-lightdriven transfer hydrogenation of nicotinamide cofactors with a robust ruthenium complex photocatalyst[J]. Green Chem, 2020, 22(7): 2279-2287. |
| [36] |
a. Jiang Z Y, Lü C Q, Wu H. Photoregeneration of NADH using carbon-containing TiO2[J]. Ind Eng Chem Res, 2005, 44(12): 4165-4170. b. Yin Y C, Wang R, Zhang J, et al. Efficiently enantioselective hydrogenation photosynthesis of (R)-1[3, 5——bis (trifluoromethyl) phenyl] ethanol over a CLEs-TiO2 bioinorganic hybrid materials[J]. ACS Appl Mater Interfaces, 2021, 13(35): 41454-41463. |
| [37] |
a. Nam D H, Lee S H, Park C B. CdTe, CdSe, and CdS nanocrystals for highly efficient regeneration of nicotinamide cofactor under visible light[J]. Small, 2010, 6(8): 922-926. b. Lee S H, Ryu J, Nam D H, et al. Photoenzymatic synthesis through sustainable NADH regeneration by SiO2-supported quantum dots[J]. Chem Commun, 2011, 47(16): 4643-4645. c. Yadav R K, Kumar A, Park N J, et al. New carbon nanodots-silica hybrid photocatalyst for highly selective solar fuel production from CO2[J]. ChemCatChem, 2017, 9(16): 3153-3159. d. Kim J, Lee S H, Tieves F, et al. Biocatalytic C=C bond reduction through carbon nanodot-sensitized regeneration of NADH analogues[J]. Angew Chem, 2018, 130: 14021-14024. e. Singh A, Yadav R K, Yadav U, et al. Highly efficient flower-like graphene quantum dots-based fuschin photocatalyst for selective NAD (P) H cofactor regeneration under solar light irradiation[J]. Photochem Photobiol, 2021, 98(2): 412-420. |
| [38] |
a. Liu J, Antonietti M. Bio-inspired NADH regeneration by carbon nitride photocatalysis using diatom templates[J]. Energy Environ Sci, 2013, 6(5): 1486-1493. b. Yang D, Zou H J, Wu Y Z, et al. Constructing quantum dots@flake graphitic carbon nitride isotype heterojunctions for enhanced visible-light-driven NADH regeneration and enzymatic hydrogenation[J]. Ind Eng Chem Res, 2017, 56(21): 6247-6255. c. Wu Y Z, Ward Bond J, Li D L, et al. g-C3N4@α-Fe2O3/C photocatalysts: Synergistically intensified charge generation and charge transfer for NADH regeneration[J]. ACS Catal, 2018, 8(7): 5664-5674. d. Yang D, Zhang Y S, Zou H J, et al. Phosphorus quantum dots-facilitated enrichment of electrons on g-C3N4 hollow tubes for visible-light-driven nicotinamide adenine dinucleotide regeneration[J]. ACS Sustainable Chem Eng, 2019, 7(1): 285-295. e. Liu W G, Hu W J, Yang L J, et al. Single cobalt atom anchored on carbon nitride with well-defined active sites for photo-enzyme catalysis[J]. Nano Energy, 2020, 73: 104750. f. Tian Y, Zhou Y N, Zong Y C, et al. Construction of functionally compartmental inorganic photocatalystenzyme system via imitating chloroplast for efficient photoreduction of CO2 to formic acid[J]. ACS Appl Mater Interfaces, 2020, 12(31): 34795-34805. g. Tian Y, Zong Y C, Zhou Y N, et al. Thiopheneconjugated porous C3N4 nanosheets for boosted photocatalytic nicotinamide cofactor regeneration to facilitate solar-to-chemical enzymatic reactions[J]. Trans Tianjin Univer, 2021, 27(1): 42-54. h. Yu S S, Zhang S D, Li K N, et al. Furfuryl alcohol production with high selectivity by a novel visible-light driven biocatalysis process[J]. ACS Sustainable Chem Eng, 2020, 8(42): 15980-15988. i. Huang X W, Liu J, Yang Q J, et al. Microfluidic chipbased one-step fabrication of an artificial photosystem I for photocatalytic cofactor regeneration[J]. RSC Adv, 2016, 6(104): 101974-101980. |
| [39] |
Kirch M, Lehn J M, Sauvage J P. Hydrogen generation by visible light irradiation of aqueous solutions of metal complexes. An approach to the photochemical conversion and storage of solar energy[J]. Helv Chim Acta, 1979, 62(4): 1345–1384.
|
| [40] |
Kiwi J. Photochemical generation of reduced β-nicotinamide-adenine dinucleotide (induced by visible light)[J]. J Photochem, 1981, 16(2): 193–202.
|
| [41] |
Lutz J, Hollmann F, Ho T V, et al. Bioorganometallic chemistry: Biocatalytic oxidation reactions with biomimetic NAD+/NADH co-factors and[Cp*Rh (bpy)H]+for selective organic synthesis[J]. J Org Chem, 2004, 689(25): 4783–4790.
|
| [42] |
Köhler V, Wilson Y M, Dürrenberger M, et al. Synthetic cascades are enabled by combining biocatalysts with artificial metalloenzymes[J]. Nat Chem, 2013, 5(2): 93–99.
|
| [43] |
Khataee A R, Kasiri M B. Photocatalytic degradation of organic dyes in the presence of nanostructured titanium dioxide: Influence of the chemical structure of dyes[J]. J Mol Catal A: Chem, 2010, 328(1): 8–26.
|
| [44] |
Schneider J, Matsuoka M, Takeuchi M, et al. Understanding TiO2 photocatalysis: Mechanisms and materials[J]. Chem Rev, 2014, 114(19): 9919–9986.
|
| [45] |
Wang X C, Maeda K, Thomas A, et al. A metal-free polymeric photocatalyst for hydrogen production from water under visible light[J]. Nat Mater, 2009, 8(1): 76–80.
|
| [46] |
Zhang Y Y, Zhao Y J, Li R, et al. Bioinspired NADH regeneration based on conjugated photocatalytic systems[J]. Sol RRL, 2021, 5(2): 2000339.
|
| [47] |
a. van Schie M M C H, Zhang W, Tieves F, et al. Cascading g-C3N4 and peroxygenases for selective oxyfunctionalization reactions[J]. ACS Catal, 2019, 9(8): 7409-7417. b. Özgen F F, Runda M E, Schmidt S. Photo-biocatalytic cascades: Combining chemical and enzymatic transformations fueled by light[J]. ChemBioChem, 2021, 22(5): 790-806. |
 2022, Vol. 36
2022, Vol. 36