2. 中国科学院兰州物理化学研究所 羰基合成与选择氧化国家重点实验室, 甘肃 兰州 730000
2. State Key Laboratory for Oxo Synthesis & Selective Oxidation, Lanzhou Institute of Chemical Physics, Chinese Academy of Science, Lanzhou 730000, China
植物甾醇(Phytosterol, PS)是一种结构类似于胆固醇的天然甾体化合物, 主要包括β-谷甾醇、豆甾醇、菜油甾醇等, 广泛存在于植物的根茎、叶、花、果实、种子中[1-3]. 植物甾醇最主要的功能是降低胆固醇[4-7], 此外它还具有抗氧化[8]、预防癌症[9]和动脉粥样硬化等生物活性功能[9-11]. 但由于它熔点高(> 140 ℃)、油溶性差(25 ℃时约为2%~3%), 严重限制了它在功能性食品中的功效和应用范围[12-13]. 针对植物甾醇的酯化改性是降低其熔点、增加其脂溶性的有效手段, 以植物甾醇和中长链脂肪酸进行酶催化的酯化合成, 能够有效地结合植物甾醇和脂肪酸的功能优势, 既提高了甾醇的脂溶性, 又提高了脂肪酸的稳定性, 因此受到国内外学者的广泛关注[14-16]. Hakalin等[17]利用β-谷甾醇为反应底物, 以5种不同碳链长度的油酸为酰基供体, 进行酶催化的酯化反应, 并利用响应面实验优化最佳合成条件. 研究表明Ophiostoma piceae (OPEr)酶能有效催化合成谷甾醇酯, 谷甾醇油酸酯在34.7 ℃、酶添加量7.5 U/mL、酰基供体添加量为22.8 mmol/L的条件下反应343.4 min后, 得到底物游离甾醇的最大转化率为89.3±0.7%. Wang等[18]利用CRL脂肪酶为催化剂, 催化植物甾醇与高油酸葵花籽油中的脂肪酸(油酸含量84%)进行反应, 采用响应面法对合成工艺进行优化, 产物转化率在反应2 h后达到96.8%, 植物甾醇酯的收率为92%. 研究表明制备的植物甾醇酯具有较高的油溶性和氧化稳定性, 从而扩大了其在功能性食品领域的应用.
微波辐照技术在辅助催化反应中能够达到很好的强化效果. 微波是一种频率介于300 MHz到300 GHz之间变化的电磁波, 能够通过共振或弛豫现象将能量转移到反应物中, 通过诱导反应物分子的快速迁移, 达到减少热损失、缩短反应时间、减少能耗的目的[19-20]. 所以与传统加热相比, 微波加热更加迅速快捷且温度均匀, 不会出现传统加热外部温度高内部温度低的现象, 不存在温度滞后性[21-22]. 尽管如此, 在酶催化的非水相体系中通常采用的弱极性或非极性的有机试剂作为反应介质, 微波的热效应受到影响, 并且采用游离酶催化合成植物甾醇酯时会出现酶团聚的现象, 这势必会影响到最终的转化率. 因此, 需要一种反应温和、耗时短、转化率高, 且能避免酶团聚的合成方法来进行植物甾醇油酸酯的合成[23]. 纳米金具有较小的扩散限制、较大的比表面积和较高的酶担载量, 并且其良好的生物亲和性和微波辐射下产生的“热点效应”, 能够显著提高酶催化反应效率, 因此可将其用于微波场强化下的脂肪酶的催化反应中[24].
为解决以上问题, 我们首先利用直接合成法合成纳米金杂化的脂肪酶, 然后在微波场辅助的条件下, 利用AuNPs-CRL纳米杂化酶催化合成植物甾醇酯. 通过控制变量法及响应面实验, 探究AuNPs粒径、AuNPs-CRL添加量、微波功率、微波时间对植物甾醇转化率的影响, 优化合成工艺, 为植物甾醇的酯化改性提供一种新方法.
1 材料与方法 1.1 实验材料与设备植物甾醇(源叶生物科技有限公司, 纯度为95%, 其中包含41.54%的β-谷甾醇、28.89%的豆甾醇、23.76%的菜油甾醇、1.17%的菜籽甾醇), 油酸(西陇科学股份有限公司, 纯度为99%), 褶皱假丝酵母脂肪酶(CRL)(700 U/mg, Sigma公司), 氯金酸(纯度99.9%, 国药集团上海试剂公司), 正己烷、甲苯、冰乙酸、无水乙醇、碳酸氢钠、乙醚等试剂均为分析纯, 购自天津市天力化学试剂有限公司.
XH-100A微波反应器, 北京祥鹄科技有限公司; DHG-9053A恒温鼓风干燥箱, 上海一恒科学仪器有限公司; SB25-12DTD超声波清洗机, 宁波新芝生物科技有限公司; KH-2000薄层色谱扫描仪, 上海科贺生化科技有限公司; Scion456气相色谱仪, 天美(中国)科学仪器有限公司; RV8V旋转蒸发仪, 德国IKA公司; PerkinElmer 100傅里叶变换红外光谱仪, 美国PerkinElmer公司; 2-16K冷冻离心机, Sigma公司; FDU-1200冷冻干燥机, 东京理化器械株式会社.
1.2 AuNPs-CRL杂化酶的制备首先利用柠檬酸钠法制备纳米金[25], 通过控制反应体系中柠檬酸钠浓度来制备不同粒径的纳米金溶液. 将HAuCl4溶液(0.1 g/mL, 100 mL)倒入圆底烧瓶中, 并加热至溶液微沸, 然后逐滴加入不同体积的1%柠檬酸钠溶液, 混合均匀并继续加热2 min, 直至溶液颜色由淡黄色逐渐转变为蓝黑色、紫红色, 室温下静置冷却备用. 通过AuNPs溶液在紫外分光光度计下SPR吸收峰和450 nm处吸光度计算AuNPs的粒径, 计算方法参见公式(1)[26]. 通过该方法制得平均粒径分别为10、12、15、17、20和30 nm的纳米金溶液.
| $ d=e^{3.00 \times \frac{A_{s p r}}{A_{450}}-2.20} $ | (1) |
其中, Aspr为AuNPs最高峰的吸光度值; A450为AuNPs在450 nm处的吸光度值.
利用直接合成法构建AuNPs-CRL杂化酶. 将充分混合均匀的CRL酶液(10 mg/mL, 14 mL)倒入100 mL的具塞三角瓶中, 然后向反应瓶中加入40 mL制备好的不同粒径的纳米金溶液, 于35 ℃的恒温培养箱中静置24 h. 借助脂肪酶分子上的巯基和二硫键, 通过与纳米金形成金硫键或二者之间的静电吸附作用构建AuNPs-CRL纳米金属杂化酶. 静置结束后, 将AuNPs-CRL杂化酶溶液于5 000 r/min的条件下离心10 min, 去除未反应的脂肪酶后将沉淀冷冻干燥得到的利用不同粒径纳米金制备的AuNPs-CRL杂化酶粉末, 置于4 ℃冰箱中冷藏备用.
1.3 植物甾醇酯的合成及检测方法取50 mL三颈圆底烧瓶, 并向其中分别加入一定量充分干燥脱水的植物甾醇、油酸, 然后加入脱水处理后的正己烷10 mL, 充分混合均匀后, 加入适量AuNPs-CRL杂化酶, 然后将反应瓶置于微波反应器中, 打开冷凝水, 设置好微波功率及反应时间后开始反应, 微波反应器如图 1所示. AuNPs-CRL杂化酶催化的植物甾醇油酸酯合成如图 2所示. 反应结束后取出反应溶液, 于5 000 r/min的条件下离心10 min去除脂肪酶, 将上清液用正己烷稀释适当倍数后利用气相色谱检测底物转化率.
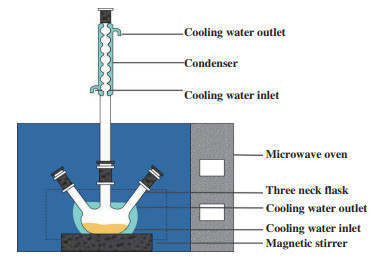
|
图 1 微波反应器示意图 Fig.1 Schematic diagram of microwave reactor |

|
图 2 AuNPs-CRL杂化酶催化的植物甾醇油酸酯合成的示意图 Fig.2 Schematic illustration of synthesis of phytosterol oleate catalyzed by AuNPs-CRL hybridase |
以外标法气相色谱进行植物甾醇的定量检测, 首先以不同浓度植物甾醇为横坐标, 以植物甾醇总峰面积为纵坐标, 绘制标准曲线, 并进行线性回归方程的拟合. 气相色谱使用DB-5 HT熔融石英毛细管柱(30.0 m×0.25 mm×0.1 μm)为分离柱, FID检测器, 载气为氮气, 载气流速为4.0 mL/min, 样品进样量1 μL, 分流比为5∶1. 采用梯度升温的方式进行检测, 初始柱温为210 ℃, 保持2 min, 然后以10 ℃/min的速度升温至310 ℃, 保持8 min, 进样器温度为300 ℃, 检测器温度为320 ℃. 通过该方法得到植物甾醇的线性方程为y=2 284.5x-4 049.4, R2为0.999 4, 表示拟合程度良好, 可用于植物甾醇的定量检测.
通过反应前后植物甾醇的变化量计算植物甾醇的转化率, 具体计算方法如公式(2).
| $ \text { Conversion of phytosterols }=\frac{W_1-W_2}{W_1} \times 100 \% $ | (2) |
其中: W1为反应前体系中甾醇含量(mol/L); W2为酯化后反应体系中甾醇含量(mol/L).
1.4 反应条件优化 1.4.1 单因素实验利用控制变量法分别研究AuNPs粒径、AuNPs-CRL杂化酶添加量、微波功率、微波反应时间对微波强化AuNPs-CRL杂化酶合成植物甾醇酯转化率的影响. 初始反应条件为: 植物甾醇2.5 mmol, 油酸7.5 mmol, AuNPs-CRL杂化酶的添加量为植物甾醇质量的10%(g/g), 正己烷10 mL, 分子筛6粒, 反应温度45 ℃, 微波功率480 W, 反应时间80 min. 每组实验重复3次, 数据利用SPSS软件进行汇总分析.
1.4.2 响应面优化实验综合单因素的实验结果, 选择AuNPs粒径、AuNPs-CRL添加量、微波功率和微波时间4个因素进行4因素3水平的Box-Behnken响应面实验设计, 并用Design-Expert 13进行响应面分析, 以此得到微波强化纳米金杂化酶合成植物甾醇酯的最优条件. 因素水平表见表 1.
| 表 1 因素水平表 Table 1 Factor level table |
将制备好的纳米金及AuNPs-CRL杂化酶溶液于8 000 r/min的条件下离心15 min, 弃去上清液, 取沉淀加入蒸馏水复溶后继续离心, 重复3次洗去未反应的氯金酸及游离酶, 然后在沉淀中加入少量蒸馏水复溶后, 将其均匀的滴在铜网上, 在通风处自然风干后, 通过JEOL JEM-2100F透射电子显微镜观察纳米金的形貌.
1.5.2 甾醇油酸酯的红外光谱检测方法采用溴化钾压片法对甾醇油酸酯进行红外光谱检测, 首先将反应后的样品于5 000 r/min的条件下离心10 min去除AuNPs-CRL杂化酶, 然后取上层溶液用体积比1∶1的正己烷和无水乙醇在45 ℃的条件下混匀, 并置于4 ℃冰箱中静置24 h, 静置结束后将结晶析出的植物甾醇通过过滤分离出去, 然后向滤液中添加4%的NaHCO3溶液使油酸皂化, 皂化后的油酸在6 000 r/min的条件下离心15 min, 重复上述步骤以去除未反应的油酸, 然后通过旋蒸去除反应介质, 得到淡黄色的混合物进行红外光谱分析, 以底物植物甾醇的红外光谱作为对照. 红外光谱的测试范围为400~4 000 cm-1, 分辨率为4 cm-1. 按照公式(3)对产物植物甾醇酯的收率进行计算.
| $ \text { Yield }=\frac{\text {m}_1}{\text {m}_0} \times 100 \% $ | (3) |
式中m1为纯化后植物甾醇酯的质量(mg), m0为最佳条件下理论上合成的植物甾醇酯的质量(mg).
1.5.3 甾醇油酸酯的薄层层析检测方法反应结束后, 以植物甾醇和油酸为对照取样进行薄层层析检测[24]. 薄层板为20 cm×10 cm预铺板, 展开剂为正己烷∶乙醚∶冰乙酸=90∶10∶1, 展开时间为30 min, 展开结束后将薄层板置于通风处风干, 经碘熏显色后置于薄层层析仪中观察展开情况.
1.6 酶蛋白的杂化效率和残余活性测定方法杂化效率是指在杂化过程中成功杂化的酶蛋白占总投入蛋白的比例. 向100 mL具塞三角瓶中加入10 mL浓度为10 mg/mL酶液, 再添加40 mL的AuNPs溶液, 将其混匀后盖上胶塞并用保鲜膜密封好, 于35 ℃恒温培养箱中反应24 h, 将反应溶液在8 000 r/min的条件下离心15 min, 下方沉淀即为杂化酶, 上清液是没有被杂化而剩余的蛋白量. 将下方沉淀经冷冻干燥处理, 通过橄榄油乳化法测定酶活, 以初始的CRL酶活为100%, 测定的结果与其比值即为保留的活性.
1.7 酶的重复利用稳定性研究方法取浓度为10 mg/mL的CRL溶液10 mL, 添加40 mL粒径为15 nm的纳米金溶液, 放在35 ℃的恒温培养箱中反应24 h, 冷冻干燥制得杂化酶. 将其投入反应, 反应后的反应液在离心机10 000 r/min离心20 min, 将沉淀取出重复进行催化反应, 测定重复使用性. 将初始酶活力设定为100%, 计算剩余相对酶活力. 每组实验重复3次取平均值.
2 结果与讨论 2.1 AuNPs-CRL杂化酶及产物的结构表征 2.1.1 AuNPs和AuNPs-CRL杂化酶的TEM检测利用透射电镜能够直观的表现出纳米金及杂化酶的形态及分布. 图 3为纳米金及AuNPs-CRL杂化酶的透射电镜图, 从图 3(a)中可以看出柠檬酸钠法制备的纳米金呈圆形或椭圆型, 粒径均匀且分散良好. 图 3(b)可以看出CRL脂肪酶与纳米金在共价键及静电相互作用下且在聚集在一起, 结合紧密.

|
图 3 (a) AuNPs和(b)AuNPs-CRL的TEM检测 Fig.3 The TEM images of (a) AuNPs and (b) AuNPs-CRL hybridase |
植物甾醇酯的红外光谱图如图 4所示, 其中1 000~1 300 cm-1出现的伸缩振动为C-O伸缩振动、C-C骨架振动, 2 853 cm-1出现的伸缩振动为烷烃的C-H伸缩振动(对称), 2 956 cm-1出现的伸缩振动为烷烃的C-H伸缩振动(反称). 从图中可以看出3 366 cm-1为底物植物甾醇的羟基伸缩振动峰, 该振动峰在产物的红外光谱图中几乎消失不见, 而在1 733 cm-1附近出现酯键的伸缩振动峰. 综上, 认为在植物甾醇的羟基与油酸的羧基发生了酯化反应, 形成了新产物甾醇油酸酯.
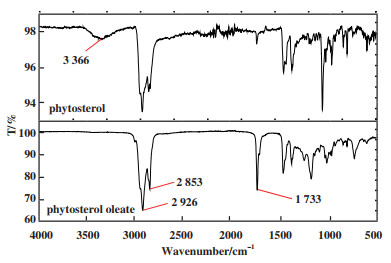
|
图 4 植物甾醇油酸酯的红外光谱图 Fig.4 The FT-IR spectrum of phytosterol oleate |
图 5为样品的薄层层析结果图, 图中样品点1为油酸, 比移值为0.26, 样品点2为植物甾醇, 比移值为0.07. 图中样品点3为反应后的产物, 除了比移值相似的油酸与植物甾醇外, 还出现了一个比移值为0.81的新物质, 综合分析样品的极性与扩散速度, 认为比移值为0.81的新物质应为植物甾醇油酸酯.

|
图 5 植物甾醇油酸酯的薄层层析结果图 Fig.5 The TLC of phytosterol oleate |
纳米金粒径对植物甾醇转化率的影响主要体现在两方面, 一是纳米金粒径会影响脂肪酶的活性, 进而影响植物甾醇酯的转化率. 在纳米金属杂化酶的构建过程中, 脂肪酶在纳米金表面的相对曲率以及酶与纳米金的接触面积是控制酶活性大小的决定性因素, 研究表明随纳米金粒径的逐渐增加, 酶结构中的α-螺旋构象逐渐被β-折叠所取代, 导致酶的构象发生变化、活性位点暴露[27]. 同时较小粒径的纳米金与脂肪酶之间具有较大的比表面积, 有利于增加酶与底物接触的机会, 增加酶的表观活性[28]. 另一方面, 纳米金作为一种金属在导热方面具有突出效果, 能够放大微波场产生的点热效应, 通过提高分子碰撞概率提高酶催化速度, 增加反应的转化率, 因此研究AuNPs粒径对转化率的影响是十分必要的.
图 6展示了AuNPs粒径对植物甾醇转化率的影响. 研究表明纳米金粒径对底物转化率的影响十分显著, 随纳米金粒径的增加, 底物的转化率由55.21%上升至65.12%, 当纳米金粒径为15 nm时, 底物转化率达到最大值, 继续增加纳米金的粒径, 植物甾醇的转化率迅速下降, 此时纳米金粒径过大, 相对曲率显著下降, 导致酶分子构象发生显著变化, 破坏了酶活性中心的空间构象, 酶活性迅速下降, 导致植物甾醇的转化率降低. 综上, 用于合成AuNPs-CRL杂化酶的纳米金最佳粒径为15 nm.
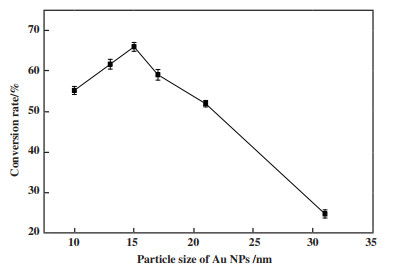
|
图 6 AuNPs粒径对植物甾醇转化率的影响 Fig.6 Effect of AuNPs particle size on the conversion rate of phytosterols (反应条件: 醇酸摩尔比为1∶3, AuNPs-CRL杂化酶的添加量为植物甾醇质量的10%, 正己烷10 mL, 微波功率480 W, 温度45 ℃, 反应时间80 min) (Reaction conditions: 45 ℃, 80 min, 1∶3 molar ratio of phytosterols to oleic acid, 10% of the mass of phytosterol for the addition of AuNPs-CRL hybridase, 10 mL hexane, microwave power was 480 W) |
AuNPs-CRL杂化酶的添加量对植物甾醇转化率的影响如图 7所示. 随着AuNPs-CRL杂化酶添加量的增加, 植物甾醇的转化率也逐步增加, 当酶的添加量为植物甾醇质量的8%时, 转化率达到最大值68.53%. 这是因为随着AuNPs-CRL杂化酶浓度的增加, 酶催化位点的数量也增加, 允许更多的底物与酶结合并进行催化作用, 导致更多的底物转化为植物甾醇酯. 继续增加AuNPs-CRL杂化酶的添加量, 植物甾醇转化率逐渐下降. 一方面, 酶量过高导致反应体系固形物含量过高, 严重影响了底物与酶之间的传质, 导致底物转化率下降. 另一方面, 随着反应体系中AuNPs-CRL杂化酶含量的增加, AuNPs的含量也随之增加, 引起强烈的热点效应, 导致局部温度过高致使酶失活. 因此, AuNPs-CRL杂化酶的最佳添加量为植物甾醇质量的8%.
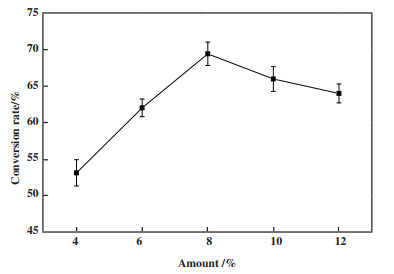
|
图 7 AuNPs-CRL添加量对植物甾醇转化率的影响 Fig.7 Effect of AuNPs-CRL hybridase amount on the conversion of phytosterols (反应条件: 醇酸摩尔比为1∶3, 纳米金粒径为15 nm, 正己烷10 mL, 微波功率480 W, 温度45 ℃, 反应时间80 min) (Reaction conditions: 45 ℃, 80 min, 1∶3 molar ratio of phytosterols to oleic acid, AuNPs particle size was 15 nm, 10 mL hexane, microwave power was 480 W) |
同时, 有研究表明纳米金的杂化效应对脂肪酶的活性有显著影响, 杂化过程中AuNPs与CRL脂肪酶内部的-NH、-SH和S-S键, 通过静电吸附和Au-S共价键的相互作用而紧密结合, 较高的曲率半径使脂肪酶在分子外部与纳米金结合时脂肪酶分子变形严重, 二级结构发生刚性变化, 造成脂肪酶活性下降[27-28].
2.2.3 微波功率对转化率的影响通过微波的热点效应, 能显著提高脂肪酶的活性, 利用均匀分布的纳米金能够作为微波吸收剂, 在微波辐射条件下产生热点效应, 达到强化酶促反应的目的. 在此过程中, 微波的功率和时间对植物甾醇的转化率均有显著影响. 图 8说明了微波功率对植物甾醇转化率的影响. 当微波功率在240~320 W之间时, 随着微波功率的增加, 植物甾醇转化率随之增加. 在低功率输入状态下, 体系达到相变的时间较长, 因此有足够长的时间将产生的热量传递到低温度区域, 导致反应体系受热均匀, 此时酶能够在温度适宜的环境中发挥催化作用. 而当微波功率较高时, 由于热点效应, 短时间内即可达到相变温度, 体系温度不均匀, 并且由于AuNPs-CRL杂化酶中纳米金的导热作用, 酶受温度的影响导致三维构象发生明显变化, 造成酶活性损失, 因此当微波功率超过320 W后, 植物甾醇的转化率迅速下降. 综上, 最适微波功率应为320 W, 以避免高功率下引起酶失活.
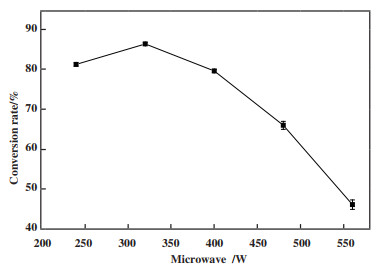
|
图 8 微波功率对植物甾醇转化率的影响 Fig.8 Effect of microwave power on the conversion of phytosterols (反应条件: 醇酸摩尔比为1∶3, 纳米金粒径为15 nm, AuNPs-CRL杂化酶的添加量为植物甾醇质量的8%, 正己烷10 mL, 温度45 ℃, 反应时间80 min) (Reaction conditions: 45 ℃, 80 min, 1∶3 molar ratio of phytosterols to oleic acid, AuNPs particle size was 15 nm, 8% (g/g) of the mass of phytosterol for the addition of AuNPs-CRL hybridase10 mL hexane) |
微波时间的控制对于该酯化反应至关重要. 微波时间不足, 酯化反应不充分, 未能达到理想的转化率; 微波时间过长, 可能会导致酶活性的不必要损失. 由图 9可知, 在40~60 min时, 增加微波时间, 反应持续向正方向进行. 当反应进行至60 min左右, 反应处于一种相对的动态平衡状态, 转化率达到最高值. 继续延长微波时间, 转化率反而降低. 一方面, 随着反应时间增加, 该酯化反应的另一产物水也在不断生成, 导致体系中的水分含量大, 引起产物甾醇酯水解. 另一方面, 随着副产物的不断积累, 反应会逐渐向反向进行. 微波辐射能量作为内部热源, 可直接加热目标化合物, 避免了常规加热需要加热整个反应体系才能加热目标物的弊端, 在达到相似转化率的同时, 节省了时间和能源. 因此, 从节约能源和提高转化率的角度来看, 选择60 min作为反应的最佳时间.
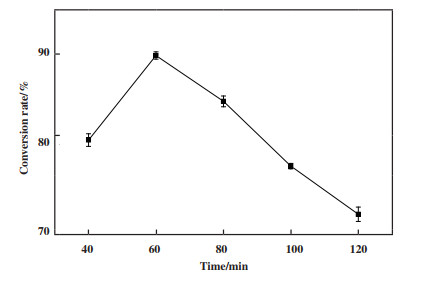
|
图 9 微波时间对植物甾醇转化率的影响 Fig.9 Effect of microwave time on the conversion of phytosterols (反应条件: 醇酸摩尔比为1∶3, 纳米金粒径为15 nm, AuNPs-CRL杂化酶的添加量为植物甾醇质量的8%, 正己烷10 mL, 温度45 ℃, 微波功率为320 W) (Reaction conditions: 45 ℃, 1∶3 molar ratio of phytosterols to oleic acid, AuNPs particle size was 15 nm, 8% (g/g) of the mass of phytosterol for the addition of AuNPs-CRL hybridase, 10 mL hexane, microwave power was 320 W) |
基于单因素实验结果, 以AuNPs粒径(A)、AuNPs-CRL杂化酶添加量(B)、微波功率(C)和微波时间(D)等因素为自变量, 以植物甾醇转化率为响应值, 经Design-Expert 8.0.6统计分析软件基于Box-Behnken中心组合试验的设计原则, 进行了4因素3水平响应面优化的试验研究, 以确定最佳催化反应条件, 具体试验方案及结果见表 2.
| 表 2 响应面实验方案和结果 Table 2 Response surface experimental scheme and results |
使用Design-Expert 13软件, 对表 2中数据进行回归拟合, 得到的回归拟合方程为:
Y=89.8767+3.0225A-0.2425B-1.25083C+1.06083D+0.73AB+1.7275AC+2.42AD-0.1875BC-0.535BD-0.1625CD-4.13583A2-3.56333B2-3.23083C2-5.25083D2
其中Y为底物植物甾醇酯的转化率(%), A为纳米金粒径(nm), B为AuNPs-CRL杂化酶用量(%), C为微波功率(W), D为微波反应时间(min).
2.3.2 二次回归模型的方差分析为检验回归方程有效性, 对回归模型进行方差分析和显著性检验, 结果如表 3所示.
| 表 3 回归模型方差分析结果 Table 3 ANOVA results of the regression mode |
由表 3回归模型方差分析结果可以看出, 该模型的F值为15.66, P值<0.001, 表示该模型极显著, 说明模型拟合有意义. 模型的失拟项F值为4.83, P值为0.183 7, 表明该模型的失拟项不显著, 影响响应值的各因素均包含在模型范围内, 说明模型与试验的差异值较小, 能够很好地解释四因素与响应值之间的关系. 建立的回归模型决定系数R2=0.948 1, 调整回归系数Radj2=0.887 5. 植物甾醇转化率的实际值和预测值具有较高的拟合度, 误差小, 可用这个模型来预测不同AuNPs粒径、AuNPs-CRL杂化酶添加量、微波功率和微波时间对植物甾醇转化率的影响.
F值越大表明该因素对响应值的影响越显著. 所以各因素对植物甾醇转化率的影响顺序为A-AuNPs粒径 > C-微波功率 > D-微波时间 > B-AuNPs-CRL添加量. 由方差分析结果可以看出: A-AuNPs粒径、C-微波功率、交互作用AD、A2、B2、C2、D2为极显著水平(P < 0.01); D-微波时间、交互作用AC为显著水平(0.01≤P < 0.01); 剩余的B-AuNPs-CRL添加量、交互作用AB、交互作用BC、交互作用BD、交互作用CD对响应值的影响不显著(P≥0.05). 表明四因素对响应值植物甾醇转化率均存在显著影响, 表现出一种非线性关系.
2.3.3 响应面交互作用分析交互作用图和等高线图可形象地描述各因素之间的交互作用, 如图 10所示. 响应面的坡度大小可直接反映各因素对响应值的影响程度, 曲面图中坡度越大, 表明该因素对响应值的影响越大. 比较响应面图中坡度大小, 可以判断出各因素对植物甾醇转化率的影响程度分别为: A-AuNPs粒径 > C-微波功率 > D-微波时间 > B-AuNPs-CRL杂化酶添加量. 等高线的形状反映两因素交互作用的大小. 在图 10b和图 10c中, 等高线趋近椭圆, 表明图中所涉及的两因素交互作用较好; 在图 10a、d、e、f中, 等高线趋于圆形, 表明图中所涉及的两因素交互作用较弱.
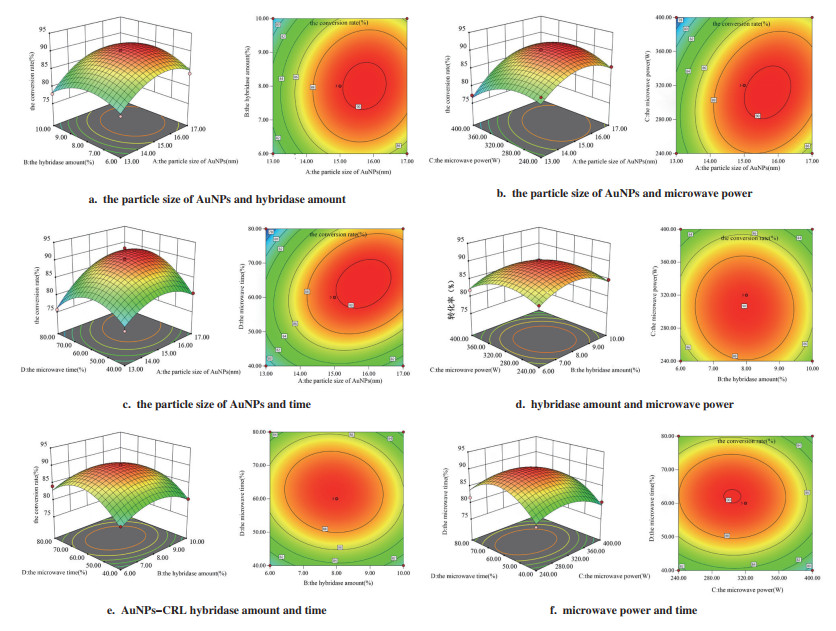
|
图 10 4因素两两交互作用的响应面图和等高线图 Fig.10 Response surface and contour plots of pairwise interactions of the four factors |
利用Design Expert 8.0.6软件对上述所得到的回归方程进行进一步分析, 能够得到微波场强化AuNPs-CRL杂化酶合成植物甾醇油酸酯的最佳工艺条件为: AuNPs粒径15.74 nm, AuNPs-CRL添加量7.99%, 微波功率312.77 W, 微波时间63.56 min, 在此条件下植物甾醇转化率的理论值为91.66%. 为验证响应面所得结果的准确性, 结合实际因素, 将最佳合成条件调整为AuNPs粒径15 nm, AuNPs-CRL杂化酶添加量8%, 微波功率320 W, 微波时间64 min, 在此优化条件下进行3次重复实验, 测得植物甾醇的转化率为91.24%±0.42%, 可见实际值与理论值相接近, 说明本实验模型与实际情况拟合良好, 可用于实际值检测.
2.4 酶蛋白杂化效率和残余活性结果分析研究表明, CRL原液蛋白浓度为0.294 mg/mL、体积为10 mL, 上清液的蛋白浓度为0.040 mg/mL、体积为49 mL. 经计算有32.72%的脂肪酶与纳米金粒子结合, 杂化效率较低的原因是因为柠檬酸钠法制备的纳米金粒径较大, 很难进入脂肪酶内部形成杂化酶. 此外对冷冻干燥后的沉淀部分进行了酶活测定, 得出AuNPs-CRL杂化酶的残余活性为68.33%.
2.5 酶的重复利用稳定性重复使用稳定性是判断杂化酶性能的一个重要的手段, 与游离酶相比, AuNPs-CRL杂化酶能够通过简单的物理方法将其与反应体系分离开来, 酶活损失较少. 图 11展示了CRL和杂化酶的反复、批式的反应操作稳定性的研究结果, 可以看出游离的CRL脂肪酶重复使用6次后, 酶活损失了一半, 而AuNPs-CRL杂化酶重复使用6次后, 相对酶活仍保持在71.61%, 比CRL高19.22 %, 表明杂化酶具有较好的操作稳定性.

|
图 11 CRL和杂化酶的反复批式反应操作稳定性 Fig.11 Repeated batch reaction operation stability of CRL and AuNPs-CRL hybridase |
我们选用AuNPs-CRL杂化酶为催化剂, 联合微波场强化技术合成植物甾醇油酸酯. 结果表明, 杂化酶中的AuNPs能够吸收微波, 产生热点效应, 从而强化酶促反应. 通过单因素实验和响应面法可以确定最佳反应条件为AuNPs粒径15 nm, AuNPs-CRL添加量8%, 微波功率320 W, 微波时间64 min. 此条件下测得植物甾醇的转化率能够达到91.24%±0.42%, 收率为83.73%, 结果与预测值吻合度好, 并且得益于微波体系中AuNPs的热点效应, 植物甾醇转化率显著提高, 并且能够进一步减少微波功率和微波时间, 达到节约能耗的效果, 为制备具有良好油溶性和氧化稳定性的植物甾醇酯提供了一种绿色的合成方法.
利用生物酶催化法合成植物甾醇酯是改善植物甾醇溶解性和氧化稳定性的良好手段, 但该技术目前还存在一些问题亟待解决, 例如脂肪酶的团聚等. 我们在研究中发现在酶催化的甾醇酯合成过程中有部分甾醇脱水副产物生成, 未来也将继续针对如何减少副产物的生成进行研究, 希望为实现植物甾醇酯的工业化生产提供理论基础.
| [1] |
Ren Jian-min(任建敏). The bioactivities of the phytosterolsin foods and their pharmacological actions(食物中植物甾醇生理活性及药理作用研究进展)[J]. Sci Technol Food Ind(食品工业科技), 2015, 36(22): 389-393+399.
|
| [2] |
Liu W, Xiao B, Wang X, et al. Solvent-free synthesis of phytosterol linoleic acid esters at low temperature[J]. Rsc Adv, 2021, 11(18): 10738–10746.
DOI:10.1039/D1RA00798J |
| [3] |
Leone A, Spada A, Battezzati A, et al. Moringa oleifera seeds and oil: Characteristics and uses for human health[J]. Int J Mol Sci, 2016, 17(12): 2141–2155.
DOI:10.3390/ijms17122141 |
| [4] |
Poli A, Marangoni F, Corsini A, et al. Phytosterols, cholesterol control and cardiovascular disease[J]. Nutrients, 2021, 13(8): 2810–2823.
DOI:10.3390/nu13082810 |
| [5] |
Cedó L, Farràs M, Lee-Rueckert M, et al. Molecular insights into the mechanisms underlying the cholesterol-lowering effects of phytosterols[J]. Curr Med Chem, 2019, 26(37): 6704–6723.
DOI:10.2174/0929867326666190822154701 |
| [6] |
He W S, Jia C S, Yang Y B, et al. Cholesterol-lowe-ring effects of plant steryl and stanyl laurate by oral administration in mice[J]. J Agr Food Chem, 2011, 59(9): 5093–5099.
DOI:10.1021/jf104031e |
| [7] |
Chen S, Wang R, Cheng M, et al. Serum cholesterol-lowering activity of beta-Sitosterol laurate is attributed to the reduction of both cholesterol absorption and bile acids reabsorption in hamsters[J]. J Agr Food Chem, 2020, 68(37): 10003–10014.
DOI:10.1021/acs.jafc.0c04386 |
| [8] |
Shahzad N, Khan W, Shadab M D, et al. Phytosterols as a natural anticancer agent: Current status and future perspective[J]. Biomed Pharmacother, 2017, 88: 786–794.
DOI:10.1016/j.biopha.2017.01.068 |
| [9] |
Cabral C E, Klein M R S T. Phytosterols in the treatment of hypercholesterolemia and prevention of cardiovascular diseases[J]. Arq Bras Cardiol, 2017, 109(5): 475–482.
|
| [10] |
Tada H, Nohara A, Inazu A, et al. Sitosterolemia, hyper-cholesterolemia and coronary artery disease[J]. J Atheroscler Thromb, 2018, 25(9): 783–789.
DOI:10.5551/jat.RV17024 |
| [11] |
Xiao X H, Yuan Z Q, Li G K, et al. Preparation of phytosterols and phytol from edible marine algae by microwave-assisted extraction and high-speed counter-current chromatography[J]. Sep Purif Technol, 2013, 104(5): 284–289.
|
| [12] |
Zhang Y, Zhang T, Zhang Y, et al. Microwave‐assisted catalytic synthesis of phytosterol esters[J]. Int J Food Sci Tech, 2022, 57(5): 3162–3170.
DOI:10.1111/ijfs.15649 |
| [13] |
He W S, Zhu H, Chen Z Y. Plant Sterols: Chemical and enzymatic structural modifications and effects on their cholesterol-lowering activity[J]. J Agr Food Chem, 2018, 66(12): 3047–3062.
DOI:10.1021/acs.jafc.8b00059 |
| [14] |
a. He W S, Cui D D, Zhang Y L, et al. Highly efficient synthesis of phytosterol linolenate catalyzed by candida rugosa lipase through transesterification[J]. Food Sci Technol Res, 2017, 23(4): 525-533. b. Chen Lin-lin(陈林林), Zhang Jia-xin(张佳欣), Li Wei(李伟), et al. Preparation and catalytic properties of inorganichybrid lipase(无机杂化脂肪酶的制备及其催化性能研究)[J]. J Mol Catal (China)(分子催化), 2022, 36(3): 235-244. c. Zhang Can(张灿), Jiang Guo-fang(姜国芳), Yang Jiang-nan(杨江楠), et al. Research progress of immobilized lipaseon porous materials(多孔材料固定化脂肪酶的研究进展)[J]. J Mol Catal (China)(分子催化), 2020, 34(4): 378-396. |
| [15] |
Hu Y Y, Ma C G, Zhou T L, et al. Enzymatic synthesis of hydrophilic phytosterol polyol esters and assessment of their bioaccessibility and uptake using an in vitro digestion/Caco-2 cell model[J]. Food Chem, 2022, 370(15): 1–8.
|
| [16] |
Pereira A S, De Souza A H, Fraga J L, et al. Lipases as effective green biocatalysts for phytosterol esters' production: A review[J]. Catalysts, 2022, 12(1): 88–101.
DOI:10.3390/catal12010088 |
| [17] |
Hakalin N L S, Molina-Gutiérrez M, Prieto A, et al. Optimization of lipase-catalyzed synthesis of β-sito-stanol esters by response surface methodology[J]. Food Chem, 2018, 261(30): 139–148.
|
| [18] |
Wang X, Xiao B, Yang G, et al. Enzymatic preparation of phytosterol esters with fatty acids from high-oleic sunflower seed oil using response surface methodology[J]. RSC adv, 2021, 11(25): 15204–15212.
DOI:10.1039/D1RA01486B |
| [19] |
Nayak S N, Bhasin C P, Nayak M G. A review on microwave-assisted transesterification processes using various catalytic and non-catalytic systems[J]. Renew Energ, 2019, 143: 1366–1387.
DOI:10.1016/j.renene.2019.05.056 |
| [20] |
Hoang Chinh Nguyen, Huang Kuan-Chieh, Su Chia-Hung. Green process for the preparation of phytosterol esters: Microwave-mediated noncatalytic synthesis[J]. Chem Eng J, 2020, 382(15): 1–8.
|
| [21] |
Qiang R, Du Y, Zhao H, et al. Metal organic framework-derived Fe/C nanocubes toward efficient microwave absorption[J]. J Mater Chem A, 2015, 3(25): 13426–13434.
DOI:10.1039/C5TA01457C |
| [22] |
Zhao H, Wang F, Cui L, et al. Composition optimization and microstructure design in MOFs-Derived magnetic carbon-based microwave absorbers: A review[J]. Nanomicro Lett, 2021, 13(1): 1–33.
|
| [23] |
Yusuf J Y, Soleimani H, Sanusi Y K, et al. Recent advances and prospect of cobalt based microwave absorbing materials[J]. Ceram Int, 2020, 46(17): 26466–26485.
DOI:10.1016/j.ceramint.2020.07.244 |
| [24] |
Wang yan(王艳), Gao Peng(高鹏), Xin Jia-ying(辛嘉英), et al. Gold nanoparticles assisted microwave coup-ling lipase catalyzed synthesis of ferulic acid starch ester(纳米金辅助微波耦合脂肪酶催化阿魏酸淀粉酯的合成)[J]. Food Res & Dev(食品研究与开发), 2018, 39(24): 1-6.
|
| [25] |
Li Chun-yu(李春雨), Xin Jia-ying(辛嘉英), Lin Hui-ying(林惠颖), et al. Study on functionalized gold nanoparticlesof methanobactin by copper ion coordination uesd as simulated peroxidase(铜离子配位甲烷氧化菌素功能化纳米金模拟过氧化物酶的研究)[J]. J Mol Catal (China)(分子催化), 2017, 31(5): 480-485.
|
| [26] |
Shao Q, Wu P, Gu P, et al. Electrochemical and spectr-oscopic studies on the conformational structure of hemoglobin assembled on gold nanoparticles[J]. J Physi Chem B, 2011, 115(26): 8627–8637.
DOI:10.1021/jp203344u |
| [27] |
Haiss W, Thanh N T K, Aveyard J, et al. Determination of size and concentration of gold nanoparticles from UV-Vis spectra[J]. Analytical Chem, 2007, 79(11): 4215–4221.
DOI:10.1021/ac0702084 |
| [28] |
Shao Q, Wu P, Gu P, et al. Electrochemical and spectr-oscopic studies on the conformational structure of hemoglobin assembled on gold nanoparticles[J]. J Phys Chem B, 2011, 115(26): 8627–8637.
DOI:10.1021/jp203344u |
 2022, Vol. 36
2022, Vol. 36


