2. 南京信息工程大学 化学与材料学院, 江苏 南京 210044
2. School of Chemistry and Materials Science, Nanjing University of Information Science & Technology, Nanjing 210044, China
室内挥发性有机化合物(VOCs)可对人体健康造成巨大危害, 如甲醛、苯、甲苯等, 其中甲醛(HCHO)作为一种典型的室内空气污染物, 其来源广泛, 危害极大, 已经被列为“一级致癌物”[1-3].长期接触气态HCHO, 甚至低浓度HCHO(0.1~0.4 mg·m-3), 亦会对人体健康造成诸多不利影响[4-5].由于室内空气污染与人们的生活息息相关, 所居住的环境和工作场所都或多或少存在气态HCHO污染问题, 因此高效去除室内HCHO污染对于改善居住和工作场所空气质量是必要的.
现有技术中如物理或化学吸附[6-7]、等离子体[8-9]以及催化氧化[10-12]等, 已被广泛应用于室内气态HCHO的去除, 其中吸附法是一种利用某些吸附能力强的材料, 如活性炭或分子筛等吸附去除VOCs的方法, 具有装置简单、净化效率高、成本低等特点, 但存在吸附剂吸附饱和失效、吸附容量有限(尤其低浓度VOCs)、再生困难等问题, 且易造成二次污染[13-14]. 低温等离子体是利用空气强力杀菌除臭技术去除VOCs的方法, 具有装置简单、除臭效率高、自动化程度高等优点, 但亦存在降解不完全而造成二次污染、易产生火花放电、能耗高、安全性差等问题[15].催化氧化技术被认为是一种最为有效的实用技术, 可分为热催化、常温催化、光催化和臭氧辅助催化氧化等, 由于HCHO的可降解性, 无需光照、加热或O3辅助的常温催化氧化技术在消除室内环境中低浓度气态HCHO方面具有重要实际应用价值, 具有净化效率高、能耗低、操作简单、无二次污染等优点, 催化剂可在常温条件下(0~35 ℃)将HCHO转化为CO2和H2O[16-17].
目前, 常温催化氧化技术的核心任务仍是寻求净化效率高、性能稳定、抗水蒸气能力强、成本低的催化新材料, 其主要包括贵金属催化剂和非贵金属催化剂两大类. 贵金属催化剂是一类最为有效的催化材料, 如铂(Pt)、钯(Pd)、金(Au)和钌(Ru)等, 其分散于高比表面积载体上最为高效, 如Pd/TiO2[18]、Ag/TiO2[19]、Au/SiO2[20]、Pt/ZSM-5[21]和Pt/Co3O4[22]等, 可在常温条件下实现对气态HCHO完全降解. He等[23]开发了一种具有丰富氧空位的还原TiO2, 在其上负载Pd. 还原的TiO2通过将电子从载体转移到Pd, 形成带负电的钯纳米粒子, 从而显著诱导了电子-金属-载体的相互作用, 促进了氧的缔合. 同时, 与原始TiO2相比, 还原的TiO2通过提供更多锚定位点和电子富集位点, 显著增加了Pd的分散度和还原程度. 然而, 贵金属催化剂价格昂贵、资源匮乏, 且需要高比表面积载体来分散这些贵金属, 如Pt纳米颗粒粒径须在2~4 nm范围内(甚至低于1 nm)才能显示出高活性, 因而限制了其广泛应用.
研究发现, 具有活性氧物种和快速电子转移特性的过渡或稀土金属氧化物(Fe2O3、MnO2、NiO、Co3O4、CeO2和CuO等)是贵金属催化剂的良好替代品, 具有催化活性相对较高、成本低、还原性强、稳定性好、无二次污染等特点, 其中氧化锰(MnOx)在氧化性能方面都被证明是降解HCHO最有效的过渡金属氧化物之一, 其通过锰物种(Mn4+/Mn3+)间的氧化还原循环及氧活化过程进行氧转移, 并在催化剂表面产生移动电子环境促使氧化还原反应的进行[24-25]. Huang等[26]通过原位还原结合氨改性合成了δ-MnOx/活性炭催化剂, 通过调节Mn3+含量有效调节了氧空位浓度, 优化后的催化剂在室温下具有优越的HCHO去除效率和CO2选择性, 这主要是由于丰富的氧空位对氧的活化, 从而形成活性氧物种. 相较于单组分氧化锰催化剂, 两种或多种金属氧化所形成的混、复合氧化物基于氧化物间的协同作用可展示出更高的氧化性能. Lu等[27]采用溶胶-凝胶柠檬酸法合成了一系列高效MnOx-Co3O4-CeO2混合氧化物. 研究了Mn/Co/Ce摩尔比的影响, 当Mn/Co/Ce的摩尔比为16/19/1时, 催化剂可以有效地将HCHO转化为CO2和H2O. 在Co3O4-CeO2中引入MnOx可以改善Co3O4的高分散性, 进而增加比表面积, 也增强了MnOx-Co3O4-CeO2的还原性和丰富的表面活性氧, 这有助于实现完全消除HCHO的优异催化活性. Wang等[28]采用共沉淀法制备了坡缕石(PG)负载的纳米级Mn1-xCexO2催化剂, 铈的掺杂显著提高了氧化锰在100~180 ℃下氧化HCHO的活性. 铈的引入显著改善了MnCe氧化物的分散性, 使MnCe氧化物具有较小的粒径、较高的氧转移能力和表面吸附氧, 表现出较高的反应活性、优异的稳定性和耐水性能.
基于上述研究进展, 为进一步提升催化剂氧化性能、稳定性及抗水性能, 同时研制出便于实际应用的负载型催化剂, 我们旨在采用不同制备方法研制CuMnCeOx混合氧化物催化剂在常温条件下催化氧化低浓度HCHO, 探索制备方法、载体对催化剂氧化性能的影响. 通过表征和催化实验重点研究了CuMnCeOx混合催化剂的微观结构、物理化学性质以及在常温下催化氧化室内低浓度甲醛, 以期研制出高效、稳定、低成本的过渡金属氧化物催化剂, 为高效合成研制常温催化氧化HCHO催化剂提供了一种新的策略.
1 实验部分 1.1 催化剂的制备实验中所用试剂均为分析纯(AR), 均购置于国药集团化学试剂有限公司, 所述溶液均采用去离子水配制. 实验采用了柠檬酸配合法和水热法制备CuMnCeOx催化剂, 以作对比分析, 具体方法如下:
(1) 柠檬酸配合法: 首先, 准确量取30 mL去离子水和7.80 mL质量分数为50% 的Mn(NO3)2溶液于烧杯中, 再称取3.2 g Cu(NO3)2·3H2O、5.0 g Ce(NO3)3·6H2O和2.0 g柠檬酸依次溶解于述溶液中(n(Mn)∶n(Cu)=5∶2, CeO2:10%, n(金属离子)∶n(柠檬酸)=6), 再将溶液加热搅拌直至形成溶胶-凝胶状, 取出后置于烘箱中80 ℃、6 h干燥和马弗炉中450 ℃、4 h煅烧制得, 记为CuMnCeOx-C催化剂. 为作比较, 其CuO-C、MnOx-C和CeO2-C催化剂亦采用上述方法制得.
(2) 水热法: 准确称量3.2 g Cu(NO3)2·3H2O和5.0 gCe(NO3)3·6H2O依次搅拌溶解在70 mL去离子水中. 再添加7.80 mL的质量分数50%的Mn(NO3)2溶液. 充分搅拌30 min后, 将其转移至具有聚四氟乙烯内胆的高压反应釜中, 经180 ℃、12 h陈化, 取出后经冷却、离心、水洗和醇洗各两次, 再置于烘箱中80 ℃、6 h干燥和马弗炉中450 ℃、4 h煅烧制得, 记为CuMnCeOx-H催化剂.
同时实验亦采用上述柠檬酸配合法制备了负载型催化剂, 以Al2O3、ZSM-5、坡缕石、高岭土和堇青石为载体, 即在上述溶液经加热形成溶胶状态下将5.0 g载体添加至其中, 并不断搅拌加热直至形成凝胶状, 其实验流程如上, 制得CuMnCeOx-C/Al2O3, CuMnCeOx-C/ZSM-5, CuMnCeOx-C/坡缕石, CuMnCeOx-C/高岭土和CuMnCeOx-C/堇青石催化剂, 其负载量均为20%.
1.2 催化剂性能评价为考察所制催化剂在常温条件下(20±4 ℃)催化氧化HCHO性能, 实验采用长、宽和高均为50 cm的玻璃反应器模拟室内空气环境. 具体过程如下: (1) 称量1.0 g催化剂粉末于培养皿A中(直径Φ: 6 cm), 并将其均匀摊平; (2) 取3滴38%甲醛溶液至培养皿B中, 并将其置于反应器内使气态HCHO浓度升高至1.1 mg·m-3左右; (3) 迅速取出培养皿B并将培养皿A置于反应器底部, 并使用凡士林密封该玻璃反应器; (4) 连续测量反应器内HCHO浓度, 保持HCHO初始浓度为1.05±0.05 mg·m-3间, 其HCHO浓度直接由甲醛分析仪(PPM-400st)测量得出, 每12 h测量连续测定3次, 取平均值, 其HCHO转化率按下式计算:
| $ \mathrm{HCHO} \text { 转化率 }(\%)=\frac{C_0-C_{\mathrm{t}}}{C_0} \times 100 \% $ |
式中: Ct表示每12 h后反应器内HCHO浓度; C0表示反应器内起始HCHO浓度.
1.3 催化剂的表征使用Cu-Kα辐射(λ=0.154 06 nm)在40 kV和40 mA条件下通过X射线衍射仪(XRD, D/teX Ultra 250 detector, Shimadzu XRD-6100, 日本)分析制备样品的晶体结构; 表面形貌采用德国蔡司公司生产的Gemini SEM扫描电镜检测分析, 工作电压5.0 kV.比表面积(BET)和孔径分布分别基于Brunauer-Emmett-Teller(BET)和Barrett-Joyner-Halenda(BJH)方法(Micromeritics ASAP 2460)进行检测. 氢程序升温还原(H2-TPR)是在U型石英反应管中进行, 热导检测器(TCD)检测. 使用Thermo ESCALAB 250XI(美国赛默飞世尔科技公司)进行X射线光电子能谱(XPS)分析. 由美国热电公司生产的傅里叶红外光谱仪(Nicolet iS5)检测分析样品红外光谱.
2 结果与讨论 2.1 催化剂表征分析 2.1.1 XRD分析为了解催化剂结构的演变对催化剂性能的影响, 实验对所制备的CuO-C、MnOx-C、CeO2-C、CuMnCeOx-C和CuMnCeOx-H催化剂的晶型结构进行了XRD分析, 如图 1所示. 对于CuO-C, 在2θ=32.5°、35.5°、38.7°、48.7°、53.4°、58.2°、61.5°、66.1°、67.8°、72.3°和74.9°处的特征峰与CuO(PDF#80-1916)的(110)、(-111)、(111)、(-202)、(020)、(202)、(-113)、(-311)、(113)、(311)和(004)晶面相匹配[29-30], 未发现有Cu2O的特征衍射峰. 纯MnOx-C的衍射图谱显示出尖锐的衍射峰, 这主要归因于结晶的α-Mn2O3物种[31], 在2θ=23.1°、32.9°、38.2°、45.1°、49.3°、55.1°和65.7°处的特征峰与Mn2O3 (PDF#73-1826)的(121)、(222)、(004)、(323)、(341)、(404)和(226)晶面相匹配. CeO2-C具有立方萤石结构[32] (PDF#34-0394), 在2θ=28.5°、33.1°、47.5°、56.3°、59.1°、69.4°、76.7°和79.1°处的特征峰与CeO2的(111)、(200)、(220)、(311)、(222)、(400)、(331)和(420)晶面相匹配. 而在CuMnCeOx-C催化剂中仅能观察到与CeO2相关的弱的衍射峰, 而未发现有明显的CuO和α-Mn2O3晶体衍射峰, 表明氧化铈抑制了氧化铜和氧化锰晶体的生长, 晶体粒径较小, 且高度分散于催化剂中而未被XRD检查出, 氧化铜和氧化锰可能以无定形态或铈基铜锰固溶体形式存在, 且CeO2晶体衍射峰发生向大角度偏移, 说明亦存在一定晶格缺陷, 均会造成大量氧空位的形成, 而在催化氧化反应中, 高氧空位的形成是影响催化剂催化活性的关键因素, 其可以作为氧的活性中心, 促进活性氧(晶格氧和表面氧)的传递, 且降低中间副产物的集聚和减少碳沉积. 此外, 高度分散的铜锰氧化物结构可以作为一种活性相, 具有很强的活化HCHO分子的能力, 从而充当催化氧化HCHO中心. 然而, 采用水热法所制CuMnCeOx-H催化剂中除CeO2晶体衍射峰外, 亦能观察到与CuO和MnO2相关的晶体衍射峰, 在2θ=35.5°和38.7°处的特征峰与CuO的(-111)和(111)晶面相匹配, 在2θ=37.3°处的特征峰与MnO2(PDF#81-2261)的(101)晶面相匹配, 表明水热法所制催化剂晶体粒径较大, 比表面积较小, 这与BET分析结果相一致.
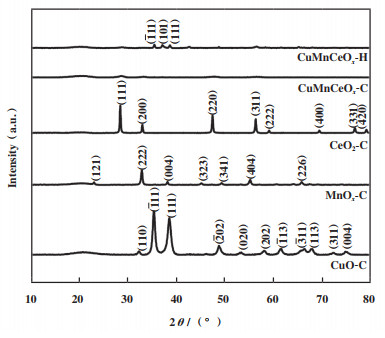
|
图 1 样品的XRD图 Fig.1 XRD patterns of samples |
为探究柠檬酸配合法和水热法所制CuMnCeOx催化剂表面结构形貌的区别, 探索材料结构对催化剂氧化性能的影响, 实验对其进行了SEM分析, 如图 2所示. 催化剂CuMnCeOx-C内部显示出大量花片状形貌, 其前段附有长条状结构, 错综复杂, 且表面富含不规则的块状氧化物结构, 可能为氧化铈, 样品表面凹凸不平, 存有丰富的微孔结构, 这有利于增加催化剂比表面积而利于对气态HCHO的吸附及氧化. 然而, CuMnCeOx-H整体显示出花球状, 其直径约为5.3 μm, 其表面富含大量棒状结构, 其长度约为0.4~0.7 μm, 内部为空心状, 展示出一端粗一端细针状特征, 其棒状结构表面略显光滑, 其花球状内部亦存有一些不规则团簇, 其比表面积明显低于采用柠檬酸配合法所制CuMnCeOx-C催化剂. 结果表明, 两种制备方法所制催化剂表面结构完全不同, 相较而言, CuMnCeOx-C催化剂展示出更佳优异的表面结构形态, 这与其催化氧化活性结果相一致.

|
图 2 SEM图 Fig.2 SEM images (a), (b) CuMnCeOx-C, (c), (d) CuMnCeOx-H (a), (b) CuMnCeOx-C, (c), (d) CuMnCeOx-H |
为了探究载体对CuMnCeOx-C催化剂的表面结构形貌的影响, 实验以堇青石、Al2O3、ZSM-5、坡缕石和高岭土5种常见材料为载体并对其表面结构进行了SEM分析, 如图 3所示. 与粉末态CuMnCeOx-C催化剂相比, CuMnCeOx-C/堇青石样品表面结构形态与粉末态相似, 内部以花片状前段附有长条状为主, 外部掺有不规则块状结构, 这可能与堇青石载体表面光滑密实有关, 其活性氧化物主要在其表面附着生长, 致使活性物种在其表面分布, 其结构形态未发生显著变化. 而其它负载型催化剂表面均发生不同程度的改变, 其中CuMnCeOx-C/Al2O3催化剂在其表面局部区域显示光滑、紧密堆积的片状结构, 而其它区域显示出较为疏松的结构. CuMnCeOx-C/ZSM-5催化剂(图 3(c)和(d))因高比表面积ZSM-5载体展示出丰富的球状颗粒物结构, 部分区域亦显示出棒状物和块状物, 这是由于未充分燃烧所致, 但催化剂内含丰富的孔道, 催化剂展示出最高的比表面积及孔体积. CuMnCeOx-C/坡缕石显示出大量光滑块状结构, 部分区域显示出颗粒物, 但分布较不均匀, 较为杂乱. 而CuMnCeOx-C/高岭土催化剂形成了许多具有较小粒径的块状结构, 其表面生长有类似球状的颗粒物, 为活性氧化物. 由此可见, 载体对同一组成及制备方法所制催化剂表面结构产生重大影响, 亦可产生不同的催化氧化性能.
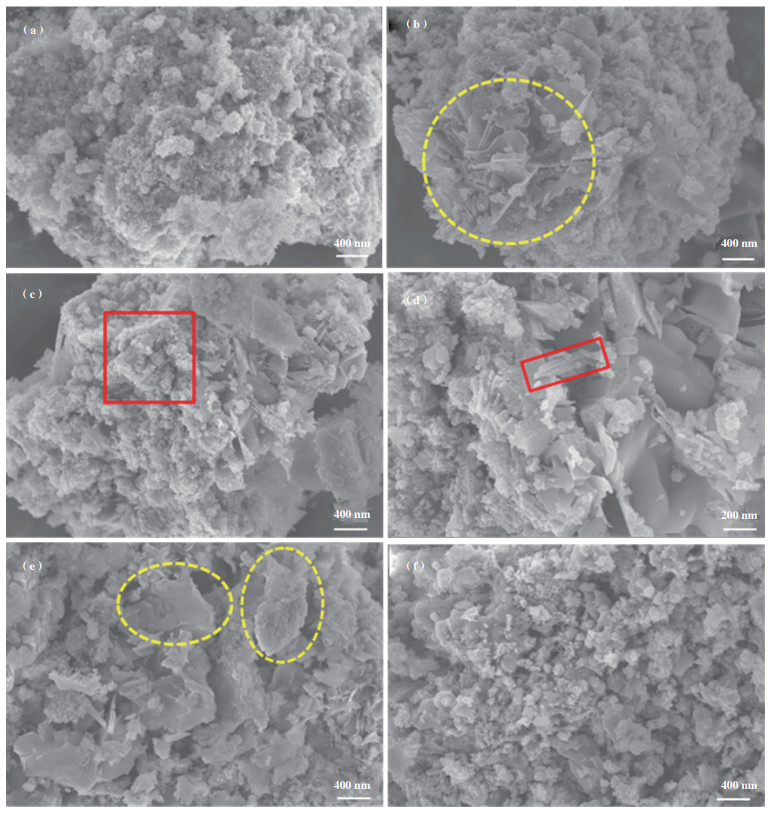
|
图 3 SEM图 Fig.3 SEM images (a) CuMnCeOx-C/堇青石; (b) CuMnCeOx-C/Al2O3; (c), (d) CuMnCeOx-C/ZSM-5; (e) CuMnCeOx-C/坡缕石; (f) CuMnCeOx-C/高岭土 (a) CuMnCeOx-C/Cordierite; (b) CuMnCeOx-C/Al2O3; (c), (d) CuMnCeOx-C/ZSM-5; (e) CuMnCeOx-C/Palygorskite; (f) CuMnCeOx-C/Kaolin |
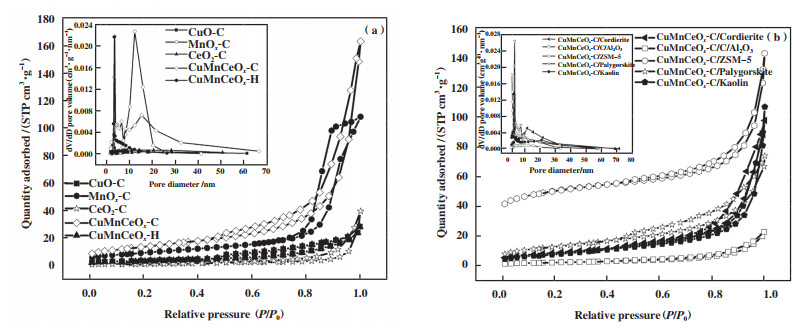
为考察制备方法及载体对催化剂比表面积及孔容孔径产生的影响, 实验对所制备样品进行了BET分析, 如表 1和图 4所示. 由表 1可知, 采用不同组成、制备方法以及载体所制催化剂的表面积、孔体积及平均孔径各不相同. 在单组分氧化物中, MnOx-C催化剂显示出最高的比表面积和孔体积, 达34.4 m2·g1, 均远高于CuO-C和CeO2-C催化剂, 其平均孔径有所降低. 而混合所制CuMnCeOx-C催化剂比表面积较MnOx-C有了进一步提升, 表明氧化铈的掺入有利于氧化锰和氧化铜的分布, 有利于其催化氧化性能的提升. 相较于柠檬酸配合法, 采用水热法所制CuMnCeOx-H催化剂其比表面积大幅降低, 仅为13.6 m2·g-1, 这与其表面形态结构相一致, 致使其氧化性能明显低于CuMnCeOx-C催化剂. 而对于负载型催化剂而言, CuMnCeOx-C/ZSM-5展示了最佳的比表面积, 高达160 m2·g-1, 均远高于粉末态催化剂, 但其氧化性能并未达到最佳, 表明样品比表面积不是决定催化剂活性高低的唯一因素, 而是必要条件之一, 其结构形态决定着其氧化性能, 其中CuMnCeOx-C/堇青石比表面积虽较小, 低于粉末态CuMnCeOx-C样品, 但是其氧化性能相近, 均展示最佳的HCHO氧化转化率, 两种催化剂表面结构相近, 无显著差异. 相对于其它载体, 催化剂比表面积、孔体积、孔径和表面结构形态均发生不同程度的改变.
| 表 1 催化剂的比表面积、孔体积及平均孔径 Table 1 Specific surface area, pore volume and average pore diameter of catalysts |
|
图 4 样品的吸附等温线及孔径分布 Fig.4 Adsorption isotherms and pore size distribution of samples |
图 4为粉末型(a)和负载型(b)催化剂的N2吸附等温线和孔径分布图. 由图可知, 所述样品均呈现IV型吸附-解吸等温线, 表明存在由纳米粒子随机聚集形成的介孔结构. 与其它催化剂相比, MnOx-C和CuMnCeOx-C催化剂在高压区吸附量迅速增加, 表明孔径分布较宽且较大, 以大孔为主, 这有利于反应物的吸附和催化氧化过程中反应产物的去除. MnOx-C催化剂在相对压力为0.8~1.0 MPa范围内显示出明显的H2型滞后环, 表明纳米片中存在墨水瓶型介孔, 而其他催化剂具有H3型环, 在聚集的纳米片之间形成狭缝状介孔. CuMnCeOx-C样品具有较大的比表面积和孔体积, 以及较小的平均孔径, 这可能是由于复合氧化物催化剂中锰和铈的协同作用, 有助于提高复合氧化物对甲醛的吸附和降解, 并促进反应活性中心对HCHO分子的可接近性, 从而获得更好的催化性能. 对于负载型催化剂而言, CuMnCeOx-C/Al2O3催化剂一直保持相对很低的吸附量, 而CuMnCeOx-C/ZSM-5催化剂一直保持相对高的吸附量, 这与表 1中CuMnCeOx-C/Al2O3和CuMnCeOx-C/ZSM-5具有最小和最大的比表面积及孔体积是相一致的. 但CuMnCeOx-C/ZSM-5催化剂的催化活性较差, 这可能与它的平均孔径较小有关, 易造成孔隙堵塞, 促使催化剂活性降低.
2.1.4 H2-TPR分析为分析样品的氧化活性性能, 实验对所制备的催化剂进行了H2-TPR分析, 如图 5所示. 样品CuO-C在150~200 ℃区间呈现两个重叠的H2还原峰, 其可能为表面活性氧和CuO被还原成Cu2O. MnOx-C催化剂在279和382 ℃处显示两个强的H2还原峰, 其分别归属为Mn2O3被还原为Mn3O4和Mn3O4被还原为MnO, 与报道结果相一致[33], 即块状Mn2O3的还原是通过一个独特的两步过程进行, 而未观察到CeO2-C的还原峰, 这与研究结果相一致[34], 表明CeO2难以被还原. 单金属氧化物中CuO-C展现出最低的氧化还原峰, 3种金属复合后的CuMnCeOx-C和CuMnCeOx-H样品的H2还原峰相较于MnOx-C、CeO2-C均向低温发生不同程度的偏移, 表明Cu、Mn离子与CeO2晶格的结合不仅提高了氧的储存能力、加速了表面氧的流动性, 而且通过Mn与Ce物种间的相互作用提高了低温下的氧化还原活性, 这有利于常温催化氧化HCHO. 相较于CuMnCeOx-H, CuMnCeOx-C样品展示出更低的H2还原温度, 表明柠檬酸配合法有利于催化剂氧化性能的发挥, 这与实验结果相一致.
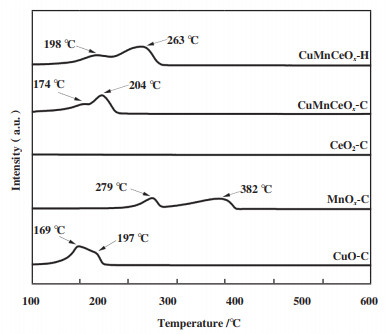
|
图 5 样品的H2-TPR图 Fig.5 H2-TPR measurements of samples |
为了确定样品中Cu、Mn、Ce和O元素的组成和化学结合状态, 实验对CuMnCeOx-C和CuMnCeOx-H催化剂进行了XPS分析, 如图 6所示. 由图可知, 结合能值为933.9和953.8 eV特征峰分别归属于Cu 2p3/2和Cu 2p1/2, 证实了样品中Cu处于+2价氧化态, 以CuO形式存在, 且两种催化剂相同, 未显示出显著性差异. 在Mn 2p光谱中, 结合能为642.1和653.6 eV处的特征峰分别归因于MnO2的Mn 2p3/2和Mn 2p1/2自旋轨道峰, 并将Mn 2p3/2峰反褶积为两个特征峰, 结合能值为642.7~643.0和641.2~641.3 eV处分别归属为Mn4+和Mn3+, 且CuMnCeOx-C和CuMnCeOx-H样品中Mn3+/(Mn3++Mn4+)比例分别为64.4%和61.2%, 表明CuMnCeOx-C具有更多的氧空位, 更有利于催化氧化反应的进行. 结合能值为889.0、898.9、884.8、901.0、908.0和916.8 eV可归属于Ce4+, 而结合能值为882.5、898.0和904.0 eV可归属于Ce3+, 结果显示CuMnCeOx-C和CuMnCeOx-H样品中Ce3+/(Ce3++Ce4+)比例分别为25.9%和27.7%, 较多的Ce3+可以形成更多的氧空位, 为保持催化剂表面的电中性平衡, 进而增加亲电表面氧原子数量, 从而进一步提升催化氧化HCHO性能. 由O 1s光谱可知, 结合能值在529.0~530.0 eV可归因于晶格氧Oα, 530.0~532.0 eV处归因于表面氧Oβ, 与CuMnCeOx-H样品相比, CuMnCeOx-C催化剂上表面氧Oβ比例显著提升, CuMnCeOx-C和CuMnCeOx-H样品中Oβ/(Oα+Oβ)比例分别为47.2%和38.5%, 表明CuMnCeOx-C样品中含有大量表面吸附氧物种, 如O2-、O-和·OH等, 这在催化氧化HCHO过程中起着重要作用.
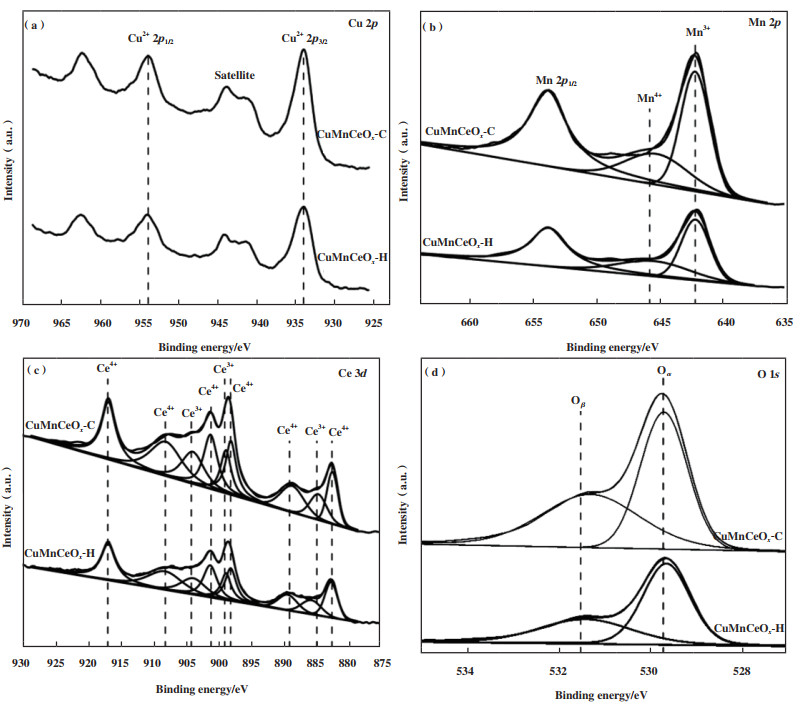
|
图 6 样品的XPS图 Fig.6 XPS spectra of samples |
为分析催化反应前后催化剂表面化学键或官能团变化情况, 实验对CuMnCeOx-C和CuMnCeOx-H样品催化反应前后进行了红外光谱测试, 如图 7所示. 波数为3 435 cm-1处特征峰归属为H2O的对称伸缩振动vs(-OH)峰[35], 波数为1 627和1 385 cm-1处特征峰归属于水分子的-OH基团弯曲振动峰[36], 波数为1 047和889 cm-1处特征峰归属于DOM(二氧亚甲基)中δ(CH2)基团伸缩振动峰[37], 波数在800~1 200 cm-1间的宽峰归属于甲酸盐(HCOO-)的伸缩振动峰. 研究发现, CuMnCeOx-H催化剂催化反应后其表面吸附有大量水蒸气和反应中间体, 导致其活性位点减少, 稳定性降低, 而CuMnCeOx-C仅较反应前增加了中间产物甲酸盐, 显示出良好的抗水蒸气性能, 有利于常温催化氧化反应.
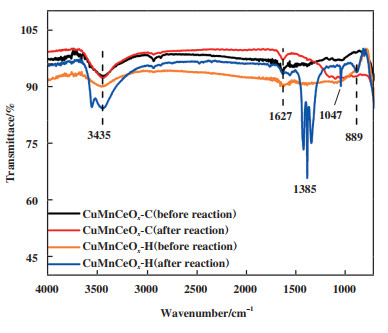
|
图 7 样品IR光谱图 Fig.7 IR spectra of samples |
表 2总结了其它文献报道的催化剂催化氧化HCHO性能研究. 研究发现, 贵金属催化剂展现出较优异的氧化性能, 但成本高昂, 过渡态金属催化剂需在一定温度条件下(100 ℃左右)方可实现对甲醛较高的去除效率. 因此, 实验对所制过渡金属氧化物催化剂常温催化氧化HCHO性能进行了研究, 如图 8(a)所示. 研究发现, 空白对照实验显示反应器内48 h HCHO浓度变化极小, 未见显著性下降, 表明该玻璃反应器密闭性良好, 完全符合测试要求. 由图可知, 对于单组分活性氧化物, MnOx-C催化剂的氧化性能远高于CuO-C和CeO2-C, 表明MnOx是催化剂发挥常温催化氧化性能的主要组分, 而CuO和CeO2仅起到助催化作用, 其中CeO2-C最差, 仅展示出一定的物理吸附HCHO性能. 虽CuO-C显示出较MnOx-C更低的H2-TPR还原峰温度, 但其氧化HCHO能力远低于MnOx-C, 表明氧化物中所含晶格氧的氧化能力高低不是催化剂氧化性能的主要因素, 可能是由于MnOx-C催化剂在反应过程中形成了大量表面吸附活性氧物种, 如O2-、O-和·OH等. 相较于单组分氧化剂, 混/复合氧化物催化剂CuMnCeOx显示出较单组分样品良好的吸附及催化氧化性能, 其中CuMnCeOx-C表现更佳, 0~48 h(12 h/次)反应器内HCHO浓度分别为1.018、0.251、0.051、0.027和0.014 mg·m-3, 48 h转化率达98.6%, 达到《民用建筑工程室内环境污染控制规范》(GB50325-2001)所规定的室内甲醛限值(0.08 mg·m-3), 更高的比表面积和孔体积及孔径、高度分散的活性组分、低的H2还原峰温度以及催化剂表面更丰富的吸附氧活性物种是催化剂性能提升的关键, 而CuMnCeOx-H催化剂48 h HCHO去除率为82%. 结果表明, 同一组分经不同制备方法所制的催化剂, 因结构形态不尽相同致使其氧化性能迥异, 良好的结构形态亦是催化剂性能发挥的影响因素之一, 表明柠檬酸配合法优于水热法, 且更加简便安全、能耗低.
| 表 2 催化剂性能对比表 Table 2 Performance comparison of catalysts |
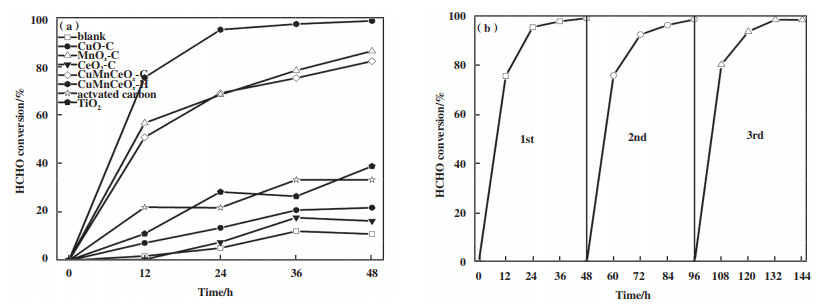
|
图 8 CuMnCeOx-C催化剂催化氧化HCHO活性图(a)及稳定性图(b) Fig.8 (a) Performance of catalytic oxidation of HCHO and (b)stability over CuMnCeOx-C |
图 8(b)为性能最佳的CuMnCeOx-C催化剂常温催化氧化HCHO稳定性研究. 研究发现, 催化剂在常温条件下显示出良好的稳定性, 经3次连续性测试, 未见吸附大量水蒸气而造成催化剂性能快速下降情形, 仅表现为轻微的降低, 其48 h HCHO去除率分别为98.6%、98.1%和97.9%, 可完全满足实际应用的需求, 良好的催化稳定性对于催化剂实际应用具有重要意义.
为探究催化剂载体对CuMnCeOx-C负载型催化剂氧化活性的影响, 实验亦对其进行了常温催化氧化HCHO研究, 如图 9(a)所示. 研究发现, 样品CuMnCeOx-C/堇青石最佳, 且远高于具有更大比表面积的CuMnCeOx-C/ZSM-5催化剂(64.3%), 其48 h HCHO去除率高达98.3%(0.018 mg·m-3), 与CuMnCeOx-C粉末型催化剂催化活性相差不大, 这是由于堇青石载体的密实度较高, 活性氧化物以分布在堇青石载体表面为主, 且活性组分结构形态与粉末型CuMnCeOx-C催化剂完全一致, 其比表面积略有降低, 而其它载体上的活性组分结构形态因载体表面的不同而造成不同程度的改变, 尤其CuMnCeOx-C/ZSM-5催化剂, 其比表面积高达160.0 m2·g-1, 较CuMnCeOx-C/堇青石提升了约5倍, 但氧化性能不及CuMnCeOx-C/堇青石(67.6%), 这与上述粉末型催化剂结构相一致, 结构是同一组分催化剂氧化性能高低的关键.
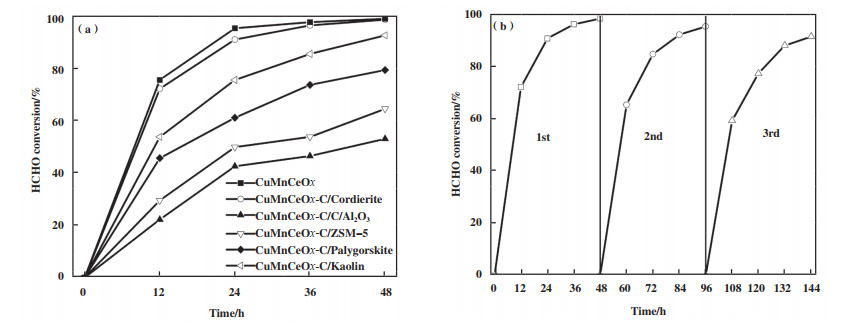
|
图 9 CuMnCeOx-C/堇青石催化剂催化氧化HCHO活性图(a)及稳定性图(b) Fig.9 (a) Performance of catalytic oxidation of HCHO and (b) stability over CuMnCeOx-C/Cordierite catalysts |
图 9(b)为性能最佳的CuMnCeOx-C/堇青石催化剂常温催化氧化HCHO稳定性研究. 其48 h HCHO去除率分别为98.3%、95.3%和91.4%, 仅表现为轻微的降低, 与CuMnCeOx-C催化剂相比, 稳定性略微下降, 这可能与堇青石本身有一定的吸水性有关.
2.3 催化氧化机理分析综合上述实验结果及分析, CuMnCeOx催化剂催化降解HCHO可能机理如图 10所示. 在Ce4+/Ce3+离子偶的Redox循环作用下促进了Cu+和Mn3+分别被氧化为CuO和MnO2, Cu+/Cu2+和Mn3+/Mn4+间的氧化循环均可形成大量氧空位, 而氧空位是催化剂催化氧化反应的中心, 进而形成大量活性氧参与催化氧化HCHO反应. 据前期原位红外光谱分析可知, 催化氧化反应历程为: 首先, 气态HCHO被吸附于CuMnCeOx催化剂表面被氧化为二氧亚甲基(DOM), 随后DOM被表面氧快速氧化为甲酸盐, 甲酸盐被进一步氧化为不稳定的碳酸, 碳酸最终分解为CO2和H2O, 并从催化剂表面释放出来.
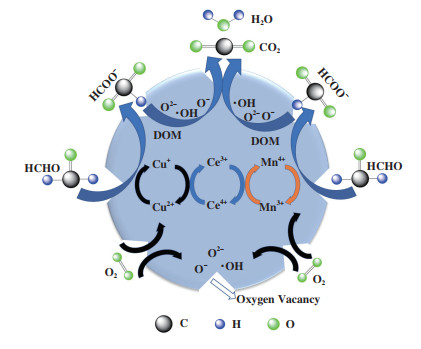
|
图 10 催化剂催化氧化的反应机理图 Fig.10 Mechanism diagram of catalytic oxidation reaction |
通过柠檬酸配合法和水热法制备了一系列CuMnCeOx催化剂用于常温催化氧化气态HCHO, 研究考察制备方法、载体对CuMnCeOx催化剂氧化性能的影响. 研究发现, 混/复合氧化物较单组分氧化物催化剂具有更佳的氧化性能, 且制备方法和载体类型对CuMnCeOx催化剂表面结构形貌及氧化性能和抗水蒸气能力产生显著影响, 进而深刻影响其氧化性能及稳定性, 其中粉末型CuMnCeOx-C和CuMnCeOx-C/堇青石催化剂表现更佳, 其48 h气态HCHO去除率均高达98.0%以上, 其氧化性能高低与比表面积不成正比. 采用柠檬酸配合法所制CuMnCeOx-C催化剂所具有的中等介孔结构, 晶体粒径小, 低的H2还原峰以及所形成的铈基铜锰固溶体有利于形成大量氧空位, 其作为催化氧化的氧活性中心可形成丰富的表面活性氧参与氧化还原反应, 同时催化剂展示出优异的催化氧化性能, 稳定性良好, 其在常温催化氧化反应中具有潜在的应用前景.
| [1] |
a. Cheng Meng(陈猛), Li Yi-zhuo(李一倬), Fan Ze-yun(范泽云), et al. Co Mn composite metal oxides for simul-taneous removal of indoor formaldehyde and low concentration ozone(钴锰复合金属氧化物同时去除室内甲醛和低浓度臭氧)[J]. J Mol Catal (China) (分子催化), 2015, 29(6): 545-552. b. Liu Yu-feng(刘玉凤), Zhou Ying(周瑛), Lu Mei(卢梅), et al. Preparation of noble metal single-atom catalyst and its applications in catalytic oxidation reaction of CO and VOCs(贵金属单原子催化剂的制备及其在CO、VOCs完全氧化反应中的应用)[J]. J Mol Catal (China)(分子催化), 2022, 36(1): 81-97. c. Zhang Ying(张迎), Zhu Wen-jie(朱文杰), Fu Te(富特), et al. Research progress of Ce-based catalysts incatalytic combustion control of volatile organic comp-ounds(铈基催化剂在挥发性有机物催化燃烧治理中的研究进展)[J]. J Mol Catal (China)(分子催化), 2022, 36(1): 58-70. |
| [2] |
a. Zhan Ke-xin(张可欣), Tang Tong(唐彤), Li Feng-ji(李粉吉), et al. Effect of precipitator and Ag content change on formaldehyde degradation(沉淀剂和Ag含量变化对甲醛降解性能的影响)[J]. J Mol Catal (China) (分子催化), 2019, 33(4): 356-362. b. Zhang Fei(张飞), Zhu Xin-bo(竺新波), Liu Jin(刘进), et al. Effect of preparation method on the catalytic performance of CuCo2O4 spinel oxides for diesel soot oxidation(制备方法对铜钴尖晶石氧化物催化碳烟燃烧性能的影响)[J]. J Mol Catal (China)(分子催化), 2021, 35(6): 549-560. |
| [3] |
Zhu Jie(朱杰), Sun Yue-yin(孙月吟), Gu Ming-yang(顾名扬), et al. Preparation of TiO2 supported MnFeOx catalystand its catalytic performance for formaldehyde oxidation at room temperature(TiO2负载MnFeOx催化剂的制备及常温催化氧化甲醛性能研究)[J]. J Funct Mater (功能材料), 2022, 53(4): 4011-4019.
|
| [4] |
Yusuf A, Snape C, He J, et al. Advances on transition metaloxides catalysts for formaldehyde oxidation: A review[J]. Catal Rev, 2017, 59(3): 189–233.
DOI:10.1080/01614940.2017.1342476 |
| [5] |
Wang Yi-jie(王艺洁), Ding Hong(丁红), Yang Jia-ping(杨家萍), et al. Adsorption of gaseous formaldehyde by attapulgite in Jingyuan, Gansu Province(甘肃靖远凹凸棒对气相甲醛的吸附研究)[J]. Chem Eng Des Commun(化工设计通讯), 2018, 44(10): 139-140.
|
| [6] |
Bellat J P, Bezverkhyy I, Weber G, et al. Capture of formal-dehyde by adsorption on nanoporous materials[J]. J Hazard Mater, 2015, 300: 711–717.
DOI:10.1016/j.jhazmat.2015.07.078 |
| [7] |
Liu H, Wang M, Ma J, et al. Modulation of HCHO, H2O and H adsorption on AgPd cocatalyst by optimizing of selective exposed facet to enhancing the efficiency of conversion toxic formaldehyde into hydrogen driven by visible light[J]. J Catal, 2019, 375: 493–506.
DOI:10.1016/j.jcat.2019.06.003 |
| [8] |
Fan X, Zhu T, Sun Y, et al. The roles of various plasma species in the plasma and plasma-catalytic removal of low-concentration formaldehyde in air[J]. J Hazard Mater, 2011, 196: 380–385.
DOI:10.1016/j.jhazmat.2011.09.044 |
| [9] |
Hou L, Li X, Xie D, et al. Effects of BTEX on the Removal of Acetone in a Coaxial Non-Thermal Plasma Reactor: Role Analysis of the Methyl Group[J]. Molecules, 2018, 23(4): 890–904.
DOI:10.3390/molecules23040890 |
| [10] |
Du X, Li C, Zhang J, et al. Highly efficient simultaneous removal of HCHO and elemental mercury over Mn-Co oxides promoted Zr-AC samples[J]. J Hazard Mater, 2021, 408: 124830–124848.
DOI:10.1016/j.jhazmat.2020.124830 |
| [11] |
Liu F, Zhang S, Zhang X, et al. Synergy of surface sodium and hydroxyl on NaTi2HO5 nanotubes accelerating the Pt-dominated ambient HCHO oxidation[J]. J Hazard Mater, 2022, 421: 126769–12688.
DOI:10.1016/j.jhazmat.2021.126769 |
| [12] |
Ma C, Sun S, Lu H, et al. Remarkable MnO2 structure-dependent H2O promoting effect in HCHO oxidation atroom temperature[J]. J Hazard Mater, 2021, 414: 125542–125552.
DOI:10.1016/j.jhazmat.2021.125542 |
| [13] |
Lei Chun-sheng(雷春生), Zhu Xiao-feng(朱晓峰). Prepar-ation of aminated attapulgite clay and its adsorption properties for formaldehyde(胺化凹凸棒黏土的制备及甲醛吸附性能研究)[J]. Envion Eng (环境工程), 2016, 34(6): 95-100.
|
| [14] |
Li Yong-feng(李永峰), Fan Yun(范云), Kuang Huan-ming(邝焕明). Catalytic purification of formaldehyde by platinum based catalysts at room temperature(铂基催化剂对甲醛的室温催化净化性能)[J]. Chin Powder Sci Technol (中国粉体技术), 2016, 22(6): 39-53.
|
| [15] |
Jiang N, Li X, Kong X, et al. The post plasma-catalytic decomposition of toluene over K-modified OMS-2 catalysts at ambient temperature: Effect of K(+) loading amount and reaction mechanism[J]. J Coll Interf Sci, 2021, 598: 519–529.
DOI:10.1016/j.jcis.2021.04.028 |
| [16] |
Zhang Yi(张溢), Shi Jin(石琎), Zhang Zhi-xiang(张志翔), et al. Simultaneous removal of formaldehyde and ozone by manganese oxide octahedral molecular sieves at room temperature(锰氧八面体分子筛室温同时去除甲醛和臭氧的性能研究)[J]. J Mol Catal (China) (分子催化), 2019, 33(3): 201-208.
|
| [17] |
Zhan Zhen-zhen(张珍珍), Li Xing-heng(李鑫恒). Rese-arch progress of formaldehyde removal based on catalytic oxidation technology(基于催化氧化技术去除甲醛的研究进展)[J]. J Mol Catal (China) (分子催化), 2019, 33(4): 381-389.
|
| [18] |
Li Y, Zhang C, He H, et al. Significant enhancement in activity of Pd/TiO2 catalyst for formaldehyde oxidation by Na addition[J]. Catal Today, 2016, 281: 412–417.
|
| [19] |
Chen X, Wang H, Chen M, et al. Co-function mechanism of multiple active sites over Ag/TiO2 for formaldehyde oxidation[J]. Appl Catal B-Environ, 2021, 282: 119543–119551.
DOI:10.1016/j.apcatb.2020.119543 |
| [20] |
Chen D, Shi J, Shen H, et al. High-dispersed catalysts of core-shell structured Au@SiO2 for formaldehyde catalytic oxidation[J]. Chem Eng J, 2019, 385: 123887–123900.
|
| [21] |
Ding J, Rui Z, Lyu P, et al. Enhanced formaldehyde oxidation performance over Pt/ZSM-5 through a facile nickel cation modification[J]. Appl Surf Sci, 2018, 457: 670–675.
DOI:10.1016/j.apsusc.2018.06.302 |
| [22] |
Yan Z, Xu Z, Cheng B, et al. Co3O4 nanorod-supported Pt with enhanced performance for catalytic HCHO oxidation at room temperature[J]. Appl Surf Sci, 2017, 404: 426–434.
DOI:10.1016/j.apsusc.2017.02.010 |
| [23] |
He M, Cao Y, Ji J, et al. Superior catalytic performance of Pd-loaded oxygen-vacancy-rich TiO2 for formaldehyde oxidation at room temperature[J]. J Catal, 2021, 396: 122–135.
DOI:10.1016/j.jcat.2021.01.035 |
| [24] |
Peng S, Yang X, Strong J, et al. MnO2-decorated N-doped carbon nanotube with boosted activity for low-temperature oxidation of formaldehyde[J]. J Hazard Mater, 2020, 396: 122750–122759.
DOI:10.1016/j.jhazmat.2020.122750 |
| [25] |
Chen J, Chen W, Huang M, et al. Metal organic frameworks derived manganese dioxide catalyst with abundant chemisorbed oxygen and defects for the efficient removal of gaseous formaldehyde at room temperature[J]. Appl Surf Sci, 2021, 565: 150445–150454.
DOI:10.1016/j.apsusc.2021.150445 |
| [26] |
Huang Y, Liu Y, Wang W, et al. Oxygen vacancy-engin-eered δ-MnOx/activated carbon for room-temperature catalytic oxidation of formaldehyde[J]. Appl Catal B-Environ, 2020, 278: 119294–119302.
DOI:10.1016/j.apcatb.2020.119294 |
| [27] |
Lu S, Li K, Huang F, et al. Efficient MnOx-Co3O4-CeO2 catalysts for formaldehyde elimination[J]. Appl Surf Sci, 2017, 400: 277–282.
DOI:10.1016/j.apsusc.2016.12.207 |
| [28] |
Wang C, Liu H, Chen T, et al. Synthesis of palygorskite-supported Mn1-xCexO2 clusters and their performance in catalytic oxidation of formaldehyde[J]. Appl Clay Sci, 2018, 159: 50–59.
DOI:10.1016/j.clay.2017.08.023 |
| [29] |
Dey S, Mehta N S. Selection of Manganese oxide catal-ysts for catalytic oxidation of Carbon monoxide at ambient conditions[J]. Resour, Environ-Sustain, 2020, 1: 100003–100017.
|
| [30] |
Dey S, Mehta N S. Synthesis of CuMnOx catalysts by using various precipitants for oxidation of carbon monoxide[J]. Resour, Environ-Sustain, 2021, 4: 100025–100035.
|
| [31] |
Jiang X, Li X, Wang J, et al. Three-dimensional Mn-Cu-Ce ternary mixed oxide networks prepared by polymer-assisted deposition for HCHO catalytic oxidation[J]. Catal Sci Technol, 2018, 8(10): 2740–2749.
DOI:10.1039/C8CY00212F |
| [32] |
Wang S, Wang Y, Wang F, et al. Room temperature HCHO oxidation over the Pt/CeO2 catalysts with different oxygen mobilities by changing ceria shapes[J]. Appl Catal A-Gen, 2022, 630: 118469–118477.
DOI:10.1016/j.apcata.2021.118469 |
| [33] |
Huang Q, Lu Y, Si H, et al. Study of complete oxidation of formaldehyde over MnOx-CeO2 mixed oxide catalysts at ambient temperature[J]. Catal Lett, 2018, 148(9): 2880–2890.
DOI:10.1007/s10562-018-2479-0 |
| [34] |
Ma L, Wang D, Li J, et al. Ag/CeO2 nanospheres: Efficientcatalysts for formaldehyde oxidation[J]. Appl Catal B-Environ, 2014, 148/149: 36–43.
DOI:10.1016/j.apcatb.2013.10.039 |
| [35] |
Chen B B, Shi C, Crocker M, et al. Catalytic removal of formaldehyde at room temperature over supported gold catalysts[J]. Appl Catal B-Environ, 2013, 132/133: 245–255.
DOI:10.1016/j.apcatb.2012.11.028 |
| [36] |
Zhu D, Huang Y, Cao J J, et al. Cobalt nanoparticles encapsulated in porous nitrogen-doped carbon: Oxygen activation and efficient catalytic removal of formaldehyde at room temperature[J]. Appl Catal B-Environ, 2019, 258: 117981–117988.
DOI:10.1016/j.apcatb.2019.117981 |
| [37] |
Kwon D W, Seo P W, Kim G J, et al. Characteristics of the HCHO oxidation reaction over Pt/TiO2 catalysts at room temperature: The effect of relative humidity on catalytic activity[J]. Appl Catal B-Environ, 2015, 163: 436–443.
DOI:10.1016/j.apcatb.2014.08.024 |
 2022, Vol. 36
2022, Vol. 36


