2. 吉林医药学院 药学院, 吉林 吉林 132013
2. Department of Pharmacy, Jilin Medical University, Jilin 132013, China
Michael反应是有机合成领域中的重要反应, 是指亲电的共轭体系(Michael受体)与亲核的负碳离子(Michael给体)进行的共轭加成, 是活性亚甲基化物烷基化的一种重要方法, 也是最常用于构筑C-C键的方法之一[1-2]. 不对称Michael/环化串联反应是指包含Michael加成和环化反应的串联反应, 常用于构建具有多个手性中心的复杂环状结构, 如广泛存在的双环、含氧杂环、螺环和多环结构等[3-6], 也是合成许多天然产物和药物骨架结构的关键反应[7-8]. 因此, 成为不对称反应的研究热点.
近些年, 有机催化的不对称Michael/环化串联反应备受关注, 各种有机催化剂如手性膦类[9-13]、金鸡纳碱类[14-22]、(硫)脲类[23-27]等有机催化剂以及一些金属[28-34]催化剂被应用于不对称Michael/环化串联反应, 并取得了重大进展. 我们根据不同的催化剂类型进行分类, 综述了近5年来有机催化不对称Michael/环化串联反应的研究进展.
1 手性膦类催化剂2018年, Hodík小组[35]开发了一种新的方法制备具有烷基、烯基、炔基、芳基或杂芳基的螺环二氢喹诺酮类手性化合物, 该小组利用有机膦催化剂Cat 1催化炔丙基醇和环状β-氧代酯的不对称多米诺Michael加成/内酰胺化串联反应(图 1). 研究发现, 该反应体系具有良好的普适性, 以38%~81%的产率, 优异的非对映选择性(> 20∶1 dr)和对映选择性(高达99∶1 er)得到目标产物. 这种一步多米诺迈克尔加成-内酰胺化过程反应条件温和、原料价廉易得, 一步反应产生具有两个相邻手性中心的螺环产品, 其中一个是手性季碳中心. 且机理研究表明, 手性磷酸和手性二磷酸镁均能作为催化活性物质, 但是原位生成的手性磷酸镁盐能产生更快速的反应和更高的收率.
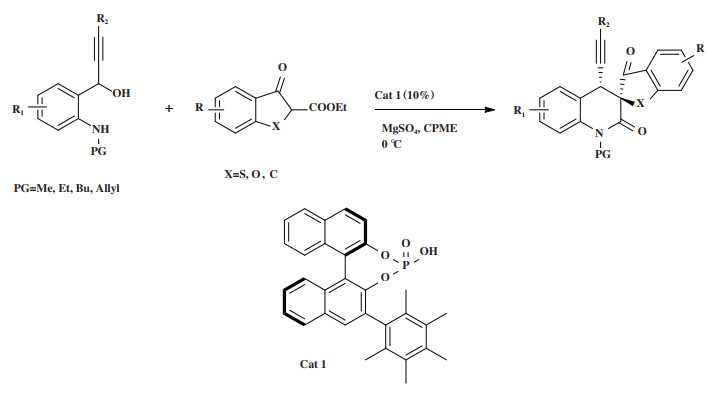
|
图 1 催化剂Cat 1催化多米诺Michael加成/内酰胺化串联反应 Fig.1 Cat 1 Catalyzes domino Michael addition/lactamization tandem reaction |
2019年, Xiao实验组[36]报道了有机膦催化剂Cat 2催化3-烯烃(7-氮杂)羟基吲哚与3-苯并呋喃基乙烯基酮的不对称Rauhut-Currier/Michael加成串联反应(图 2). 研究发现, 该反应条件温和(在0.4 nm分子筛的存在下, 5%(摩尔分数)的Cat 2在甲苯溶剂中于5 ℃条件下反应12 h), 以57%~93%的产率, 最高达 > 19∶1 dr和优秀的对映选择性(96%~ > 99% ees)得到产物, 当反应规模扩大 > 1000倍, 仍能够保持产品的ee值. 实现了对苯并呋喃底物以[4+2]环加成的形式直接进行不对称脱芳反应, 所得手性产物可以进一步转化为其他的α-羟甲基化或多环骨架衍生物, 值得一提的是转换过程中, 产物的立体选择性没有发生变化.
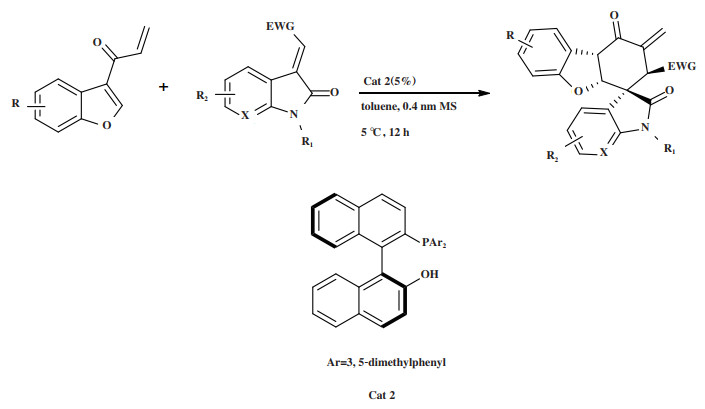
|
图 2 催化剂Cat 2催化Rauhut-Currier/Michael加成串联反应 Fig.2 Cat 2 Catalyzes the Rauhut-Currier/Michael addition tandem reaction |
2019年, Xia小组[37]发展了一种手性磷酸催化剂Cat 3参与的不对称Michael/Retro-Mannich/Mannich串联反应(图 3), 在10%(摩尔分数)催化剂作用下, 合成一系列的3-(吲哚-3-基)-吡咯烷类化合物, 该串联反应条件温和, 能以65%~91%的收率, 最高达 > 19∶1 dr和54%~92%的对映选择性获得产物. 实验组通过DFT计算, 提出了一种可能的催化循环机理(图 4), 该反应被证实为3步反应: 首先, 在Cat 3的存在下, 吲哚环的C3位与α, β-不饱和酮(INT0至INT1)完成Michael加成反应, 该步反应是可逆的. 随后, INT1发生Retro-Mannich反应(INT1至INT2), 建立第一个立体中心. 由于该步具有最高的能垒, 因此, 该步限制了整个反应的速率. 最后, INT2发生Mannich反应生成INT3, 该步反应具有优异的非对映选择性. 其中反式-3-(吲哚-3-基)吡咯的形成主要是因为在相应的闭环过渡态中存在最小的空间斥力. 同时, 实验组还研究了两种可能的副反应途径, 即吲哚环的C2位对INT0的α, β-不饱和酮部分或INT2的亚胺部分的亲核攻击, 因此在原料吲哚的苯环上引入6-OMe基团可增强C2位的亲核性, 从而主产物将由Ⅰ变为Ⅱ, 该副反应路径具有能量竞争性.
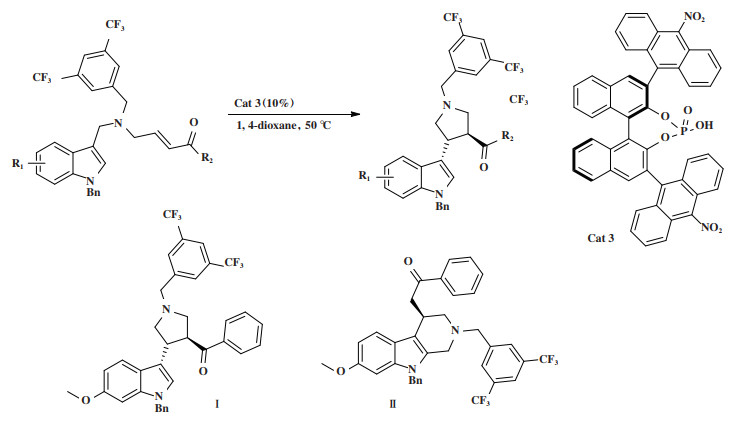
|
图 3 催化剂Cat 3催化Michael/Retro-Mannich/Mannich串联反应 Fig.3 Cat 3 Catalyzes Michael/Retro-Mannich/Mannich tandem reaction |
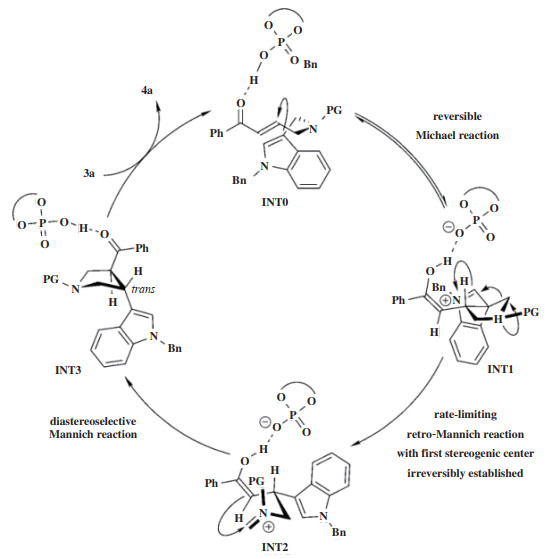
|
图 4 催化剂Cat 3催化Michael/Retro-Mannich/Mannich串联反应机理 Fig.4 Mechanism of Michael/Retro-Mannich/Mannich tandem reaction catalyzed by Cat 3 |
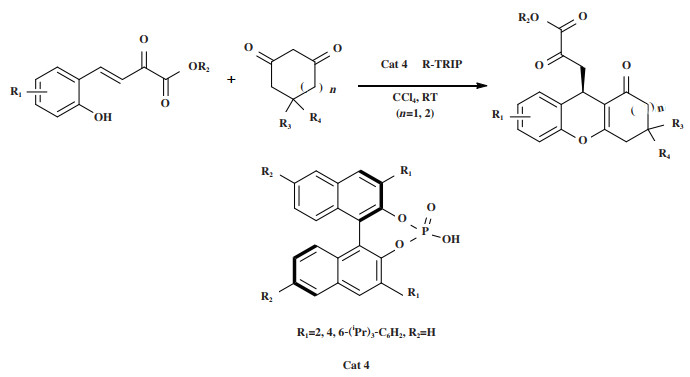
2020年, Gao小组[38]报道了使用手性膦类催化剂Cat 4催化环状1, 3二羰基化合物与β, γ-不饱和α-酮酯的不对称Michael加成/环化串联反应(图 5). 该研究以25%~99%的产率和对映选择性(55%~94%)得到了目标产物, 也为构建光学纯9-烷基四氢蒽酮提供了一种简便的合成方法.
|
图 5 催化剂Cat 4催化Michael加成/环化串联反应 Fig.5 Cat 4 Catalyzes Michael addition/cyclization tandem reaction |
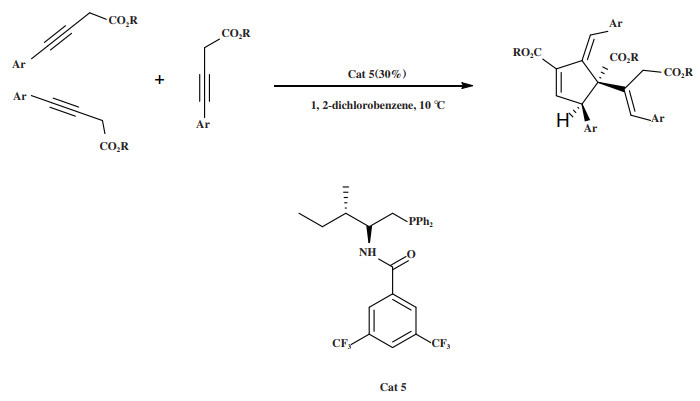
2021年, Gao小组[39]利用L-异亮氨酸衍生的酰胺膦催化剂Cat 5催化γ-芳基-3-丁酸的三聚化反应, 该反应经历了异构化为烯丙酸酯、[3+2]环化和Michael加成等一系列反应(图 6). 通过“一锅法”立体选择性地合成了含季碳中心的环戊烯类化合物, 18种γ-芳基-3-丁酸底物均适用于该反应, 以25%~85%的产率, 优秀的对映选择性(95%~ > 99% ees)得到手性环戊烯衍生物. 但催化剂用量过大(30%(摩尔分数)), 研究发现当催化剂用量分别降低至20%和10%(摩尔分数)时, 产品的ee保持不变(97% ee), 但产率明显降低, 分别下降了15%和39%, 即使延长反应时间, 产率也没有提高.
|
图 6 催化剂Cat 5催化异构化/ [3 + 2]环化/Michael加成串联反应 Fig.6 Cat 5 Catalyzes isomerization / [3 + 2] cyclization/Michael addition tandem reaction |
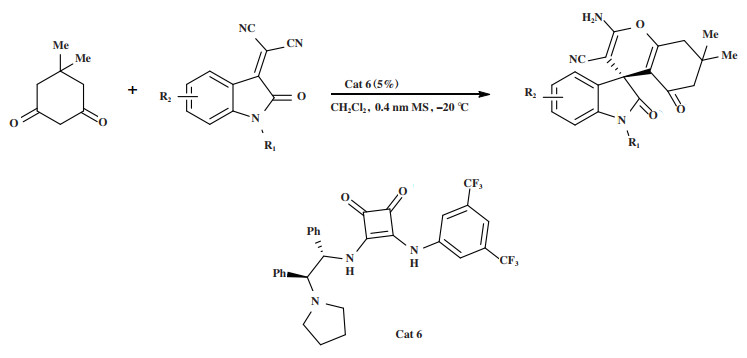
2018年, Hu小组[40]报道了1, 3-环己二酮和3-烯-2-羟吲哚之间的高对映选择性Michael/环化串联反应(图 7). 在5%(摩尔分数)的双功能有机催化剂Cat 6的作用下, 以优秀的产率(97%~99%)和最高达 > 99%的对映选择性得到手性螺(2-氨基-4H-吡喃-羟吲哚)衍生物.
|
图 7 催化剂Cat 6催化Michael/环化串联反应 Fig.7 Cat 6 Catalyzes Michael/cyclization tandem reaction |
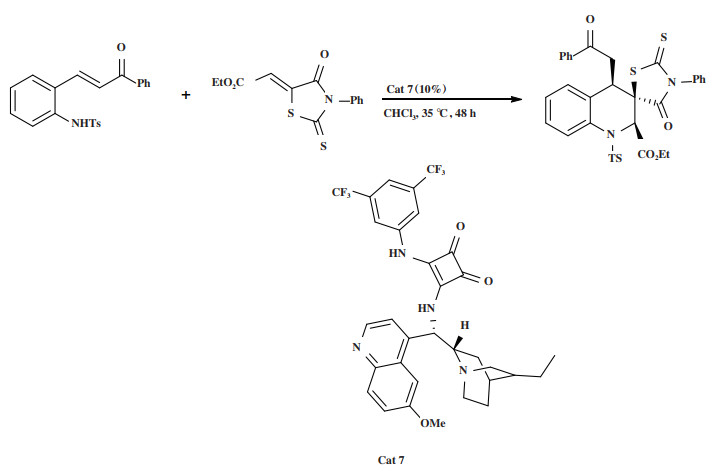
2018年, Song小组[41]利用方酰胺催化剂Cat 7催化2-对甲苯磺酰氨查尔酮和2-硫代-4-噻唑酮衍生物之间的不对称aza-Michael/Michael加成串联反应(图 8), 合成具有3个连续立体中心的手性螺噻唑酮四氢喹啉化合物. 以最高达 > 99%的产率, > 25∶1 dr的非对映选择性和31%~96%的对映选择性得到目标产物.
|
图 8 催化剂Cat 7催化aza-Michael/Michael加成串联反应 Fig.8 Cat 7 Catalyzes aza-Michael/Michael addition tandem reaction |
2019年, Xian小组[42]报道了双功能方酰胺催化剂Cat 8催化的1, 3-环己二酮和α, β-不饱和吡唑酰胺类化合物之间的不对称Michael加成/内酯化串联反应(图 9), 筛选出的催化剂体系以中等到优秀的收率(50%~99%)和对映选择性(49%~99%)得到3, 4-二氢吡喃-2-酮, 对不同取代的α, β-不饱和N-酰基杂环表现出普适性. 值得一提的是, 实验组对催化剂用量没有进行筛选, 直接使用了20%(摩尔分数)的催化剂.
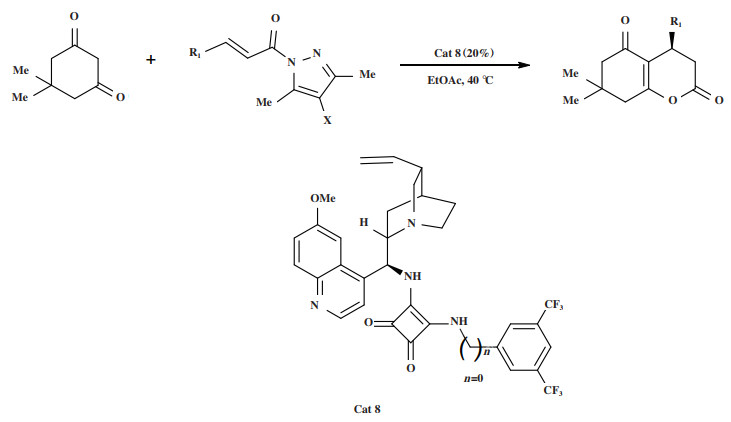
|
图 9 催化剂Cat 8催化Michael加成/内酯化串联反应 Fig.9 Cat 8 Catalyzes Michael addition/lactonization tandem reaction |
2019年, Chen小组[43]报道了一种金鸡纳生物碱衍生的硫方酰胺催化剂Cat 9为催化剂催化苯甲酰丙二腈和硝基烯烃的不对称Michael/Henry串联反应(图 10). 该反应以良好的收率和高达98%的对映选择性合成了含手性中心的环戊烯类化合物. 基于实验数据和初步理论分析(Hartree-Fock计算), 提出了硫方酰胺催化不对称Michael加成反应和辅助E2消除的机理. 该小组推测反应机理可能是(图 11): 两种底物硝基烯烃和苯甲酰丙二腈均被双功能硫方酰胺Cat 9协同活化, 通过过渡态TS1形成第一个C-C键. 生成的迈克尔加合物通过TS2进行分子内Henry反应, 优先形成中间体B, 而A则由于空间排斥而受到不利影响. 此外, 中间体的计算研究显示B在热力学上比A更稳定. 然后中间体B的羟基部分对近端氰基进行分子内亲核进攻得到双环中间体C. 最后, 中间体C通过E1消除转化为异构体E和F的混合物, 或通过E2消除转化为单一异构体E. 虽然理论分析表明F具有较高的稳定性, 但是在实验过程中没有观察到此情况, 因此, 提出了催化剂Cat 9辅助E2消除的机理.
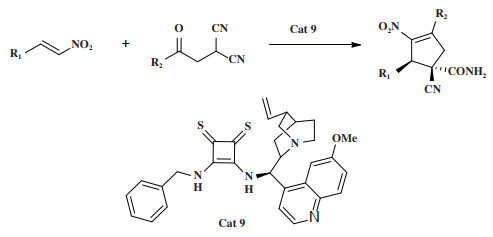
|
图 10 催化剂Cat 9催化Michael/Henry串联反应 Fig.10 Cat 9 Catalyzes Michael/Henry tandem reaction |
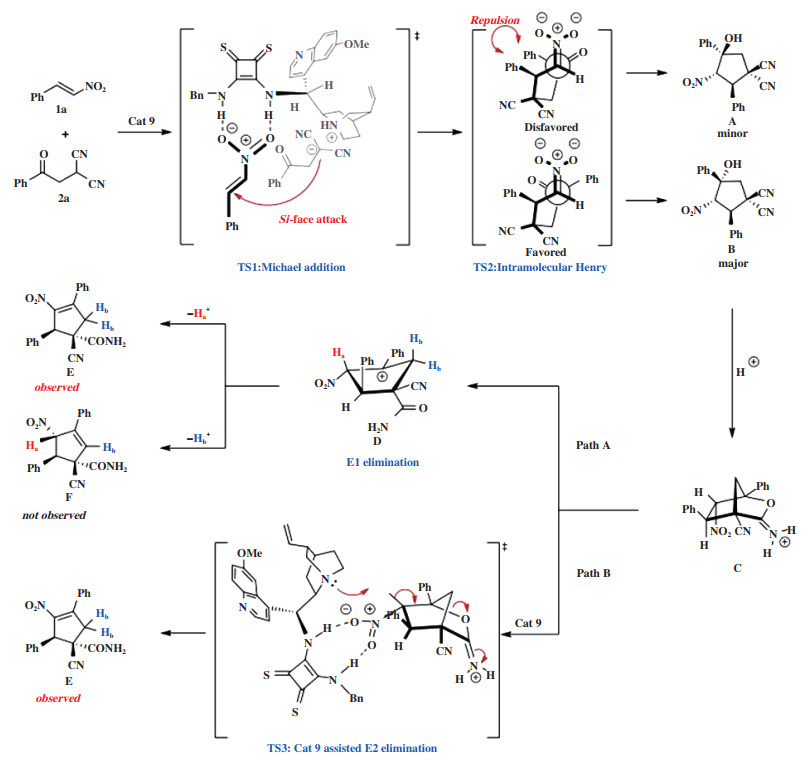
|
图 11 催化剂Cat 9催化Michael/Henry串联反应机理 Fig.11 Mechanism of Michael/Henry tandem reaction catalyzed by Cat 9 |
2019年, Zhao小组[44]报道了双功能方酰胺催化剂Cat 10催化肉桂酰基-3-亚甲基吲哚、三氟乙基靛红酮亚胺和3-异硫氰酸氧吲哚三组分的不对称Michael/Mannich-Michael环化串联反应, 通过一锅法合成复杂的具有双螺吲哚-螺吲哚骨架化合物(图 12). 反应以81%~95%的收率和最高达 > 20∶1 dr, 99% ee得到手性产物.
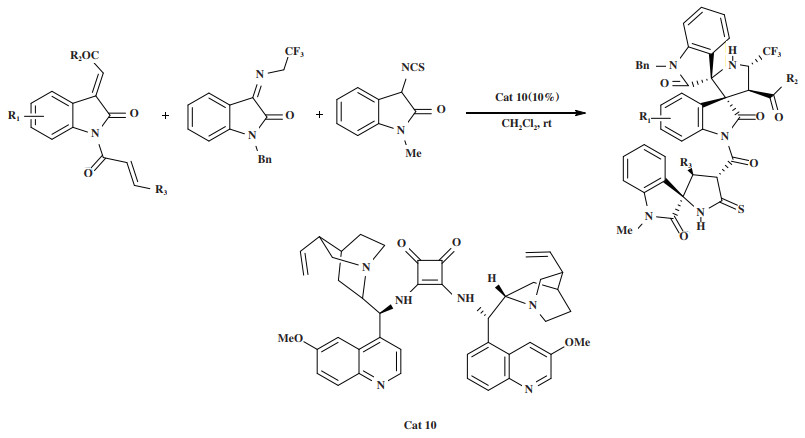
|
图 12 催化剂Cat 10催化Michael/Mannich-Michael环化串联反应 Fig.12 Cat 10 Catalyzes Michael/Mannich-Michael cyclization tandem reaction |
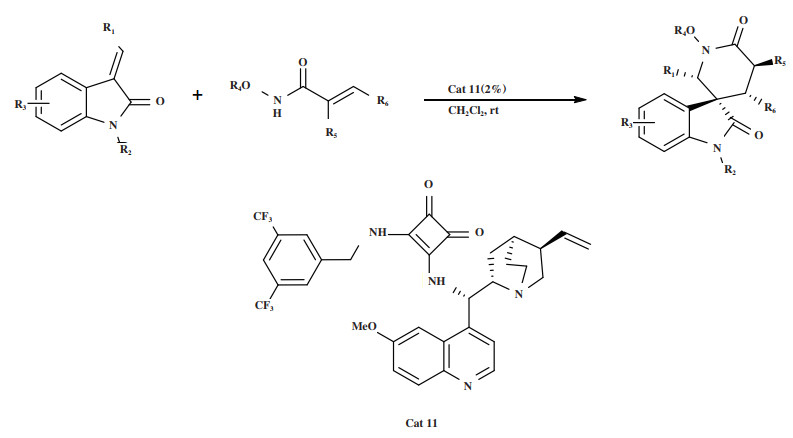
2020年, Tang实验组[45]报道了3-亚甲基吲哚酮与α, β-取代的酰基酰胺的不对称aza-Michael/Michael环化串联反应(图 13), 提供了一条以方酰胺为催化剂合成螺氧吲哚哌啶-2-酮衍生物的有效途径. 该反应在温和条件下使用催化剂Cat 11以高达99%的产率和立体选择性(> 20∶1 dr, 99% ee)获得目标产物, 在此类螺氧吲哚-2-酮衍生物中生成了相邻的4个手性中心. 研究发现, 该催化体系对于吲哚环上C-5、C-6和C-7位置不同取代底物均表现出优良的普适性, 吸电子基较供电子基更有利于反应的产率.
|
图 13 催化剂Cat 11催化aza-Michael/Michael环化串联反应 Fig.13 Cat 11 Catalyzes the aza-Michael/Michael cyclization tandem reaction |
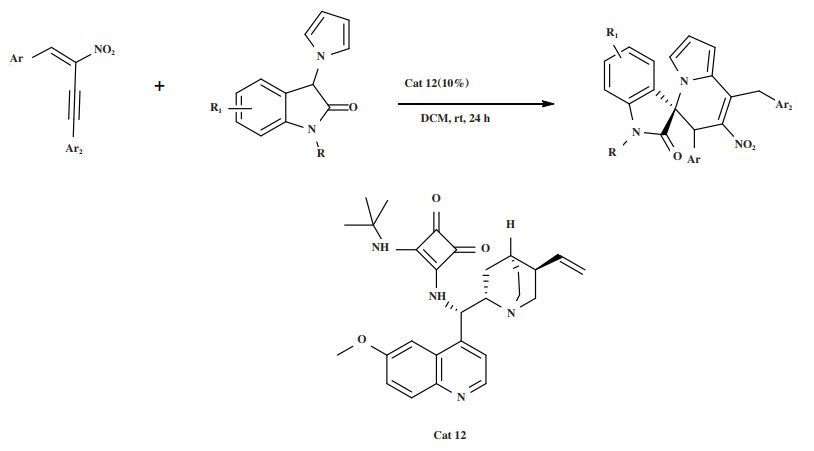
2021年, Ni实验组[46]报道了在手性双功能方酰胺催化剂的作用下, 实现了硝基炔和3-吡咯烷酮的不对称Michael/Friedel-Crafts串联反应(图 14). 研究发现最优催化体系为: 室温条件下, 10%(摩尔分数)的Cat 12在溶剂二氯甲烷中反应24 h, 最终以32%~95%的产率和对映选择性(65%~97%)获得了不同取代的一系列多环氮杂螺环化合物. 该方法具有反应条件温和、不含金属, 官能团相容性好等特点.
|
图 14 催化剂Cat 12催化Michael/Friedel-Crafts串联反应 Fig.14 Cat 12 Catalyzes Michael/Friedel-Crafts tandem reaction |
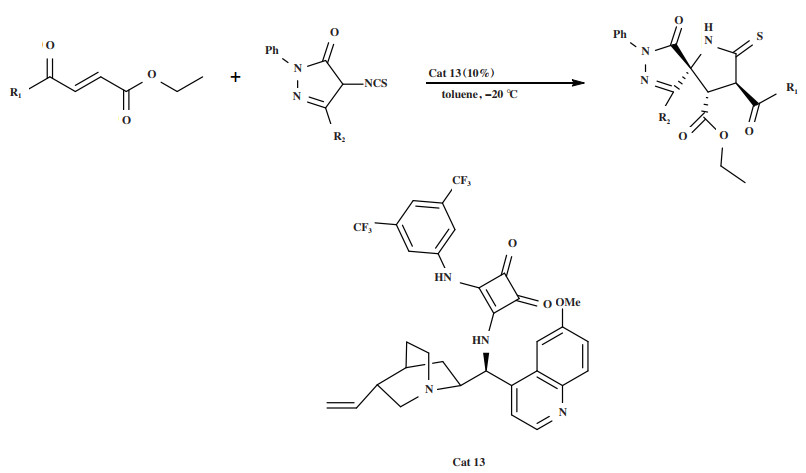
2021年, Gong小组[47]将奎宁衍生的方酰胺催化剂Cat 13用于4-异硫氰基吡唑酮与苯甲酰丙烯酸乙酯的不对称Michael加成/环化串联反应(图 15), 合成了具有3个相邻手性中心的螺环化合物. 该方法以73%~91%的产率和最高达95%的对映选择性获得具有两个相邻叔碳中心的螺吡唑酮衍生物.
|
图 15 催化剂Cat 13催化Michael加成/环化串联反应 Fig.15 Cat 13 Catalyzes Michael addition/cyclization tandem reaction |
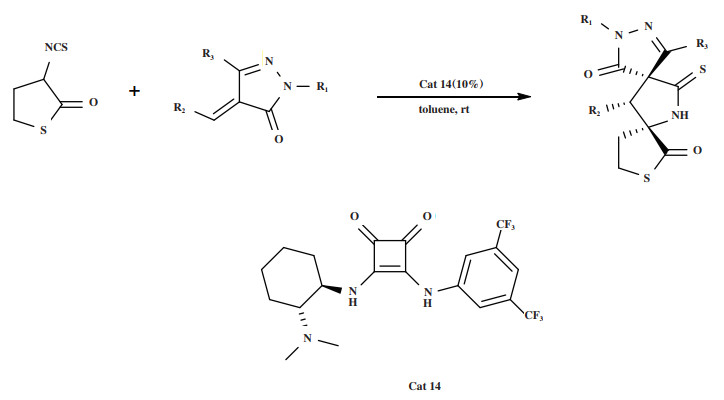
2022年, Liu小组[48]报道了3-异硫氰酸硫代丁内酯与亚烷基吡唑酮的不对称Michael/环化串联反应(图 16), 用于选择性地构建具有光学活性的双[吡唑酮-硫代丁内酯]骨架. 研究发现最优催化体系为: 10%(摩尔分数)的Cat 14, 以甲苯为溶剂, 室温条件下反应, 最终产物的产率为80%~90%, dr > 20∶1, ee为86%~ > 99%.
|
图 16 催化剂Cat 14催化Michael/环化串联反应 Fig.16 Cat 14 Catalyzes Michael/cyclization tandem reaction |
2019年, Chen实验组[49]报道了在手性硫脲催化剂Cat 15的作用下, 通过不对称Michael/环化串联反应获得手性3-硝基-4-色满酮类化合物(图 17). 合成了一系列具有连续C2/C3立体中心的3, 3-二取代-3-硝基-4-色满酮类化合物, 具有较高的非对映选择性和对映选择性(高达99% ee). 实验组研究发现: 当环化的外消旋体3-硝基-4-色满酮的酯基被转化为酰胺时, 可以得到更好的生物活性. 所以对生成的几种手性3-硝基-4-色满酮进行了酯-酰胺转化(图 18). 最终的体外生物学评价表明, 外消旋体A在体外对前列腺癌DU145细胞和PC3细胞显示出最强的抗肿瘤活性, (2S, 3S)-A具有比其外消旋体A及其对映体(2R, 3R)-A更强的抑制活性, (2S, 3S)-A对DU145细胞的抑制活性为(2R, 3R)-A的2.6倍, 这也表明了不对称催化方法学的发展对药物研究的重要影响. 值得一提的是, 在芳环上含有不同取代基的底物在此转化过程中立体选择性保持不变.
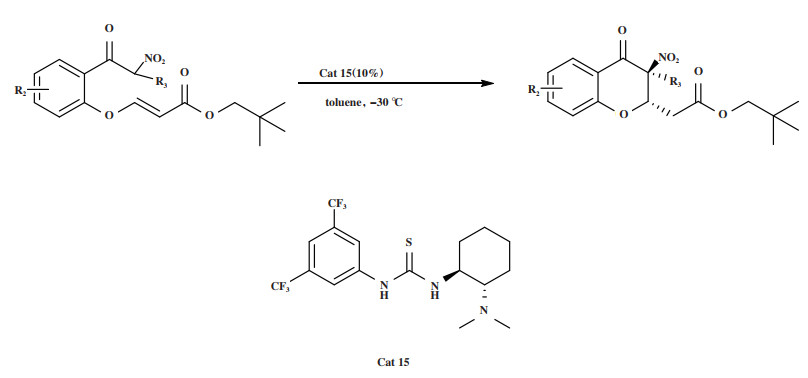
|
图 17 催化剂Cat 15催化Michael/环化串联反应 Fig.17 Cat 15 Catalyzed Michael/cyclization tandem reaction |
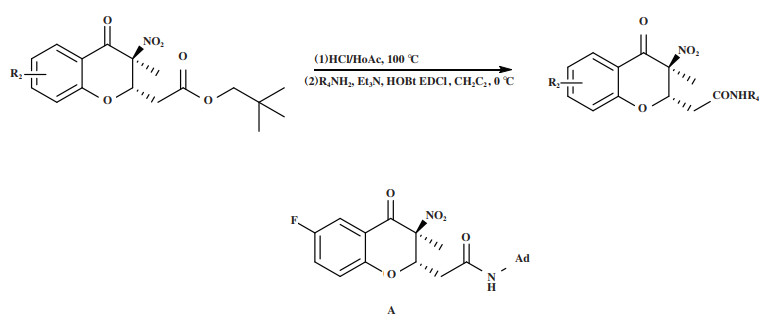
|
图 18 将酯转化为酰胺类化合物的反应 Fig.18 Reaction for converting esters to amides |
2019年, Silm小组[50]开发了一种新的、高效的有机催化级联反应用以合成具有4H-吡喃骨架的手性化合物, 利用金鸡纳碱-硫脲双功能催化剂Cat 16催化环戊烷-1, 2-二酮与亚苄基丙二腈的不对称Michael加成/环化串联反应(图 19). 研究发现, 该催化体系对于R为芳基的底物具有良好的立体选择性, 能以35%~81%的产率和对映选择性(44%~74%)得到具有4H-吡喃骨架的手性化合物. 文章提出的反应机理为(图 20): 两种反应物均由催化剂活化, 亚苄基丙二腈与硫脲部分的两个NH通过氢键活化, 而环戊烷-1, 2-二酮通过氢键与奎宁环的叔胺氮作用. 第一步迈克尔加成反应是决定产物立体构型的关键步骤. 根据产物的构型, 环戊烷1, 2-二酮从Si面进攻亚苄基丙二腈, 从而得到了具有R构型的中间体Ⅰ. 第二步, 中间体Ⅰ发生烯醇互变异构得到中间体Ⅱ. 烯醇Ⅱ对氰基的O-亲核进攻导致环化反应, 得中间体Ⅲ. 第三步, 中间体Ⅲ发生烯胺互变异构得到R构型的产物.
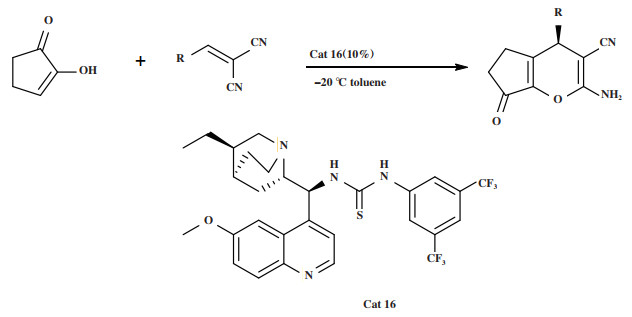
|
图 19 催化剂Cat 16催化Michael加成/环化串联反应 Fig.19 Cat 16 Catalyzes Michael addition/cyclisation tandem reaction |
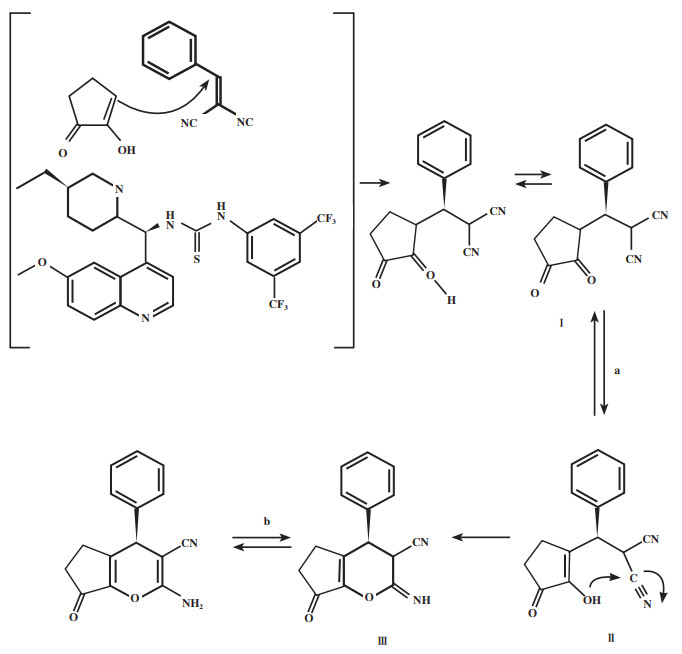
|
图 20 催化剂Cat 16催化Michael加成/环化串联反应机理 Fig.20 Mechanism of Michael addition/cyclisation tandem reaction catalyzed by Cat 16 |
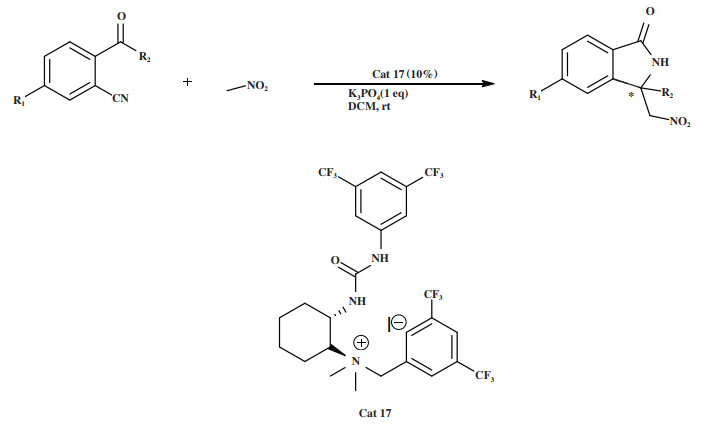
2019年, Romano小组[51]建立了一种利用手性脲类催化剂Cat 17对映选择性制备光学纯3, 3-二取代异吲哚酮骨架化合物的方法(图 21). 该方法用于催化酮苄腈与硝基甲烷的不对称Henry/aza-Michael串联反应, 该催化体系能以优异的产率(95%~99%)得到一系列目标化合物, 但是反应立体选择性较低, 仅为4%~45% ee.
|
图 21 催化剂Cat 17催化Henry/aza-Michael串联反应 Fig.21 Cat 17 Catalyzes the Henry/aza-Michael tandem reaction |
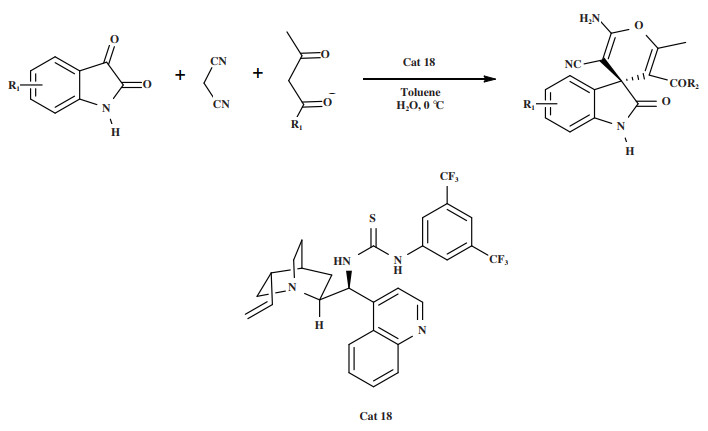
2019年, Konda小组[52]利用辛可尼定衍生的硫脲催化剂Cat 18有机催化靛红、丙二腈和1, 3-二羰基化合物的不对称Knovenagel/Michael/环合串联反应, 实现了三组分立体选择性合成螺环[4H-吡喃-3, 3’-氧吲哚]衍生物(图 22). 以71%~92%的产率和38%~87% ee得到螺氧吲哚产品. 实验发现, 在水添加剂的存在下, 产品的ee值提高了15%.
|
图 22 催化剂Cat 18催化Knovenagel/Michael/环合串联反应 Fig.22 Cat 18 Catalyzes Knovenagel/Michael/cyclization tandem reaction |
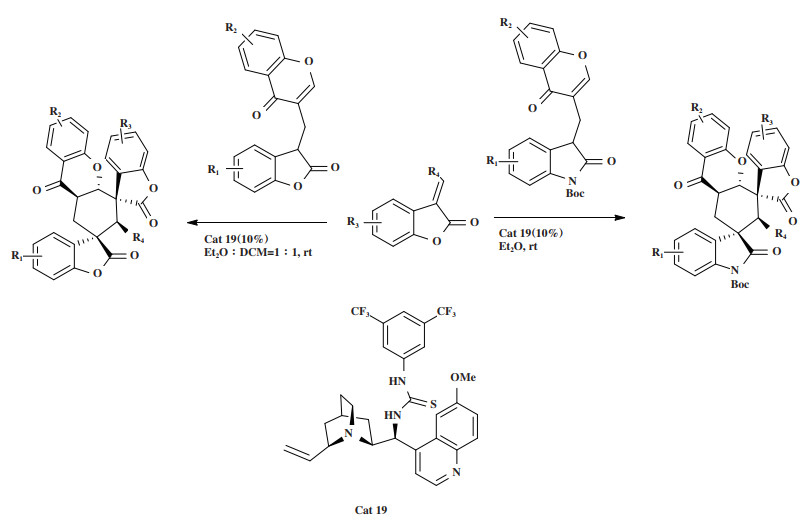
2020年, Zhang小组[53]开发了一种利用色酮羟吲哚/苯并呋喃酮合成子与3-取代的亚甲基苯并呋喃酮的分子间/分子内Michael环化加成串联反应, 获得了光学纯的双螺环[苯并呋喃-羟吲哚/苯并呋喃-色满酮]衍生物(图 23). 研究发现, 对于3-取代的亚甲基苯并呋喃酮与色酮羟吲哚的反应体系, Cat 19/Et2O催化体系具有良好普适性, 当色酮环上被吸电子或供电子基团取代时, 能以70%~93%的产率和优异的立体选择性(均大于20∶1 dr和96%~ > 99% ee)得到产物Ⅰ, 并可放大至g级. 对于另一个反应体系, 即3-取代的亚甲基苯并呋喃酮与苯并呋喃酮的反应, 催化剂Cat 19/(Et2O∶DCM=1∶1)催化体系同样显示出良好的催化性能(93%~ > 99% ee, 最高达 > 20∶1 dr), 得到产物Ⅱ. 这是双功能色酮-苯并呋喃酮合成子定向有机催化串联反应的第一个例子, 也是合成双螺[苯并呋喃-羟吲哚]和双螺苯并呋喃酮的第一个例子, 在药物研发中具有潜在的应用价值.
|
图 23 催化剂Cat 19催化分子间/分子内Michael环化加成串联反应 Fig.23 Cat 19 Catalyzes inter-/intramolecular Michael cycloaddition tandem reaction |
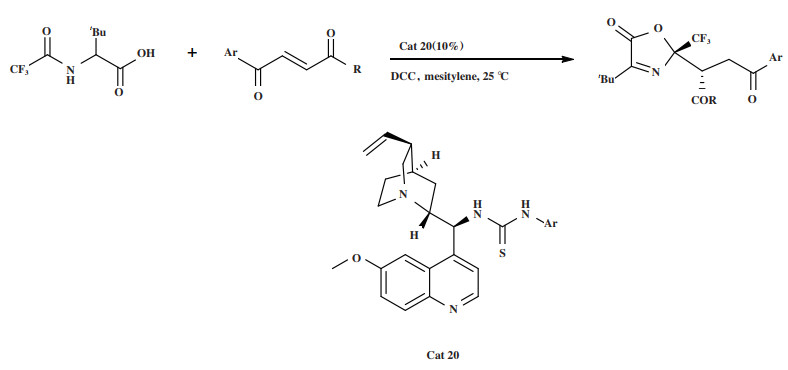
2020年, Li小组[54]报道了利用手性催化剂Cat 20, 以N-3-氟乙酰基氨基酸为起始原料, 在温和的条件下合成N, O-缩酮衍生物的环化/Michael加成串联反应(图 24). 通过高效的原子经济性反应生成了噁唑酮N, O-缩酮衍生物, 同时构建了邻位的季碳和叔碳立体中心, 产率为58%~96%, dr高达 > 20∶1, ee达96%. 他们提出的反应机理为(图 25): 首先, N-3-氟乙酰基氨基酸在缩合剂DCC的作用下转化为相应的中间体. 由于Bronsted碱催化剂中氮的碱性, 中间体发生去质子化, 生成稳定的α-CF3碳负离子. 然后, 亲核试剂的羰基与双功能催化剂的R3NH+通过氢键活化, 催化剂的硫脲部分通过氢键与另一底物丁烯酸酯的羰基作用. 中间体从Re面进攻丁烯酸酯导致环化反应, 最终得到S构型的噁唑酮N, O-缩酮衍生物.
|
图 24 催化剂Cat 20催化环化/Michael加成串联反应 Fig.24 Cat 20 Catalyzes cyclization/Michael addition tandem reaction |
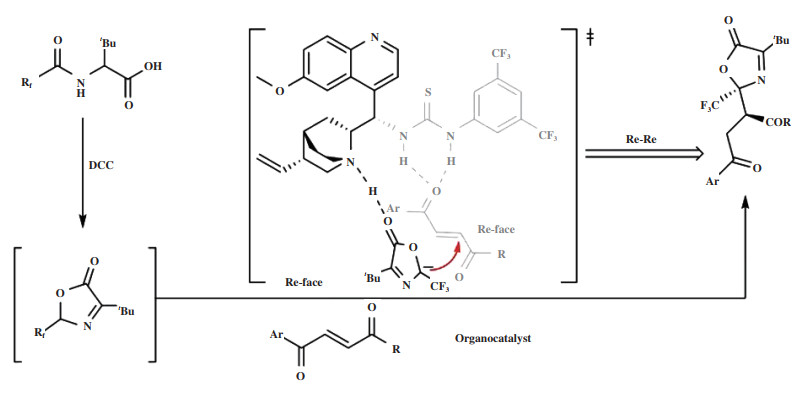
|
图 25 催化剂Cat 20催化环化/Michael加成串联反应机理 Fig.25 Mechanism of cyclization/Michael addition tandem reaction catalyzed by Cat 20 |
2022年, Li小组[55]报道了在手性硫脲催化剂Cat 21的作用下, 通过催化α-亚胺-β-氧代丁酰胺的aza-Michael/Mannich串联反应(图 26), 对映选择性地合成了一系列3, 3’-螺氧吲哚γ-内酰胺类化合物. 34种底物均适用于该反应, 以32%~78%的产率, > 10∶1 dr的非对映选择性和95%~ > 99%的对映选择性得到目标产物.
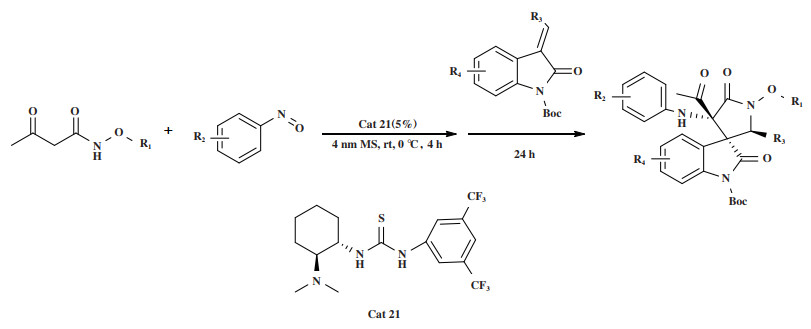
|
图 26 催化剂Cat 21催化aza-Michael/Mannich串联反应 Fig.26 Cat 21 catalyzes the aza-Michael/Mannich tandem reaction |
综上所述, 有机催化不对称Michael/环化串联反应在近年来取得了很大进展. 在3类有机小分子催化剂中, 关于含方酰胺结构催化剂的报道最多, 我们所述的方酰胺类和硫脲类催化剂都是以双功能活化底物的方式的不对称诱导反应, 这两类中的大多数催化剂结构中包含金鸡纳碱骨架结构. 一方面是金鸡纳碱奎宁环上的氮作为亲核试剂活化底物, 另一方面方酰胺或硫脲部分作为亲电试剂通过氢键活化底物. 这两个官能团能精准地诱导底物, 通过优势途径进行反应, 并稳定过渡态, 使反应顺利进行. 有机膦催化剂催化Michael/环化串联反应的报道有限, 既有作为碱的叔膦类[36, 39], 也有作为酸的膦酸类[35, 37-38], 但是绝大部分催化剂结构中包含了轴手性联萘酚的结构. 因此, 对于有机膦类催化剂, 通过修饰联萘酚结构来改善催化性能是至关重要的.
有机催化不对称Michael/环化串联反应为合成具有多种立体中心化合物提供了一种简便方法, 具有广阔的发展空间, 但此类反应目前仍然存在着局限性, 如反应类型有待于扩展、催化剂种类有限、催化剂用量大等问题. 因此, 开发新型高性能、价廉易得的手性催化剂, 扩展反应类型, 拓宽底物范围, 获得更好的立体选择性等仍然是研究的重点. 随着不对称催化领域研究的不断深入, 有机催化不对称Michael/环化串联反应在有机合成领域将具有更大的应用价值.
| [1] |
Fotouhi L, Heravi M M, Zadsirjan V, et al. Electrochem-ically induced michael addition reaction: An overview[J]. Chem Rec, 2018, 18(11): 1633–1657.
DOI:10.1002/tcr.201800022 |
| [2] |
Wang Li-ming(王黎明), Chen Zhe(陈哲), Zhao Mei-jun(赵美君), et al. Thiourea derivatives organocatalyzed asymmetric michael addition reaction of anthrone with nitroalkenes(硫脲衍生物有机催化蒽酮与硝基烯烃的不对称Michael加成反应)[J]. J Mol Catal (China)(分子催化), 2018, 32(2): 187-193.
|
| [3] |
Rullo M, Pisani L. 4-Hydroxycoumarins as michael donors in asymmetric routes to polycyclic coumarins (microre-view)[J]. Chem Heterocyclic Com+, 2018, 54(4): 394–396.
DOI:10.1007/s10593-018-2281-3 |
| [4] |
Reznikov A N, Klimochkin Y N. Recent developments inhighly stereoselective michael addition reactions cataly-zed by metal complexes[J]. Synthesis, 2020, 52(6): 781–795.
DOI:10.1055/s-0039-1690044 |
| [5] |
Wang Y, Du D M. Recent advances in organocatalytic asymmetric oxa-Michael addition triggered cascade react-ions[J]. Org Chem Front, 2020, 7(20): 3266–3283.
DOI:10.1039/D0QO00631A |
| [6] |
Nagorny P, Cichowicz N. New strategy based on seque-ntial michael/aldol reactions for the asymmetric synthesis of cardenolides[J]. StrategTacticsOrgSynth, 2016, 12(9): 237–267.
|
| [7] |
Nising C F, BraSe S. Recent developments in the field of oxa-Michael reactions[J]. Chem Soc Rev, 2012, 41(3): 988–999.
DOI:10.1039/C1CS15167C |
| [8] |
Nising C F, Brase S. The oxa-michael reaction: From recentdevelopments to applications in natural product synthesis[J]. Chem Soc Rev, 2008, 37(6): 1218–1228.
DOI:10.1039/b718357g |
| [9] |
a. Li Y F, Wang H M, Su Y W, et al. Phosphine-catalyzed[3+2] cycloaddition reaction of α-diazoacetates and β-trifluoromethyl enones: A facile access to multisubs-tituted 4-(trifluoromethyl)pyrazolines[J]. Org Lett, 2018, 20(20): 6444-6448. b. Liu Meng-li(刘梦力), Zeng Bo(曾波), Hu Bo(胡波), et al. Influence of electronic and steric factors of phosphine ligands upon palladium-catalyzed alkoxycar-bonylation(膦配体电子和空间效应对钯催化羰化酯化反应的影响)[J]. J Mol Catal (China)(分子催化), 2022, 36(3): 253-273. |
| [10] |
Lorton C, Castanheiro T, Voituriez A. Catalytic and asymm-etric process via P~Ⅲ/P~Ⅴ=O redox cycling: Access to (trifluoromethyl)cyclobutenes via a michael addition/ wittig olefination reaction[J]. J Am Chem Soc, 2019, 141(26): 10142–10147.
DOI:10.1021/jacs.9b02539 |
| [11] |
Kishi K, Takizawa S, Sasai S. Phosphine-catalyzed dual umpolung domino michael reaction: Facile synthesis of hydroindole- and hydrobenzofuran-2-carboxylates[J]. ACS Catal, 2018, 8(6): 5228–5232.
DOI:10.1021/acscatal.8b01011 |
| [12] |
Zhang J Y, Miao Z W. Bisphosphine catalyzed sequential[3 + 2] cycloaddition and michael addition of ynones with benzylidenepyrazolones via dual α', α'-C(sp3)-Hbifunctionalization to construct cyclopentanone-fused spiro-pyrazolones[J]. Org Biomol Chem, 2018, 16(48): 9461–9471.
DOI:10.1039/C8OB02675K |
| [13] |
Cao Z Y, Zhou F, Zhou J, et al. Development of synthetic methodologies via catalytic enantioselective synthesis of 3, 3-disubstituted oxindoles[J]. Acc Chem Res, 2018, 51(6): 1443–1454.
DOI:10.1021/acs.accounts.8b00097 |
| [14] |
a. Formánek B, Tauchman J, Císarová I, et al. Accessto spir-ocyclic benzothiophenones with multiple stereocen-ters via an organocatalytic cascade reaction[J]. J Org Chem, 2020, 85(13): 8510-8521. b. Ge Wei-wei(葛伟伟), Kong Fan-hua(孔凡华), Huang Li-hua(黄力华). Asymmetric synthesis of α-arylpropanol compounds by chiral phosphoramide compounds catalysts(手性磷酰胺类化合物不对称催化合成α- 芳基丙醇类化合物)[J]. J Mol Catal (China)(分子催化), 2022, 36(1): 22-31. |
| [15] |
Mondal B, Balha M, Pan S C. Organocatalytic asymmetric spirocyclization reactions of cyclic 2, 4-dienones with cyanoketones: Synthesis of spiro-dihydropyrano cyclohexanones[J]. Org Biomol Chem, 2019, 17(34): 7849–7853.
DOI:10.1039/C9OB01415B |
| [16] |
Tamanna , Hussain Y, Sharma D, et al. Asymmetric synthesis of cyclohexenone-fused isochromans via quinidine-catalyzed domino peroxyhemiacetalization/oxa-michael addition/desymmetrization sequence[J]. J Org Chem, 2022, 87(9): 6397–6402.
DOI:10.1021/acs.joc.2c00215 |
| [17] |
Huang Z C, Zou Y, Xiang M, et al. 3-Amino oxindole schiff base as synthon for enantioselective preparation of spiro[oxindol-3, 2'-pyrrol] from a michael/cyclization reac-tion catalyzed by a bifunctional cinchona[J]. Org Lett, 2021, 23(6): 2227–2231.
DOI:10.1021/acs.orglett.1c00370 |
| [18] |
Yang H Z, Wang Q Q, Luo Y, et al. Enantioselective synth-esis of trifluoromethyl substituted cyclohexanones via an organocatalytic cascade Michael/aldol reaction[J]. Org Biomol Chem, 2020, 18(8): 1607–1611.
DOI:10.1039/D0OB00004C |
| [19] |
Zhang Y P, Yong Y, Zhao J Q, et al. Chiral bifunctional amine-squaramide-catalyzed highly diastereo- and enantioselective michael/aldol cascade reaction of 2-mercaptobenzaldehyde and α, β-unsaturated 7-azaindoline amides[J]. J Org Chem, 2019, 84(12): 7984–7994.
DOI:10.1021/acs.joc.9b00837 |
| [20] |
Song Y K, Wang J, Deng S M, et al. Quinidine-catalyzed enantioselective domino Michael addition/cyclization process: Synthesis of chiral 1, 4-dihydro-pyridine contain-ing benzosultams[J]. Mol Catal, 2022, 520: 112165.
DOI:10.1016/j.mcat.2022.112165 |
| [21] |
Lin Ye(林晔), Du Da-Ming(杜大明). Recent advances in squaramide-catalyzed asymmetric cascade reactions for the synthesis of spirooxindoles(方酰胺催化的不对称串联反应合成螺环氧吲哚衍生物研究进展)[J]. Chin J Org Chem(有机化学), 2020, 40(10): 3214-3236.
|
| [22] |
a. Wang Li-ming(王黎明), Yang Wen-xin(杨文鑫), Zhang Jun-wei(张俊伟), et al. Michael/ cyclization tandem reaction of 4-hydroxycoumarin with β-nitroolefins(4-羟基香豆素与β-硝基烯烃的不对称Michael加成/环化串联反应)[J]. Chem Res Appl(化学研究与应用), 2022, 34(4): 834-841. b. Mu Hong-wen(穆宏文), Du Nan(杜楠), Wang Li-ming(王黎明), et al. Organocatalyzed enantioselective aldol reac-tion of isatins and acetoacetates(脲衍生物有机催化靛红与乙酰乙酸酯的不对称Aldol反应)[J]. J Mol Catal (China)(分子催化), 2022, 36(1): 51-57. |
| [23] |
Zhang Y, Liu J Y, Zhang X H. Organocatalytic enantios-elective michael-aldol[3+2] annulation for the synthesis of nitro-methanobenzo[7] annulenes[J]. Eur J Org Chem, 2021, 2021(35): 5008–5011.
DOI:10.1002/ejoc.202100974 |
| [24] |
Wang B, Wang X H, Huang W, et al. Protecting group-directed diastereodivergent synthesis of chiral tetrahydron-aphthalene-fused spirooxindoles via bifunctional tertiary amine catalysis[J]. J Org Chem, 2019, 84(16): 10349–10361.
DOI:10.1021/acs.joc.9b01501 |
| [25] |
Murakami H, Yamada A, Kenichi M, et al. Novel aza-michaeladdition-asymmetric protonation to α, β-unsaturated carboxylic acids with chiral thiourea-boronic acid hybrid catalysts[J]. Asian J Org Chem, 2021, 10(5): 1097–1101.
DOI:10.1002/ajoc.202100145 |
| [26] |
Bai M, Chen Y Z, Cui B D, et al. Thiourea-catalyzed asymmetric domino Michael-cyclization reaction of 3-isothi-ocyanato oxindoles with β, γ-unsaturated α-keto estersfor the synthesis of spirocyclic oxindoles[J]. Tetrahe-dron, 2019, 75(14): 2155–2161.
DOI:10.1016/j.tet.2019.02.036 |
| [27] |
Tan Fen(谭芬), Xiao Wen-jing(肖文精), Zeng Guo-ping(曾国平). Recent advances in 3-isothiocyanato oxindoles engagedasymmetric cascade reactions(3-异硫氰酸酯氧化吲哚参与的不对称串联反应研究进展)[J]. Chin J Org Chem(有机化学), 2017, 37(4): 824-840.
|
| [28] |
Das B G, Shah S, Singh V K. Copper catalyzed one-potthree-component imination-alkynylation-aza-michaelsequence: Enantio- and diastereoselective synthesesof 1, 3-disubstituted isoindolines and tetrahydroiso-quinolines[J]. Org Lett, 2019, 21(13): 4981–4985.
DOI:10.1021/acs.orglett.9b01507 |
| [29] |
Shu T, Zhao L, Li S, et al. Asymmetric synthesis of spiroc-yclic β-lactams via copper-catalyzed kinugasa/michael domino reactions[J]. Angew Chem Int Ed, 2018, 57(34): 10985–10988.
DOI:10.1002/anie.201806931 |
| [30] |
Liu M M, Yang X C, Hua Y Z, et al. Dinuclear zinc-cataly-zed asymmetric tandem reaction of α-hydroxy-1-indanone: Access to spiro[1-indanone-5, 2'-γ-butyrola-ctones][J]. Org Lett, 2019, 21(17): 7089–7093.
DOI:10.1021/acs.orglett.9b02658 |
| [31] |
Fan W T, Yang X P, Lv H P, et al. Chiral binaphthyl box-copper-catalyzed enantioselective tandem michael-ketalization annulations for optically active aryl and heteroaryl fused bicyclicnonanes[J]. Org Lett, 2020, 22(10): 3936–3941.
DOI:10.1021/acs.orglett.0c01221 |
| [32] |
Lee J, Wang S B, Callahan M, et al. Copper(Ⅱ)-catalyzed tandem decarboxylative michael/aldol reactions leading to the formation of functionalized cyclohexenones[J]. Org Lett, 2018, 20(7): 2067–2070.
DOI:10.1021/acs.orglett.8b00607 |
| [33] |
Xu H, Tan Y X, Xie P P, et al. Rhodium(Ⅲ)-catalyzed asymmetric reductive cyclization of cyclohexadienone-containing 1, 6-dienes via an anti-michael/michael cascade process[J]. ACS Catal, 2021, 11(13): 8015–8022.
DOI:10.1021/acscatal.1c02431 |
| [34] |
Fang G S, Zheng C W, Cao D D, et al. Asymmetric cycliza-tions via a sequential michael addition/conia-ene reaction by combining multi- functional quaternary phosphonium saltand silver catalysis[J]. Tetrahedron, 2019, 75(18): 2706–2716.
DOI:10.1016/j.tet.2019.03.045 |
| [35] |
Hodík T, Schneider C A. Highly enantio- and diastereosele-ctive synthesis of spirocyclic dihydroquinolones via domino michael addition-lactamization of ortho-quinone methide imines[J]. Chem Eur J, 2018, 24(68): 18082–18088.
DOI:10.1002/chem.201803886 |
| [36] |
Xiao B X, Jiang B, Song X, et al. Phosphine-catalysed asymmetric dearomative formal[4 + 2] cycloadditions of 3-benzofuranyl vinyl ketones[J]. Chem Comm, 2019, 55(21): 3097–3100.
DOI:10.1039/C9CC00386J |
| [37] |
Xia Z L, Zheng C, Liang X W, et al. Manipulation of spiroin-dolenine intermediates for enantioselective synthesis of 3-(indol-3-yl)-pyrrolidines[J]. Angew Chem Int Ed, 2019, 58(4): 1158–1162.
DOI:10.1002/anie.201812344 |
| [38] |
Gao Y Q, Hou Y, Chen J H, et al. Asymmetric synthesis of 9-alkyl tetrahydroxanthenones via tandem asymmetric Michael/cyclization promoted by chiral phosphoric acid[J]. Org Biomol Chem, 2021, 19(2): 348–354.
DOI:10.1039/D0OB02140G |
| [39] |
Gao Y J, Zhang J, Shan W Y, et al. Enantioselective phosp-hine-catalyzed trimerization of γ-aryl-3-butynoates via isomerization/[3 + 2] cyclization/michael addition cascade[J]. Org Lett, 2021, 23(16): 6377–6381.
DOI:10.1021/acs.orglett.1c02197 |
| [40] |
Hu J L, Sha F, Li Q, et al. Highly enantioselective Michael/cyclization tandem reaction between dimedone and isatylidene malononitriles[J]. Tetrahedron, 2018, 74(50): 7148–7155.
DOI:10.1016/j.tet.2018.10.029 |
| [41] |
Song Y X, Du D M. Asymmetric synthesis of highly functionalized spirothiazolidinone tetrahydroquinolines via a squaramide-catalyzed cascade reaction[J]. Org Biomol Chem, 2018, 16(48): 9390–9401.
DOI:10.1039/C8OB02731E |
| [42] |
Xian J L, Chen L, Ye L, et al. Enantioselective synthesis of fused dihydropyranones via squaramide-catalyzed Michael addition/lactonization cascade reaction[J]. Tetrahedron, 2019, 75(15): 2350–2356.
DOI:10.1016/j.tet.2019.03.007 |
| [43] |
Chen C, Wei R, Yi X, et al. Diastereo- and enantiosele-ctive synthesis of functionalized cyclopentenes containing a quaternary chiral center via a thiosquaramide-catalyzed cascade michael-henry reaction[J]. J Org Chem, 2019, 84(23): 15655–15661.
DOI:10.1021/acs.joc.9b02176 |
| [44] |
Zhao B L, Du D M. Asymmetric synthesis of spirooxin-doles with seven stereocenters via organocatalyzed one-pot three-component sequential cascade reactions[J]. Adv Synth Catal, 2019, 361(14): 3412–3419.
DOI:10.1002/adsc.201900218 |
| [45] |
Tang Q G, Cai S L, Wang C C, et al. Organocatalytic Aza-michael/michael cyclization cascade reaction: Enantiosel-ective synthesis of spiro-oxindole piperidin-2-one deriv-atives[J]. Org Lett, 2020, 22(9): 3351–3355.
DOI:10.1021/acs.orglett.0c00779 |
| [46] |
Ni Q J, Wang X Y, Zeng D, et al. Organocatalytic asymmetric synthesis of Aza-spirooxindoles via michael/friedel-crafts cascade reaction of 1, 3-nitroenynes and 3-pyrrolyloxindoles[J]. Org Lett, 2021, 23(6): 2273–2278.
DOI:10.1021/acs.orglett.1c00409 |
| [47] |
Gong W J, Du X, Wang W Y, et al. Squaramide-catalyzed asymmetric Michael/cyclization of 4-isothiocyanato pyrazolones and α, β -unsaturated ketones[J]. Tetrahedron Lett, 2021, 78: 153259.
DOI:10.1016/j.tetlet.2021.153259 |
| [48] |
Liu R M, Zhang M, Han X X, et al. Catalytic asymmetric Michael/cyclization reaction of 3-isothiocyanato thiobu-tyrolactone: An approach to the construction of a library of bispiro[pyrazolone-thiobutyrolactone] skeletons[J]. Org Biomol Chem, 2022, 20(25): 5060–5065.
DOI:10.1039/D2OB00773H |
| [49] |
Chen H Q, Tang J, Liu T, et al. Enantioselective synthesisof chiral 3-alkyl-3-nitro-4-chromanones via chiral thiourea-catalysed intramolecular Michael-type cycliza-tion[J]. Org Biomol Chem, 2021, 19(34): 7403–7408.
DOI:10.1039/D1OB01296G |
| [50] |
Silm E, Kaabel S, Jarving I, et al. Asymmetric organocat-alytic michael addition-cyclisation cascade of cyclopen-tane-1, 2-dione with alkylidene malononitriles[J]. Synthesis, 2019, 51(22): 4198–4204.
DOI:10.1055/s-0039-1690484 |
| [51] |
Romano F, Mola A D, Palombi L, et al. Synthesis andorganocatalytic asymmetric nitro-aldol initiated cascadereactions of 2-acylbenzonitriles leading to 3, 3-disubstit-uted isoindolinones[J]. Catalysts, 2019, 9(4): 327–337.
DOI:10.3390/catal9040327 |
| [52] |
Konda S, Jakkampudi S, Arman H D, et al. Enantiosel-ective synthesis of spiro[4H-pyran-3, 3'-oxindole] deri-vatives catalyzed by cinchona alkaloid thioureas: Signifi-cant water effects on the enantioselectivity[J]. Synth Commun, 2019, 49(21): 2971–2982.
|
| [53] |
Zhang M, Wang J X, Chang S Q, et al. Highly efficient enan-tioselective synthesis of bispiro[benzofuran-oxindole/benzofuran-chromanone]s through organocatalytic inter-/intramolecular Michael cycloaddition[J]. Chin Chem Lett, 2020, 31(2): 381–385.
DOI:10.1016/j.cclet.2019.06.015 |
| [54] |
Li L Y, Yang T X, Zhang T, et al. Organocatalytic asymm-etric tandem cyclization/michael addition via oxazol-5(2h)one formation: Access to perfluoroalkyl-containing N, O acetal derivatives[J]. J Org Chem, 2020, 85(19): 12294–12303.
DOI:10.1021/acs.joc.0c01545 |
| [55] |
Li X T, Tian H Z, Sun X W. Organocatalytic Aza-michael/mannich cascade reaction: Synthesis of enantioenriched 3, 3'-spirooxindole γ-lactamss[J]. J Org Chem, 2022.
|
 2022, Vol. 36
2022, Vol. 36


