2. 甘肃省低碳能源化工重点实验室, 甘肃 兰州 730050
2. Key Laboratory of Low Carbon Energy and Chemical Engineering of Gansu Province, Lanzhou 730050, China
脂肪腈是一类重要的化工原料和中间体[1-2], 被广泛应用于医药、农用化学品(杀虫剂、除草剂)、染料和合成树脂等领域, 同时, 也是合成脂肪胺类化合物的重要原料, 在化工行业中具有重要的地位[3-7]. 脂肪腈主要以脂肪烃[8-13]、脂肪醇[14-16]、卤代脂肪烃[17-19]等为原料, 通过氧化腈化、直接腈化或脱水腈化等反应制备得到. 其中, 脂肪醇氨氧化制备脂肪腈, 是氧化腈化法制备脂肪腈的重要路线之一. 该过程使用可源于生物质资源的脂肪醇为原料[20-23], 有助于“碳中和”和“碳达峰”目标的实现; 同时, 该反应副产物为水或氢气, 符合“绿色”可持续发展的要求, 具有重要的研究价值.
脂肪醇氨氧化制备脂肪腈的反应要经历醇→醛→亚胺→腈的过程, 如图 1所示. 根据反应过程是否需要向体系中提供氧气, 脂肪醇氨氧化反应可分为需氧氧化-氨化反应和脱氢氧化-氨化反应两类[24]. 需氧氧化-氨化反应一般以氧气或空气为氧化剂, 在“醇→醛”和“亚胺→腈”过程中参与反应并生成副产物水(图 1(a))[14, 25-28]; 脱氢氧化-氨化反应中, 不向体系中添加额外的氧化剂, “醇→醛”和“亚胺→腈”过程是在催化剂的作用下发生脱氢氧化反应, 生成副产物氢气(图 1(b))[16, 29].
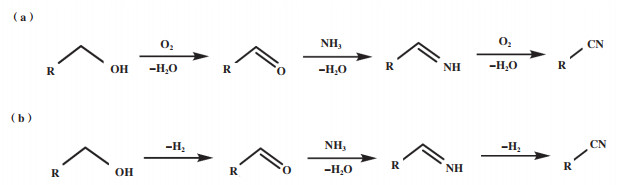
|
图 1 脂肪醇氨氧化制脂肪腈反应过程示意图[14, 25-28] Fig.1 Schematic diagram of ammoxidation of aliphatic alcohol to aliphatic nitrile [14, 25-28] |
针对当前脂肪醇氨氧化反应制备脂肪腈的研究进展, 按需氧氧化-氨化反应和脱氢氧化-氨化反应的分类进行了综述, 并对该类研究的未来发展方向进行了展望.
1 需氧氧化-氨化反应需氧氧化-氨化反应大致可以分为三步, 如图 1(a)所示. 第一步, 羟基被氧气氧化为醛, 这一步一般是速率控制步骤且较难发生[30]; 第二步, 醛基中间体与氨缩合生成亚胺, 该步经历一个亲核加成再脱水的过程, 在由活性金属提供的酸性活性中心上较容易发生; 第三步是腈的生成, 亚胺不能在含氧反应体系中稳定存在, 会与氧气迅速反应生成腈[31]. 近年来, 研究人员开发了多种催化体系用于醇类化合物氨氧化制腈的反应, 但由于脂肪醇与芳香醇在电子结构和位阻效应上的区别, 多数催化剂对脂肪醇的催化活性低于对芳香醇的催化活性, 但通过对反应条件进行优化, 也能够很大程度上提高这类催化体系中脂肪醇的氨氧化活性. 下面按均相体系和非均相体系分类对这些催化体系进行综述.
1.1 均相催化体系在均相催化过程中, 催化剂以离子态形式存在, 能与反应物充分接触, 更有利于促进反应的进行, 并提高原子利用率. 研究人员构筑了一系列均相体系用于醇氨氧化制腈反应, 如表 1所示, 这些研究工作多以苯甲醇的氧化氨化为探针反应, 在优选催化剂和反应条件后, 进行包括脂肪醇在内的其它醇为反应底物的拓展研究. 所使用催化剂多由TEMPO(2, 2, 6, 6-四甲基哌啶氧化物)与其它活性组分共同组成的均相催化体系, 下面对这些催化体系进行分析.
| 表 1 醇氧化氨化制腈均相催化体系 Table 1 Homogeneous catalytic system for ammoxidation of alcohol to nitrile |
Yin等[25]制备了CuI/TEMPO/bpy(2, 2-联吡啶)催化剂用于醇氨氧化制腈的反应(表 1, 序号1), 反应结果表明, 该催化剂对于苯甲醇活性很高, 常温下苯甲腈收率大于90%, 但对于脂肪醇活性稍差. 将反应温度提高至50 ℃后, 对于3-甲基戊醇、正十五醇等脂肪醇的氨氧化反应, 相应脂肪腈收率可达85%以上. 同时, 作者通过对反应的分析与研究, 提出了Cu(Ⅱ)-OH介导的TEMPO氧化机理. 图 2展示了醇氨氧化制腈反应中“醇→醛”(右侧循环)和“亚胺→腈”(左侧循环)两个氧化过程的反应机理. 在醇被氧化为醛的过程中, 首先, Cu(I)-L(D)在O2和TEMPOH共同作用下被氧化为Cu(Ⅱ)-OH(A); 然后, A与反应物醇(1)发生配体交换反应, 得到Cu(Ⅱ)-OR(B); B可以被TEMPO通过夺氢机理氧化为C; C不稳定, 会分解为醛和D, 从而完成了“醇→醛”的氧化过程. 生成的醛与氨会迅速反应生成亚胺, 亚胺会与D发生配体交换反应得到E(左侧循环), E在O2和TEMPOH的作用下被氧化为F, F被TEMPO通过夺氢作用氧化为G, G与氨进一步反应得到D与产物腈, 完成了“亚胺→腈”的氧化过程.
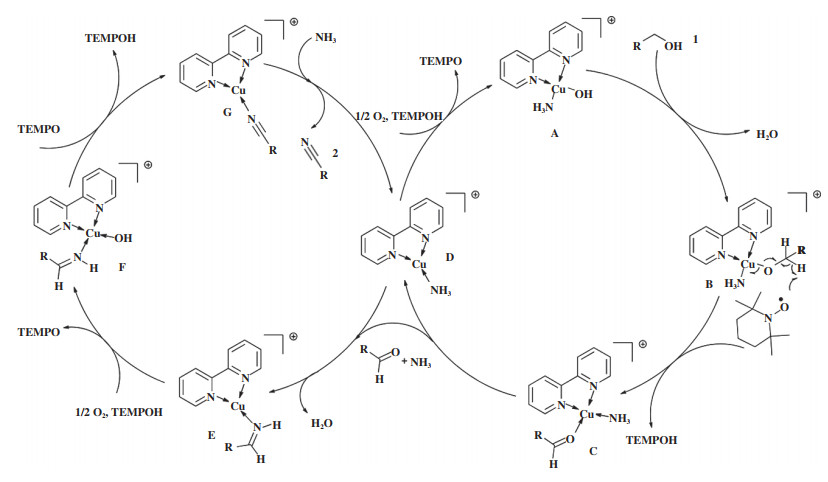
|
图 2 CuI/TEMPO/bpy体系催化醇氨氧化的机理[25](网络版彩图) Fig.2 The mechanism of alcohols ammoxidation over CuI/TEMPO/bpy catalysis [25] (color online) |
Dornan等[26]采用Cu(OTf)2/TEMPO/bpy催化体系, 分别以氧气和氨水为氧化剂和氨源, 将一系列芳香醛和杂环醛高效转化为相应的腈. 同时, 通过对体系进行优化, 以[Cu(MeCN)4][OTf]为Cu前驱体、乙腈为溶剂, 用于正辛醇氨氧化反应, 在50 ℃下反应24 h, 获得了100%辛腈收率(表 1, 序号2), 证明了该催化体系对于脂肪醇氨氧化反应的有效性.
赵丽园[32]制备了CuBr/2-吡啶甲酸钠/TEMPO催化剂用于醇氧化氨化制备腈(表 1, 序号3). 以苯甲醇制备苯甲腈为探针反应, 在50 ℃的优选条件下, 苯甲腈的选择性最高可达99%. 同时作者在上述优选条件下, 对芳香伯醇、烯丙基类伯醇和脂肪伯醇进行了研究, 以4-甲氧基苄醇、3-甲氧基苄醇、2-甲氧基苄醇、4-氟苯甲醇、2-氟苯甲醇、4-甲基苯甲醇等芳香伯醇的氨氧化为探针反应, 转化率均达到99%, 相应腈的选择性分别为71.9%、74.5%、89.4%、88.2%、82.1%、91.9%. 烯丙基类伯醇也可以氧化氨化生成相应的腈, 但催化效果并不理想, 例如肉桂醇反应35 h转化率可达99%, 但肉桂腈的选择性只有54.3%. 此外, 作者探究了催化剂对环己基甲醇氧化氨化反应性能, 发现环己基甲醇几乎没有转化, 说明该催化体系对于脂肪醇氧化氨化几乎没有活性.
张贵华[33]制备了CuI/TEMPO/N-苯基甘氨酸催化剂, 用于醇选择性氧化氨化制备腈的反应(表 1, 序号4). 在50 ℃下, 反应24 h的优选条件下, 在对苯甲醇的氧化氨化反应中, 可得到100%的苯甲腈收率; 但是, 在上述优选条件下, 即便将催化剂和配体量提高3倍, 在对苯乙醇的氨氧化反应中, 仅获得了2%的苯乙腈收率, 说明该催化体系对于脂肪醇氨氧化反应活性差.
除使用均相Cu盐催化体系外, 非金属均相催化体系也被用于醇氨氧化制腈反应(表 1, 序号5). Shimojo等[34]使用TEMPO/I2催化剂或TEMPO/ DIH(1, 3-二碘-5, 5-二甲基海因)催化剂实现了醇高效氨氧化制腈. 通过机理研究发现, 反应过程中, TEMPO促进醇的氧化, I2(或DIH)促进醛的氨化, 如图 3所示. 该体系不仅对芳香醇的氨氧化具有优异活性, 对脂肪醇的氨氧化也具有较好活性, 在9-癸烯醇和(1-甲基环己基)甲醇两个探针脂肪醇的氨氧化反应中, 相应腈的收率均达到99%.
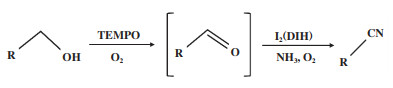
|
图 3 TEMPO/I2(或DIH)体系催化醇氨氧化的机理[34] Fig.3 The mechanism of alcohols ammoxidation over TEMPO/I2(or DIH) catalysis[34] |
除使用含TEMPO的均相体系外, Yadav等[35]提出了一种以CuCl2·2H2O为催化剂、以甲酸铵为氮源催化醇氧化氨化制腈的体系(表 1, 序号6). 反应底物为苯甲醇时, 优选条件下, 苯甲腈的收率高达100%. 同时该催化体系在多种芳香醇氧化氨化反应中表现出了优异活性. 但是在相同条件下, 正己醇氧化氨化制备己腈的反应中, 该催化剂几乎没有活性, 说明该催化剂在脂肪醇氧化氨化反应中无活性或活性很差.
1.2 非均相催化体系在非均相催化过程中, 催化剂以固载化的形式存在. 相对于均相催化过程, 非均相催化过程中催化剂更容易分离并得以循环使用, 从而在很大程度上降低催化剂成本. 研究人员构筑了多种非均相催化体系用于醇类化合物氨氧化制腈的反应, 下面对这些催化体系进行综述.
Molla等[36]使用氯甲基聚苯乙烯树脂聚合物将Cu(Ⅱ)配合物进行负载, 得到了固态的Cu(Ⅱ)配合物催化剂(PS-BHA-Cu), 用于醇氧化氨化制腈的反应. 在115 ℃下反应16 h, 苯甲醇的转化率和苯甲腈的选择性分别为94%和98%. 作者以正辛醇的氧化氨化为探针反应, 对脂肪醇的氧化氨化活性进行了研究, 在上述优选条件下, 正辛醇氧化氨化反应中辛腈的收率只有6%, 说明该催化剂对于脂肪醇氧化氨化活性不太理想. 同时作者对该催化剂的重复使用性进行了研究, 在重复使用6次后, 初始活性并没有明显降低, 表明活性位点不会从载体中浸出, 活性组分负载稳定性较好, 该催化剂可多次循环使用.
贵金属催化剂具有较好的催化氧化性能, 被用于脂肪醇氨氧化的反应中. Oishi等[28]制备了Ru-(OH)x/Al2O3催化剂用于醇氨氧化制腈的反应, 研究结果表明, 该催化剂在芳香醇、芳香醛和脂肪醛(壬醛、葵醛)的氨氧化反应中均表现出了优异活性, 但其在脂肪醇氨氧化反应中的活性未被提及. Hamill等[14]制备了Pd/TiO2催化剂用于乙醇气相氨氧化制乙腈的反应, 230 ℃条件下, 乙腈收率可达93%, 且反应70 h后催化剂活性未见明显降低, 证明催化剂具有较好的稳定性.
N掺杂C载体上负载的非贵金属催化剂也被用于脂肪醇氨氧化反应. Jagadeesh等[37]以Co(Ac)2·4H2O、1, 10-菲罗啉和炭粉(XVC72R)为原料, 通过配位-热解的方式构筑了N掺杂石墨烯层(NGr)包围的Co3O4催化剂(Co3O4-NGr/C), 并用于醇氨氧化制腈的反应中. 在丁醇、辛醇、十二醇、1, 6-己二醇和1, 8-辛二醇等脂肪醇的氨氧化反应中, 分别得到了73%、82%、79%、66%和63%的脂肪腈收率. Shang等[38]以SBA-15为硬模板构筑了新型介孔N杂C载体负载的Co3O4催化剂(Meso-Co-N/C)用于醇氨氧化制腈的反应, 实现了多种芳香醇高效氨氧化制腈. 但对脂肪醇的氨氧化活性远低于芳香醇, 其中, 辛醇氨氧化反应中仅获得了12%的辛腈收率. Sun等[39]通过热解ZIF-67@ZIF-8空心结构材料制备了具有空心结构的Co@NC催化剂用于醇氧化氨化制腈的反应. 以苯甲醇为反应底物时, 在50 ℃、0.1 MPa O2下反应12 h, 可获得93%的苯甲腈收率; 同时, 该催化剂在多种芳香醇的氧化氨化中均表现出优异的催化活性, 但以正辛醇为反应底物时, 只获得了3%的辛腈收率, 说明该催化剂对于脂肪醇氧化氨化的活性远不及对芳香醇的氧化氨化. 之后, Sun等[40]通过热解苯甲胺改性的含Fe-ZIF材料, 制备了单原子Fe1-N-C材料, 如图 4所示. 该催化剂对多种芳香醇、杂环取代醇、烯丙基醇和脂肪醇的氧化氨化反应均表现出优异的活性. 在环己基甲醇、正戊醇、正辛醇和2-乙基己醇4种脂肪醇氧化氨化制备相应脂肪腈的反应中, 脂肪腈收率分别可达83%、51%、61%和95%, 说明该催化剂在脂肪醇氧化氨化的反应中具有较好活性. 机理研究表明, “醇→醛”的步骤是醇氧化氨化反应的控制步骤, 这与前人的研究结果一致; 而含量较高(催化剂中铁含量约为2.2%(质量分数))且高度分散的Fe1-N-C活性位对于醇氧化至醛的过程表现出优异的催化活性, 同时, NH3·H2O的加入对于醇的氧化过程也有促进作用.
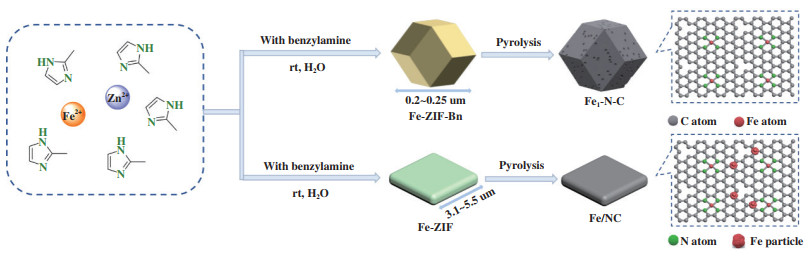
|
图 4 单原子Fe1-N-C制备过程示意图[40](网络版彩图) Fig.4 Schematic illustration of the synthesis of Fe1-N-C catalyst[40] (color online) |
Ishida等[41]发现MnO2、Co3O4和NiO等过渡金属氧化物也对醇氨氧化制腈的反应具有较好活性, 尤其是MnO2催化剂, 在催化苯甲醇氨氧化反应中, 反应0.5 h可获得近100%的苯甲腈收率, 对辛醇氨氧化反应的催化活性虽然不如芳香醇, 但通过延长反应时间到10 h也可获得94%的辛腈收率. 此外, 作者对MnO2催化剂醇氨氧化反应的机理进行了阐述, 如图 5所示, 高价态的Mn(Ⅳ)在“醇→醛”(图 5右侧)和“亚胺→腈”(图 5左侧)的过程中充当了氧化剂, 同时, 自身被还原为Mn(Ⅲ); 随后Mn(Ⅲ)被体系中的O2氧化为Mn(Ⅳ), 得以循环.
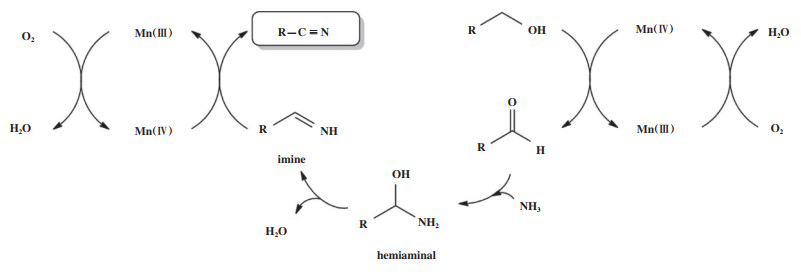
|
图 5 MnO2催化剂催化醇氨氧化制腈反应机理[41](网络版彩图) Fig.5 Reaction mechanism for the ammoxidation of alcohol over MnO2[41](color online) |
Wang等[42]基于MnO2和贵金属在氧化氨化反应中的优异活性, 制备了一系列由MnO2负载贵金属组成的催化剂, 并对比研究了所制催化剂在正庚醇氧化氨化反应中的活性, 结果如图 6所示. 由图可知, 以纯MnO2-r为催化剂时, 正庚醇转化率和庚腈收率分别约为40%和37%; 在负载Au、Pt、Pd、Rh、Ag等贵金属以及负载Fe后, 催化剂活性均低于纯MnO2-r催化剂, 原因是负载的金属对正庚醇的氧化氨化基本没有活性, 而负载过程覆盖了部分MnO2-r催化剂的活性位点; 在负载Ru后, 催化剂活性有显著提高. 而且得益于Ru在MnO2上的高度分散, 仅仅负载0.1%的Ru即可显著提高催化剂的活性, 且0.1Ru/MnO2-r催化剂在多种脂肪醇氧化氨化反应中表现出了优异活性. 通过实验探究以及DFT理论计算研究, 作者认为Ru在该催化剂中起助剂的作用, Ru-O-MnOx和MnO2活性位均能催化醇氧化氨化, 但Ru-O-MnOx比MnO2具有更高的活性. 此外, 作者的研究还发现, 体系中的NH3会阻碍醇在Au活性位上的吸附并提高C-H键在Pt表面吸附断裂的能垒, 从而显著抑制Au、Pt催化剂的催化醇脱氢的能力, 进而抑制Au、Pt催化剂催化醇氨氧化制腈的活性.
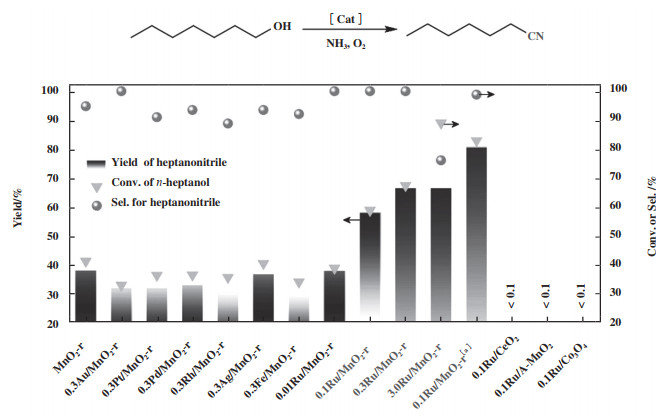
|
图 6 不同催化剂催化正庚醇氧化氨化活性结果[42](网络版彩图) Fig.6 Performance data characterizing oxidative cyanation of n-heptanol with various catalysts (Reaction conditions: 0.2 mmol of substrate, 4 mL of t-amyl alcohol, 100 μL of aqueous NH3 (28%~30%), 100 mg of catalyst, 2.0 MPa of oxygen, 100 ℃, 2 h, [a]Reaction time: 5 h [42])(color online) |
综上, 在均相催化体系和非均相催化体系中都有一些工作实现了脂肪醇氨氧化制脂肪腈, 均相体系中, 由于催化剂以分子形式存在, 活化脂肪醇的能力较强, 多使用Cu、TEMPO等组分即实现了反应的发生, 但均相体系在未来的实际应用中, 反应产物的分离以及催化剂的循环使用会在一定程度上增大该类催化体系的成本. 非均相体系中, 催化剂的分离和循环使用相对容易是该体系优于均相体系的一个特点, 但脂肪醇的活化对多相催化剂的活性位点要求较高, 多数非均相催化体系对脂肪醇的催化活性低于均相体系. N掺杂C材料负载的Co、Fe基催化剂表现出较好活性, 但这一类催化剂的规模化制备以及稳定性方面还需进一步研究; MnO2为代表的金属氧化物催化剂具有一定的活性, 但其活性有待进一步提高; 合适的贵金属组分与金属氧化物的协同组合可能是这类催化剂未来发展的一个方向.
2 脱氢氧化-氨化反应脂肪醇通过脱氢氧化-氨化制备脂肪腈的过程中不需要向体系中提供氧气作为氧化剂, 脂肪醇以催化脱氢的方式被氧化为醛(图 1(b)). 该类反应往往需要较高温度(> 200 ℃), 因此, 一般在固定床反应器中使用非均相催化剂催化反应的进行. 主要的催化剂有Cu、Ni、Co等过渡金属组成的催化剂和Zn30Cr4.5/Al2O3催化剂. 下面分别对这几种催化剂进行阐述.
2.1 过渡金属催化剂Hu等[15]报道了Cu/m-ZrO2(单斜-ZrO2)催化剂用于正丁醇、异丁醇、正戊醇等C4-C8脂肪醇脱氢氨化反应, 得到了 > 96%的醇转化率和 > 87%的腈选择性. 作者认为, 催化剂中活性组分Cu0促进了醇脱氢到醛的过程, 而载体m-ZrO2有助于醛与氨亲核加成后进一步脱水形成亚胺的过程, 机理如图 7所示. 同时机理研究发现, “醇→醛”的过程是该反应中非常重要的一步.
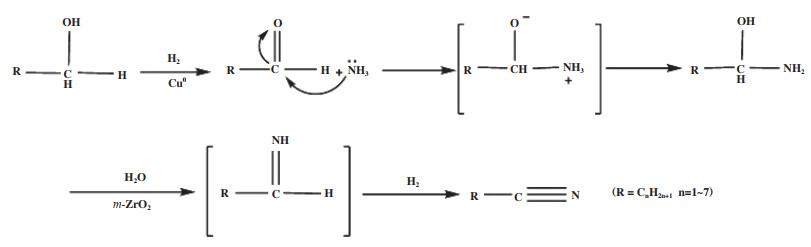
|
图 7 C2-C8脂肪醇在Cu/m-ZrO2催化剂上脱氢氨化制腈反应机理[15](网络版彩图) Fig.7 Reaction mechanism of dehydrogenation-amination of C2-C8 primary alcohols to nitriles over Cu/m-ZrO2[15] (color online) |
Ni金属由于具有较高的脱氢活性, 被用作醇脱氢氨化制腈的活性组分. Wang等[16]采用沉积-沉淀法制备了Al2O3负载的Ni催化剂(Ni/Al2O3-DP)用于醇脱氢氨化制腈的反应. 在230 ℃下, 己醇脱氢氨化制己腈的反应中, 己醇转化率和己腈选择性均超过了99%. 作者认为, 醇脱氢制醛的过程是脱氢氨化反应的控制步骤, Ni/Al2O3-DP催化剂高活性的原因在于Ni具有优异的催化脱氢活性. 此外, Al2O3载体对醛中间体与氨反应形成亚胺中间体的过程有促进作用, 也有助于促进反应的进行. 在此基础上, Wang等[29]进一步构筑了Ni-M/Al2O3双金属催化剂(M=Fe、Co、Cu和Zn)用于该反应, 结果表明, Ni-Cu/Al2O3在这些双金属催化剂中具有最高活性, 240 ℃条件下, 实现了正丁醇、正己醇等一系列脂肪醇高效脱氢氨化制脂肪腈. 通过DFT计算, 发现Ni0.5Cu0.5/Al2O3催化剂表现出最好催化活性的原因在于在该催化剂上反应具有最低活化能.
Zhang等[43]研究发现γ-Al2O3负载的Co催化剂(Co/γ-Al2O3)在乙醇脱氢氨化制乙腈反应中表现出优异活性, 在420 ℃固定床反应器上, 乙醇转化率和乙腈选择性分别可达100%和87.7%. 然后其又研究了Cr、Fe、Zn、Ni、Pd和Cu金属掺杂对Co/γ-Al2O3催化活性的影响规律, 结果表明, 同等条件下, Ni掺杂的Co催化剂(Co19.9Ni3.0/γ-Al2O3)可将乙腈选择性提高至92.5%. 作者认为, Ni的掺杂, 有利于提高活性组分分散性、增大催化剂表面积并抑制Co物种与载体间相互作用, 进而提高Co催化剂催化性能. 之后, 作者又对该体系所用催化剂的机械强度进行了优化[44], 并对该反应的动力学进行了详细研究[45].
2.2 其它催化剂Zhang等[46]合成了Zn30Cr4.5/Al2O3催化剂用于烯丙醇脱氢氨化制丙腈的反应, 优选条件下可获得超过65%的丙腈收率. 通过机理研究发现, ZnAl2O4是反应过程中脱氢和加氢反应的活性组分, Cr的掺杂有利于减小ZnAl2O4微晶的尺寸, 进而提高催化剂性能.
3 总结与展望脂肪腈是一类重要的化工原料和中间体, 被广泛应用于医药、农用化学品、染料和合成树脂等领域. 脂肪醇氨氧化制备脂肪腈的过程使用可源于生物质资源的脂肪醇为原料, 有助于“碳中和”和“碳达峰”目标的实现; 同时, 该反应副产物为水或氢气, 符合“绿色”可持续发展的要求, 是氧化腈化法制备脂肪腈的重要路线之一. 综述了氧化-氨化和脱氢-氨化两类以脂肪醇为原料合成脂肪腈催化体系的研究进展.
目前, 由脂肪醇制备脂肪腈的催化体系虽然取得了一定的进展, 但受限于催化剂活性与稳定性、反应效率与反应产物分离成本等问题, 依旧停留在实验室阶段, 尚不能满足产业化的需求. 为促进脂肪醇制备脂肪腈产业化进程, 未来的研究中, 以下几方面的研究尤为重要: (1)进一步进行催化剂构效关系研究, 设计高活性催化剂; (2)对催化剂失活机理进行深入研究, 明确催化剂失活原因, 构筑在高氨浓度条件下性能稳定的催化剂; (3)提高反应体系中醇的浓度, 从而提高反应效率并降低分离成本; (4)底物拓展方面, 除关注脂肪一元醇的氨氧化外, 也要关注脂肪二元醇的氨氧化, 尤其是1, 6-己二醇氨氧化制己二腈的反应.
| [1] |
Mcconvey I F, Woods D, Lewis M, et al. The importance ofacetonitrile in the pharmaceutical industry and opportu-nities for its recovery from waste[J]. Org Process Res Dev, 2012, 16(4): 612–624.
DOI:10.1021/op2003503 |
| [2] |
Lv Y, Li J, Feng S, et al. Multi-walled carbon nanotubes supported nickel nanoparticles doped with magnesia and copper for adiponitrile hydrogenation with high activity and chemoselectivity under mild conditions[J]. Chem Eng J, 2018, 346: 203–216.
DOI:10.1016/j.cej.2018.04.031 |
| [3] |
Fleming F F. Nitrile-containing natural products[J]. Nat Prod Rep, 1999, 16(5): 597–606.
DOI:10.1039/a804370a |
| [4] |
Najam T, Shah S S A, Mehmood K, et al. An overview on the progress and development on metals/non-metal catalyzed cyanation reactions[J]. Inorg Chim Acta, 2018, 469: 408–423.
DOI:10.1016/j.ica.2017.09.058 |
| [5] |
Ping Y, Ding Q, Peng Y. Advances in C-CN bond formation via C-H bond activation[J]. ACS Catal, 2016, 6(9): 5989–6005.
DOI:10.1021/acscatal.6b01632 |
| [6] |
Yan G, Zhang Y, Wang J. Recent advances in the synthesis of aryl nitrile compounds[J]. Adv Synth Catal, 2017, 359(23): 4068–4105.
DOI:10.1002/adsc.201700875 |
| [7] |
Fleming F F, Yao L, Ravikumar P C, et al. Nitrileconta-ining pharmaceuticals: Efficacious roles of the nitrile pharmacophore[J]. J Med Chem, 2010, 53(22): 7902–7917.
DOI:10.1021/jm100762r |
| [8] |
Andrushkevich T V, Popova G Y, Chesalov Y A, et al. Propane ammoxidation on Bi promoted movtenbox oxide catalysts: Effect of reaction mixture composition[J]. Appl Catal A-Gen, 2015, 506: 109–117.
DOI:10.1016/j.apcata.2015.08.034 |
| [9] |
Baek M, Lee J K, Kang H J, et al. Ammoxidation of propane to acrylonitrile over Mo-V-P-Oy/Al2O3 catalysts: Effect of phosphorus content[J]. Catal Commun, 2017, 92: 27–30.
DOI:10.1016/j.catcom.2016.12.022 |
| [10] |
Bilde J, Delichere P, Burel L, et al. Propane ammoxid-ation catalyst prepared by thermally induced spreading of Sb2O3 on V/Al/O-Mixed oxide[J]. Appl Catal A-Gen, 2013, 468: 341–349.
DOI:10.1016/j.apcata.2013.08.042 |
| [11] |
Castelli A, Ballarini N, Cavani F. New rutile Ga/V/Nb/Sb mixed oxides as catalysts for propane ammoxidation to acrylonitrile[J]. Catal Today, 2012, 192(1): 72–79.
DOI:10.1016/j.cattod.2012.01.032 |
| [12] |
Li Y, Armor J N. Ammoxidation of ethane to acetonitrile over metal-zeolite catalysts[J]. J Catal, 1998, 173(2): 511–518.
DOI:10.1006/jcat.1997.1947 |
| [13] |
Mhamdi M, Khaddar-Zine S, Ghorbel A. Influence of the Co/Al ratio and the temperature of thermal treatment on cobalt speciation and catalytic properties of Co-ZSM-5 prepared by solid-state ion exchange[J]. Appl Catal A-Gen, 2008, 337(1): 39–47.
DOI:10.1016/j.apcata.2007.11.033 |
| [14] |
a. Hamill C, Driss H, Goguet A, et al. Mild temperature palladium-catalyzed ammoxidation of ethanol to acetonitrile[J]. Appl Catal A-Gen, 2015, 506: 261-267. b. Tang Chen(唐成), Li Shuang-ming(李双明), Yu San-san(于三三). Research progress of solid catalysts for catalyticconversion of glycerol to lactic acid(固体催化剂用于甘油催化转化制备乳酸研究进展)[J]. J Mol Catal (China)(分子催化), 2022, 36(4): 398-411. c. Gong Peng(龚朋), Liu Lu(刘璐), Shao Guang-cai(邵广才), et al. Mechanism of ozone decomposition and oxygen species formation on copper oxide surface(氧化铜表面臭氧分解路径及表面氧物种生成机理研究)[J]. J MolCatal (China)(分子催化), 2022, 36(3): 199-206. |
| [15] |
a. Hu Y, Jin S, Zhang Z, et al. One-step synthesis of nitriles by the dehydrogenation-amination of fatty primary alcohols over Cu/m-ZrO2[J]. Catal Commun, 2014, 54: 45-49. b. Zhao Mao-xu(赵茂旭), Zhang Tian-qi(张天琦), Duan Ting-ting(段婷婷), et al. Research progress of selective oxidation of alcohols to aldehydes and ketones by electrocatalysis(电催化醇选择性氧化为醛酮的研究进展)[J]. J Mol Catal (China)(分子催化), 2021, 35(6): 583-594. c. Xia Yu-yan(夏语嫣), Lu Qing-yang(吕庆阳), Yuan hua(袁华). Co-N-C System catalyzed the ammoxidation ofα-aromatic alcohol to α-aromatic nitrile directly(Co-N-C体系催化α-芳香醇氨氧化直接制备α-芳香腈)[J]. J Mol Catal (China)(分子催化), 2021, 35(1): 48-53. d. Lu Zi-xuan(卢自轩), Li Shuang-ming(李双明), Yu San-san(于三三). Research progress of composite metal oxide catalysts for the oxidation of glycerol to acrylic acid(复合金属氧化物催化剂用于甘油氧化制丙烯酸的研究进展)[J]. J Mol Catal (China)(分子催化), 2020, 34(5): 484-494. |
| [16] |
a. Wang Y, Furukawa S, Zhang Z, et al. Oxidant free conversion of alcohols to nitriles over Ni-Based catalysts[J]. Catal Sci Technol, 2019, 9(1): 86-96. b. Li Gui-xian(李贵贤), Meng Jia-le(孟佳乐), Dong Peng(董鹏), et al. Ionic liquid thermal synthesis of cesium heterot-ungstophosphate catalyzed by cyclohexanol to cyclohex-anone(离子液体热合成磷仲钨酸铯杂多酸盐催化环己醇制备环己酮)[J]. J Mol Catal (China)(分子催化), 2020, 34(2): 125-132. |
| [17] |
Alazet S, West M S, Patel P, et al. Synthesis of nitrile-bearing quaternary centers by an equilibrium-driven transnitrilation and anion-relay strategy[J]. Angew Chem Int Edit, 2019, 58(30): 10300–10304.
DOI:10.1002/anie.201903215 |
| [18] |
Ratani T S, Bachman S, Fu G C, et al. Photoinduced, copper-catalyzed carbon-carbon bond formation with alkyl electrophiles: Cyanation of unactivated secondary alkyl chlorides at room temperature[J]. J Am Chem Soc, 2015, 137(43): 13902–13907.
DOI:10.1021/jacs.5b08452 |
| [19] |
Xia A, Xie X, Chen H, et al. Nickel-catalyzed cyanation of unactivated alkyl chlorides or bromides with Zn(CN)2[J]. Org Lett, 2018, 20(23): 7735–7739.
DOI:10.1021/acs.orglett.8b03539 |
| [20] |
Zhou C, Xia X, Lin C, et al. Catalytic conversion of lignocellulosic biomass to fine chemicals and fuels[J]. Chem Soc Rev, 2011, 40(11): 5588–5617.
DOI:10.1039/c1cs15124j |
| [21] |
Zheng M, Pang J, Sun R, et al. Selectivity control for cellulose to diols: Dancing on eggs[J]. ACS Catal, 2017, 7(3): 1939–1954.
DOI:10.1021/acscatal.6b03469 |
| [22] |
Mika L T, Csefalvay E, Nemeth A. Catalytic conversion of carbohydrates to initial platform chemicals: Chemistry and sustainability[J]. Chem Rev, 2018, 118(2): 505–613.
DOI:10.1021/acs.chemrev.7b00395 |
| [23] |
Sun D, Sato S, Ueda W, et al. Production of C4 and C5 alcohols form biomass-derived materials[J]. Green Chem, 2016, 18(9): 2579–2597.
DOI:10.1039/C6GC00377J |
| [24] |
Xu Bao-hua(徐宝华), Wang Yao-feng(王耀锋), Ding Guang-rong(丁光荣), et al. Progress in synthetic strategy and indust-rial preparation of aliphatic nitriles(脂肪腈的合成方法及规模化制备进展)[J]. SCI SIN: Chimica(中国科学: 化学), 2020, 50(7): 766-805.
|
| [25] |
Yin W, Wang C, Huang Y. Highly practical synthesis of nitriles and heterocycles form alcohols under mild conditions by aerobic double dehydrogenative catalysis[J]. Org Lett, 2013, 15(8): 1850–1853.
DOI:10.1021/ol400459y |
| [26] |
Dornan L M, Cao Q, Flanagan J C, et al. Copper/TEMPO catalysed synthesis of nitriles form aldehydes or alcohols using aqueous ammonia and with air as the oxidant[J]. Chem Commun, 2013, 49(54): 6030–6032.
DOI:10.1039/c3cc42231c |
| [27] |
Tao C, Liu F, Zhu Y, et al. Copper-catalyzed aerobic oxidative synthesis of aryl nitriles form benzylic alcohols and aqueous ammonia[J]. Org Biomol Chem, 2013, 11(20): 3349–3354.
DOI:10.1039/c3ob00002h |
| [28] |
Oishi T, Yamaguchi K, Mizuno N. Catalytic oxidative synthesis of nitriles directly from primary alcohols and ammonia[J]. Angew Chem Int Edit, 2009, 121(34): 6404–6406.
DOI:10.1002/ange.200900418 |
| [29] |
Wang Y, Furukawa S, Yan N. Identification of an active NiCu catalyst for nitrile synthesis from alcohol[J]. ACS Catal, 2019, 9(8): 6681–6691.
DOI:10.1021/acscatal.9b00043 |
| [30] |
Preger Y, Root T W, Stahl S S. Platinum-based heterogen-eous catalysts for nitrile synthesis via aerobic oxidative coupling of alcohols and ammonia[J]. ACS Omega, 2018, 3(6): 6091–6096.
DOI:10.1021/acsomega.8b00911 |
| [31] |
Biswas S, Poyraz A S, Meng Y, et al. Ion induced promotionof activity enhancement of mesoporous manganese oxides for aerobic oxidation reactions[J]. Appl Catal B-Environ, 2015, 165(C): 731–741.
|
| [32] |
Zhao Li-yuan(赵丽园). Study on the application of pyridinecarboxylic acid nitroxide ligands in the catalytic oxidation of alcohols and the oxidative ammination of alcohols to nitriles(吡啶甲酸类氮氧配体在催化醇氧化及醇氧化氨化制腈中的应用研究)[D]. Tianjing(天津): Hebei University of Technology(河北工业大学), 2017.
|
| [33] |
Zhang Gui-hua(张贵华). Copper-catalyzed aerobic alcoholoxidation into nitriles or aldehydes(铜催化醇有氧氧化制备腈和醛的反应研究)[D]. Hangzhou(杭州): Zhejiang University of Technology(浙江工业大学), 2016.
|
| [34] |
Shimojo H, Moriyama K, Togo H. Simple one-pot conversion of alcohols into nitriles[J]. Synthesis, 2013, 45(15): 2155–2164.
DOI:10.1055/s-0033-1338489 |
| [35] |
Yadav D, Bhanage B M. Copper-catalyzed synthesis of nitriles by aerobic oxidative reaction of alcohols and ammonium formate[J]. Eur J Org Chem, 2013, 2013(23): 5106–5110.
DOI:10.1002/ejoc.201300361 |
| [36] |
Molla R A, Ghosh K, Tuhina K, et al. An aerobic oxida-tive synthesis of aryl nitriles and primary aryl amides from benzylic alcohols catalyzed by a polymer supported Cu(Ⅱ) complex[J]. New J Chem, 2015, 39(2): 921–930.
DOI:10.1039/C4NJ01457J |
| [37] |
Jagadeesh R V, Junge H, Beller M. Green synthesis of nitriles using non-noble metal oxides-based nanocatalysts[J]. Nat Commun, 2014, 5(1): 1–8.
|
| [38] |
Shang S, Wang L, Dai W, et al. High catalytic activity of mesoporous Co-N/C catalysts for aerobic oxidative synthesis of nitriles[J]. Catal Sci Technol, 2016, 6(14): 5746–5753.
DOI:10.1039/C6CY00195E |
| [39] |
Sun K, Sun J, Lu G, et al. Enhanced catalytic activity of cobalt nanoparticles encapsulated with an N-doped porous carbon shell derived from hollow ZIF-8 for afficient synthesis of nitriles from primary alcohols in water[J]. Green Chem, 2019, 21(16): 4334–4434.
DOI:10.1039/C9GC01893J |
| [40] |
Sun K, Shan H, Neumann H, et al. Efficient iron single-atom catalysts for selective ammoxidation of alcohols to nitriles[J]. Nat Commun, 2022, 13(1): 1–9.
DOI:10.1038/s41467-021-27699-2 |
| [41] |
Ishida T, Watanabe H, Takei T, et al. Metal oxide-catalyzed ammoxidation of alcohols to nitriles and promotion effect of gold nanoparticles for one-pot amide synthesis[J]. Appl Catal A-Gen, 2012, 425/426: 85–90.
DOI:10.1016/j.apcata.2012.03.006 |
| [42] |
Wang H, Xu D, Guan E, et al. Atomically dispersed Ru on manganese oxide catalyst boosts oxidative cyanation[J]. ACS Catal, 2020, 10(11): 6299–6308.
DOI:10.1021/acscatal.0c00485 |
| [43] |
Zhang Y, Zhang Y, Feng C, et al. Amination of ethanol to acetonitrile over Ni-doped Co/γ-Al2O3 catalyst[J]. Catal Commun, 2009, 10(10): 1454–1458.
DOI:10.1016/j.catcom.2009.03.019 |
| [44] |
Feng C, Zhang Y, Zhang Y, et al. Study on alumina-supported cobalt-nickel oxide catalyst for synthesis of acetonitrile from ethanol[J]. Catal Lett, 2010, 141(1): 168–177.
|
| [45] |
Zhang D I, Zhang Y, Wen Y, et al. Intrinsic kinetics for the synthesis of acetonitrile form ethanol and ammonia over Co-Ni/γ-Al2O3 catalyst[J]. Chem Eng Res Des, 2011, 89(10): 2147–2152.
DOI:10.1016/j.cherd.2011.01.029 |
| [46] |
Zhang Y, Wei T, Pian Y, et al. Amination of allyl alcohol to propionitrile over a Zn30Cr4.5/γ-Al2O3 bimetallic catalyst via coupled dehydrogenation-hydrogenation reactions[J]. Appl Catal A-Gen, 2013, 467: 154–162.
DOI:10.1016/j.apcata.2013.07.026 |
 2022, Vol. 36
2022, Vol. 36


