2. 中国石油大学(北京)化学工程与环境学院, 北京 102249;
3. 中国石油石油化工研究院 大庆化工研究中心, 黑龙江 大庆, 163714
2. College of Chemical Engineering and Environment, China University of Petroleum, Beijing 102249, China;
3. Daqing Chemical Research Center, China Petroleum and Petrochemical Research Institute, Daqing 163714, China
丙烯是重要的化工产品, 也是衡量国家化工水平的重要指标之一. 丙烯下游产物用途广泛, 是三大合成材料(塑料、合成橡胶、合成纤维)的原料之一, 也是生产聚丙烯的重要原料. 目前丙烷脱氢制丙烯有3种途径: (1)单独丙烷进料直接脱氢(PDH); (2)丙烷有氧脱氢; (3)丙烷与温和的氧化剂(CO2)进料, 二氧化碳与丙烷脱氢后的H2反应, 产生CO和H2O(水煤气逆变化反应), 进而拉动丙烷转化[1]. 丙烷脱氢(PDH)反应是制丙烯的重要途径, 近年来产能逐渐扩大, 目前正引起广泛关注[2].
叶敏等[3]分析了丙烷脱氢中各反应的热力学性质以及平衡转化率, 分析了氢气和氧气燃烧放热与丙烷脱氢吸热之间的关系, 并且表明高温低压有利于反应正向进行. 蒲江龙等[4]利用Aspen对甲醇制烯烃反应进行了热力学模拟, 从热力学角度分析了反应温度和压力以及水量对反应的平衡产物体系影响. 范中宇等[5]建立了甲醇制烯烃网络, 结合Aspen中热力学平衡反应器和动力学反应器模块对MTO反应进行详细模拟. 齐国祯等[6]报道了甲醇制烯烃是强放热反应, 反应热在37~50 kJ/mol, 并且大部分反应都可以自发进行. 从反应热力学角度看, 丙烷脱氢属于强吸热反应, 高温有利于反应进行. 然而甲醇制烯烃是放热反应, 如果利用甲醇放热来拉动丙烷脱氢反应, 不仅可以降低反应温度还可以提高丙烷转化. 田海峰等[7]对丙烷与二氧化碳共进料体系热力学进行了模拟, 考察了各个反应的焓变、熵变、吉布斯自由能变化, 分析了工艺条件对反应的影响. 氧化剂对丙烷脱氢有很大影响, 使丙烯平衡生成量减少, 并且出现副产物甲烷、一氧化碳[8]. Layokun[9]和Chen等[10]研究了在氧气存在下丙烷脱氢反应性能, 认为氧气越多对丙烯生成越不利, 对丙烯构成竞争的产物就是甲烷和一氧化碳. 因此可以看出适当的含氧化合物可以拉动丙烷脱氢反应. 考虑到甲醇制烯烃(MTO)是放热反应, 丙烷脱氢是吸热反应[11], 加入甲醇作为丙烷的共反应物, 反应条件变得温和, 所需能耗更低, 同时可以解决高温带来的裂解反应. 丙烷脱氢反应温度均高于550 ℃. 然而高温会使丙烷脱氢反应中C-C键比C-H键更容易断裂, 丙烷很容易裂解成甲烷和乙烯[12]. 所以丙烷脱氢反应最大的难题是提高丙烯选择性, 选择性地活化C-H键, 从根本上抑制丙烷深度裂化形成副产物. Ruthwik等[13]研究了丙烷与CO2氧化脱氢耦合化学链燃烧的热力学分析, 提出了一种新型的丙烯生产环保方案, 该方案将丙烷氧化脱氢(ODP-CO2)和化学回路燃烧(CLC)集成在一起, 并具有固有CO2的双重优势, 避免了丙烷过度氧化. 此外, 通过回收多余的热量可产生用于发电的蒸汽. 使用ASPEN plus软件进行了严格的灵敏度分析, 以优化操作温度、压力和氧气载体、CO2和丙烷的摩尔流量, 从而使最大丙烯收率达到79.1%. Zangeneh等[14]使用约束吉布斯自由能最小化方法进行丙烷与二氧化碳脱氢的热力学分析, 模拟了对应于不同催化体系的不同反应网络, 包括非氧化还原和氧化还原氧化物催化剂, 研究了CO2/C3H8摩尔比(1~10)、温度(427~727 ℃)和压力(0.05~0.50 MPa) 对平衡转化率和产物组成的影响. Wu等[15]采用热力学方法对丙烷化学循环氧化脱氢(CL-ODHP) 工艺进行了可行性和能量分析, 结果表明经过一次氧化还原循环后, 可产生约100 kJ/mol的能量. 由此看出丙烷和二氧化碳脱氢具有可行性. Michorczyk等[16]研究了在CO2存在下丙烷脱氢成丙烯和合成气体系, 基于热力学计算和催化试验表明, 通过控制进料中的CO2浓度, 可以调节产物混合物中H2/CO(合成气)的摩尔比. 提出了DHP-CO2工艺与利用合成气的商业化化学工艺集成的几种不同途径. 由此可以看出氧化剂对丙烷脱氢具有可行性.
刘淑鹤等[17]分析了丙烷脱氢反应过程中热力学反应机理和动力学, 发现丙烷直接脱氢在热力学上受平衡转化率限制难以提高, 而氧化脱氢可以解决热力学平衡限制, 但选择性普遍较低.
刘博贤等[18]研究了在Pt纳米簇-Sn催化剂上丙烷脱氢本征动力学模型, 并对模型进行了显著性检验, 结果表明丙烷脱氢键断裂是控制步骤. 陈海松等[19]研究了在稀土改良的铬基催化剂体系上丙烷脱氢动力学, 在此催化剂上丙烷脱氢表观活化能为40.61 kJ/mol. 目前还没有报道甲醇作为氧化剂对丙烷脱氢动力学的影响.
甲醇作为与丙烷共同进料进行氧化脱氢, 不可避免会产生副产物, 因此分析丙烷甲醇热力学对催化剂设计以及能耗分析具有重要指导意义. 我们基于Gibbs最小自由能法建立丙烷甲醇共进料制烯烃产物热力学分析模型, 分析反应条件对平衡产物的影响, 基于Hess定律计算反应过程热效应, 分析优化了提高烯烃收率的工艺条件. 从热力学角度看, 高温下甲醇很容易生成一氧化碳[20], 但忽略了动力学因素在反应中的作用, 因此, 为了进一步研究添加甲醇对丙烷脱氢的促进作用, 我们研究了在Fe-Zn/Al2O3催化剂上丙烷共反应中的表观活化能, 设计了测定表观活化能的实验, 通过微分法直接测定反应速率, 进一步得出丙烷脱氢表观活化能实验数据.
1 实验部分 1.1 实验药品实验中使用的化学品如表 1所示.
| 表 1 主要实验药品 Table 1 Main experimental chemicals |
称取1.47 g九水硝酸铁和1.08 g六水硝酸锌溶于8 g去离子水中, 形成溶液A, 将上述溶液A浸渍在10 g Al2O3载体(喷球)上; 将上述半成品放置过夜, 之后放于120 ℃烘箱中烘干6 h; 最后置于马弗炉中程序升温焙烧, 以4 ℃/min条件升温到550 ℃, 保持4 h, 记作Fe-Zn/Al2O3.
1.3 催化剂活性评价催化剂的性能评价装置采用小型固定流化床反应装置. 催化剂装填1 g,原料气从反应装置顶部进入反应器, 与催化剂床层接触. 实验前先通氮气吹扫, 排除反应器内空气. 设置反应炉上、中、下3段的预设温度. 管芯温度达到所需要求后将氮气关闭, 切换为丙烷开始反应, 打开甲醇泵开关, 设置所需流量, 反应压力为0.1 MPa, 进料丙烷空速1 200 mL·gcat-1·h-1. 反应所得产物采用安捷伦7890B气相色谱仪在线分析. 待温度稳定后再继续反应10 min, 色谱开始在线采集, 气体产物一部分进入色谱在线分析, 其余被抽走. 其中TCD检测器检测氢气和甲烷, 采用阀切换系统, 总共三根色谱柱, 分别是60.96 cm porapak Q, 0.180~0.154 mm, 1.83 m Porapak Q 0.180~0.154 mm, 2.44 m分子筛, 0.280~0.180 mm, 载气采用氩气. 其次FID检测器采用双检测器, 利用中心切割技术, 第一根色谱柱HP-innowax检测甲醇以及C6-C10芳烃, 将C5以下的组分分离, 吹到第二根色谱柱氧化铝色谱柱分析C1-C5的烷烃, 载气是氮气. 柱箱起始温度50 ℃, 保持2 min后以10 ℃/min速率升到180 ℃, 再保持30 min.
2 结果分析与讨论 2.1 热力学分析 2.1.1 丙烷脱氢反应平衡转化率分析首先用Gibbs自由能最小法, 在实验条件下考察所有组分达到热力学平衡时的产物分布. 计算采用Aspen plus V8.6软件中的RGibbs反应器模块进行.
不考虑副产物生成, 对于丙烷脱氢反应(PDH)平衡转化率随反应温度变化如图 1红色曲线所示. 丙烷平衡转化率随反应温度升高而逐渐增加, 升温对反应有利. 添加甲醇后, 不考虑甲醇分解, 丙烷甲醇共进料制烯烃主要产物有H2、CH4、C2H6、C2H4、C3H6、H2O, 具体反应如下:
| $\mathrm{C}_3 \mathrm{H}_8=\mathrm{C}_3 \mathrm{H}_6+\mathrm{H}_2$ | (1) |
| $\mathrm{C}_3 \mathrm{H}_8=\mathrm{CH}_4+\mathrm{C}_2 \mathrm{H}_4$ | (2) |
| $2 \mathrm{CH}_3 \mathrm{OH}=\mathrm{C}_2 \mathrm{H}_4+2 \mathrm{H}_2 \mathrm{O}$ | (3) |
| $3 \mathrm{CH}_3 \mathrm{OH}=\mathrm{C}_3 \mathrm{H}_6+3 \mathrm{H}_2 \mathrm{O}$ | (4) |
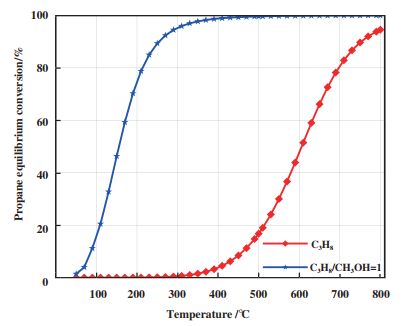
|
图 1 甲醇对丙烷平衡转化率影响 Fig.1 Effect of methanol on propane equilibrium conversion |
基于吉布斯自由能最小法, 计算在反应压力为0.1 MPa时, 丙烷和甲醇等摩尔进料, 不考虑甲醇分解的情况下, 丙烷平衡转化率与温度关系如图 1蓝色曲线所示. 可以看出在同样反应温度下, 添加甲醇后丙烷平衡转化率有了明显提高. 在400 ℃以后, 丙烷甲醇共进料反应中丙烷基本完全转化, 说明丙烷在高温时容易达到热力学平衡.
2.1.2 反应条件对平衡产物分布影响研究平衡产物分布对反应有更深入认识. 丙烷与甲醇共进料反应中存在吸热和放热反应, 高温也会带来甲醇分解等问题, 因此产物中可能存在CO、H2、CO2和H2O, 采用RGibbs反应器在标准压力(0.1 MPa)下, 通过改变进料中丙烷和甲醇摩尔流量, 计算产物中各组分平衡分布.
图 2是丙烷甲醇共进料制烯烃反应中进料摩尔比对平衡产物的影响, 可以看出平衡产物中丙烯的摩尔分数随着温度先升后降, 说明温度升高到一定程度后丙烷容易裂解成甲烷; 平衡产物中丙烯的摩尔分数随着丙烷甲醇进料中丙烷摩尔比增高而增高, 说明甲醇的加入有利于丙烷裂解. 当丙烷∶甲醇摩尔比为32时, 丙烯摩尔分数均显著提高, 因此少量添加甲醇, 在热力学上有利于丙烯生成. 当甲醇过量后, 反应体系反应热过大, 丙烷可能裂解成甲烷和乙烯, 甲醇也有可能分解成一氧化碳和氢气. 在反应温度337 ℃以后, 丙烯摩尔分数下降的原因是产物中甲烷和其他产物增多造成的. 图 2(b)是丙烷甲醇共进料制烯烃反应中进料摩尔比对反应产物中乙烯摩尔分数影响, 图 2(c)是丙烷甲醇共进料制烯烃反应中进料摩尔比对反应产物中CH4摩尔分数影响. 可以看出反应温度在300 ℃以后C2H4平衡产物开始增加, 然而CH4摩尔分数基本保持不变, 由于1 mol的丙烷裂成C2H4, 会产生1 mol的CH4, 说明C2H4增多的原因不是丙烷分解成C2H4和CH4. 由图 2(c)可知产物中甲烷的摩尔分数随着进料中甲醇的增加而增加, 这说明过量的甲醇会使反应体系热量过剩造成丙烷深度脱氢生成甲烷副产物, 这和氧气对丙烷脱氢反应体系热力学过程类似, 过量氧气会使反应体系产生一氧化碳、二氧化碳、甲烷等副产物[10]. 图 2(d)是丙烷甲醇共进料制烯烃反应中进料摩尔比对反应产物中CO摩尔分数的影响. 平衡产物中CO摩尔分数随着进料中丙烷和甲醇摩尔比的增大而减小, 这和之前的分析是对应的, 过量的甲醇会使反应热效应增大, 甲醇很容易分解成CO.
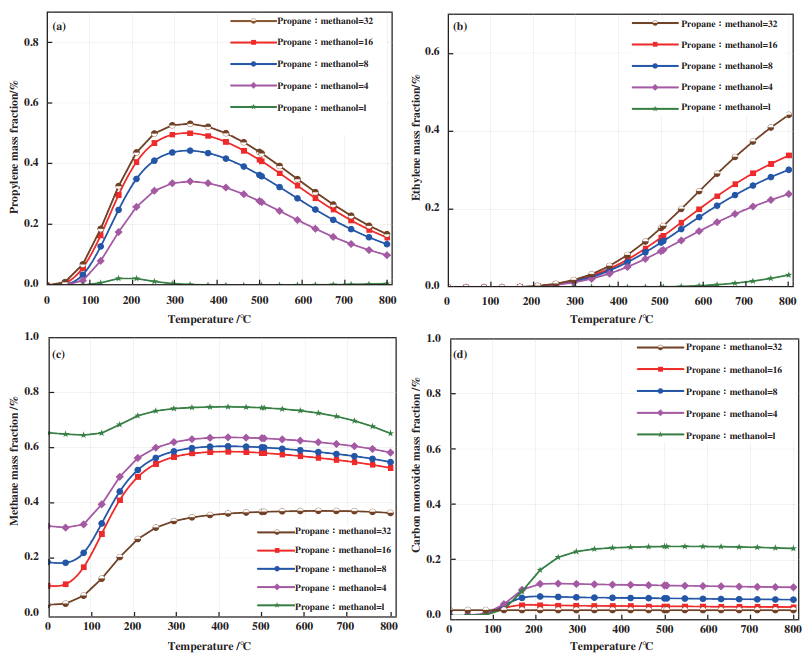
|
图 2 (a) 丙烷甲醇进料摩尔比对平衡产物丙烯影响; (b) 进料摩尔比对平衡产物乙烯影响; (c) 丙烷甲醇进料摩尔比对平衡产物甲烷影响; (d) 进料摩尔比对平衡产物一氧化碳影响 Fig.2 (a) Effect of feed mole ratio on equilibrium product propylene; (b) Influence of feed mole ratio on equilibrium product ethylene; (c) Influence of feed mole ratio on equilibrium product methane; (d) Influence of feed mole ratio on equilibrium product carbon monoxide |
表 2是丙烷直接脱氢制丙烯(C3H8 = C3H6 + H2)的平衡产物分布, 在反应温度为600 ℃, 标准压力为0.1 MPa时, 丙烷平衡转化率为47.41%, 丙烯选择性为95.45%(质量分数), 反应热为117.8 kJ·mol-1; 如果考虑丙烷裂解和脱氢同时发生, 平衡产物分布如表 3所示, 丙烷脱氢制丙烯代表丙烷C-H键断裂程度, 对于丙烷裂解反应(C3H8 = CH4 + CH4)代表丙烷C-C键断裂程度, 同样在反应温度600 ℃, 标准压力为0.1 MPa, 丙烷进料为1 kmol·h-1时, 丙烷平衡转化率为99.81%, 丙烯选择性为36.36%(质量分数), 甲烷选择性为35.56%(质量分数), 乙烯选择性为26.72%, 反应热为110.38 kJ·mol-1, 丙烷C-C键比C-H更容易断裂, 催化剂更容易结焦失活, 因此丙烷脱氢需要开发高选择性、高活性的催化剂, 同时还需要催化剂具有高温稳定性.
| 表 2 丙烷脱氢制丙烯进料平衡产物物料平衡(热力学计算值) Table 2 Propane dehydrogenation to propylene feed balance Product material balance(Thermodynamic calculation value) |
| 表 3 丙烷脱氢制丙烯和丙烷裂解反应的进料平衡产物物料平衡(热力学计算值) Table 3 Propane dehydrogenation to propylene and feed balance of propane cracking reaction material balance of products(Thermodynamic calculation value) |
对于热效应显著的反应, 需要关注各个反应的耦合程度, 充分利用化学反应热量来达到产物最大化, 同时降低反应温度, 提高催化剂稳定性. 考虑到甲醇制烯烃(MTO)是强放热反应, 如果利用甲醇放出的热量带动丙烷脱氢, 不仅可以降低反应温度还能减少能耗. 丙烷甲醇进料摩尔比对反应中平衡产物分布有很大影响, 表 4是丙烷甲醇不同摩尔比对平衡产物的影响, 同时进料摩尔比对反应热影响至关重要.
| 表 4 丙烷甲醇不同摩尔比进料时平衡产物物料平衡 Table 4 Equilibrium product material balance of propane methanol feed with different mole ratio |
反应热计算如下[7]:
| $Q_r=\varSigma x_i \Delta_t H_{p i}-\Delta_t H_F$ | (5) |
式中: Qr为产品的反应热, kJ·mol-1; ΔrHpi为产品中i组分的生成焓, kJ·mol-1; ΔrHF为原料的生成焓, kJ·mol-1; xi为产物中i组分的质量分数.
如表 4所示, 丙烷甲醇等摩尔进料时, 平衡产物中大部分是CO和CH4, 丙烯收率仅0.049%(质量分数), 丙烷甲醇摩尔比为32时, 丙烯平衡收率有显著提高, 达到43.90%(质量分数). 甲醇的添加量对反应的平衡组成有很大影响, 过量的甲醇会使反应体系热量过剩, 更容易生成甲烷、一氧化碳等产物, 这是因为丙烷C-C键更容易断裂生成CH4或者C2H4, 甲醇也更容易分解成CO和H2, 适量的甲醇就可以带动丙烷脱氢转化.
2.1.3 优化反应条件丙烷甲醇共反应过程和反应温度、反应压力、丙烷甲醇进料摩尔比有关, 为了确定最佳工艺条件, 结合吉布斯自由能最小法和响应面设计法来确定操作条件范围内生产所需产品产量最大化.
对反应温度、反应压力、丙烷甲醇进料摩尔比作为3个操作变量, 平衡产物中丙烯摩尔分数作为响应值, 采用二元二次交互回归方程来拟合因素与响应值的关系, 通过回归方程分析寻求最佳操作变量.
| $y_1=A_1 x_1^2+B_1 x_2^2+C_1 x_1+D_1 x_2+E_1 x_1 x_2+F_1$ | (6) |
| $y_2=A_2 x_2^2+B_2 x_3^2+C_2 x_2+D_2 x_3+E_2 x_2 x_3+F_2$ | (7) |
| $y_3=A_3 x_1^2+B_3 x_3^2+C_3 x_1+D_3 x_3+E_3 x_1 x_3+F_3$ | (8) |
式中: y为平衡产物中丙烯的摩尔分数, x1为反应温度, ℃, x2为反应压力, MPa, x3为丙烷甲醇进料摩尔比.
首先分析反应温度和反应压力对平衡产物的影响, 利用Aspen plus灵敏度分析得到离散数据, 再用Matlab拟合方程(5)得到方程的具体表达式, 同理分析方程(6)和方程(7).
温度范围选取200~700 ℃, 压力范围0.1~2.0 MPa, 丙烷甲醇进料摩尔比为16, RGibbs反应器计算平衡组成.
y1 = -1.585e - 06x12 - 0.000 108 8x22 + 0.001 125x1 -0.006 393x2 + 1.982e - 0.5x1x2 + 0.101 2
选取压力范围0.1~2.0 MPa, 丙烷甲醇进料摩尔比为0.5~20, 反应温度500 ℃, RGibbs反应器计算平衡组成.
y2 = -0.001 098x22 - 0.000 165x32 + 0.033 5x2 + 0.004 477x3 + 5.451e - 0.5x2x3 + 0.008 04
温度范围选取200~700 ℃, 丙烷甲醇进料摩尔比0~20, 压力0.1 MPa, RGibbs反应器计算平衡组成.
y3 = -1.02e - 0.6x12 -0.000 712 6x32 + 0.007 047x1 +0.028 41x3 - 1.076e - 0.5x1x3 - 0.027 32
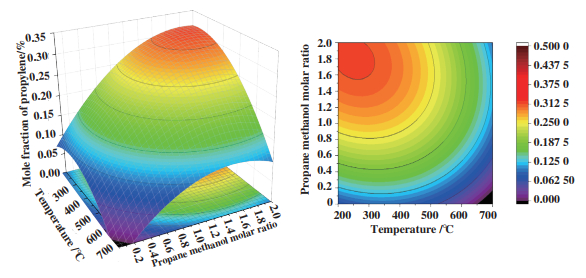
图 3是反应温度和反应压力对丙烯平衡产物的影响, 当丙烷甲醇进料摩尔比固定为16时, 可以看出在温度为350~400 ℃时, 压力在0.4~0.9 MPa范围内, 平衡产物中丙烯摩尔分数基本维持在0.3. 图 4是丙烷甲醇摩尔比和反应压力对丙烯平衡产物的影响, 当温度固定在500 ℃时, 丙烷甲醇进料摩尔比在15~16, 压力在1.6~1.8 MPa范围内, 平衡产物中丙烯摩尔分数基本维持在0.3. 图 5是丙烷甲醇摩尔比和反应温度对丙烯平衡产物的影响, 温度在200~400 ℃, 丙烷甲醇进料摩尔比在16~20, 反应压力为0.1 MPa, 平衡产物中丙烯摩尔分数基本维持在0.3. 通过吉布斯自由能最小计算了反应过程中平衡产物的含量, 再将响应面统计法应用在热力学平衡中, 可以清晰地理解操作条件对反应的影响以及最佳工艺条件, 从而对反应有了深入认识, 图 5是对最佳工艺条件的总结.
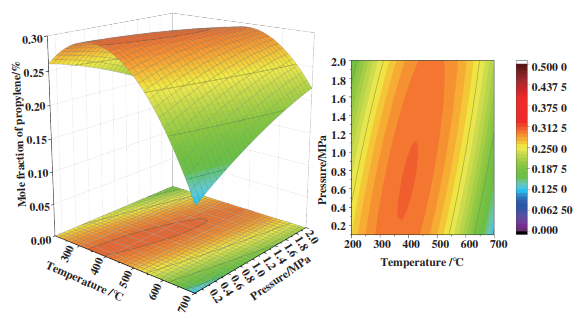
|
图 3 温度、压力对丙烯摩尔分数影响 Fig.3 Mole fraction of propylene based on temperature and pressure |
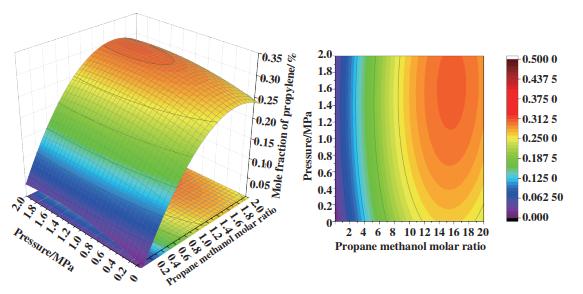
|
图 4 丙烷甲醇摩尔比、压力对丙烯摩尔分数影响 Fig.4 Mole fraction of propylene based on propane and methanol molar ratio and pressure |
|
图 5 温度、丙烷甲醇摩尔比对丙烯摩尔分数影响 Fig.5 Mole fraction of propylene based on temperature and propane methanol molar ratio |
| 表 5 最优工艺解 Table 5 Optimal process solution |
丙烷甲醇共进料催化脱氢动力学实验是在440~500 ℃范围内进行的, 丙烷在此温度下转化率较低(< 20%), 根据反应动力学可知,在一定条件下丙烷反应速率与转化率成正比, 因此测定不同反应温度下丙烷转化率可以计算得到丙烷脱氢表观活化能. 实验条件: 装填1 g Fe-Zn/Al2O3催化剂, 丙烷甲醇摩尔比为4∶1, 丙烷空速1 200 mL·(g·h)-1.
丙烯形成速率公式:
| $r=\frac{Yield\times D}{M_{c a t}}$ | (9) |
Arrhenius方程:
| $r=A e^{-E a / R T}$ | (10) |
D是丙烷进料流量mol·h-1, Mcat是催化剂质量, 催化剂动力学数据在固定流化床反应器上测得, 通过Arrhenius方程计算表观活化能. 方程两边取对数, Inr与1/T是线性关系.
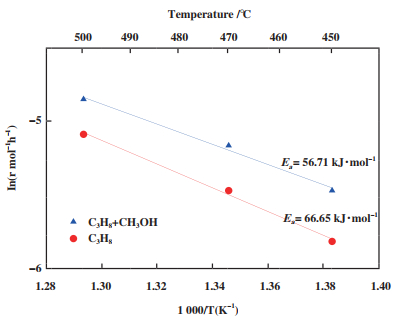
温度在450、470、500 ℃下, 分别考察丙烷单独进料和丙烷甲醇共进料下脱氢反应活性, 评价数据如表 6和表 7所示, 进一步得到丙烯生成速率, 通过Arrhenius方程得出两种反应表观活化能如图 6所示.
| 表 6 丙烷进料催化剂活性评价数据(丙烷空速1 200 mL·g-1·h-1), 丙烷甲醇进料摩尔比为4) Table 6 Activity evaluation data of propane feed catalyst (propane space velocity 1 200 mL·g-1·h-1), propane methanol feed molar ratio 4) |
| 表 7 丙烷甲醇进料催化剂活性评价数据(丙烷空速1 200 mL·g-1·h-1, 丙烷甲醇进料摩尔比4) Table 7 Activity evaluation data of propane and methanol feed catalyst (propane space velocity 1 200 mL·g-1·h-1), propane methanol feed molar ratio 4) |
|
图 6 添加甲醇在丙烷脱氢过程中的转化动力学 Fig.6 Conversion kinetics of methanol in propane dehydrogenation process |
由图 6可知, 在丙烷直接脱氢反应中表观活化能为66.65 kJ·mol-1, 当添加甲醇后, 丙烷脱氢反应活化能降低到56.71 kJ·mol-1, 由此可知甲醇不仅在热力学上有利于丙烷脱氢, 从动力学角度看甲醇也可以降低丙烷脱氢反应能垒, 反应更容易进行.
3 结论 3.1丙烷脱氢反应属于强吸热且体积增大反应, 高温低压有利于丙烷脱氢正向进行, 为了提高丙烯收率, 丙烷直接脱氢反应温度需要高于550 ℃; 丙烷甲醇等摩尔进料时, 在400 ℃以后, 丙烷甲醇共进料反应中丙烷基本完全转化, 说明丙烷转化是不受热力学控制的.
3.2从热力学角度看, 丙烷甲醇摩尔比增大, 可以减少丙烷和甲醇裂解反应, 同时提高平衡产物中丙烯摩尔分数, 有利于丙烷C-H键断裂.
3.3反应温度、反应压力、丙烷甲醇摩尔比对反应平衡产物有很大影响, 采用响应面分析法构建了反应条件与平衡产物中丙烯摩尔分数的函数关系, 得到了最佳工艺条件范围.
3.4从催化动力学实验表明, 甲醇的添加可以降低丙烷脱氢转化的活化能垒, 使反应更容易进行.
符号说明:
HF 进料生成焓, kJ·mol-1
Hpi 产品中 i 组分的生成焓, kJ·mol-1
Qr 反应热, kJ·mol-1
x1 反应温度, ℃
x2 反应压力, MPa
x3 丙烷甲醇进料摩尔比
y 产物中丙烯摩尔分数
| [1] |
a. Yan W F, Sun Q M, Yu J H. Dehydrogenation of propane marches on [J]. Matter, 2021, 4(8): 2642-2644. b. Pan Yin-yin(潘茵茵), Song Guang-jie(宋广杰), Xue Kuan-rong(薛宽荣), et al. The development of hydroformylation of alkenes and alkynes with syngas substitutes(非合成气法烯烃、炔烃氢甲酰化研究进展)[J]. J Mol Catal(China)(分子催化), 2021, 35(2): 166-177.
|
| [2] |
Ouyang Su-fang(欧阳素芳), Fang Zhi-ping(方志平). Devel-opment status of propane dehydrogenation technology(丙烷脱氢技术发展现状)[J]. Petrochem Technol(石油化工), 2022, 51(7): 823–830.
DOI:10.3969/j.issn.1000-8144.2022.07.014 |
| [3] |
Ye Min(叶敏), Li Xian(李贤). Thermodynamic analysis of propane dehydrogenation to propylene(丙烷脱氢氧化制丙烯热力学分析)[J]. J Chem Ind Eng(化学工业与工程技术), 2011, 32(6): 18–21.
DOI:10.3969/j.issn.1006-7906.2011.06.006 |
| [4] |
Pu Jiang-long(蒲江龙), Weng Hui-xin(翁惠新). Thermo-dynamic calculation and analysis of methanol to olefin system(甲醇制烯烃体系的热力学计算与分析)[J]. Petrochem Technol(石油化工), 2013, 42(11): 1229–1234.
|
| [5] |
Fan Zhong-yu(范中宇), Zhou Yu-hang(周宇航), Cao Lin(曹琳), et al. Simulation strategy and parameter analysis ofmethanol to olefins reaction process(甲醇制烯烃反应过程的模拟策略及参数分析)[J]. Petrochem Technol(石油化工), 2020, 49(8): 797–802.
|
| [6] |
Qi Guo-zhen(齐国祯), Xie Zai-ku(谢在库), Zhong Si-qing(钟思青), et al. Thermodynamic study of methanol to lightolefins (MTO) reaction(甲醇制低碳烯烃(MTO)反应热力学研究)[J]. Chem Eng Oil Gas(石油与天然气化工), 2005, 34(5): 349–353.
|
| [7] |
Tian Hai-feng(田海峰), Liao Jian-kang(廖建康), Zha Fei(查飞), et al. Thermodynamic simulation of propane and carbon dioxide coupling to propylene(丙烷与二氧化碳耦合制丙烯的热力学模拟研究)[J]. J Northwestn Norm Univ, Nat Sci(西北师范大学学报(自然科学版)), 2019, 55(2): 94–99.
|
| [8] |
Lin Shao-bo(林少波), Shan Yu-ling(单玉领), Sui Zhi-jun(隋志军), et al. Thermodynamic analysis of the effect of oxygen on propane dehydrogenation reaction system(氧对丙烷脱氢反应体系影响的热力学分析)[J]. Chem Ind Eng Prog(化工进展), 2015, 34(4): 970–975.
|
| [9] |
Layokun S K. Oxidative pyrolysis of propane[J]. Ind Eng Chem Process Des Dev, 1979, 18(2): 241–245.
|
| [10] |
Chen L, Ding J S, Jia J B, et al. Cobalt-doped MnO2 nano-fibers for enhanced propane oxidation[J]. ACS Appl Nano Mater, 2019, 2(7): 4417–4426.
|
| [11] |
Zhang Bao-zhu(张宝珠), Zhao Wen-ping(赵文平), Wang Gui-ru(王桂茹), et al. Thermodynamic study of methanol to hydrocarbon (MTH) reaction(甲醇制烃(MTH)反应热力学研究)[J]. J Mol Catal(China)(分子催化), 2012, 26(6): 546–553.
|
| [12] |
Xu Zhi-kang(徐志康), Huang Jia-lu(黄佳露), Wang Ting-hai(王廷海), et al. Research progress of catalysts for propane dehydrogenation to propylene(丙烷脱氢制丙烯催化剂的研究进展)[J]. Chem Ind Eng Prog(化工进展), 2021, 40(4): 1893–1916.
|
| [13] |
Ruthwik N, Kavya D, Shadab A, et al. Thermodynamic analysis of chemical looping combustion integrated oxidative dehydrogenation of propane to propylene with CO2[J]. Chem Eng Process, 2020, 153: 107959.
|
| [14] |
Zangeneh F T, Taeb A, Gholivand K, et al. Therm-odynamic equilibrium analysis of propane dehydrog-enation with carbon dioxide and side reactions[J]. Chem Eng Commun, 2016, 203(4): 557–565.
|
| [15] |
Wu T W, Yu Q B, Qin Q. Energy analysis of chemical loopingoxidative dehydrogenation of propane[J]. Pet Sci Technol, 2018, 36(4): 266–272.
|
| [16] |
Michorczyk P, Zeńczak K, Niekurzak R, et al. Dehydrog-enation of propane with CO2-a new green process for propene and synthesis gas production[J]. Pol J Chem Technol, 2012, 14(4): 77–82.
|
| [17] |
Liu Shu-he(刘淑鹤), Fang Xiang-chen(方向晨), Zhang Xi-wen(张喜文), et al. Research progress in catalytic reactionmechanism and kinetics of propane dehydrogenation(丙烷脱氢催化反应机理及动力学研究进展)[J]. Chem Ind Eng Pro(化工进展), 2009, 28(2): 259–266.
|
| [18] |
Liu Bo-xian(刘博贤), Hou Kai-hu(侯凯湖), Xu Zhi-dong(徐志东). Intrinsic kinetics of propane dehydrog-enation over Pt nanocluster-Sn catalyst(Pt纳米簇-Sn催化剂上丙烷脱氢反应本征动力学)[J]. Chem Eng Oil Gas(石油与天然气化工), 2009, 38(3): 179–182.
|
| [19] |
Chen Hai-song(陈海松), Yu Li-xin(余立新), Xu Hai-sheng(徐海升), et al. Macrokinetics of propane dehydrogenation on chromium aluminum catalyst modified by rare earth promoter(稀土助剂改良的铬铝催化剂上丙烷脱氢宏观动力学)[J]. J Chem Eng Chin Univer(高校化学工程学报), 1999, 13(1): 39–44.
|
| [20] |
Rodrigues C T, de Lopes G F, de Souza T L, et al. Methanoland dimethyl ether steam reforming: A thermodynamic analysis[J]. Braz J Chem Eng, 2022, 39(4): 1–15.
|
 2023, Vol. 37
2023, Vol. 37


