大规模消耗化石燃料导致排放到大气层中的CO2剧增, 随之带来的是全球变暖、海平面上升、酸雨等严重的气候变化[1]. 通过光催化的手段将CO2转化成CO、CH4、CH3OH等化学物质或太阳能燃料, 不仅能部分解决大气中CO2含量偏高的问题, 同时还可以减轻全球能源危机[2-3]. 然而, 由于CO2和H2O的热力学稳定性, 光催化CO2还原的选择性和产率较低[4]. 如何促进光催化剂的电荷分离和传输, 成为开发高效催化剂的关键因素.
目前可用作光催化剂的物质有贵金属半导体、硫化物、金属氧化物以及非金属半导体等[5], 其中, g-C3N4廉价易得、对环境友好, 同时具有独特的能带结构(2.7 eV)和稳定的物理化学性质, 可以实现在可见光下光催化反应, 因此受到了众多研究者的青睐[6]. 但是g-C3N4的光催化剂活性主要来源于π共轭结构, 这种结构导致电荷载流子的复合较快、光的吸收和利用不足. 为了提高g-C3N4的光催化效率, 研究人员尝试了各种办法来解决此类问题, 例如g-C3N4纳米片化、提高g-C3N4的孔隙率以及进行杂原子掺杂, 其中掺杂是一种较为简单且有效的方法. 例如, 使用H2O2热处理g-C3N4, 用O取代sp2杂化N原子, 增加离域π键的电子, 可使导带带值下降0.21 eV, 进而增加了对可见光的吸收范围和电子分离率[7]. Hou等[8]使用尿素和过硫酸钾(K2S2O8)作为前驱体, 制备了K、O共掺杂的g-C3N4, 制备好的材料致密状表面结构, 具有~1.5 nm的超薄厚度, 大大降低了薄膜的厚度, 电荷传输距离增大, 提高了电子传输能力; 此外共掺杂也优化带隙结构, 扩大了光吸收范围. Xu等制备了Mn/O共掺杂的g-C3N4, 改善后的光催化剂对可见光利用率明显提升, 在Mn和O的协同作用下, 催化剂光致载流子均可加速分离和转移[9].
使用尿素和KMnO4为前驱体, 通过简单的一步热聚合法构建了K、Mn共掺杂g-C3N4复合材料并应用于CO2还原, 通过TEM、XRD、XPS等表征探讨了K、Mn共掺杂g-C3N4光催化效率比纯g-C3N4光催化效率提高的原因.
1 实验部分 1.1 实验原料和试剂我们所用试剂的纯度均为分析纯, 购买得到的试剂直接使用、没有经过进一步处理. 尿素(分析纯, 阿拉丁); 高锰酸钾(分析纯, 国药); 高纯CO2(滨州市三和气体有限责任公司).
1.2 材料制备采用一步热聚合法制备了g-C3N4: 将30 g尿素放置于加盖的氧化铝陶瓷方舟中, 在空气中加热至550 ℃, 加热2 h, 升温速率为5 ℃· min-1. 降至室温, 将g-C3N4磨细后收集, 记为CN.
K-Mn共掺杂g-C3N4制备过程如下: 称取30 g尿素与一定量的KMnO4一并放于研钵中, 研磨至充分混合. 将混合物转移至加盖的氧化铝陶瓷方舟中并用铝箔密封. 在空气气氛中加热至550 ℃, 加热2 h, 升温速率为5 ℃·min-1. 用去离子水彻底清洗几次除去可溶性物质, 最后在80 ℃下干燥12 h得到粉末, 磨细后收集. 将制备得到的光催化材料标记为K-Mn-CN-x(x=0.4、0.8、1.2), 其中x代表加入KMnO4的量, 单位为g.
1.3 材料的表征选用Bruker D8 Advance X射线衍射仪来测试材料的广角XRD, Cu Ka射线为光源, 扫描速度为4(°)/min. 催化剂表面元素的化学组成和化学态用Thermon Scientific公司的Escalab 250Xi光电子能谱仪进行分析实验, 采用Mg靶(hv = eV), 12 kV, 12 mA, 真空度2×10-6 Pa, 以沾污碳C 1s结合能284.6 eV作为结合能的校正标准. 催化剂形貌由日本公司的JEM-2100F型透射电子显微镜得到. 紫外-可见吸收光谱由UV-3101 PC紫外可见分光光度计以BaSO4为标准物质在波长为200~800 nm时扫描得到. 催化剂的荧光特性则由FLS980荧光分析仪来表征, 激发光波长为350 nm. C、N、O元素分析是在Flash 2000系列元素分析仪上进行的. K、Mn则通过Agilent 720/7700系列电感耦合等离子体质谱仪得到. N2-低温物理吸附在ASAP 2010型气体吸附仪(USA Micromeritics)上于-196 ℃进行. 红外(IR)谱图由Nicolet-460仪器上获得. 光电化学(PEC)测试在ZS90电化学工作站上进行.
1.4 光催化活性测试CO2光催化还原反应在一个容积为500 mL、气密性良好的高硼硅玻璃容器(泊菲莱公司, 北京)中进行, 容器上方的盖子由透光性能良好的石英玻璃制备. 实验开始前, 样品置于200 ℃的烘箱中处理2 h除去催化剂表面上可能存在的污染物. 称取50 mg光催化剂, 均匀地分散在直径3 cm圆形玻璃皿中. 用高纯N2置换反应器中空气0.5 h, 然后改用高纯CO2 (99.99%)气体置换反应器中的N2, 气体通过装有蒸馏水的洗气瓶产生水蒸气. 以300 W的氙弧灯(中教金源, 北京)为光源, 通过循环冷却水将反应体系的温度控制在30 ℃, 活性测试过程中, 每小时从反应器中抽取1 mL气体, 将其注入气相色谱中分析检测CH4以及其它的含碳气体化合物, 选用N2为载气、氢火焰检测器(FID)为检测器、5A分子筛和TDX-01填充柱为色谱柱.
2 实验结果与讨论 2.1 样品TEM表征通过TEM对样品K-Mn-CN-0.8的微观形貌进行分析, 如图 1(a)所示, 样品呈纳米片结构, 并且纳米片表面较为紧凑和光滑, 这可能是KMnO4在分解过程中抑制了NH3的产生[10]. g-C3N4的二维纳米片可有效抑制光生载流子的复合, 进而有益于光催化效率的提高[11]. 图 1(b)-(h)为样品K-Mn-CN-0.8对应的Mapping谱图, 谱图说明K、Mn和O均匀分布在整个连续的C、N元素背景上[9].

|
图 1 样品K-Mn-CN-0.8的TEM图及对应的元素Mapping谱图 Fig.1 TEM of K-Mn-CN-0.8 and corresponding element mapping |
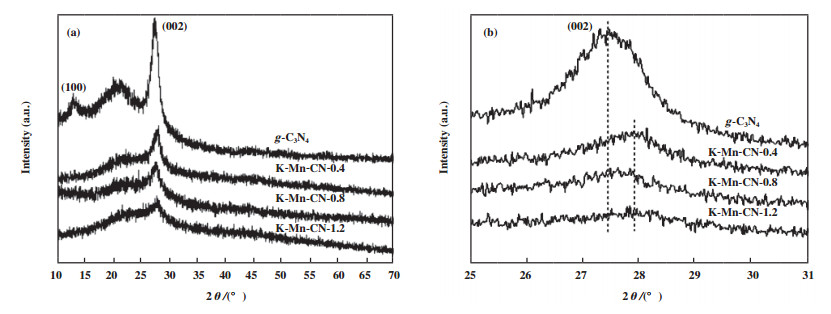
使用X-衍射对g-C3N4及K-Mn-CN-x进行物相分析, 如图 2所示. 由图 2(a)可以看出, 12.9°和27.3°处的峰分别属于g-C3N4的(100)和(002)晶面的衍射峰[12], 同时在21.2°出现一个较为明显的峰, 这可能是在焙烧过程中部分g-C3N4以非晶相的形式存在[13]. 而KMnO4的加入致使(001)处的峰消失, 同时削弱了21.2°处的衍射峰, 表明KMnO4的加入致使g-C3N4在形成过程中面内结构规律发生了改变. 与g-C3N4相比, K-Mn-CN-0.8的峰从27.3°转移到27.8°左右, 这是由于g-C3N4层间距减少, 各层之间叠加更加密集所致[14], 如图 2(b)所示. 值得注意的是, XRD谱图中没有检测到与K和Mn有关的峰, 这是因为在样品形成过程中K、Mn进入到g-C3N4的框架中通过化学反应形成K-N/Mn-N键或含量较少低于检测线[15].
|
图 2 催化剂的XRD谱图: 10°~70°(a), 25°~31°(b) Fig.2 10°~70°(a) and 25°~31°(b) XRD spectra of the catalysts |
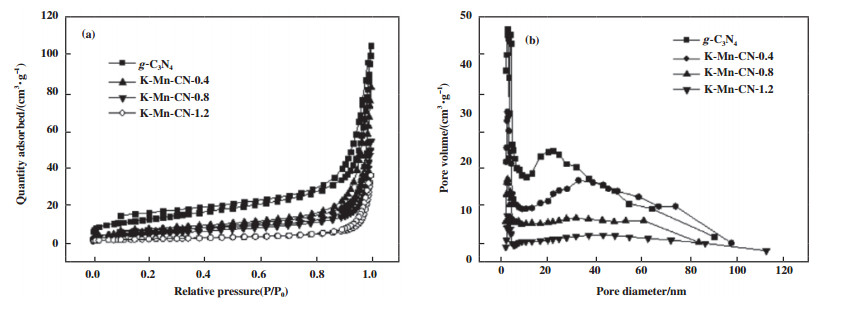
样品g-C3N4、K-Mn-CN-x的低温氮气物理吸附测定的织构性质结果如图 3所示. 从图 3(a)等温线可知, 所有样品的吸脱附等温线均表现出典型的Ⅳ型等温线特征并表现出H3型滞后环特点, 表明所有样品中均存在介孔结构, 由图 3(b)可知, 所有样品的孔主要集中在2~60 nm范围内.
|
图 3 催化剂的N2吸脱附热力学谱图(a)与孔径分布(b) Fig.3 N2 adsorption desorption thermodynamic spectra (a) and pore size distribution (b) of the catalysts |
随着KMnO4含量的增加, 样品的表面积和孔容逐渐降低, 但是孔径却随之增加, 如表 1所示. KMnO4分解后会产生Mn的氧化物, 堵塞g-C3N4的部分小孔, 致使催化剂比表面积、孔容减小, 而小孔的消失导致催化剂平均孔径增大.
| 表 1 催化剂的物理性质 Table 1 Physical properties of the catalysts |
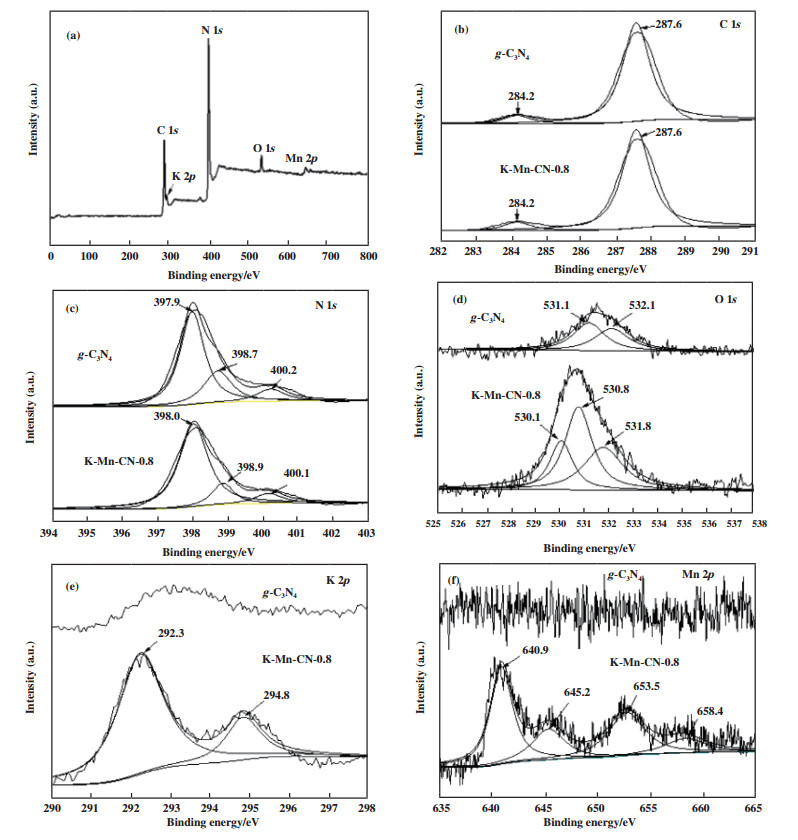
为了进一步探究纳米复合材料K-Mn-CN-0.8中表面元素的化学状态, 使用X-射线光电子能谱仪对样品g-C3N4、K-Mn-CN-0.8进行分析测试. 所有元素的电子结合能用C 1s 284.6 eV为基准进行校正. 如图 4(a)所示, K-Mn-CN-0.8中元素有C、N、O、K和Mn. 图 4(b)为C 1s的高分辨谱图, C 1s的XPS谱图可以被拟合为两个峰, 284.6 eV处的峰对应材料表面吸附的碳元素, 287.6 eV处的峰对应g-C3N4材料三嗪环(N-C=N)中sp2杂化的碳元素[16]. 由图 4(c)可知,g-C3N4的N 1s光谱中397.9 eV的峰归属于芳香C、N杂环中的双配位N原子(C-N=C)、398.7 eV归属于N-(C)3中的季氮, 而400.2 eV则归属于表面氨基(C-N-H)的N原子[17]. 材料K-Mn-CN-0.8中的N 1s光谱虽有微小的变动, 但基本也归属于以上3种情况, 表明KMnO4的加入并没有对g-C3N4中N原子的结构产生影响. 在图 4(d)中, g-C3N4的O 1s光谱在531.1和532.1 eV处出现峰, 分别归属于C-O和O-H中O的峰; 样品K-Mn-CN-0.8在530.1 eV出现峰, 可归属于晶格氧的1s峰, 这可能是样品中有金属氧化物的存在[18-19]. 而其C-O和O-H中O的峰强度有所增强, 这可能是KMnO4在分解过程中产生更多的O进入到g-C3N4结构中形成更多的C-O键, 同时由于K、Mn的存在, 使得电子密度有所增加, 进而致使峰的数值产生负移. 由Flash元素分析可知(见表 2), K-Mn-CN-x中氧元素占比并未增加, 这可能是由于K、Mn的加入稀释了O的占比. 由图 4(e)可知, 与g-C3N4相比, K-Mn-CN-0.8在292.3和294.8 eV具有两个较为明显的峰, 这归属于K 2p谱, 而在292.3 eV的峰可能是由于KN3的形成, g-C3N4在形成过程中, 其中的氨基基团与KMnO4中分解出的K+在高温下发生相互作用, 形成N-K键[20], 而通过ICP分析可知, K的含量逐步上升, 如表 2所示. 而同样, K-Mn-CN-0.8显示了分别符合Mn 2p3/2和Mn 2p1/2的双峰, 640.9和645.2 eV处的两个峰属于Mn3+和Mn4+的2p3/2的峰, 而653.5和658.4 eV处的两个峰属于Mn3+和Mn4+的2p1/2峰, 如图 4(f)所示, 这一结果表明, Mn元素以Mn3+、Mn4+的高价态共存于样品中, 其中Mn3+可能通过化学反应在CN骨架中形成Mn-N键[9]. 值得注意的是, 在530.1 eV处的O 1s峰和Mn4+的特征峰表明样品K-Mn-CN-0.8中有MnO2存在[19].
|
图 4 g-C3N4和K-Mn-CN-0.8的X射线光电子能谱(a); 以及C 1s(b), N 1s(c), O 1s(c), K 2p(e)和Mn 2p(f) Fig.4 High-resolution XPS spectra of g-C3N4 and K-Mn-CN-0.8, high-resolution spectra of C 1s(b), N 1s(c), O 1s(c), K 2p(e) and Mn 2p(f) |
| 表 2 催化剂的元素分析及ICP分析结果 Table 2 Elemental analysis results and the ICP analysis for various samples |
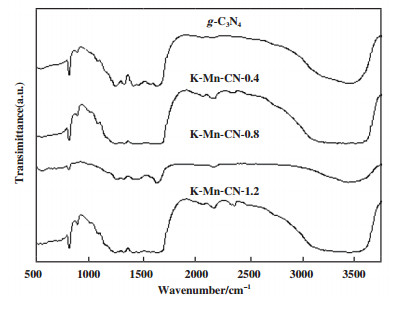
如图 5所示, 所有样品在1 200~1 700 cm-1范围内均出现较强的吸收峰, 其中, 1 680 cm-1处的吸收峰对应于C-N的伸缩振动, 而1 520 cm-1处的峰对应于芳环的C-N振动, 1 200 ~1 400 cm-1则对应于C-NH-C单元的伸缩振动峰, 但是不同样品的峰强度有所变化[21]. 在810 cm-1附近出现较小的峰, 这对应于C-N杂环的面外弯曲振动[22], 所有的样品在此处都有相似的峰, KMnO4的加入并没有改变三嗪环的结构, 这与XRD结果相对应; 随着KMnO4的加入, 在2 180和2 350 cm-1附近出现新的峰, 分别对应C≡N和N=C=O的不对称伸缩振动[8], 3 000~3 550 cm-1出现大而宽的吸收峰是由于表面吸附的氨基和羟基中N-H和O-H的伸缩振动峰[14].
|
图 5 催化剂的红外谱图 Fig.5 FTIR spectra of the catalysts |
采用UV-DRS对样品g-C3N4、K-Mn-CN-x进行光学吸收性质测试, 如图 6(a)所示. g-C3N4光的本征带隙宽度在2.7 eV左右, 因此在紫外到可见光区均有光学吸收[23]. 与g-C3N4相比, K-Mn-CN-x的吸收光发生红移, 说明KMnO4加入后, 热处理所得到的纳米复合物在紫外光区和可见光区的光吸收能力均呈现明显的增强趋势. 半导体光催化剂的光学带隙宽度如图 6(b)所示, 与g-C3N4相比, 样品K-Mn-CN-x的带隙宽度随KMnO4添加量的增加而变窄, 众所周知半导体的光学吸收特性与其电子结构密切相关[24], 热分解后金属K、Mn增加了样品中的可流动电子密度.
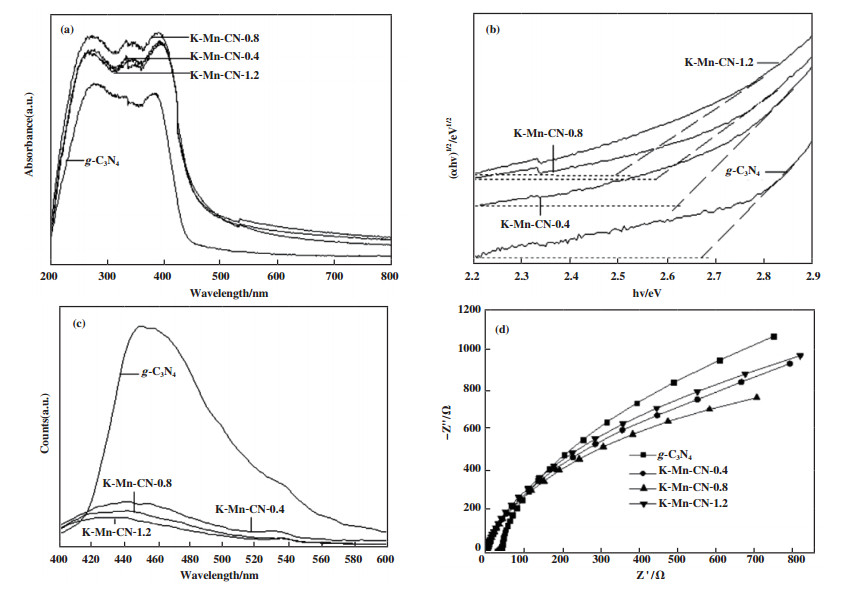
|
图 6 催化剂的紫外可见漫反射(a), Mott-Schottky图(b)及350 nm激发的荧光谱图(c)和电化学阻抗图(d) Fig.6 UV visible diffuse reflectance spcetra of catalysts (a), Mott Schottky diagram (b), 350 nm excitation fluorescence spectrum (c) and electrochemical spcetra (d) |
图 6(c)是样品的荧光光谱图, 激发波长为350 nm, 而所有材料的荧光光谱出现在450 nm左右, 并表现为一个较宽的峰. 随着KMnO4的加入, K-Mn-CN-x的荧光强度呈现逐渐减小的趋势. 与g-C3N4相比, K-Mn-CN-x复合物的荧光强度明显降低, 说明KMnO4与尿素共加热分解后, 有利于光催化剂中光生电子-空穴的有效分离. 对样品进行电化学阻抗测试研究电子传输行为, 所有样品的EIS谱图如图 6(d)所示, 可以看出材料K-Mn-CN-x的曲线半径要小于g-C3N4, 说明材料K-Mn-CN-x的界面电荷具有较快的移动速率. KMnO4热处理后得到的K、Mn提供了更多的电子, 不仅有效地抑制了光生载流子电荷和空穴的复合行为, 同时加快了电荷在催化剂表面的电子传输[25], 尤其是当添加量为0.8%(质量分数)时效果最为明显, 可有效地提高光催化剂的反应活性.
3 催化剂评价用光催化法测定了样品的催化活性. 通过色谱检测可知, CO2与H2O在光照条件下主要产物为CO和CH4, 连续照射6 h后g-C3N4、K-Mn-CN-0.4、K-Mn-CN-0.8和K-Mn-CN-1.2的CO产率分别为2.56、3.21、4.66和2.65 μmol·g-1, 而CH4的产率分别为0.27、0.41、0.59和0.32 μmol·g-1. 由图 7(a)可直观地看到, 样品K-Mn-CN-x无论是CO产率还是CH4产率都比纯g-C3N4的高.
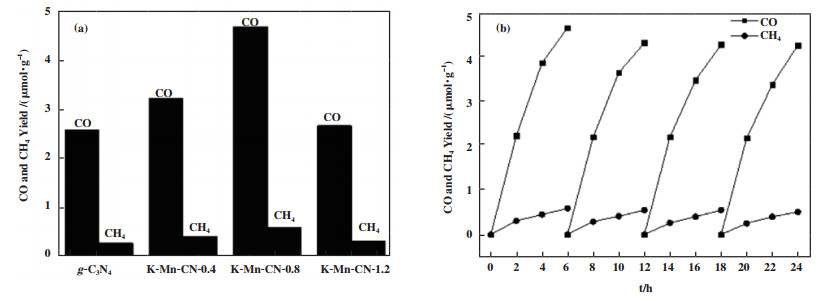
|
图 7 催化剂的光催化活性表征, CO和CH4的产量随时间变化图(a)及K-Mn-CN-0.8光催化稳定性测试(b) Fig.7 Photocatalytic CO2-reduction performance of the catalysts(a) and time courses of photocatalytic activity for CO and CH4 production over K-Mn-CN-0.8 in another repeated four runs(b) |
g-C3N4的导带和价带分别为-1.4和1.3 eV, 而MnO2的导带和价带分别为0.57和2.34 eV[26], KMnO4分解产生的少量MnO2与CN-K-Mn形成Z型异质结. 在可见光照射下, g-C3N4和MnO2电子和空穴均发生分离, MnO2导带上的电子转移到g-C3N4界面, 与g-C3N4价带中的空穴结合, 因此MnO2价带中的空穴得到保留, 有效地实现了光生电子-空穴的空间分离. 同时, K、Mn在g-C3N4的掺杂进一步提高了g-C3N4可见光的响应, 增加了样品中电荷分离效率. 另外, 传统的多相光催化通常被认为是表面的光催化(SPs), 相应的催化剂作为表面光催化剂(SPt), 由于其表面载流子的重组, 导致SPs的反应效率大大降低; 如果一个反应物(电子给体或受体)可以插入到固体光催化剂的体内, 该光催化剂可以定义为体积光催化剂(VPt),相应的光催化则为体相催化(VPs). 当VPt被光激发时, 插入的反应物可以在原位清除光生电子或空穴, 因此留下的空穴或电子很容易扩散到VPt表面与其他反应物发生反应[27-28]. 相较于g-C3N4, 催化剂K-Mn-CN-0.8的表面积减少, 但是孔径进一步增大, 反应物较容易进入到体相中, 因此进一步增加了催化剂的活性. 但是过多KMnO4的加入致使样品的表面积锐减, 使得样品和CO2的接触减少, 导致CO和CH4的产率又出现大幅下降的趋势.
为了验证催化剂的稳定性, 对K-Mn-CN-0.8进行了循环试验, 测试结果如图 7(b)所示. 在后面3次循环实验中, CO和CH4的产率出现稍微的下降, 但是下降的并不是很明显.
使用XRD、FTIR、XPS和TEM对反应循环后的K-Mn-CN-0.8催化剂进行了进一步的结构表征, 如图 8所示. 由图可知, 反应前后催化剂的晶体结构、化学物质、表面结构无明显的变化, 可见催化剂具有较好的稳定性. 催化性能变弱的原因可能是由于反应产物或者中间产物吸附在光催化剂的活性位点上, 抑制了后续反应的进行.
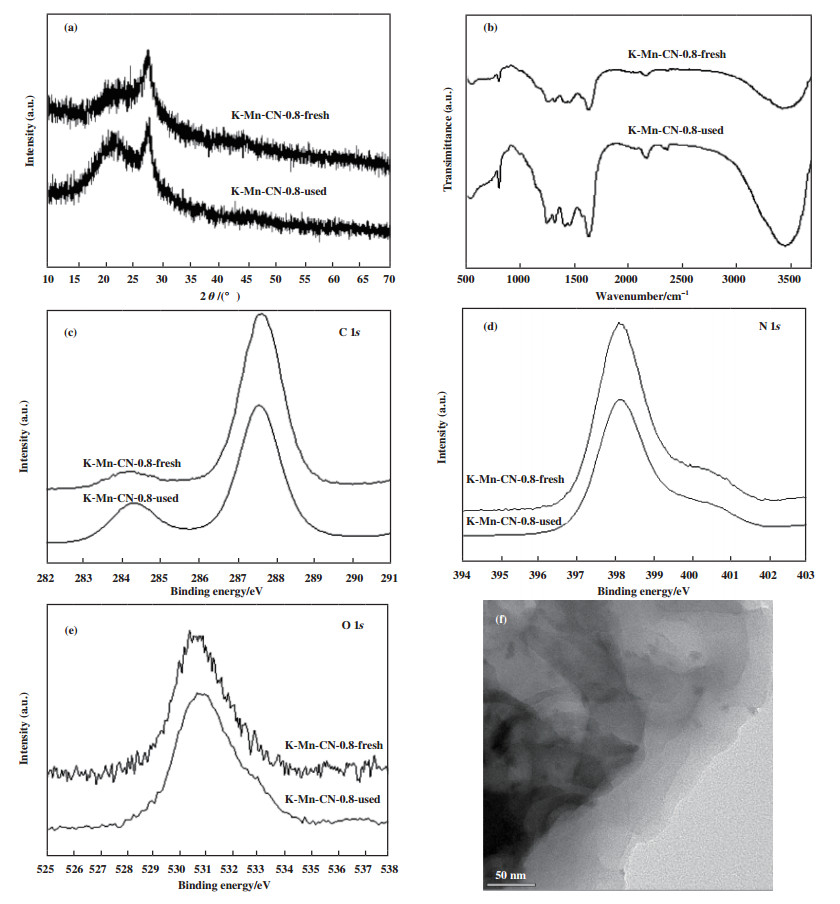
|
图 8 K-Mn-CN-0.8催化剂反应前后XRD(a)、FTIR(b)、XPS(c)-(e)对比及反应后TEM (f) Fig.8 Powder XRD (a), FTIR (b) and XPS (c)-(e) patterns for fresh catalyst and used catalyst and TEM (f) diagram of K-Mn-CN-0.8 |
采用一步煅烧法制备了系列K、Mn共掺杂的g-C3N4复合催化剂并将其应用于CO2光催化还原, 实验证明当KMnO4的添加量为0.8%(质量分数)时催化剂具有优异的光催化性能, 在可见光下CO和CH4的产率分别为4.66和0.59 μmol·g-1, 是纯g-C3N4的1.82倍和2.18倍. 这可能是由于掺杂后导致在可见光区域的响应增强, 同时提高了电荷的分离效率所致. 而循环实验和反应后催化剂表征表明, 催化剂具有较好的稳定性.
| [1] |
Jo W K, Kumar S, Tonda S. N-doped C dot/CoAl-layered double hydroxide/g-C3N4 hybrid composites for efficient and selective solar-driven conversion of CO2 into CH4[J]. Compos Part B Eng, 2019, 176: 107212.
DOI:10.1016/j.compositesb.2019.107212 |
| [2] |
a. Bi Q Y, Hu K Y, Chen J C, et al. Black phosphorus coupledblack titania nanocomposites with enhanced sunlight absor-ption properties for efficient photocatalytic CO2 reduction[J]. Appl Catal B: Environ, 2021, 295: 120211. b. Wang Yan-xin(王彦欣), Liu Ya-jing(刘亚靖), Tao Ran(陶然), et al. Preparation and photocatalytic properties of K/Cl doped g-C3N4(K/Cl掺杂g-C3N4的制备及其光催化性能研究)[J]. J Mol Catal(China)(分子催化), 2022, 36(6): 561-570. c. Zhang Hao-yu(张灏昱), Guo Ji-wei(郭纪伟), Gong Jian-ren(宫建仁), et al. Study on the electronic structure modulation and photocatalytic performance of bismuth oxychloride photocatalysts(氯氧化铋催化剂的电子结构调控及其光催化性能研究)[J]. J Mol Catal(China)(分子催化), 2022, 36(5): 433-445. d. Ge Jian-hua(葛建华), Zhang Wan(张万), Ding Xiu-long(丁修龙), et al. Preparation of S doped BiOBr photoc-atalyst and its nitrogen fixation performance(掺杂BiOBr的制备及其光催化固氮性能研究)[J]. J Mol Catal(China)(分子催化), 2022, 36(3): 245-252. |
| [3] |
a. Zhang J, Shao S, Zhou D, et al. ZnO nanowire arrays decorated 3D N-doped reduced graphene oxide nanotube framework for enhanced photocatalytic CO2 reduction performance[J]. J CO2 Util, 2021, 50: 101584. b. Lu Jia-yuan(律佳媛), Ren Rui-peng(任瑞鹏), Lu Yong-kang(吕永康). The Study of the mechanism of the ratecontrollingstep of C3H8 by CO2 on the NixCuy-B24N28 Surface(NixCuy-B24N28催化CO2氧化C3H8速控步骤的反应机理研究)[J]. J Mol Catal(China)(分子催化), 2022, 36(2): 129-136. c. Guan Yuan-hao(关元昊), Bai Jin(白金), Hu Shao-zheng(胡绍争), et al. The effect of electronic transitions on the N2photofixation ability of phosphorus doped g-C3N4 synthes-ized by microwave treatment(微波法合成磷掺杂石墨相氮化碳催化剂及n-π*电子跃迁对其光催化固氮性能的影响)[J]. J Mol Catal(China)(分子催化), 2022, 36(2): 180-189. |
| [4] |
Yang H B, Hung S F, Liu S, et al. Atomically dispersed Ni(I) as the active site for electrochemical CO2 reduction[J]. Nat Energy, 2018, 3: 140–147.
DOI:10.1038/s41560-017-0078-8 |
| [5] |
Ong W J, Tan L L, Ng Y H, et al. Graphitic carbon nitride (g-C3N4)-based photocatalysts for artificial photosynthesis and environmental remediation: Are we a step closer toachieving sustainability[J]. Chem Rev, 2016, 116(12): 7159–7329.
DOI:10.1021/acs.chemrev.6b00075 |
| [6] |
Wen J Q, Xie J, Chen X B, et al. A review on g-C3N4-based photocatalysts[J]. Appl Surf Sci, 2017, 391: 72–123.
DOI:10.1016/j.apsusc.2016.07.030 |
| [7] |
Li J H, Shen B, Hong Z H, et al. A facile approach to synthesize novel oxygen-doped g-C3N4 with superior visible-light photoreactivity[J]. Chem Commun, 2012, 48(98): 12017–12019.
DOI:10.1039/c2cc35862j |
| [8] |
Hou Y T, Guan H H, Yu J G, et al. Potassium/oxygen co-doped polymeric carbon nitride for enhanced photoc-atalytic CO2 reduction[J]. Appl Surf Sci, 2021, 563: 150310.
DOI:10.1016/j.apsusc.2021.150310 |
| [9] |
Xu X Q, Wang S M, Hu T J, et al. Fabrication of Mn/O co-doped g-C3N4: Excellent charge separation and transfer for enhancing photocatalytic activity under visible light irradiation[J]. Dyes Pigm, 2020, 175: 108107.
DOI:10.1016/j.dyepig.2019.108107 |
| [10] |
Zhou Z X, Wang J H, Yu J C, et al. Dissolution and liquid crystals phase of 2D polymeric carbon nitride[J]. J Am Chem Soc, 2015, 137(6): 2179–2182.
DOI:10.1021/ja512179x |
| [11] |
Du X R, Zou G J, Wang Z H, et al. A scalable chemical route to soluble acidified graphitic carbon nitride: An ideal precursor for isolated ultrathin g-C3N4 nanosheets[J]. Nanoscale, 2015, 7(19): 8701–8706.
DOI:10.1039/C5NR00665A |
| [12] |
Hu S Z, Ma L, You J G, et al. Enhanced visible light photocatalytic performance of g-C3N4 photocatalysts co-doped with iron and phosphorus[J]. Appl Surf Sci, 2014, 311: 164–171.
DOI:10.1016/j.apsusc.2014.05.036 |
| [13] |
Liu M J, Xia P F, Zhang L Y, et al. Enhanced photoc-atalytic H2-production activity of g-C3N4 nanosheets via optimal photodeposition of Pt as cocatalyst[J]. ACS Sustainable Chem Eng, 2018, 6(8): 10472–10480.
DOI:10.1021/acssuschemeng.8b01835 |
| [14] |
Niu P, Zhang L L, Gang L, et al. Graphene-like carbon nitride nanosheets for improved photocatalytic activities[J]. Adv Funct Mater, 2012, 22(22): 4763–4770.
DOI:10.1002/adfm.201200922 |
| [15] |
Fan J H, Qin H H, Jiang S M. Mn-doped g-C3N4 composite to activate peroxymonosulfate for acetaminophen degradation: The role of superoxide anion and singlet oxygen[J]. Chem Eng J, 2019, 359: 723–732.
DOI:10.1016/j.cej.2018.11.165 |
| [16] |
Li M L, Zhang L X, Fan X Q, et al. Dual synergetic effects in MoS2/pyridine-modifed g-C3N4 composite for highly active and stable photocatalytic hydrogen evolution under visible light[J]. Appl Catal B: Environ, 2016, 190: 36–43.
DOI:10.1016/j.apcatb.2016.02.060 |
| [17] |
Mao J, Peng T Y, Zhang X H, et al. Effect of graphitic carbon nitride microstructures on the activity and selectivity of photocatalytic CO2 reduction under visible light[J]. Catal Sci Technol, 2013, 3(5): 1253–1260.
DOI:10.1039/c3cy20822b |
| [18] |
Song X H, Li X, Zhang X Y, et al. Fabricating C and O co-doped carbon nitride with intramolecular donor-acceptor systems for efficient photoreduction of CO2 to CO[J]. Appl Catal B: Environ, 2020, 268: 118736.
DOI:10.1016/j.apcatb.2020.118736 |
| [19] |
Zhang Q, Peng Y, Deng F, et al. Porous Z-scheme MnO2/Mn-modifed alkalinized g-C3N4 heterojunction with excellent Fenton-like photocatalytic activity for effcient degradation of pharmaceutical pollutants[J]. Sep Purif Technol, 2020, 246: 116890.
DOI:10.1016/j.seppur.2020.116890 |
| [20] |
Hu S Z, Li F Y, Fan Z P, et al. Band gap-tunable potas-sium doped graphitic carbon nitride with enhanced miner-alization ability[J]. Dalton Trans, 2015, 44(3): 1084–1092.
DOI:10.1039/C4DT02658F |
| [21] |
Long B H, Lin J L, Wang X C. Thermally-induced desulfurization and conversion of guanidine thiocyanate into graphitic carbon nitride catalysts for hydrogen photosynthesis[J]. J Mater Chem A, 2014, 2(9): 2942–2951.
DOI:10.1039/c3ta14339b |
| [22] |
Yan S C, Li Z S, Zou Z G. Photodegradation performance of g-C3N4 fabricated by directly heating melamine[J]. Langmuir, 2009, 25(17): 10397–10401.
DOI:10.1021/la900923z |
| [23] |
Dong F, Wu L W, Sun Y J, et al. Effcient synthesis of polymeric g-C3N4 layered materials as novel effcient visible light driven photocatalysts[J]. J Mater Chem, 2011, 21(39): 15171–15174.
DOI:10.1039/c1jm12844b |
| [24] |
Zhao J N, Ma L, Wang H Y, et al. Novel band gap-tunable K-Na co-doped graphitic carbon nitride prepared by molten salt method[J]. Appl Surf Sci, 2015, 332: 625–630.
DOI:10.1016/j.apsusc.2015.01.233 |
| [25] |
Li H P, Liu J Y, Hou W G, et al. Synthesis and charac-terization of g-C3N4/Bi2MoO6 heterojunctions with enha-nced visible light photocatalytic activity[J]. Appl Catal B: Environ, 2014, 160/161: 89–97.
DOI:10.1016/j.apcatb.2014.05.019 |
| [26] |
Panimalar S, Uthrakumar R, Selvi E T, et al. Studies of MnO2/g-C3N4 hetrostructure effcient of visible light photocatalyst for pollutants degradation by sol-gel techni-que[J]. Surf Interf, 2020, 20: 100512.
DOI:10.1016/j.surfin.2020.100512 |
| [27] |
Li Y X, Ji M F, MA Z Y, et al. Hierarchically porous polym-eric carbon nitride as a volume photocatalyst for effcient H2 generation under strong irradiation[J]. Sol RRL, 2022, 6(2): 2100823.
DOI:10.1002/solr.202100823 |
| [28] |
Li Y X, He R C, Han P, et al. A new concept: Volume photocatalysis for effcient H2 generation-Using low poly-meric carbon nitride as an example[J]. Appl Catal B: Environ, 2020, 279: 119379.
DOI:10.1016/j.apcatb.2020.119379 |
 2023, Vol. 37
2023, Vol. 37

