20世纪90年代以来, 担载纳米金金属氧化物的研究受到世界关注, 掀起了纳米金的研究热潮. 经过几十年的发展, 纳米金催化剂已逐渐应用到室内甲醛消除、臭氧分解、废气中有机物的催化燃烧、二氧化碳激光器中CO的催化还原以及废水中氯氟烃和含氯烃类的催化分解等领域. 但是, 应用中金催化剂的失活仍是困扰催化剂广泛应用的一大难题. 研究表明催化剂中活性物种的价态、载体表面氧空位数量、载体表面碳酸盐的沉积以及活性物种与载体之间的结合程度是引起催化失活的关键因素. 因此, 催化剂载体表面修饰或掺杂是改善催化剂催化性能的主要途径之一.
我国是稀土资源的储量大国, 同时也是全球最大的稀土矿生产和出口国. 2021年我国稀土矿总产量达到1.64×105 t, 约占全球稀土矿总产量的65%[1]. 包括镧系元素在内的稀土元素, 由于其独特的4f外层电子结构, 有优异的光、电、磁等特性, 可应用于诸多新兴产业, 主要包括稀土冶炼分离领域、稀土永磁材料领域、稀土发光材料领域、稀土催化材料领域和高纯稀土金属领域, 其中稀土元素在催化材料领域的应用目前仅占到6%[2-3], 具有巨大的开发潜力. 选择合适的稀土元素对催化剂的表面进行修饰成为当前研究的热点[4].
Tabakova等[5]报道了富二氧化碳下的一氧化碳反应, 测试了稀土元素Ce对Au/Fe2O3催化剂的改性作用, 通过转化率测试发现Au/Ce50Fe50催化剂表现出较好的转化率, 并且通过FTIR表征证明了稀土元素Ce的加入明显提高了催化剂对高浓度CO2的抵抗力. Reddy等[6]采用共沉淀法制备了Ce0.8Pr0.2O2-δ催化剂, 结果表明向CeO2中添加Pr可以增加氧空位, 提高Ce3+含量. 并且在RE3+/RE4+(RE=Ce, Pr)还原电子对的协同作用下, 提高了氧的流动性, 从而提高了催化剂的催化氧化活性. 并且Pr的加入使得表面组成在500~800 ℃时的热处理几乎是恒定的, 提高了催化剂的热稳定性[4]. 并且相比于铈氧化物, 镨有多种稳定的氧化状态, 它在较低的温度下比铈有更多的氧交换, 特别是在高温烧结的情况下, 其储氧能力不会减弱[7]. Schaefer等[8]的研究表明在最稳定状态下的氧化镨(Pr6O11)中Pr 3+/Pr4+占比约为1∶1, 故氧化镨从理论上来说具有非常高的氧化还原能力. 本课题组[9]的研究结果也表明了Au/PrOx催化剂在CO氧化反应中表现出了优良的活性.
为了进一步研究镨在催化剂中的作用, 我们采用金属镨作为助剂对ZrO2改性, 以期提高催化剂的稳定性和氧活化能力. 以水热法制备的二氧化锆和镨锆复合金属氧化物作为载体, 随后采用沉积沉淀法制备Au/ZrO2、Au/PraZr1Ox催化剂(Pr/Zr的摩尔比a= 0.005、0.050、0.125、0.250), 寻找适合的镨锆摩尔比. 考察Au/ZrO2和Au/PraZr1Ox催化剂在富CO2气氛下一氧化碳氧化反应中的CO转化率、活化能和CO反应速率的差异, 探究金与镨锆复合氧化物间的相互作用.
1 实验部分 1.1 实验材料AuCl3·HCl·4H2O、KOH、NaOH, 分析纯, 上海国药集团化学试剂有限公司; NH3·H2O, 分析纯, 天津市科密欧化学试剂有限公司; Pr(NO3)3·6H2O、Zr(NO3)4·5H2O, 分析纯, 上海迈瑞尔化学技术有限公司; N2、CO2、H2, 标准气, 烟台飞鸢特气有限公司; 15.03% CO + 8.99% O2/N2, 标准气, 烟台飞鸢特气有限公司.
1.2 催化剂的制备 1.2.1 载体ZrO2和PraZr1Ox的制备采用传统水热法和沉积沉淀法制备二氧化锆和镨锆复合氧化物载体. 详细制备步骤如下: 称取准确质量Pr(NO3)3·6H2O和Zr(NO3)4·5H2O后混合溶于去离子水, 随后利用滴定管逐滴加入到25 mL 1 mol/L的NaOH溶液, 并且持续搅拌30 min, 将上述混合溶液加入到100 mL的水热反应釜(聚四氟乙烯材料)中置于100 ℃下水热反应24 h. 经过离心、60 ℃干燥12 h后的产物在400 ℃下空气中焙烧4 h后获得镨锆复合氧化物载体, 记作ZrO2、PraZr1Ox, 其中Pr/Zr的摩尔分数a=0.005、0.050、0.125、0.250.
1.2.2 Au/ZrO2和Au/PraZr1Ox催化剂的制备通过沉积沉淀法制备Au/ZrO2和Au/PraZr1Ox催化剂, 我们所用催化剂的理论载金量均为1.0%(质量分数). 取一定量的氯金酸溶液(9.56 g/L)于烧杯, 依次加入适量的去离子水和1 mol/L的氢氧化钾溶液, 使混合后溶液pH为9~10. 取适量催化剂载体缓慢加入上述溶液并超声使载体均匀分散在烧杯底部, 静置5 h. 随后经过稀氨水(pH=9~10)浸泡24 h、抽滤、洗涤, 并在60 ℃下干燥过夜, 得到最终的催化剂. 载金后的催化剂分别记为Au/ZrO2、Au/Pr0.005Zr1Ox、Au/Pr0.050Zr1Ox、Au/Pr0.125Zr1Ox及Au/Pr0.250Zr1Ox.
1.3 样品的表征所有催化剂晶体结构均采用SmartLab3型多晶粉末X射线衍射仪器进行物相分析, 测试条件: Cu Kα射线, 工作电压40 kV, 工作电流30 mA, 扫描范围10°~80°, 扫描速度为10(°)/min. 催化剂的物理性质使用美国Micromeritics公司的ASAP 2020 HD型吸附仪进行测试. 先将样品置于200 ℃下真空预处理4 h, 随后在液氮(-196 ℃)条件下进行测试. 采用BET和BJH的方法计算得到样品的比表面积与孔径分布. 采用麦克仪器公司AutoChem Ⅱ化学吸附仪进行程序升温测试. 以CO2和O2为探针分子测试了样品的程序升温脱附(CO2-TPD、O2-TPD). 制备的催化剂首先在200 ℃下预处理1.5 h, 待温度降至室温后吸附探针分子60 min, 随后氦气吹扫30 min, 待基线稳定后以10(°)/min的升温速率将温度从室温升到800 ℃进行测试, 采用热导检测器(TCD)记录实验.
1.4 CO催化氧化性能评价所有评价实验中均采用U形玻璃管(内径为8 mm), 并通过智能化温控仪来精准控制反应温度. 反应后的气体产物进入安捷伦7820A型气相色谱仪在线分析. 富二氧化碳气氛下一氧化碳氧化反应评价详情: 称取100±10 mg催化剂置于U形玻璃管中进行活性实验评价, 反应总气速为100 mL/min, 反应气氛(体积分数)为CO2 60%、CO 1%、O2 0.5%、H2O 0.5%和N2 38%. 反应温度为50~400 ℃, 反应温度间隔为50 ℃.
基于在线分析的结果, 我们采用以下的公式对一氧化碳的转化率(XCO)和转换频率(TOF)值进行了计算:
一氧化碳转化率(XCO):
| $ X_{\mathrm{CO}}=\left(\frac{\mathrm{CO}_{{in}}-\mathrm{CO}_{{out}}}{\mathrm{CO}_{{in}}}\right) \times 100 \% $ |
其中XCO是一氧化碳转化率, COout为一氧化碳的出口浓度, COin为原料气中一氧化碳的浓度.
转换频率(TOF):
| $ \operatorname{TOF}\left(\mathrm{s}^{-1}\right)=\frac{X_{\mathrm{CO}} \times F_{\mathrm{CO}} \times M_{\mathrm{Au}}}{W_{\mathrm{cat}} \times X_{\mathrm{Au}} \times D_{\mathrm{Au}}} $ |
其中XCO是一氧化碳转化率, FCO为单位时间内一氧化碳的流速, MAu为金的摩尔质量(197 g/mol), Wcat为催化剂质量, DAu为催化剂中金的分散度, XAu为所用催化剂实际的金载量.
2 结果与讨论 2.1 催化剂BET表征结果图 1(a)显示了Au/ZrO2、Au/Pr6O11、Au/PraZr1Ox系列催化剂的氮气吸脱附等温线. 从图中分析可得除了Au/Pr6O11催化剂, 其余催化剂在相对压力(P/P0)为0.4~0.8之间出现了较为明显的回滞环, 属于Ⅳ型等温吸附曲线[10]. 图 1((b)、(c))为所制备催化剂的孔径分布图, 孔径分布证明制备的催化剂为介孔结构. 表 1列出了催化剂的比表面积(SBET)、平均孔径(Daver pore)以及孔体积(Toal pore volume). 从表中可以看出, 采用水热法制备的复合氧化物催化剂随着镨摩尔含量的增加比表面积由184下降至150 m2·g-1, 而孔径(2.9→5.1 nm)和孔体积(0.135→0.190 cm3·g-1)逐渐变大. 这是由于氧化镨(Pr6O11)的平均孔径非常大, 催化剂的平均孔径随着镨含量的增加逐渐趋向于氧化镨, 因此呈现出依次递增的趋势.

|
图 1 Au/ZrO2、Au/Pr6O11、Au/PraZr1Ox系列催化剂的氮气吸附解析等温线(a)及孔径分布图(b)和(c) Fig.1 N2 adsorption-desorption isotherms (a) and pore size distributions (b) and (c) of Au/ZrO2、Au/Pr6O11、Au/PraZr1Ox catalysts |
| 表 1 Au/ZrO2、Au/Pr6O11、Au/PraZr1Ox系列催化剂的物理性质 Table 1 Physical properties of Au/ZrO2, Au/Pr6O11 and Au/Au/PraZr1Ox catalysts |
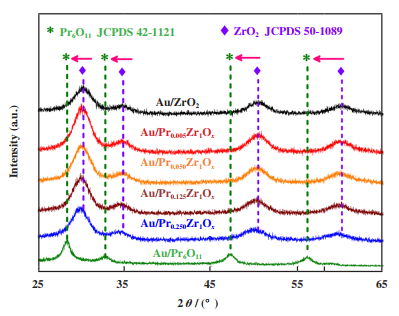
采用X射线衍射(XRD)表征进一步证明Au/PraZr1Ox系列催化剂的结构变化. 如图 2所示, Au/ZrO2催化剂中30.27°、35.25°、50.71°、60.20°处的特征峰归属于四方相(JCPDS 50-1089)[11]; Au/Pr6O11催化剂中28.25°、32.74°、46.99°、55.71°处的特征峰归属于立方相(JCPDS 42-1121)[12]. 根据XRD图分析可知, 当引入镨后所有催化剂均形成了单一的镨锆复合氧化物, 图中没有出现Pr6O11特征峰, 表明镨在复合氧化物催化剂中高度分散. 随着镨含量的增加, Au/PraZr1Ox系列催化剂的特征峰逐渐向低角度方向移动.
|
图 2 Au/ZrO2、Au/PraZr1Ox、Au/Pr6O11系列催化剂的XRD谱图 Fig.2 XRD patterns of Au/ZrO2, Au/PraZr1Ox and Au/Pr6O11 catalysts |
表 1中列出了Au/ZrO2、Au/Pr6O11、Au/PraZr1Ox系列催化剂的晶粒尺寸和晶格常数, 其中晶粒尺寸采用谢乐公式算得, 晶格常数采用Jade软件算得. 从表中数据变化分析得, 随着镨摩尔量的增加, 镨锆复合氧化物的晶格常数由5.145 4增加至5.170 9 nm, 同时镨元素的引入使得镨锆复合氧化物的晶格尺寸明显增大, 并且催化剂显示的特征峰也随着变得尖锐, 说明其具有较高的结晶度. 这可能是因为Zr4+(0.072 nm)的离子半径小于Pr3+(0.085 nm), 部分Zr4+被较大离子半径的Pr3+所取代, 从而使得复合氧化物中的晶格发生膨胀, 这也与BET的分析结果一致. 此外, XRD图中并没有发现金的衍射峰, 可能是由于金的负载量低于X射线检测仪的检测基线.
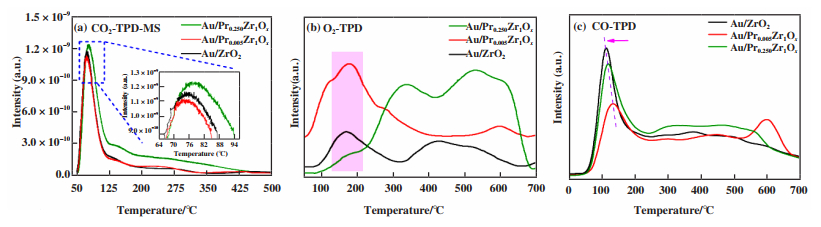
2.3 催化剂的CO2-TPD-MS、O2-TPD、CO-TPD表征由于高浓度的CO2会对催化剂的活性和稳定性产生消极作用. 因此, 采用CO2-TP-MS技术对催化剂的CO2脱附能力进行测试. 图 3(a)显示所有测试样品只在低温处出现一个脱附峰(76 ℃), 该峰归属于在催化剂表面吸附的CO2. 而在200~600 ℃处没有出现CO2脱附峰, 说明Au/ZrO2、Au/PraZr1Ox系列催化剂表面不易积累碳酸盐物种. 也就是说, Au/ZrO2、Au/PraZr1Ox系列催化剂对CO2吸附能力弱, 即使在高浓度CO2气氛下也有利于保持良好的稳定性. CO2-TPD的分析结果表明CO2对催化剂影响较小, 因此高浓度的CO2不是影响催化活性差异的因素.
|
图 3 Au/ZrO2、Au/Pr0.005Zr1Ox和Au/Pr0.250Zr1Ox催化剂的CO2-TPD-MS(a)、O2-TPD(b), CO-TPD(c) Fig.3 The CO2-TPD-MS (a), O2-TPD (b) and CO-TPD(c) of Au/ZrO2, Au/Pr0.005Zr1Ox and Au/Pr0.250Zr1Oxcatalysts |
Au/PraZr1Ox系列催化剂的氧脱附能力如图 3(b)所示, Au/Pr0.005Zr1Ox和Au/ZrO2催化剂在低温区(50~150 ℃)都出现较强的氧脱附峰, 此处脱附峰是表面氧气分子的脱附, 并且Au/ Pr0.005ZrO2催化剂的脱附峰强度明显高于Au/ZrO2催化剂, 但是Au/Pr0.250Zr1Ox催化剂在低温处并未显示出明显的脱附峰. 因此, 优化镨锆摩尔比例有利于提高晶格氧的流动性. 换句话说, 镨含量对氧的脱附能力影响较大, 这对一氧化碳氧化反应非常重要[11].
图 3(c)显示了系列催化剂的CO吸附能力, 可以看出, 所有催化剂在90~150 ℃都有一个CO解吸峰, 主要依赖于催化剂表面的CO吸附, 图中Au/ZrO2和Au/Pr0.250Zr1Ox的峰明显高于Au/Pr0.005Zr1Ox催化剂, 这说明, 相比于Au/Pr0.005Zr1Ox催化剂, 在低温下Au/ZrO2和Au/Pr0.250Zr1Ox更容易吸附CO. 这和我们的活性数据不一致, 是由于反应原料气是模拟实际二氧化碳激光器的工作气氛, 在CO2浓度高达60% 的情况下, 氧和CO的原子比为化学计量比, 因此结合氧脱附数据和反应活性数据, 说明氧气的吸附能力在很大程度上决定了相应催化剂的反应速率.
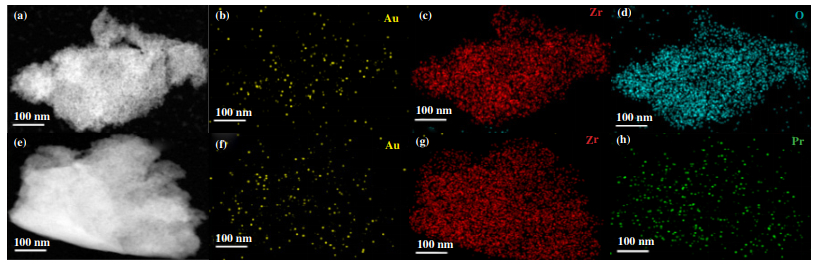
2.4 催化剂的TEM表征结果据文献报道[13-14], 金纳米颗粒的尺寸大小对一氧化碳氧化反应影响较大, 因此采用TEM与EDS表征对催化剂的组成以及金纳米颗粒的尺寸进行分析. 图 4所示为Au/ZrO2和Au/Pr0.005Zr1Ox催化剂的TEM和HRTEM图. 从TEM图中可以看出两种催化剂均为多孔结构, 这也与BET的分析结果一致. 此外, HRTEM图中出现了间距为0.295 nm的晶格条纹, 这对应着t-ZrO2的(101)晶面, 而图中并没有观察到与金或镨相对应的晶格条纹, 这说明两种元素在催化剂中高度分散, 这也与XRD中的分析结果相一致. 通过HRTEM和EDS进一步探究金纳米颗粒的尺寸以及分布情况, 图 5(a)和(e)表明Au/ZrO2和Au/Pr0.005Zr1Ox催化剂中金纳米颗粒的粒径较小(< 2 nm), 因此在HRTEM(粒径限制[15]: > 5 nm)图中没有观察到金纳米颗粒. 结合EDS图 5((b)-(d)、(f)-(h))分析得Au/ZrO2和Au/Pr0.005Zr1Ox催化剂中金纳米颗粒的粒径尺寸相似, 因此, 金纳米颗粒的尺寸也不是影响催化剂活性差异的关键因素.

|
图 4 催化剂的TEM和HRTEM图 Fig.4 TEM and HRTEM images of Au/ZrO2 (a)-(b), Au/Pr0.005Zr1Ox (c)-(d) catalysts (Au/ZrO2催化剂(a)-(b)和Au/Pr0.005Zr1Ox催化剂(c)-(d)) |
|
图 5 催化剂的HAADF-STEM和EDS图 Fig.5 HAADF-STEM images and elemental distributions maps of Au/ZrO2 (a)-(d), Au/Pr0.005Zr1Ox(e)-(h) catalysts (Au/ZrO2催化剂(a)-(d)和Au/Pr0.005Zr1Ox催化剂(e)-(h) |
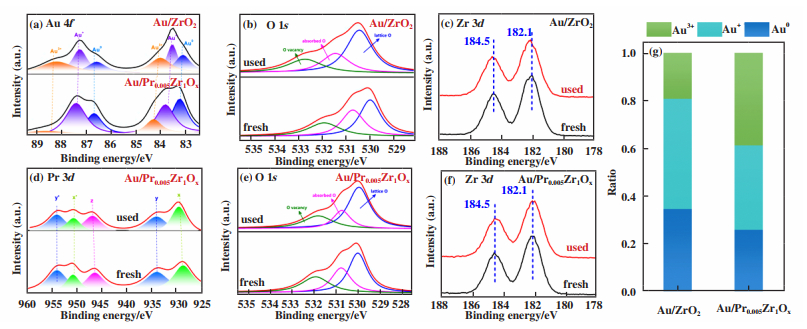
利用XPS测试了反应前后的催化剂, 以此来获得更多催化剂表层结构变化的信息. 图 6(b)和(e)为反应前后两种催化剂的表面氧物种, O 1s可以分为530.1、531.6和532.7 eV, 分别归属于晶格氧(Lattice O)、吸附氧(Absorbed O)和氧空位(O vacancy)[16]. 结合表 2中反应前后的氧物种变化情况, 反应前的Au/ZrO2、Au/Pr0.005Zr1Ox催化剂中氧空位含量由于Pr的添加而增大(21.9%→ 26.5%), 而Au/Pr0.005Zr1Ox催化剂反应前后各种类的氧物种组分含量差别不大, 因此引入镨后有利于稳定催化剂中氧物种的变化. 值得注意的是, 图 6(c)、(f)中Au/ZrO2催化剂反应前后Zr 3d轨道峰并没有发生偏移[17], 这说明Zr并没有电子的得失. 综上, Au/ZrO2催化剂在反应过程中Au失去电子, 部分氧空位得到电子转变为晶格氧, 而氧空位的减少限制了表面氧分子的吸附, 从而导致催化剂的活性产生差异. 图 6(a)和(g)为Au/ZrO2和Au/Pr0.005Zr1Ox催化剂中Au 4f谱图以及Au不同价态百分比含量柱状图, 结果显示添加镨元素后, 正价态金(Au+和Au3+)的百分比含量也随之增加, 这说明了电子从Au转移到氧化物载体, 根据Büergel等[18]的报道, 正价态的金团簇可以促进CO分子通过类似ER(Eley-Rideal)机理或者类似LH(Langmuir-Hinshelwood)机理被吸附, 故正价态的金在吸附CO分子过程中发挥重要作用. 综上, 我们发现Pr的加入可以调变金与载体间的电子转移, 从而控制阳离子金的含量, 这为催化剂活性位点的调控提供了一种新的途径.
|
图 6 反应前后的Au/ZrO2和Au/Pr0.005Zr1Ox催化剂XPS谱图 Fig.6 The XPS spectra of Au 4f (a), O 1s (b), (e), Zr 3d (c), (f), Pr 3d (d) of Au/ZrO2 and Au/Pr0.005Zr1Oxcatalysts (fresh and used) and plots of Au0, Au+ and Au3+ ration(g) (Au 4f (a)、O 1s (b)和(e)、Zr 3d (c)和(f)、Pr 3d (d)及Au 4f百分比含量柱状图(g) |
| 表 2 反应前后Au/ZrO2和Au/Pr0.005Zr1Ox催化剂中不同O物种及其含量 Table 2 Species and corresponding contents of Au/ZrO2 and Au/Pr0.005Zr1Oxcatalysts by XPS |
将所制备的催化剂用于富CO2气氛下催化CO氧化反应, 其活性如图 7(a)和(b)所示. 在100 ℃下CO转化率由大到小依次为Au/Pr0.005Zr1Ox > Au/Pr0.050-Zr1Ox > Au/Pr0.125Zr1Ox > Au/ZrO2 > Au/Pr0.250Zr1Ox. 基于此结果, 我们以Au/ZrO2、Au/Pr0.005Zr1Ox和Au/Pr0.250Zr1Ox为主要研究对象, 来深入探究稀土元素镨对二氧化锆改性后的影响. 采用ICP-OES表征对各催化剂中Au和Pr的含量进行了计算, Au/Pr0.005Zr1Ox系列催化剂的实际金载量处于0.22%~0.28%(质量分数)之间, 而实际镨的原子量与理论值相近, 这说明成功合成镨锆复合氧化物. 根据表 3中的ICP结果, 计算了所有催化剂的一氧化碳转化速率, Au/Pr0.005Zr1Ox催化剂无论在50还是100 ℃下的反应速率都是此系列催化剂中的最高者, 这说明Au/Pr0.005Zr1Ox催化剂具有较好的催化活性. 此外, 图 7(b)为催化剂的反应动力学测试结果, 富CO2气氛下各催化剂的活化能依次为Au/Pr0.005Zr1Ox(22.3 kJ·mol-1) < Au/Pr0.050Zr1Ox(26.0 kJ·mol-1) < Au/ZrO2(28.9 kJ·mol-1) < Au/Pr0.125Zr1Ox(32.1 kJ·mol-1) < Au/Pr0.250Zr1Ox(36.3 kJ·mol-1) < Au/Pr6O11(52.2 kJ·mol-1), 较低的活化能使得催化剂的反应速率提高, 这也与反应速率的顺序类似.
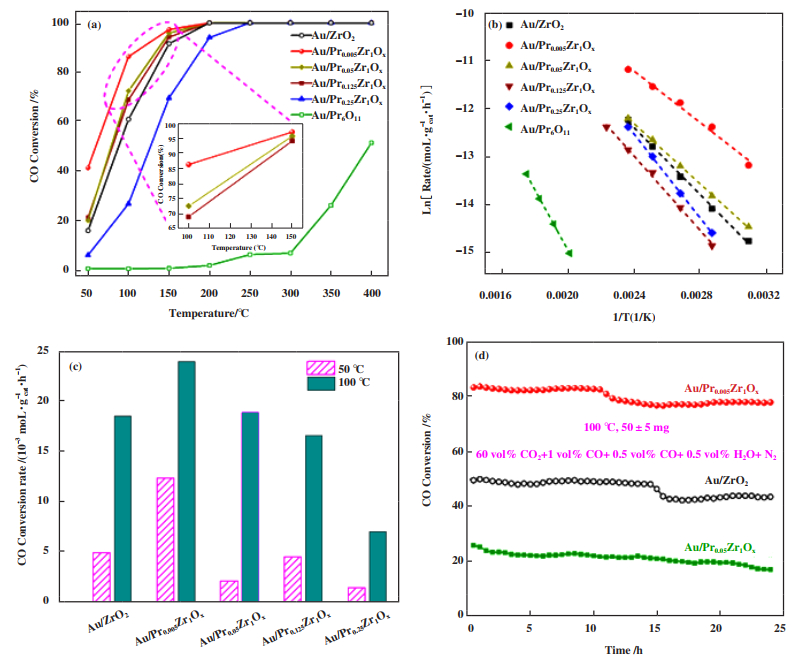
|
图 7 Au/ZrO2、Au/PraZr1Ox催化剂上CO的转化率(a); 反应活化能(b); 50和100 ℃下反应速率对比图(c)和稳定性测试(d) Fig.7 The comparison of CO conversion (a), CO conversion rate at 50 and 100 ℃ (b), activation energy (c) CO conversion rate at 50 and 100 ℃ of Au/ZrO2 and Au/PraZr1Ox catalysts in the feed with CO2 (60% CO2+1% CO+0.5% O2+0.5% H2O+ N2)(Volume fraction) balance, GHSV=60 000 mL·gcat-1·h-1); (d) the steady-state test at 100 ℃ of Au/ZrO2, Au/Pr0.005Zr1Ox and Au/Pr0.25Zr1Ox catalysts 60% CO2+1% CO+ 0.5% O2+ 0.5% H2O+ N2(Volume fraction) balance, GHSV=120 000 mL·gcat-1·h-1) |
| 表 3 Au/ZrO2、Au/Pr6O11、Au/PraZr1Ox催化剂中的实际金载量和反应活化能 Table 3 Actual loadings of Au in catalysts and activation energy of Au/ZrO2、Au/Pr6O11 and Au/PraZr1Ox catalysts |
采用水热法通过改变镨锆摩尔比制备了一系列的镨锆复合氧化物, 其中Pr/Zr=0.005为最优摩尔比. 通过稳定性测试发现无论是Au/ZrO2还是Au/PraZr1Ox系列催化剂均不受高浓度CO2的影响. 通过XRD和BET表征分析得出随着Pr含量的增加, 镨锆复合氧化物的晶体常数和平均孔径逐渐增加. TEM和EDS表征共同证明了所制备催化剂上金纳米颗粒分散较好且尺寸较小, 均低于电镜可分辨尺寸. 通过XPS分析发现反应过程中活性物种Au的价态和氧物种的组分含量变化是造成催化剂活性差异的关键性因素, O2-TPD进一步表明Au/Pr0.005Zr1Ox催化剂在低温下可以吸附更多的氧分子. 因此掺杂适量的稀土元素镨有益于稳定催化剂中活性物种, 从而改善Au/ZrO2催化剂的催化活性, 这为镨锆复合氧化物的开发与应用提供了理论依据.
| [1] |
Zhu Ming-gang (朱明刚), Sun Xun (孙迅), Liu Rong-hui(刘荣辉), et al. Development strategies for rare earth functional materials by 2035(稀土功能材料2035发展战略研究)[J]. Eng Sci (China)(中国工程科学), 2020, 22(5): 37-43.
|
| [2] |
Gu Bao-jiang(顾保江), Long Zhi-qi(龙志奇), Huang Xiao-wei(黄小卫), et al. Present status and prospect of RE compound industry in China (我国稀土化合物产业现状和展望) [J]. Chin J Rare Metals(China)(稀有金属), 2003, 27(3): 391-394.
|
| [3] |
a. Zhao Wei(赵伟), Kan Yun(谌昀), Hu Qiang(胡强), et al. Brief overview of rare earth catalytic materials(稀土催化材料综述)[J]. Jiang Xi Sci(China) (江西科学), 2021, 39(1): 1-7. b. Fang Dong-xu(房东旭), Liu Zhi-xi(刘智焬), Jiang Zhi(江治). Microwave catalysis for energy and environment: A review(能源与环境应用中的微波催化研究进展)[J]. J Mol Catal(China)(分子催化), 2022, 36(5): 456-466. c. Lan Yong-cheng(兰永成), Lu Yan-mei(鲁艳梅), Yun Dong(郧栋), et al. Application of ionic liquid functionalized MOFs/COFs in catalytic reactions(离子液体功能化金属/共价-有机框架材料在催化反应中应用)[J]. J Mol Catal(China)(分子催化), 2022, 36(5): 480-498. |
| [4] |
a. Jin Xing(金星), Luo Yong-ming(罗永明), Mei Zhan-qiang(梅占强), et al. Research progress on modification of catalytic oxidation catalyst for CO(CO催化氧化催化剂改性研究进展)[J]. Petrochem Technol(China)(石油化工), 2019, 48(2): 197-202. b. Liu Yu-feng(刘玉凤), Zhou Ying(周瑛), Lu Mei(卢梅), et al. Preparation of noble metal single-atom catalyst and its applications in catalytic oxidation reaction of CO and VOCs(贵金属单原子催化剂的制备及其在CO、VOCs完全氧化反应中的应用)[J]. J Mol Catal(China)(分子催化), 2022, 36(1): 81-97. c. Qin Hong-yu(秦宏宇), Ke Yi-hu(柯义虎), Li Jing-yun(李景云), et al. Application of photo-thermal synergistic effect in catalytic reactions(光热协同效应在催化反应中的应用研究进展)[J]. J Mol Catal(China)(分子催化), 2021, 35(4): 375-389. |
| [5] |
a. Tabakova T, Avgouropoulos G, Papavasiliou J, et al. CO-free hydrogen production over Au/CeO2-Fe2O3 catalysts: Part 1. impact of the support composition on the performance for the preferential CO oxidation reaction[J]. Appl Catal B, 2011, 101(3/4): 256-265. b. Su Hui-juan(苏慧娟), Zheng Yu-hua(郑玉华), Sun Xun(孙逊), et al. The research of CO monoxide in different atmosphere on Au/Cu/FLA catalysts at low temperature(Au/Cu/FLA催化剂在不同气氛中CO低温氧化性能研究)[J]. J Mol Catal(China)(分子催化), 2022, 34(1): 65-71. |
| [6] |
Reddy B, Thrimurthulu G, Katta L, et al. Structural characteristics and catalytic activity of nanocrystalline ceria praseodymia solid solutions[J]. J Phys Chem C, 2009, 113(36): 15882–15890.
DOI:10.1021/jp903644y |
| [7] |
Logan A D, Shelef M. Oxygen availability in mixed cerium/praseodymium oxides and the effect of noble metals[J]. J Mater Res, 1994, 9(2): 468–475.
DOI:10.1557/JMR.1994.0468 |
| [8] |
Schaefer A, Gevers S, Zielasek V, et al. Photoemission study of praseodymia in its highest oxidation state: The necessity of in situ plasma treatment[J]. J Phys Chem C, 2011, 134(5): 054701.
DOI:10.1063/1.3516953 |
| [9] |
Zhao W X, Shi J J, Lin M Y, et al. Praseodymia-titania mixed oxide supported gold as efficient water gas shift catalyst: Modulated by the mixing ratio of oxides[J]. RSC Adv, 2022, 12(9): 5374–5385.
DOI:10.1039/D1RA08572G |
| [10] |
Hua X Y, Zheng Yh, Yang Z X, et al. Gold nanoparticles supported on Ce-Zr oxides for selective hydrogenation of acetylene[J]. Top Catal, 2020, 64(3): 206–214.
|
| [11] |
Du Yun-peng(杜云鹏), Wei Yong-gang(魏永刚), Wang Hua (王华), et al. Synthesis, characteri'zation and oxidationactivity of Pr-Zr oxide solid solution(Pr-Zr固溶体的制备及其氧化性能研究)[J]. Rare Metal Mater Eng(China)(稀有金属材料与工程), 2014, 43(4): 891-895.
|
| [12] |
Shi J J, Li H L, Zhao W X, et al. Praseodymium hydroxide precursor supported gold: New strategy for preparing stable and active catalyst for the water gas shift reaction[J]. Catal Sci Technol, 2020, 10(21): 7291–7301.
DOI:10.1039/D0CY01263G |
| [13] |
Shekhar M, Wang J, Lee W, et al. Size and support effects for the water-gas shift catalysis over gold nanoparticles supported on model Al2O3 and TiO2[J]. J Am Chem Soc, 2012, 134(10): 4700–4708.
DOI:10.1021/ja210083d |
| [14] |
Saavedra J, Powell C, Panthi B, et al. CO oxidation over Au/TiO2 catalyst: Pretreatment effects, catalyst deactivation, and carbonates production[J]. J Catal, 2013, 307(6): 37–47.
|
| [15] |
Li J, Sun J. Application of X-ray diffraction and electron crystallography for solving complex structure problems[J]. Acc Chem Res, 2017, 50(11): 2737–2745.
DOI:10.1021/acs.accounts.7b00366 |
| [16] |
Zheng Y H, Okumura M, Hua X Y, et al. Partial oxidation of propylene with H2 and O2 over Au supported on ZrO2 with different structural and surface properties[J]. J Catal, 2021, 401(48): 188–199.
|
| [17] |
Zhou Y M, Zhang L J, Tao S Y. Mesoporous ZrO2 nanopowder catalysts for the synthesis of 5-hydroxymethylfurfural[J]. ACS Appl Energy Mater, 2019, 2(8): 5125–5131.
|
| [18] |
Büergel C, Reilly N, Johnson G, et al. Influence of charge state on the mechanism of CO oxidation on gold clusters[J]. J Am Chem Soc, 2008, 130(5): 1694–1698.
DOI:10.1021/ja0768542 |
 2023, Vol. 37
2023, Vol. 37


