随着我国双碳目标的提出和实施, 利用风能、太阳能等可持续能源替代传统的化石能源已成为大势所趋[1], 但这些能源存在着间歇性、不稳定性、不易储存等致命缺点. 可持续能源发电电解水制氢可以有效解决上述规模储能问题, 从而构建满足社会需求的氢能燃料系统. 碱性电解水制氢是目前我国应用最多的制氢技术, 但也存在能耗较高的问题. 在电解水制氢过程中, 缓慢的水解离步骤严重制约了析氢反应(HER)的效率, 因此设计和开发各种电催化剂对提高制氢效率和降低能耗具有重要作用.
铂被认为是最有效的析氢反应催化剂, 但由于其高成本、稀缺性和不稳定性等因素, 使其广泛应用存在局限性. 研究表明非贵金属基催化剂价格低廉且活性稳定, 有独特的电子构型以及优异的电化学性能, 对HER有类铂催化行为[2], 受到人们的广泛关注. 在过去十年中非贵金属(Co、Fe、Mo、Ni、Ti、W等)[3-4]电催化剂经历了快速发展. 其中金属Ni具备经济优势, 它还具有良好的延展性、耐腐蚀性和导电性, 因此在电化学领域被广泛研究[5]. 例如Lu等[6]利用钼掺杂制备了超薄多孔镍纳米片, 10 mA·cm-2下仅91 mV的过电位、62 mV·dec-1的低Tafel斜率. Li等[7]制备的NiMo/Ni(OH)2/CC在10 mA·cm-2下的过电位仅为132 mV. 之前我们研究的壳寡糖(COS)保护下的NiB合金颗粒, 碱性介质中在10 mA·cm-2下仅49.4 mV的低过电位[8].
然而非贵金属催化剂的性能依然不能达到实际的要求, 近年来的研究表明在Ni基催化剂的基础上引入少量的贵金属可以极大地提升催化剂性能, 同时在成本上不会增加很多. 如Kavian等[9]在Ni的基础上引入Pt, 其HER活性是商业Pt/C催化剂在0.1 mol·L-1 KOH溶液中的4.6倍. Wu等[10]制备的Ir-Ni催化剂在10 mA·cm-2下有60 mV的过电位和40 mV·dec-1的Tafel斜率, 对HER显示出高效的电催化活性. 其原因是引入的贵金属具有高催化活性和稳定性, 往往展现出很高的分散状态, 同时与Ni结合产生协同催化作用, 其催化性能提高的程度明显大于单独使用时其各组分的催化性能之和.
据报道Ru显示出与Pt相当甚至更好的HER性能, 且成本仅为Pt的4%[11-12], 并与氢(~27.2 kJ·mol-1)具有类似的键合强度, 这与中性或碱性电解质中的HER活性直接相关. 此外对于水解离和OH的化学吸附, Ru显示出优于其他金属的性能[12-14]. Li等[15]开发了可大量生产的Ru纳米颗粒均匀分散在石墨烯纳米片上(Ru@GnP), 在酸性和碱性电解质中都表现出优异的HER性能. Qiu等[16]报道了锚定在分级多孔碳(Ru-HPC)上制备的超细Ru纳米颗粒显示出优异的HER活性. Mahmood等[12]制备了分散在氮化多孔二维碳结构中的Ru纳米颗粒(Ru@C2N), HER性能与Pt/C催化剂相当, 甚至更好.
综上, Ru作为HER催化剂具有一定的潜力, 结合上述提到Ni基材料的优良HER性能, 将Ru与Ni偶联应是进一步提高催化剂活性和降低成本的简便有效的方法. 双金属纳米粒子能极大提高催化剂的催化性能, 其协同催化作用[17]使催化活性、选择性、催化剂耐用性等性能得到改善. 但到目前为止, 用于HER的Ru-Ni双金属催化剂的相关研究还鲜有报道.
另一方面, 许多文献报道表明碳基材料可以有效分散金属, 保护金属免受腐蚀和浸出[13, 18-20], 因此我们采取Ru-Ni作为催化剂活性组分, 导电活性炭Vulcan XC-72R为载体, 用沉积沉淀法制备Ru-Ni/C电催化剂, 对在碱性介质中HER的各种电化学性能进行详细深入的讨论, 以期望获得低过电位、稳定性良好且分散程度较高的HER电催化剂.
1 实验部分 1.1 催化剂的制备采用沉积沉淀法合成负载在Vulcan XC-72R上的Ru0.75Ni0.25纳米颗粒, 金属负载量为7.4%(质量分数). 首先将40 mg经浓硝酸预处理过的Vulcan XC-72R溶解在15 mL超纯水中, 持续搅拌, 然后将56 μL RuCl3·nH2O溶液(100 mg·mL-1, 含2.7 mg Ru)分散在5 mL超纯水中, 磁力搅拌8 min, 添加2.4 mg Ni(NO3)2·6H2O, 再搅拌8 min, 混合均匀后倒入滴定管中, 缓慢滴入到持续搅拌中的Vulcan XC-72R溶液, 滴加完毕后通入氩气的过程中向其中缓慢逐滴添加2 mol·L-1(8 mL)硼氢化钠溶液, 待溶液表面无反应气泡, 将其转移至80 ℃的水浴中搅拌5 h, 以形成浆液. 对浆液进行离心处理, 用去离子水和无水乙醇分别冲洗3次, 最后在60 ℃下真空干燥一整夜得到催化剂粉末. Ru/C、Ni/C也用相同的方法合成, 用于比较.
1.2 材料表征为了确定相组成和变化, 用Bruker D8 Advance X射线衍射仪(XRD)对合成的催化剂进行了表征, 在20°~90°范围内扫描, 扫描速度为10 (°)·min-1. 通过FEI Tecnai f20透射电子显微镜(TEM)以及高分辨率透射电子显微镜(HRTEM)对Ru-Ni/C的形貌和尺寸分布进行表征. 通过Thermo Fisher Nexsa X射线光电子能谱(XPS)证明了元素组成和价态, 进一步确定了在反应过程中起催化作用的活性相或活性位点. 通过Micromeritics ASAP2020对材料进行BET比表面积测试, 确定其比表面积以评定催化剂活性. 通过FEI TALOS F200高角环形暗场扫描透射电子显微镜(HAADF-STEM)及元素分布图确定元素分布情况.
1.3 电催化性能测试取5 mg催化剂, 向其中添加无水乙醇(500 μL)以及Nafion溶液(25 μL), 超声30 min后得到催化剂油墨. 然后取5 μL溶液滴涂到3 mm直径玻碳电极上(GC 0.070 7 cm2), 使催化剂在电极上形成均匀分散的薄膜, 晾干后开始测试. 所有电化学性能的测试在CHI760E电化学工作站上进行, 将涂有催化剂油墨的玻碳电极作为工作电极, 铂片作为对电极, Ag/AgCl作为参比电极, 组成三电极体系, 在1 mol·L-1 KOH碱性电解液中来评价催化剂的催化效果.
循环伏安(CV)测试扫描速度为50 mV·s-1, 扫描范围为-2~1.8 V; 线性扫描伏安法(LSV)测试扫描速度为5 mV·s-1, 区间设置为-0.5~-2 V(vs.Ag/AgCl); 电化学阻抗谱(EIS)测试振幅为10 mV, 频率范围为0.01~1×105 Hz; 计时电流(i-t)法测试时间为25 h.
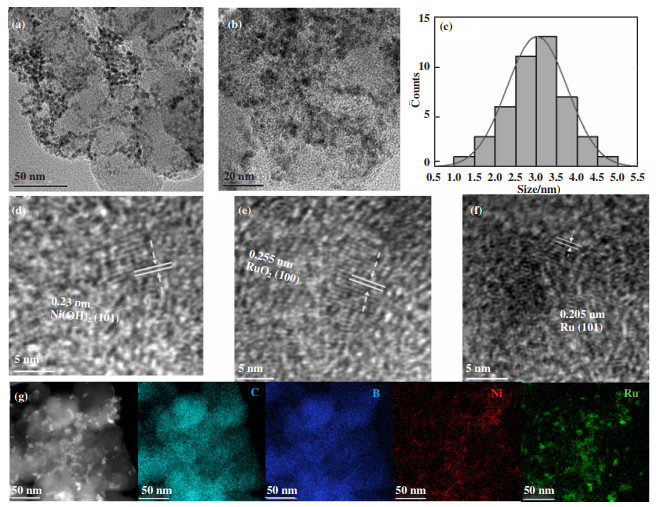
2 结果与讨论 2.1 TEM、HRTEM以及BET测试Ru-Ni/C催化剂的TEM图(图 1(a)、(b))可以观察到, 微小的纳米颗粒在炭载体上分散良好, 没有出现明显的聚集, 大部分呈球形, 粒径分布直方图(图 1(c))和元素分布图可以看到Ru、Ni平均纳米颗粒尺寸大约为2~5 nm. HRTEM(图 1(d)-(f))能看到晶格间距分别为0.233、0.255和0.205 nm的晶格条纹, 这分别与Ni(OH)2(101)、RuO2(100)和Ru(101)晶面非常吻合. 表明Ni大部分以氧化物形式存在, Ru以金属单质及氧化物形式存在, 大多数Ru原子和少量Ni原子被还原导致氢溢出, 从而产生Ru和Ni(OH)2活性中心的协同效应. 另外, 我们做了BET比表面积的测试, 结果显示Ru-Ni/C比表面积为133.96 m2·g-1, 相较于Ru/C(58.06 m2·g-1)、Ni/C(13.07 m2·g-1)以及C载体(70.02 m2·g-1), 均有大幅提高, 可能是对比样品催化剂团聚, 而Ru-Ni/C催化剂较为分散, 孔隙增多的缘故. HAADF-STEM和C、B、Ni、Ru的元素分布图(图 1(g))进一步证实了纳米颗粒分散程度很高, 颗粒较细, 颗粒之间大量的孔隙有利于气体的扩散和电解液的渗透, 提高了反应的动力学.
|
图 1 Ru-Ni/C的TEM图谱((a)、(b)), 粒径分布直方图(c), HRTEM图(d)-(f); HAADF-STEM和元素分布图(C、B、Ni、Ru)(g) Fig.1 TEM spectra ((a)、(b)), particle size distribution histogram (c) and HRTEM spectra (d)-(f); (g) HAADF-STEM image and EDS mappings of C, B, Ni, Ru of Ru-Ni / C |
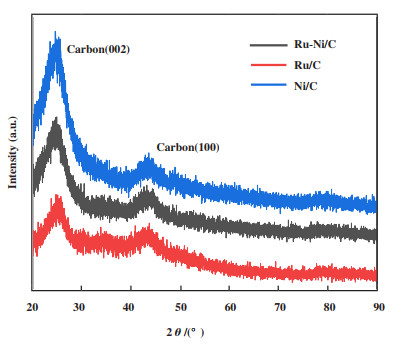
通过XRD测试确定了催化剂的相组成, 如图 2所示, 3种催化剂在25°和45°都有峰且形状相似, 所以只能判定这两个峰为C(002)和C(100)[21-24], 在3条图谱中并没有观察到Ru或Ni的任何衍射峰, 说明RuNi纳米粒子均匀分散, 可能以微小的纳米粒子形式分布在炭载体上.
|
图 2 Ru-Ni/C、Ru/C、Ni/C的XRD图谱 Fig.2 XRD patterns of Ru-Ni/C, Ru/C, Ni/C |
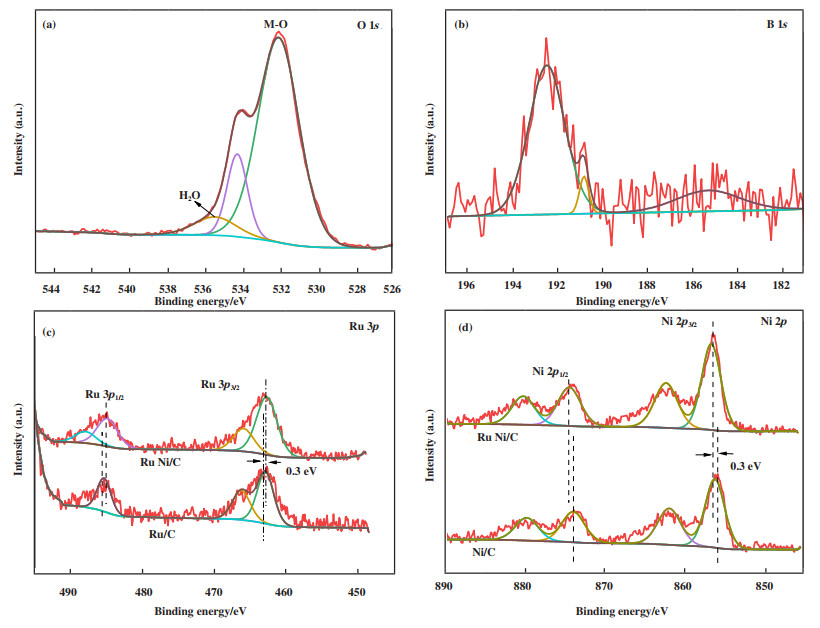
为了进一步确定催化剂的组成元素与价态, 对其进行了X射线光电子能谱(XPS)测试, 如图 3所示, 每个光谱都是根据C 1s (284.8 eV)的结合能进行校正的. O 1s中分别位于532.0和535.5 eV处的峰, 分别归属于表面羟基和吸附H2O(图 3(a))[25-26]. 按照实验条件, 可能有硼化镍生成[27], 为了证实是否存在NiB, 测试了硼的XPS谱(图 3(b)), B 1s中位于193.0 eV处的峰归属于B-O键, 在188.0 eV(B-Ni键)处未出现峰, 说明生成了B2O3, 没有NiB生成.
|
图 3 Ru-Ni/C的(a) O 1s; (b) B 1s; (c) Ru 3p; (d) Ni 2p的XPS图谱 Fig.3 The XPS spectra comparison of (a) O 1s; (b) B 1s; (c) Ru 3p; (d) Ni 2p of Ru-Ni/C |
对于我们的催化剂, Ru 3d的XPS光谱信号不明显, 因为Ru 3d XPS光谱通常被来自碳的强C 1s信号所掩盖[28]. 因此, Ru的XPS测量在450.0~492.0 eV范围内进行, 可以观察到Ru 3p峰(图 2c). Ru 3p3/2光谱中462.0和465.0 eV结合能处的峰值对应于Ru(0)和Ru4+(RuO2)[29]. Ru 3p1/2 XPS光谱中的其他两个峰(484.0和486.2 eV)可分别归属于金属钌(Ru(0))和氧化态钌(RuO2)[30-31]. 对比我们的催化剂, 表明Ru(0)和RuO2共存于Ru-Ni/C样品表面, RuO2的存在是Ru(0)纳米粒子的表面氧化所致[32]. 462.7 eV处的结合能对应于Ru(0).
已知Ni 2p峰位于862.0和882.1 eV时归因于多电子激发[33-34], 在结合能为852.7、853.9、855.4和857.1 eV时出现的Ni 2p3/2峰分别归属于Ni(0)、NiO、Ni(OH)2和NiOOH, 870.0、871.2、872.9和874.4 eV的结合能分别对应于Ni 2p1/2 XPS光谱(图 2(d))中的Ni(0)、NiO、Ni(OH)2和NiOOH[35-36]. NiO主要来源于空气中Ni的氧化, 而Ni(OH)2的形成可能是由于NiO与空气中H2O的反应所致. 通过比较结合能发现催化剂中镍的存在形式是Ni(OH)2, 催化剂的XPS图谱分析与HRTEM图的晶格条纹分析结果相一致. 相比于Ru/C和Ni/C, Ru-Ni/C的Ru 3p峰向低结合能端偏移约0.3 eV, Ni 2p峰值向高结合能端偏移约0.3 eV, 这意味着在形成RuNi双金属催化剂的过程中, 电子从Ni转移到Ru, 导致Ru的电子密度更高, 表明两金属间存在协同效应.
2.3 电催化性能分析我们对碱性条件下催化剂的析氢性能做了全面的的分析, Ru-Ni/C催化剂展示出优异的电化学性能. 用线性扫描伏安法(LSV), 在温室条件下, 用1 mol·L-1 KOH溶液做电解液, 以5 mV·S-1的扫描速率, 对Ru-Ni/C与对照材料Ni/C和Ru/C的析氢性能进行测试, 还测试了商用20% Pt/C的LSV曲线用于参照, 实验结果如图 4(a)所示. LSV曲线表明, 3种材料的HER活性顺序为: Ru-Ni/C > Ru/C > Ni/C. 在10 mA·cm-2的电流密度下, Ru-Ni/C催化剂过电位为34.4 mV, 小于Ru/C(51.5 mV)和Ni/C(656.1 mV), 仅比商用20% Pt/C(22.5 mV)高了10.9 mV, 表明Ni可以与Ru发生协同作用, 有效提高催化性能. 如图 4(b)所示, 根据LSV曲线绘出对应Tafel曲线, Ru-Ni/C催化剂的Tafel斜率是60.3 mV·dec-1, 小于Ru/C(70.5 mV·dec-1)和Ni/C(244.4 mV·dec-1), 甚至比商用Pt/C(66.7 mV·dec-1)还小, 表明了Ni的加入加快了Ru-Ni/C催化剂HER的有效催化动力学, 催化性能最好.

|
图 4 在1 mol·L-1 KOH中(a)扫描速率为5 mV·s-1时催化剂的极化曲线; (b)相应的塔菲尔曲线图; (c) Ru-Ni/C在非法拉第区域不同扫速下的CV曲线; (d) 3种催化剂电流密度-扫描速率的线性拟合图 Fig.4 (a) The polarization curve of the catalysts at a scanning rate of 5 mV·s-1 in 1 mol·L-1 KOH; (b) Corresponding Tafel curve; (c) The CVs of Ru-Ni/C at different scan rate; (d) Linear fitting diagram of current density and scanning rate of three catalysts |
催化剂的活性中心也是需要考虑的一个非常重要的因素, 首先选取非法拉第区域以不同的扫描速率记录了3种材料的CV曲线, Ru-Ni/C的CV曲线图如图 4(c)所示. 然后我们将非法拉第过程的CV曲线拟合判断3种材料的双电层电容(Cdl), 再进一步推算电化学表面积(ECSA)的大小. 测试过程中依次选取的扫描速率为20、40、60、80、100 mV·s-1, 所得结果如图 4(d)所示, Ru-Ni/C的Cdl值为15.9 mF·cm-2, 大于Ru/C(4.1 mF·cm-2)和Ni/C(0.7 mF·cm-2), 通过ECSA=Cdl/Cs可求得ECSA, 但Cs常数精确性不够, 常以Cdl值反映ECSA的大小, 即Ru-Ni/C催化剂的ESCA值最大, 该结果与LSV及Tafel斜率结果相一致, 这说明RuNi掺杂后的催化剂具有更大的活性表面积, 更多的催化活性位点, 可有效提高HER电催化性能, 加速其催化反应动力学.
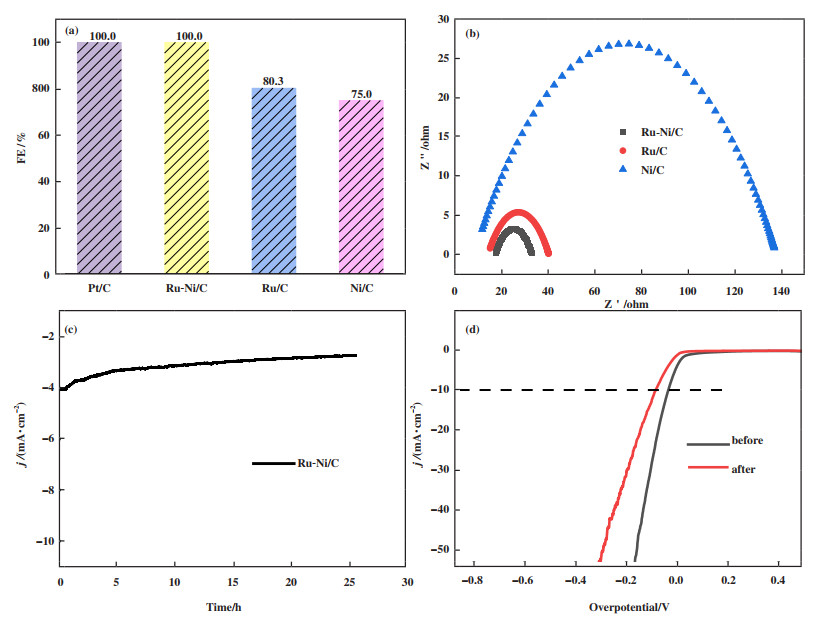
我们还探究了4种催化剂在100 mA下的法拉第效率(图 5(a)), RuNi/C的法拉第效率与Pt/C类似, 都在100%, 大于Ru/C和Ni/C, 说明其电解水性能优异. 通过探究阻抗图谱(图 5(b))对催化剂在碱性溶液中的析氢过程进行了研究, Ru-Ni/C的半圆直径最小, 说明其电荷转移电阻值最小, 电子转移速率更快, 说明C负载Ru-Ni双金属的电极动力学最优.
|
图 5 (a) 法拉第效率图; (b)催化剂在1 mol·L-1 KOH溶液中的交流阻抗(EIS)图; (c) 1 mol·L-1 KOH溶液中Ru-Ni/C的i-t曲线; (d) CV循环1 000 r·min-1后LSV曲线 Fig.5 (a) Faraday efficiency diagram; (b) The EIS diagram of catalysts in 1 mol·L-1 KOH solution; (c) i-t curve of Ru-Ni/C in 1 mol·L-1 KOH solution (d) LSV curve after 1 000 r·min-1 of CV cycling |
最后对Ru-Ni/C催化剂的稳定性进行了测试, 在1 mol·L-1 KOH溶液中进行25 h i-t测试(图 5(c)). i-t图显示随着测试时间增加电流密度只小幅度上升, 稳定性良好. 粉末状催化剂附着在玻碳电极上产生的气泡可能会覆盖电极表面, 导致电极接触不到电解液, 因此我们还扫描了1 000 r·min-1非法拉第区域的CV曲线来评判催化剂的稳定性(图 5(d)), 扫描后的LSV曲线与扫描之前对比, 在10 mA·cm-2时过电位仅上升了49.6 mV, 说明了Ru-Ni/C在碱性电解液中具有优异的稳定性.
3 结论综上所述, 我们用沉积沉淀法合成了在碱性介质中有优异HER性能的Ru-Ni/C催化剂, 对其进行XRD、TEM、XPS等表征, 观察到催化剂分散均匀, 有明显的晶格条纹. 在电化学性能测试中, LSV曲线显示电流密度为10 mA·cm-2, 过电位仅为34.4 mV, Tafel斜率(为60.33 mV·dec-1)比商用Pt/C还小. CV拟合曲线和EIS图谱显示, 相比于Ru/C和Ni/C, Ru-Ni/C有更大的电化学活性表面积以及更低的电荷转移电阻, i-t曲线表明其能在KOH溶液中稳定存在25 h, 表明RuNi双金属的协同效应很大程度上促进了催化剂的催化性能, 为发展高效的碱性电解水制氢阴极催化剂提供了新思路.
| [1] |
Li Z, Zhang W, Zhang R, et al. Development of renewable energy multi-energy complementary hydrogen energy system (a case study in China): A review[J]. Energ Explor Exploit, 2020, 38(6): 2099–2127.
DOI:10.1177/0144598720953512 |
| [2] |
Deng J, Ren P, Deng D, et al. Enhanced electron penetration through an ultrathin graphene layer for highly efficient catalysis of the hydrogen evolution reaction[J]. Angew Chem, Int Ed, 2015, 54(7): 2100–2104.
DOI:10.1002/anie.201409524 |
| [3] |
Li Y, Yang T, Li H, et al. Transformation of Fe-B@Fe into Fe-B@Ni for efficient photocatalytic hydrogen evolution[J]. J Coll Interf Sci, 2020, 578: 273–280.
DOI:10.1016/j.jcis.2020.05.124 |
| [4] |
Jiao M, Chen Z, Zhang X, et al. Multicomponent N doped graphene coating Co@Zn heterostructures electrocatalysts as high efficiency HER electrocatalyst in alkaline electrolyte[J]. Int J Hydrogen Energy, 2020, 45(33): 16326–16336.
DOI:10.1016/j.ijhydene.2020.04.121 |
| [5] |
Devi B, Koner R R, Halder A. Ni(Ⅱ)-dimeric complex-derived nitrogen-doped graphitized carbon-encapsulated nickel nanoparticles: Efficient trifunctional electrocatalyst for oxygen reduction reaction, oxygen evolution reaction, and hydrogen evolution reaction[J]. ACS Sustainable Chem Eng, 2019, 7(2): 2187–2199.
DOI:10.1021/acssuschemeng.8b04883 |
| [6] |
Lu X, Cai M, Huang J, et al. Ultrathin and porous Modoped Ni nanosheet arrays as high-efficient electrocatalysts for hydrogen evolution reaction[J]. J Coll Interf Sci, 2020, 562: 307–312.
DOI:10.1016/j.jcis.2019.12.001 |
| [7] |
Li C, Wang J, Wang Y, et al. Enhancing hydrogen evolution reaction by synergistically coupling NiMo alloy with Ni(OH)2 nanosheet on carbon cloth[J]. Chem Select, 2020, 5(22): 6774–6779.
|
| [8] |
Wu M X, Chen Y, Li S, et al. Nanosized amorphous nickel-boron alloy electrocatalysts for hydrogen evolution reaction under alkaline conditions[J]. J Fuel Chem Technol, 2022, 51: 1–8.
|
| [9] |
Kavian R, Choi S I, Park J, et al. Pt-Ni octahedral nanocrystals as a class of highly active electrocatalysts toward the hydrogen evolution reaction in an alkaline electrolyte[J]. J Mater Chem A, 2016, 4(32): 12392–12397.
DOI:10.1039/C6TA05411K |
| [10] |
Wu W, Liu J, Johannes N, et al. Galvanostatic electrodeposition of thin-film Ir-Ni electrocatalyst on copper foam for HER performance in alkaline electrolyte[J]. Catal Lett, 2020, 150(5): 1325–1336.
DOI:10.1007/s10562-019-03038-5 |
| [11] |
Kweon D H, Okyay M S, Kim S J, et al. Ruthenium anchored on carbon nanotube electrocatalyst for hydrogen production with enhanced Faradaic efficiency[J]. Nat Commun, 2020, 11(1): 1278.
DOI:10.1038/s41467-020-15069-3 |
| [12] |
Mahmood J, Li F, Jung S M, et al. An efficient and pH-universal ruthenium-based catalyst for the hydrogen evolution reaction[J]. Nat Nanotechnol, 2017, 12(5): 441–446.
DOI:10.1038/nnano.2016.304 |
| [13] |
Zheng Y, Jiao Y, Zhu Y, et al. High electrocatalytic hydrogen evolution activity of an anomalous ruthenium catalyst[J]. J Am Chem Soc, 2016, 138(49): 16174–16181.
DOI:10.1021/jacs.6b11291 |
| [14] |
Karlberg G S. Adsorption trends for water, hydroxyl, oxygen, and hydrogen on transition-metal and platinum-skin surfaces[J]. Phys Rev B, 2006, 74: 153414.
DOI:10.1103/PhysRevB.74.153414 |
| [15] |
Li F, Han G F, Noh H J, et al. Mechanochemically assisted synthesis of a Ru catalyst for hydrogen evolution with performance superior to Pt in both acidic and alkaline media[J]. Adv Mater, 2018, 30(44): 1803676.
DOI:10.1002/adma.201803676 |
| [16] |
Qiu T, Liang Z, Guo W, et al. Highly exposed ruthenium-based electrocatalysts from bimetallic metal-organic frameworks for overall water splitting[J]. Nano Energy, 2019, 58: 1–10.
DOI:10.1016/j.nanoen.2018.12.085 |
| [17] |
Liu A, Yang Q, Ren X, et al. Two-dimensional CuAg/Ti3C2 catalyst for electrochemical synthesis of ammonia under ambient conditions: a combined experimental and theoretical study[J]. Sustainable Energy & Fuels, 2020, 4(10): 5061–5071.
|
| [18] |
Wang Q, Ming M, Niu S, et al. Scalable solid-state synthesis of highly dispersed uncapped metal (Rh, Ru, Ir) nanoparticles for efficient hydrogen evolution[J]. Adv Energy Mater, 2018, 8(31): 1801698.
DOI:10.1002/aenm.201801698 |
| [19] |
Liu Y, Li X, Zhang Q, et al. A general route to prepare low-ruthenium-content bimetallic electrocatalysts for pH-universal hydrogen evolution reaction by using carbon quantum dots[J]. Angew Chem, Int Ed, 2020, 59(4): 1718–1726.
DOI:10.1002/anie.201913910 |
| [20] |
Gao Sen(高森), Yang Mao-xia(杨茂夏), Li Shao-min (李绍敏), et al. Preparation and electrocatalysis hydrogen evolution research of cobalt nanoparticles supported on carbon spheres(碳球担载二硫化钴纳米复合电催化剂的制备及其析氢性能研究)[J]. J Mol Catal(China) (分子催化), 2018, 32(3): 261-267.
|
| [21] |
Bernsmeier D, Sachse R, Bernicke M, et al. Outstanding hydrogen evolution performance of supported Pt nanoparticles: Incorporation of preformed colloids into mesoporous carbon films[J]. J Catal, 2019, 369: 181–189.
DOI:10.1016/j.jcat.2018.11.006 |
| [22] |
Ilkaeva M, Krivtsov I, García-López E I, et al. Selective photocatalytic oxidation of 5-hydroxymethylfurfural to 2, 5-furandicarboxaldehyde by polymeric carbon nitride-hydrogen peroxide adduct[J]. J Catal, 2018, 359: 212–222.
DOI:10.1016/j.jcat.2018.01.012 |
| [23] |
Zhang H B, Lin G D, Zhou Z H, et al. Raman spectra of MWCNTs and MWCNT-based H2-adsorbing system[J]. Carbon, 2002, 40(13): 2429–2436.
DOI:10.1016/S0008-6223(02)00148-3 |
| [24] |
Egbert J D, Lopez-Ruiz J A, Prodinger S, et al. Counting surface redox sites in carbon-supported electrocatalysts by cathodic stripping of O deposited from N2O[J]. J Catal, 2018, 365: 405–410.
DOI:10.1016/j.jcat.2018.07.026 |
| [25] |
Li B, Jian J, Chen J, et al. Nanoporous 6H-SiC photoanodes with a conformal coating of Ni–FeOOH nanorods for zero-onset-potential water splitting[J]. ACS Appl Mater Inter, 2020, 12(6): 7038–7046.
DOI:10.1021/acsami.9b17170 |
| [26] |
Kim C, Kim S H, Lee S, et al. Boosting overall water splitting by incorporating sulfur into NiFe (oxy)hydroxide[J]. J Energy Chem, 2022, 64: 364–371.
DOI:10.1016/j.jechem.2021.04.067 |
| [27] |
Li Y, Zhang W, Li H, et al. Ni-B coupled with borate-intercalated Ni(OH)2 for efficient and stable electrocatalytic and photocatalytic hydrogen evolution under low alkalinity[J]. Chem Eng J, 2020, 394: 124928.
DOI:10.1016/j.cej.2020.124928 |
| [28] |
Ronning C, Feldermann H, Merk R, et al. Carbon nitride deposited using energetic species: A review on XPS studies[J]. Phys Rev B, 1998, 58(4): 2207–2215.
DOI:10.1103/PhysRevB.58.2207 |
| [29] |
Carrillo A I, Schmidt L C, Marín M L, et al. Mild synthesis of mesoporous silica supported ruthenium nanoparticles as heterogeneous catalysts in oxidative wittig coupling reactions[J]. Catal Sci Technol, 2014, 4(2): 435–440.
DOI:10.1039/C3CY00773A |
| [30] |
Yamauchi Y, Ohsuna T, Kuroda K. Synthesis and structural characterization of a highly ordered mesoporous Pt-Ru alloy via "evaporation-mediated direct templating"[J]. Chem Mater, 2007, 19(6): 1335–1342.
DOI:10.1021/cm062539n |
| [31] |
Lasch K, Jörissen L, Garche J. The effect of metal oxides as co-catalysts for the electro-oxidation of methanol on platinum-ruthenium[J]. J Power Sources, 1999, 84(2): 225–230.
DOI:10.1016/S0378-7753(99)00321-3 |
| [32] |
Miao S, Liu Z, Han B, et al. Ru nanoparticles immobilized on montmorillonite by ionic liquids: A highly efficient heterogeneous catalyst for the hydrogenation of benzene[J]. Angew Chem, Int Ed, 2006, 45(2): 266–269.
DOI:10.1002/anie.200502632 |
| [33] |
Park K W, Choi J H, Kwon B K, et al. Chemical and electronic effects of Ni in Pt/Ni and Pt/Ru/Ni alloy nanoparticles in methanol electrooxidation[J]. J Phys Chem B, 2002, 106(8): 1869–1877.
DOI:10.1021/jp013168v |
| [34] |
Deivaraj T C, Chen W, Lee J Y. Preparation of PtNi nanoparticles for the electrocatalytic oxidation of methanol[J]. J Mater Chem, 2003, 13(10): 2555–2560.
DOI:10.1039/b307040a |
| [35] |
Wang Sha-sha(王莎莎), Yu Bo(于博). Preparation of (NiCo)2P/NF self-supporting electrode and its electrocatalytic water splitting(金属磷化物(NiCo)2P/NF自支撑电极制备及其电催化研究)[J]. J Mol Catal(China)(分子催化), 2020, 34(1): 81-86.
|
| [36] |
Li Zuo-peng(李作鹏), Zhao Yao-xiao(赵耀晓), Liu Wei (刘卫), et al. Facile synthesis of spine-like NiCo2O4 nanorods as highly efficient electrocatalysts for oxygen reduction and evolution reactions(脊椎状NiCo2O4纳米棒的制备及其析氧和氧还原性能研究) [J]. J Mol Catal(China) (分子催化), 2019, 33(1): 19-26.
|
 2023, Vol. 37
2023, Vol. 37


