2. 武汉理工大学 光纤传感技术与网络国家工程研究中心, 湖北 武汉 430074
2. National Engineering Research Center of Fiber Optical Sensing Technology and Networks, Wuhan University of Technology, Wuhan 430074, China
尿素由碳、氢、氧、氮等元素组成, 是最简单的有机小分子之一. 尿素本身是含氮量最高的氮肥, 也可用于合成70%的其他各类氮肥. 同时, 作为一种重要的化工原料, 尿素的生产对于国民经济建设和农业生产有着直接的影响. 1828年德国化学家Wöhler首次实现了尿素的合成[1]. 此后, 人工合成尿素的研究逐渐受到学者们的广泛关注. 目前, 尿素的工业化生产过程是将氨气(NH3)和二氧化碳(CO2)在高温高压下(150~200 ℃、15 ~ 25 MPa)形成氨基甲酸胺, 随后脱水形成尿素分子. 其中, 原料NH3主要通过Haber-Bosch法(N2 + 3H2 → 2NH3)获取, 能耗巨大, 且尿素生产需消耗每年全球所生产的80%的NH3. 如何在温和条件下, 利用廉价的原料实现尿素的高效合成, 已成为亟待解决的重要研究课题. N2在空气中的占比高达78%, 且由于化石燃料的过渡消耗导致全球CO2浓度急剧增加, 利用电催化技术, 在温和条件下将两种分子同时还原合成尿素(N2 + CO2 + 6H+ + 6e- → CO(NH2)2 + H2O), 对解决能源环境问题和进一步实现“双碳”战略有着重大的意义.
随着新材料研发和制备技术的不断提升, 电催化分解水制氢效率在过去十几年有了显著的提升. 随后, 学者们逐渐将目光转向电催化CO2还原、N2还原制备高附加值化学品等方面, 并开发出各类成本低廉、性能优异的电催化剂. 在此基础上, 利用电催化碳氮(C-N)偶联技术, 在常温常压条件下同时将CO2和N2合成为尿素, 具有更大的挑战性. 由于CO2和N2分子均具有化学惰性, 在催化剂表面的化学吸附较弱, 且反应过程中存在其他非偶联竞争反应, 造成尿素电合成反应的过电位较高、法拉第效率(FE)低、尿素分子的选择性低等一系列问题. 众所周知, 电催化剂是小分子电合成反应体系的核心组成部分, 进一步优化反应物分子在催化剂表面的化学吸附, 改善碳氮偶联能力, 对提升尿素电合成的效率发挥着至关重要的作用. 我们结合尿素电合成领域电催化剂的最新研究进展, 系统总结了不同电催化剂的设计方法、催化机制和性能提升策略, 随后探讨了电催化合成尿素的反应机理, 分析了该领域目前存在的主要问题, 并展望了后续研究的发展方向.
1 电催化碳氮偶联合成尿素简介1995年, 日本学者Furuya及其团队[2]率先提出C-N偶联合成尿素的研究设想. 随后该团队通过设计气体扩散电极, 利用各类不同金属催化剂相继实现了CO2和亚硝酸根(NO2-)、硝酸根(NO3-)电还原制备尿素[3-6]. 2019年, 美国特拉华大学Feng Jiao教授使用电催化C-N偶联技术, 将CO和NH3合成为酰胺、醋酸、正丙醇、乙醇、乙烯等一系列有机小分子[7]. 2020年, 湖南大学王双印教授团队[8]以二氧化钛(TiO2)负载钯金(PdAu)合金作为电催化剂, 在温和条件下直接将N2和CO2分子转化为尿素. 随后, 电催化合成尿素逐渐引发了学者们的广泛关注[9-14].
和传统的尿素合成方法相比, 电催化C-N偶联合成尿素具有以下几个优势: (1) 有机氮化合物小分子的合成一般需要在高温高压下实现, 而电催化反应通常在室温和标准大气压下进行, 反应条件温和, 能耗较低; (2) 尿素合成时以CO2为碳源, 可实现CO2的高效利用和转化; (3) 除NH3之外, 也可选用N2、NO3-、NO2-、NO等作为氮源[15]. 其中, N2储量最为丰富; NO是有毒气体; NO3-和NO2-在水中富集则会对公众健康和环境产生危害. 利用电催化技术将各类氮源转化为尿素, 可以实现惰性或有毒有害气体以及废弃物的资源化转化.
然而, 尿素电合成技术的工业化应用仍面临着巨大的挑战, 尤其是直接利用N2作为氮源来合成尿素, 反应效率仍然较低. 一方面, N2的低溶解度(~0.66 mmol·L-1)直接影响了电催化效率[16]. N2分子结构是非极性的, 本征极化率低且N≡N的解离能大(946 kJ·mol-1), 导致N2分子在水溶液中的溶解度和扩散系数均非常小, 因此N2在催化活性位点的吸附并不理想, 且电催化反应过程中N2的传质动力学较为缓慢. 另一方面, 由于C-N偶联反应和碳源、氮源各自的还原反应(例如CO2还原为C1、C2分子; N2还原为NH3)存在竞争关系, 尽管在反应过程中增大过电位能够获得更高的电流密度, 但副反应的出现导致尿素电合成的法拉第效率也逐渐降低.如图 1所示, 传统电解水的能量效率为~70%, 而尿素电合成仅有~50%[9]. 因此, 如何进一步改善尿素的选择性, 对于提升尿素电合成的整体效率尤为重要.
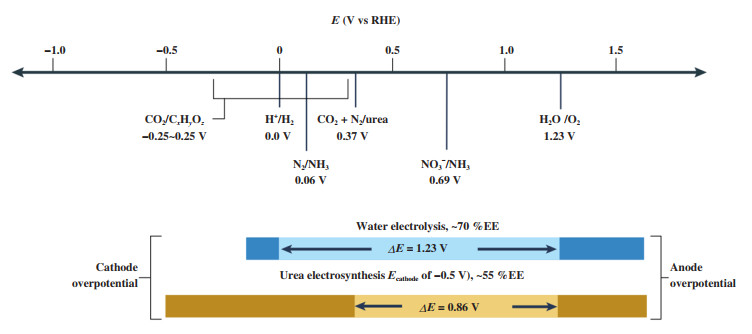
|
图 1 尿素电合成和电解水的电位对比[9] Fig.1 Comparison of potentials of water electrolysis and urea electrosynthesis[9] |
目前常用的电催化装置主要有3种, 其中H型电解槽由于结构简单、成本低, 其使用频率最高. 如图 2(a)所示, H型电解槽包含阴极反应腔体(包含工作电极和参比电极)和阳极反应腔体(包含对电极), 中间则由离子交换膜分隔. 离子交换膜能够阻碍产物的扩散流动, 但并不会影响离子电导率. 工作电极通常选用金属片、碳纸、碳布或玻碳电极等作为电催化剂的载体. 对电极则一般选用铂电极或石墨棒. 此外, 由于不同反应体系中, 电解液的pH值不同, 根据不同需求, 参比电极通常选用Hg/Hg2SO4、Ag/AgCl、Hg/HgO、Hg/Hg2Cl2等. 在用于电催化尿素合成时, 阴极产物为尿素, 而阳极一般则发生析氧反应.
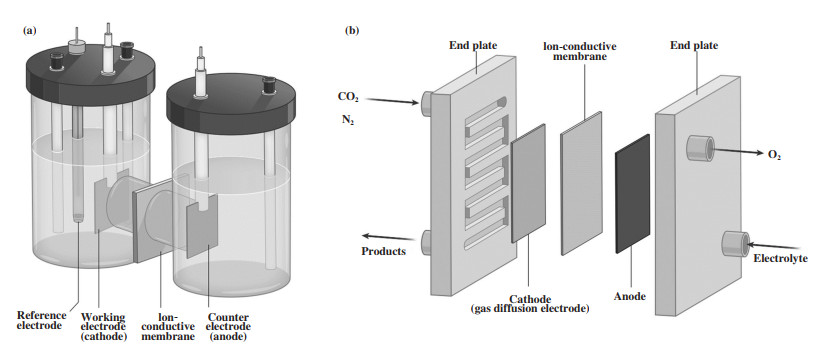
|
图 2 电催化装置示意图[17] Fig.2 Schematic illustration of electrocatalytic cells[17] (a) H型电解槽和(b) 流动相电解槽 (a) H-type cell and (b) flow cell |
由于CO2和N2在电解液中溶解度较低, 因此选用流动相电解槽(FC)可以改善反应过程中的传质. FC主要由阴极、阳极和离子交换膜3部分组成(图 2(b)), 其中阴极部分通常选用气体扩散电极(GDE), 电解液则在阴极和阳极反应腔体之间流动. GDE包含气体扩散层和催化剂层, 前者表面疏水, 主要用于气体扩散通道和电催化剂的载体. 气相反应物通过多孔气体扩散层与催化剂、电解液发生接触, 形成气体-电解液-催化剂三相界面.
膜电极组件电解槽(MEA)和流动相电解槽相类似, 区别在于前者没有阴极电解液且采用加湿的反应物气流作为进料气体. 去除阴极电解液后, GDE不再发生溢流且欧姆电阻减小, 能够改善电催化反应的稳定性和能量效率[11]. 此外, MEA中的产物均为气相, 可通过凝聚进一步收集和分离. 目前, 电催化尿素合成的文献中尚未采用过MEA装置.
3 各类尿素电合成催化剂及其研究策略电催化合成尿素过程中, 影响尿素的选择性和产率的两个主要因素是:(1) 碳源和氮源在催化剂表面的吸附行为; (2) 碳源和氮源同时发生还原后, 能够尽可能形成尿素合成所需的中间体. 因此, 电催化剂在尿素电合成过程中发挥着至关重要的作用. 以下将着重介绍近期关于贵金属、过渡金属、单原子、金属(氢)氧化物、非金属等不同催化剂在尿素电合成中的应用(各类催化剂的性能已汇总于表 1中), 主要介绍各类电催化剂的设计思路、性能特点以及催化活性提升的微观机制.
| 表 1 不同电催化剂合成尿素的性能对比 Table 1 Performance comparison of different eletrocatalysts for urea synthesis |
贵金属由于催化活性高、稳定性好, 在热催化、光催化、电催化等各类非均相催化领域有着广泛的用途. Kayan等[18]报道了聚苯胺和聚吡咯修饰的铂(Pt)电极及尿素合成的电催化性能. 两种聚合物修饰的Pt电极分别呈现条状和近似球状的显微结构. 在0.1 mol·L-1 Li2SO4/0.03 mol·L-1 H+电解液中, N2和CO2均能在聚合物修饰的Pt电极上发生还原, 且聚吡咯修饰后N2的还原效果更好. N2还原后提升氨浓度, 直接导致聚吡咯修饰Pt电极的尿素产量更大, 可达到21.2 μmol, 是聚苯胺修饰Pt电极的1.77倍. 然而, 除尿素外电催化产物中还存在氨和甲酸, 一定程度上影响了尿素的选择性. Liu等[19]利用一步化学还原法, 在4-氨基吡啶溶液中将暴露(111)晶面的AuCu合金纳米线自组装为纳米纤维, 实现了NO2-和CO2电还原合成尿素(产率为3.889 mg·h-1·mgcat-1), 在-1.55 VRHE时的FE为24.7%. 独特的一维结构具有各向异性和大比表面积, 能够提升双金属原子的利用率, 加速电荷传输速率并避免催化剂的团聚和溶解. 此外, AuCu纳米纤维中存在孪晶、堆积层错和原子台阶等结构缺陷, 可作为催化活性中心. 同时, 合金化也能够调控两种金属的配位结构和电子结构, 从而显著提升了电催化性能. Shao及其合作者[20]合成了Pd纳米颗粒并通过掺杂碲(Te)提升电催化性能. 理论计算发现Te和Pd之间存在协同效应, 能够显著促进CO2→*CO和NO2-→*NH2的还原效果. 此外, 未掺杂的Pt纳米晶在反应时, 还原产物为N2, 而该反应在Te掺杂后得到有效抑制. Te掺杂Pd纳米晶在-1.1 VRHE时合成尿素的FE为12.2%且氮原子利用效率高达88.7%(未掺杂Pd纳米晶的FE和原子利用率仅为4.2%和21.8%).
3.2 过渡金属催化剂贵金属催化剂由于元素储量较低、成本高, 限制了其大规模工业化应用的可能. 除了减少贵金属比例的研究策略(如3.1中介绍的合金化、非金属掺杂等), 直接开发元素丰度高的过渡金属催化剂并不断优化其性能, 能够在维持催化效率的同时, 有效降低尿素电合成的生产成本. Huang等[21]先对比了10种不同金属的电催化尿素产率, 确定金属锌(Zn)的性能最佳, 随后通过电化学还原方法将ZnO纳米片还原为Zn纳米带, 用于NO和CO2电合成尿素. 电化学还原后, 极化曲线中的还原峰消失(图 3(a)). 原位X射线衍射(XRD)图谱也观察到随时间延长ZnO的X射线衍射峰消失而Zn的衍射峰信号逐渐增强(图 3(b)). 电催化过程中, NO和CO2分别还原为*NH2和*CO中间体, 然后发生偶联形成尿素分子(图 3(c)). 尿素的最佳产率为15.13 mmol·h-1且FE为11.26%. Yu及其合作者[22]设计了一种Cu@Zn核壳结构纳米线, 首先将铜网阳极氧化并煅烧获得氧化亚铜, 然后通过水热法在其表面生长氧化锌纳米棒, 最后电还原为Cu@Zn核壳结构. 由于Cu的功函数(4.63 eV)大于Zn(4.30 eV), 电子由Zn转移到Cu后导致Zn周围电子浓度降低, 更有利于还原. 微分电化学质谱、衰减全反射-傅立叶变换红外光谱(FTIR)和密度泛函(DFT)理论计算等结果证实了电子由Zn向Cu转移, 能够促进*NH2和*CO中间体的形成.
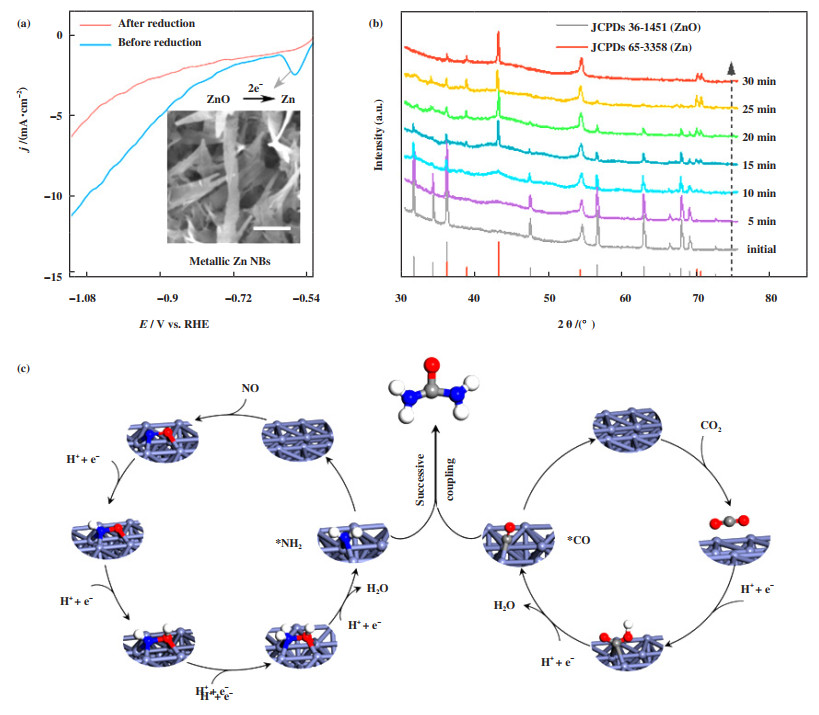
|
图 3 (a) 电还原前后ZnO纳米片的极化曲线; (b) -2.1 VRHE电压下不同反应时间的XRD图谱; (c) Zn表面尿素合成机理示意图[21] Fig.3 (a) LSV curves recorded on the ZnO NSs electrode before and after electroreduction; (b) Time-dependent in-situ electrochemical XRD patterns of ZnO under -2.1 VRHE; (c) Schematic illustration of urea formation mechanism on the surface of Zn[21] |
近年来, 凭借优异的电催化CO2还原性能, Cu基催化剂逐渐受到学者们的广泛关注[23-25]. 由于尿素电合成过程中需要快速实现CO2分子吸附并还原为活性中间体, 因此Cu基催化剂在电催化碳氮偶联合成尿素领域也有着潜在的应用前景. Liu等[26]以中性电解液中的Cu(100)晶面为研究对象, 利用从头算分子动力学模拟, 同时考虑电极电势以及水溶剂的动力学本质, 揭示了C-N偶联的根本原因. *NH和*CO是低过电位时形成C-N键的关键前驱体, 而高过电位时由于CO2还原的竞争反应, 导致合成尿素的电势范围变得更窄, 此时C-N偶联通过吸附*NH和溶剂化CO实现. Yang等[27]则开展了Cu(111)晶面C-N偶联合成尿素的理论研究. 和前期文献不同的是, 催化过程中形成首个C-N键可直接由气相CO2分子耦合实现, 并不涉及CO2还原后的中间体(例如*COOH、*CO). 该反应遵循Eley-Rideal机制且仅需要单个活性位点. 由于CO2和N1(表面束缚氮原子中间体)的形变能较小, C-N偶联的动力学更快, 两者间的相互作用源于N1向CO2发生电荷转移. Krzywda等[28]通过表面增强拉曼光谱和质谱, 发现NO3-和CO2在Cu电极表面形成类似Cu-C≡N的可溶性活性物种, 该活性物种的出现也是Cu表面重构的主要原因. Song及其合作者[29]设计了Cu-Bi双金属合金催化剂并研究了缺陷对尿素电合成性能的影响. 考虑distal(质子化反应发生在末端氮原子)和alternating(质子化反应在两个氮原子上交替进行)两种不同反应机制, 无缺陷和含金属缺陷Cu-Bi催化剂的决速步并不相同: 前者的distal和alternating机制的决速步都是*NN + *CO → *NCON*(势垒为2.63 eV); 而后者distal机制的决速步为*NCON* → *NHHCON(势垒为0.78 eV), alternating机制的决速步为*NH + *CO → *NCON*(势垒为0.76 eV). 和几种对照样品相比, 含缺陷的Cu-Bi合金在-0.4 VRHE时的最大尿素浓度为0.45 ± 0.06 mg·L-1, FE为8.7%±1.7%.
单原子催化剂中金属单原子均匀负载在各类载体表面作为催化活性中心, 金属单原子具有不饱和配位环境, 且由于尺寸减小导致表面自由能急剧增大并呈现出量子尺寸效应, 近年来在各类催化反应中已展现出优异的催化性能[30-32]. Xiong等[33]通过DFT研究了Ti、Cr、Nb、Mo、Ta等不同金属单原子修饰的α-硼烯催化剂, 发现催化性能与活性中心原子的d带中心以及电荷密度高度相关. 在建立d带中心和描述符φ之间的火山图后(图 4(a)), 发现提升M@α-硼烯电合成尿素活性需满足两个条件:反应限制电势适中(-0.4 < UL < 0 V); d带中心降低(-0.2 < εd < 0.8 eV). Kong等[34]以多孔氮化硼(p-BN)负载不同金属单原子为研究对象, 通过理论计算发现锚定的金属单原子和相邻的两个硼原子可以形成不对称的活性位点, 利用强弱电子极化效应充分活化氮气分子. 高通量DFT计算从不同金属单原子催化剂中筛选出Fe/p-BN和Co/p-BN, 选择性好且C-N偶联动力学势垒最低. 此外, 活性位点的电荷分布证实, 电催化合成尿素的性能取决于催化剂对于NCON*中间体的结合强度.
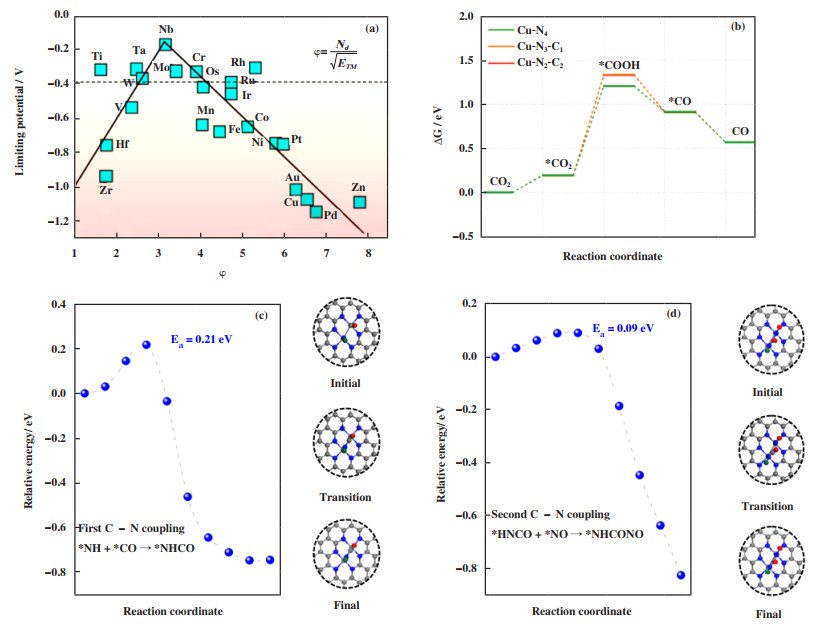
|
图 4 (a) M@α-硼烯的限制电势和新描述符φ之间的火山图[33]; (b) 铜单原子锚定石墨烯催化CO2还原的反应路径[35]; Fe-Ni双金属单原子催化剂的反应路径: (c) 第1次C-N偶联形成*NHCO(能量势垒为0.21 eV)和(d) 第2次C-N偶联形成*NHCONO(能量势垒为0.09 eV)[36] Fig.4 (a) Volcano plot for the urea synthesis based on the limiting potential of M@α-B as a function of the new descriptor φ[33]; (b) Reaction pathways for CO2 reduction to CO on Cu single atom anchored graphene[35]; The reaction pathway of (c) first C-N coupling for *NHCO formation and (d) second C-N coupling for *NHCONO[36] |
在理论研究的基础上, 近期单原子催化剂用于尿素电合成的实验研究也有相关的报道. Amal及其合作者[35]首次报道了单原子催化剂在尿素电合成领域的应用. 通过溶液浸渍-退火方法, 在石墨烯载体上负载了Cu单原子, 其中Cu-N-C配位构型能够同时实现CO2和NO3-还原. X射线吸收光谱证实提高热解温度后单原子催化剂的配位结构由Cu-N4转变为Cu-N4-x-C, 前者有利于CO2还原而后者则能够实现较高的产率. 此外, 电催化过程中*COOH中间体优先在Cu-N4位点上形成, 且该步骤是CO2还原和尿素合成的决速步(图 4(b)所示). Zhang等[36]也在同一时期开展了Fe-Ni双金属单原子催化剂的研究工作. 与分散双原子和单原子催化剂相比, 成键Fe-Ni原子对可作为活性位点实现反应分子的配位吸附以及活化. DFT计算证实了*NH和相邻*CO在成键Fe-Ni原子对位置存在热力学自发且动力学可行的偶联作用(图 4(c)), 重新形成Ni活性位点. 随后NO分子靠近新生成的Ni位点, *NHCO和*NO快速结合并转化为关键的*NHCONO中间体(图 4(d)), 伴随着质子耦合电子转移过程最终形成尿素分子. 该双金属单原子催化剂电催化合成尿素的产率可达到20.2 mmol·h-1·g-1且FE为17.8%(尿素、氨气和一氧化碳3种产物的总FE为100%).
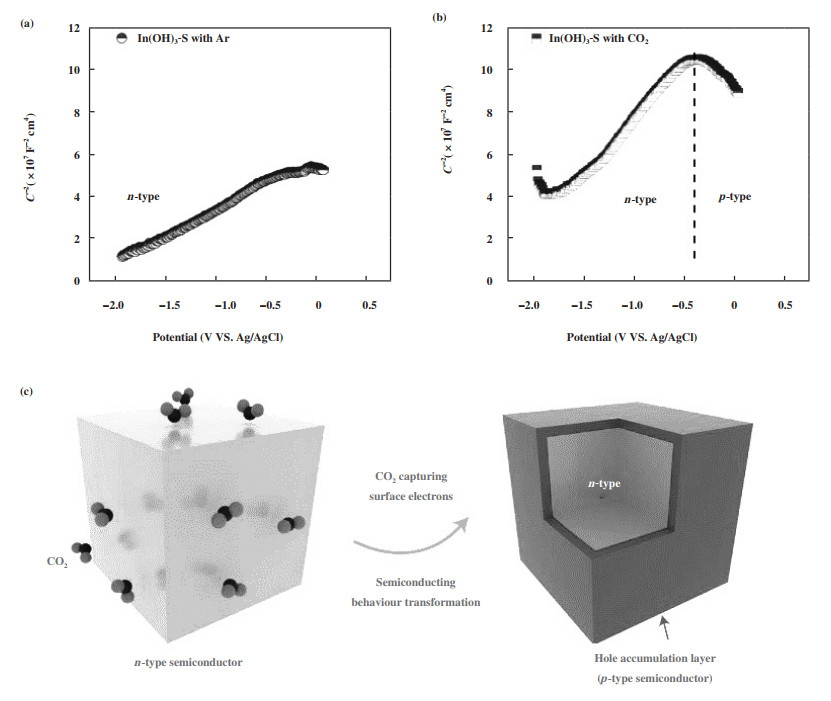
3.3 金属氢氧化物Yu及其合作者[37]报道了一种暴露{100}晶面族的氢氧化铟(In(OH)3)电催化剂及其尿素电合成的应用. CO2吸附后诱导了N型→P型半导体转变(图 5(a)-(c)), 表面形成空穴富集层能够有效抑制析氢反应, 且{100}晶面族的能量势垒最低, 有利于*NO2和*CO2中间体发生C-N偶联. 在-0.6 VRHE时尿素产率可达到533.1 μg·h-1·mgcat-1, FE、氮原子利用率以及碳选择性分别为53.4%、82.9%和~100%. 此外, 该团队也考察了氧空位对羟基氧化铟(InOOH)电合成尿素的影响[38]. 结合原位同步辐射-傅里叶变换FTIR测试和理论计算, 发现*CO2NH2的质子化是尿素合成的决速步. 此外, 氧空位能够将表面In活性位点的电子结构进行重构并降低*CO2NH2→*COOHNH2的能量势垒. 含有氧空位的InOOH在电合成尿素时产率为592.5 μg·h-1·mgcat-1, FE为51%.
|
图 5 (a) Ar或(b) CO2气氛中的莫特-肖特基测试结果(Ar气氛中测试时为N型半导体而CO2气氛中测试出现N→P转变); (c) In(OH)3半导体发生N→P转变的示意图(捕捉CO2分子后表面形成P型半导体)[37] Fig.5 Mott-Schottky plots recorded in (a) Ar and (b) CO2 (the catalyst was n-type semiconductor in Ar but n-p transition took placewhen measured in CO2); (c) Schematic illustration of n-p transformation process in semiconductor type (p-type semiconductorformed after CO2 capture)[37] |
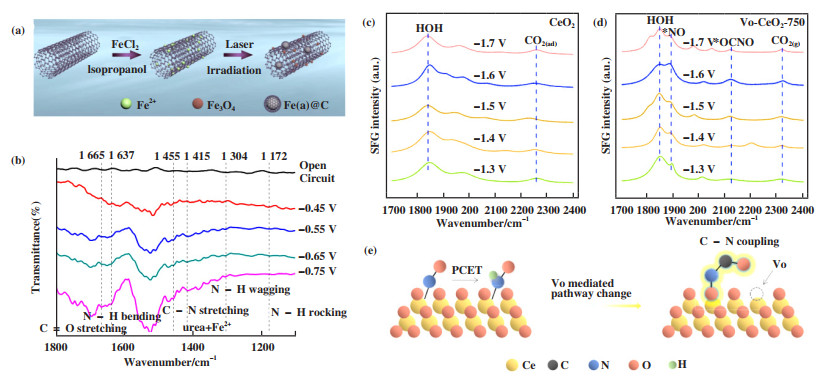
金属氧化物是最为常见的一类电催化剂, 其电催化性能的优化策略主要通过调控金属位点的配位环境和电子结构、引入氧缺陷、构筑异质界面等方式[39-44]. 例如, Zhang及其合作者[44]利用液相激光辐照策略在碳纳米管(CNT)载体上成功地修饰了晶态的四氧化三铁(Fe3O4)和碳包覆的非晶态铁(Fe(a)@C), 利用两种铁基活性组分作为双活性位点并发挥出协同效应来提升NO3-和CO2的吸附和活化(图 6(a)). 原位FTIR观测到C-N键的伸缩振动, 证实尿素分子可通过C=O的O原子以及N-H的N原子与Fe2+形成Fe2+-尿素配合物(图 6(b)). DFT进一步揭示Fe3O4能够促进CO2还原为*CO中间体, 而Fe(a)@C则有利于*NH2中间体的形成. 在0.1 mol·L-1 KNO3电解液中, Fe(a)@C-Fe3O4/CNTs在-0.65 VRHE电压下的尿素产率为1 341.3± 112.6 µg·h-1·mgcat-1, FE为16.5 ± 6.1%.
|
图 6 (a) Fe(a)@C-Fe3O4/CNTs的合成示意图及(b) 原位FTIR图谱[44]; (c) CeO2和(d)含有氧空位的CeO2的和频振动光谱; (e) 氧空位介导引起反应路径变化的示意图[40] Fig.6 (a) Schematic illustration of the synthetic process and (b) in-situ FTIR spectra of Fe(a)@C-Fe3O4/CNTs[44]; Sum frequency generation spectra of intermediate species on (c) pristine CeO2 and (e) CeO2 containing oxygen vacancies; (e) Schematic diagram of oxygen vacancies mediated reaction pathway[40] |
Wang及其合作者[40]通过在二氧化铈(CeO2)表面引入大量氧空位(VO)来提升催化性能, 尿素产率高达943.6 mg·h-1·g-1. *NO中间体可以在氧空位上发生吸附, 随后与*CO偶联并形成*OCNO中间体, 有效避免了*NO的质子化反应. 原位和频振动光谱对比了电催化反应时中间体的演化过程(图 6(c)和(d)), 并成功地在VO-CeO2催化剂上观察到*OCNO中间体(图 6(b)), 证实了氧空位介导的反应路径变化(图 6(d)). 与之相比, 催化剂在无氧空位时C-N偶联的选择性较差, *NO的质子耦合电子转移(PCET)仍为主要反应机制(图 6(e)).
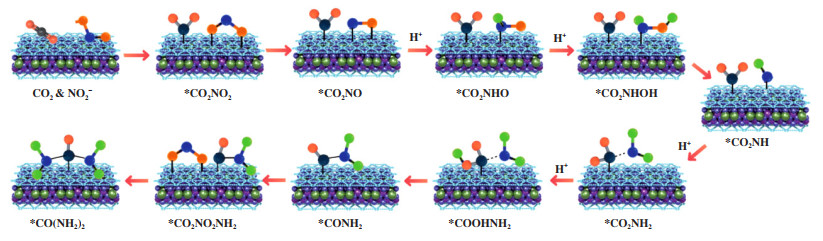
过渡金属氧化物由于本征电导率不高, 通常需要和贵金属或碳材料等复合来改善电荷传输动力学. Li及其合作者[45]在石墨炔(GDY)表面原位生长了Co-Ni双金属氧化物(Co-NiOx@GDY), 利用石墨炔和金属氧化物之间的界面和分子间相互作用, 实现电荷传输. 原位红外光谱(SR-FTIR)系统分析了不同电位下催化剂表面的分子信号, 包含C≡C的伸缩振动(石墨炔的特征信号)、CO2吸附峰、N-H键、C=O伸缩信号、O-H等. 此外, N-H键的弯曲和摇摆的信号峰证实了*NH2中间体的形成. 结合SR-FTIR, 尿素电合成的反应机制如图 7所示[45]: 首先, 亚硝酸盐电解液中的氧原子与Co-NiOx@GDY的氧空位结合, 随后通过多步质子耦合电子传输形成*NH2中间体. 然后, CO2分子填充氧空位, 转变为*COOH中间体. 最后*NH2和*COOH耦合形成*CO2NH2中间体, 并生成尿素.
|
图 7 Co-NiOx@GDY表面电催化合成尿素的反应机理示意图[45] Fig.7 Schematic illustration of reaction mechanism for electrocatalytic urea synthesis on Co-NiOx@GDY[45] |
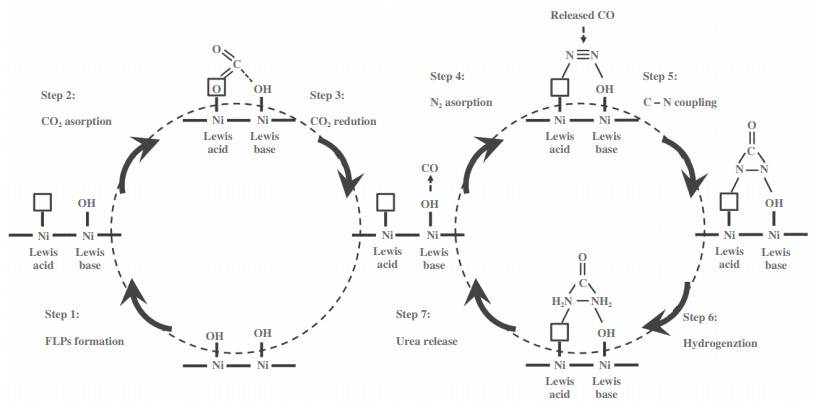
Yuan等[39]结合受阻路易斯酸碱对(FLPs)的研究思路设计了Ni3(BO3)2催化剂, 表面羟基和相邻的Ni位点分别作为路易斯碱和路易斯酸. FLPs的酸碱位点之间产生协同作用捕捉CO2和N2分子, 随后气体分子的成键和反键轨道分别和路易斯酸的空轨道以及路易斯碱的非成键轨道发生相互作用, 实现了分子的活化. 尿素电合成的具体反应机制如图 8所示[39]: (1) 首先通过退火处理产生配位不饱和Ni位点, 从而在Ni位点和相邻羟基之间形成FLPs; (2) FLPs通过轨道相互作用促进分子化学吸附, 路易斯碱羟基基团捕捉CO2的碳原子; (3) 路易斯酸和路易斯碱位点之间的协同作用将吸附的CO2活化为*CO中间体; (4) FLPs位点捕捉氮气分子, 将其活化为*N=N*并释放CO, 形成*NCON*中间体; (5) 完成催化加氢步骤形成尿素分子并脱附. 此外, 该团队合成了一种Bi-BiVO4莫特-肖特基异质结构, 通过自驱动电荷转移形成空间电荷区, 不仅能够促进CO2和N2分子在局部亲核和亲电位点发生吸附和活化, 还能够有效抑制CO中毒和*NNH中间体的形成, 确保*N=N*中间体和CO之间的放热偶联, 最终形成尿素前驱体*NCON*[42].
|
图 8 Ni3(BO3)2的受阻路易斯酸碱对将N2和CO2电催化活化合成尿素的反应机理示意图[39] Fig.8 Schematic illustration of the electrocatalytic co-activation of N2 and CO2 into urea over artificial FLPs of Ni3(BO3)2 catalysts[39] |
除金属(氢)氧化物外, 近期金属碳化物、磷化物、硼化物、金属-有机框架材料(MOF)等其他各类过渡金属基催化剂用于尿素电合成的理论和实验研究也已有少量文献报道[46-49]. 例如, Zhang及其合作者[49]合成了一种导电性良好的Co-PMDA-2-mbIM(PMDA: 均苯四甲酸二酐; 2-mbIM: 2-甲基苯并咪唑)MOF催化剂. 催化剂通过主客体分子相互作用将CoO6八面体中部分高自旋态Co3+(t2g4eg2)转变为中间自旋态Co4+(t2g4eg1), 且形成局部的亲电和亲核区域. 富电子N2和缺电子CO2分别在亲电CoO6的Co位点和亲核Co-PMDA-2-mbIM的N位点发生吸附, 产生*N=N*和*CO中间体. *N=N*σ轨道中的电子可占据高自旋态Co3+(t2g4eg2)的eg轨道, 有效促进C-N偶联反应并形成*NCON*尿素前驱体. Zhu等[46]通过理论计算预测了Mo2B2、Ti2B2和Cr2B2 3种金属硼化物用于尿素电合成的应用前景. N2和CO2可吸附在3种金属硼化物的Basal面并形成*NCON*中间体, 再经过4步质子耦合电子转移过程形成尿素. 3种金属硼化物合成尿素的电势范围为-0.49~-0.65 eV, 与Pd-Cu合金催化剂相接近, 且都能够明显地抑制氮还原合成氨反应. 此外, 由于*OH和*O基团占据二维Ti2B2的表面活性位点, 导致活性位点堵塞和自腐蚀等问题的出现. 与之相比, 二维Mo2B2和Cr2B2的活性和稳定性则更为优异.
3.6 无金属催化剂此外, 以碳材料(碳纳米管、石墨烯等)为代表性的无金属催化剂, 对环境无污染且化学稳定性好, 也是电催化研究领域中备受关注的对象. Hu及其合作者[50]设计了氟(F)掺杂CNT(F-CNT), 由于F的电负性较大, 在碳结构骨架中引入F可以在一定程度上导致碳原子带正电, 且F掺杂的碳材料能够抑制析氢反应, 并促进CO2和NO3-的电还原. DFT理论计算发现F掺杂的石墨外层提供了大量的“C-F2”作为尿素电合成的活性位点, 形成*CO和*NH2反应中间体并促进C-N偶联(*CONH2在F-CNT和未掺杂CNT上的形成能分别为-1.32和-0.07 eV). 在-0.65 VRHE时, F-CNT电催化合成尿素的产率为6.36 mmol-1·h-1·mgcat-1, FE为18%. Roy等[51]结合第一性原理研究了硅掺杂石墨相氮化碳(Si-C6N6)在尿素电合成领域的潜在用途. 在C6N6结构中引入两个Si原子后, 能够促进酸性环境中CO2分子的吸附并还原为CO. 随后, CO嵌入活化的N-N键中, 形成*N(CO)N*. 同时, 施加最优限制电势也有利于将活化的*N2-COOH转变为*N(CO)N*. 此外, 与合成氨或析氢反应相比, 尿素合成的起始电势明显更低, 且理论FE接近100%.
4 碳氮偶联尿素电合成的反应机理结合以上尿素电合成的研究可以看出, 反应分子的化学吸附和偶联效果直接影响尿素合成反应的效率. 此外, 由于原料种类多样, 电催化C-N偶联合成尿素的反应机制也有所不同(如图 9所示), 部分反应路径涉及较多的中间体, 反应机理较为复杂[15]. 以CO2和NO3-的电还原为例, CO2和NO3-分别还原形成*CO和*NH2, 或还原成*COOH和*NH2, 再进行偶联合成尿素分子(图 9(a)和(c)). 尽管合成尿素的理论电位为0.811 VSHE(标准氢电极电势), 但由于反应动力学缓慢, 导致实际施加电压高达-0.6 VRHE(RHE, 可逆氢电极电势)[59]. 前期大量文献已证实*CO由于脱附能较大, 可稳定吸附在未修饰的催化剂表面; 而*NH2→NH3也较容易实现, 因此设计电催化剂时应确保提高*NH2→NH3的活化能垒且进一步降低*NH2 + *CO偶联反应的能垒[59].此外, 以N2为氮源、CO2为碳源合成尿素时(图 9(e)和(f)), N2在催化剂表面活化为*N2, CO2则还原为*CO. 随后形成反应中间体*NCON*, 并通过distal和alternating两种机制进行氢化(两者的潜在限速步有所不同), 转变为*NHCONH2并最终形成尿素.
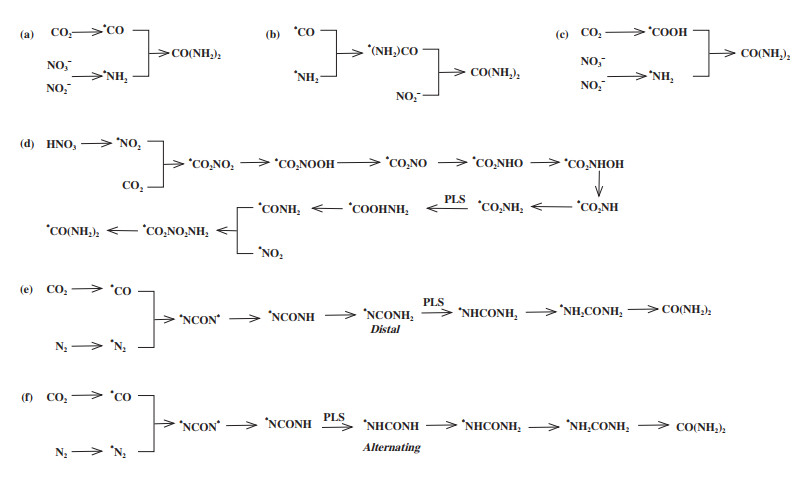
|
图 9 尿素电合成的几种反应机理[15] Fig.9 Proposed mechanisms of urea electrosynthesis[15] (a)*CO + *NH2偶联机理; (b) 改进的*CO + *NH2偶联机理; (c) *COOH + *NH2偶联机理; (d) *CO2 + *NO2偶联机理; (e)和(f)*CO + *N2偶联机理(PLS: 潜在限速步) (a) *CO + *NH2 coupling mechanism; (b) Revised *CO + *NH2 coupling mechanism; (c) *COOH + *NH2 coupling mechanism; (d) *CO2 + *NO2 coupling mechanism; and (e), (f) *CO + *N2 coupling mechanisms with different hydrogenation routes and potential-limiting steps |
电催化碳氮偶联合成尿素是一种可行的尿素合成新技术, 为实现CO2和N2的高效转化与利用提供了新思路. 我们结合近年来该领域的最新研究进展, 总结了电催化碳氮偶联合成尿素的催化反应机理、电催化剂设计策略以及影响电催化性能的关键因素. 尿素电合成过程中, 氮源种类多样性导致碳氮偶联的反应机制也有所不同. 例如, *CO和*NH2直接耦合形成尿素分子是目前最为常见的反应机制. 此外, *COOH和*NH2耦合或由*CO2和*NO2形成*CO2NO2再通过质子化形成尿素等反应途径也已有报道.
由于反应分子在催化剂表面的化学吸附效果一般, H2O、CO2、氮源分子的还原反应和尿素电合成存在竞争关系, 现阶段电催化合成尿素仍存在法拉第效率低、产物尿素选择性不高、反应路径调控机制不明确等问题. 因此, 作者建议从以下几个方面开展进一步的研究工作:
(1) 借助不同原位表征测试(例如原位红外光谱、同步辐射光谱、X射线结构谱等), 深入分析尿素电合成的反应活性位点和关键活性中间体的演化机制, 进一步明确催化反应的路径以及关键步骤的调控因素;
(2) 利用不同金属活性组分的协同作用, 结合活性中间体的表面吸附和转化等路径设计, 推动金属单原子、双金属单原子等高活性催化剂的开发, 甚至能够在一种催化剂上实现将不同氮源催化合成为尿素;
(3) 结合催化反应的机理研究, 设计无金属催化剂. 目前针对无金属催化剂的研究仍主要停留在理论模拟阶段[51, 60], 相关实验论文较少. 如何在理论研究的基础上, 获得高性能的无金属催化剂, 在后续研究中值得加以关注;
(4) 进一步发挥数据驱动的机器学习和人工智能在电化学领域的优势, 通过高通量筛选、结构化数据收集、机器学习建模等预测新型催化剂及其潜在电催化性能, 理清材料成分-结构-性能之间复杂的构效关系, 在尿素电合成等各类电化学研究领域有着广阔的应用前景.
| [1] |
Kinne-Saffran E, Kinne R K H. Vitalism and synthesis of urea[J]. Am J Nephrol, 1999, 19(2): 290–294.
DOI:10.1159/000013463 |
| [2] |
Shibata M, Yoshida K, Furuya N. Electrochemical synthesis of urea on reduction of carbon dioxide with nitrate and nitrite ions using Cu-loaded gas-diffusion electrode[J]. J Electroanal Chem, 1995, 387(1/2): 143–145.
|
| [3] |
Shibata M, Yoshida K, Furuya N. Electrochemical synthesis of urea at gas-diffusion electrodes: Part Ⅱ. Simultaneous reduction of carbon dioxide and nitrite ions at Cu, Ag and Au catalysts[J]. J Electroanal Chem, 1998, 442(1/2): 67–72.
|
| [4] |
Shibata M, Yoshida K, Furuya N. Electrochemical synthesis of urea at gas-diffusion electrodes: Ⅲ. Simultaneous reduction of carbon dioxide and nitrite ions with various metal catalysts[J]. J Electrochem Soc, 1998, 145(2): 595–600.
DOI:10.1149/1.1838309 |
| [5] |
Shibata M, Yoshida K, Furuya N. Electrochemical synthesis of urea at gas-diffusion electrodes: Ⅳ. Simultaneous reduction of carbon dioxide and nitrate ions with various metal catalysts[J]. J Electrochem Soc, 1998, 145(7): 2348–2353.
DOI:10.1149/1.1838641 |
| [6] |
Shibata M, Furuya N. Electrochemical synthesis of urea at gas-diffusion electrodes: Part Ⅵ. Simultaneous reduction of carbon dioxide and nitrite ions with various metallophthalocyanine catalysts[J]. J Electroanal Chem, 2001, 507(1/2): 177–184.
|
| [7] |
Jouny M, Lv J J, Cheng T, et al. Formation of carbon-nitrogen bonds in carbon monoxide electrolysis[J]. Nat Chem, 2019, 11(9): 846–851.
DOI:10.1038/s41557-019-0312-z |
| [8] |
Chen C, Zhu X, Wen X, et al. Coupling N2 and CO2 in H2O to synthesize urea under ambient conditions[J]. Nat Chem, 2020, 12(8): 717–724.
DOI:10.1038/s41557-020-0481-9 |
| [9] |
Li J, Zhang Y, Kuruvinashetti K, et al. Construction of C-N bonds from small-molecule precursors through heterogeneous electrocatalysis[J]. Nat Rev Chem, 2022, 6(5): 303–319.
DOI:10.1038/s41570-022-00379-5 |
| [10] |
Chen C, He N, Wang S. Electrocatalytic C-N coupling for urea synthesis[J]. Small Sci, 2021, 1(11): 2100070–2100078.
DOI:10.1002/smsc.202100070 |
| [11] |
Zhong Y, Xiong H, Low J, et al. Recent progress in electrochemical C-N coupling reactions[J]. eScience, 2022: 100086.
|
| [12] |
Mei Z, Zhou Y, Lv W, et al. Recent progress in electrocatalytic urea synthesis under ambient conditions[J]. ACS Sustainable Chem Eng, 2022, 10(38): 12477–12496.
DOI:10.1021/acssuschemeng.2c03681 |
| [13] |
Liu S, Wang M, Cheng Q, et al. Turning waste into wealth: Sustainable production of high-value-added chemicals from catalytic coupling of carbon dioxide and nitrogenous small molecules[J]. ACS Nano, 2022, 16(11): 17911–17930.
DOI:10.1021/acsnano.2c09168 |
| [14] |
Huang Y, Wang Y, Liu Y, et al. Unveiling the quantification minefield in electrocatalytic urea synthesis[J]. Chem Eng J, 2023, 453(1): 139836–139842.
|
| [15] |
Tao Z, Rooney C L, Liang Y, et al. Accessing organonitrogen compounds via C-N coupling in electrocatalytic CO2 reduction[J]. J Am Chem Soc, 2021, 143(47): 19630–19642.
DOI:10.1021/jacs.1c10714 |
| [16] |
Tian Y, Liu Y, Wang H, et al. Electrocatalytic reduction of nitrogen to ammonia in ionic liquids[J]. ACS Sustainable Chem Eng, 2022, 10(14): 4345–4358.
DOI:10.1021/acssuschemeng.2c00018 |
| [17] |
Seger B, Robert M, Jiao F. Best practices for electrochemical reduction of carbon dioxide[J]. Nat Sustain, 2023, 6: 236–238.
DOI:10.1038/s41893-022-01034-z |
| [18] |
Kayan D B, Köleli F. Simultaneous electrocatalytic reduction of dinitrogen and carbon dioxide on conducting polymer electrodes[J]. Appl Catal B Environ, 2016, 181: 88–93.
DOI:10.1016/j.apcatb.2015.07.045 |
| [19] |
Liu S, Yin S, Wang Z, et al. AuCu nanofibers for electrosynthesis of urea from carbon dioxide and nitrite[J]. Cell Rep Phys Sci, 2022, 3(5): 100869–100883.
DOI:10.1016/j.xcrp.2022.100869 |
| [20] |
Feng Y, Yang H, Zhang Y, et al. Te-doped Pd nanocrystal for electrochemical urea production by efficiently coupling carbon dioxide reduction with nitrite reduction[J]. Nano Lett, 2020, 20(11): 8282–8289.
DOI:10.1021/acs.nanolett.0c03400 |
| [21] |
Huang Y, Yang R, Wang C, et al. Direct electrosynthesis of urea from carbon dioxide and nitric oxide[J]. ACS Energy Lett, 2022, 7(1): 284–291.
DOI:10.1021/acsenergylett.1c02471 |
| [22] |
Meng N, Ma X, Wang C, et al. Oxide-derived core-shell Cu@Zn nanowires for urea electrosynthesis from carbon dioxide and nitrate in water[J]. ACS Nano, 2022, 16(6): 9095–9104.
DOI:10.1021/acsnano.2c01177 |
| [23] |
Nitopi S, Bertheussen E, Scott S B, et al. Progress and perspectives of electrochemical CO2 reduction on copper in aqueous electrolyte[J]. Chem Rev, 2019, 119(12): 7610–7672.
DOI:10.1021/acs.chemrev.8b00705 |
| [24] |
Li Li(李丽), Shi Yong-xia(石永霞), Hou Man(侯曼), et al. Research progress of copper-based materials for electrocatalytic CO2 reduction reaction (铜基材料电催化二氧化碳还原反应的研究进展)[J]. Chin J Rare Metals (稀有金属), 2022, 46(6): 681-694.
|
| [25] |
Liu C, Mei X, Han C, et al. Tuning strategies and structureeffects of electrocatalysts for carbon dioxide reduction reaction[J]. Chin J Catal, 2022, 43(7): 1618–1633.
DOI:10.1016/S1872-2067(21)63965-7 |
| [26] |
Liu X, Jiao Y, Zheng Y, et al. Mechanism of C-N bonds formation in electrocatalytic urea production revealed by ab initio molecular dynamics simulation[J]. Nat Commun, 2022, 13(1): 5471–5479.
DOI:10.1038/s41467-022-33258-0 |
| [27] |
Yang G L, Hsieh C T, Ho Y S, et al. Gaseous CO2 coupling with N-containing intermediates for key C-N bond formation during urea production from coelectrolysis over Cu[J]. ACS Catal, 2022, 12(18): 11494–11504.
DOI:10.1021/acscatal.2c02346 |
| [28] |
Krzywda P M, Paradelo Rodríguez A, Benes N E, et al. Carbon-nitrogen bond formation on Cu electrodes during CO2 reduction in NO3- solution[J]. Appl Catal B Environ, 2022, 316: 121512–121520.
DOI:10.1016/j.apcatb.2022.121512 |
| [29] |
Wu W, Yang Y, Wang Y, et al. Boosting electrosynthesis of urea from N2 and CO2 by defective Cu-Bi[J]. Chem Catal, 2022, 2(11): 3225–3238.
DOI:10.1016/j.checat.2022.09.012 |
| [30] |
Wang A, Li J, Zhang T. Heterogeneous single-atom catalysis[J]. Nat Rev Chem, 2018, 2(6): 65–81.
DOI:10.1038/s41570-018-0010-1 |
| [31] |
Zhou Guang-he(周广贺), Han Wei-gao(韩维高), ZhangXiao-hong(张晓红), et al. Recent advance of constructedsingle-atom catalysts based on substrates' surface and catalytic performance (基底表面构建单原子催化剂与催化性能研究进展)[J]. J Mol Catal (China)(分子催化), 2021, 35(1): 54-64.
|
| [32] |
Liu Yu-feng(刘玉凤), Zhou Ying(周瑛), Lu Mei(卢梅), et al. Preparation of noble metal single-atom catalyst and its applications in catalytic oxidation reaction of CO and VOCs (贵金属单原子催化剂的制备及其在CO、VOCs完全氧化反应中的应用)[J]. J Mol Catal (China )(分子催化), 2022, 36(1): 81-97.
|
| [33] |
Xiong Z, Xiao Y, Shen C. Screening of the transition metal single atom anchored on α-borophene catalysts as a feasible strategy for electrosynthesis of urea[J]. Chem Mater, 2022, 34(21): 9402–9413.
DOI:10.1021/acs.chemmater.2c01572 |
| [34] |
Kong L, Jiao D, Wang Z, et al. Single metal atom anchored on porous boron nitride nanosheet for efficient collaborative urea electrosynthesis: A computational study[J]. Chem Eng J, 2023, 451: 138885–138893.
DOI:10.1016/j.cej.2022.138885 |
| [35] |
Leverett J, Tran-Phu T, Yuwono J A, et al. Tuning the coordination structure of Cu-N-C single atom catalystsfor simultaneous electrochemical reduction of CO2 and NO3- to urea[J]. Adv Energy Mater, 2022, 12(32): 2201500–2201508.
DOI:10.1002/aenm.202201500 |
| [36] |
Zhang X, Zhu X, Bo S, et al. Identifying and tailoring C-N coupling site for efficient urea synthesis over diatomic Fe-Ni catalyst[J]. Nat Commun, 2022, 13(1): 5337–5344.
DOI:10.1038/s41467-022-33066-6 |
| [37] |
Lv C, Zhong L, Liu H, et al. Selective electrocatalytic synthesis of urea with nitrate and carbon dioxide[J]. Nat Sustain, 2021, 4(10): 868–876.
DOI:10.1038/s41893-021-00741-3 |
| [38] |
Lv C, Lee C, Zhong L, et al. A defect engineered electrocatalyst that promotes high-efficiency urea synthesis under ambient conditions[J]. ACS Nano, 2022, 16(5): 8213–8222.
DOI:10.1021/acsnano.2c01956 |
| [39] |
Yuan M, Chen J, Xu Y, et al. Highly selective electroreduction of N2 and CO2 to urea over artificial frustrated Lewis pairs[J]. Energy Environ Sci, 2021, 14(12): 6605–6615.
DOI:10.1039/D1EE02485J |
| [40] |
Wei X, Wen X, Liu Y, et al. Oxygen vacancy-mediated selective C-N coupling toward electrocatalytic urea synthesis[J]. J Am Chem Soc, 2022, 144(26): 11530–11535.
DOI:10.1021/jacs.2c03452 |
| [41] |
Meng N, Huang Y, Liu Y, et al. Electrosynthesis of urea from nitrite and CO2 over oxygen vacancy-rich ZnO porousnanosheets[J]. Cell Rep Phys Sci, 2021, 2(3): 100378–100390.
DOI:10.1016/j.xcrp.2021.100378 |
| [42] |
Yuan M, Chen J, Bai Y, et al. Unveiling electrochemical urea synthesis by co-activation of CO2 and N2 with Mott-Schottky heterostructure catalysts[J]. Angew Chem Int Ed, 2021, 60(19): 10910–10918.
DOI:10.1002/anie.202101275 |
| [43] |
Yuan M, Chen J, Bai Y, et al. Electrochemical C-N coupling with perovskite hybrids toward efficient urea synthesis[J]. Chem Sci, 2021, 12(17): 6048–6058.
DOI:10.1039/D1SC01467F |
| [44] |
Geng J, Ji S, Jin M, et al. Ambient electrosynthesis of ureawith nitrate and carbon dioxide over iron-based dualsites[J]. Angew Chem Int Ed, 2022, 62(6): e202210958–e202210964.
|
| [45] |
Zhang D, Xue Y, Zheng X, et al. Multi-heterointerfaces for selective and efficient urea production[J]. Natl Sci Rev, 2022, 10: nwac 209.
|
| [46] |
Zhu X, Zhou X, Jing Y, et al. Electrochemical synthesis of urea on MBenes[J]. Nat Commun, 2021, 12(1): 4080–4088.
DOI:10.1038/s41467-021-24400-5 |
| [47] |
Peng J, Wang X, Wang Z, et al. Uncovering the mechanism for urea electrochemical synthesis by coupling N2 and CO2 on Mo2C-MXene[J]. Chin J Struct Chem, 2022, 41(9): 2209094–2209104.
|
| [48] |
Sun M, Wu G, Jiang J, et al. Carbon-anchored molybdenum oxide nanoclusters as efficient catalysts for the electrosynthesis of ammonia and urea[J]. Angew Chem Int Ed, 2023, 62(19): e202301957–e202301965.
DOI:10.1002/eem2.12496 |
| [49] |
Yuan M, Chen J, Zhang H, et al. Host-guest molecular interaction promoted urea electrosynthesis over a precisely designed conductive metal-organic framework[J]. Energy Environ Sci, 2022, 15(5): 2084–2095.
DOI:10.1039/D1EE03918K |
| [50] |
Liu X, Kumar P V, Chen Q, et al. Carbon nanotubes with fluorine-rich surface as metal-free electrocatalyst for effective synthesis of urea from nitrate and CO2[J]. Appl Catal B Environ, 2022, 316: 121618–121625.
DOI:10.1016/j.apcatb.2022.121618 |
| [51] |
Roy P, Pramanik A, Sarkar P. Dual-silicon-doped graphitic carbon nitride sheet: an efficient metal-free electrocatalyst for urea synthesis[J]. J Phys Chem Lett, 2021, 12(44): 10837–10844.
DOI:10.1021/acs.jpclett.1c03242 |
| [52] |
Jiao D, Dong Y, Cui X, et al. Boosting the efficiency of urea synthesis via cooperative electroreduction of N2 and CO2 on MoP[J]. J Mater Chem A, 2023, 11(1): 232–240.
DOI:10.1039/D2TA07531H |
| [53] |
Mukherjee J, Paul S, Adalder A, et al. Understanding the site-selective electrocatalytic co-reduction mechanism for green urea synthesis using copper phthalocyanine nanotubes[J]. Adv Funct Mater, 2022, 32(31): 2200882–2200890.
DOI:10.1002/adfm.202200882 |
| [54] |
Pan L, Wang J, Lu F, et al. Single-atom or dual-atomin TiO2 nanosheet: Which is the better choice for electrocatalytic urea synthesis[J]. Angew Chem Int Ed, 2023: 202216835.
|
| [55] |
Zhang S, Geng J, Zhao Z, et al. High-efficiency electrosynthesis of urea over bacterial cellulose regulated Pd-Cu bimetallic catalyst[J]. EES Catal, 2023, 1(1): 45–53.
DOI:10.1039/D2EY00038E |
| [56] |
Saravanakumar D, Song J, Lee S, et al. Electrocatalytic conversion of carbon dioxide and nitrate ions to urea by a titania-nafion composite electrode[J]. ChemSusChem, 2017, 10(20): 3999–4003.
DOI:10.1002/cssc.201701448 |
| [57] |
Bharath G, Karthikeyan G, Kumar A, et al. Surface engineering of Au nanostructures for plasmon-enhanced electrochemical reduction of N2 and CO2 into urea in the visible-NIR region[J]. Appl Energy, 2022, 318: 119244–119254.
DOI:10.1016/j.apenergy.2022.119244 |
| [58] |
Cao N, Quan Y, Guan A, et al. Oxygen vacancies enhanced cooperative electrocatalytic reduction of carbon dioxide and nitrite ions to urea[J]. J Colloid Interface Sci, 2020, 577: 109–114.
DOI:10.1016/j.jcis.2020.05.014 |
| [59] |
Huang Y, Wang Y, Wu Y, et al. Electrocatalytic construction of the C-N bond from the derivates of CO2 and N2[J]. Sci China Chem, 2022, 65(2): 204–206.
DOI:10.1007/s11426-021-1173-8 |
| [60] |
Cao Y, Meng Y, Wu Y, et al. Metal-free boron nanosheet as "buffer electron pool" for urea and ethanol synthesis via C-N and C-C coupling[J]. J Mater Chem A, 2022, 10(44): 23843–23853.
DOI:10.1039/D2TA06739K |
 2023, Vol. 37
2023, Vol. 37

