2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
α,β-不饱和醛的选择性加氢是催化领域的一个重要反应, 由于其内部同时存在C=C 双键和羰基两个不饱和官能团, 使得开发出羰基选择性加氢的高效催化剂具有一定挑战性[1]. 肉桂醛(CAL)是α,β-不饱和醛的代表物质, 其羰基加氢产物作为具有较高经济价值的重要中间体, 广泛应用于精细化工、医药、涂料、香水等领域[2−3]. 然而, 肉桂醛含有C=C双键、羰基和苯环3种不饱和键, 由于C=C双键 (键能为615 kJ·mol−1 )在热力学上更容易加氢, 在与羰基 (键能715 kJ·mol−1)共存时更容易得到C=C双键加氢产物, 导致肉桂醇(COL)的选择性较低[4−5]. 因此, 如何有效地实现羰基的活化, 降低其加氢反应的能垒, 减少C=C双键的加氢产物, 是解决肉桂醛高效选择性加氢制肉桂醇的一个重要问题.
近年来研究人员已报道了多种策略来提高肉桂醇的选择性[6]. 事实上, 为了便于不饱和键的加氢, 共轭乙烯基通常只能通过平面构型在催化剂表面进行吸附[7−9]. 针对这一吸附特点, 研究人员采用有机分子表面修饰的方法来提高肉桂醇的选择性[10−14]. 例如, 通过螯合有机配体[15−16]或用金属有机框架(MOFs)包裹催化活性位点[17−18], 在催化剂表面形成空间位阻屏障来调节CAL的空间取向, 使得反应物分子端位的羰基相比于在分子内部的C=C双键更容易接近催化活性位点, 从而提高选择性. 然而, 表面修饰形成的空间位阻在促进肉桂醇选择性提高的同时, 也不可避免地抑制了表面分子的迁移, 导致肉桂醛的转化率降低. 另一类策略是使用贵金属/过渡金属的双金属催化剂来产生协同电子效应, 在热力学上降低羰基的加氢能垒, 从而提高肉桂醇的选择性[19−23]. 理论上, 该策略可以在不影响CAL转化率的情况下提高肉桂醇的选择性, 但是, 使用稀缺和昂贵的贵金属是不可持续的. 近年来, 已有学者报道在氮掺杂碳载体上应用Fe-Co合金纳米颗粒(NPs), 可有效地将肉桂醛选择性氢化为肉桂醇[24], 该催化剂中Fe-Co合金的协同作用是同时实现肉桂醇高选择性和肉桂醛高转化率的关键. 近期亦有研究表明, 催化剂表面的L酸与B酸比例也会较大程度地影响肉桂醛加氢的性能. 当ZrO2/SiO2-Al2O3复合氧化物催化剂中Si/Al比为2时, 肉桂醇的收率可以达到86.4%[25]. 然而, 双金属合金和复合氧化物的配比优化是一个复杂而困难的过程, 缺乏普适性. 因此, 如何使用成本低廉、制备简单的高效肉桂醛选择性加氢催化剂, 仍然是该领域的一大挑战.
受到构建优先吸附位点可以提高硝基芳烃加氢活性的启发[26], 我们设想用含N杂环配体(L)对负载型铜催化剂进行特定的功能修饰, 可能为肉桂醛的选择性加氢提供一种有效的催化剂制备方法. 配体的引入会导致催化剂表面空间位阻的变化, 也可能会在活性金属与配体之间形成新的相互作用, 这些都为调节肉桂醛的吸附构型提供了可能, 在提高催化剂性能方面有一定潜力.
我们报道了一种由1,10-菲啰啉(L1)修饰的负载型纳米Cu催化剂(Cu/Al2O3-L1) 用于肉桂醛的选择性加氢. 相比于未修饰的纳米Cu催化剂(Cu/Al2O3), 该催化剂可将肉桂醛加氢活性提高到99%, 同时可以实现高达95%的肉桂醇选择性(图1). 实验和DFT计算结果表明, 活性金属Cu与配体L1之间存在相互作用, 降低了H2在Cu表面的解离能, 提高了催化剂的活性. 此外, 由于配体的空间位阻限制了肉桂醛的平面吸附, 肉桂醇的选择性也显著提升. 该方法打破了不饱和醛加氢活性和选择性之间的限制, 为包含多种还原性基团化学品的选择性加氢提供了借鉴意义.
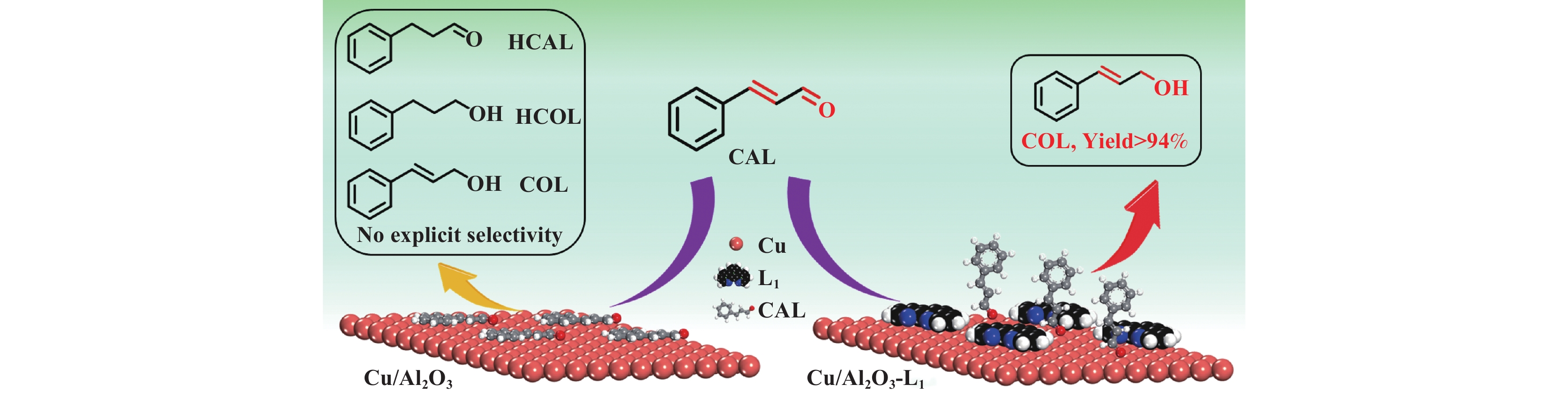
|
图 1 肉桂醛在Cu/Al2O3 和 Cu/Al2O3-L1催化剂上的反应对比示意图 Fig.1 Diagram of CAL reacting on Cu/Al2O3-L and Cu/Al2O3-L1 |
实验所用的药品包括硝酸铝(Al(NO3)3·9H2O)、硝酸铜(Cu(NO3)2·3H2O)、无水碳酸钠(Na2CO3)、硼氢化钠(NaBH4)、1,10-菲啰啉(1,10-Phenanthroline)、1,7-菲啰啉(1,7-Phenanthroline)、4,7-菲啰啉(4,7-Phenanthroline)、吡啶(Pyridine)、2,2’-联吡啶(2,2'-Bipyridine)、2,3’-联吡啶(2,3'-Bipyridine)、2,4’-联吡啶(2,4'-Bipyridine)、乙二胺(Ethylenediamine); 所用溶剂包括甲苯、乙二醇二甲醚、正己烷、二氧六环均为分析纯, 全部购买自国药集团化学试剂有限公司; 所用去离子水为实验室自制. 以上所有试剂及溶剂均直接使用, 未经进一步纯化.
1.2 催化剂制备Al2O3载体制备. 采用化学沉淀法制备了Al2O3载体. 将4.28 g Al(NO3)3·9H2O加入到250 mL烧瓶中, 加入100 mL去离子水并在室温下搅拌. 在搅拌过程中, 使用恒压漏斗滴入30 mL Na2CO3 (2.71 g)溶液, 混合物在室温下继续搅拌5 h后, 将反应混合物离心、去离子水洗涤, 直至上清液pH ≈ 7. 然后, 将白色固体在100 ℃鼓风干燥箱中干燥12 h, 在马弗炉中以5 ℃/min的速率升温至350 ℃并保持该温度煅烧5 h, 随后得到白色粉末, 记为Al2O3.
Cu/Al2O3制备. 采用化学还原沉积法制备了Cu/Al2O3催化剂. 将0.15 g Cu(NO3)2·3H2O和0.60 g 自制Al2O3载体加入250 mL烧瓶中, 加入100 mL去离子水. 接着, 滴入10 mL的NaBH4溶液(0.023 g). 搅拌10 min后, 使用恒压漏斗滴入20 mL Na2CO3 (0.076 g)溶液, 继续搅拌5 h. 将反应混合物离心、去离子水洗涤, 直至上清液pH值 ≈ 7. 然后在100 ℃普通鼓风干燥箱中干燥12 h, 在马弗炉中以5 ℃/min速率升温到350 ℃并保持该温度煅烧5 h, 随后以5 ℃/min速率升温到350 ℃并保持该温度, 使用纯H2还原3 h, 得到黑色粉末, 记为Cu/Al2O3.
Cu/Al2O3-L制备. 将Cu/Al2O3 (40 mg)、配体 (0.1 mmol)和甲苯 (3 mL)的混合物加入玻璃管, 置于100 mL的高压反应釜中, 密封后用H2交换气体3次, 在140 ℃、1.0 MPa H2下反应12 h. 反应结束后冷却至室温, 将催化剂从反应混合物中分离出来, 用甲苯洗涤3次. 最后将催化剂在80 ℃真空干燥箱中干燥6 h, 记为Cu/Al2O3-L.
1.3 催化剂表征XRD测量采用STADIP-X射线粉晶衍射仪(STOE), 该仪器配备了入射光束弧形锗单色仪, Cu Kα1靶射线, 电压和电流分别为40 kV和150 mA, 扫描范围为10°~90°, 扫描速度为6(°)/min. 数据解析采用WinXpow (STOE)软件和国际衍射数据中心(ICDD)粉末衍射文件(PDF)数据库.
X射线光电子能谱 (XPS)测量由VG ES-CALAB 210仪器进行, 该仪器配备了双镁/铝阳极X射线源、半球形电容分析器和5 keV Ar+ 离子枪, 电子结合能以284.8 eV的C 1s峰为基准矫正, 实验背景压力小于10−7 Pa. 采用线性背景减法后的高斯-洛伦兹曲线拟合峰值, 定量分析时, 峰面积由元素特异性斯科菲尔德因子和分析仪的传输函数划分.
在METTLER TOLEDO同步热分析仪上进行热重分析(TGA). 经100 ℃干燥10 h后的样品, 在空气气氛中, 以10 ℃/min速率升温到450 ℃, 获得TGA曲线.
采用电感耦合等离子体原子发射光谱法(ICP-AES), 利用Iris优势Thermo Jarrel Ash装置测定了催化剂中Cu的含量.
采用Bruker VERTEX 70 FTIR光谱仪对样品进行红外漫反射光谱(IR)分析.
催化剂的比表面积和孔隙体积采用美国Qantachrome iQ2全自动气体吸附分析仪在−196 ℃下测定氮的吸附-脱附等温线. 在氮气吸附之前, 将样品以10 ℃·min−1 速率升到100 ℃并保持该温度脱气预处理12 h, 随后在−196 ℃下测试氮气吸附. 使用Brunauer-Emmett-Teller (BET)方程计算比表面积, 孔径分布采用Barrett、Joyner和Halenda (BJH)解吸等温线法计算, 微孔尺寸分布使用DFT方法确定.
高分辨率透射电子显微镜测试 (HR-TEM)采用Tecnai G2 F30 S-Twin透射电镜, 工作电压300 kV, 采用Tecnai G2 F30 S-Twin Field Emission TEM在STEM模式下进行单粒子EDX分析. 催化剂样品通过超声波分散在乙醇中, 并沉积在碳涂层的钼栅格上.
H2-TPR在配备热导率检测器(TCD)的天津先权贸易有限公司TP-5080D上进行. 样品(30 mg)在100 ℃、25 mL/min He预处理3 h, 在25 mL/min H2保持100 ℃, 直到TCD的信号恢复到基线后以10 ℃/min从100加热到800 ℃, 获得H2-TPR曲线.
1.4 催化剂性能测试催化剂性能测试. 将肉桂醛(1 mmol)、甲苯(3 mL)和催化剂(40 mg)的混合物加入玻璃管, 置于100 mL的高压反应釜中, 将高压反应釜密封后, 使用H2交换气体3次, 以Cu/Al2O3-L为催化剂, 在140 ℃、1.0 MPa H2下反应8 h. 反应结束后, 将高压反应釜冷却至室温, 并小心地释放压力. 然后用加入40 mg联苯作为内标, 再用5 mL甲苯稀释反应混合物, 离心后上清液用GC-FID (Agilent 7890B-5977A)进行定量分析. 其他反应和对照实验也采用同样的方法进行测试.
催化循环实验. 催化循环所用催化剂通过离心从反应混合物中分离出来, 用甲苯洗涤3次, 在80 ℃的真空干燥箱中干燥6 h后回收, 并直接与肉桂醛和溶剂一起加入高压反应釜内进行下一次催化循环.
2 结果与讨论 2.1 催化剂组成的影响首先, 以肉桂醛选择性加氢为模型反应, 研究了有机配体对负载型Cu催化剂 (Cu/Al2O3)催化性能的影响 (表1). 将有机配体和Cu/Al2O3催化剂在140 ℃、1.0 MPa H2高压反应釜中原位反应8 h, 混合物经离心、溶剂洗涤后所得催化剂标记为Cu/Al2O3-L, 其中L表示添加的有机配体.
| 表 1 Cu/Al2O3-L催化剂的配体优化及不同金属对比 Table 1 Optimization of ligands for Cu/Al2O3-L and comparison of different metals |
如表1所示, 我们可以看到不含配体的Cu/Al2O3催化剂仅获得了 20% 的肉桂醛转化率, 并且没有发现目标产物肉桂醇 (表1, Entry 1). 其中一些配体, 尤其是 1,10-菲咯啉 (L1), 可以显著提高催化性能, CAL的转化率达到 91%, COL的选择性为 85%(表1, Entry 2). Cu/Al2O3经过1,7-菲咯啉 (L2)、2,2-联吡啶 (L4) 和吡啶 (L7)等配体修饰后, 所得Cu/Al2O3-L催化剂可以获得更高的肉桂醛转化率, 但未观察到令人满意的肉桂醇选择性 (表1, Entry 3、5和8). 另外, 也有部分配体对催化性能的提升作用有限, 如4,7-菲咯啉 (L3)、2,3-联吡啶 (L5)和乙二胺 (L8) (表1, Entry 4、6和7). 从上述结果中我们可以推测, Cu/Al2O3-L的催化性能可能与有机配体中两个N原子的位置或距离有关. 值得注意的是, 通过相同的制备方法得到的不同金属M/Al2O3-L1催化剂, 如Fe/Al2O3-L1、Co/Al2O3-L1和Ni/Al2O3-L1并没有表现出比Cu/Al2O3-L1更好的结果 (表1, Entry 10−12). 其他反应条件的优化结果展示在表2中, 包括反应温度、预处理时间、反应溶剂等. 其中预处理时间对催化性能的影响很大.
| 表 2 肉桂醛选择性加氢反应条件优化 Table 2 Optimization of reaction condition for selective hydrogenation of CAL |
如图2(a)所示, 随着预处理时间的增加, 肉桂醛的转化率逐渐增加, 肉桂醇的选择性没有明显下降. 当使用经过12 h预处理的催化剂时, 肉桂醇的收率达到最大值(86%), 继续延长预处理时间到15 h, 肉桂醇的选择性开始下降. L1的添加量对预处理的结果也有较大影响, 在相同反应条件下, 当L1的添加量在20 mg (催化剂与配体的质量比为2∶1)时, 肉桂醛的转化率和肉桂醇的选择性都达到最大值 (图2(b)).
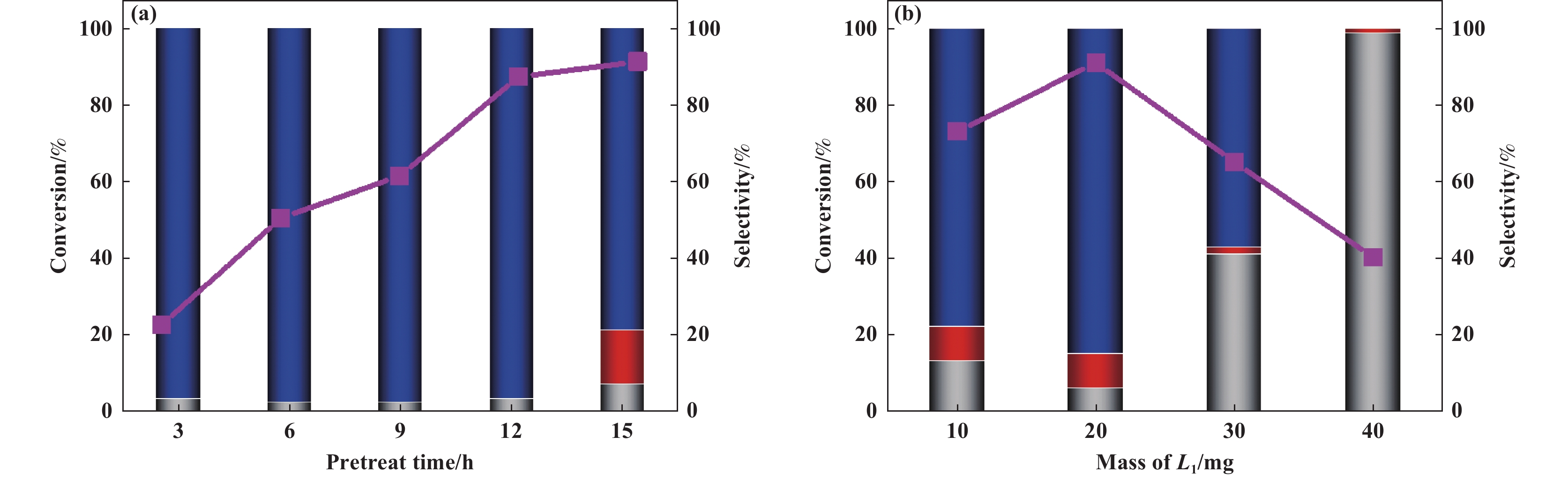
|
图 2 Cu/Al2O3-L1预处理条件的优化(a) Cu/Al2O3-L1的预处理时间; (b) L1的添加量(折线图代表肉桂醛转化率, 柱状图代表各加氢产物的选择性, 蓝色代表肉桂醇, 红色代表苯丙醇, 灰色代表苯丙醛) Fig.2 Optimization of pretreating conditions for Cu/Al2O3-L1(a) pretreating time of Cu/Al2O3-L1; (b) mass of L1 (The broken line chart for the conversion of CAL, and the bar chart for selectivity: cinnamylalcohol in blue, phenylpropanol in red, and phenylpropanal in gray) |
根据上述实验分析, Cu/Al2O3-L1具有优异的肉桂醛加氢催化活性并显著提高了肉桂醇的加氢选择性. 为了研究L1预处理后Cu/Al2O3-L1催化剂结构与活性之间的关系, 采用X射线光电子能谱 (XPS)、X射线衍射光谱 (XRD)、漫反射红外-傅里叶变换光谱 (DRIFTS)、透射电子显微镜 (TEM)、电感耦合等离子体原子发射光谱 (ICP-AES)、热重分析 (TGA)、N2吸附-脱附仪、H2程序升温还原 (H2-TPR)等一系列手段来表征Cu/Al2O3、Cu/Al2O3-L1和Cu/Al2O3-L1-used催化剂.
首先, 我们使用Qantachrome iQ2全自动气体吸附分析仪测定了催化剂的物理特性, 其中N2吸脱附等温线表现出具有回滞环的IV型等温线, 证明了其介孔特性 (图3). 有趣的是, 与Cu/Al2O3相比, Cu/Al2O3-L1在吸附L1后比表面积从325.071减少到了137.580 m2/g, 平均孔体积也从0.684 3降低到了0.332 6 m3/g, 表明L1处理后部分配体吸附在催化剂表面, 导致其比表面积和平均孔体积减小[27].
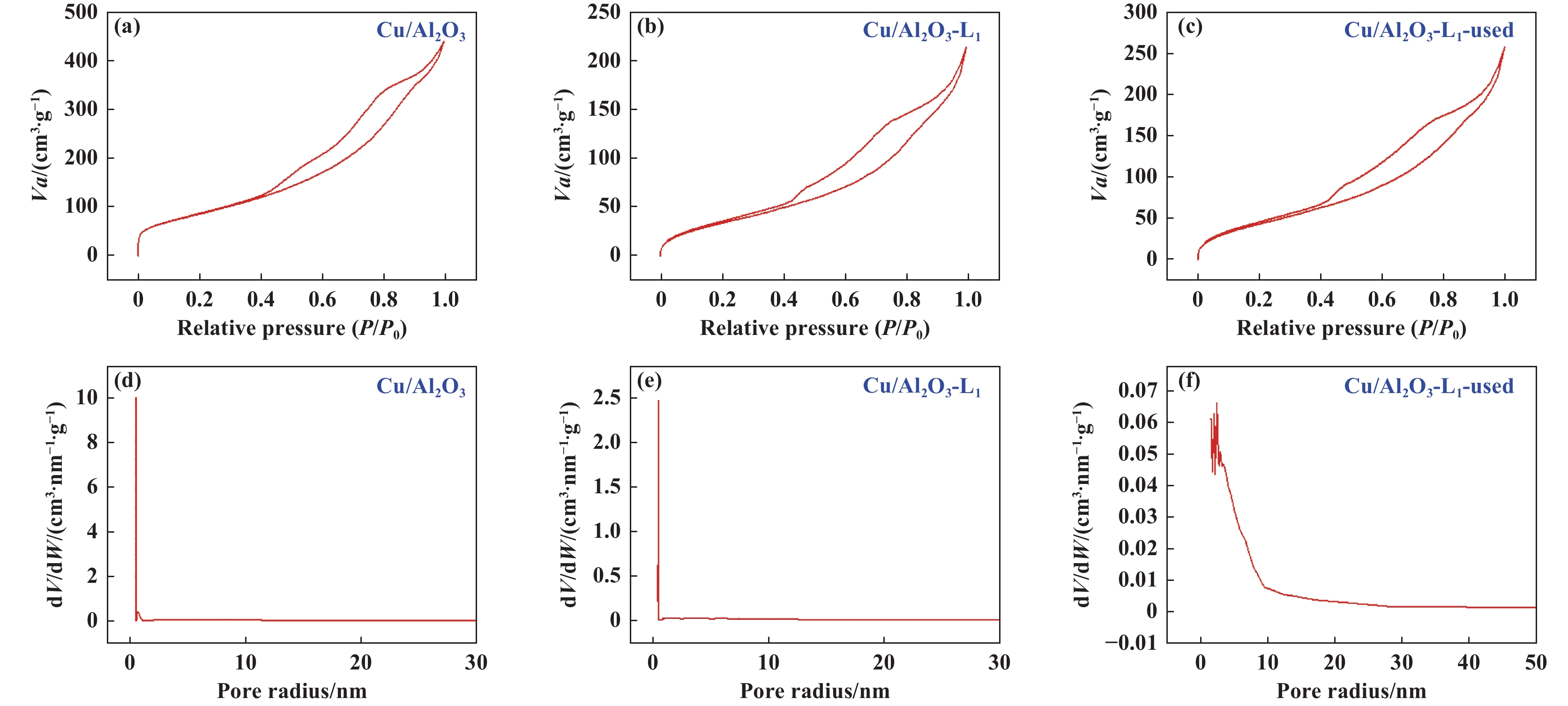
|
图 3 催化剂的N2吸脱附曲线及孔径分布 Fig.3 N2 adsorption-desorption analysis and pore size distribution of catalysts |
随后, 通过热重分析 (TGA) 证明了Cu/Al2O3-L1表面有机物的存在 (图4(a)), Cu/Al2O3、Cu/Al2O3-L1和Cu/Al2O3-L1-used的失重率分别为4.8%、21.5%和19.7%. 其中, 由于催化剂在空气中会吸附部分水蒸气和CO2, 导致Cu/Al2O3本身存在一定的质量损失 (图4(a), 曲线i). 因此, Cu/Al2O3-L1和Cu/Al2O3-L1-used的实际失重率分别为16.7%和14.9%, 两者失重率的差异较小, 也表明Cu/Al2O3-L1具有一定的稳定性 (图4(a), 曲线ii和iii).
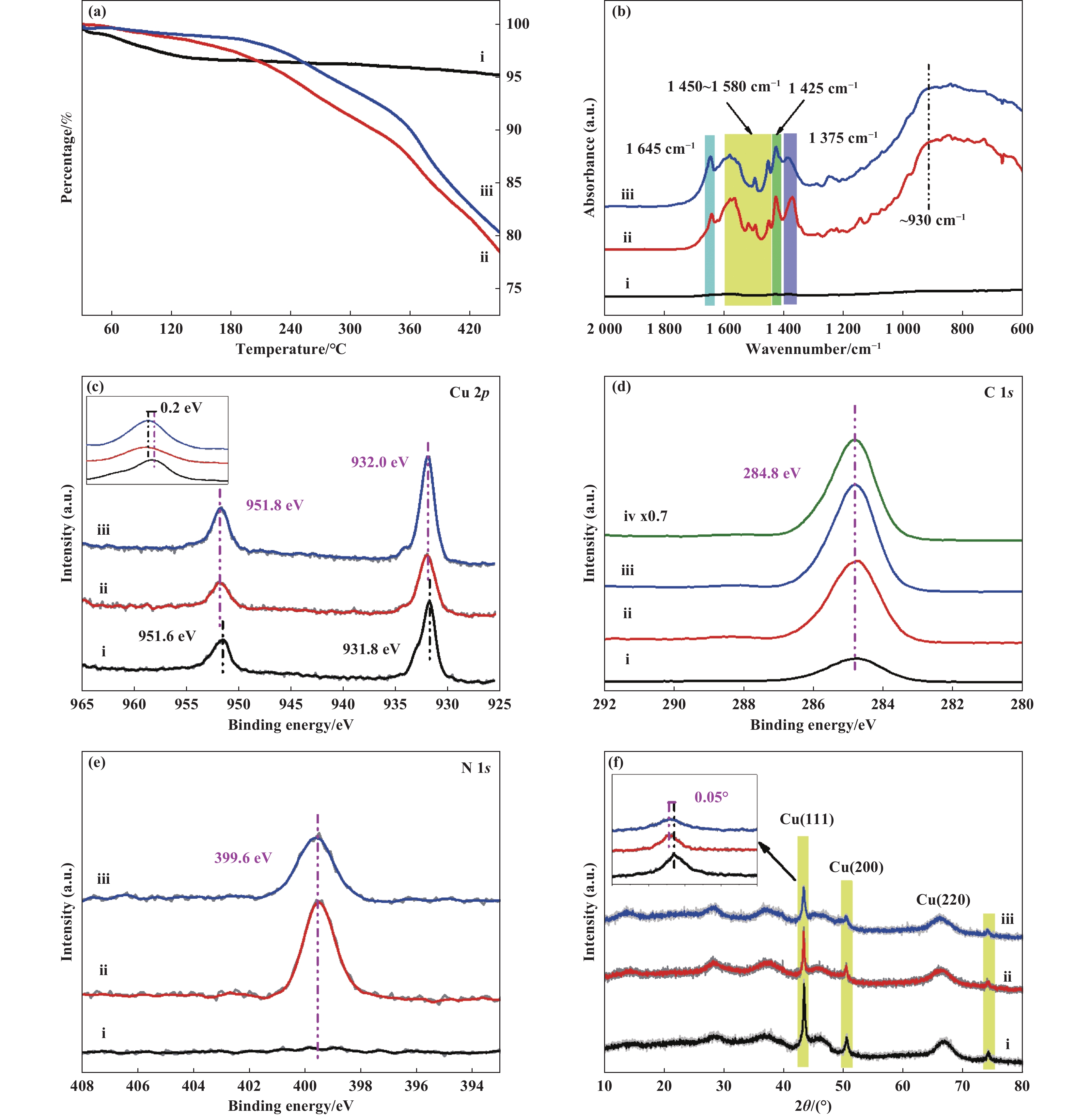
|
图 4 Cu/Al2O3、Cu/Al2O3-L1、Cu/Al2O3-L1-used的催化剂表征(a) TGA; (b) IR-DRS; (c) XPS Cu 2p; (d) XPS C 1s;(e) XPS N 1s; (f) XRD (i, Cu/Al2O3, ii, Cu/Al2O3-L1, iii, Cu/Al2O3-L1-used, iv, L1) Fig.4 Series of characteristic of Cu/Al2O3, Cu/Al2O3-L1, Cu/Al2O3-L1-used (a) TGA; (b) IR-diffuse reflectance spectrum; (c) XPS of Cu 2p; (d) XPS of C 1s; (e) XPS of N 1s; (f) XRD (i, Cu/Al2O3, ii, Cu/Al2O3-L1, iii, Cu/Al2O3-L1-used, iv, L1) |
在红外漫反射测试中, 与Cu/Al2O3催化剂(图4(b), 曲线i) 相比, L1对Cu/Al2O3进行预处理后 (图4(b), 曲线ii) 在1 645和1 425 cm−1处分别出现了C=N和C―N的伸缩振动吸附峰. 此外, Cu/Al2O3-L1在1 450~1 580 cm−1范围内观察到一系列吸收峰归属于L1的苯环骨架振动, 1 375 cm−1处的吸附峰来自于L1的C―H面内弯曲振动. 随后, 对Cu/Al2O3-L1-used催化剂的红外漫反射表征中也能观察到上述所有特征峰 (图4(b), 曲线iii), 这也证明了Cu/Al2O3-L1催化剂的稳定性.
采用X射线光电子能谱 (XPS) 研究了催化剂表面组成及其化学状态的变化. 在Cu/Al2O3中存在较弱C 1s信号峰, 该信号是由环境中的污染碳引起的 (图4(d), 曲线i), 同时在Cu/Al2O3中几乎没有N 1s的信号峰 (图4(e), 曲线i). 与之相比, Cu/Al2O3-L1在284.8 eV处出现与L1中C 1s相同的特征峰(图4(d), 曲线iv), 同时也观察到在399.6 eV处的N 1s信号峰, 这两个信号峰主要来自于配体L1, 由此推测L1可以稳定存在于Cu/Al2O3表面(图4(d)和(e))[26]. 在Cu 2p的XPS结合能也可以发现, Cu/Al2O3-L1的Cu 2p结合能位于932.0 eV, 比Cu/Al2O3的结合能向高能方向偏移了0.2 eV (图4(c)), 表明Cu/Al2O3-L1中的Cu处于缺电子状态, 由此进一步推测Cu与L1之间存在相互作用且电子从Cu流向L1[28]. 此外, Cu/Al2O3-L1-used的Cu 2p和N 1s的结合能与Cu/Al2O3-L1相比差异不大, 也证明了Cu/Al2O3-L1在加氢反应中催化剂的状态没有发生明显变化.
通过X射线衍射光谱 (XRD) 对催化剂进行了表征. 如图4(f)所示, 未预处理的Cu/Al2O3催化剂在43.3°和50.4°处出现了两个明显的衍射峰, 分别对应于Cu(111) 和Cu(200) 的衍射峰 (PDF#85-1326). 由于Cu/Al2O3和L1之间存在相互作用, L1也会覆盖在Cu/Al2O3表面, 使得Cu/Al2O3-L1和Cu/Al2O3-L1-used催化剂在上述角度的衍射峰仍然存在但略微减弱 (图3(f), 曲线ii和iii). 有趣的是, 预处理后的催化剂在43.3°处的衍射峰与Cu/Al2O3相比略有左移 (图4(f), 左上角小图), 表明预处理后催化剂的Cu(111) 出现了微小的晶格膨胀. 由于预处理L1的存在已被TGA、IR-DRS和XPS证实, 我们认为Cu(111) 的晶格膨胀可以归因于表面Cu位点与L1的相互作用.
高分辨率透射电子显微镜(HR-TEM) 图像显示Cu/Al2O3中存在金属Cu纳米颗粒, Cu(111) 的晶格间距为0.207 nm (图5(a)−(c)). 经L1预处理后, Cu/Al2O3-L1中Cu(111) 的晶格间距略微增大(为0.209 nm, 图5(e)−(g)), 这与XRD观察到的结果相符合. 同时, EDXS图像也揭示了Cu纳米颗粒的存在, 并且C和N均匀地分散在催化剂表面, 证明了L1稳定存在于Cu表面(图5(h)). Cu/Al2O3-L1-used的TEM显示其Cu(111) 的晶格间距也为0.209 nm, 与Cu/Al2O3-L1相同, 表明催化剂在反应前后差异不大 (图5(i)−(k)), 也由此可以推测Cu(111) 的晶格膨胀是由于Cu位点与L1的相互作用导致的.

|
图 5 Cu/Al2O3、 Cu/Al2O3-L1 和 Cu/Al2O3-L1-used的TEM结果(a) Cu/Al2O3的HR-TEM图像; (b) 和 (c)为(a) 中红色区域的放大图像和蓝色矩形区域的晶格间距; (d) Cu/Al2O3的元素EDXS图像; (e) Cu/Al2O3-L1的HR-TEM图像; (f) 和 (g)为(e) 中红色区域的放大图像和蓝色矩形区域的晶格间距;(h) Cu/Al2O3-L1的元素EDXS图像; (i) Cu/Al2O3-L1-used的HR-TEM图像; (j) 和 (k)为(i) 中红色区域的放大图像和蓝色矩形区域的晶格间距; (l) Cu/Al2O3-L1-used的元素EDXS图像 Fig.5 The TEM results for Cu/Al2O3, Cu/Al2O3-L1 and Cu/Al2O3-L1-used (a) HR-TEM images of Cu/Al2O3; (b) and (c) magnified pictures of red region from (a) and lattice distance of blue region; (d) elemental EDXS mapping of Cu/Al2O3; (e) HR-TEM images of Cu/Al2O3-L1; (f) and (g) magnified pictures of red region from (a) and lattice distance of blue region; (h) elemental EDXS mapping of Cu/Al2O3-L1; (i) HR-TEM images of Cu/Al2O3-L1; (j) and (k) magnified pictures of red region from (i) and lattice distance of blue region; (l) elemental EDXS mapping of Cu/Al2O3-L1 |
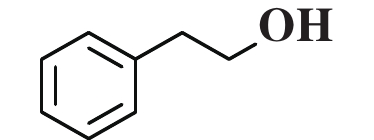
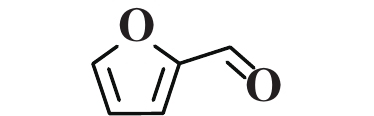
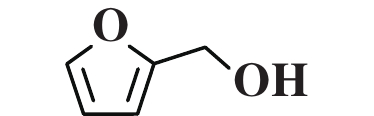
为了研究Cu/Al2O3-L1催化剂优异性能的原因, 利用对照实验、H2-TPR试验和DFT计算对其结构-性能的关系作了进一步分析. 使用含有醛基和C=C键的不同底物进行选择性加氢的对照实验 (表3). 实验结果显示, 具有末端醛基和末端C=C双键的底物加氢效果良好, 如苯乙烯、苯乙醛、糠醛等 (表3, Entry 1−3). 然而, 具有内烯的底物几乎没有发生加氢反应, 如2-丁烯、2-辛烯 (表3, Entry 4−5). 当同一分子中同时存在末端醛基和末端C=C双键时, 两者都能发生加氢反应 (表3, Entry 6). 根据表征结果可以推断, 随着L1在Cu/Al2O3表面的吸附并与Cu发生相互作用, Cu周围的电子环境受到影响, 引起催化剂加氢活性显著提高. 此外, 由于Cu/Al2O3-L1表面L1的存在, 肉桂醛等分子只能以直立或倾斜方式靠近Cu位点, 从而分子内部的C=C键加氢因远离Cu活性位点而受到抑制, 从而提高了肉桂醇的选择性 (图6).
| 表 3 Cu/Al2O3-L1 催化机制对照试验 Table 3 Control experiment for selective source of Cu/Al2O3-L1 |
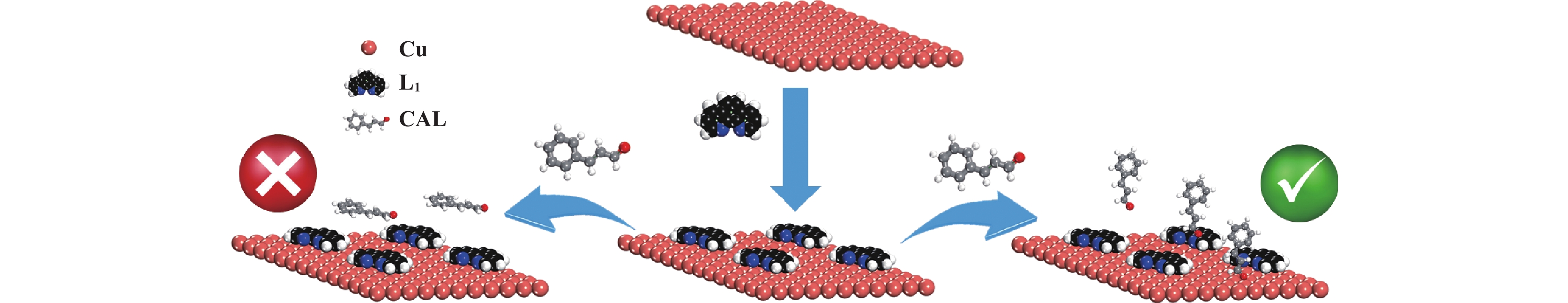
|
图 6 Cu/Al2O3-L1 催化机制示意图 Fig.6 The schematic diagram of catalytic mechanism of Cu/Al2O3-L1 |
利用H2-TPR试验, 研究了Cu/Al2O3和Cu/Al2O3-L1催化剂在H2活化能力方面的差异. Cu/Al2O3, Cu/Al2O3-L1催化剂的H2-TPR曲线均在100~800 ℃范围内出现3个吸收峰, 表明催化剂上存在3种不同的H2化学吸附位点 (图7(a)). 其中Cu/Al2O3-L1的最低还原温度为210 ℃, 低于Cu/Al2O3的273 ℃, 表明Cu/Al2O3-L1具有更强的还原能力, 这可能是Cu/Al2O3-L1高活性的原因之一.
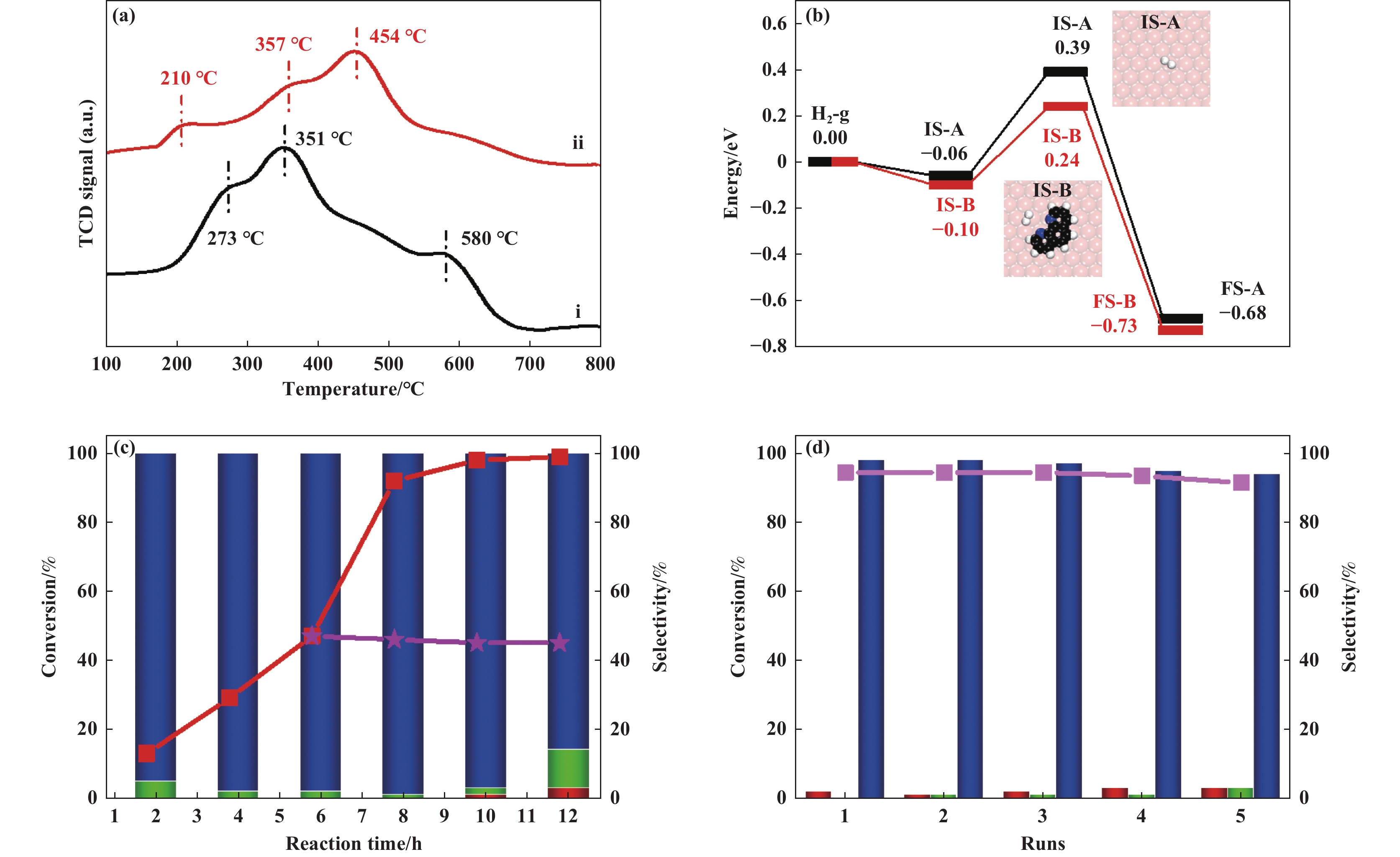
|
图 7 H2还原、活化能力对比以及Cu/Al2O3-L1的催化性能(a) H2-TPR (i, Cu/Al2O3, ii, Cu/Al2O3-L1); (b) H2在不同催化剂上活化的能量分布图 (黑色, Cu/Al2O3; 红色, Cu/Al2O3-L1; TS-A表示H2在纯Cu(111)上的过渡态, TS-B表示H2在吸附了L1后Cu(111)上的过渡态, 其中白色为H原子, 黑色为C原子, 蓝色为N原子, 橙色为Cu原子); (c) Cu/Al2O3-L1在不同反应时间下的实验结果和热过滤实验; (d) Cu/Al2O3-L1的重复使用及其实验结果 (粉色折线表示热过滤后反应转化率, 红色折线图表示转化率, 柱状图表示选择性: 蓝色代表肉桂醇, 绿色代表苯丙醇, 红色代表苯丙醛) Fig.7 Comparison of reducing and activation capacity of H2 on different catalysts and catalyst performance of Cu/Al2O3-L1 (a) H2-TPR (i, Cu/Al2O3, ii, Cu/Al2O3-L1); (b) Energy profiles of H2 activation on Cu/Al2O3 and Cu/Al2O3-L1 catalyst (black and TS-A, H2 on bare Cu(111) of Cu/Al2O3, red and TS-B, H2 on Cu(111) with L1 of Cu/Al2O3-L1, H atom in white, C in black, O in red, N in blue and Cu in pink); (c), different reaction time of Cu/Al2O3-L1 and hot filtration; (d) catalytic runs of Cu/Al2O3-L1 (Cinnamylalcohol in blue, phenylpropanol in green, and phenylpropanal in red) |
为了证明上述猜想的合理性, 我们构建了L1在Cu/Al2O3表面的吸附模型, 对上述猜测结构进行建模分析. 首先, 我们研究了Cu/Al2O3和Cu/Al2O3-L1表面上H2活化能力的差异. 在纯Cu表面, H2的吸附能为−0.06 eV, H2活化的解离能垒为0.45 eV (图7, TS-A). 相比之下, 当L1存在时, H2在Cu表面的吸附能为−0.10 eV, H2的活化解离能垒仅为0.34 eV(图7(b), TS-B), 明显低于纯Cu表面, 表明H2在Cu/Al2O3-L1上更容易发生解离, 这为解释L1处理后Cu/Al2O3-L1催化剂的高活性提供了新的证据.
使用Cu/Al2O3-L1催化剂研究了其反应时间与催化性能之间的关系, 转化率-时间曲线显示, 随着反应时间的增加, 肉桂醛的转化速度先慢后快, 在10 h左右转化率达到98%, 肉桂醇的选择性也保持在95%附近. 继续延长反应时间至12 h, 肉桂醛完全转化, 但对肉桂醇的选择性降低, 副产物增加(图7(c)). 为了测试活性铜物种是否在反应过程中从体相中浸出,对Cu/Al2O3-L1进行了热过滤实验. 从反应后的混合物中过滤得到滤液, 通过ICP-AES分析, 仅有0.11 mg·L−1的Cu元素被检出, 这一结果接近仪器的最低检测限 (0.1 mg·L−1). 此外, 将热过滤后的滤液再继续反应2~6 h, 发现肉桂醛没有进一步转化, 证实了Cu/Al2O3-L1催化剂的多相性, 其催化活性物种不是来自浸出的金属Cu (图7(c)). 随后我们也对Cu/Al2O3-L1和Cu/Al2O3-L1-used的催化剂固体进行了ICP-AES分析, 发现两者Cu元素的含量在4.1%~4.2%之间, 说明Cu/Al2O3-L1催化剂中Cu元素没有明显流失. 然后, 我们通过催化循环实验进一步研究了Cu/Al2O3-L1催化剂的可重复使用性和稳定性, 结果显示, 该催化剂可以在反应条件下至少重复使用5次, 同时催化剂的活性和肉桂醇选择性没有出现明显下降, 具有实际应用的潜力 (图7(d)).
3 结论我们通过表面配体修饰的策略, 制备了1,10-菲啰啉 (L1) 修饰的负载型纳米Cu催化剂(Cu/Al2O3-L1), 与纳米Cu催化剂 (Cu/Al2O3) 相比, 该催化剂可以同时实现选择性和活性的显著提升, 在肉桂醛几乎完全转化的情况下肉桂醇 (COL) 选择性高达95%. 表征和DFT结果表明, Cu与表面L1之间存在电子转移, 有利于L1的吸附, 同时L1的空间位阻效应也抑制了肉桂醛的平面吸附, 导致肉桂醛只能以直立或倾斜方式靠近活性金属表面, 从而提高了肉桂醇的选择性. 另外, L1的存在增强了H2与催化剂表面Cu的相互作用, 降低了H2的解离能, 提高了催化活性. 该工作揭示了通过含N-配体的表面修饰作用提升催化性能的可行性, 为其他还原性基团的选择性加氢提供了一定的借鉴意义.
| [1] |
Multicomponent Pt-based zigzag nanowires as selectivity controllers for selective hydrogenation reactions[J]. J Am Chem Soc, 2018, 140(27): 8384–8387.
DOI:10.1021/jacs.8b03862 |
| [2] |
Effective and selective catalysts for cinnamaldehyde hydrogenation: Hydrophobic hybrids of metal-organic frameworks, metal nanoparticles, and micro- and mesoporous polymers[J]. Angew Chem Int Ed, 2018, 57(20): 5708–5713.
DOI:10.1002/anie.201801289 |
| [3] |
Metal-organic frameworks as selectivity regulators for hydrogenation reactions[J]. Nature, 2016, 539(7627): 76–80.
DOI:10.1038/nature19763 |
| [4] |
Mechanistic insights on the hydrogenation of α,β-unsaturated ketones and aldehydes to unsaturated alcohols over metal catalysts
[J]. ACS Catal, 2012, 2(4): 671–683.
DOI:10.1021/cs200567z |
| [5] |
Chemo-regioselectivity in heterogeneous catalysis: Competitive routes for CO and CC hydrogenations from a theoretical approach[J]. J Am Chem Soc, 2006, 128(4): 1316–1323.
DOI:10.1021/ja056689v |
| [6] |
Xu Li-yong(许莉勇), Zhang Xin-bo(张新波), Zhang Bin(张斌), et al. Recent progress in heterogeneous catalytic selective hydrogenation of cinnamaldehyde to cinnamylalcohol(肉桂醛多相催化选择性加氢制肉桂醇的研究进展)[J]. Chin J Mod Appl Pharm(中国现代应用药学), 2010, 27(7): 599−603.
|
| [7] |
Adsorption of styrene on Ag(111)[J]. Surf Sci, 2004, 572(2): 401–408.
|
| [8] |
Selective hydrogenation of α,β-unsaturated aldehydes catalyzed by amine-capped platinum-cobalt nanocrystals
[J]. Angew Chem Int Ed, 2012, 51(14): 3440–3443.
DOI:10.1002/anie.201108593 |
| [9] |
The Electronic structure and orientation of styrene adsorbed on FeO(111) and Fe3O4(111)A spectroscopic investigation
[J]. J Phys Chem B, 2000, 104(32): 7694–7701.
DOI:10.1021/jp0006734 |
| [10] |
Controlling surface ligand density and core size of alkanethiolate-capped Pd nanoparticles and their effects on catalysis[J]. Langmuir, 2012, 28(40): 14502–14508.
DOI:10.1021/la302653u |
| [11] |
Organic thiol modified Pt/TiO2 catalysts to control chemoselective hydrogenation of substituted nitroarenes
[J]. ACS Catal, 2012, 2(10): 2079–2081.
DOI:10.1021/cs300378p |
| [12] |
Directing reaction pathways by catalyst active-site selection using self-assembled monolayers[J]. Nat Commun, 2013, 4(1): 2448.
DOI:10.1038/ncomms3448 |
| [13] |
Controlling surface crowding on a Pd catalyst with thiolate self-assembled monolayers[J]. J Catal, 2013, 303: 92–99.
DOI:10.1016/j.jcat.2013.03.012 |
| [14] |
Control of metal catalyst selectivity through specific noncovalent molecular interactions[J]. J Am Chem Soc, 2014, 136(1): 520–526.
DOI:10.1021/ja411973p |
| [15] |
Atomically precise Au25(SR)18 nanoparticles as catalysts for the selective hydrogenation of α,β-unsaturated ketones and aldehydes
[J]. Angew Chem Int Ed, 2010, 122: 1317–1320.
DOI:10.1002/ange.200906249 |
| [16] |
Breaking trade-off between selectivity and activity of nickel-based hydrogenation catalysts by tuning both steric effect and d-band center[J]. Adv Sci, 2019, 6(10): 1900054–1900064.
DOI:10.1002/advs.201900054 |
| [17] |
Nanocomposites of platinum/metal-organic frameworks coated with metal-organic frameworks with remarkably enhanced chemoselectivity for cinnamaldehyde hydrogenation[J]. ChemCatChem, 2016, 8(5): 946–951.
DOI:10.1002/cctc.201501256 |
| [18] |
Shen Hai-yu(申海玉), Zhao Hua-hua(赵华华), Yang Jian(杨 建), et al. Progresses in the application of MOFs in selective hydrogenation of unsaturated aldehydes(MOFs在不饱和醛选择加氢中的应用研究进展)[J]. J Mol Catal(China)(分子催化), 2021, 35(6): 571−582.
|
| [19] |
Selective hydrogenation of cinnamaldehyde to cinnamyl alcohol over mesoporous carbon supported Fe and Zn promoted Pt catalyst[J]. Appl Catal, A:Chem, 2008, 339(2): 159–168.
DOI:10.1016/j.apcata.2008.01.023 |
| [20] |
On the role of water in selective hydrogenation of cinnamaldehyde to cinnamyl alcohol on PtFe catalysts[J]. J Catal, 2018, 364: 192–203.
DOI:10.1016/j.jcat.2018.05.008 |
| [21] |
A strongly coupled ultrasmall Pt3Co nanoparticle-ultrathin Co(OH)2 nanosheet architecture enhances selective hydrogenation of α,β-unsaturated aldehydes
[J]. ACS Catal, 2019, 9(1): 154–159.
DOI:10.1021/acscatal.8b03471 |
| [22] |
Efficient liquid-phase hydrogenation of cinnamaldehyde to cinnamyl alcohol with a robust PtFe/HPZSM-5 catalyst[J]. J Catal, 2020, 382: 1–12.
DOI:10.1016/j.jcat.2019.12.004 |
| [23] |
Li Meng-nan(李梦楠), Xin Hui-yue(信惠跃), Wu Peng(吴 鹏), et al. Progress in supported Pt-based catalysts for the liquid-phase selective hydrogenation of cinnamaldehyde(负载型铂基催化剂在肉桂醛选择加氢中的研究进展)[J]. J East China Normal Univ(Nat Sci)(华东师范大学学报(自然科学版)), 2023; 227(1): 114−128.
|
| [24] |
Fe-Co Alloyed nanoparticles catalyzing efficient hydrogenation of cinnamaldehyde to cinnamyl alcohol in water[J]. Angew Chem Int Ed Engl, 2020, 59(52): 23521–23526.
DOI:10.1002/anie.202009913 |
| [25] |
Ge Yuan-yuan(盖媛媛), Li Hai-tao(李海涛), Li Jian-fa(李建法), et al. Catalytic MPV transfer hydrogenation performance of cinnamaldehyde over ZrO4/SiO2-Al2O3 (ZrO4/SiO2-Al2O3催化肉桂醛MPV转移加氢性能)[J]. J Mol Catal(China)(分子催化), 2018, 32(6): 511−519.
|
| [26] |
Efficient hydrogenation catalyst designing via preferential adsorption sites construction towards active copper[J]. J Catal, 2021, 400: 397–406.
DOI:10.1016/j.jcat.2021.06.025 |
| [27] |
Active catalyst construction for CO2 recycling via catalytic synthesis of N-doped carbon on supported Cu
[J]. Nat Commun, 2019, 10: 2599–2605.
DOI:10.1038/s41467-019-10633-y |
| [28] |
One-dimensional self-assembled molecular chains on Cu(100): Interplay between surface-assisted coordination chemistry and substrate commensurability[J]. J Phys Chem C, 2007, 111(29): 10982–10987.
DOI:10.1021/jp071100v |
 2023, Vol. 37
2023, Vol. 37