化石燃料燃烧排放大量温室气体, 导致全球气温升高等严重的环境问题, 因此人们不得不寻求清洁的可再生能源以替代传统的化石能源. 随着国家双碳战略的提出, 我国清洁能源的开发显得尤为紧迫. 氢气是一种绿色清洁能源[1−2], 同时在建筑、冶金加工、石油精炼和燃料电池中也有巨大的需求. 常见的制氢方法如煤制氢、电解水等都存在着严重的碳排放和高能耗等问题[3]. 以甲烷为原料制氢(包括甲烷蒸汽重整、甲烷热裂解和甲烷部分氧化制氢等工艺)具有产氢量高、相对排放低等优点. 甲烷水蒸汽重整制氢技术已工业化多年, 是当今常见的大规模制氢途径之一, 但其强吸热反应使得生产成本和能耗剧增[4−5], 反应过程中每生产1 kg氢气的同时会产生约10 kg的CO2, 而H2和CO2的分离会导致生产成本的额外增加. 尽管如此, 目前也没有其他更好的氢气生产方法应用在大规模氢气生产中[6].
甲烷热催化裂解可实现避免COx生成的同时以较低成本制备高纯度氢气[7], 其反应方程式为: CH4(g) → C(s) + 2 H2(g), ΔH0298K = +75.6 kJ/mol. 通过简单吸热反应使得甲烷分解生成氢气和具有高附加值的碳纳米材料, 吸引了很多国内外学者的研究和关注[8]. 在制氢方面, 甲烷热催化裂解工艺优于蒸汽重整工艺[9]; 从技术角度方面, 也优于电解制氢工艺[10−11]. 此外, 甲烷热催化分解易于生产具有高机械强度和结晶度的多壁碳纳米管, 进而可以给甲烷热催化裂解带来更高的附加经济价值[12−13].
甲烷是一种高度稳定的分子, 需要温度>1 200 ℃才能解离强C―H共价键(EC―H = 434 kJ/mol)[14]. 因此, 必须要为甲烷热催化裂解提供一条强有力的降低活化能的途径, 才能有效降低反应温度. 常用的甲烷热催化裂解催化剂活性金属为Ni、Fe和Co, 载体有MgO、Al2O3、SiO2、ZrO2、MgO-Al2O3、TiO2、SiO2-Al2O3、CeO2-ZrO2、沸石和中孔结构硅载体等[15−21].
过渡金属Ni、Fe和Co作为活性金属对甲烷热催化裂解反应具有较好的催化活性. 其中, Ni通常被认为是甲烷热催化裂解过程中活性最高且成本较低的金属之一. Ni基催化剂的结构和电子状态常常受载体类型的影响, 从而影响催化剂的反应性能. 因此, 选择适宜载体负载活性金属Ni可得到高活性、高稳定性的催化剂[22]. 此外研究还发现, 甲烷转化率随活性金属负载量的增加而提高, 这主要归因于催化剂中NiO颗粒数量的增加. 在甲烷热催化裂解反应中, 导致催化剂失活的主要原因是: 在反应过程中活性金属颗粒被生成的副产物碳封装, 形成金属包埋颗粒. 采用其他过渡金属为助剂来改性Ni基催化剂是解决这一问题的有效方案[23]. 由于合金效应, 添加第二种活性金属在Ni基催化剂中可以显著提高催化剂的活性和稳定性[24]. Musamali等[25]报道, 添加助剂金属Cu, 可有效提高以MgO为载体的Ni基催化剂稳定性, 使其在反应8 h后催化剂稳定性良好. 金属Cu并不具备甲烷热催化裂解反应活性, 其主要功能是提高产物碳的扩散速率, 有助于碳纳米管的形成, 从而避免活性金属Ni被碳产物覆盖失去催化反应活性. 此外, 金属Cu可促进甲烷热催化裂解反应形成更宽、更长的碳纳米管副产物[26].
常用的甲烷热催化裂解催化剂载体是Al2O3[27], 此外SiO2、 TiO2,、MgAl2O4,、SBA-15和La2O3等载体在Ni基催化剂上的应用也被学者们广泛研究[28−32]. 研究发现以SiO2为载体制备催化剂具有较高的起始甲烷转化率, 但其容易因催化剂载体孔道内积累的碳而失活[33]. TiO2载体具有较高的表面积和孔隙体积, 有助于提高活性金属Ni的分散性, 形成大量反应活性位点, 因此以TiO2为载体负载金属Ni制备催化剂的反应活性较高[34]. 此外, 适当的载体和活性金属间相互作用, 也可提高催化剂的热稳定性. Italiano等[35]的研究结果表明, 在反应温度高于800 ℃时, Fe基催化剂的甲烷转化率较高. 研究人员对比了不同载体在Fe基催化剂中的催化效果, 结果发现与MgO和TiO2相比, Al2O3为载体负载铁所得催化剂的甲烷转化率较高, 催化剂的活性顺序为Al2O3 > MgO > TiO 2[36]. 分子筛具有优良的孔道结构和比表面积, 能够有效提高产物的扩散. 分子筛通常具有优异的水热稳定性, 能够耐受较高的反应温度, 在甲烷裂解反应过程中保持稳定的孔隙率, 有利于甲烷分子与活性金属位点的接触, 并促进产物原子碳的扩散[37]. IM-5分子筛是以吡咯烷类双季铵盐为模板剂制备的分子筛, 其复杂孔道结构是由二维十元环孔道和有限的2.5 nm厚的三维孔道组成. IM-5分子筛具有较高的热稳定性, 因此其具有广泛的应用前景. 然而, 目前针对不同分子筛为载体并应用于甲烷热催化裂解的报道并不多见, 以IM-5分子筛为载体应用于制备甲烷热催化裂解催化剂尚未见报道.
因此, 为进一步探究载体类型特别是IM-5分子筛对催化剂甲烷热催化裂解性能的影响, 我们选择研究者们常用的γ-Al2O3、介孔SiO2、碳纳米管(CNTs)和实验室合成分子筛TS-1、IM-5、Y为载体, 以常温浸渍法制备Ni-Cu催化剂, 将其应用于甲烷热催化裂解反应. 考察不同载体对所制Ni-Cu催化剂的晶体结构性质的影响, 以及其在甲烷热催化裂解反应中的催化性能和稳定性.
1 实验部分 1.1 催化剂的制备以研究者们常用的γ-Al2O3、介孔SiO2、CNTs和实验室合成的TS-1、IM-5、Y分子筛为催化剂载体, 硝酸镍和硝酸铜为活性金属前驱体. 实验所得催化剂的金属负载量以金属氧化物计为: NiO 20%; CuO 10% (质量分数). 首先, 将一定质量金属硝酸盐溶于去离子水中, 得到浸渍液. 将一定质量的载体置于坩埚内, 将浸渍液滴加至载体表面使其完全浸渍载体. 将所得样品在室温下静置4 h, 使浸渍液在载体孔道内扩散均匀. 然后, 将样品转移至120 ℃鼓风干燥箱内加热蒸发除去水分, 将所得样品充分研磨后, 于通入空气的马弗炉中550 ℃焙烧4 h(以CNTs为载体制备样品在通N2的马弗炉中550 ℃焙烧4 h), 所得样品在10 MPa压力下压制成片, 并研磨后过筛制备粒径0.450~0.280 mm的催化剂以用于甲烷热催化裂解反应性能评价.
1.2 表征方法使用X射线粉末衍射法对合成的产品进行物相分析, 仪器为荷兰PANalytial X’Pert Powder型X-射线衍射仪. 使用扫描电子显微镜观察样品的颗粒(晶粒)形貌和聚集状态等, 仪器为ZEISS Gemini SEM 300型热场发射扫描电子显微镜. 我们使用低温氮气物理吸附脱附表征样品的结构性质, 仪器为美国Micromeritics TriSTAR 3020型物理吸附仪. 由BET公式计算样品比表面积, 根据等温线吸附得到BJH法孔径分布曲线, t-plot法获得微孔比表面积和孔体积. 采用化学吸附仪Micromeritics AutoChem Ⅱ 2920测定催化剂还原性能以及氢气吸附量. 采用热重分析仪Simultaneous DSC-TGA Q600, 对参与反应后得到的产物在程序控温下, 测定样品质量随温度变化曲线. 采用JEOL JEM-2100透射电子显微镜观察样品的形貌和金属分布.
1.3 甲烷热催化裂解制氢实验甲烷热催化裂解制氢反应装置是实验室搭建的常压固定床反应器称取0.1 g干燥后的催化剂装入内径8 mm、长400 mm的反应管内, 反应管两端装有石英棉以固定催化剂位于反应炉恒温区内.20 mL/min N2气氛下加热反应炉至550 ℃, 切换气体为10 mL/min H2, 将催化剂还原2 h. 待催化剂还原结束后, 切换气体为20 mL/min N2, 吹扫反应管30 min, 以除去反应管内残存H2. 然后, 加热反应炉至700 ℃后切换气体为2.5 mL/min N2和7.5 mL/min CH4混合气, 待反应稳定5 min后采用Agilent 8890气相色谱仪对反应产物进行在线组分分析. 反应400 min后结束反应, 关闭反应炉加热和原料气. 待反应装置降至室温后取出反应管内的催化剂和碳产物并称重. 反应后催化剂和碳产物质量与反应前催化剂质量的差值为催化剂积碳质量. 甲烷转化率、碳产量和催化剂失活比的计算公式如下:
| $ \begin{split} & 甲烷转化率: \\ & {X_{{{ CH}_4}}}({\text{%}} ) = \frac{{{\text{mol}}{{ CH}_{4,in}} - {\text{mol}}C{H_{4, out}}}}{{{\text{mol}}{{ CH}_{4,in}}}} \times 100{\text{%}} \end{split}$ | (1) |
| $ 产碳量: {Y_C} = {M_C}/{M_{ cat}} \times 100{\text{%}} $ | (2) |
| $ 催化剂失活比: {\nu _d} = \frac{{{X_0} - {X_t}}}{{{X_0}}} \times 100{\text{%}} $ | (3) |
甲烷进料摩尔量: mol
催化剂质量: Mcat; 甲烷初始/最高转化率: X0; 反应时间t min; 时甲烷转化率: Xt.
2 结果与讨论 2.1 不同载体负载Ni-Cu催化剂的织构性质通过低温N2物理吸附-脱附分析表征了不同载体负载Ni-Cu催化剂的织构性质. 如图1(a)、(b)所示, 不同催化剂N2吸附-脱附曲线的滞后环和孔径分布曲线均存在明显差异, 这主要是因载体不同的晶胞单元和孔型结构所致[38]. 上述6种载体中, IM-5、TS-1和Y分子筛为载体制备的催化剂均为微孔结构材料, γ-Al2O3和SiO2为载体制备的催化剂为介孔结构材料, 而CNTs为载体制备的催化剂为多级孔结构材料. 如表1所示, IM-5、TS-1和Y分子筛为载体制备催化剂的平均孔径均小于5.0 nm. 以γ-Al2O3和介孔SiO2为载体制备催化剂的平均孔径分别为15.0和10.0 nm, 具有较多的介孔孔道结构和较高的孔体积. 以CNTs为载体制备的催化剂含有较丰富的多级孔道, 平均孔径为12.6 nm. 催化剂不同的平均孔径和孔径分布曲线主要是由载体种类不同导致的, 不同的金属颗粒分布, 使得催化剂表现出不同的甲烷热催化裂解反应活性和稳定性.
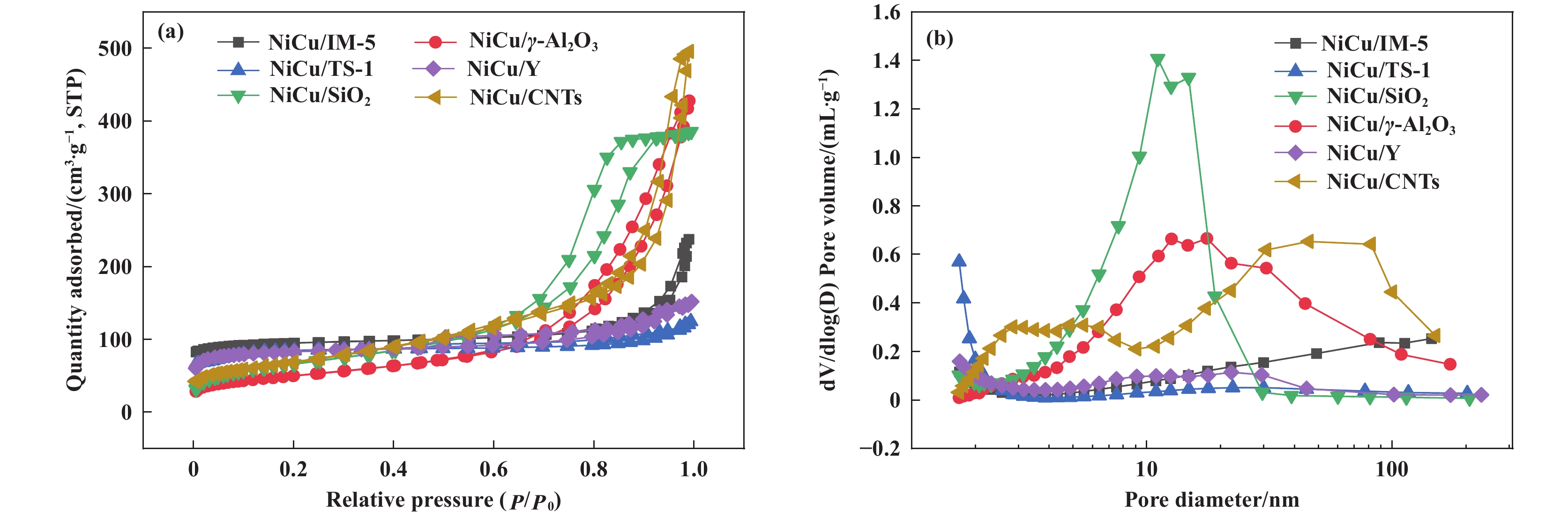
|
图 1 不同载体负载Ni-Cu催化剂的低温N2物理吸附-脱附曲线(a)和孔径分布曲线(b) Fig.1 N2 Adsorption-desorption isotherms (a) and BJH pore size distributions (b) of different catalysts prepared supports |
| 表 1 不同载体负载Ni-Cu催化剂的理化性质 Table 1 Physico-chemical properties of different catalysts |
为进一步明确不同载体对表面金属颗粒的影响, 我们对还原前后的催化剂进行了XRD分析. 如图2所示, 以γ-Al2O3、介孔SiO2、Y、TS-1和IM-5 5种载体所制备催化剂的XRD谱图曲线均含不同衍射晶面的NiO颗粒, NiO金属颗粒在2θ=37.3°、43.4°、63.0°、75.6°、79.2°附近出现衍射峰, 分别归属于(111)、(200)、(220)、(311)、(222)晶面[39]. 以CNTs为载体制备催化剂在N2氛围下焙烧, 分布于载体表面的金属未能被氧化为NiO颗粒, 因此其XRD谱图曲线未能检测到NiO特征峰. 由Scherrer方程计算不同催化剂还原前后表面金属颗粒大小, 计算结果列于表1中. 由表1中数据可得, 催化剂表面的金属颗粒大小不同. 催化剂表面NiO粒径大小排序为: NiCu/Y > NiCu/IM-5 > NiCu/TS-1 > NiCu/SiO 2 > NiCu/ γ-Al2O3. 以分子筛为载体制备催化剂表面的NiO平均粒径较大, 显著高于以介孔SiO2和γ-Al2O3为载体制备的催化剂. 这可能归因于分子筛的特殊孔道结构使得金属颗粒被限域在孔道结构中, 抑制了金属颗粒的分散, 使得金属颗粒团聚, 最终形成较大的NiO颗粒. 如图3所示, 催化剂经H2在550 ℃条件下还原2 h后, 所有催化剂表面均未发现NiO特征峰, 说明催化剂表面的Ni物种均被还原为Ni0. Ni0金属颗粒在2θ=44.6°、51.9°、76.4°附近出现衍射峰, 分别归属于(111)、(200)、(220)晶面. Ni0金属颗粒为甲烷热催化裂解反应过程中甲烷吸附和C―H键断裂位点, 但在Ni0(111)晶面发生原子C的沉积[40]. 图3中不同载体负载Ni-Cu催化剂的Ni0(111)晶面衍射峰强度不同, 说明催化剂表面具有不同大小的Ni0(111)晶粒, 这可能会导致催化剂表面不同的碳沉积类型. 这与不同催化剂生成碳产物的SEM表征结果相一致. H2还原后催化剂表面Ni0粒径大小排序为: NiCu/IM-5 > NiCu/Y > NiCu/TS-1 > NiCu/SiO 2 > NiCu/CNTs > NiCu/ γ-Al2O3. NiCu/IM-5催化剂表面Ni0粒径最大达到32.7 nm. 除NiCu/γ-Al2O3催化剂外, 其他催化剂经H2还原后表面平均金属Ni颗粒明显增加, 这是由H2还原过程中金属烧结而导致的颗粒团聚. 而NiCu/γ-Al2O3催化剂的Ni颗粒呈现变小的趋势, 这可归因于催化剂表面金属Ni与γ-Al2O3间的强相互作用力. 载体于金属颗粒间的强相互作用力抑制了催化剂表面的原子迁移, 进而避免了金属烧结[41]. 同时, 较强的相互作用力使得部分Ni金属颗粒迁移进γ-Al2O3载体内部, 导致催化剂表面Ni颗粒变小, 与NiCu/γ-Al2O3催化剂的H2-TPR曲线的分析结果相一致.
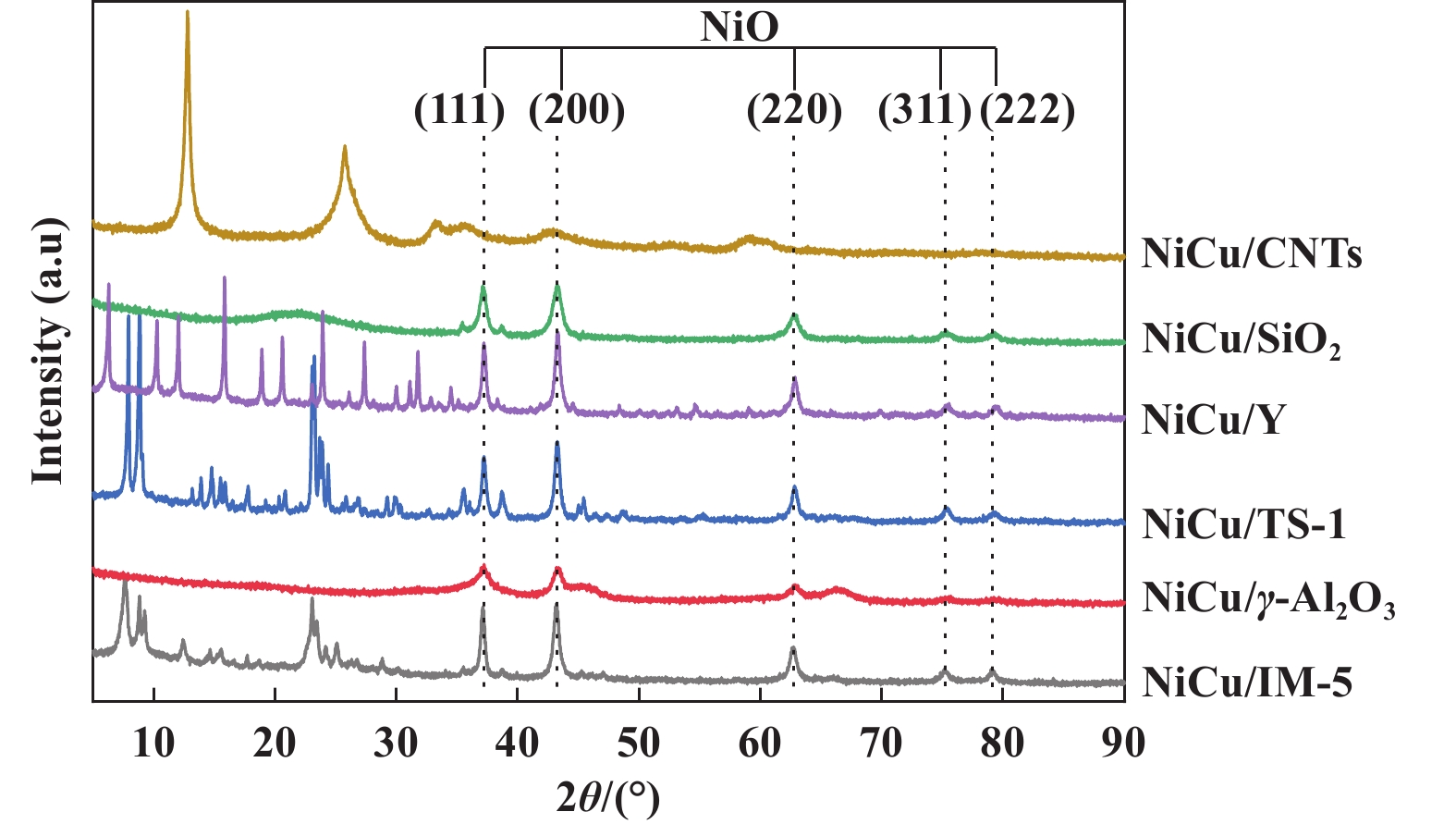
|
图 2 不同载体负载Ni-Cu催化剂的XRD谱图 Fig.2 XRD patterns of fresh catalysts |
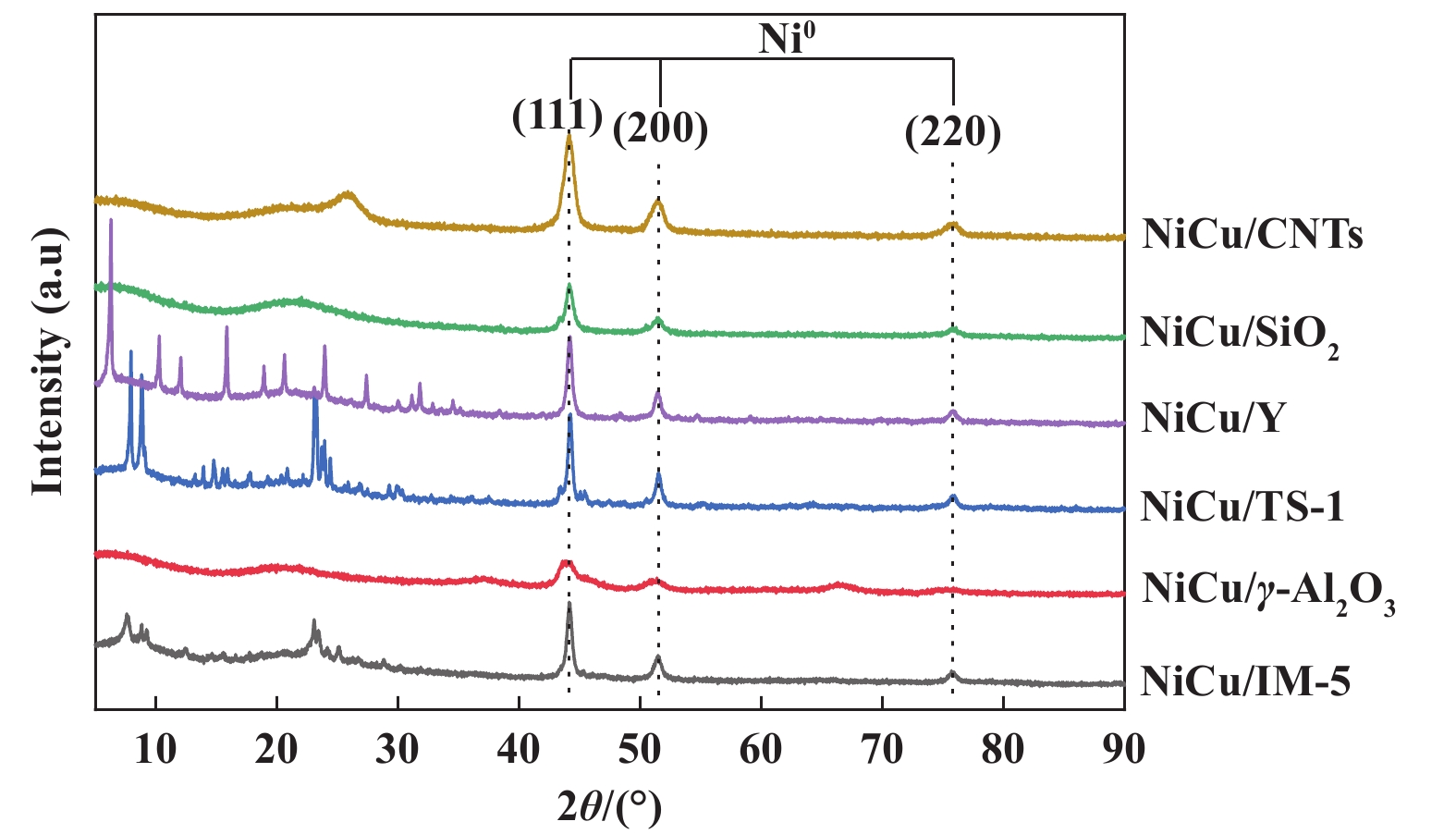
|
图 3 不同载体负载Ni-Cu催化剂还原态的XRD谱图 Fig.3 XRD patterns of reduced catalysts prepared by different supports |
催化剂的H2还原性能对其反应活性和稳定性有重要影响. 因此, 通过H2-TPR分析表征不同载体所制备催化剂的还原峰出现位置, 可以探究催化剂表面金属颗粒与不同载体间相互作用力的差异. 所有制备催化剂的H2-TPR曲线如图4所示, 以不同载体制备的催化剂均在150~200 ℃范围内出现尖锐还原峰, 这归属于催化剂中的CuO颗粒(Cu2+→Cu0), 通常其不与载体间发生相互作用, 仅以游离态分布于载体表面[42]. 以Y分子筛、介孔SiO2、TS-1分子筛和IM-5分子筛为载体制备的催化剂均在200~325 ℃范围内具有较强且宽的特征峰, 表明以这4种载体制备的催化剂均含有较多的游离NiO颗粒, 其与载体间仅存在非常微弱的相互作用力, 这是催化剂经H2还原后表面金属Ni粒径增加的主要原因. 然而, 以γ-Al2O3为载体制备的催化剂在325~450 ℃范围内含有显著特征峰, 这表明催化剂中含有小颗粒的NiO颗粒, 其与载体间相互作用力强于游离NiO颗粒[43]. 上述5种催化剂中出现的H2还原峰均低于500 ℃, 表明催化剂表面的NiO物种均易于被H2还原为Ni0. NiCu/CNTs催化剂的还原峰较多, 说明催化剂表面含有多种尺寸的金属颗粒. 较高的还原温度说明NiCu/CNTs催化剂表面含有部分尺寸较大的金属颗粒. 催化剂不同的还原曲线表明催化剂载体与金属颗粒间不同的相互作用力, 这是导致还原态催化剂表面Ni0金属颗粒大小不同的主要原因.
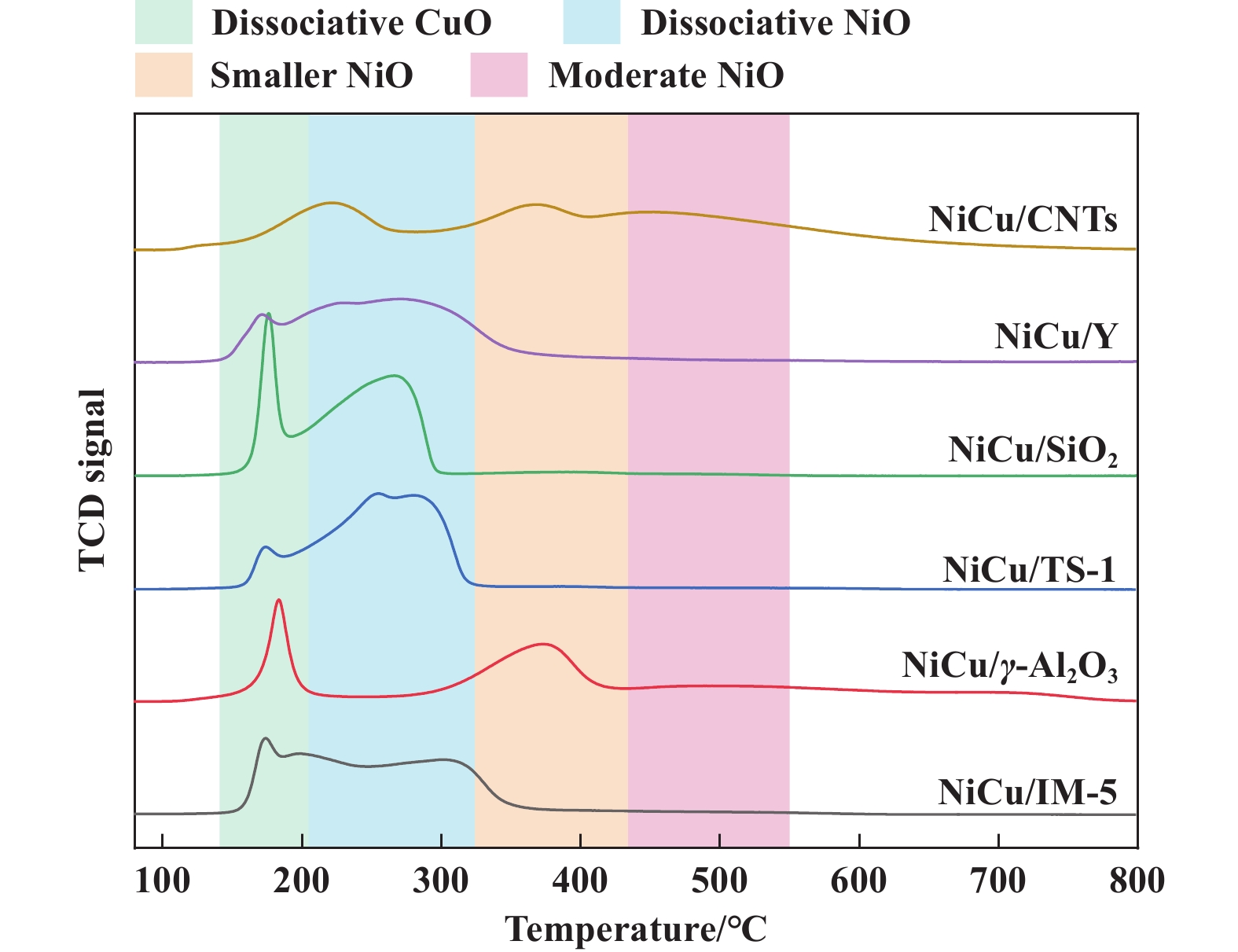
|
图 4 不同载体负载Ni-Cu催化剂的H2-TPR谱图曲线 Fig.4 H2-TPR curves of different catalysts |
为分析比较各催化剂的反应性能和稳定性, 在700 ℃、GHSV=2 L/h的条件下进行催化剂的甲烷裂解制氢反应. 不同催化剂的甲烷转化率随时间变化曲线如图5所示, 由图中曲线可知, 载体对催化剂的甲烷转化率和稳定性均有显著影响. 以IM-5、Y、TS-1、介孔SiO2和CNTs为载体制备催化剂的甲烷起始转化率均约为70%~75%. 而以γ-Al2O3为载体制备催化剂的起始甲烷转化率仅为35%, 远低于其他载体制备催化剂. 这可能归因于催化剂还原过程中, 催化剂中部分金属Ni迁移进载体内部, 从而丧失了催化反应活性. 以CNTs、介孔SiO2和γ-Al2O3为载体制备的催化剂反应稳定性较差, 甲烷转化率随时间变化呈显著下降趋势, 其催化稳定性为: NiCu/CNTs > NiCu/ γ-Al2O3 > NiCu/SiO 2. 以IM-5、Y和TS-1 3种分子筛为载体制备催化剂在400 min内保持稳定的甲烷转化活性, 但反应活性存在差异. NiCu/IM-5催化剂在100 min内甲烷转化率逐渐上升. 100 min后达到稳定, 其甲烷转化率最高达到约83%, 随后稳定为80%左右. 此阶段沉积碳的扩散将活性金属从较大的金属颗粒中剥离出小颗粒, 小金属颗粒通过尖端生长机制生成碳纳米管. 这种不断的金属剥离使得活性位点不断增加, 最终导致反应初期甲烷转化率逐渐上升. NiCu/Y和NiCu/TS-1催化剂在400 min内的甲烷转化率稍低, 分别约为70%和65%左右. 相比其他种类载体, 以分子筛为载体制备的Ni-Cu催化剂具有较好的活性和稳定性, 这是由于以分子筛为载体制备催化剂被H2还原后表面Ni0颗粒较大, 有利于甲烷分子与活性中心的结合. 分子筛的孔道结构可以促进产物碳原子的扩散, 有效避免积碳效应导致的催化剂快速失活.
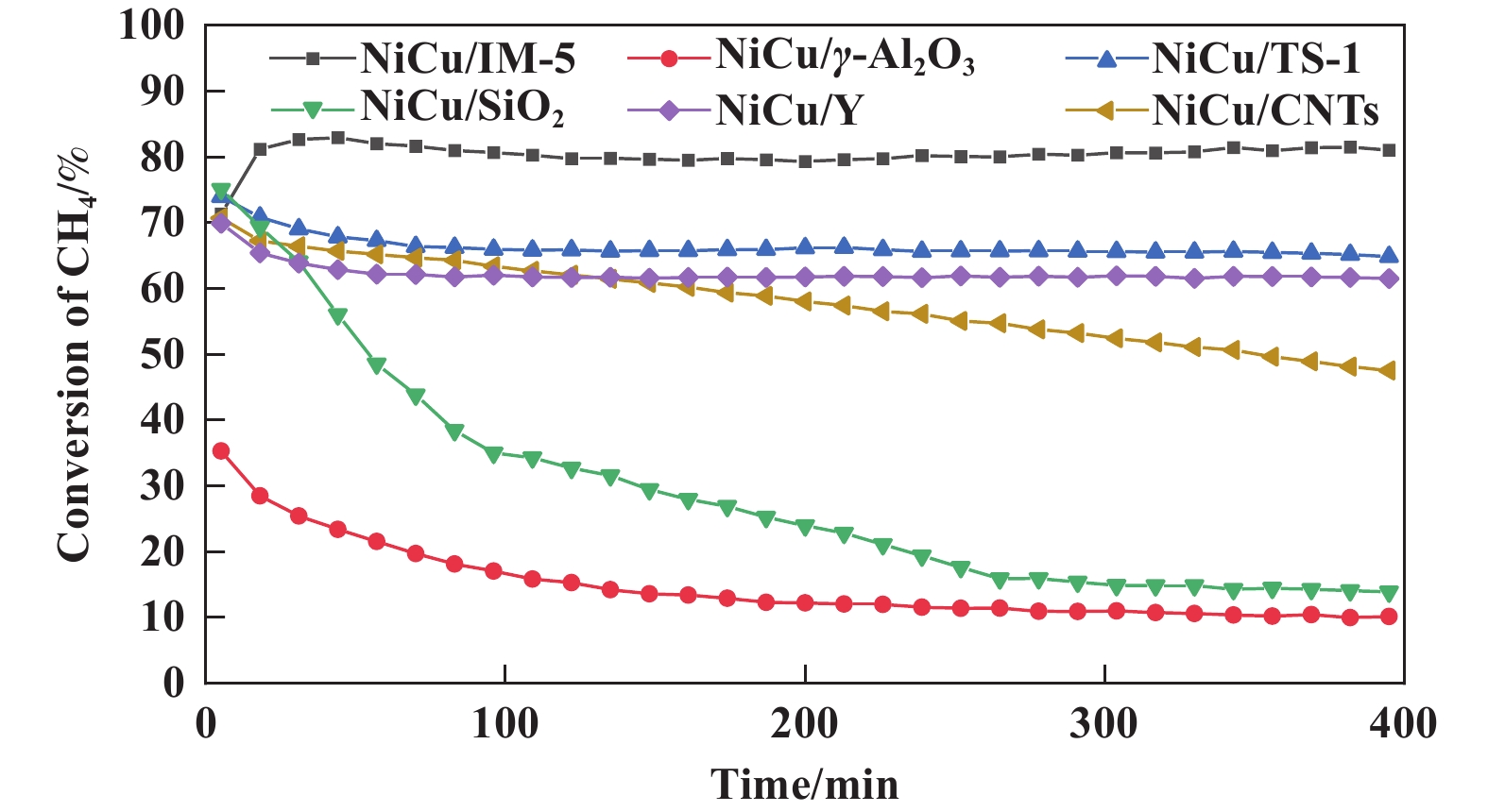
|
图 5 不同载体负载Ni-Cu催化剂的甲烷转化率随时间变化曲线 Fig.5 CH4 conversion rate of different catalysts with time on steam |
如图6所示,反应过程中反应管内压力随时间逐渐增加, 这种增加的阻力可归因于催化剂反应床层上的碳沉积, 反应管内升压速率可说明催化剂床层沉积碳的堆积程度. NiCu/IM-5、NiCu/Y和NiCu/TS-1催化剂的反应管内压力随时间的推移呈线性上升, 直到400 min时NiCu/IM-5催化剂的反应管内压力达到装置的最大允许压力(0.46 MPa). NiCu/IM-5催化剂反应管内的升压速率最高, 表明NiCu/Y和NiCu/TS-1催化剂生成的碳产物相比于NiCu/IM-5催化剂生成的碳产物更疏松. 400 min内NiCu/CNTs、NiCu/γ-Al2O3和NiCu/SiO2催化剂的反应管内未出现压力变化, 这主要归因于催化剂甲烷转化率较低, 生成沉积碳较少且堆积疏松.
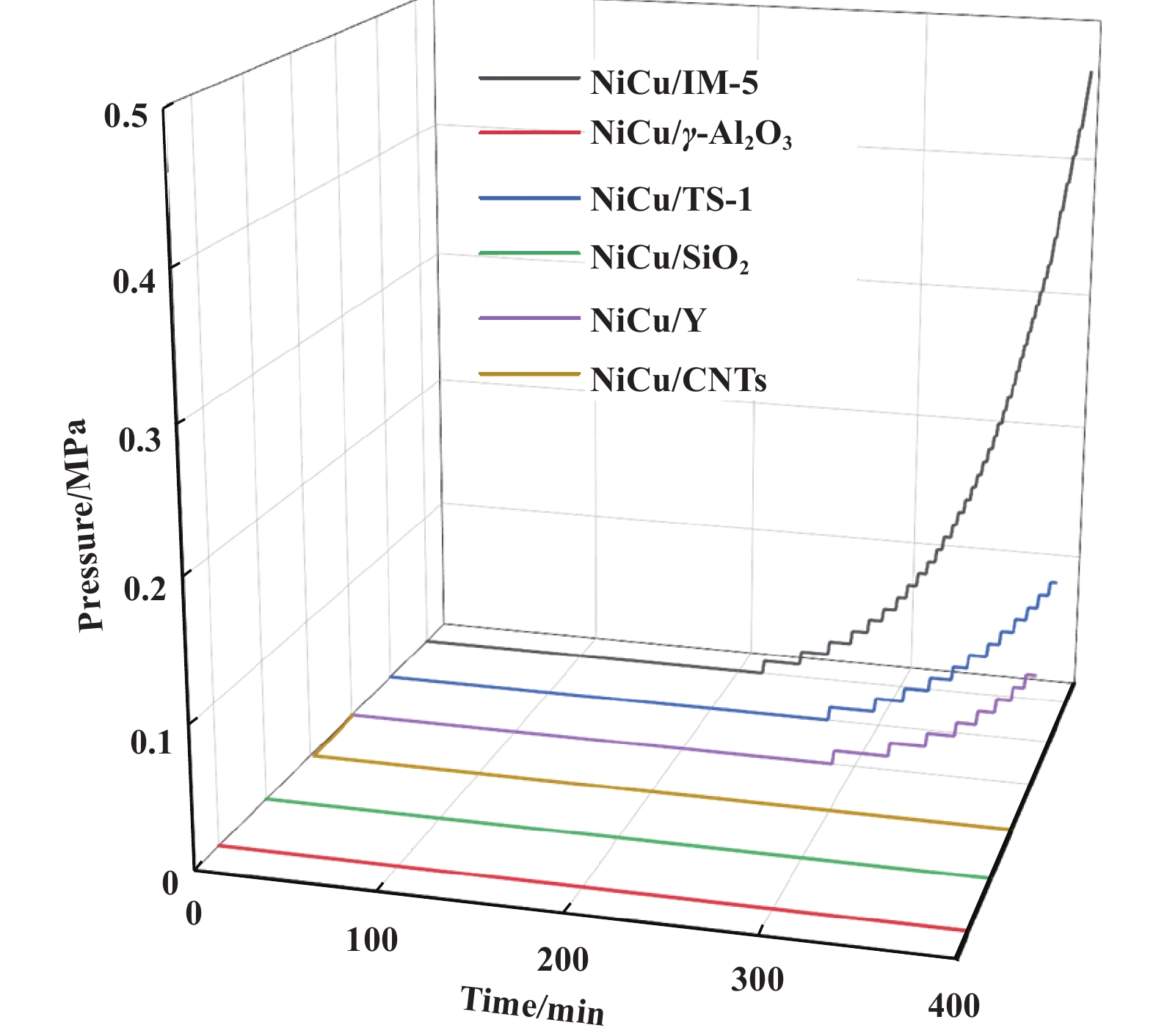
|
图 6 不同载体负载Ni-Cu催化剂的反应压力随时间变化曲线 Fig.6 Operation pressure of different catalysts with time on steam |
为进一步探讨催化剂参与甲烷裂解制氢反应的产碳量与催化剂反应活性和稳定性之间的关系, 我们将催化剂进行400 min的甲烷裂解制氢反应, 测定催化剂在本实验条件下, 相同反应时间内的产碳量. 如表1所示, 催化剂产碳量为: NiCu/IM-5 > NiCu/TS-1 > NiCu/Y > NiCu/CNTs > NiCu/SiO 2 > NiCu/ γ-Al2O3. 以分子筛为载体制备催化剂的产碳量均远高于以其他载体制备催化剂的产碳量. 其中, NiCu/IM-5催化剂的产碳量最高(达到1 446 gC/gcat), 是NiCu/SiO2催化剂的5.7倍, NiCu/γ-Al2O3催化剂的7.1倍.
采用热重分析法研究了不同载体负载Ni-Cu催化剂参与甲烷热分解反应后形成的碳材料的热稳定性、产率和纯度. 分析结果如图7所示, 样品质量的降低是因为样品中沉积碳在氧气氛围中的燃烧导致. 因此, 样品的失重百分比与催化剂的碳产率结果相一致, 碳产率较高的催化剂对应较高的样品失重百分比. NiCu/CNTs催化剂的载体即为碳纳米管, 其具有最高的失重百分比, 主要是因其生成的碳材料和载体的燃烧导致. 非晶碳在200~400 ℃范围内开始燃烧, 因此在200~400 ℃温度范围内的质量降低可归因于催化剂表面存在的非晶碳. 相反, 碳纳米管(有序碳)的氧化稳定性较好, 通常在约500 ℃左右开始氧化燃烧. 碳纳米管的平均直径影响其氧化稳定性, 不同的起始失重温度对应于不同的碳纳米管平均直径. 如图7所示, 所有的样品均表现出相似的单步氧化趋势, 单步氧化表明催化剂中均存在高纯度的碳纳米管材料. 不同样品的起始失重温度存在差异, 表明不同载体负载Ni-Cu催化剂表面生成碳纳米管直径存在差异, 这与SEM表征结果相一致.
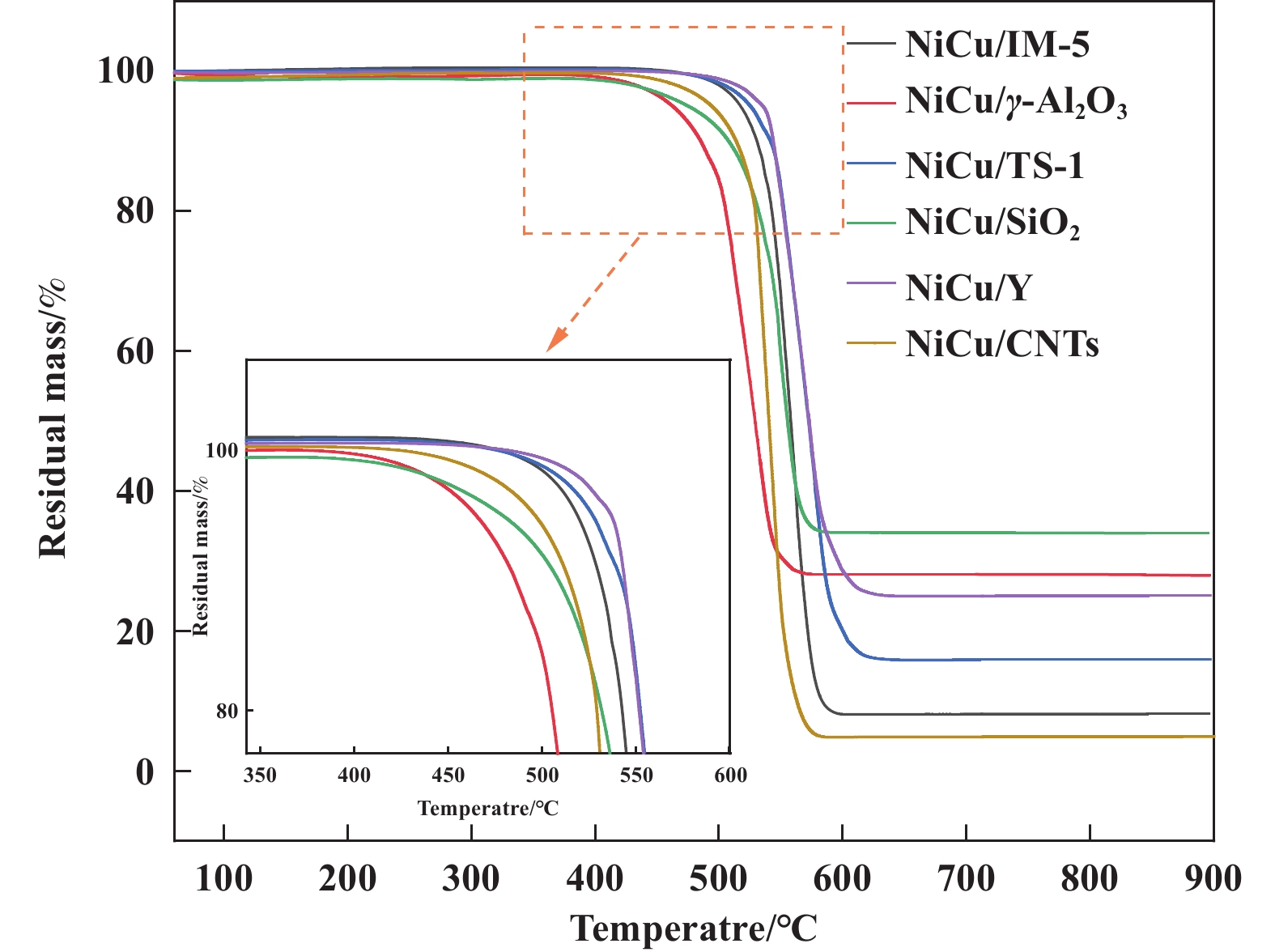
|
图 7 不同载体负载Ni-Cu催化剂反应后失重曲线 Fig.7 Thermal gravimetric analysis (TGA) profiles of spent catalysts |
以不同载体负载Ni-Cu催化剂进行甲烷热催化裂解反应后, 催化剂表面生成大量碳沉积产物. 产物形貌可采用SEM清晰地观察到(如图8所示), 不同催化剂表面生成的碳产物形貌差异较大. NiCu/γ-Al2O3、NiCu/SiO2和NiCu/TS-1催化剂表面生成的碳产物均呈现为曲折缠绕的碳纳米管, NiCu/γ-Al2O3和NiCu/SiO2催化剂生成的碳纳米管直径均一且细, 而NiCu/TS-1催化剂生成的碳纳米管表面粗糙且直径不均. NiCu/CNTs和NiCu/Y催化剂表面生成的碳产物呈现小颗粒块状堆积, NiCu/IM-5催化剂生成的碳产物呈现为内部实心且团聚的碳纳米纤维而非碳纳米管, 这主要归因于NiCu/IM-5催化剂表面Ni0颗粒较大, 碳纳米管在较大的Ni0颗粒表面逐渐生长成粗而堆积紧实的碳纳米纤维. 由上述分析发现, 载体会显著影响负载Ni-Cu催化剂参与甲烷热催化裂解反应生成副产物碳的形貌, 这可归因于催化剂表面不同的金属颗粒分布, 与XRD和H2-TPR结果相一致.
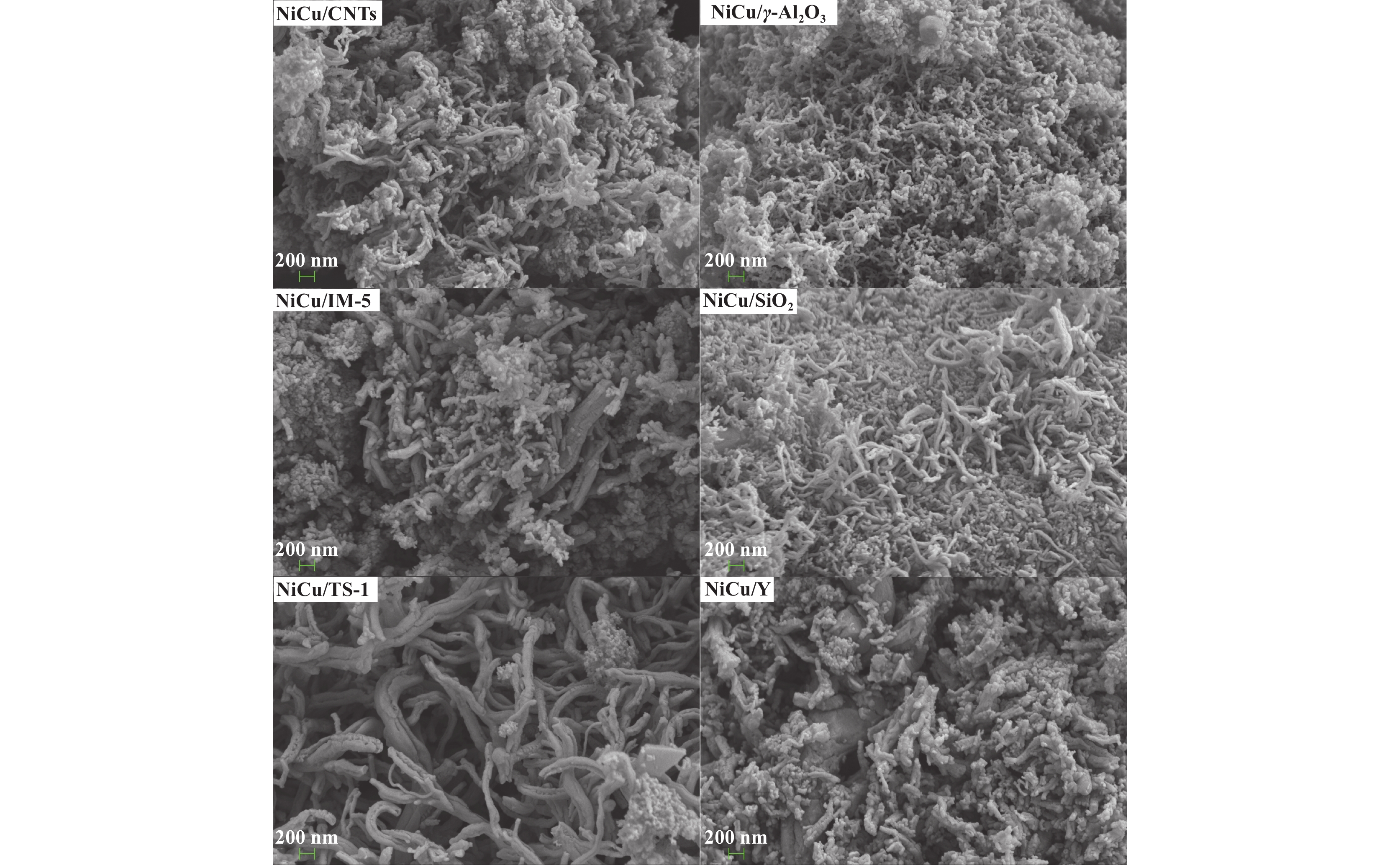
|
图 8 不同载体负载Ni-Cu催化剂反应后生成碳纳米管形貌 Fig.8 SEM images of different catalysts after reaction |
甲烷热催化裂解反应过程中, 催化剂表面活性金属随反应进行发生迁移和被沉积碳包裹, 这会影响催化剂的稳定性和表面碳纳米管生长机制. 因此, 采用TEM对催化剂反应后金属颗粒形貌和碳纳米管形貌进行表征. NiCu/SiO2、NiCu/TS-1和NiCu/IM-5催化剂生成碳纳米管形貌如图9, 由图可以清楚地观察到, 催化剂生成的碳纳米管弯曲缠绕. NiCu/SiO2和NiCu/TS-1催化剂生成的碳纳米管细长, 而NiCu/IM-5催化剂生成的碳纳米管短且粗, 这主要归因于催化剂表面不同的金属颗粒分布. 由图10(a)所示, 金属颗粒(图中黑色斑点)被沉积碳包裹, 使得反应活性中心丧失, 这是导致催化剂失活的主要原因. 图10(b)中可以清晰地观察到位于碳纳米管顶端的金属颗粒, 其可以在较长时间内保持反应活性. 从图10(c)可以观察到位于碳纳米管内部的金属颗粒, 这是由反应过程中“原子侵蚀”导致的, 这也是导致催化剂逐渐失活的原因之一. 上述3种不同的金属颗粒分布对应于催化剂表面碳纳米管的3种生长机制和失活机理, 所以接下来我们对催化剂表面碳纳米管生长机制和催化剂失活原因进行了详细探讨与分析.

|
图 9 Ni-Cu催化剂反应后生成碳纳米管形貌 Fig.9 TEM images of different catalysts after reaction |

|
图 10 Ni-Cu催化剂反应后生成的沉积碳金属包埋颗粒(a) 位于碳纳米管顶端的金属颗粒; (b) 和位于碳纳米管内的金属颗粒; (c) TEM形貌 Fig.10 TEM images of typical deactivated Ni nanoparticle (a) Ni nanoparticle located at the tip of nanotubes (b) and Ni nanoparticle entrapped in the nanotubes (c) |
众所周知, 在甲烷热催化裂解反应中, 甲烷吸附和C―H键的断裂均发生在催化剂金属活性相表面. 反应生成的部分C原子可能在金属粒子表面扩散并向金属-载体界面移动. 其他一些C原子可能溶解到金属粒子中形成“亚稳态溶液”, 在金属粒子-载体界面分解释放金属粒子和C原子, 碳原子通过沉淀、成核和结晶形成纳米管[44−45]. 如图8(a)所示, 当金属活性相颗粒与载体间相互作用力较强且金属颗粒较大时, 强相互作用使得金属粒子难以移动. 因此, 一些金属粒子牢固地锚定在载体表面, 碳管向固-气界面生长. 但固-气界面生长空间有限, 因此生成碳纳米管通常较曲折且短粗. 因界面效应导致催化剂表面生成的碳不能及时扩散, 当C原子生成速率远大于C原子生成碳纳米管的速率时, 会造成C原子在活性金属粒子表面大量堆积, 致使活性位点被沉积碳覆盖进而催化剂失活, 形成沉积碳金属包埋颗粒. 如图11(b)所示, 当金属与载体间相互作用力较弱时, 在金属-支撑界面中被释放出的C原子在界面处形成碳纳米管, 并迫使金属粒子离开载体表面, 碳纳米管顶端支撑活性金属粒子不断生长. 活性金属粒子暴露表面保持不变, 同时可避免界面效应导致的碳沉积, 进而可很好地保持催化剂反应活性, 并生成质量较好的碳纳米管. 如图11(c)所示, 甲烷热催化反应通常在较高的反应温度下进行, 载体表面金属粒子以“准液态”形式存在, 碳纳米管内部存在一个中空的结构, 碳纳米管内和“准液态”金属粒子表面存在压力差. 随着碳纳米管进一步增长, 压力差逐渐增加, “准液态”金属粒子在压力差作用下发生形变, 其与碳纳米管接触部分粒子变窄被拉入碳纳米管中. 当压力差远大于“准液态”金属粒子表面张力时, 发生形变的金属粒子被吸入碳纳米管内并被封装[46]. 因这种原子侵蚀导致催化剂表面金属粒子逐渐变小, 最终完全迁移进碳纳米管内, 使得催化剂失活. 图11(a)和(c)生长机理是催化剂失活的主要原因, 也是NiCu/γ-Al2O3 和 NiCu/SiO2催化剂在甲烷热催化反应过程中呈现迅速失活趋势的主要原因, 这主要是因其表面碳纳米管生长机制遵循基底生长机制和原子侵蚀机理所导致. 以分子筛为载体制备的催化剂NiCu/Y、NiCu/TS-1和NiCu/IM-5在甲烷热催化裂解反应过程中碳纳米管的优势生长机制为顶端生长机制, 因此可表现出较稳定的甲烷转化活性.
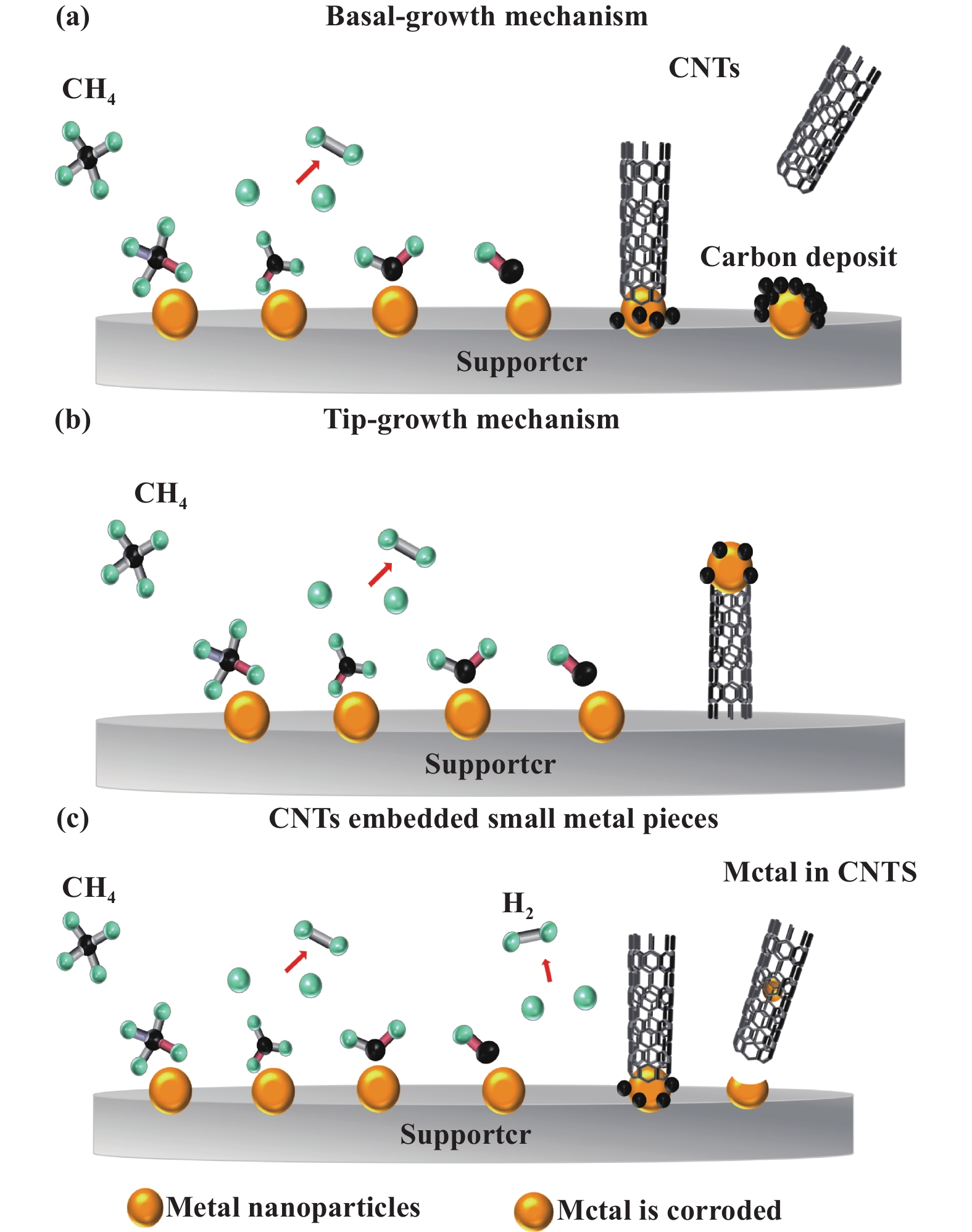
|
图 11 催化剂表面CNTs生长机理和催化剂失活示意图(a)基底生长机制; (b)顶端生长机制; (c)原子侵蚀机理 Fig.11 Different mechanism models of the formation of carbon nanotubes (a) basal-growth mechanism; (b) Tip-growth mechanism; (c) Atomic erosion mechanism |
我们以IM-5、TS-1、Y、γ-Al2O3、CNTs和介孔SiO2为载体, 负载金属Ni和铜为活性金属, 通过常温等体积浸渍法制备催化剂. 研究了不同载体对催化剂表面金属颗粒大小、H2还原性能、织构性质和甲烷裂解反应活性及稳定性和碳纳米管生长机理的影响. 实验结果和表征分析表明, 载体不同的孔型结构和比表面积导致金属颗粒在载体表面不同的分布, 不同大小的金属颗粒与载体间相互作用力不同, 导致焙烧和还原过程中不同的金属迁移趋势. 以IM-5、TS-1、Y、CNTs和介孔SiO2为载体制备催化剂, 表面金属颗粒经H2还原后, 表面Ni颗粒呈增大趋势, 这是因为氢气还原过程中金属颗粒团聚烧结导致. 而以γ-Al2O3为载体制备催化剂, 表面Ni颗粒经氢气还原后, 金属颗粒变小, 这与载体和金属间相互作用力较强有关. 较强的相互作用力使得部分Ni金属颗粒迁移进γ-Al2O3载体内部, 导致催化剂表面Ni颗粒变小. 由XRD曲线和Scherrer方程计算结果表明, 以不同载体负载Ni-Cu制备催化剂表面Ni0晶面和颗粒大小不同, 这会影响其进行甲烷热催化裂解性能以及碳产物的生长/失活机理. 通过选择适宜载体可以调节催化剂表面金属晶粒大小和金属与载体间相互作用力, 避免界面效应导致的催化剂失活, 进而延长催化剂稳定性和提高其反应活性. 以分子筛为载体制备催化剂的反应稳定性较好, 而以γ-Al2O3、CNTs和介孔SiO2为载体的催化剂稳定性较差, 催化剂极易失活. NiCu/IM-5的甲烷转化率高达80%, 而NiCu/γ-Al2O3的甲烷转化率仅为约20%, 且NiCu/IM-5在反应400 min内未见明显失活. 因此, 上述几种载体中IM-5为最适宜制备甲烷热催化裂解制氢催化剂的载体.
| [1] |
Song Y F, Zhang X M, Xie K, et al. High-temperature CO2 electrolysis in solid oxide electrolysis cells: Developments, challenges and prospects[J]. Adv Mater, 2019, 31(50): 1902033.
|
| [2] |
a. Hou Hui-xia(侯慧霞), Zhang Jing-yi(张婧怡), Cai Ping-long(蔡平龙), et al. Ultrasound-driven deposition of Au nanoparticles on CdS for efficient photocatalytic hydrogen evolution(超声驱动制备Au/CdS催化剂及其高效光催化产氢)[J]. J Mol Catal(China)(分子催化), 2022, 36(2): 129−136.b. Li Bo-yuan(李博远), He Feng-gui(何凤贵), Zhang Ming-hui(张明慧), et al. Modification of metal organic framework materials and their application in photo-catalytic hydrogen evolution(金属-有机骨架材料的改性方法及其光催化制氢应用)[J]. J Mol Catal(China)(分子催化), 2023, 37(1): 94−107.c. Hou Hui-xia(侯慧霞), Zhang Jing-yi(张靖怡), Cai Ping-long(蔡平龙), et al. Ultrasound-driven deposition of Au nanoparticles on CdS for efficient photocatalytic hydrogen evolution(超声驱动制备Au/CdS催化剂及其高效光催化产氢)[J]. J Mol Catal(China)(分子催化), 2022, 36(2): 129−136.
|
| [3] |
a. Yu Xiao-peng(余晓鹏), Zhang Fu-bao(张付宝). Ni-Ru/MgAl Catalysts derived from hydrotalcites for the dry reforming of methane(甲烷干重整反应用Ni-Ru/MgAl类水滑石催化剂的研究)[J]. J Mol Catal(China)(分子催化), 2015, 29(5): 448−457.b. Sun Nan-nan(孙楠楠), Zhao Zhi-chao(赵志超), Zhang Yu(张宇), et al. Investigation of the hydrogen evolution reaction on two-dimensional tetragonal TiC monolayer sheet(二维四角TiC单层片上的析氢反应研究)[J]. J Mol Catal(China)(分子催化), 2022, 36(1): 12−21.c. Qiao Jin-song(乔劲松), Han Miao-miao(韩苗苗). Preparation of porous binary transition metal nanosheets array electrode and its electrocatalytic hydrogen evolution(多孔二元过渡金属纳米片阵列电极制备及电催化析氢研究)[J]. J Mol Catal(China)(分子催化), 2021, 35(5): 449−455.d. Liu Hong-xia(刘洪霞), Lu Gong-xuan(吕功煊). Research progress for hydrogen evolution from formaldehyde(甲醛催化制氢的研究进展)[J]. J Mol Catal(China)(分子催化), 2020, 34(3): 210−226.
|
| [4] |
Metal-free carbon materials for CO2 electrochemical reduction
[J]. Adv Mater, 2017, 29(41): 1701784.
DOI:10.1002/adma.201701784 |
| [5] |
Xu Kai(许 凯), Liu Lu(刘 璐), Jin Jie-yin(荆洁颖), et al. Preparation and hydrogen production performance of CaO-Ca3Al2O6@Ni-SiO2 composite catalyst (CaO-Ca3Al2O6@Ni-SiO2复合催化剂制备及制氢性能) [J]. J Fuel Chem Technol(燃料化学学报), 2022, 12(50): 1−10.
|
| [6] |
Determining air quality and greenhouse gas impacts of hydrogen infrastructure and fuel cell vehicles[J]. Environ Sci Technol, 2009, 43(23): 9022–9029.
DOI:10.1021/es901515y |
| [7] |
Hydrogen production by thermocatalytic decomposition of methane using a fixed bed activated carbon in a pilot scale unit: Apparent kinetic, deactivation and diffusional limitation studies[J]. Int J Hydrogen Energy, 2010, 35(22): 12268–12276.
DOI:10.1016/j.ijhydene.2010.08.036 |
| [8] |
Chen Ying-jie(陈英杰). Technical progress and development trend of hydrogen production from natural gas(天然气制氢技术进展及发展趋势)[J]. Coal Chem Ind(煤炭与化工), 2020, 43(11): 130−133.
|
| [9] |
Decomposition of methane to carbon and hydrogen: A catalytic perspective[J]. Energy Technol-ger, 2019, 7(6): 1800593.
DOI:10.1002/ente.201800593 |
| [10] |
Political, economic and environmental impacts of biomass-based hydrogen[J]. Int J Hydrogen Energy, 2009, 34(9): 3589–3603.
DOI:10.1016/j.ijhydene.2009.02.067 |
| [11] |
Influence of reactor material and activated carbon on the thermocatalytic decomposition of methane for hydrogen production[J]. Appl Catal, A:General, 2010, 388(1): 232–239.
|
| [12] |
Economic analysis of hydrogen production by methane thermal decomposition: Comparison to competing technologies[J]. Energy Convers Manage, 2018, 159: 264–273.
DOI:10.1016/j.enconman.2017.12.063 |
| [13] |
Liu pan(刘 攀), Lu Ji-Chang(陆继长), Chen ding-kai(陈定凯), et al. Research of hydrogen production by thermocatalytic decomposition of methane on carbonaceous and metal catalysts(碳质与金属催化剂热催化裂解甲烷产氢研究进展)[J]. J Mol Catal(China)(分子催化). 2016, 30(5): 480−495.
|
| [14] |
Hydrogen storage methods: Review and current status[J]. Renew Sust Energ rev, 2022, 167: 112743.
DOI:10.1016/j.rser.2022.112743 |
| [15] |
Recent advances in metal sulfides: From controlled fabrication to electrocatalytic, photocatalytic and photoelectrochemical water splitting and beyond[J]. Chem Soc Rev, 2019, 48(15): 4178–4280.
DOI:10.1039/C8CS00664D |
| [16] |
A review on the coal gasification wastewater treatment technologies: Past, present and future outlook[J]. J Clean Prod, 2016, 126: 38–55.
DOI:10.1016/j.jclepro.2016.02.147 |
| [17] |
A comparative overview of hydrogen production processes[J]. Renew Sust Energ Rev, 2017, 67: 597–611.
DOI:10.1016/j.rser.2016.09.044 |
| [18] |
Dry reforming of methane catalysed by molten metal alloys nature catalysis[J]. Nat Catal, 2020, 3(1): 83–89.
DOI:10.1038/s41929-019-0416-2 |
| [19] |
Hydrogen production by catalytic methane decomposition: Carbon materials as catalysts or catalyst supports[J]. Int J Hydrogen Energy, 2017, 42(31): 19755–19775.
DOI:10.1016/j.ijhydene.2017.06.197 |
| [20] |
Methane decomposition to pure hydrogen and carbon nano materials: State-of-the-art and future perspectives[J]. Int J Hydrogen Energy, 2020, 45(32): 15721–15743.
DOI:10.1016/j.ijhydene.2020.04.100 |
| [21] |
Methane decomposition to produce COx-free hydrogen and nano-carbon over metal catalysts: A review
[J]. Int J Hydrogen Energy, 2020, 45(15): 7981–8001.
DOI:10.1016/j.ijhydene.2020.01.052 |
| [22] |
Chemistry with methane: Concepts rather than recipes[J]. Angew Chem Int Ed, 2011, 50(43): 10096–10115.
DOI:10.1002/anie.201006424 |
| [23] |
Development of methane decarbonisation based on liquid metal technology for CO2-free production of hydrogen
[J]. Int J Hydrogen Energy, 2016, 41(19): 8159–8167.
DOI:10.1016/j.ijhydene.2015.11.164 |
| [24] |
Integrating catalysis of methane decomposition and electrocatalytic hydrogen evolution with Ni/CeO2 for improved hydrogen production efficiency
[J]. ChemSusChem, 2019, 12(5): 1000–1010.
DOI:10.1002/cssc.201802618 |
| [25] |
A novel catalyst system for methane decomposition[J]. Int J Hydrogen Energy, 2018, 42(14): 4372–4382.
|
| [26] |
Experimental investigation and thermo-chemical modeling of methane pyrolysis in a liquid metal bubble column reactor with a packed bed[J]. Int J Hydrogen Energy, 2015, 40(41): 14134–14146.
DOI:10.1016/j.ijhydene.2015.08.102 |
| [27] |
NiAl2O4 as a beneficial precursor for Ni/Al2O3 catalysts for the dry reforming of methane
[J]. J CO2 Util
, 2022, 63: 102112.
DOI:10.1016/j.jcou.2022.102112 |
| [28] |
The catalysis of nickel on the thermal decomposition of methane[J]. Bull Chem Soc Jpn, 1927, 2(11): 289–294.
DOI:10.1246/bcsj.2.289 |
| [29] |
Statistical models for ensemble control by alloying and poisoning of catalysts: I. Mathematical assumptions and derivations[J]. J Catal, 1987, 104(2): 454–465.
DOI:10.1016/0021-9517(87)90377-0 |
| [30] |
Recent developments in methane decomposition over heterogeneous catalysts: an overview[J]. Mater Renew Sustain., 2020, 9(2): 8.
DOI:10.1007/s40243-020-00167-5 |
| [31] |
Grafting Ni particles onto SBA-15, and their enhanced performance for CO2 methanation
[J]. RSC Adv, 2015, 5(70): 56444–56454.
DOI:10.1039/C5RA07461D |
| [32] |
Catalytic methane decomposition over ZrO2 supported iron catalysts: Effect of WO3 and La2O3 addition on catalytic activity and stability
[J]. Renew Energ, 2020, 155: 969–978.
DOI:10.1016/j.renene.2020.04.038 |
| [33] |
Effect of crystalline structure and pore geometry of silica based supported materials on the catalytic behavior of metallic nickel particles during methane decomposition to COx-free hydrogen and carbon nanomaterials
[J]. Int J Hydrogen Energy, 2016, 41(38): 16890–16902.
DOI:10.1016/j.ijhydene.2016.07.081 |
| [34] |
Characterization of NiTiO2 catalysts by TEM, X-ray diffraction and chemisorption techniquess
[J]. J Catal, 1981, 68(2): 270–285.
DOI:10.1016/0021-9517(81)90097-X |
| [35] |
Methane decomposition over Co thin layer supported catalysts to produce hydrogen for fuel cell[J]. Int J Hydrogen Energy, 2010, 35(20): 11568–11575.
DOI:10.1016/j.ijhydene.2010.05.012 |
| [36] |
Natural sand as a non-conventional catalyst for hydrogen production by methane thermo-catalytic decomposition[J]. Int J Hydrogen Energy, 2019, 44(23): 11625–11633.
DOI:10.1016/j.ijhydene.2019.03.163 |
| [37] |
Pore geometry influence on the deactivation behavior of Ni-based catalysts for simultaneous production of hydrogen and nanocarbon[J]. Catal Today, 2009, 148(1): 134–139.
|
| [38] |
Determination of thermodynamic parameters from Langmuir isotherm constant-revisited[J]. J Mol Liq, 2017, 255: 137–146.
|
| [39] |
Zhang Yun(张 云), Zhao Shun(赵 舜), Zhang Li-jun(张丽君), et al. Production of hydrogen and carbon nanofibers by methane decomposition over the Ni/SiO2 catalyst(Ni/SiO2催化甲烷裂解制氢和纤维炭)[J]. J Fuel Chem Technol(燃料化学学报), 2021, 49(4): 529−536.
|
| [40] |
Unraveling the role of Ni13 catalyst supported on ZrO2 for CH4 dehydrogenation: The d-band electron reservoir
[J]. J Fuel Chem Technol, 2022, 50(5): 601–609.
DOI:10.1016/S1872-5813(21)60184-6 |
| [41] |
Ni/Ce-MCM-41 mesostructured catalysts for simultaneous production of hydrogen and nanocarbon via methane decomposition[J]. Int J Hydrogen Energy, 2010, 35(8): 3509–3521.
DOI:10.1016/j.ijhydene.2010.01.068 |
| [42] |
A Study of anomalous temperature-programmed reduction profiles of Cu2O, CuO and CuO-ZnO catalysts
[J]. J Catal, 1994, 148(2): 709–721.
DOI:10.1006/jcat.1994.1257 |
| [43] |
Ni-Cu-Zn/MCM-22 catalysts for simultaneous production of hydrogen and multiwall carbon nanotubes via thermo-catalytic decomposition of methane[J]. Int J Hydrogen Energy, 2011, 50(21): 13352–13360.
|
| [44] |
Improvement of activity and stability of Ni-Mg-Al catalysts by Cu addition during hydrogen production by catalytic decomposition of methane[J]. Catal Today, 2006, 116(3): 264–270.
DOI:10.1016/j.cattod.2006.05.085 |
| [45] |
Li Feng-yi(李凤仪), Peng Nian-cai(彭年才), Wang Min-wei(王敏炜), et al. Effects of preparation conditions of catalysts on the carbon nanotubes(催化剂制备条件对碳纳米管的影响)[J]. J Mol Catal(China)(分子催化). 2003, 17(1): 65−69.
|
| [46] |
Formation of bamboo-shape carbon nanotubes by controlled rapid decomposition of picric acid[J]. Carbon, 2004, 42(15): 3199–3207.
DOI:10.1016/j.carbon.2004.08.003 |
 2023, Vol. 37
2023, Vol. 37


