L-2-氨基己二酸(L-2-aminoadipic acid, L-2-AAA)是β-内酰胺抗生素异青霉素N的前体, 也是化学合成新的抗生素和生理活性肽的手性中间体. L-2-氨基己二酸的生物制备方法主要包括: 1)发酵法. Mochizuki等[1] 以5% DL-哌啶-2-羧酸为发酵前体, Alcaligenes sp. 309B1 为发酵菌株, L-哌啶-2-羧酸完全同化, L-2-氨基己二酸累积量达到2.8%. Fujii等[2−3]从黄杆菌中得到了L-赖氨酸 6-氨基转移酶和∆-1-哌啶啉-6-羧酸脱氢酶基因并构建了一个重组菌, 用于以L-赖氨酸为发酵前体发酵产生L-2-氨基己二酸. 发酵过程中需要添加L-谷氨酸、氯化镁和氯化钙等无机盐. 赵妍[4]对大肠杆菌进行代谢工程改造, 发酵产生的L-2-氨基己二酸产量达到18.3 mmol/L; 2)不对称生物合成法. Matos等[5]构建了一个谷氨酸脱氢酶/醇脱氢酶偶合体系和水-有机溶剂两相体系, 催化α-酮己二酸还原胺化合成L-2-氨基己二酸, 反应中需要的辅酶NADH以顺-1,2-环己基二甲醇为辅底物实现原位再生. 该方法中使用的底物α-酮己二酸成本较高; 3)手性源生物合成法. Isobe等[6−7] 采用胺氧化酶和黑曲霉菌丝体催化Nα-Z-L-赖氨酸合成Nα-Z-L-2-氨基己二酸半醛和Nα-Z-L-2-氨基己二酸, 但产率不高. 该小组[8]进一步利用红球菌AIU Z-35-1细胞催化Nα-Z-L-赖氨酸合成Nα-Z-L-2-氨基己二酸. 经过6 d反应后, Nα-Z-L-2-氨基己二酸浓度达到40 mmol/L, 产率为80%. 同一微生物细胞也用于催化Nα-Z-L-赖氨酸合成Nα-Z-L-2-氨基己二酸半醛, 产率为95%. Nα-Z-L-2-氨基己二酸半醛可经化学氧化为Nα-Z-L-2-氨基己二酸[9]. 这些方法中尽管不需要辅酶, 但底物采用了α-氨基保护的L-赖氨酸.
L-赖氨酸 6-脱氢酶(L-LysDH)在NAD+存在下催化L-赖氨酸氧化脱氨为L-2-氨基己二酸半醛(L-AASA), L-2-氨基己二酸半醛自动环合为∆-1-哌啶-6-羧酸(P6C)[10]. ∆-1-哌啶-6-羧酸脱氢酶(P6CDH)催化∆-1-哌啶-6-羧酸脱氢为L-2-氨基己二酸[11]. 利用L-赖氨酸 6-脱氢酶/∆-1-哌啶啉-6-羧酸脱氢酶体系可将L-赖氨酸转化为L-2-氨基己二酸.
我们实验室从土壤中分离的一株解木糖赖氨酸芽孢杆菌(Lysinibacillus xylanilyticus)XX-2, 含有多样性的L-氨基酸脱氢酶, 已用于从L-氨基酸制备α-酮酸[12] 和拆分DL-氨基酸制备D-氨基酸[13]. 最近, 通过全基因组测序和基因注释发现该菌株中存在L-赖氨酸 6-脱氢酶和∆-1-哌啶啉-6-羧酸脱氢酶基因. 我们首先以解木糖赖氨酸芽孢杆菌XX-2为出发菌株, 以L-赖氨酸单盐酸盐为前体, 采用发酵法产生L-2-氨基己二酸. 在解木糖赖氨酸芽孢杆菌XX-2发酵过程中, 以L-赖氨酸单盐酸盐诱导产生胞内L-赖氨酸 6-脱氢酶和∆-1-哌啶啉-6-羧酸脱氢酶, 利用全细胞催化L-赖氨酸单盐酸盐高效制备L-2-氨基己二酸.
1 实验部分 1.1 实验材料解木糖赖氨酸芽孢杆菌(Lysinibacillus xylanilyticus)XX-2系本实验室从土壤中筛选, 保藏于中国典型培养物保藏中心, 保藏号为CCTCC No: M2015520. L-赖氨酸单盐酸盐(>98%)、L-2-氨基己二酸(>98%)、2,3,4,6-四-O-乙酰基-β-D-吡喃葡萄糖(GITC, >99%)购自梯希爱(上海)化成工业发展有限公司, 其余试剂均为市售分析纯或化学纯.
1.2 实验方法 1.2.1 培养基斜面培养基(g/L): 牛肉膏3, 酵母膏5, 氯化钠5, 琼脂15, pH 6.5; 种子培养基(g/L): 与斜面培养基相同, 无琼脂; 发酵培养基(g/L): L-赖氨酸单盐酸盐20, 其余成分与种子培养基相同; 产酶培养基(g/L): L-赖氨酸单盐酸盐(诱导剂)4, 其余成分与种子培养基相同.
1.2.2 种子培养取斜面培养基上保存的解木糖赖氨酸芽孢杆菌XX-2菌种接种于5 mL种子培养基中, 30 ℃、180 r/min下恒温摇床振荡培养48 h, 制得种子液.
1.2.3 发酵产生L-2-氨基己二酸按10%接种量将种子液接种于200 mL发酵培养基中, 30 ℃, 180 r/min下恒温摇床振荡培养192 h. 每间隔1 d取发酵液, 采用分光光度法测定OD600, 柱前手性衍生-HPLC测定L-赖氨酸和L-2-氨基己二酸浓度.
1.2.4 细胞培养和收获按10%接种量将种子液接种于200 mL产酶培养基中, 30 ℃、180 r/min下恒温摇床振荡培养48 h. 发酵液4 ℃、8 000 r/min下离心15 min, 菌体用100 mmol/L磷酸盐缓冲液(KPB, pH=7.0)洗涤两次, 重新悬浮在相同缓冲液中备用.
1.2.5 生物催化反应条件优化细胞浓度优化. 20 mL 100 mmol/L磷酸盐缓冲液(pH 7.0)中含0~80 g干重细胞/L, 50 mmol/L L-赖氨酸单盐酸盐, 30 ℃、180 r/min下反应48 h.
底物浓度优化. 20 mL 100 mmol/L磷酸盐缓冲液(pH=7.0)中含45 g干重细胞/L, 50~250 mmol/L L-赖氨酸单盐酸盐, 30 ℃、180 r/min下反应48 h.
pH优化. 20 mL 100 mmol/L磷酸盐缓冲液(pH:6.0~10.0)中含45 g干重细胞/L, 50 mmol/L L-赖氨酸单盐酸盐, 30 ℃、180 r/min下反应48 h.
温度优化. 20 mL 100 mmol/L磷酸盐缓冲液(pH=7.0)中含45 g干重细胞/L, 50 mmol/L L-赖氨酸单盐酸盐, 20~40 ℃、180 r/min下反应48 h.
1.2.6 L-2-氨基己二酸制备和结构确认200 mL 100 mol/L磷酸盐缓冲液(pH=7.0)中加入3.6 g L-赖氨酸单盐酸盐, 9.0 g(干重)湿细胞, 30 ℃、180 r/min下反应192 h. 反应液在4 ℃、8 000 r/min下离心15 min. 上清液用微孔膜过滤去除蛋白质, 用盐酸调pH至L-2-氨基己二酸等电点, 4 ℃下冷却过夜, 过滤, 冷水洗涤, 烘干. 制备的L-2-氨基己二酸溶解在6 mol/L盐酸中形成盐酸盐. 通过采用NMR测定L-2-氨基己二酸盐酸盐的结构确认产生的L-2-氨基己二酸结构.
1.2.7 L-赖氨酸转化中间产物鉴定L-赖氨酸转化中间产物∆-1-哌啶啉-6-羧酸采用化学法鉴定[14].
2,4-二硝基苯肼显色法. 反应液离心后的1 mL上清液与1 mL 1 mol/L 2,4-二硝基苯肼混合, 37 ℃下水浴加热20 min, 冷却至室温. 加入5 mL 1.5 mol/L NaOH溶液混匀, 5 ℃下静置2 d, 观察颜色变化.
TLC法. 反应液离心后的上清液在硅胶板上用正丁醇-醋酸-水(3∶1∶1, v∶v)展开, 茚三酮溶液显色, L-赖氨酸单盐酸盐、L-2-氨基己二酸溶液作对照.
1.2.8 分析方法发酵液和细胞悬浮液中的生物质浓度采用分光光度法在600 nm下测量. 1个OD600相当于0.373 mg干重细胞(DWC)/mL.
发酵和生物催化过程中L-赖氨酸、L-2-氨基己二酸浓度采用柱前手性衍生-HPLC分离和测定. 取1 mL发酵液或转化液, 12 000 r/min离心1 min弃去细胞. 取100 μL上清液, 加入 150 μL H2O, 250 μL三乙胺乙腈溶液(39.5 mmol/L)和500 μL 2,3,4,6-四-O-乙酰基-β-D-吡喃葡萄糖异硫氰酸酯(GITC)乙腈溶液(16.9 mmol/L), 30 ℃下衍生30 min, 离心. 上清液采用HPLC法在Alltech高效液相色谱仪上测定. 色谱柱: Sepax MAH-C18(250×4.6 mm, 5 μm), 流动相: 0.1%三氟乙酸/甲醇(40∶60, v∶v), 流速: 1 mL/min, 检测波长: 254 nm, 柱温: 25 ℃. L-赖氨酸的GITC衍生物和L-氨基己二酸的GITC衍生物的保留时间分别为7.9、24.8 min.
2 结果与讨论 2.1 发酵产生L-2-氨基己二酸熊文娟[13]对解木糖赖氨酸芽孢杆菌XX-2的培养基成分和培养条件进行了优化. 最优的培养基组成(g/L): 牛肉膏 3, 酵母膏 5, 氯化钠 5. 最优培养条件为: pH=6.5, 30 ℃, 48 h. 我们在此培养条件下, 以牛肉膏为碳源, 酵母膏为氮源, 110 mmol/L L-赖氨酸单盐酸盐为前体, 开展了解木糖赖氨酸芽孢杆菌XX-2发酵产生L-2-氨基己二酸的研究(图1). 结果表明, 发酵时间为24 h时, L-赖氨酸单盐酸盐消耗完全, 细胞生物量达到最大, 在发酵液中未观察到L-2-氨基己二酸产生, 但观察到发酵液中有中间产物累积. 此后随着发酵时间延长, 细胞生物量减小, 144 h时OD600为1.5. 细胞停止生长后, L-2-氨基己二酸的产量随保温时间延长逐渐增大, 144 h时达到最大, 累积浓度达到10.4 mmol/L, 产率9.5%. 此后随着发酵时间的延长, 细胞继续裂解, 但L-2-氨基己二酸产量不再增加. 一个合理的解释是发酵过程中, 发酵前体L-赖氨酸单盐酸盐转化为中间体∆-1-哌啶啉-6-羧酸并诱导产生∆-1-哌啶啉-6-羧酸脱氢酶. 发酵完成后, ∆-1-哌啶啉-6-羧酸在∆-1-哌啶啉-6-羧酸脱氢酶催化下转化为L-2-氨基己二酸.

|
图 1 发酵过程中细胞生长和L-2-氨基己二酸产生的时间进程 Fig.1 Time course of cell growth and production of L-2-aminoadipic acid in fermentation Fermentation broth (200 mL) contained 3 g/L beef extract, 5 g/L yeast extract, 5 g/L NaCl, 20 g/L L-lysine monohydrochloride. pH 6.5, 30 ℃, 180 r/min |
采用单因素法, 研究了以解木糖赖氨酸芽孢杆菌XX-2细胞为生物催化剂, L-赖氨酸单盐酸盐为底物, 细胞浓度、底物浓度、pH和温度等生物催化条件对L-2-氨基己二酸产生的影响.
考察了细胞浓度和L-赖氨酸单盐酸盐浓度对L-2-氨基己二酸产生的影响. L-2-氨基己二酸产率随细胞浓度的增加而增大, 当细胞浓度为45 g(干重)/L时达到最大. 此后, 因为质量扩散阻力, L-2-氨基己二酸产率随细胞浓度增大而减小(图2(a)). 因此, 最优的细胞浓度为45 g(干重)/L. L-2-氨基己二酸产率随L-赖氨酸单盐酸盐浓度的增加而增大, 当L-赖氨酸单盐酸盐浓度为100 mmol/L时达到最大. 此后, 因为底物对酶的抑制作用, L-2-氨基己二酸产率随底物浓度增大而急剧减小(图2(b)). 因此, L-赖氨酸单盐酸盐的最优浓度为100 mmol/L.
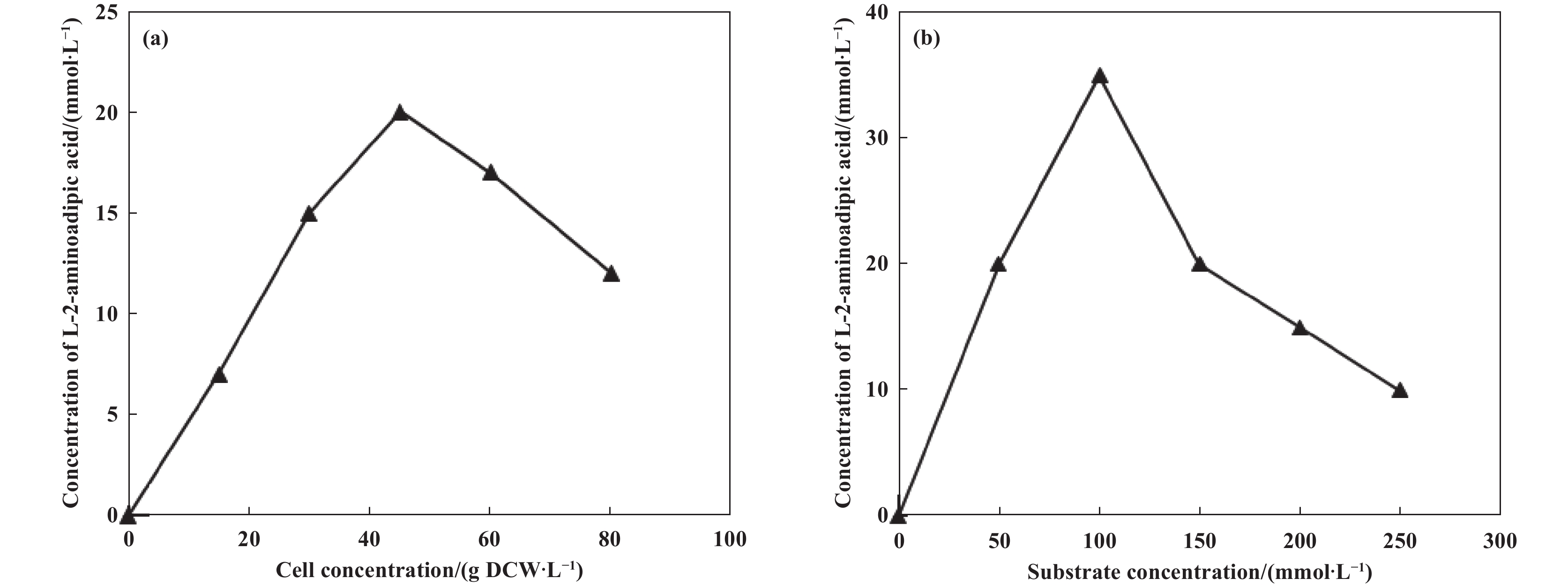
|
图 2 细胞浓度(a)和底物浓度(b)对L-2-氨基己二酸产生的影响 Fig.2 Effect of cell concentration (a) and substrate concentration (b) on production of L-2-aminoadipic acid Reaction mixture(20 mL) contained 100 mmol/L phosphate buffer(pH =7.0), L-lysine monohydrochloride and cells. 30 ℃, 180 r/min, 48 h (a): 50 mmol/L L-lysine monohydrochloride, 0~80 g DWC/L; (b): 45 g DWC/L, 50~250 mmol/L L-lysine monohydrochloride |
考察了pH值大小以及温度对L-2-氨基己二酸产生的影响. L-2-氨基己二酸产率随pH值增大而增大, 当pH值为7.0时达到最大, 此后随pH值增大而减小(图3(a)). 因此, 最适pH值为7.0. L-2-氨基己二酸产率随温度升高而增大, 30 ℃时达到最大, 此后随着温度的升高导致酶失活而减小(图3(b)). 因此, 最适温度为30 ℃.
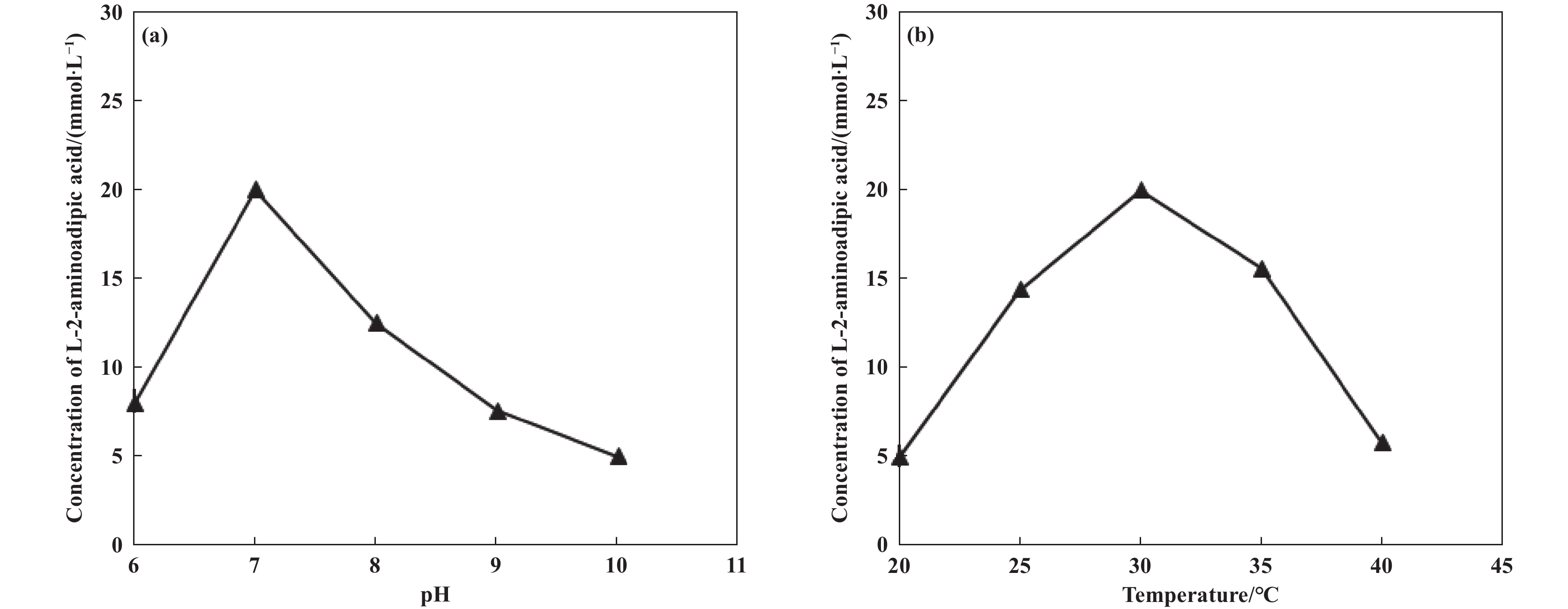
|
图 3 pH (a)和温度(b)对L-2-氨基己二酸产生的影响 Fig.3 Effect of pH (a) and temperature (b) on production of L-2-aminoadipic acid Reaction mixture(20 mL) contained 100 mmol/L phosphate buffer, 50 mmol/L L-lysine monohydrochloride and 45 g DCW/L. 180 r/min, 48 h (a): pH:6~10, 30 ℃; (b): 20~40 ℃, pH=7.0 |
在放大反应中, 考察了反应时间对L-2-氨基己二酸产生的影响(图4). 在最优生物催化条件下(细胞浓度45 g(干重)/L, L-赖氨酸单盐酸盐浓度100 mmol/L, pH=7.0, 温度为30 ℃), 100 mmol/L L-赖氨酸单盐酸盐在pH=7.0、30 ℃下反应192 h, 反应达到平衡转化点, L-2-氨基己二酸浓度达到90 mmol/L, 产率为90%. 随着反应时间的进一步增加, L-2-氨基己二酸浓度不再增加.
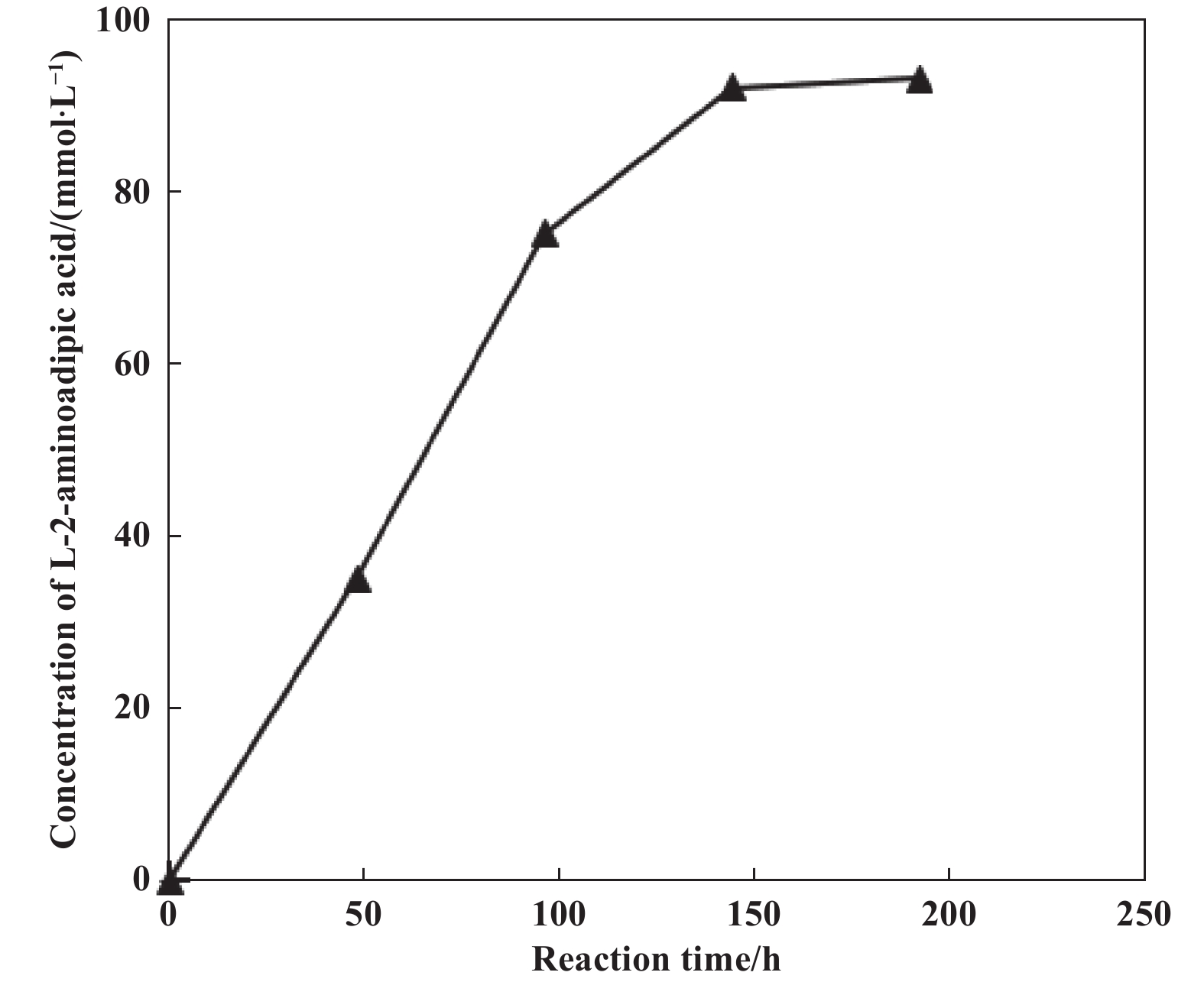
|
图 4 L-2-氨基己二酸产生的时间进程 Fig.4 Time course of L-2-aminoadipic acid production Reaction mixture(200 mL) contained 100 mmol/L phosphate buffer(pH=7.0), 100 mmol/L L-lysine monohydrochloride and 45 g DCW/L, 30 ℃, 180 r/min |
以解木糖赖氨酸芽孢杆菌XX-2细胞为生物催化剂, L-赖氨酸单盐酸盐为底物, 制备的L-2-氨基己二酸, 采用柱前手性衍生-HPLC分离. L-氨基己二酸的GITC衍生物的保留时间与对照品的GITC衍生物一致(图 5).
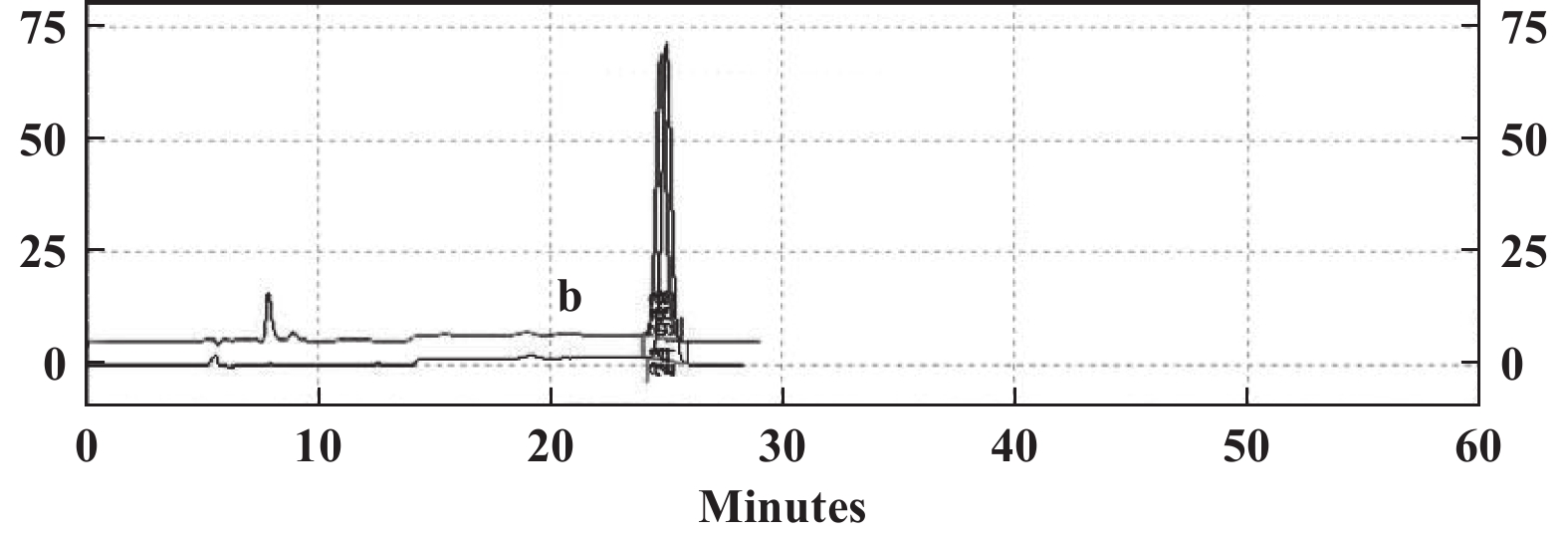
|
图 5 转化产物(a)和L-2-氨基己二酸(b)的GITC衍生物HPLC图谱 Fig.5 HPLC profile of GITC-derivatives of both product (a) and authentic L-2-aminoadipic acid (b) |
L-2-氨基己二酸的水溶性很小, 其盐酸盐的水溶性较好. 通过对产物盐酸盐的1HNMR测定, 进一步证实了制备的产物为L-2-氨基己二酸. 产物盐酸盐的1HNMR图谱见图6. 1HNMR(400 MHz, D2O): δ7.99(s, -NH3+), 4.79(m, 1H, H-2), 3.83(t, 2H, H-5), 2.17 (q, 2H, H-3); 1.71(m, 2H, H-4).

|
图 6 源于L-赖氨酸单盐酸盐转化的L-2-氨基己二酸盐酸盐的1HNMR Fig.6 1HNMR of L-2-aminoadipic acid hydrochloride from conversion of L-lysine monohydrochloride |
L-赖氨酸单盐酸盐转化中间产物∆-1-哌啶啉-6-羧酸与L-2-氨基己二酸半醛处于平衡中, 很难分离和纯化, 且无商用对照品. 为此, 我们按照文献提供的方法, 采用2,4-二硝基苯肼(DNP)法和TLC法, 对解木糖赖氨酸芽孢杆菌XX-2细胞催化L-赖氨酸单盐酸盐24 h反应后反应液中的中间产物进行了鉴定. 采用2,4-二硝基苯肼法检测时, 反应液未立即显色, 在5 ℃下长时间放置后, 呈现红棕色, 证实反应液中有含醛基的组分存在, 但含量较低. 进一步采用TLC检测, 茚三酮显色, 加热, 在L-赖氨酸单盐酸盐和L-2-氨基己二酸之间呈现黄色斑点. ∆-1-哌啶啉-6-羧酸用茚三酮显色, 加热脱羧形成的产物显示黄色斑点, 与其它氨基酸用茚三酮显色得到紫红色斑点不同. 因此, 比移值介于L-赖氨酸单盐酸盐和L-2-氨基己二酸之间的黄色斑点即为推断的中间体∆-1-哌啶啉-6-羧酸(图7)[14].
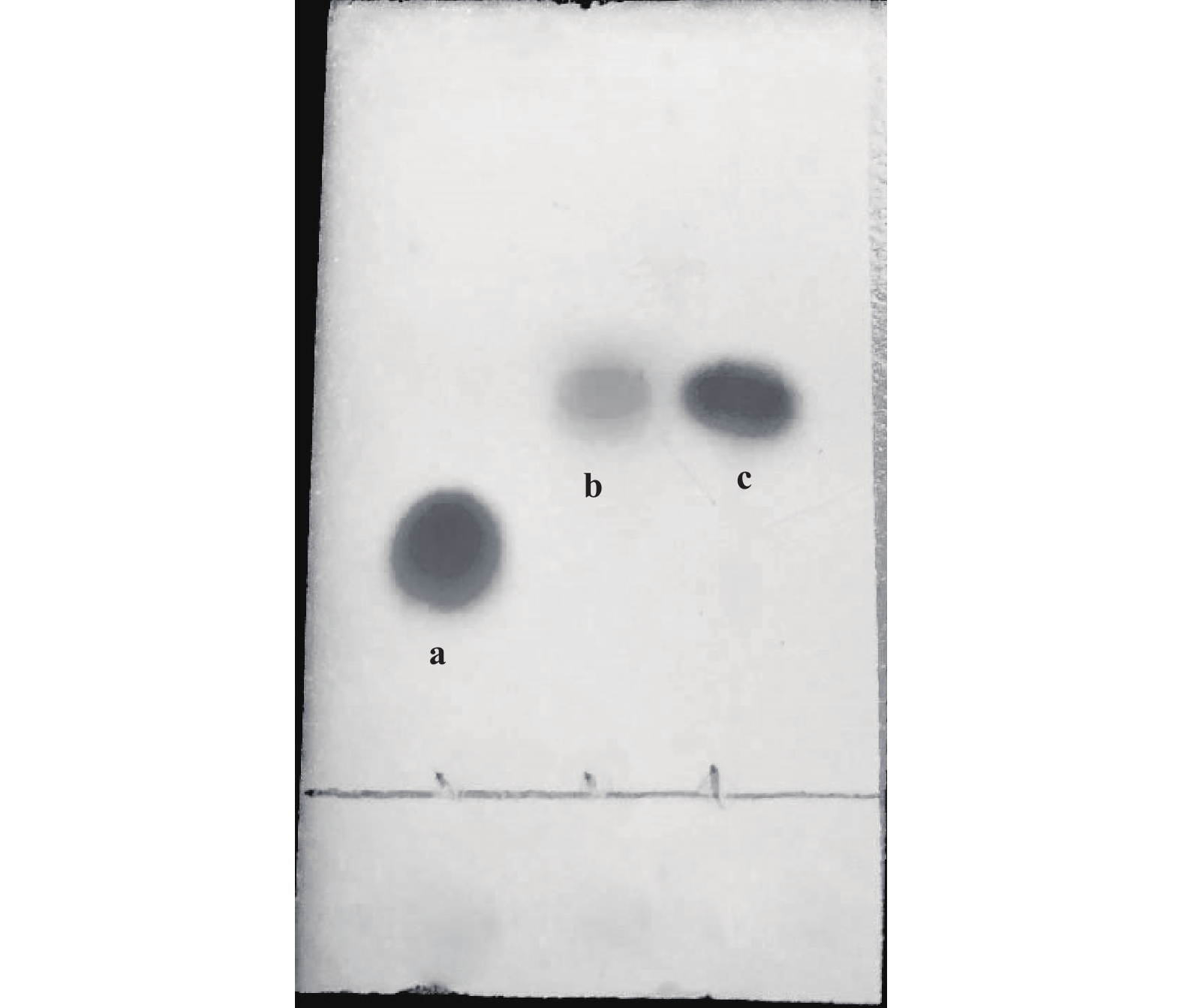
|
图 7 L-赖氨酸单盐酸盐(a)、24 h反应后的中间产物(b)和L-2-氨基己二酸(c)的薄层色谱 Fig.7 TLC of L-lysine monohydrochloride(a), intermediate product after 24 h reaction(b) and L-2-aminoadipic acid(c) |
微生物中, ∆-1-哌啶啉-6-羧酸(∆-1-piperideine-6-carboxylate, P6C)途径是L-赖氨酸的代谢途径之一[15]. L-赖氨酸在L-赖氨酸 6-氨基转移酶(L-lysine 6-aminotransferase, LAT)或L-赖氨酸 6-脱氢酶(L-lysine 6-dehydrogenase, LysDH)作用下转化为∆-1-哌啶啉-6-羧酸, 然后在∆-1-哌啶啉-6-羧酸脱氢酶(∆-1-piperideine-6-carboxylate dehydrogenase, P6CDH)作用下转化为L-2-氨基己二酸.
L-赖氨酸 6-氨基转移酶催化L-赖氨酸代谢需要氨基受体如α-酮戊二酸参与. 在解木糖赖氨酸芽孢杆菌XX-2细胞催化L-赖氨酸的生物催化过程中, 缺乏氨转移条件. 因此, 反应是通过L-赖氨酸 6-脱氢酶催化进行的. 我们的全基因组测序结果也表明, 解木糖赖氨酸芽孢杆菌XX-2中存在L-赖氨酸 6-脱氢酶和∆-1-哌啶啉-6-羧酸脱氢酶基因. 结合发酵过程中L-2-氨基己二酸的产生过程和L-赖氨酸代谢中间体鉴定, 推断该菌株在生长过程中, L-赖氨酸诱导产生L-赖氨酸 6-脱氢酶和∆-1-哌啶啉-6-羧酸脱氢酶. 因此, 解木糖赖氨酸芽孢杆菌XX-2全细胞催化L-赖氨酸产生L-2-氨基己二酸的反应机理推测如图示1.
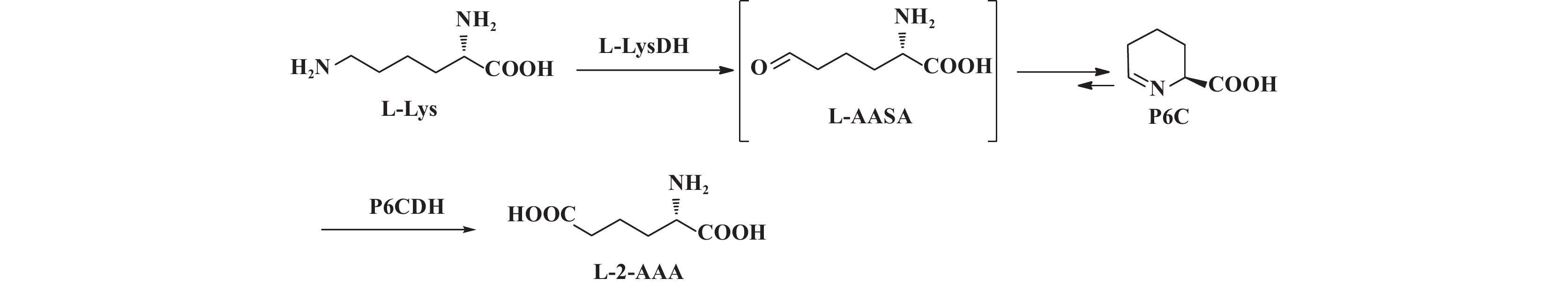
|
1 解木糖赖氨酸芽孢杆菌XX-2催化L-赖氨酸产生L-2-氨基己二酸的反应机理推测 Scheme 1 Postulated mechanism for the production of L-2-aminoadipic acid from L-Lysine by Lysinibacillus xylanilyticus XX-2 |
以110 mmol/L L-赖氨酸单盐酸盐为发酵前体, 解木糖赖氨酸芽孢杆菌XX-2发酵144 h后, L-2-氨基己二酸浓度达到10.4 mmol/L, 产率为9.5%. 解木糖赖氨酸芽孢杆菌XX-2全细胞催化L-赖氨酸单盐酸盐转化为L-2-氨基己二酸的最优条件为: 细胞浓度为45 g(干重)/L, L-赖氨酸单盐酸盐浓度为100 mmol/L, pH=7.0, 温度为30 ℃, 反应时间为144 h. L-2-氨基己二酸浓度达到90 mmol/L, 产率为90%. 生物催化法中的底物L-赖氨酸无需对其α-氨基进行保护, 直接利用解木糖赖氨酸芽孢杆菌XX-2诱导产生的共生L-赖氨酸 6-脱氢酶/∆-1-哌啶啉-6-羧酸脱氢酶体系, 以级联的方式转化为L-2-氨基己二酸. 相对于发酵法, 生物催化法具有收率高、分离方法简单的优点, 为L-2-氨基己二酸的制备提供了一种新的生物途径.
| [1] |
Simultaneous production of D-pipecolic acid and L-ɑ-aminoadipic acid from DL-pipecolic acid using a microorganism
[J]. Agric Biol Chem, 1988, 52(5): 1113–1116.
|
| [2] |
Characterization of L-lysine 6-aminotransferase and its structural gene from Flavobacterium lutescens IFO3084
[J]. J Biochem, 2000, 128(3): 391–397.
DOI:10.1093/oxfordjournals.jbchem.a022766 |
| [3] |
Cloning and characterization of pcd encoding Δ'-piperideine-6-carboxylate dehydrogenase from Flavobacterium lutescens IFO3084
[J]. J Biochem, 2000, 128(3): 975–982.
|
| [4] |
Zhao Yan(赵 妍). Metabolic engineering transforms to produce α-aminoadipate(代谢工程改造大肠杆菌生产α-氨基己二酸)[D]. Beijing(北京): Beijing University of Chemical Technology(北京化工大学), 2020.
|
| [5] |
Biphasic one-pot synthesis of two useful and separable compounds using cofactor-requiring enzymatic reactions: Glutamate dehydrogenase catalyzed synthesis of L-alpha-aminoadipate coupled with alcohol dehydrogenase catalyzed synthesis of a chiral lactone[J]. J Org Chem, 1986, 51(12): 2388–2389.
DOI:10.1021/jo00362a045 |
| [6] |
Formation of Nα-benzyloxycarbonyl-L-aminoadipic acid from N α-benzyloxycarbonyl-L-lysine with mycelia from Aspergillus niger
[J]. J Mol Cat B:Enzymatic, 2004, 30(1): 13–18.
DOI:10.1016/j.molcatb.2004.02.006 |
| [7] |
A method for production of N α-benzyloxycarbonyl-L-aminoadipate-α-semialdehyde with amine oxidase from Aspergillus niger
[J]. J Mol Cat B:Enzymatic, 2004, 30(3/4): 119–123.
|
| [8] |
Production of N α-benzyloxycarbonyl-L-aminoadipic acid and N α-benzyloxycarbonyl-D-aminoadipic acid with Rhodococcus |
| [9] |
A new microbial method for more efficient production of N α-benzyloxycarbonyl-L-aminoadipate-α-semialdehyde and N α-benzyloxycarbonyl-D-aminoadipate-α-semialdehyde
[J]. J Biosci Bioeng, 2005, 100(3): 288–291.
DOI:10.1263/jbb.100.288 |
| [10] |
First crystal structure of L-lysine 6-dehydrogenase as an NAD-dependent amine dehydrogenase[J]. J Bio Chem, 2010, 285(11): 8444–8453.
DOI:10.1074/jbc.M109.084384 |
| [11] |
Structure and mechanism of piperideine-6-carboxylate dehydrogenase from Streptomyces clavuligerus
[J]. Acta Cryst Sec D Str Bio, 2019, 75(12): 1107–1118.
DOI:10.1107/S2059798319014852 |
| [12] |
Xia Shi-wen(夏仕文), Xiong Wen-juan(熊文娟), Wei Yan-chan(韦燕婵), et al. A preparative method of α-keto acid by Lysinibacillus xylanilyticus (一种解木糖赖氨酸芽孢杆菌及其制备α-酮酸的方法) [P]. CN(中国专利), ZL201510697875.6, 2016-02-10.
|
| [13] |
Xiong Wen-juan(熊文娟). Synthesis of D-amino acids by microbial L-AAO(微生物L-AAO催化合成D-氨基酸)[D]. Chongqing(重庆): Chongqing University of Posts and Telecommunications(重庆邮电大学), 2016.
|
| [14] |
Metabolism of amino acids and amines part B: Δ1-Piperideine-6-carboxylic acid and α-aminoadipic acid δ-semialdehyde
[J]. Method Enzymol, 1971, 17: 188–199.
|
| [15] |
Pipecolic acid in microbes: Biosynthetic routes and enzymes[J]. J Ind Microbiol Biotechnol, 2006, 33(6): 401–407.
DOI:10.1007/s10295-006-0078-3 |
 2023, Vol. 37
2023, Vol. 37


