2. 山西浙大新材料与化工研究院, 山西 太原 030024
2. Shanxi-Zheda Institute of Advanced Materials and Chemical Engineering, Taiyuan 030024, China
甲醇作为一种清洁能源, 来源广泛, 可以从煤、石油和天然气中获得. 甲醇产量正逐年增加, 导致甲醇产能过剩[1]. 发展多元化的甲醇下游技术路线是最佳出路, 甲醇可用于生产醛、醚、醇、酯、烯烃和其他化学产品[2]. 其中, 甲醛可用于生产复合材料和粘合剂, 在化妆品、食品、保健品的生产中用作防腐剂和杀菌剂, 也被广泛用作合成大量工业化学品(如乙二醇、染料、药物和塑料)的原料, 是重要的化学品之一[3−4]. 甲醇的非氧化直接脱氢制甲醛引起了学术界和工业界的广泛关注, 被认为是一种有前景的方法[5−6].
甲醇非氧化直接脱氢制甲醛技术的核心和关键在于高效催化剂的开发和设计. 甲醇非氧化直接脱氢通常采用过渡金属催化剂如Ni、Pt、Ru[7−9]等, 产物一般为CO和H2. Wang等[10]开发Cu/ZnO用于甲醇脱氢领域, 发现甲醛为主要产物; Cu基催化剂对甲醛表现出高活性和显著的选择性, 并且Cu 因其低成本备受关注[11]. 但是, Cu基催化剂在反应过程中容易出现烧结和团聚等问题, 导致其稳定性差、寿命短[12−13]. 因此, 通过合理设计Cu基催化剂提升催化稳定性对于甲醇非氧化直接脱氢制甲醛技术至关重要.
目前, 为提升催化剂稳定性, 研究人员基于结构调控和物理屏障等手段开展了很多工作[14−18]. 改变铜配位环境是优化催化性能的有效策略, 近年来二维材料由于其多个活性位点和出色的电子转移能力而表现出很大的优势[16−18]. 有研究表明, 嵌入氮化碳中的铜四原子团簇(M4-C5N2H2) 在CORR中表现出优异的催化性能, C5N2H2作为衬底可以很好的锚定金属团簇, 该结果表明M4-C5N2H2具有优异的稳定性[18]. 基于上述分析, Cu4与C5N2H2相互作用有望在甲醇裂解制甲醛反应中表现出良好的催化性能.
我们以Cu4-C5N2H2为催化剂模型, 基于密度泛函理论(DFT) 对其催化性能进行了研究, 考察了催化剂的热稳定性, 研究了CH3OH在Cu4-C5N2H2催化剂上的吸附和裂解机理以及H2的生成, 探讨了电子结构的影响. 所得结果可为类似反应和催化体系的研究提供理论指导.
1 计算方法及模型 1.1 计算方法所有计算均使用Vienna Ab-initio Simulation Package 6.3 (VASP 6.3) 进行, 采用包含自旋极化的DFT方法进行[19−21]. 投影缀加波(PAW)赝势用于描述电子之间的相互作用[22], 色散效应采用DFT-D3方法描述[23]. 截止能量为400 eV, 采用2 × 2 × 1 k点网格的标准Monkhorst-Pack网格采样, 真空层厚度设置为3 nm. 优化过程中的原子力和能量的收敛标准分别设定为0.005 eV·nm−1和1×10−5 eV, 采用CI-NEB方法确定各基元反应的过渡态(TS)[24], 过渡态用唯一虚频进行振动分析验证. 文献表明在甲醇脱氢生成甲醛反应中, 当反应温度升高到633 K 时, 甲醛的选择性提高至98%[10], 因此本工作的温度设为650 K. 在650 K下进行从头算分子动力学(AIMD)模拟, 模拟时间为10 ps.
形成能(Ef)定义如下:
| $ E_{\mathrm{f}}=(E_{\mathrm{s}\mathrm{u}\mathrm{b}+\mathrm{M}}-E_{\mathrm{s}\mathrm{u}\mathrm{b}}-nE_{\mathrm{M}})/n_{ } $ | (1) |
式(1)中Esub+M为Cu4-C5N2H2的能量, Esub为C5N2H2的能量, EM是金属原子Cu在其最稳定的体相结构中的能量.
吸附能 (Eads)定义如下:
| $ E_{\mathrm{a}\mathrm{d}\mathrm{s}}=E_{\mathrm{a}\mathrm{d}\mathrm{s}\mathrm{orbate}/\mathrm{s}\mathrm{u}\mathrm{b}}-E_{\mathrm{a}\mathrm{d}\mathrm{sorbate}}-E_{\mathrm{s}\mathrm{u}\mathrm{b}} $ | (2) |
式(2)中Eadsorbate/sub为被吸附物质和底物的总能量, Eadsorbate为被吸附物质的能量, Esub为清洁底物的能量.
反应热(∆H)和能垒(Ea)由下式计算:
| $ \Delta H={E}_{\mathrm{F}\mathrm{S}}-{E}_{\mathrm{I}\mathrm{S}} $ | (3) |
| $ {E}_{\mathrm{a}}={E}_{\mathrm{T}\mathrm{S}}-{E}_{\mathrm{I}\mathrm{S}} $ | (4) |
其中, EIS、ETS和EFS分别对应初态(IS)、TS和终态(FS)的总能量.
根据过渡态理论[25], 反应速率常数的公式为:
| $ k=\frac{{k}_{\mathrm{B}}T}{h}exp\left(\frac{-{E}_{\mathrm{a}}}{{k}_{\mathrm{B}}T}\right) $ | (5) |
其中, Ea为能垒, h为普朗克常数, kB为玻尔兹曼常数, T为反应温度650 K.
差分电荷密度的计算公式[18]如下:
| $ \Delta \mathit{\rho } \mathrm= \mathit{\rho } _{ \mathrm{AB}} -\mathit{\rho } _{ \mathrm{A}} -\mathit{\rho } _{ \mathrm{B}} $ | (6) |
其中, ρAB表示优化后的整体电荷密度, ρA和ρB分别表示A和B的电荷密度. 根据公式, 可以分析A和B形成AB后电荷密度的变化.
1.2 计算模型如图1(a)所示, C5N2H2优化后结构的空间群为P4/MMM, a=b=1.181 nm, 最大和最小孔径分别为 0.771和0.738 nm. 本文选用的Cu4-C5N2H2催化剂模型的稳定构型如图1(b)所示, 展示了Cu4-C5N2H2的主视图和俯视图. 其中, Cu—Cu距离均为0.246 nm, Cu—N距离均为0.206 nm.
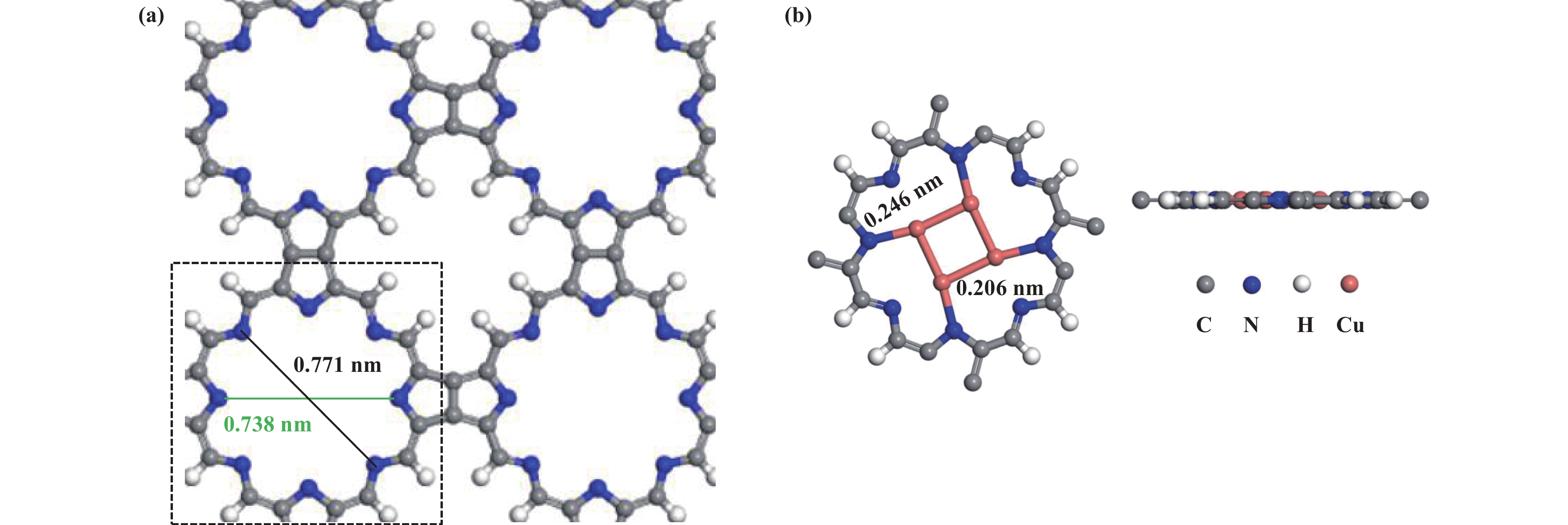
|
图 1 C5N2H2和Cu4-C5N2H2的稳定构型 Fig.1 The stable configurations of C5N2H2 and Cu4-C5N2H2 |
在Cu4-C5N2H2 催化剂上, 测试簇的稳定性具有重要意义. Cu4-C5N2H2的形成能较低, 仅为0.03 eV. 接下来, 为了进一步验证Cu4-C5N2H2 催化剂的热力学稳定性, 还进行了分子动力学模拟. 在650 K下, 模拟时间为10 ps. 如图2所示, 在模拟过程中, 能量波动范围较小, 没有观察到明显的结构变化. 以上结果表明, Cu4-C5N2H2催化剂在650 K时表现出良好的热力学稳定性.
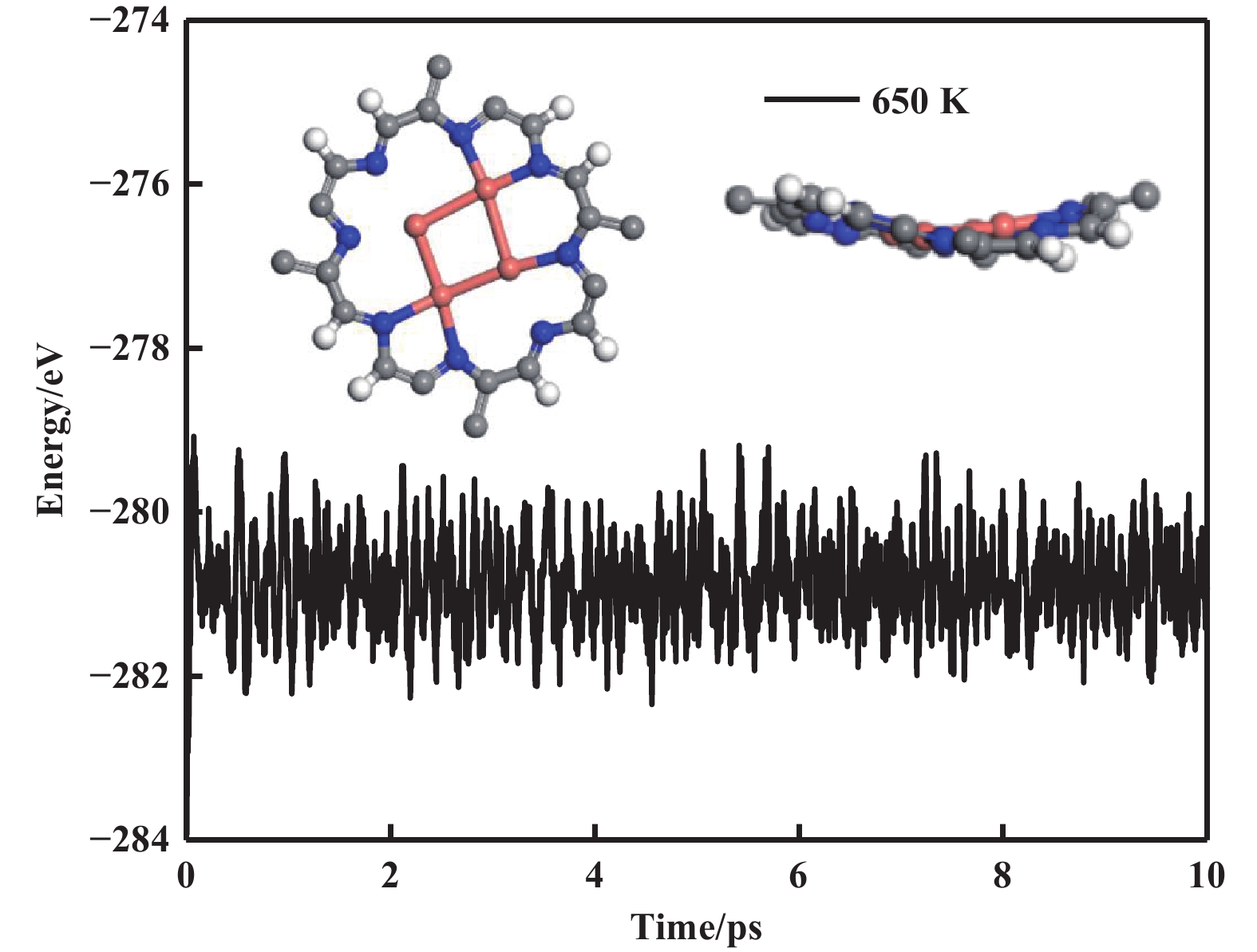
|
图 2 Cu4-C5N2H2 在分子动力学模拟中的总能量波动和模拟结束时的几何形状 Fig.2 The total energy fluctuation of Cu4-C5N2H2 during the molecular dynamics simulation and the geometry at the end of the simulation |
在Cu4-C5N2H2结构中, Cu4作为活性中心可以非常稳定的锚定在C5N2H2孔中. 为研究甲醇和相关物种在Cu4-C5N2H2表面的吸附行为, 确定了主要物种的吸附态, 包括CH3OH、CH3O、CH2O和H2, 各物种的最稳定构型如图3所示. 甲醇活化始于其吸附, 甲醇分子在Cu4-C5N2H2催化剂上的吸附能为−0.39 eV. 如图3所示, CH3O通过O吸附在Cu4-C5N2H2表面, 由于失去一个H, CH3O的吸附能比CH3OH大得多, 为−2.49 eV. CH2O通过O和C原子与催化剂表面相互作用, 吸附能为−0.81 eV, 弱于其它催化剂[8−9, 26]. H2分子与催化剂表面作用很弱, 吸附能仅为−0.10 eV.
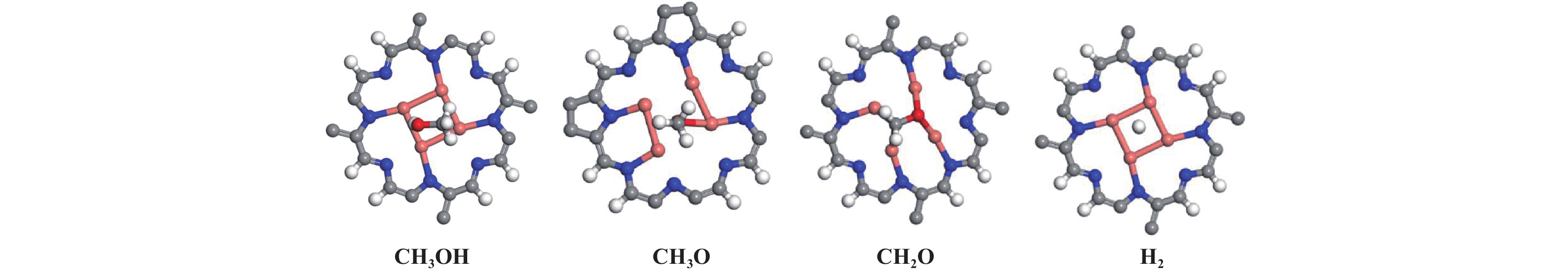
|
图 3 CH3OH及主要物种在Cu4-C5N2H2表面的最稳定构型 Fig.3 The most stable configuration of CH3OH and related species on the Cu4-C5N2H2 surface |
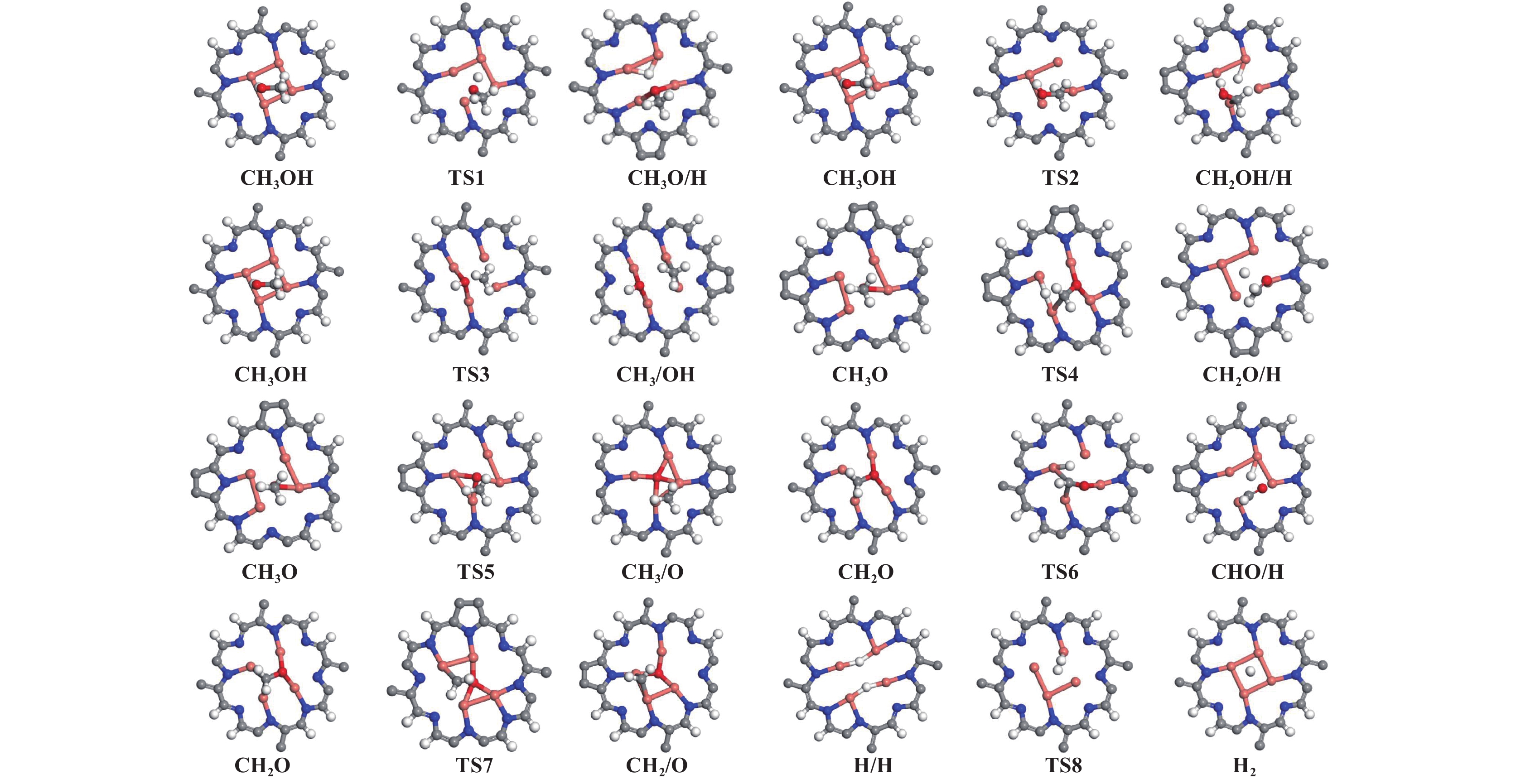
本节计算了Cu4-C5N2H2表面CH3OH裂解各基元反应的反应能和能垒, 确定了CH3OH裂解的最有利路径. 甲醇生成甲醛的反应涉及甲醇裂解(R1−3)、甲氧基裂解(R4−5)、甲醛裂解(R6−7)和脱附以及H2生成的过程, 各基元反应路线如图4所示. 所有的反应能、能垒和650 K时的速率常数的计算结果汇于表1中, CH3OH裂解的IS、TS、FS的构型如图5所示.
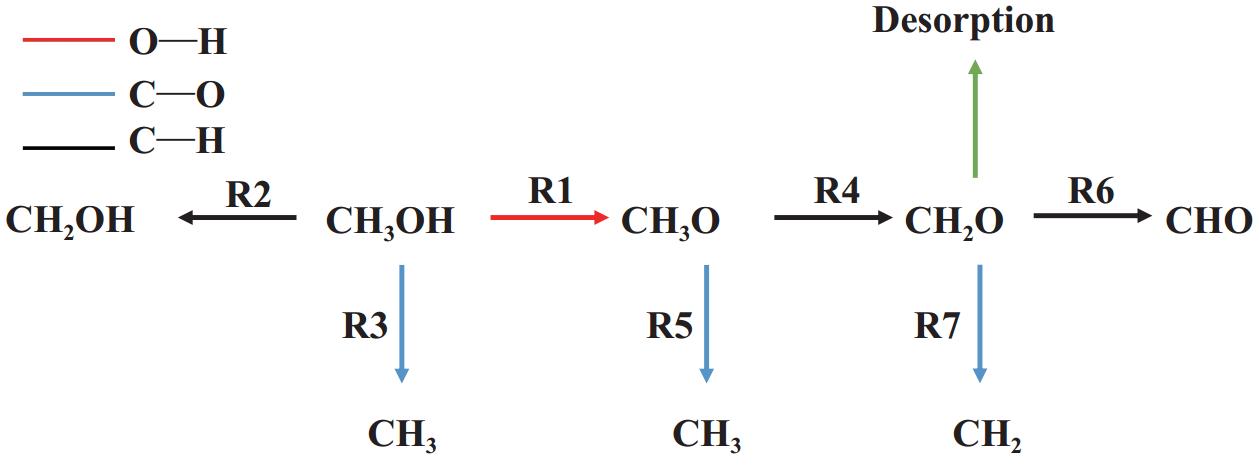
|
图 4 甲醇裂解涉及的基元反应路线图 Fig.4 The roadmap of elementary reactions involved in methanol cracking |
| 表 1 甲醇裂解各基元反应的反应能、能垒和速率常数 Table 1 Reaction energy, barrier and rate constant of each elementary reaction of methanol cracking |
|
图 5 Cu4-C5N2H2催化剂上CH3OH 裂解反应IS、TS和FS的最稳定构型 Fig.5 The most stable configuration of IS, TS and FS of CH3OH cracking reaction on the Cu4-C5N2H2 catalyst |
对于甲醇初步裂解, 存在三条可能路径, 涉及O―H、C―H和C―O键断裂. 在TS1中, 甲醇经O―H键断裂生成CH3O和H, CH3O通过O与催化剂表面的Cu成键, 解离的H也被吸附于Cu原子上, 该基元反应的反应热和能垒分别为−0.53和0.86 eV, 低于其它催化剂上甲醇脱氢能垒[27−28], 650 K时对应的速率常数为2.91×106 s−1;甲醇经C―H键断裂也可能发生, 该基元反应吸热0.43 eV, 需要跨越1.37 eV的能垒, 速率常数为3.23×102 s−1;另一种可能的反应路径是甲醇通过C―O键裂解生成CH3和OH, 该基元反应的反应热和能垒分别为−0.32和1.84 eV, 速率常数为7.32×10−2 s−1. 通过对比以上能垒数据(0.86 vs. 1.37 vs. 1.84 eV), 甲醇经O―H键断裂生成CH3O为初步裂解的优选路径, 这与其它研究结果相一致[8].
根据表1 计算结果, 随着CH3O中C―H键断裂, CH2O通过TS4形成, 反应热为0.08 eV, 对应的能垒为0.89 eV, 低于其它催化剂上脱氢能垒[27, 29], 速率常数为1.70×106 s−1. 同样, CH3O还可通过C―O键断裂生成CH3, 该基元反应的能垒为0.94 eV, 速率常数为6.97×105 s−1. 通过比较以上两个基元反应的相关数据, 发现C―H键断裂的能垒更低、速率常数更大, 故C―H键断裂更为有利[30−33].
随后, CH2O生成CHO和H的反应热和能垒分别为0.03和1.22 eV, 速率常数为4.70×103 s−1, 而生成CH2和O的反应热和能垒分别为0.37和1.15 eV, 速率常数为1.64×104 s−1. 由于CH2O的脱附能为0.81 eV, 小于CH2O经C―H键(1.22 eV)和C―O键(1.15 eV)断裂的能垒. 因此, CH2O在Cu4-C5N2H2表面优先脱附而不是继续裂解. 本工作选用CH2O进一步裂解的能垒和CH2O脱附能之间的能量差值作为评价CH2O选择性的描述符, 其能够定性和定量地评价CH2O选择性. 选择性的值越正, 说明CH2O选择性越好. 计算得到的选择性为0.34 eV, 高于Pt3Ni(111)(−0.79 eV)[8]和Ru-Pt(−1.21 eV)[9]催化剂上的CH2O选择性.
最后, 裂解过程中产生的H原子可结合生成H2, 需要跨越0.85 eV的能垒, 其反应热为0.21 eV, 速率常数为3.48×106 s−1. 由于H2的吸附能仅为−0.10 eV, 因此反应过程中生成的H2很容易从Cu4-C5N2H2表面脱附.
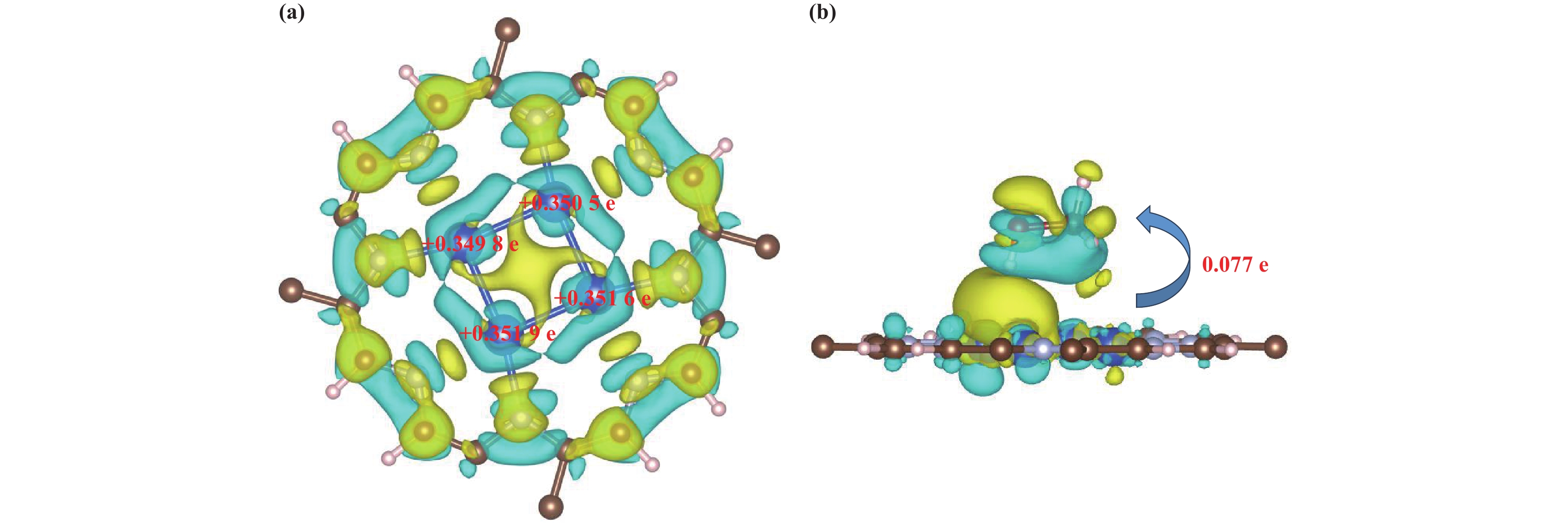
2.4 电子结构分析Cu4-C5N2H2的电子性质是影响其催化性能的一个重要因素. 如图6(a)所示, C、N、H和Cu原子之间存在明显的电荷转移, 使得Cu4-C5N2H2富有活性. 进一步通过bader电荷分析定量计算了Cu原子的电荷分布, 4个Cu原子分别失去
|
图 6
(a) Cu4-C5N2H2催化剂的bader电荷和 (b) Cu4-C5N2H2催化剂吸附CH3OH最稳定构型的差分电荷,等值面分别为0.002和 |
在本研究中, 为解决甲醇裂解催化剂稳定性差和甲醛选择性低的问题, 构建了Cu4-C5N2H2催化剂, 基于 DFT对其催化性能进行了研究. 结果表明: Cu4-C5N2H2催化剂在650 K时表现出优异的稳定性(650 K维持10 ps); 甲醇在Cu4-C5N2H2表面裂解的最优路径为CH3OH→CH3O→CH2O, 伴随H2生成; 催化反应过程中速控步骤为CH3O→CH2O, 该基元反应对应的能垒和速率常数分别为0.89 eV和1.70×106 s−1. 本文所建立的模型和计算结果为甲醇裂解催化剂的设计和开发提供了有价值的参考.
| [1] |
Homogeneous hydrogenation of CO2 and CO to methanol: The renaissance of low-temperature catalysis in the context of the methanol economy[J]. Angew Chem Int Edit, 2022, 61(42): e202207278.
DOI:10.1002/anie.202207278 |
| [2] |
Catalysts for methanol steam reforming: A review[J]. Appl Catal B-Environ, 2010, 99(1/2): 43–57.
DOI:10.1016/j.apcatb.2010.06.015 |
| [3] |
Industrial production of formaldehyde using polycrystalline silver catalyst[J]. Ind Eng Chem Res, 2017, 56(33): 9247–9265.
DOI:10.1021/acs.iecr.7b02388 |
| [4] |
Methanol to formaldehyde: An overview of surface studies and performance of an iron molybdate catalyst[J]. Catalysts, 2021, 11(8): 893.
DOI:10.3390/catal11080893 |
| [5] |
Using microkinetic analysis to search for novel anhydrous formaldehyde production catalysts[J]. Surf Sci, 2015, 641: 105–111.
DOI:10.1016/j.susc.2015.04.028 |
| [6] |
Non-oxidative dehydrogenation of methanol to formaldehyde over supported GaOx-based catalysts[J]. J Catal, 2023, 427: 115111.
DOI:10.1016/j.jcat.2023.115111 |
| [7] |
Highly efficient hydrogen production from methanol by single nickel atoms anchored on defective boron nitride nanosheet[J]. Nano Res, 2023, 16(7): 8800–8808.
DOI:10.1007/s12274-023-5515-3 |
| [8] |
Mechanism of methanol decomposition on the Pt3Ni(111) surface: DFT study[J]. J Phys Chem C, 2017, 121(17): 9348–9360.
DOI:10.1021/acs.jpcc.7b01114 |
| [9] |
Methanol decomposition reactions over boron-doped graphene supported Ru-Pt catalyst[J]. Phys Chem Chem Phys, 2018, 20(14): 9355–9363.
DOI:10.1039/C7CP07618E |
| [10] |
Catalytic membrane nano reactor with Cu/ZnO in situ immobilized in membrane pores for methanol dehydrogenation to formaldehyde[J]. J Membr Sci, 2022, 643: 120014.
DOI:10.1016/j.memsci.2021.120014 |
| [11] |
Anhydrous methanol and ethanol dehydrogenation at Cu(111) step edges[J]. J Phys Chem C, 2018, 122(38): 21952–21962.
DOI:10.1021/acs.jpcc.8b06730 |
| [12] |
Sintering of catalytic nanoparticles: Particle migration or Ostwald ripening?[J]. Acc Chem Res, 2013, 46(8): 1720–1730.
DOI:10.1021/ar3002427 |
| [13] |
Sintering-resistant Cu/B/Ca/Al2O3 catalysts for durable hydrogenation of sec-butyl acetate to 2-butanol and ethanol[J]. J Ind Eng Chem, 2019, 74: 86–95.
DOI:10.1016/j.jiec.2019.02.007 |
| [14] |
A multifunctional core–shell nanoreactor with unique features of sintering resistance for high-performance ethanol steam reforming reaction[J]. Fuel, 2021, 287: 119514.
DOI:10.1016/j.fuel.2020.119514 |
| [15] |
Synthesis of robust MOF-derived Cu/SiO2 catalyst with low copper loading via sol–gel method for the dimethyl oxalate hydrogenation reaction[J]. ACS Catal, 2018, 8(4): 3382–3394.
DOI:10.1021/acscatal.8b00501 |
| [16] |
Methanol decomposition over bimetallic Cu-M catalysts supported on nanoceria: Effect of the second metal on the catalytic properties[J]. Catal Today, 2020, 356: 440–455.
DOI:10.1016/j.cattod.2019.04.076 |
| [17] |
Confined Fe-Cu clusters as sub-nanometer reactors for efficiently regulating the electrochemical nitrogen reduction reaction[J]. Adv Mater, 2020, 32(40): 2004382.
DOI:10.1002/adma.202004382 |
| [18] |
Design of a four-atom cluster embedded in carbon nitride for electrocatalytic generation of multi-carbon products[J]. J Am Chem Soc, 2023, 145(12): 7030–7039.
DOI:10.1021/jacs.3c01561 |
| [19] |
Ab initio molecular dynamics for open-shell transition metals[J]. Phys Rev B, 1993, 48(17): 13115–13118.
DOI:10.1103/PhysRevB.48.13115 |
| [20] |
Efficient iterative schemes for ab initio total-energy calculations using a plane-wave basis set[J]. Phys Rev B, 1996, 54(16): 11169–11186.
DOI:10.1103/PhysRevB.54.11169 |
| [21] |
Efficiency of ab-initio total energy calculations for metals and semiconductors using a plane-wave basis set[J]. Comput Mater Sci, 1996, 6(1): 15–50.
DOI:10.1016/0927-0256(96)00008-0 |
| [22] |
From ultrasoft pseudopotentials to the projector augmented-wave method[J]. Phys Rev B, 1999, 59(3): 1758–1775.
DOI:10.1103/PhysRevB.59.1758 |
| [23] |
A consistent and accurate ab-initio parametrization of density functional dispersion correction (DFT-D) for the 94 elements H-Pu[J]. J Chem Phys, 2010, 132(15): 154104.
DOI:10.1063/1.3382344 |
| [24] |
A climbing image nudged elastic band method for finding saddle points and minimum energy paths[J]. J Chem Phys, 2000, 113(22): 9901–9904.
DOI:10.1063/1.1329672 |
| [25] |
Dehydrogenation of methanol to methyl formate over supported Ni, Pd and Pt catalysts. Anomalous catalytic functions of PdZn and PtZn alloys[J]. React Kinet Catal Lett, 1995, 55(2): 245–250.
DOI:10.1007/BF02073057 |
| [26] |
Insight into the reaction mechanisms of methanol on PtRu/Pt(111): A density functional study[J]. Appl Surf Sci, 2016, 369: 257–266.
DOI:10.1016/j.apsusc.2015.11.104 |
| [27] |
Insights into the crucial role of a Zn promoter for methanol dehydrogenation to methyl formate over Cu(111) catalysts[J]. Phys Chem Chem Phys, 2022, 24(37): 22661–22669.
DOI:10.1039/D2CP01544G |
| [28] |
A density functional theory study of methanol dehydrogenation on the PtPd3(111) surface[J]. Int J Hydrogen Energy, 2015, 40(31): 9656–9669.
DOI:10.1016/j.ijhydene.2015.06.028 |
| [29] |
Insights into the reaction mechanisms of methanol decomposition, methanol oxidation and steam reforming of methanol on Cu(111): A density functional theory study[J]. Int J Hydrogen Energy, 2014, 39(4): 1664–1679.
DOI:10.1016/j.ijhydene.2013.11.048 |
| [30] |
Spectroscopic study of surface dynamics of Al2O3 supported Pt-catalysts(Al2O3负载 Pt基催化剂表面动态变化的谱学研究)[J]. J Mol Catal (China)(分子催化), 2024, 38(1): 7–16.
DOI:10.16084/j.issn1001-3555.2024.01.002 |
| [31] |
Effect of K+ modified Au/ZSM-5 zeolite catalyst on cracking performance of n-butane(钾改性对Au/ZSM-5催化剂上正丁烷裂解性能的影响)[J]. J Mol Catal (China)(分子催化), 2023, 37(2): 118–129.
DOI:10.16084/j.issn1001-3555.2023.02.002 |
| [32] |
Effect of IM-5 on the methane decomposition to produce hydrogen over Ni-Cu bimetallic catalyst(IM-5分子筛在Ni-Cu催化剂甲烷热裂解制氢反应中的作用研究)[J]. J Mol Catal (China)(分子催化), 2023, 37(3): 252–263.
DOI:10.16084/j.issn1001-3555.2023.03.005 |
| [33] |
Research progress of the DFT study on the acetylene hydrochlorination over gold catalyst(金催化乙炔氢氯化的密度泛函理论研究进展)[J]. J Mol Catal (China)(分子催化), 2024, 38(3): 273–283.
DOI:10.16084/j.issn1001-3555.2024.03.009 |
 2025, Vol. 39
2025, Vol. 39


