天然气, 包括页岩气、甲烷水合物和煤层气, 在人类社会中起着不可替代的作用. 随着对能源需求的不断扩大, 天然气探明储量呈现直线增长的趋势. 可以预见, 天然气的使用将会越来越广泛[1−3]. 与石油、煤炭等化石燃料相比, 天然气燃烧释放的硫氧化物和氮氧化物等污染物明显要少, 而且热值还很高, 使其成为化石能源的替代品之一[4−7]. 甲烷作为天然气的主要成分, 其成本低、热值高、全球储量巨大[8−11]. 同时, 甲烷作为一种重要的化工原料, 可用于制造甲醇、乙烷、丙烷等高附加值化合物, 从而减少化工行业对原油的严重依赖. 但大气中甲烷含量过多又会引起温室效应, 会加剧全球变暖的过程, 导致全球气温升高, 造成严重的环境问题. 因此, 将甲烷转化为高附加值化学品, 还能够减少温室效应, 是一项意义重大的“碳中和”策略.
甲烷分子C―H键键能高, 稳定性好, C―H键的断裂存在一定困难, 转化过程要克服非常高的反应势垒, 需要高温高压, 条件苛刻[12−15]. 例如, Song等[16]合成了Ni-Mo纳米催化剂在单晶MgO上重整甲烷制合成气, 在800 ℃时, Ni-Mo合金不可避免的发生了团聚, 导致催化活性降低. 目前, 只有甲烷重整制合成气实现了大规模工业应用, 生成的合成气再通过费托合成转化为碳氢化合物或甲醇、乙酸等含氧化合物[17−21]. 但是, 这种转换路线增加了过程的复杂性和能量消耗, 已难以满足当代化工产业的环保要求, 而绕过合成气生产的直接路线, 将甲烷一步转化为高附加值化学品将更加经济和环保[22]. 直接转化途经, 甲烷可以直接转化为液态含氧化合物、合成气、碳氢化合物等, 可以在相对较低的温度下进行, 减少了间接过程蒸汽转化步骤所需的高热能和资金成本. 20世纪70年代初, Shilov等[3]通过K2PtCl6作为氧化剂, 在120 ℃下, 将甲烷部分氧化为甲醇. 之后, 甲烷转化为高价值的液态氧化物取得了显著的进展, 但仍有很大的局限性. 光催化技术是一项新兴的技术, 被广泛应用于水分解、二氧化碳还原、降解等方面[23−26], 实现了在温和条件下直接将太阳能转化为化学能, 是一种有前途的绿色技术. 1978年, Kaliaguine等[27]首次报道了将甲烷转化为液态化合物, TiO2在紫外光的照射下, 甲烷被O−激发为CH3O−, 最终形成C2H6、HCHO. 之后, 通过金属氧化物将甲烷转化为CH3OH、HCHO、HCOOH被广泛报道. 这些开创性的工作初步验证了光催化甲烷直接转化为高价值产物的可行性. 然而, 这些过程通常伴随着产品被过氧化的问题, 导致选择性低. 随着对光催化技术的深入研究, 科研人员开始尝试在无氧条件下进行甲烷转化. 1998年, Yoshida等[28]在紫外光照射下, 首次实现了室温下甲烷的非氧化偶联反应, 偶联产物的总产率达5.9%, 且主产物为乙烷(3.54%), 所得乙烷的产率比热力学平衡计算高很多. 这一研究也进一步证实了利用光催化替代热催化是甲烷催化转化的一种可行性策略, 实现甲烷的高效转化, 促进清洁能源的利用和发展, 是替代传统能源的一种新策略. 近年来, 光催化甲烷转化的研究取得了快速发展. 研究人员致力于从温和条件下将CH4转化为高价值产品, 也证实了在温和条件下将CH4转化为碳氢化合物和含氧液体产物的可行性, 同时也能够避免在高温、高压下催化剂失活、积碳等问题, 推动了光催化甲烷转化的发展. 本文综述了近年来光催化甲烷转化高附加值产品的研究进展. 首先, 从甲烷的结构、键能等方面进行反应机理的分析; 随后, 对甲烷转化反应进行了分类, 包括甲烷的非氧化偶联、氧化偶联制碳氢化合物和甲烷转化成氧化物, 并对催化过程中催化剂组成与结构、反应机理等方面进行评述. 最后, 提出了光催化甲烷转化领域的研究前景和面临的挑战.
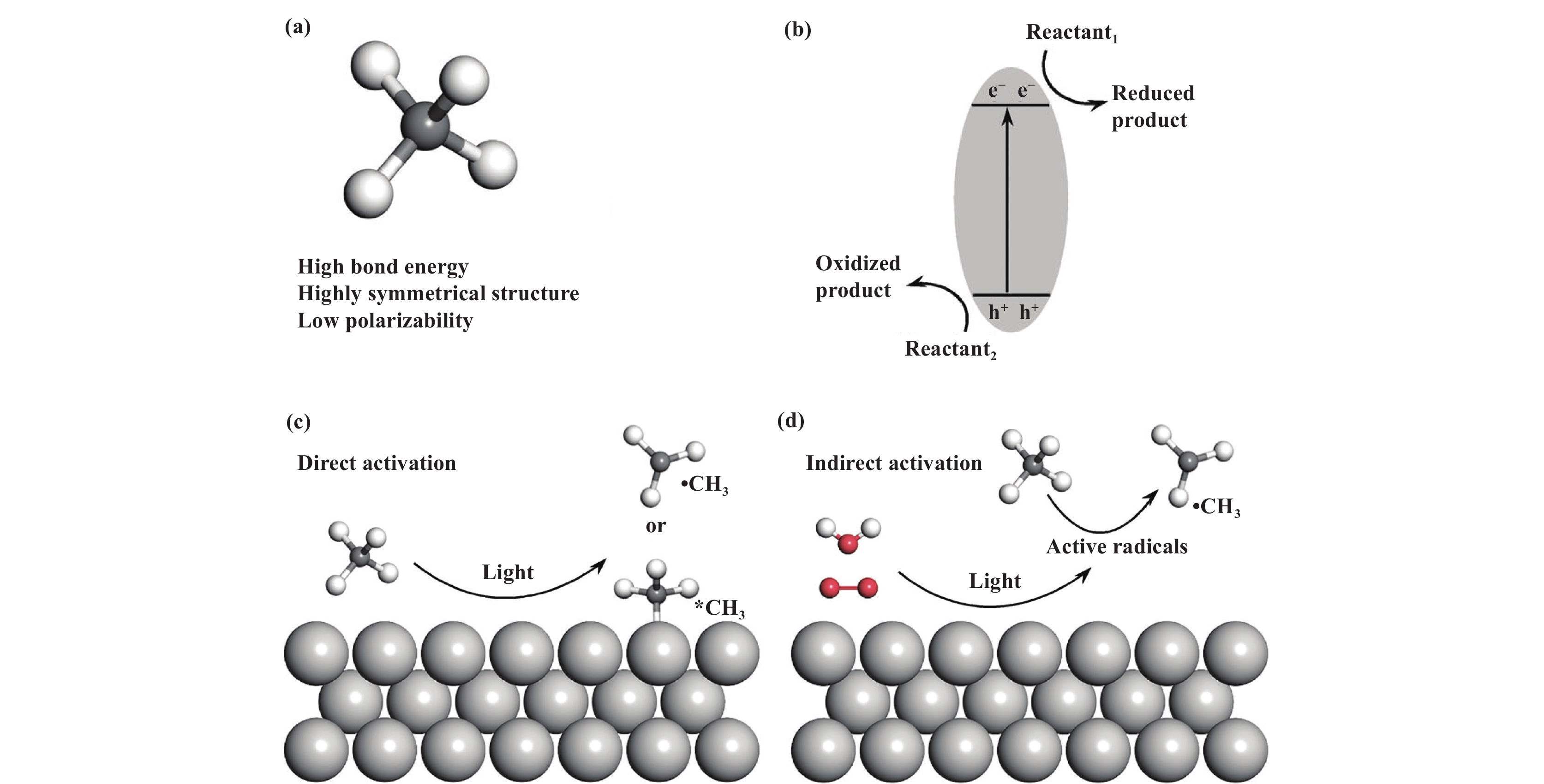
1 光催化甲烷转化基本原理光催化反应是一种绿色友好的技术, 将甲烷转化成一系列含碳的化学物质, 如醇类、芳烃、烷烃和烯烃, 一直被认为是催化和化学领域的“圣杯”. 首先, 从甲烷的结构分析, 如图1(a)所示[29], 甲烷具有对称的四面体结构, 有4个相等的C―H键, C―H键的平均解离能ΔHC―H =440 kJ·mol−1, 使得甲烷具有极高的键能和较低的极化率, 在热力学上是不利于反应进行的[30−32]. 甲烷结构固有的惰性导致其在热催化转化过程中需要克服极高的活化能垒, 因此, 通常需要在高温(700~
|
图 1 (a) 甲烷的分子结构; (b) 光催化反应的基本原理; (c) 甲烷在光催化剂表面的直接活化; (d) 活性自由基间接活化甲烷[29] Fig.1 (a) Molecular structure of methane; (b) Basic principles of photocatalytic reactions; (c) Direct activation of methane on the photocatalyst surface; (d) Indirect activation of methane by active radicals[29] |
CH4的光催化过程主要包括C―H键的断裂以及自由基的形成并进行偶联反应. 光催化的整个过程可分为三个步骤: 1) 光吸收产生电子和空穴, 催化剂所吸收的能量必须大于或等于带隙宽度才能够被光激发产生光生电荷; 2) 电子和空穴扩散到半导体表面; 3) 光电子和空穴参与吸附分子的还原和氧化反应[29,35]. 如图1(b), 在此过程中, 受激发的电子从价带跃迁到导带, 并在导带留下相同数量的空穴, 在半导体上与吸附的分子发生氧化还原反应. 甲烷活化通常被认为是整个氧化还原反应中的氧化反应, 对于还原反应, 可以加入不同的氧化剂(如H2O2、O2、H2O等), 生成不同的自由基(•OH、•OOH), 参与甲烷的转化过程, 提高甲烷的转化率和产率, 但也要避免因加入氧化剂而发生过氧化问题. 因此, 在进行甲烷有氧偶联反应中, 需要选用合适的氧化剂. 在电子-空穴对分离和转移之后, 多相光催化主要发生在催化剂-介质界面的过程, 包括反应物的吸附和活化、中间体的形成以及产物的脱附[36]. 甲烷活化通常被认为是甲烷转化反应速率的决定步骤. 基于多相催化的光催化甲烷活化可分为两类: 直接活化, 甲烷在光照下直接吸附在光催化剂表面, 与金属氧化物(如ZnO、TiO2)中的晶格氧作用[37], 导致甲烷分子中的C―H键断裂并形成游离的甲基自由基或者其它自由基, 最后自由基之间发生相互偶联并从催化剂表面解吸, 如图1(c). 间接活化, 甲烷在来自附加反应物(如H2O和O2)的光诱导活性自由基(•OH、•OOH等)的帮助下被激活[38], 如图1(d). 例如, Zhu等[39]利用BiVO4半导体催化甲烷制甲醇反应. 首先, 光产生的空穴转移到BiVO4表面, 将H2O氧化成•OH自由基. 随后, 甲烷中的H原子被•OH自由基抽离生成•CH3中间体, 最后与•OH自由基偶联生成CH3OH. 在整个催化过程中甲烷活化通常被认为是甲烷转化反应速率的决定步骤, 同时在整个动力学过程中电子与空穴对的分离和复合也是CH4转化的重要条件.
2 光催化甲烷转化反应光催化CH4转化为高附加值化学品和绿色可再生燃料, 为解决能源短缺和温室效应提供了一个有前景的策略. 开发高效、高选择性的光催化剂氧化CH4并转化为有用的化学品是十分紧迫并具有挑战性的任务[40−44]. 近年来, 光催化甲烷转化反应体系和反应途径被广泛研究. 大多数研究集中在光催化非氧化偶联生成乙烷和氢气, 但是其产率较低. 通过引入氧化剂(如O2), 可以进一步提高反应的速率和产率, 同时通过引入氧化剂, 甲烷转化产物多样化, 生成含氧液态产物(如CH3OOH和CH3OH等)[45], 避免了传统的高温高压重整甲烷-醇类转化的多步路线. 根据是否含有氧化剂, 将甲烷制烃的偶联过程分为两种类型[46−47], 如方程式(1)−(5): 甲烷的非氧化偶联(NOCM)和甲烷的氧化偶联(OCM), 包括氧化偶联制碳氢化合物和含氧化合物. 如表1所示, 列举了不同催化剂在不同反应条件下光催化甲烷转化为含氧液体产物和碳氢化合物的最新趋势[48−56].
| 表 1 不同光催化剂的光催化甲烷反应条件及产率 Table 1 The productivity and reaction conditions of photocatalytic methane over different reported photocatalysts |
| $ \mathrm{2CH}_{4} \to \mathrm{C}_{2} \mathrm{H}_{6} +\mathrm{H}_{2}, \;\;{\Delta G}^{0}_{\mathrm{298K}} =68.8\; \mathrm{\;kJ\cdot mol}^{-1} $ | (1) |
| $ \mathrm{2CH} _{ \mathrm{4} } \to \mathrm{C} _{ \mathrm{2} } \mathrm{H} _{ \mathrm{4} } \mathrm{+2H} _{ \mathrm{2} },\;\; \mathrm{\Delta } {G} ^{ \mathrm{0} }_{ \mathrm{298K} } \mathrm{=169.6\;kJ\cdot mol} ^{ \mathrm{-1} } $ | (2) |
| $ \mathrm{4CH} _{ \mathrm{4} } \mathrm{+O} _{ \mathrm{2} } \to \mathrm{2C} _{ \mathrm{2} } \mathrm{H} _{ \mathrm{6} } \mathrm{+2H} _{ \mathrm{2} } {\mathrm{O}},\;\;\Delta {G} ^{ \mathrm{0} }_{ \mathrm{298K} } \mathrm{=-320\;kJ\cdot mol} ^{ \mathrm{-1} } $ | (3) |
| $ \mathrm{2CH} _{ \mathrm{4} } \mathrm{+O} _{ \mathrm{2} } \to \mathrm{C} _{ \mathrm{2} } \mathrm{H} _{ \mathrm{4} } \mathrm{+2H} _{ \mathrm{2} } {\mathrm{O}},\;\;\Delta {G} ^{ \mathrm{0} }_{ \mathrm{298K} } \mathrm{=-288\;kJ\cdot mol} ^{ {-1} } $ | (4) |
| $ \mathrm{2CH} _{ \mathrm{4} } \mathrm{+O} _{ \mathrm{2} } \to \mathrm{2CH} _{ \mathrm{3} } \mathrm{OH},\;\;\Delta {G} ^{ \mathrm{0} }_{ \mathrm{298K} } \mathrm{=-233\;kJ\cdot mol} ^{ \mathrm{-1} } $ | (5) |
NOCM能够直接把CH4转化为高价值的烃(如乙烷、乙烯、苯等), 且反应过程中没有引入氧化剂(如O2、H2O2), 避免甲烷过度氧化为CO或CO2, 为直接将甲烷转化为高价值的化学物质提供了途径. 从等式(1、2)可知, 甲烷在298 K时的吉布斯自由能ΔG>0, 为吸热反应, 需要非常高的温度才能达到可接受热催化甲烷转化. 例如, Bao等[10]采用单原子铁嵌入SiO2中, 在
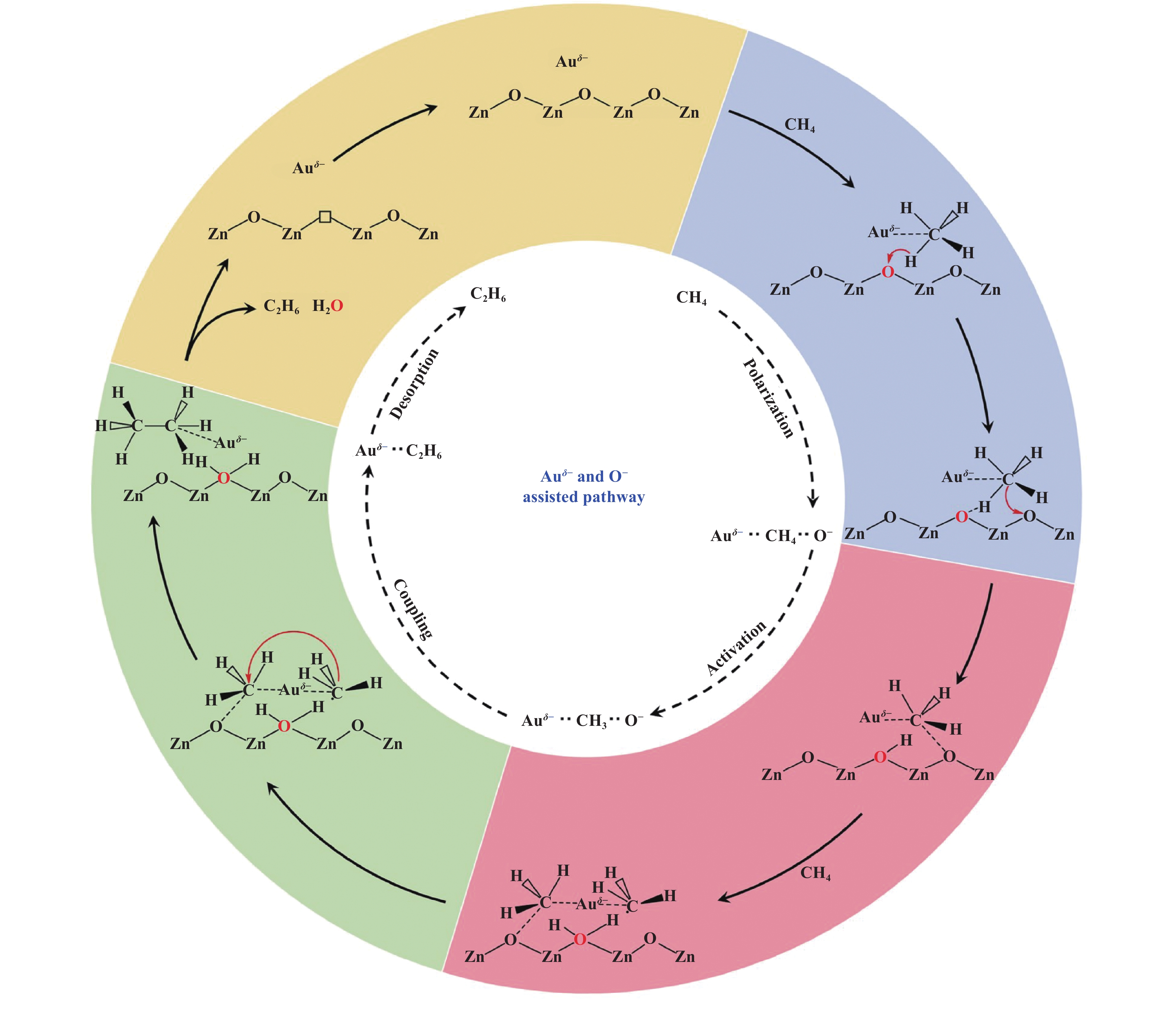
Xie等[57]通过构筑Au/ZnO多孔纳米片促进甲烷的转化, 利用金属-载体间的强相互作用使得Au表面带有部分负电荷, 通过构筑双活性物种(Auδ−和O−)共同极化惰性的甲烷分子, 活化C―H键, 加速甲烷偶联过程. 实验结果表明, 当Au的负载量为2.8%时, 能够高效的将CH4转化为C2H6, 产率为
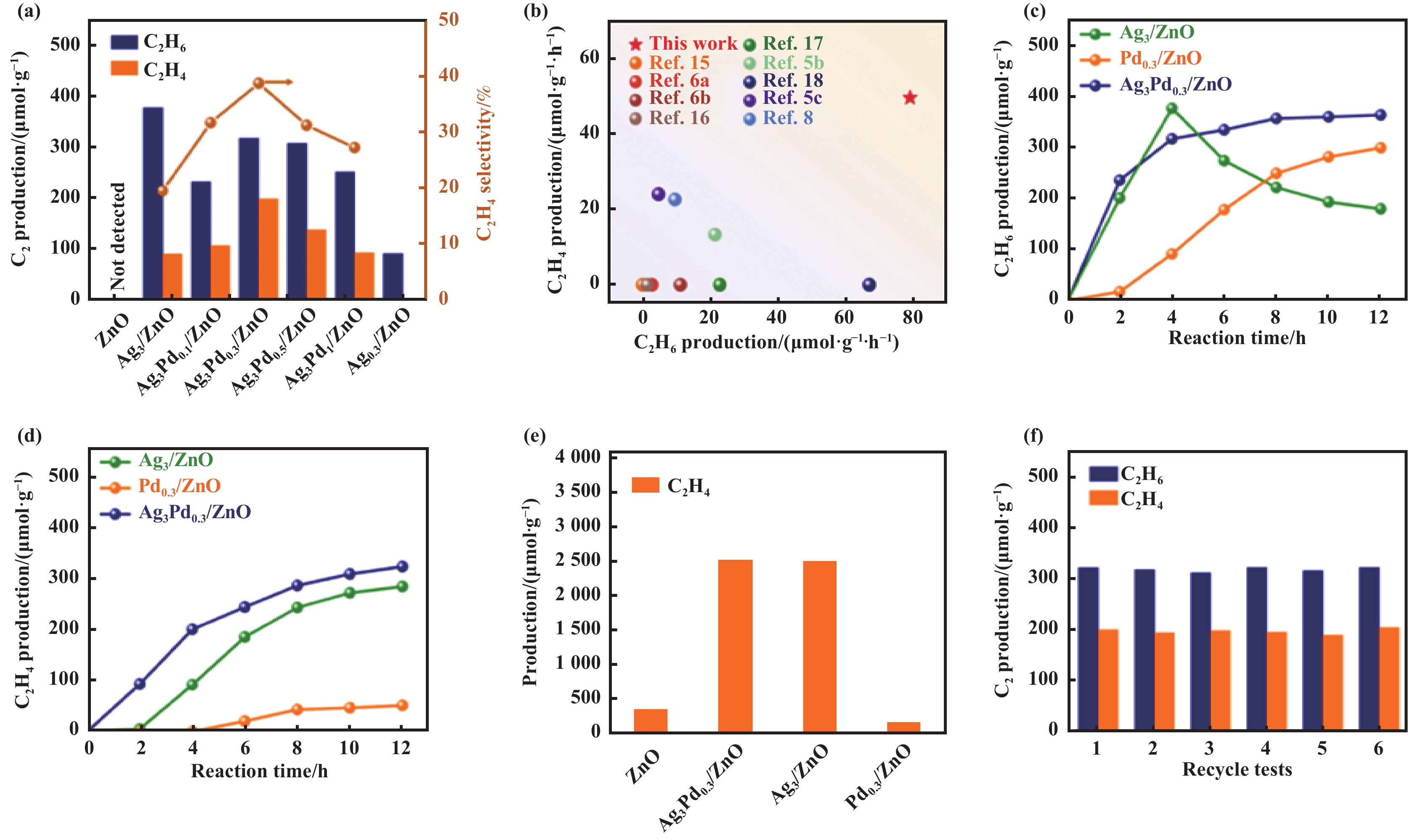
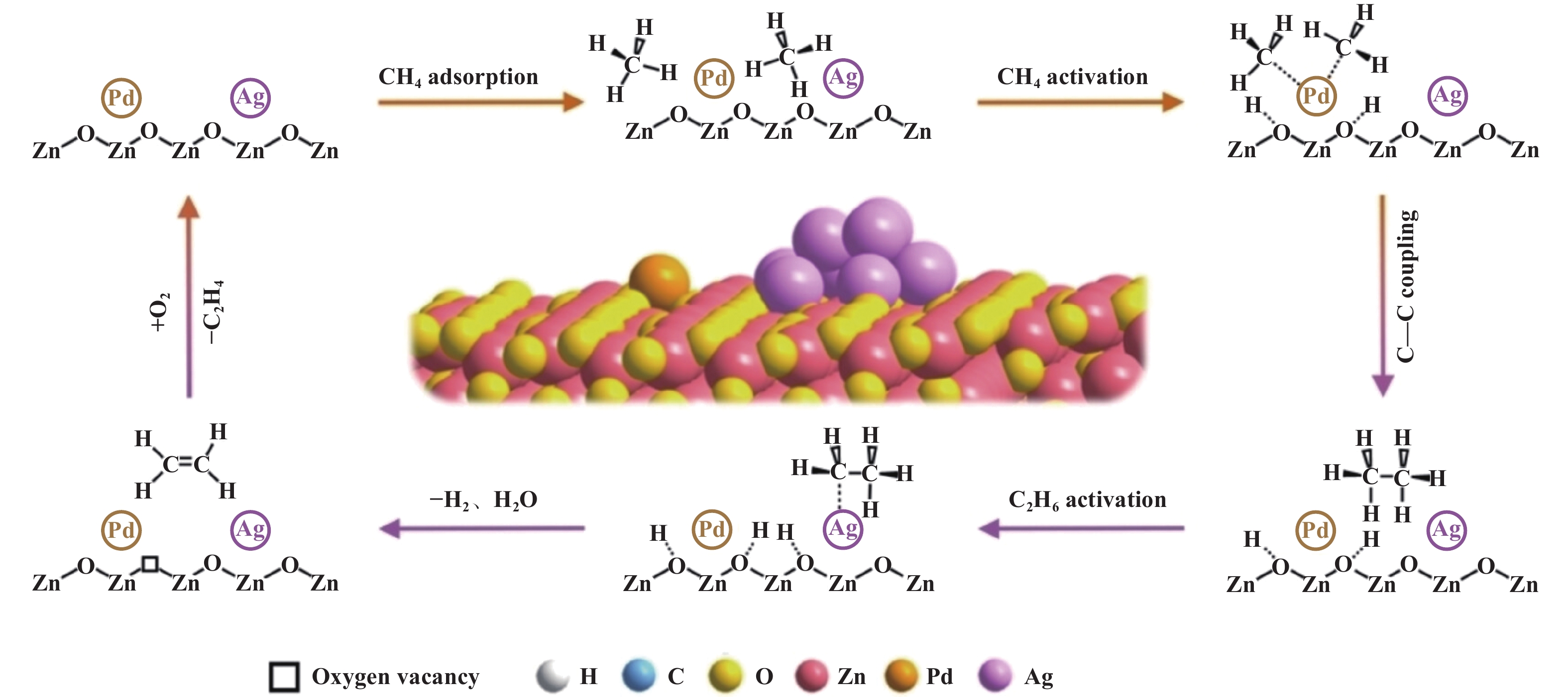
氧化物半导体具有良好的光吸收能力, 被广泛应用于光催化NOCM研究. 然而, 氧化物半导体的晶格氧位点有时会将甲烷过度氧化生成CO、CO2等副产物. 近日, Xu等[58]设计了一种双金属协同催化位点策略, 即银纳米粒子(Ag NPs)和钯单原子(Pd SAs)共同修饰ZnO, 在温和条件下进行高效光催化CH4无氧偶联转化为C2H4. 在优化Ag和Pd负载量后, Ag3Pd0.3/ZnO表现出最佳的CH4转化性能, 在光照4 h后, C2化合物的产率为515 μmol·g−1, C2H4的选择性为39%, 优于目前大多数甲烷无氧偶联的性能, 而且该催化剂在6次循环实验中具有良好的稳定性, 没有发生明显的活性衰减(图3 (a−f)). 此外, 该工作还通过详细的表征和理论计算结果, 提出了AgPd/ZnO光催化甲烷转化反应机理(如图4): 在光照下, ZnO受光激发产生光生载流子, 生成的空穴富集在ZnO的晶格氧上, 激活并裂解CH4的C―H键生成CH3*; 随后, 在Pd SAs上CH3*中间体C-C耦合生成C2H6; 最后, 生成的C2H6脱质子生成C2H5*, 在Ag位点的作用下脱氢生成C2H4. 然而, 当CH4和C2H6共存时, 单个Ag位点优先促进C2H6的活化, 不利于CH4的持续转化. 与此相反, Pd SAs的特点是选择性促进CH4的C―H键活化, 从而提高了CH4转化效率. 此研究工作通过双金属级联催化剂策略的精妙设计, 证明了Ag和Pd负载ZnO, 在促进CH4转化为C2H4中协同作用的重要性. 同时也为推进光催化CH4定向转化为高附加值C2+碳氢化合物提供了新视角.
|
图 3 (a)各种催化剂光催化CH4转化性能(光照4 h); (b) Ag3Pd0.3/ZnO以及已报道的其他光催化剂CH4转化性能比较; (c) Ag3/ZnO, Pd0.3/ZnO和Ag3Pd0.3/ZnO随时间变化的光催化CH4转化C2H6产率; (d) Ag3/ZnO, Pd0.3/ZnO和Ag3Pd0.3/ZnO随时间变化的光催化CH4转化C2H4产率; (e) 光照4 h各种催化剂的光催化CH4转化C2H4产率比较; (f) Ag3Pd0.3/ZnO循环试验中C2化合物产率(每次循环4 h)[58] Fig.3 (a) Photocatalytic CH4 conversion performance of various catalysts after 4 h illumination; (b) The performance comparison of the CH4 nonoxidative conversion to C2 compound of Ag3Pd0.3/ZnO and other representative reported photocatalysts; (c) Time-dependent photocatalytic C2H6 production over Ag3/ZnO, Pd0.3/ZnO and Ag3Pd0.3/ZnO; (d) Time-dependent photocatalytic C2H4 production over Ag3/ZnO, Pd0.3/ZnO and Ag3Pd0.3/ZnO; (e) Photocatalytic C2H4 conversion performance of various catalysts after 4 h of illumination; (f) C2 compound yields in the recycle tests of Ag3Pd0.3/ZnO (each cycle illumination 4 h)[58] |
|
图 4 AgPd/ZnO光催化CH4非氧化转化为C2H4的示意图[58] Fig.4 Schematic illustration for photocatalytic CH4 nonoxidative conversion toward C2H4 over AgPd/ZnO[58] |
光催化NOCM的烃类产物除乙烷和乙烯外, 还有价值更高的C3+产物. Li等[44]报道了Pt/black TiO2光催化剂, 通过表面氧化策略在黑色的二氧化钛表面调控Pt活性位点, 实现从孤立的单原子到团簇, 其中Pt物种彼此接近但不直接成键, 在室温可见光至近红外光下表现出卓越的光催化活性, 甲烷的转化率达8.2%, 丙烷选择性为65%. 研究发现, Pt物种状态对其催化活性和选择性有根本的影响, 图5(a) 所示, 0.04Pt@BT-O、0.2Pt@BT-O和1.0Pt@BT-O三种催化剂, 对于0.04Pt@BT-O, 甲烷转化率为4.9%, 由于单个Pt活性位点, 导致甲烷中的四个C―H键都有断裂的趋势, 从而产生焦炭. 相反, 在可见光照射4 h后0.2Pt@BT-O, 甲烷的转化率最高, 碳沉积最少. 更有趣的是, 主要的烃产物是丙烷(选择性~65%), 不是常见的甲烷脱氢偶联制乙烷. 为了进一步探索反应机理和独特的丙烷选择性, 进行了反应时间探究, 如图5(b)所示, 前0.5 min的主要产物为乙烯(60%), 随着反应时间的进行, 丙烷的比例急剧增加. 根据实验结果, 提出了催化机理: 如图5(c)的路径2, 甲烷在Pt单体上吸附解离形成Pt=CH2,它会插入另一个活性甲烷分子的C―H键, 生成乙烷. 生成的乙烷与另一个Pt=CH2反应生成丙烷. 这项工作标志着利用可见光驱动NOCM的开创性实例, 同时这种新方法超越了传统甲基自由基的限制, 具有独特的选择性能够将甲烷转化为丙烷, 为甲烷分子功能化提供了一个新的平台.
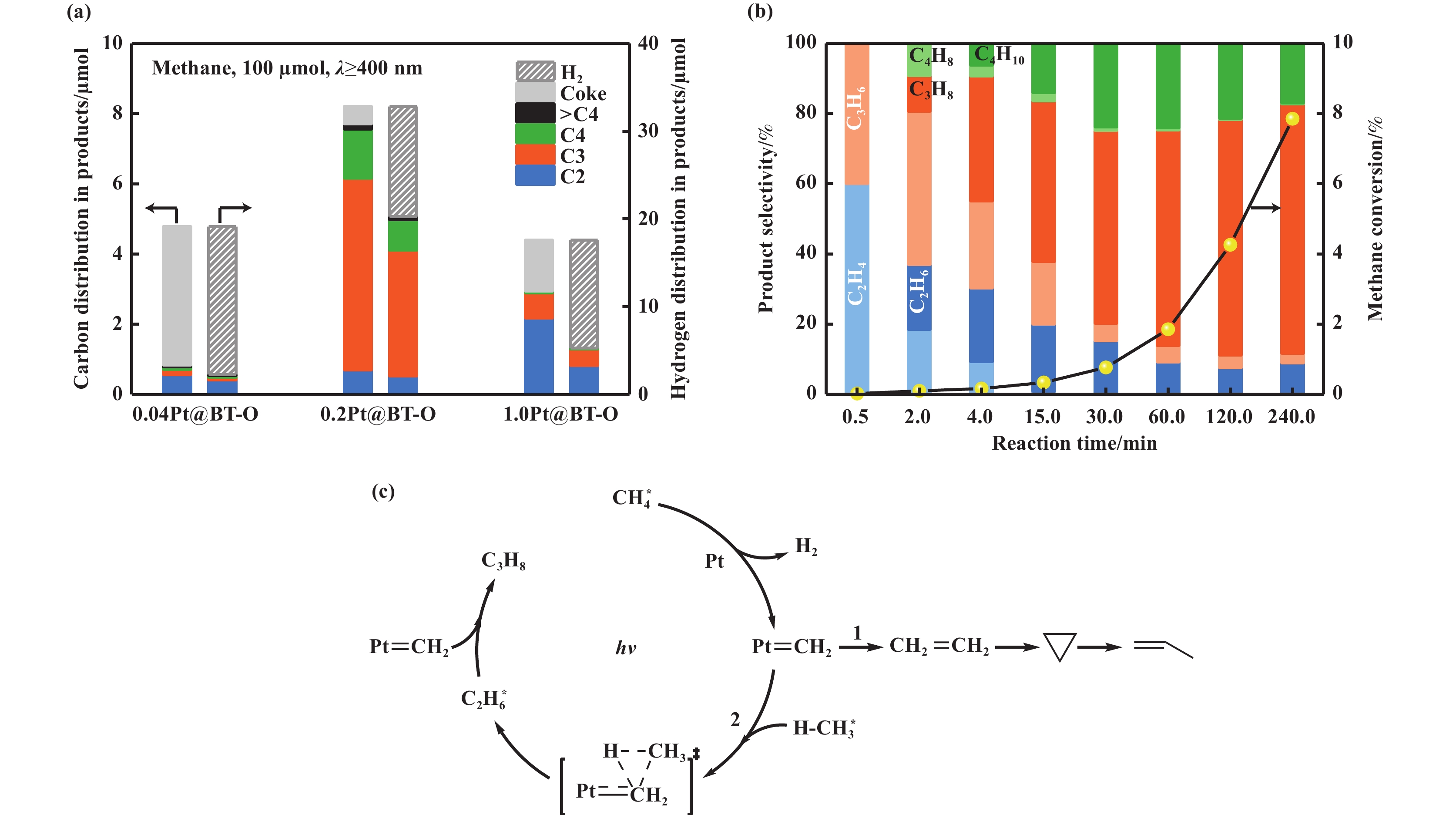
|
图 5 (a) 不同Pt含量的Pt@BT-O催化剂上甲烷脱氢反应; (b) 生成烃的分布和甲烷转化率随反应时间的变化; (c) 甲烷转化为丙烷的反应途径. CH4*表示吸附于Pt上的甲烷; hv表示光照射; 路径1表示卡宾聚合; 路径2表示卡宾插入烷烃C―H键反应途经[44] Fig.5 (a) Dehydrogenation of methane over Pt@BT-O catalysts with different Pt loadings; (b) The distribution of produced hydrocarbons and methane conversion as a function of reaction time; (c) Proposed mechanism. CH4* indicates adsorption on Pt; hv indicates light irradiation; path 1 indicates carbene dimerization and path 2 shows carbene C―H insertion[44] |
Li等[59]设计了掺硅n型半导体GaN, 具有甲烷催化生成苯的作用. 如图6(a, b) SEM和TEM图像显示, 合成的氮化镓晶体具有六边形横截面, 并与硅衬底垂直排列, 沿C轴方向生长, 具有两个晶面(m晶面和c晶面), 形态从上到下略呈锥形. 室温下, 通过紫外光照射可以将甲烷有效地转化为苯(图6(c)), n-GaN催化剂表现最佳, 苯的选择性大于90%. 机理研究表明(图6(d)), 沿C轴方向, GaN纳米棒的晶格由带正电荷的Ga和带负电荷的N原子交替堆叠而成, 其中侧面为m晶面, 由Ga原子和N原子配位组成; 顶面为c晶面, 只包含一种原子(Ga或N). 因m晶面由Ga和N原子配位组成(Ga―N键的长度为0.195 nm, 甲烷的C―H键为0.109 nm), 能够沿C轴方向产生强静电极化, 从而拉伸m晶面表面上吸附的甲烷分子, 有效极化C―H键. 在紫外光照射下, 甲烷在GaN的m晶面被活化和解离并生成CH3−和H+. 然后H+被光电子还原成H2以及CH3−被空穴氧化生成甲基自由基. 两个甲基自由基通过C―C偶联结合生成乙烷, 乙烷脱氢生成乙烯. 最后, 经过环化和脱氢步骤生成苯. 这项开创性的工作首次证明了利用半导体氮化物建立甲烷光催化反应体系, 实现无氧条件下甲烷选择性转化为芳香族化合物, 为甲烷选择性转化这一催化领域的“圣杯”反应提供了新的研究思路.
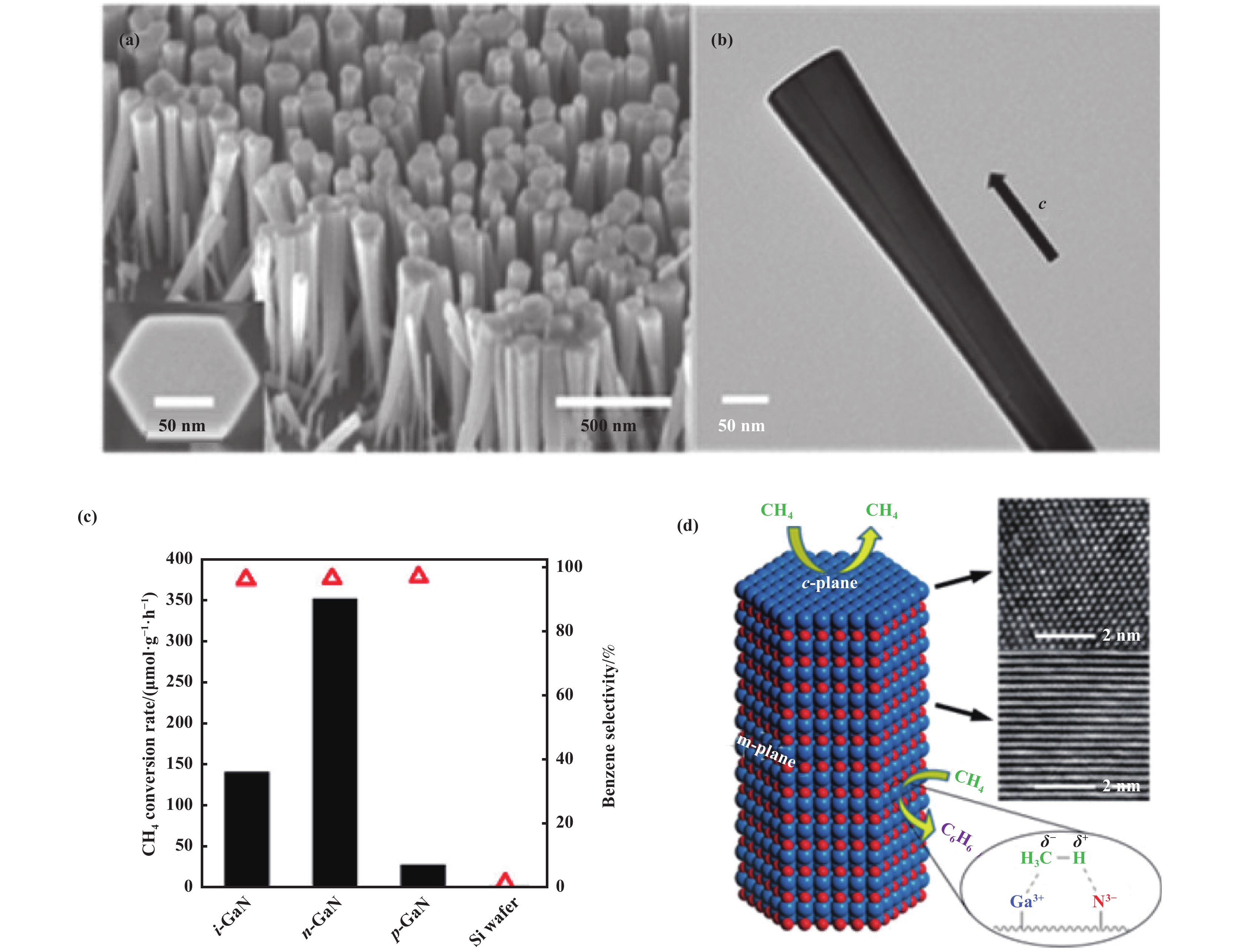
|
图 6 氮化镓纳米棒的(a) SEM图像和(b) TEM图像; (c)本征GaN NWs, n型GaN NWs, p型GaN NWs和纯Si片上的甲烷转化率和苯的选择性; (d) GaN的m晶面上甲烷C―H极化示意图[59] Fig.6 (a) SEM and (b) TEM images of Si-doped GaN nanowires; (c) Methane conversion rate and benzene selectivity over a slice of intrinsic GaN NWs, n-type GaN NWs, p-type GaN NWs, and pure Si substrate; (d) Schematic illustration of the methane molecule activated on the m-plane of GaN[59] |
OCM通过引入活性氧化剂O2, 可以显著提高反应速率. O2作为一种非常活跃的氧化剂, 很容易被光生电子还原为
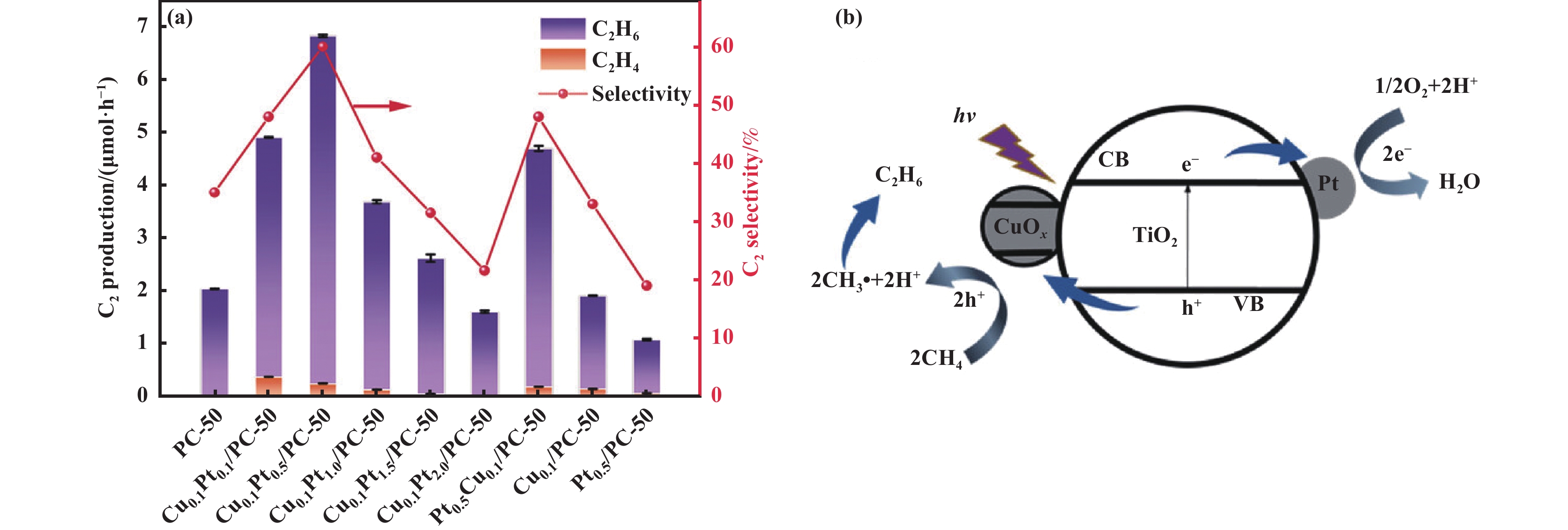
|
图 7 (a) 不同催化剂光催化甲烷氧化偶联为C2产物及其选择性; (b) Cu0.1Pt0.5/PC-50光催化OCM反应机理图[65] Fig.7 (a) C2 production and selectivity of photocatalytic OCM over different catalysts; (b) Proposed photocatalytic OCM process over Cu0.1Pt0.5/PC-50[65] |
Xiong等[52]报道了一种双金属修饰氧化锌的复合材料(ZnO-AuPd), 在温和条件下实现高效催化CH4为C2H4. 在优化复合材料金属负载量后(ZnO-AuPd2.7%), C2+化合物的产率为157.5 μmol·g−1, C2H4的选择性为33%, 同时具有良好的稳定循环性. 通过DRIFTS和XPS光谱分析CH4催化转化过程, 在Pd辅助下, 甲烷分子在氧化锌表面生成甲氧基, 然后脱氢再与甲基自由基偶联形成乙氧基, 最后进一步脱氢从催化剂表面解离得到乙烯(如图8). 这一反应途径表明CH4光催化转化不仅能发生甲基自由基相互偶联, 还可以是甲基自由基和其它中间体(如-CH2O)的交叉偶联, 为在温和条件下的甲烷转化机制和催化剂的设计提供了新的认识.
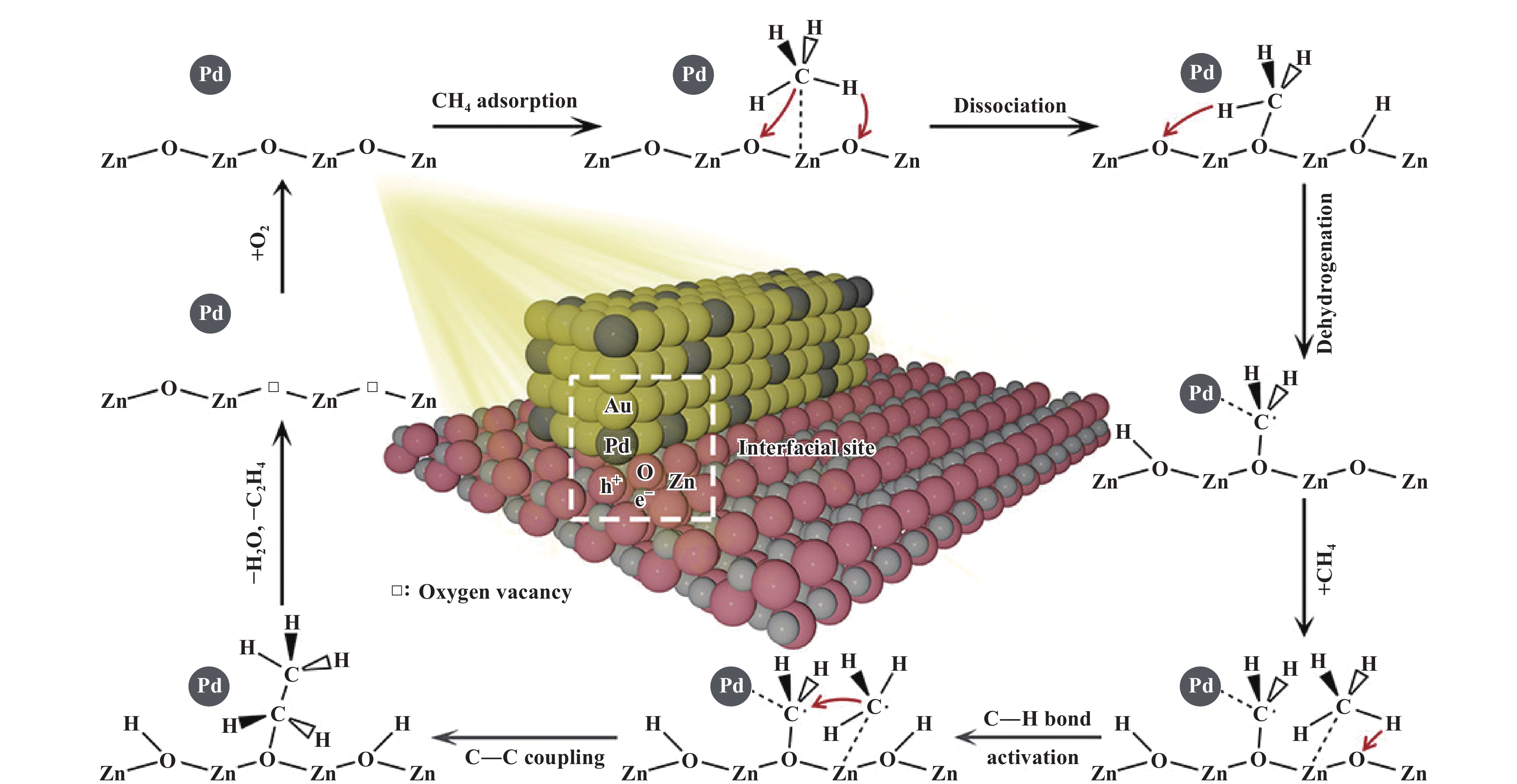
|
图 8 ZnO-AuPd催化剂借助表面烷氧基中间体光催化转化CH4为C2H4的示意图[52] Fig.8 Schematic illustration for photocatalytic conversion of CH4 to C2H4 through surface alkoxy intermediates in the case of ZnO-AuPd hybrid catalysts[52] |
在常温常压下, 甲烷直接转化为液体产物(如CH3OH、HCHO和CH3OOH[41, 66−68]的研究引起了科研人员浓厚的兴趣, 因为它们价值高且易于运输. 目前, 工业上采用间接途径从甲烷中合成含氧化合物, 而且需要在高温高压的条件下进行多步转换, 从而导致成本高, 产率低. 近年来, 光催化甲烷转化为含氧液态产物的研究取得了重大进展, 具有较高的转化率和选择性. Xie等[69]报道了多孔ZnO/Fe2O3纳米片用于光催化甲烷转化, 以水作为氧化剂将甲烷转化为甲醇, 选择性接近100%, 甲醇产率达到178.3 μmol·g−1, 同时也具有稳定的循环性能. 在Fe位点上的电荷积累不仅降低了甲烷的活化能, 而且增强了CH3OH的O―H键的极性, 阻止了CH3OH的裂解. 该工作使用水作为氧化剂, 另一优势是水本身是催化剂分散的溶剂, 它有助于氧合物从催化剂表面解吸, 可以显著抑制液体产物的过度氧化. Li等[70]设计了一种Cu-Pd/Anatase催化剂, 通过原位反应将Cu物种高度分散在催化剂上, 实现了温和条件下甲烷的高效转化, 甲醇产率高达
除C1产物外, 还有C2+含氧化合物(乙醇、乙酸等)也被报道. Zheng等[71]报道了一种空心多壳纳米球催化剂, 即CeO2@PdO@FeOx, 这种催化剂具有不对称的紧密相连界面, 使用O2作为氧化剂, 实现CH4光催化氧化制备乙醇. 在光强度为100 mW·cm−2, 没有光敏剂或牺牲剂的条件下, 乙醇产率达728 μmol·g−1·h−1, 同时具有良好的稳定性, 可以循环5次(图9(a, b)). 而且对比之前的光催化甲烷氧化反应, 该项工作比之前报道的性能更优越(图9(c)). 基于各种表征实验和理论计算, 提出了空心多壳CeO2@PdO@FeOx纳米球催化剂光催化CH4OR制乙醇的机理(图9(d)): 首先, CeO2@PdO@FeOx催化剂的FeOx层能够促进光化学还原为活性氧(ROS), 其次, 外部不对称的PdO/FeOx光活化CH4生成•CH3, 形成的•CH3进一步转移到内部不对称的CeO2/PdO界面生成CO. 空心多层壳结构最终促进了生成的•CH3和CO耦合生成乙醇, 而不是在外部表面上直接与•OH耦合生成乙醇. 在光催化过程中, 除了有效的光吸收和电荷分离外, 催化位点的合理设计和分布也很关键. 作者设计了中空的多壳纳米球光催化剂, 具有不对称的连接界面, 不同界面间的活性位点产生不同的中间体, 提供了一条新的反应路径, 两个不对称催化界面共同作用, 促进生成的•CH3和CO耦合生成乙醇, 最终实现甲烷的高效转化.
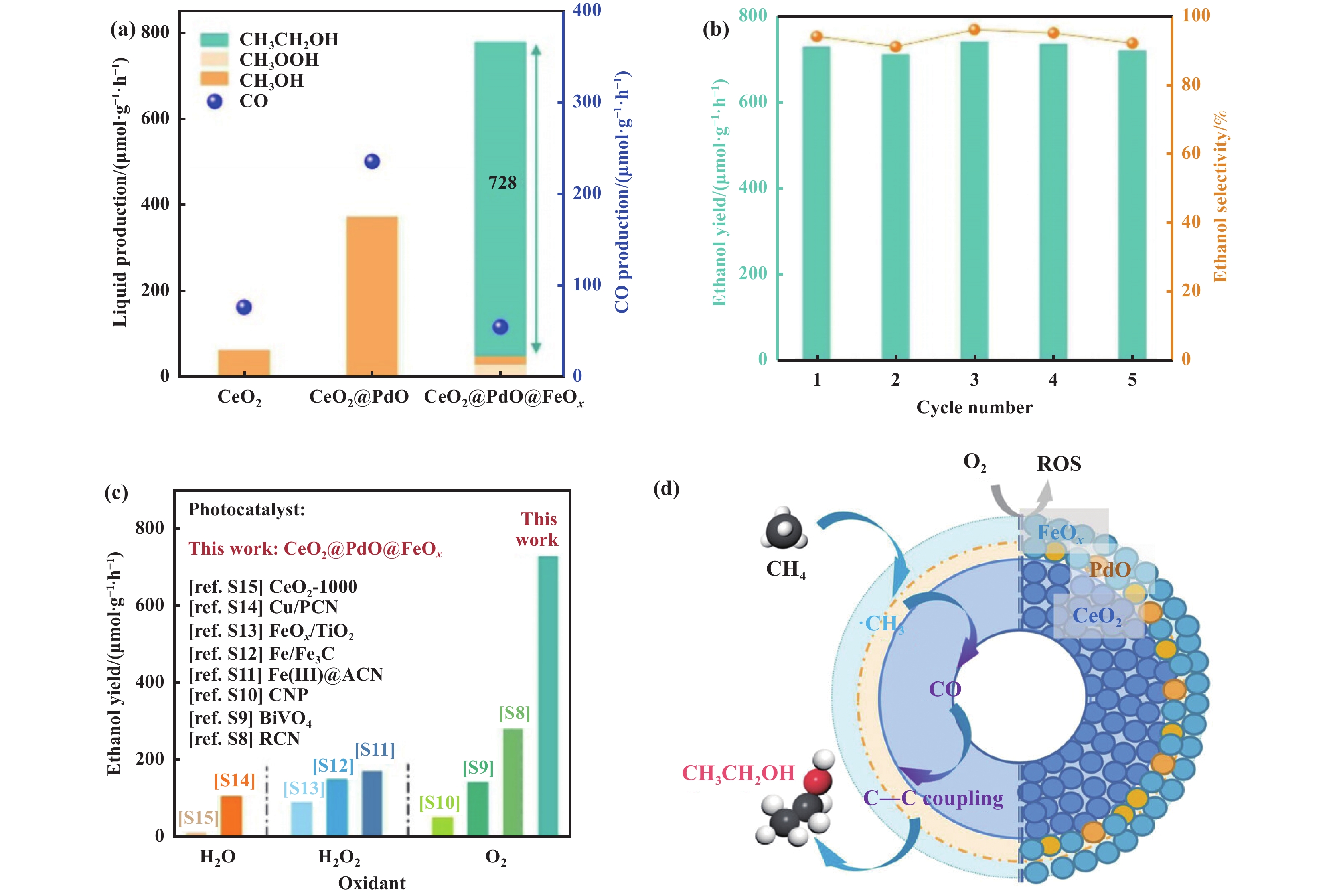
|
图 9 (a) 不同催化剂光催化CH4转化产率; (b) CeO2@PdO@FeOx光催化CH4OR循环稳定性; (c) CeO2@PdO@FeOx与其它报道的催化剂在室温下生成乙醇比较; (d) 空心多壳CeO2@PdO@FeOx纳米球光催化CH4氧化制乙醇的机理图[71] Fig.9 (a) Photocatalytic production rates of various catalysts; (b) Cyclic photocatalytic CH4OR stability of CeO2@PdO@FeOx; (c) Comparison of the ethanol yield of the CeO2@PdO@FeOx catalyst with other reported CH4OR photocatalysts to ethanol at room temperature; (d) Schematic of the photocatalytic CH4 oxidation to ethanol by the hollow CeO2@PdO@FeOx nanosphere [71] |
此外, 光催化反应条件的精确调控也是实现甲烷活化、抑制过氧化副反应的必要条件. Xiong等[72]构建了一种PdO/Pd-WO3异质界面复合材料, 实现光驱动甲烷转化为乙酸, 图10(a, b), 产率达到了1.5 mmol·g−1·h−1, 证明了光催化剂的再现性和流动反应装置的耐久性. 通过各种表征手段和理论计算, 揭示了反应机理(图10(c)): 在光照下, 由于•OH的作用, 甲烷可以分别在复合材料中的Pd和PdO位点上转化为甲基自由基和羰基中间体, 二者在界面处偶联成乙酰基前驱体, 最终水解为乙酸. 此外, 作者设计了一种光化学流动式反应装置, 将催化剂、甲烷和水三相混合, 提高了甲基自由基和碳基中间体的利用率, 并为CH4转化为氧化物开辟了一条途径.
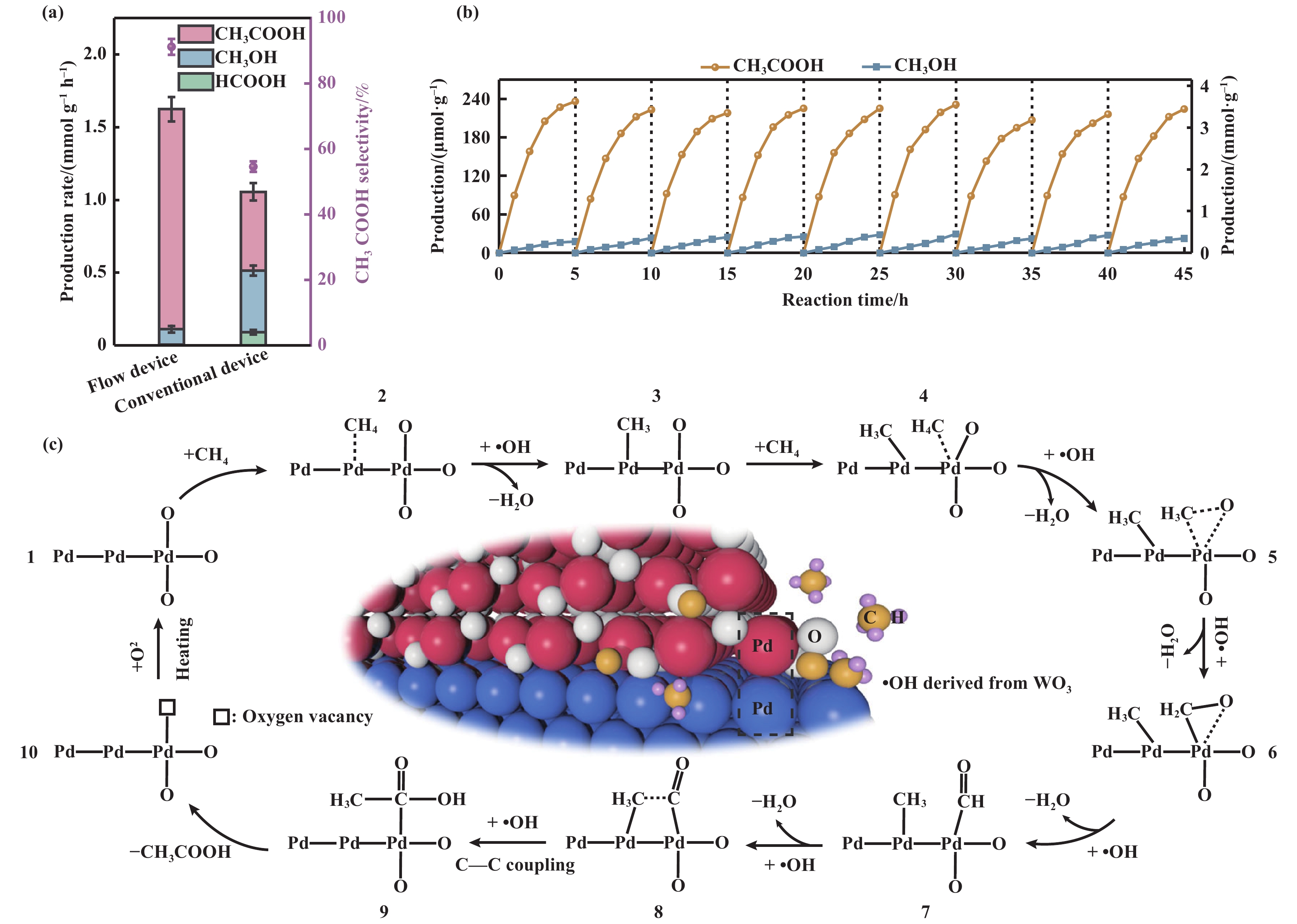
|
图 10 (a) PdO/Pd-WO3-2纳米复合材料光照3 h CH4转化为CH3COOH的产率和选择性; (b) PdO/Pd-WO3-2循环稳定性测试; (c) •OH自由基存在下, Pd/PdO异质界面上CH4光化学转化为CH3COOH的示意图[72] Fig.10 (a) Production rate and selectivity of photocatalytic CH4 conversion toward CH3COOH over PdO/Pd-WO3-2 nanocomposite for illumination 3 h; (b) Cyclic stability test of PdO/Pd-WO3-2 catalyst; (c) Schematic illustration for photochemical conversion of CH4 to CH3COOH over Pd/PdO heterointerface in the presence of •OH radicals[72] |
除了开发高效的光催化剂外, 光催化反应器的设计也是光催化甲烷转化的重点. 实现甲烷的高效转化要考虑影响光催化性能的各种因素(如流动方式、催化剂分散形式、热效应以及光源配置等), 进而选择最佳的光反应器. 目前光催化CH4转化主要通过气-固和气-固-液反应实现, 这两种反应体系都需要考虑混合和流动特性, 以获得反应物和光催化剂之间的最佳接触[73]. 下面将围绕这两种反应体系介绍相应的光催化反应器, 如图11(a)为间歇式的气-固反应器[61], 将气体反应物引入封闭的反应器中与催化剂直接接触, 光直接照射到暴露的光催化剂表面, 从而实现甲烷的转化[74]. 该反应器适用于反应缓慢, 催化剂与反应物接触时间较长的情况. 然而, 一些操作问题是不可避免的, 如密封性差、取样不方便、产物容易过氧化且难以从催化剂表面完全脱附, 导致产率低. 此外, 还有流动式的气-固反应器, 光催化剂被固定在特定的载体上, 允许催化过程连续操作, 流动模式加速了产物从催化剂表面的快速解吸, 从而避免了过度氧化. 但气体反应物与催化剂接触时间短, 可能导致产物浓度低. 为了解决这一问题, 降低气体流速和设计对气体反应物具有更高吸附能力的催化剂是潜在的解决方案. 如图11(b, c, d)所示, 为不同类型的气-固-液反应器[61, 75−76]. 在气-固-液光催化CH4转化中, CH4或CH4/O2构成气相, H2O(在某些系统中为H2O和H2O2)构成液相, 固相光催化剂悬浮在液相中. 由于水的良好溶剂化作用, 气-固-液体系更容易从CH4光催化氧化中获得液态氧化物, 如CH3OH、HCHO和HCOOH等. 此外, 在正常的水体系中, CH4的低溶解度限制了转化反应的速率. 为了提高CH4的溶解度, 近年来出现了高压反应器(图11(d)),通过增加气体压力来提高产率和选择性[77−78]. 与气-固体系不同, 由于溶剂的存在, 光子不能直接进入暴露的光催化剂表面. 因此, 在气-固-液光催化CH4转化中, 除三相接触外, 反应速率在很大程度上取决于照射在催化剂表面的光强, 而光强是由光照射方式和穿透深度决定的. 根据光照射方式, 气-固-液反应器又可以分为内照射、侧照射和顶照射. 如图11(b), 在内部照射时[73], 将灯置于反应器内部, 以获得较高的光利用率. 与侧面和顶部照射相比, 照射面积更大, 光传播距离更短. 然而, 内照射模式增加了反应器设计的复杂性, 并且内部空间的存在可能导致光催化剂分布不均匀; 如图11(c), 为侧边照射[75], 侧边发出的光落在反应堆的曲面上被反射, 容易造成光能损失, 而反应堆的另一侧则受到弱照射. 为达到均匀照明, 可以同时照亮反应器两侧, 使整个反应介质辐照均匀; 如图11(d),在顶部辐照中[79], 光落在浆料表面并穿过浆料到达反应器底部, 并且可以反射, 使光子利用效率高. 但是, 如果催化剂颜色较深, 顶部照射的照射面积相对较小, 穿透深度降低, 使得光线难以通过浆料并被反射[80]. 气-固或气-固-液反应器, 各有所长, 在催化甲烷过程中要选择合适的装置, 才能更好的进行甲烷选择性转化和产物的分离.
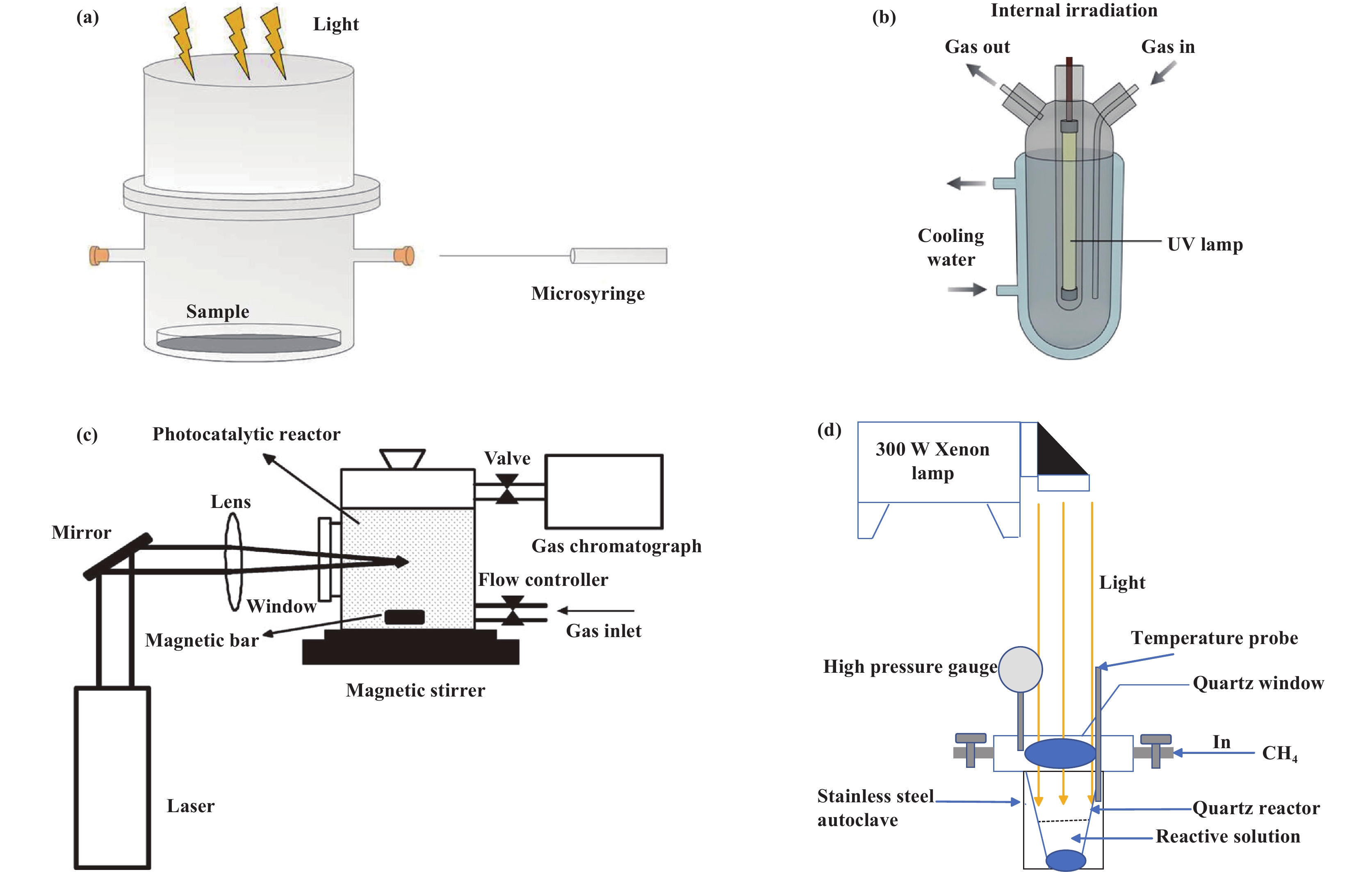
|
图 11 气-固光催化 CH4 转化反应器: (a)间歇式反应器[61]. 气-固-液光催化 CH4 转化反应器: (b) 内照射[73]; (c) 侧照射[75]; (d) 顶照射[79] Fig.11 Reactors for gas-solid photocatalytic CH4 conversion: (a) batch reactor[61]. Reactors for gas-solid-liquid photocatalytic CH4 conversion: (b) internal irradiation mode[73]; (c) side irradiation mode[75]; (d) top irradiation mode[79] |
综上所述, 我们总结了甲烷催化转化的基本原理和最新研究进展. 在温和条件下将甲烷转化成碳氢化合物或甲醇、乙酸等含氧化合物, 对减少环境污染、助力“双碳”目标实现具有十分重要的意义. 与热催化甲烷重整制合成气再转化为高附加值化学品过程相比, 温和条件下光催化甲烷转化可以避免成本高、过程复杂和过度氧化等问题, 实现“零碳”排放. 光催化甲烷转化技术不仅减少了能源的消耗, 而且解决了催化剂在高温下失活的问题, 拓宽了产品使用范围, 同时将甲烷一步转化为高附加值化学品更加经济环保. 然而, 尽管光催化甲烷转化的研究取得了很好的进展, 但是光催化甲烷在现阶段的研究中也面临很大的挑战. 比如, 在催化剂方面: 目前已报道的大多数催化剂的活性有待提高, 其表观量子效率相对较低, 限制了该技术的实际应用和大规模推广; 其次, 催化剂的稳定性不足, 在光催化反应过程中, 催化剂可能受到光腐蚀等各种因素的影响, 导致其结构和性能降低. 此外, 甲烷转化的产物多样, 如果想要得到高附加值的产物(如甲醇、乙烯等), 需要催化剂对反应具有较高的选择性, 但目前的催化剂在选择性控制方面还存在不足, 往往转化为多种产物, 从而降低了目标产物的产率. 另外在反应机理方面: 反应过程复杂且不明确, 光催化甲烷转化涉及到光物理和光化学过程, 反应机理较为复杂. 对于每一种甲烷转化反应背后的具体机理, 包括光生载流子的产生、转移、参与反应的中间体等, 目前了解对的仍然有限. 这给催化剂的设计和反应条件的优化带来了困难, 难以有针对性地进行技术改进. 中间产物检测困难: 光催化甲烷转化过程中的中间产物寿命短、浓度低, 对其进行准确检测和分析具有挑战性. 然而, 中间产物的信息对于深入理解反应机理和优化反应至关重要, 缺乏准确的中间产物数据会影响研究的深入开展等.
目前, 在温和条件下光催化甲烷转化仍面临很多的挑战, 结合以上存在的问题和目前的研究和基本认识, 提出了解决方案阐述如下: (1)目前报道的光催化甲烷转化的产物主要是低碳含氧化合物和烃类, 只有少数研究报道选择性地将甲烷转化为C3+化合物(如丙烷和苯), 而且其产率和选择性较低, 可以进行光电催化甲烷转化研究, 用外部电压来促进电荷转移过程, 实现甲烷转化为多碳高价值产物和提高产率, 为甲烷转化开辟一条新途经; (2)最大限度地利用太阳能, 目前大多数甲烷转化系统在紫外光下进行, 只能吸收小部分太阳光谱, 约占太阳光的5%, 设计光催化甲烷转化的新型光催化剂, 开发窄带隙半导体或对可见光到红外光范围有响应的催化剂, 充分利用太阳能, 合理设计活性位点, 如C3N4、MOF和COFs等, 这些有机骨架具有较强的甲烷吸附能力, 可以精确调节官能团来控制甲烷活化的位点, 是很有前途的甲烷转化光催化剂; (3)多数半导体光催化剂中, 电子和空穴容易快速复合. 开发具有可见光吸收能力、高电子空穴分离和转移效率的光催化剂是光催化甲烷转化领域的关键和持续研究的方向; (4)反应机理也需要进一步研究, 以揭示可靠的反应途径, 需要发展相应的原位检测方法(如时间分辨瞬态吸收光谱、EPR光谱等), 进一步探究光催化甲烷转化过程的复杂细节; (5)反应装置的设计, 先进的光反应器也是优化光催化甲烷转化反应的一个关键因素. 光反应器既要保证反应物的高传质效率, 又要考虑光路结构和能量损失, 使太阳能最大化能源利用.
总之, 甲烷催化转化仍然面临许多挑战, 需要继续探索, 但光驱动C―H键的活化为未来甲烷的转化提供了一条新的可持续的途径, 有望在以后实现温和条件下甲烷的高效转化. 随着科技的发展和研究的深入, 将甲烷转化为高附加值化学品, 缓解气候变暖, 共建美丽地球家园的最终目标必将实现.
| [1] |
Global assessment of oil and gas methane ultra-emitters[J]. Science, 2022, 375(6580): 557–561.
DOI:10.1126/science.abj4351 |
| [2] |
Impacts of shale gas advancements on natural gas utilization in the United States[J]. Energy Technol, 2014, 2(12): 953–967.
DOI:10.1002/ente.201402061 |
| [3] |
Active sites and mechanisms in the direct conversion of methane to methanol using Cu in zeolitic hosts: A critical examination[J]. Chem Soc Rev, 2020, 49(5): 1449–1486.
DOI:10.1039/C7CS00709D |
| [4] |
Progress and key challenges in catalytic combustion of lean methane[J]. J Energy Chem, 2022, 75: 173–215.
DOI:10.1016/j.jechem.2022.08.001 |
| [5] |
Systematic structure-property relationship studies in palladium-catalyzed methane complete combustion[J]. ACS Catal, 2017, 7(11): 7810–7821.
DOI:10.1021/acscatal.7b02414 |
| [6] |
A review on hydrogen production and utilization: Challenges and opportunities[J]. Int J Hydrogen Energy, 2022, 47(62): 26238–26264.
DOI:10.1016/j.ijhydene.2021.11.149 |
| [7] |
Multi-scale energy systems engineering for optimal natural gas utilization[J]. Catal Today, 2020, 356: 18–26.
DOI:10.1016/j.cattod.2019.09.009 |
| [8] |
Solar-energy-mediated methane conversion[J]. Joule, 2019, 3(7): 1606–1636.
DOI:10.1016/j.joule.2019.06.023 |
| [9] |
Chemistry in the center for catalytic hydrocarbon functionalization: An energy frontier research center[J]. Catal Lett, 2010, 141(2): 213–221.
DOI:10.1007/s10562-010-0499-5 |
| [10] |
Direct, nonoxidative conversion of methane to ethylene, aromatics, and hydrogen[J]. Science, 2014, 344(6184): 616–619.
DOI:10.1126/science.1253150 |
| [11] |
Direct conversion of methane to value-added chemicals over heterogeneous catalysts: Challenges and prospects[J]. Chem Rev, 2017, 117(13): 8497–8520.
DOI:10.1021/acs.chemrev.6b00715 |
| [12] |
Photocatalytic methane conversion to high-value chemicals[J]. Carbon Future, 2024, 1(1): 9200004.
DOI:10.26599/CF.2023.9200004 |
| [13] |
Strategies for the direct catalytic valorization of methane using heterogeneous catalysis: Challenges and opportunities[J]. ACS Catal, 2016, 6(5): 2965–2981.
DOI:10.1021/acscatal.6b00428 |
| [14] |
Competitive hydrogen-atom abstraction versus oxygen-atom and electron transfers in gas-phase reactions of [X4O10]·+ (X=P, V) with C2H4[J]. Chem Eur J, 2010, 16(15): 4452–4456.
DOI:10.1002/chem.201000310 |
| [15] |
Thermal hydrogen-atom transfer from methane: The role of radicals and spin states in oxo-cluster chemistry[J]. Angew Chem Int Edit, 2012, 51(23): 5544–5555.
DOI:10.1002/anie.201108363 |
| [16] |
Dry reforming of methane by stable Ni-Mo nanocatalysts on single-crystalline MgO[J]. Science, 2020, 367(6479): 777–781.
DOI:10.1126/science.aav2412 |
| [17] |
Carbon-based catalysts for Fischer-Tropsch synthesis[J]. Chem Soc Rev, 2021, 50(4): 2337–2366.
DOI:10.1039/D0CS00905A |
| [18] |
State-of-the-art catalysts for CH4 steam reforming at low temperature[J]. Int J Hydrogen Energy, 2014, 39(5): 1979–1997.
DOI:10.1016/j.ijhydene.2013.12.001 |
| [19] |
The active site of methanol synthesis over Cu/ZnO/Al2O3 industrial catalysts[J]. Science, 2012, 336(6083): 893–897.
DOI:10.1126/science.1219831 |
| [20] |
Advances in the development of novel cobalt Fischer-Tropsch catalysts for synthesis of long-chain hydrocarbons and clean fuels[J]. Chem Rev, 2007, 107(5): 1692–1744.
DOI:10.1021/cr050972v |
| [21] |
Direct methane conversion routes to chemicals and fuels[J]. Catal Today, 2011, 171(1): 15–23.
DOI:10.1016/j.cattod.2011.02.028 |
| [22] |
Xu W B, Wang Z, Huang C D, et al. Direct methane conversion to acetic acid: From homogeneous catalysis to heterogeneous catalysis[J]. ChemCatChem, 2024, DOI: 10.1002/cctc.202400692.
|
| [23] |
Surface strategies for catalytic CO2 reduction: From two-dimensional materials to nanoclusters to single atoms[J]. Chem Soc Rev, 2019, 48(21): 5310–5349.
DOI:10.1039/C9CS00163H |
| [24] |
Tetracycline sensitizes TiO2 for visible light photocatalytic degradation via ligand-to-metal charge transfer[J]. Chin Chem Lett, 2022, 33(12): 5218–5222.
DOI:10.1016/j.cclet.2022.01.067 |
| [25] |
Precisely tailoring nitrogen defects in carbon nitride for efficient photocatalytic overall water splitting[J]. ACS Appl Mater Interfaces, 2022, 14(3): 3970–3979.
DOI:10.1021/acsami.1c19638 |
| [26] |
Efficiency accreditation and testing protocols for particulate photocatalysts toward solar fuel production[J]. Joule, 2021, 5(2): 344–359.
DOI:10.1016/j.joule.2021.01.001 |
| [27] |
Reactions of methane and ethane with hole centers O−[J]. J Catal, 1978, 55(3): 384–393.
DOI:10.1016/0021-9517(78)90225-7 |
| [28] |
Photoinduced non-oxidative coupling of methane over H-zeolites around room temperature[J]. Microporous Mesoporous Mater, 2002, 51(3): 223–231.
DOI:10.1016/S1387-1811(02)00268-8 |
| [29] |
Photodriven methane conversion on transition metal oxide catalyst: Recent progress and prospects[J]. Adv Sci, 2023, 11(8): 2305471.
DOI:10.1002/advs.202305471 |
| [30] |
Understanding complete oxidation of methane on spinel oxides at a molecular level[J]. Nat Commun, 2015, 6: 7798.
DOI:10.1038/ncomms8798 |
| [31] |
In situ oxidation of carbon-encapsulated cobalt nanocapsules creates highly active cobalt oxide catalysts for hydrocarbon combustion[J]. Nat Commun, 2015, 6: 7181.
DOI:10.1038/ncomms8181 |
| [32] |
Methane activation: The past and future[J]. Energy Environ Sci, 2014, 7(8): 2580–2591.
DOI:10.1039/C4EE00604F |
| [33] |
Research progress in catalytic total oxidation of methane(甲烷完全催化氧化研究进展)[J]. J Inorg Mater(无机材料学报), 2023, 38(11): 1245–1256.
DOI:10.15541/jim20230117 |
| [34] |
Advances in methane conversion processes[J]. Catal Today, 2017, 285: 147–158.
DOI:10.1016/j.cattod.2017.01.023 |
| [35] |
Generation and detection of reactive oxygen species in photocatalysis[J]. Chem Rev, 2017, 117(17): 11302–11336.
DOI:10.1021/acs.chemrev.7b00161 |
| [36] |
Heterogeneous catalysis[J]. Angew Chem Int Edit, 2015, 54(11): 3465–3520.
DOI:10.1002/anie.201410738 |
| [37] |
Ni-phyllosilicate structure derived Ni-SiO2-MgO catalysts for bi-reforming applications: Acidity, basicity and thermal stability[J]. Catal Sci Technol, 2018, 8(6): 1730–1742.
DOI:10.1039/C7CY02475D |
| [38] |
Sulfone-decorated conjugated organic polymers activate oxygen for photocatalytic methane conversion[J]. Angew Chem Int Edit, 2022, 61(28): e202204661.
DOI:10.1002/anie.202204661 |
| [39] |
Facet-dependent enhancement in the activity of bismuth vanadate microcrystals for the photocatalytic conversion of methane to methanol[J]. ACS Appl Nano Mater, 2018, 1(12): 6683–6691.
DOI:10.1021/acsanm.8b01490 |
| [40] |
Direct photo-oxidation of methane to methanol over a mono-iron hydroxyl site[J]. Nat Mater, 2022, 21(8): 932–938.
DOI:10.1038/s41563-022-01279-1 |
| [41] |
Highly selective photocatalytic methane oxidation to methanol using CO2 as a soft oxidant[J]. ACS Sustainable Chem Eng, 2023, 11(14): 5537–5546.
DOI:10.1021/acssuschemeng.2c07355 |
| [42] |
Evoked methane photocatalytic conversion to C2 oxygenates over ceria with oxygen vacancy[J]. Catalysts, 2020, 10(2): 196.
DOI:10.3390/catal10020196 |
| [43] |
Non-oxidative coupling of methane: N-type doping of niobium single atoms in TiO2-SiO2 induces electron localization[J]. Angew Chem Int Edit, 2021, 60(21): 11901–11909.
DOI:10.1002/anie.202016420 |
| [44] |
Visible-light-driven non-oxidative dehydrogenation of alkanes at ambient conditions[J]. Nat Energy, 2022, 7(11): 1042–1051.
DOI:10.1038/s41560-022-01127-1 |
| [45] |
A selective Au-ZnO/TiO2 hybrid photocatalyst for oxidative coupling of methane to ethane with dioxygen[J]. Nat Catal, 2021, 4(12): 1032–1042.
DOI:10.1038/s41929-021-00708-9 |
| [46] |
Methane conversion to ethylene and aromatics on PtSn catalysts[J]. ACS Catal, 2017, 7(3): 2088–2100.
DOI:10.1021/acscatal.6b02724 |
| [47] |
Catalytic non-oxidative coupling of methane on Ta8O2+[J]. J Am Chem Soc, 2020, 142(12): 5862–5869.
DOI:10.1021/jacs.0c01306 |
| [48] |
Photocatalytic nonoxidative coupling of methane on gallium oxide and silica-supported gallium oxide[J]. J Catal, 2008, 257(2): 396–402.
DOI:10.1016/j.jcat.2008.05.022 |
| [49] |
Photocatalytic nonoxidative coupling of methane to ethylene over carbon-doped ZnO/Au catalysts[J]. Sci China-Chem, 2023, 66(11): 3252–3261.
DOI:10.1007/s11426-023-1766-8 |
| [50] |
Highly efficient light-driven methane coupling under ambient conditions based on an integrated design of a photocatalytic system[J]. Green Chem, 2020, 22(14): 4669–4675.
DOI:10.1039/D0GC01608J |
| [51] |
Stoichiometric methane conversion to ethane using photochemical looping at ambient temperature[J]. Nat Energy, 2020, 5(7): 511–519.
DOI:10.1038/s41560-020-0616-7 |
| [52] |
Pd-modified ZnO-Au enabling alkoxy intermediates formation and dehydrogenation for photocatalytic conversion of methane to ethylene[J]. J Am Chem Soc, 2020, 143(1): 269–278.
DOI:10.1021/jacs.0c10369 |
| [53] |
Direct functionalization of methane into ethanol over copper modified polymeric carbon nitride via photocatalysis[J]. Nat Commun, 2019, 10: 506.
DOI:10.1038/s41467-019-08454-0 |
| [54] |
Direct and selective photocatalytic oxidation of CH4 to oxygenates with O2 on cocatalysts/ZnO at room temperature in water[J]. J Am Chem Soc, 2019, 141(51): 20507–20515.
DOI:10.1021/jacs.9b11440 |
| [55] |
Atomically dispersed nickel anchored on a nitrogen-doped carbon/TiO2 composite for efficient and selective photocatalytic CH4 oxidation to oxygenates[J]. Angew Chem Int Edit, 2023, 62(4): e202215057.
DOI:10.1002/anie.202215057 |
| [56] |
Oxo dicopper anchored on carbon nitride for selective oxidation of methane[J]. Nat Commun, 2022, 13(1): 1375.
DOI:10.1038/s41467-022-28987-1 |
| [57] |
High-rate CH4-to-C2H6 photoconversion enabled by Au/ZnO porous nanosheets under oxygen-free system[J]. Sci China-Chem, 2023, 67(3): 869–875.
DOI:10.1007/s11426-023-1792-8 |
| [58] |
Bimetallic single atom/nanoparticle ensemble for efficient photochemical cascade synthesis of ethylene from methane[J]. Angew Chem Int Edit, 2024, 63(34): e202407791.
DOI:10.1002/anie.202407791 |
| [59] |
Photoinduced conversion of methane into benzene over GaN nanowires[J]. J Am Chem Soc, 2014, 136(22): 7793–7796.
DOI:10.1021/ja5004119 |
| [60] |
Fan Y Y , Zhou W C, Qiu X Y, et al. Selective photocata-lytic oxidation of methane by quantum-sized bismuth vanadate[J]. Nat Sustainability, 2021, 4 (6): 509-515.
|
| [61] |
Photocatalytic oxidation of methane over silver decorated zinc oxide nanocatalysts[J]. Nat Commun, 2016, 7: 12273.
DOI:10.1038/ncomms12273 |
| [62] |
Partial oxidation of methane on co-precipitated Ni-Mg/Al catalysts modified with copper or iron[J]. Int J Hydrogen Energy, 2017, 42(22): 15002–15009.
DOI:10.1016/j.ijhydene.2017.04.281 |
| [63] |
Photocatalytic oxidation of methane over SrCO3 decorated SrTiO3 nanocatalysts via a synergistic effect[J]. Phys Chem Chem Phys, 2016, 18(46): 31400–31409.
DOI:10.1039/C6CP04604E |
| [64] |
Research progress in low-temperature catalytic direct conversion of methane to C2 value-added chemicals(低温催化甲烷直接转化为C2增值化学品研究进展)[J]. Sci Sin Chim(中国科学: 化学), 2024, 54(3): 353–369.
DOI:10.1360/SSC-2023-0226 |
| [65] |
Platinum-and CuOx-decorated TiO2 photocatalyst for oxidative coupling of methane to C2 hydrocarbons in a flow reactor[J]. Angew Chem Int Edit, 2020, 59(44): 19702–19707.
DOI:10.1002/anie.202007557 |
| [66] |
Selective anaerobic oxidation of methane enables direct synthesis of methanol[J]. Science, 2017, 356(6337): 523–527.
DOI:10.1126/science.aam9035 |
| [67] |
Characteristics of the photocatalytic oxidation of methane into methanol on V-containing MCM-41 catalysts[J]. Catal Lett, 2008, 124(1/2): 80–84.
DOI:10.1007/s10562-008-9491-8 |
| [68] |
Mesoporous WO3 photocatalyst for the partial oxidation of methane to methanol using electron scavengers[J]. Appl Catal B-Environ, 2015, 163: 150–155.
DOI:10.1016/j.apcatb.2014.07.055 |
| [69] |
Room-temperature photooxidation of CH4 to CH3OH with nearly 100% selectivity over hetero-ZnO/Fe2O3 porous nanosheets[J]. J Am Chem Soc, 2022, 144(27): 12357–12366.
DOI:10.1021/jacs.2c03866 |
| [70] |
Wang L Q, Jin J T, Li W Z, et al. Highly selective catalytic oxidation of methane to methanol using Cu-Pd/anatase[J]. Energy Environ Sci, 2024, DOI: 10.1039/d4ee02671c.
|
| [71] |
Photocatalytic CH4-to-ethanol conversion on asymmetric multishelled interfaces[J]. J Am Chem Soc, 2024, 146(37): 25870–25877.
DOI:10.1021/jacs.4c08801 |
| [72] |
Light-driven flow synthesis of acetic acid from methane with chemical looping[J]. Nat Commun, 2023, 14(1): 3047.
DOI:10.1038/s41467-023-38731-y |
| [73] |
Best practices for experiments and reports in photocatalytic methane conversion[J]. Angew Chem Int Edit, 2024, 63(24): e202404658.
DOI:10.1002/anie.202404658 |
| [74] |
Photocatalytic ethylene production by oxidative dehydrogenation of ethane with dioxygen on ZnO-supported PdZn intermetallic nanoparticles[J]. Nat Commun, 2024, 15(1): 789.
DOI:10.1038/s41467-024-45031-6 |
| [75] |
Photo-catalytic conversion of methane into methanol using visible laser[J]. Appl Catal A-Gen, 2003, 243(1): 165–174.
DOI:10.1016/S0926-860X(02)00562-8 |
| [76] |
Recent advances in photocatalytic oxidation of methane to methanol[J]. Molecules, 2022, 27(17): 5496.
DOI:10.3390/molecules27175496 |
| [77] |
Defective ZnO nanoplates supported AuPd nanoparticles for efficient photocatalytic methane oxidation to oxygenates[J]. Adv Energy Mater, 2024, 14(11): 2303642.
DOI:10.1002/aenm.202303642 |
| [78] |
Elevating photooxidation of methane to formaldehyde via TiO2 crystal phase engineering[J]. J Am Chem Soc, 2022, 144(35): 15977–15987.
DOI:10.1021/jacs.2c04884 |
| [79] |
Synergistic photocatalysis-fenton reaction for selective conversion of methane to methanol at room temperature[J]. Catal Sci Technol, 2020, 10(8): 2329–2332.
DOI:10.1039/D0CY00028K |
| [80] |
On the problem of comparing rates or apparent quantum yields in heterogeneous photocatalysis[J]. Angew Chem Int Edit, 2010, 49(50): 9588–9589.
DOI:10.1002/anie.201002653 |
 2025, Vol. 39
2025, Vol. 39