一直以来, 经典的化学法作为分子合成的主要手段取得了突飞猛进的发展. 然而, 随着科技的进步和对环境保护要求的提升, 依赖高能耗、高温及高压条件的反应过程逐渐显得难以胜任, 不符合绿色发展的需求. 相比而言, 酶催化因其环境友好已经发展成为这种经典方法的替代方案[1−3]. 过氧化物酶是一系列酶的总称, 它们能够利用过氧化氢或其他无机、有机过氧化物作为氧化剂, 催化不同底物的氧化反应, 并已广泛应用于多个领域. 其中, 辣根过氧化物酶(HRP), 一种源自辣根的酶类, 作为过氧化物酶家族的一员, 现已实现商业化供应. 在科学研究方面, HRP常用于ELISA等免疫检测试剂盒中, 作为标记酶提高检测灵敏度; 而在污水处理领域, HRP则展现出其催化能力, 能有效地将工业废水中的酚类污染物氧化成沉淀聚合物, 从而减轻对环境的污染; 在食品领域, HRP也用于食品添加剂、保鲜和检测, 确保食品安全[4−19]. 在有机合成方面, HRP能够催化多种有机物的氧化反应, 如酚类化合物的氧化聚合, 从而生成具有特定功能的高分子材料. HRP还被用作电化学介体, 参与醇的电催化氧化过程, 以及用于合成导电聚合物等. 虽然基于HRP催化得到了日益拓展, 但在催化特定反应时仍具有一定的局限性. 本文结合HRP的结构与催化特性, 详细介绍HRP在羟基化反应、硫醚氧化、聚合和偶联等有机合成中的应用, 并对催化活性的优化策略进行概述.
1 HRP的结构与催化特性HRP是一种由无色的酶蛋白和棕色的铁卟啉辅基结合而成的糖蛋白, 含有约18%的中性糖和氨基糖, 它由300多个氨基酸残基通过肽键连接而成, 并形成4个二硫键, 从而构成稳定的三维结构, 其相对分子质量约为
以酚氧化为例, 首先静息态的HRP血红素活性中心在H2O2驱动下, 与血红素结构中铁中心结合形成前驱体复合物, 随后脱去一分子H2O, 得到高活性中间体Compound I(FeIV=O), 血红素铁中心由原来的三价(FeIII)变为高氧化态的四价(FeIV), 然后位于活性中心附近的苯酚通过单电子转移被氧化为相应的苯氧基阳离子, 而卟啉自由基阳离子被还原为中性卟啉, 随后苯氧基阳离子去质子化之后形成苯氧自由基[23], 这种机制在生物化学中被称为不可逆乒乓机制[24−25]. 苯氧基的质子被碱夺取, 形成Compound II[26], 这个物种继续氧化等量的苯酚形成苯氧自由基, 最终回到静息态完成再生(图1). 因此, 在一个催化循环中, 两个等量的苯酚被一个等量的H2O2氧化, 产生两个苯氧自由基和一个水分子[27]. 通过紫外-可见吸收光谱可以将不同的催化中间体与天然结构区分开来. HRP作为一种具有显著催化特性的酶类, 其特性主要体现在以下几方面.
1.1 广泛的底物适应性HRP能够催化多种类型的底物发生氧化反应, 这主要得益于其酶蛋白与辅基(铁卟啉)的特殊结构, 这种结构使得HRP能够与多种底物发生特异性的相互作用, 并催化其氧化反应. 例如, HRP可以催化酚类、胺类、醇类等多种有机化合物的氧化反应[28−30], 生成相应的氧化产物. 此外, HRP还可以与一些无机物如过氧化氢等发生反应[31], 进一步扩展了其底物范围. 这种广泛的底物适应性使得HRP在生物医学、环境保护和食品工业等领域具有广泛的应用前景.
1.2 高效的催化效率HRP具有非常高的催化效率, 能够在温和的反应条件下迅速催化底物的氧化反应, 其催化效率主要得益于酶蛋白与辅基之间的协同作用, 以及酶分子内部的高效传质和能量转换机制. HRP的催化效率通常通过测定其米氏常数(Km)和周转数(Kcat)的比值(Kcat/Km)来评估, 比值越高, 意味着酶在较低底物浓度下能更高效地转化底物, 展现出酶的高效性和特异性. 此外, HRP的催化效率还受到温度、pH值、离子强度等环境因素的影响[32−33], 但即使在不利条件下, HRP仍能保持一定的催化活性.
1.3 稳定的催化性能HRP之所以能在较长时间内保持稳定的催化活性, 关键在于其酶蛋白结构的坚固以及与辅基之间紧密结合的特性. HRP能够有效抵御高温、酸碱环境以及有机溶剂等多种不利因素的侵蚀, 展现出卓越的热稳定性和化学稳定性[32]. 同时, 辅基与酶蛋白之间形成的牢固联系, 确保了HRP在催化过程中性质保持稳定. 除此之外, 通过采用诸如固定化、化学修饰等先进的技术手段[34], 可以进一步增强HRP的稳定性, 从而使其能够在更多不同的体系中得到广泛应用.
2 HRP在有机合成中的应用HRP在有机合成领域具有广泛的应用, 它能够利用H2O2作为氧源驱动多种有机底物进行转化, 从而生成具有独特结构和功能性的有机产物. 近年来, 研究者们通过定点突变、基因重组等技术对HRP进行改造以提高其催化活性和稳定性. 如通过引入特定的氨基酸突变改变HRP的底物结合口袋, 从而拓宽其底物范围. 这些研究不仅拓展了HRP的应用范围, 也为开发更高效、更环保的有机合成方法提供了有力支持.
2.1 羟基化反应在有机化合物的合成中, 特别是在药物分子的合成中引入羟基是一项至关重要的反应. 采用化学法可能需要冗长的合成过程, 然而酶法合成只需要一步就可以完成. 例如, Krishna等[28]报道了一种光谱法定量评价HRP/H2O2对4-氨基-5-羟基萘-2,7-二磺酸(AHNDSA)的羟基化工作, 作者能够快速监测底物的羟基化转化研究, 同时该研究也是一种快速方便测定HRP的酶活性的方法, 动力学结果显示催化效率优于众所周知的愈创木酚方法. Prota等[35]报道了利用HRP氧化多巴胺的研究, 发现芳香环上能够引入羟基基团, 这一反应并非直接进行, 而是先经历了多巴胺转化为醌式结构作为中间体的过程, 该项研究验证了含有多巴胺结构的类似物其氧化的选择性位点为苯环而非苯环的阿尔法位(图2). 此外, 表1列出了典型的HRP在羟基化反应中的应用, 可催化苯、苯酚及氨基酚底物的羟基化反应[28, 36−40].
| 表 1 HRP在羟基化反应中的应用 Table 1 Application of HRP in hydroxylation reaction |
HRP除了能将芳香族化合物进行羟基化反应之外, 对硫醚类化合物也能进行不对称氧化得到具有重要功能的手性亚砜产物, 但对于所形成的亚砜的产率和对映体选择性的最优实验方案尚未建立, 同时由于HRP自身结构原因导致对映选择性较低. Ozaki研究小组[41]利用基因工程策略对HRP结构进行简单的修饰, 如用亮氨酸取代天然结构中的苯丙氨酸, 可以提高对硫醚氧化反应的对映体选择性, 可将苯基乙基硫醚的对映体选择性由35%提高到94%. 对于苯环上具有不同电子效应的取代基的对映体选择性也具有明显的提升到72%~97%(图3). 虽然HRP能够不对称催化硫醚底物氧化, 但高浓度的硫醚底物和有机溶剂会导致酶失活, 进而影响其催化活性. 为了有效避免HRP失活情况, Ferrer等[42]利用溶胶-凝胶基质封装HRP, 以获得一种多相催化剂. 他们以苯甲硫醚为模式底物, 对其进行选择性氧化评价氧转移催化性能, 同时选取容易导致HRP失活的有机溶剂-乙腈, 考察溶胶-凝胶基质对酶的保护作用. 研究发现, 封装后的HRP催化转化率由8%提升到48%, 对映体选择性从64%提升到90%. 此外, 这种多相催化剂可以通过普通过滤的方式进行回收. 此外, 表2列出了典型的HRP在硫醚氧化反应中的应用, 可实现对异丙嗪、过硫化物和苯硫醚及其衍生物底物的催化氧化反应[43−49].

|
图 3 HRP催化硫醚氧化反应 Fig.3 Oxidation of thioether catalyzed by HRP |
| 表 2 HRP在硫醚氧化反应中的应用 Table 2 Application of HRP in thioether oxidation reaction |
聚合反应是把低分子量的单体转化成高分子量的聚合物的过程, 具有可塑、成纤、成膜、高弹等性能和多种用途. 相较于传统方法催化聚合反应时常用的有毒试剂(如甲醛等), 生物法展现出明显的绿色环保优势. HRP可顺利实现这一类重要的反应类型, 能将酚类、胺类进行聚合. Cui等[50]在含十二烷基硫酸钠(SDS)的环境友好型磷酸盐缓冲液(pH=7.0)中, 研究了HRP催化苯酚的酶促聚合反应, 所得的苯酚聚合物部分可溶于丙酮、四氢呋喃和DMF等常见溶剂. 作者还对所得聚合物进行了深入研究, 用环氧氯丙烷和三乙胺对苯酚聚合物进行功能化反应, 得到不溶性胺化苯酚聚合物. 以氨基化苯酚聚合物为载体, 制备了一种新型负载型钯催化剂(PP-N-Pd)并成功应用于Heck反应. Zhang等[51]以HRP/H2O2为催化剂, 将乙二醇保护的对羟基苯甲醛与对羟基苯磺酸经自由基共聚和脱保护过程合成苯酚衍生物的聚合物(图4). 此外, 表3列出了典型的HRP在聚合反应中的应用, 可实现对单羟基酚、多羟基酚及其衍生物的催化转化研究[52−56].
| 表 3 HRP在聚合反应中的应用 Table 3 Application of HRP in polymerizations reaction |
HRP除了能催化聚合反应外, 在催化有机物偶联反应中也有所应用. Saliu等[57]以苯酚衍生物为底物, 在HRP/H2O2作用下成功实现了分子间交叉偶联反应, 但目标物产率仅为24%. 副产物包含相同底物的偶联, 因此还需对反应体系进行改进以提高目标物的产率. 此外, Deska课题组[58]报道了葡萄糖氧化酶提供H2O2, HRP催化的亚硝酰-烯类型的反应, 即由羟胺底物经分子内环化合成恶唑烷酮产物, 产率高达97%, 酰基化的羟胺通过HRP催化氧化可以激活烯丙基C—H键来直接和选择性地引入氮官能团(图5). 此外, 表4列出了典型的HRP在偶联反应中的应用, 可实现对酚类、醇类、硫醇、羟胺及其衍生物的催化偶联反应[59−69].
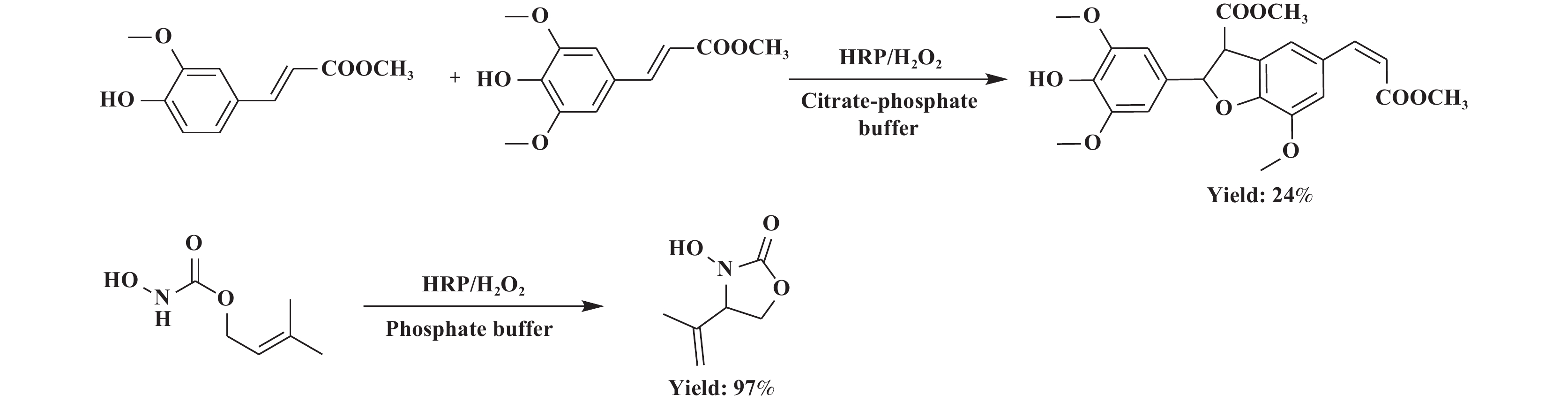
|
图 5 HRP催化的偶联反应 Fig.5 Coupling reaction catalyzed by HRP |
| 表 4 HRP在偶联反应中的应用 Table 4 Application of HRP in coupling reactions |
HRP催化活性不仅受到酶本身性质的影响, 还受到底物空间结构的显著影响, 包括大小、形状和电荷分布等[70]. 首先, 底物的大小与HRP的活性中心适应性密切相关, 较小的底物更容易进入酶的活性中心, 与催化位点紧密结合, 从而提高催化效率; 相反, 较大的底物可能需要通过酶的部分构象改变来适应, 这可能会降低催化速率. 其次, 底物的形状对HRP的催化活性也有显著影响, 酶通常具有特定的三维结构, 其活性中心具有特定的形状和电荷分布, 以与底物进行互补结合, 底物的形状与酶活性中心的形状匹配程度越高, 底物与酶的结合就越紧密, 催化活性也就越高, 因此, 底物的形状差异可能导致酶与底物之间的空间限制, 从而影响催化效率. 此外, 底物的电荷分布也是影响HRP催化活性的关键因素, 酶与底物之间的电荷相互作用在催化过程中起着重要作用, 底物的电荷分布与酶的电荷分布相匹配时, 可以形成稳定的酶-底物复合物, 从而促进催化反应的进行, 相反, 如果底物的电荷分布与酶的电荷分布不匹配, 可能会导致酶与底物之间的相互作用减弱, 从而降低催化活性.
HRP的催化活性还受到如温度、压力、pH值、溶剂以及干扰物质等多种因素的制约, 这些条件的变化均可能对实验结果产生显著影响[71]. 为了充分发挥HRP的催化效能, 确保实验结果的准确性, 必须深入了解这些因素对酶活性的影响机制, 并据此制定优化策略. HRP催化反应的优化策略, 可以从酶固定化与重复利用、酶的改造和优化、反应介质与添加剂的选择、催化反应条件的优化等四个方面进行详细介绍.
3.1 酶固定化与重复利用相比游离酶, 固定化酶更加稳定, 可以更容易地从反应体系中分离, 便于回收和重复使用, 从而降低操作成本[72]. 固定化还可以解决蛋白质在分离过程中被污染的问题, 提高酶的纯度和催化效率. 通过固定化技术, 可以实现HRP的长期稳定运行和高效催化. 如Hirobe等[39]研究了聚谷氨酸甲酯作为载体的固定化HRP对苯的催化羟化反应研究, 发现该固定化酶系统显著提高了催化效率和产物的选择性. Liu等[73]通过戊二醛交联法, 将壳聚糖与HRP通过氨基间的相互作用, 成功构建了一种稳固的固定化酶体系. 此固定化策略不仅显著增强了HRP的稳定性及在不同pH环境下的耐受能力, 而且赋予了固定化酶在连续催化作业中的优异复用性能, 进而缩减了生产成本. 这些研究推动了酶工程领域的发展, 为酶在有机合成、环境保护及医药合成等方面的应用开辟了更广阔的前景.
3.2 酶的改造和优化对HRP进行酶改造, 可以解决其在催化反应中可能遇到的活性不足或底物特异性受限等问题[74]. 酶改造可以改变HRP的氨基酸序列、引入新的功能基团或调整其空间结构, 从而影响其活性位点、底物结合能力和稳定性, 从而优化其催化性能. 如为了抑制酚类底物在氧化聚合过程中因苯氧基自由基导致的HRP迅速失活, Kim等[75]将4个苯丙氨酸(Phe)残基(F68、F142、F143和F179)分别突变为丙氨酸残基, 产生单突变体, 以检测这些位点在自由基偶联中的作用. 尽管自由基稳定性略有改善, 但每个突变体仍然表现出快速的自由基失活, 为进一步减少自由基偶联导致的失活, 研究者在F68A/F142A/F143A/ F179A中合并了四个替代突变, 与完全失活的野生型相比, 该突变体的自由基稳定性显著增强, 保留了41%的初始活性. 此外, 酶改造还可以使HRP适应不同的反应环境和条件, Ryan等[76]通过将精氨酸突变为赖氨酸, 提高其在催化体系中的稳定性和催化效率, 拓宽其应用范围.
3.3 反应介质与添加剂的选择选择合适的反应介质对于HRP的催化反应至关重要, 尽管HRP在水溶液中已表现出优异的催化性能, 然而, 某些有机溶剂或离子液体同样能够作为有效反应介质, 用以优化酶的催化性能或提升底物的溶解度[77]. 例如, 当使用疏水性底物时, Deska等[58]采用1,4-二氧六环或乙酸乙酯作为共溶剂, 能有效增加底物的溶解度, 进而提升HRP催化反应的效率. 此外, 添加剂如表面活性剂、盐类、有机溶剂等也可以影响HRP的催化活性, 特定的表面活性剂可以稳定酶的构象, 防止酶在反应过程中失活, 而盐类则可以调节反应体系的离子强度, 进一步影响酶的催化活性. 通过实验筛选和优化反应介质与添加剂的种类和浓度, 可以找到最适合HRP催化的反应条件, 如Andrés Cisneros等[78]结合分子动力学(MD)模拟和量子化学计算, 研究了HRP在纯水和1-乙基-3-甲基咪唑硫酸乙酯水溶液中的结构和动力学, 发现当1-乙基-3-甲基咪唑硫酸乙酯浓度为0.26 mol·L−1时, HRP的催化活性达到最高. 这一结果不仅验证了添加剂对酶催化性能的优化作用, 也为后续HRP催化反应的条件优化提供了具体参考.
3.4 催化反应条件的优化温度对HRP的催化活性具有显著影响, 在合适的温度区间内, 酶活性较高, 而温度过高或过低均会造成酶活性的下降[79−86]. 如Dong等[87]发现HRP在40 ℃时展现出最高的催化活性, 当温度升高或降低时, 其催化活性急剧下降甚至失活. 此外, pH值和底物浓度也是影响HRP催化活性的关键因素, Zhu等[33]研究了不同pH值条件下HRP的催化活性, 发现pH值为4.5时酶的催化活性最好, 因此调节反应体系的pH值可以提高酶的催化效率和产率. Lei等[88]研究了底物浓度对HRP的催化反应速率和产率的影响, 发现底物浓度过高或过低都会导致反应速率降低, 通过实验确定HRP的最适底物浓度范围, 可以确保反应的高效进行. 除了温度、pH值和底物浓度外, 其他条件如酶浓度、反应时间、搅拌速度等也会对HRP酶的催化反应产生影响, 通过优化这些条件, 能够进一步提升酶的催化效率及产物纯度.
4 总结与展望综上所述, HRP作为一种环境友好的生物催化剂, 在有机合成领域得到了广泛应用. 然而, 当催化特定化学反应时, 其仍面临一定的限制和挑战. 展望未来, 为了应对多样化的有机反应类型, 需要设计更多创新的实验策略进而优化催化体系.
首先, HRP虽然对特定底物具有较高的催化活性, 但其底物范围相对有限, 这限制了其在某些特定应用中的灵活性和适用性. 通过多酶级联方式构建包含HRP在内的多酶催化体系, 通过不同酶之间的协同作用, 如烯烃还原酶, 亚胺还原酶或转氨酶等与HRP的级联实现复杂有机分子的高效合成与转化, 拓宽HRP的应用范围.
其次, 将电化学技术与HRP催化相结合, 利用电极反应产生的电子传递来驱动HRP酶促反应, 为HRP提供了更为高效的催化环境, 增强其催化效率. 为有机合成提供新的动力来源和催化模式. 同时, 电化学手段还可以对催化过程进行精细调控, 提高催化的可控性.
最后, 将改性后的半导体材料如TiO2、ZnO、CdS或有机-无机杂化材料如共价有机框架(COFs)应用在HRP或改造HRP的光酶级联反应系统中, 使其原位产生H2O2, 进而引发催化反应, 最终实现目标产物的绿色转化.
| [1] |
Non-native site-selective enzyme catalysis[J]. Chem Rev, 2023, 123(16): 10381–10431.
DOI:10.1021/acs.chemrev.3c00215 |
| [2] |
Current state and future perspectives of engineered and artificial peroxygenases for the oxyfunctionalization of organic molecules[J]. Nat Catal, 2020, 3(9): 690–702.
DOI:10.1038/s41929-020-00507-8 |
| [3] |
Designing artificial metalloenzymes by tuning of the environment beyond the primary coordination sphere[J]. Chem Rev, 2022, 122(14): 11974–12045.
DOI:10.1021/acs.chemrev.2c00106 |
| [4] |
Study on the relationship between the purity of horseradish peroxidase and efficacy on the degradation of benzaldehyde(辣根过氧化物酶的纯度与降解苯甲醛效果关系的研究)[J]. J Med Chem(药物化学), 2020, 8(2): 14–20.
DOI:10.12677/HJMCe.2020.82003 |
| [5] |
Synthesis and biological activities of dehydrodiisoeugenol: A review[J]. Pharmaceuticals, 2022, 15(11): 1351.
DOI:10.3390/ph15111351 |
| [6] |
Determination of phosphatidylcholine in artificial crude soybean oil by biosensor based on horseradish peroxidase/choline oxidase-modified glassy carbon electrode(辣根过氧化物酶/胆碱氧化酶玻碳电极生物传感器检测人工大豆毛油中磷脂酰胆碱含量)[J]. Food Sci(食品科学), 2024, 45(24): 259–265.
DOI:10.7506/spkx1002-6630-20240508-049 |
| [7] |
朱建莉. 抗生素修饰辣根过氧化物酶及其在细菌检测中的应用[D]. 保定: 河北大学, 2023. [Zhu J L. Antibiotic modification of horseradish peroxidase and its application in bacterial detection[D]. Baoding: Hebei University, 2023.]
Zhu J L. Antibiotic modification of horseradish peroxidase and its application in bacterial detection[D]. Baoding: Hebei University, 2023.
|
| [8] |
Separation and purification of horseradish peroxidase from horseradish roots using a novel integrated method[J]. New J Chem, 2021, 45(4): 1959–1966.
DOI:10.1039/D0NJ04614K |
| [9] |
Enzymatic catalyzed synthesis of water-soluble polythiophene poly(3-thiophene malonie acid(水溶性聚噻吩类衍生物聚(3-噻吩丙二酸)的酶催化合成与表征)[J]. New Chem Mater(化工新型材料), 2017, 45(5): 146–148.
|
| [10] |
Development of chia gum/alginate-polymer support for horseradish peroxidase immobilization and its application in phenolic removal[J]. Sci Rep, 2024, 14(1): 1362.
DOI:10.1038/s41598-024-51566-x |
| [11] |
Study on the removal of phenolic wastewater catalyzed by horseradish peroxidase(辣根过氧化物酶降解苯酚废水催化特性研究)[J]. Appl Chem Ind(应用化工), 2012, 41(7): 1204–1207.
DOI:10.3969/j.issn.1671-3206.2012.07.024 |
| [12] |
顾磊. 新型辣根过氧化物酶复合纳米催化剂的合成及其对酚类污染物的降解研究[D]. 镇江: 江苏大学, 2018. [Gu L. The preparation of novel horseradish perxidase complex nanoparticle catalysts and degradation of phenol contaminants[D]. Zhenjiang: Jiangsu University, 2018.]
Gu L. The preparation of novel horseradish perxidase complex nanoparticle catalysts and degradation of phenol contaminants[D]. Zhenjiang: Jiangsu University, 2018.
|
| [13] |
Research progress in recombinant expression and application of peroxidases(过氧化物酶的重组表达和应用研究进展)[J]. Synth Biol J(合成生物学), 2024, 5(6): 1–19.
DOI:10.12211/2096-8280.2024-027 |
| [14] |
Preparation of thermosensitive polymer immobilized horseradish peroxidase and its application in catalytic degradation of phenol[J]. Catal Lett, 2024, 154(10): 5683–5697.
DOI:10.1007/s10562-024-04730-x |
| [15] |
Peroxidase mediated decolorization and remediation of wastewater containing industrial dyes: A review[J]. Rev Environ Sci Bio, 2010, 9(2): 117–140.
DOI:10.1007/s11157-009-9184-9 |
| [16] |
A novel hydrogen peroxide biosensor based on the immobilization of horseradish peroxidase onto Au-modified titanium dioxide nanotube arrays[J]. Biosens Bioelectron, 2008, 24(4): 566–571.
DOI:10.1016/j.bios.2008.06.004 |
| [17] |
An atomic insight into the confusion on the activity of Fe3O4 nanoparticles as peroxidase mimetics and their comparison with horseradish peroxidase[J]. J Phys Chem Lett, 2022, 13(38): 8872–8878.
DOI:10.1021/acs.jpclett.2c02331 |
| [18] |
Horseradish peroxidase-based biosensors with different nanotransducers for the determination of hydrogen peroxide[J]. J Anal Chem, 2021, 76(4): 510–517.
DOI:10.1134/S1061934821040080 |
| [19] |
Plasma-driven in situ production of hydrogen peroxide for biocatalysis[J]. ChemSusChem, 2020, 13(8): 2072–2079.
DOI:10.1002/cssc.201903438 |
| [20] |
Horseradish peroxidase (HRP) as a tool in green chemistry[J]. RSC Adv, 2014, 4(70): 37244–37265.
DOI:10.1039/C4RA06094F |
| [21] |
Inactivation kinetics of horseradish peroxidase (HRP) by hydrogen peroxide[J]. Sci Rep, 2023, 13(1): 13363–13374.
DOI:10.1038/s41598-023-39687-1 |
| [22] |
Covalent structure of the glycoprotein horseradish peroxidase (EC 1.11.1.7)[J]. FEBS Lett, 1976, 72(1): 19–23.
DOI:10.1016/0014-5793(76)80804-6 |
| [23] |
Synthesis of phenol polymers using peroxidases[J]. Adv Polym Sci, 2006, 194: 1–49.
DOI:10.1007/12_034 |
| [24] |
Reaction kinetics involved in esterification between the fatty acids in castor oil and furfuryl alcohol[J]. Ind Crops Prod, 2024, 213: 118393.
DOI:10.1016/j.indcrop.2024.118393 |
| [25] |
Looking through a new lens: Expressing the Ping Pong bi bi equation in terms of specificity constants[J]. Biochem Eng J, 2022, 178: 108276.
DOI:10.1016/j.bej.2021.108276 |
| [26] |
Role of protein environment in horseradish peroxidase compound I formation: Molecular dynamics simulations of horseradish peroxidase-HOOH complex[J]. J Am Chem Soc, 2000, 122(1): 18–25.
DOI:10.1021/ja992793z |
| [27] |
The molecular mechanism of the catalase-like activity in horseradish peroxidase[J]. J Am Chem Soc, 2015, 137(34): 11170–11178.
DOI:10.1021/jacs.5b06796 |
| [28] |
Hydroxylation of 4-amino-5-hydroxynaphthalene-2,7-disulfonic acid monosodium salt catalysed by horseradish peroxidase and hydrogen peroxide: Computation of kinetic parameters including its application to crude plant extracts[J]. J Chin Chem Soc, 2013, 60(4): 452–459.
DOI:10.1002/jccs.201200351 |
| [29] |
Horseradish peroxidase: A modern view of a classic enzyme[J]. Phytochemistry, 2004, 65(3): 249–259.
DOI:10.1016/j.phytochem.2003.10.022 |
| [30] |
Unspecific peroxygenase enabled formation of azoxy compounds[J]. Nat Commun, 2024, 15(1): 8312–8319.
DOI:10.1038/s41467-024-52648-0 |
| [31] |
Antioxidant activity of synthetic polymers of phenolic compounds[J]. Polymers, 2020, 12(8): 1646–1672.
DOI:10.3390/polym12081646 |
| [32] |
Oxidoreductase enzymes: Characteristics, applications, and challenges as a biocatalyst[J]. Biotechnol Appl Biochem, 2023, 70(6): 2108–2135.
DOI:10.1002/bab.2513 |
| [33] |
Two new preyssler-type polyoxometalate-based coordination polymers and their application in horseradish peroxidase immobilization[J]. Chem Eur J, 2017, 23(58): 14614–14622.
DOI:10.1002/chem.201703158 |
| [34] |
The energies of activation and deactivation of 2, 4-dichlorophenol degradation by horseradish peroxidase immobilized on the modified nanofibrous membrane[J]. Appl Sci, 2024, 14(6): 2423–2434.
DOI:10.3390/app14062423 |
| [35] |
Generation of the neurotoxin 6-hydroxydopamine by peroxidase/H2O2 oxidation of dopamine[J]. J Med Chem, 1995, 38(6): 917–922.
DOI:10.1021/jm00006a010 |
| [36] |
Horseradish peroxidase: A valuable tool in biotechnology[J]. Biotechnol Annu Rev, 2003, 9: 199–247.
DOI:10.1016/S1387-2656(03)09003-3 |
| [37] |
Horseradish peroxidase-catalyzed hydroxylations: Mechanistic studies[J]. Biochemistry, 1986, 25(10): 2946–2951.
DOI:10.1021/bi00358a032 |
| [38] |
Role of horseradish peroxidase in the catalytic hydroxylation of phenol[J]. J Mol Catal, 1992, 75(3): 357–369.
DOI:10.1016/0304-5102(92)80137-6 |
| [39] |
Hydroxylation of benzene by horseradish peroxidase and immobilized horseradish peroxidase in an organic solvent[J]. Bioorganic Med Chem Lett, 1995, 5(16): 1861–1864.
DOI:10.1016/0960-894X(95)00305-D |
| [40] |
Enzymatic hydroxylation of aromatic compounds[J]. Cell Mol Life Sci, 2007, 64(3): 271–293.
DOI:10.1007/s00018-007-6362-1 |
| [41] |
Molecular engineering of horseradish peroxidase. Highly enantioselective sulfoxidation of aryl alkyl sulfides by the phe-41. fwdarw. Leu mutant[J]. J Am Chem Soc, 1994, 116(10): 4487–4488.
DOI:10.1021/ja00089a052 |
| [42] |
High operational stability in peroxidase-catalyzed non-aqueous sulfoxidations by encapsulation within sol-gel glasses[J]. J Mol Catal B-Enzym, 2004, 27(2/3): 107–111.
DOI:10.1016/j.molcatb.2003.11.001 |
| [43] |
Horseradish peroxidase catalysed sulfoxidation is enantioselective[J]. J Chem Soc-Chem Commun, 1992(4): 357–358.
DOI:10.1039/c39920000357 |
| [44] |
Biotechnological production of chiral organic sulfoxides: Current state and perspectives[J]. Appl Microbiol Biotechnol, 2014, 98(18): 7699–7706.
DOI:10.1007/s00253-014-5932-z |
| [45] |
Enantioselective sulfoxidations catalyzed by horseradish peroxidase, manganese peroxidase, and myeloperoxidase[J]. Monatsh Chem, 2000, 131(6): 687–695.
DOI:10.1007/s007060070097 |
| [46] |
Enantioselective synthesis of sulfoxides: 2000-2009[J]. Chem Rev, 2010, 110(7): 4303–4356.
DOI:10.1021/cr900147h |
| [47] |
Molecular engineering of horseradish peroxidase: Thioether sulfoxidation and styrene epoxidation by phe-41 leucine and threonine mutants[J]. J Am Chem Soc, 1995, 117(27): 7056–7064.
DOI:10.1021/ja00132a003 |
| [48] |
Horseradish peroxidase-catalyzed sulfoxidation of promethazine and properties of promethazine sulfoxide[J]. Free Radic Biol Med, 1996, 20(6): 807–811.
DOI:10.1016/0891-5849(95)02213-9 |
| [49] |
Asymmetric thiosulfinations catalyzed by bovine serum albumin and horseradish peroxidase[J]. Biotechnol Lett, 2003, 25(23): 1961–1965.
DOI:10.1023/B:BILE.0000004385.50406.06 |
| [50] |
Enzymatic synthesis of phenol polymer and its functionalization[J]. J Mol Catal B-Enzym, 2013, 87: 30–36.
DOI:10.1016/j.molcatb.2012.10.015 |
| [51] |
Synthesis of a phenol copolymer with horseradish peroxidase and the study of its structure-property relations[J]. J Appl Polym Sci, 2013, 128(1): 523–529.
DOI:10.1002/app.38204 |
| [52] |
New polymers from natural phenols using horseradish or soybean peroxidase[J]. Macromol Biosci, 2002, 2(1): 24–32.
DOI:10.1002/1616-5195(20020101)2:1<24::AID-MABI24>3.0.CO;2-6 |
| [53] |
Structure and properties of the graft copolymer of starch and p-hydroxybenzoic acid using horseradish peroxidase[J]. Polym Adv Technol, 2012, 23(10): 1343–1349.
DOI:10.1002/pat.2052 |
| [54] |
Regioselective HRP-catalyzed polymerization of 4-amino-phenol[J]. J Macromol Sci A, 2002, 39: 1369–1382.
DOI:10.1081/MA-120016041 |
| [55] |
Enzymatic synthesis and characterization of polyquercetin[J]. J Macromol Sci A-Pure Appl Chem, 2010, 47(12): 1191–1196.
DOI:10.1080/10601325.2010.518839 |
| [56] |
Immobilized horseradish peroxidase (I-HRP) as biocatalyst for oxidative polymerization of 2,6-dimethylphenol[J]. ACS Sustainable Chem Eng, 2014, 2(8): 1947–1950.
DOI:10.1021/sc500392k |
| [57] |
Horseradish peroxidase catalyzed oxidative cross-coupling reactions: The synthesis of ‘unnatural’ dihydrobenzofuran lignans[J]. Tetrahedron Lett, 2011, 52(30): 3856–3860.
DOI:10.1016/j.tetlet.2011.05.072 |
| [58] |
Aerobic C-N bond formation through enzymatic nitroso-ene-type reactions[J]. Angew Chem Int Edit, 2023, 62(7): e202213671.
DOI:10.1002/anie.202213671 |
| [59] |
Horseradish peroxidase-mediated synthesis of an antioxidant gallic acid-g-chitosan derivative and its preservation application in cherry tomatoes[J]. RSC Adv, 2018, 8(36): 20363–20371.
DOI:10.1039/C8RA02632G |
| [60] |
One-pot biocatalytic synthesis of rac-syringaresinol from a lignin-derived phenol[J]. ACS Catal, 2023, 13(22): 14639–14649.
DOI:10.1021/acscatal.3c04399 |
| [61] |
Enzymatic thiol-ene click reaction: An eco-friendly approach for MPEGMA-grafted modification of wool fibers[J]. ACS Sustainable Chem Eng, 2019, 7(15): 13446–13455.
DOI:10.1021/acssuschemeng.9b02902 |
| [62] |
Horseradish peroxidase modification of sulfomethylated wheat straw alkali lignin to improve its dispersion performance[J]. ACS Sustainable Chem Eng, 2015, 3(3): 518–523.
DOI:10.1021/sc500757y |
| [63] |
Novel oxidations of (+)-catechin by horseradish peroxidase and laccase[J]. J Agric Food Chem, 2002, 50(20): 5539–5545.
DOI:10.1021/jf020503j |
| [64] |
Horseradish peroxidase catalyzed nitric oxide formation from hydroxyurea[J]. J Am Chem Soc, 2002, 124(13): 3473–3480.
DOI:10.1021/ja012271v |
| [65] |
Biocatalytic generation of o-quinone imines in the synthesis of 1, 4-benzoxazines and its comparative green chemistry metrics[J]. ACS Sustainable Chem Eng, 2024, 12(7): 2678–2685.
DOI:10.1021/acssuschemeng.3c06758 |
| [66] |
Oxidation of dobutamine and dopamine by horseradish peroxidase[J]. J Mol Struct, 2022, 1252: 132169.
DOI:10.1016/j.molstruc.2021.132169 |
| [67] |
Biocatalytic oxidation of flavone analogues mediated by general biocatalysts: Horseradish peroxidase and laccase[J]. RSC Adv, 2019, 9(23): 13325–13331.
DOI:10.1039/C9RA00470J |
| [68] |
Horseradish peroxidase (HRP): A tool for catalyzing the formation of novel bicoumarins[J]. Catal Sci Technol, 2016, 6(10): 3585–3593.
DOI:10.1039/C5CY01682G |
| [69] |
Production of a new type of bioactive phenolic compound[J]. Biosci Biotechnol Biochem, 1994, 58(1): 133–134.
DOI:10.1271/bbb.58.133 |
| [70] |
Catalytic promiscuity of horseradish peroxidase: Aerobic oxidative regeneration of oxidized nicotinamide cofactors[J]. ChemCatChem, 2023, 15(11): e202300330.
DOI:10.1002/cctc.202300330 |
| [71] |
Mechanism of action, sources, and application of peroxidases[J]. Food Res Int, 2021, 143(3): 110266–110281.
DOI:10.1016/j.foodres.2021.110266 |
| [72] |
Immobilization of horseradish peroxidase for phenol degradation[J]. ACS Omega, 2023, 8(30): 26906–26915.
DOI:10.1021/acsomega.3c01570 |
| [73] |
Chitosan-halloysite hybrid-nanotubes: Horseradish peroxidase immobilization and applications in phenol removal[J]. Chem Eng J, 2013, 214(4): 304–309.
DOI:10.1016/j.cej.2012.10.073 |
| [74] |
Production of recombinant horseradish peroxidase in an engineered cell-free protein synthesis system[J]. Front Bioeng Biotechnol, 2021, 9: 778496–778503.
DOI:10.3389/fbioe.2021.778496 |
| [75] |
Engineering a horseradish peroxidase C stable to radical attacks by mutating multiple radical coupling sites[J]. Biotechnol Bioeng, 2015, 112(4): 668–676.
DOI:10.1002/bit.25483 |
| [76] |
Arginine-to-lysine substitutions influence recombinant horseradish peroxidase stability and immobilisation effectiveness[J]. BMC Biotechnol, 2007, 7: 86–94.
DOI:10.1186/1472-6750-7-86 |
| [77] |
Improving the activity of horseradish peroxidase in betaine-based natural deep eutectic systems[J]. RSC Sustainability, 2023, 1(4): 886–897.
DOI:10.1039/D2SU00127F |
| [78] |
Impact of an ionic liquid solution on horseradish peroxidase activity[J]. J Am Chem Soc, 2024, 146(19): 13247–13257.
DOI:10.1021/jacs.4c01100 |
| [79] |
Constitutive expression of Acidovorax facilis nitrilase in E. coli and its application in the hydrolysis of nicotinonitrile in high concentration(敏捷食酸菌腈水解酶在大肠杆菌中的组成型表达及其催化高浓度烟腈水解的研究)[J]. J Mol Catal (China)(分子催化), 2024, 38(6): 560–566.
DOI:10.16084/j.issn1001-3555.2024.06.007 |
| [80] |
Optimizing the enzymatic kinetic resolution of (R/S)-δ-tetradecalactone by response surface methodology(使用响应面法优化酶动力学拆分(R/S)-δ-十四内酯)[J]. J Mol Catal (China)(分子催化), 2024, 38(5): 418–426.
DOI:10.16084/j.issn1001-3555.2024.05.003 |
| [81] |
Research progress of mechanoenzyme-catalyzed reaction(机械酶催化反应研究进展)[J]. J Mol Catal (China)(分子催化), 2024, 38(4): 375–385.
DOI:10.16084/j.issn1001-3555.2024.04.008 |
| [82] |
Research progress of fatty acid photodecarboxylase and its application in organic synthesis(脂肪酸光脱羧酶及其在有机合成中应用的研究进展)[J]. J Mol Catal (China)(分子催化), 2024, 38(2): 187–196.
DOI:10.16084/j.issn1001-3555.2024.02.011 |
| [83] |
Recent progress on covalent organic frameworks materials in immobilized enzymes(共价有机框架材料固定化酶的研究进展)[J]. J Mol Catal (China)(分子催化), 2024, 38(2): 171–186.
DOI:10.16084/j.issn1001-3555.2024.02.010 |
| [84] |
Synthesis of glycerol ferulate catalysed by NaBH4@AuNPs-CRL hybridases prepared by in situ reduction of sodium borohydride(基于硼氢化钠原位还原的纳米金杂化酶的制备及催化阿魏酸甘油酯合成)[J]. J Mol Catal (China)(分子催化), 2024, 38(1): 26–34.
DOI:10.16084/j.issn1001-3555.2024.01.004 |
| [85] |
Resolution of (R,S)-3-chloro-1-phenylpropanol by mesoporous molecular sieve SBA-15 immobilized lipase in solvent-free system(无溶剂体系介孔分子筛SBA-15固定化脂肪酶拆分(R,S)-3-氯-1-苯基丙醇)[J]. J Mol Catal (China)(分子催化), 2023, 37(4): 342–347.
DOI:10.16084/j.issn1001-3555.2023.04.003 |
| [86] |
One pot photoenzymatic cascades to synthesize chiral aliphatic amines(光酶级联一锅法合成手性脂肪胺)[J]. J Mol Catal (China)(分子催化), 2023, 37(4): 323–330.
DOI:10.16084/j.issn1001-3555.2023.04.001 |
| [87] |
A method to construct a third-generation horseradish peroxidase biosensor: Self-assembling gold nanoparticles to three-dimensional sol-gel network[J]. Anal Chem, 2002, 74(9): 2217–2223.
DOI:10.1021/ac011116w |
| [88] |
雷青娟. 辣根过氧化物酶在双功能环氧载体和胺基载体上的固定化及固定化酶催化氧化性能研究)[D]. 太原: 中北大学, 2013. [Lei Q J. Immobilization of horseradish peroxidase on the difunctional of epoxy carrier and amino carrier and catalytic oxidation properties of immobilized enzyme[D]. Taiyuan: North University of China, 2013.]
Lei Q J. Immobilization of horseradish peroxidase on the difunctional of epoxy carrier and amino carrier and catalytic oxidation properties of immobilized enzyme[D]. Taiyuan: North University of China, 2013.
|
 2025, Vol. 39
2025, Vol. 39





