2. 山西朔铭科技有限公司, 山西 太原 030032
2. Shanxi Shuoming Technology Co., Ltd., Taiyuan 030032, China
丙烯作为仅次于乙烯的第二大有机烯烃化学品, 是合成丙烯腈、丙烯酸、环氧丙烷等多种化学品的关键原料. 随着丙烯在各工业领域的广泛应用, 其需求将进一步扩大[1]. 目前, 丙烯的制备工艺主要包括石油催化裂化、石脑油蒸汽裂解和烷烃脱氢等. 其中, 丙烷脱氢工艺原料易得, 成本低廉, 成为增产丙烯的首选[2−3]. 在丙烷脱氢生成丙烯的工艺中, 丙烷直接脱氢(PDH)能耗高, 需在高温高压条件下进行, 容易裂解生成焦炭; 氧气氧化丙烷脱氢(ODPH)虽是放热反应, 能够在较低温度下发生, 但丙烯容易被过度氧化. 相比而言, 以二氧化碳作为弱氧化剂的丙烷脱氢反应(CO2-ODH)展现出显著优势. 一方面, 该反应可以消除积碳现象, 提高催化剂使用寿命的同时消耗二氧化碳, 符合绿色化学理念(CO2+C→2CO); 另一方面, 二氧化碳作为共反应物可与丙烷脱氢过程中产生的氢气发生反应(CO2+H2→CO+H2O), 能够打破丙烷直接脱氢的平衡极限, 提高平衡转化率[4−5]. 因此, CO2-ODH成为丙烷脱氢领域的研究热点[6−7]. 在金属活性位点上, CO2-ODH被广泛认为是PDH和逆水煤气转换反应(RWGS, CO2 + H2→CO + H2O)的耦合串联过程, 能够同时活化C3H8和CO2的催化剂可能促使反应容易发生[8−9]. 然而, 丙烷中C―H键和二氧化碳中C=O键的活化面临着巨大挑战, 寻找有效促进CO2-ODH反应的催化剂迫在眉睫.
近年来, 在用于CO2-ODH反应的催化剂研究领域中, 多价态和氧储存、释放能力强的金属氧化物催化剂(CrOx、CeO2等)被广泛报道[10−13], 这类催化剂由于强大的C―C键断裂能力, 其丙烯选择性低, 且易发生焦炭沉积现象, 导致催化剂发生不可逆的失活; 高比表面积Al2O3等金属氧化物负载的金属催化剂, 表现出较高的丙烷转化率, 但对C=O键活化能力弱, 导致CO2转化率低[14−15]. 最近, 氮掺杂石墨烯由于带负电荷的N原子使得空腔环境内部富含电子, 成为负载过渡金属的理想载体. 理论研究已证实, Fe/C2N和V/C2N对丙烷直接脱氢反应展现出优异的催化性能, 有助于活化C3H8的C—H键[16−17]. 同时, Mo/NC结构在活化CO2方面具有显著优势, 能够将其高效催化还原为CO, 选择性接近100%[18]. 因此, 负载FeMo双原子的C2N材料有望具备同时活化C3H8和CO2的能力.
研究结果表明[9,19−20], 在涉及多种反应物同步活化与转化的复杂反应体系中, 具备不同功能位点且能实现协同催化的催化剂体系表现出显著优势. 因此, 通过精准调控FeMo双原子在C2N载体中的配位环境, 可能提升催化剂对于CO2-ODH反应的催化性能. 另外, 鉴于单金属位点对CO2的活化程度有限, 在金属周围引入杂原子掺杂是强化CO2吸附与活化的有效策略. Wei等[21]通过态密度和Bader电荷分析揭示, S掺杂使钴的d带中心从−1.02 eV上移至−0.79 eV, 显著增强了Co-N3S与COOH中间体之间的相互作用, 这有利于CO2活化. Zhang等[22]表明N和S共掺杂的石墨烯在CO2还原为CO反应中表现出优异的活性和选择性, 其性能远优于仅N掺杂的石墨烯. 综上所述, S掺杂可能进一步活化CO2, 从而提高转化率和反应速率.
本工作选择FeMo共掺杂C2N (Fe/Mo-C2N)和S取代Fe/Mo-C2N (Fe/MoS-C2N)两种催化剂模型, 基于密度泛函理论研究了FeMo双金属取代嵌入C2N基底中的稳定性, 计算了C3H8和CO2在催化剂表面相应的吸附能、反应热、能垒和电荷转移, 并进一步探讨了其吸附行为和反应机理, 可能为设计高效二氧化碳氧化丙烷催化剂提供理论指导.
1 计算方法及模型 1.1 计算方法本文的DFT计算均使用 Vienna Ab-initio Simulation Package模拟软件包(VASP)进行[23−28]. 运用投影仪增强波(PAW)描述离子核与电子之间的相互作用, 广义梯度近似(GGA)用来处理交换相关函数[29], 平面波基组的动力学截止能量为450 eV, 布里渊区采用5×5×1 k点网格进行采样用于几何优化和电子性质计算, 并采用DFT-D3方法进行色散校正以考虑范德华力相互作用[30]. 结构弛豫过程中所有残余力和能量的收敛标准分别为0.5 eV·nm−1和 1×10−5 eV, CI-NEB方法用于确定过渡态(TS), 通过唯一虚频验证过渡态[31]. C2N衬底中单空位缺陷的形成能(Eform)计算如下:
| $ {E}_{\mathrm{f}\mathrm{o}\mathrm{r}\mathrm{m}}={E}_{\mathrm{c}\mathrm{a}\mathrm{t}\mathrm{a}\mathrm{l}\mathrm{y}\mathrm{s}\mathrm{t}}+{n}_{\mathrm{c}}{\mu }_{\mathrm{c}}-\left({E}_{\mathrm{s}\mathrm{u}\mathrm{b}\mathrm{s}\mathrm{t}\mathrm{r}\mathrm{a}\mathrm{t}\mathrm{e}}+{n}_{\mathrm{T}\mathrm{M}}{E}_{\mathrm{T}\mathrm{M}}\right) $ | (1) |
式中Ecatalyst是掺杂TM原子后的总能量, μc是石墨烯中单个碳原子的化学势, nc和nTM是被TM替代的C原子数和掺杂TM的原子数, Esubstrate是未掺杂TM前的催化剂总能量, ETM是孤立的TM原子的能量.
吸附能定义如下:
| $ {E}_{\mathrm{a}\mathrm{d}\mathrm{s}}={E}_{\mathrm{a}\mathrm{b}\mathrm{s}\mathrm{o}\mathrm{r}\mathrm{b}\mathrm{a}\mathrm{t}\mathrm{e}/\mathrm{c}\mathrm{a}\mathrm{t}\mathrm{a}\mathrm{l}\mathrm{y}\mathrm{s}\mathrm{t}}-{E}_{\mathrm{c}\mathrm{a}\mathrm{t}\mathrm{a}\mathrm{l}\mathrm{y}\mathrm{s}\mathrm{t}}-{E}_{\mathrm{a}\mathrm{b}\mathrm{s}\mathrm{o}\mathrm{r}\mathrm{b}\mathrm{a}\mathrm{t}\mathrm{e}} $ | (2) |
式中Eabsorbate/catalyst、Ecatalyst、Eabsorbate分别是吸附质吸附在催化剂上的总能量、催化剂本身的能量和吸附质本身的能量. Eads值为负表示在催化剂表面是放热吸附, 且Eads的负值越大, 表示吸附物和催化剂的结合越强.
对于在催化剂表面进行的A+B→C+D之类的反应, 根据以下方程式计算反应能(ΔH)和能垒(Ea):
| $ \mathrm{\Delta }H={E}_{\left(\mathrm{C}+\mathrm{D}\right)/\mathrm{c}\mathrm{a}\mathrm{t}\mathrm{a}\mathrm{l}\mathrm{y}\mathrm{s}\mathrm{t}}-{E}_{(\mathrm{A}+\mathrm{B})/\mathrm{c}\mathrm{a}\mathrm{t}\mathrm{a}\mathrm{l}\mathrm{y}\mathrm{s}\mathrm{t}} $ | (3) |
| $ {E}_{\mathrm{a}}={E}_{\mathrm{T}\mathrm{S}/\mathrm{c}\mathrm{a}\mathrm{t}\mathrm{a}\mathrm{l}\mathrm{y}\mathrm{s}\mathrm{t}}-{E}_{(\mathrm{A}+\mathrm{B})/\mathrm{c}\mathrm{a}\mathrm{t}\mathrm{a}\mathrm{l}\mathrm{y}\mathrm{s}\mathrm{t}} $ | (4) |
式中 E(A+B)/catalyst是催化剂表面共吸附A和B的总能量, E(C+D)/catalyst是被吸附C和D的总能量, ETS/catalyst是过渡态的能量.
1.2 计算模型催化剂模型为周期性体系, 金属原子支撑在含有48个C和24个N原子的C2N基底上, 真空空间沿z轴方向设置1.5 nm的真空度, 以避免周期性重复图像之间的相互作用. 图1展示了Fe/C2N、Fe/Mo-C2N和Fe/MoS-C2N优化后的几何构型. 优化后的C2N层的晶格参数为0.832 nm, 与实验结果接近(0.830 nm)[32], 证明了模型的合理性. Fe/Mo-C2N催化剂是通过Mo取代Fe/C2N中两个C原子而形成的, 而Fe/MoS-C2N则是Fe/Mo-C2N上Mo配位的C原子被S取代后形成.
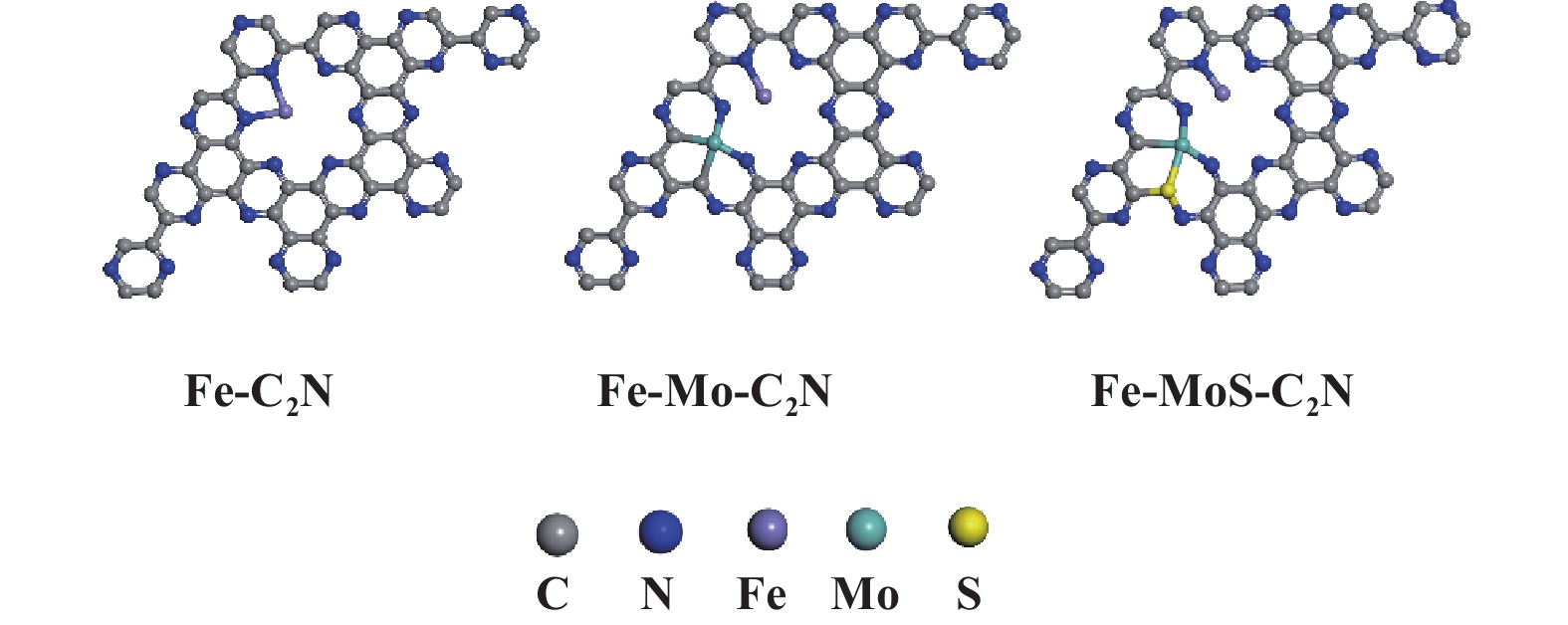
|
图 1 Fe/C2N、Fe/Mo-C2N及Fe/MoS-C2N的稳定构型 Fig.1 Stable configurations of the Fe/C2N, Fe/Mo-C2N, and Fe/MoS-C2N |
在催化剂设计中, 结构稳定性是筛选理想催化剂的关键指标之一. 金属原子和C2N基底之间的形成能(Eform)可通过公式1计算, 根据热力学稳定性判据, Eform< 0 eV的体系被认为是热力学稳定的. 研究表明[16], 通过比较单个原子的形成能和相应块体金属的内聚能, 证明Cr、Mn、Fe、Co、Ni和Cu等过渡金属能以孤立原子的形式稳定锚定于C2N单层的空腔处, 占据C2N孔内六个几何等价位置之一, 且金属原子与两个N原子成键[33], 这种强相互作用能有效防止金属原子迁移或团聚, 故Fe/C2N稳定存在.
随后计算第二金属Mo掺杂Fe/C2N的Eform, 在探索中发现取代C―C要比取代C―N更容易, 同时, Mo/NC结构有利于CO2的活化[18], 因此Mo原子优先取代两个碳原子. 随后筛选了如图2(a)的四个位点, 计算发现3号位点Eform最低(表1), 表明取代该位点的两个碳原子最容易, 确定Fe/Mo-C2N催化剂的稳定构型. 对于硫掺杂可能位点考虑了Mo原子周围的十个原子位点, 具体如图2(b). 计算各位点形成能汇于表2, 取代5号碳原子的形成能(−5.77 eV)最低, 负值表明其结构稳定, 最终确定掺杂硫的方式.
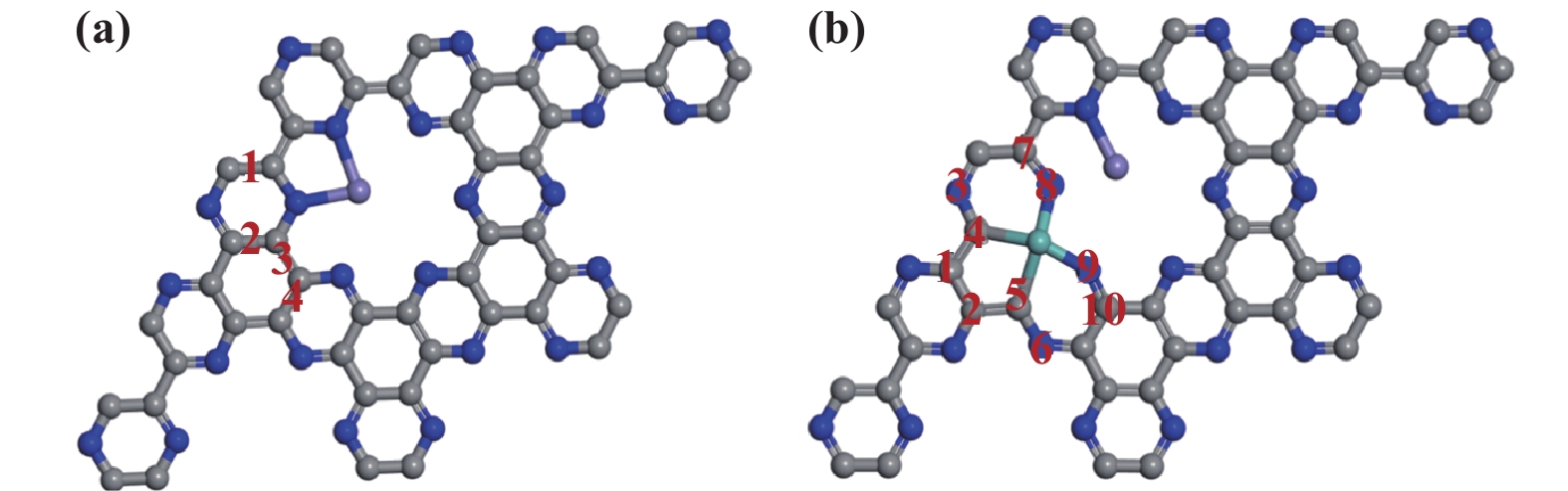
|
图 2 (a)钼掺杂Fe/C2N和(b)硫掺杂Fe/Mo-C2N可能位点的示意图 Fig.2 Diagram of possible sites for (a) Mo-doped Fe/C2N and (b) S-doped Fe/Mo-C2N |
| 表 1 钼掺杂Fe/C2N催化剂各位点的形成能 Table 1 Formation energies of Mo doped Fe/C2N catalyst at different sites |
| 表 2 硫掺杂Fe/Mo-C2N催化剂不同位点的形成能 Table 2 Formation energies of sulfur-doped Fe/Mo-C2N catalyst at different sites |
通过计算确定了Fe/Mo-C2N、Fe/MoS-C2N催化剂上反应物、中间体和产物(C3H8、CO2、CH3CH2CH2、CH3CHCH3、OCHO、COOH、CH3CHCH2、CH3CCH3、CO和H2O)的稳定吸附状态、吸附能及最优构型, 吸附能如表3所示, 最优构型如图3所示. C3Hx(x=6, 7, 8)的吸附: C3H7、C3H6和C3H8在两种催化剂表面均为化学吸附, 稳定吸附位点为Fe顶位. C3H8悬浮在Fe原子上方, CH3CH2CH2甲基碳与Fe成键, CH3CHCH3亚甲基碳和Fe原子成键, CH3CHCH2 由于甲基碳和亚甲基碳不饱和与Fe形成两个单键. OCO、OCHO、COOH的吸附: 这三者稳定吸附在Mo顶位, 结合表3吸附能数据表明其均为化学吸附, 而且OCO、OCHO、COOH在Fe/MoS-C2N表面吸附能相对更弱, 弯曲型的CO2证明其被活化, 中间体COOH与催化剂平面呈垂直状态, 而OCHO因为O与C成键, 与催化剂平面呈倾斜状态. CO的吸附: CO以15°倾斜化学吸附在Mo顶位, C和Mo原子形成化学键.
| 表 3 Fe/Mo-C2N和Fe/MoS-C2N催化剂上反应物、中间体和产物的吸附能 Table 3 Adsorption energies of reactants, intermediates, and products on the Fe/Mo-C2N and Fe/MoS-C2N catalysts |
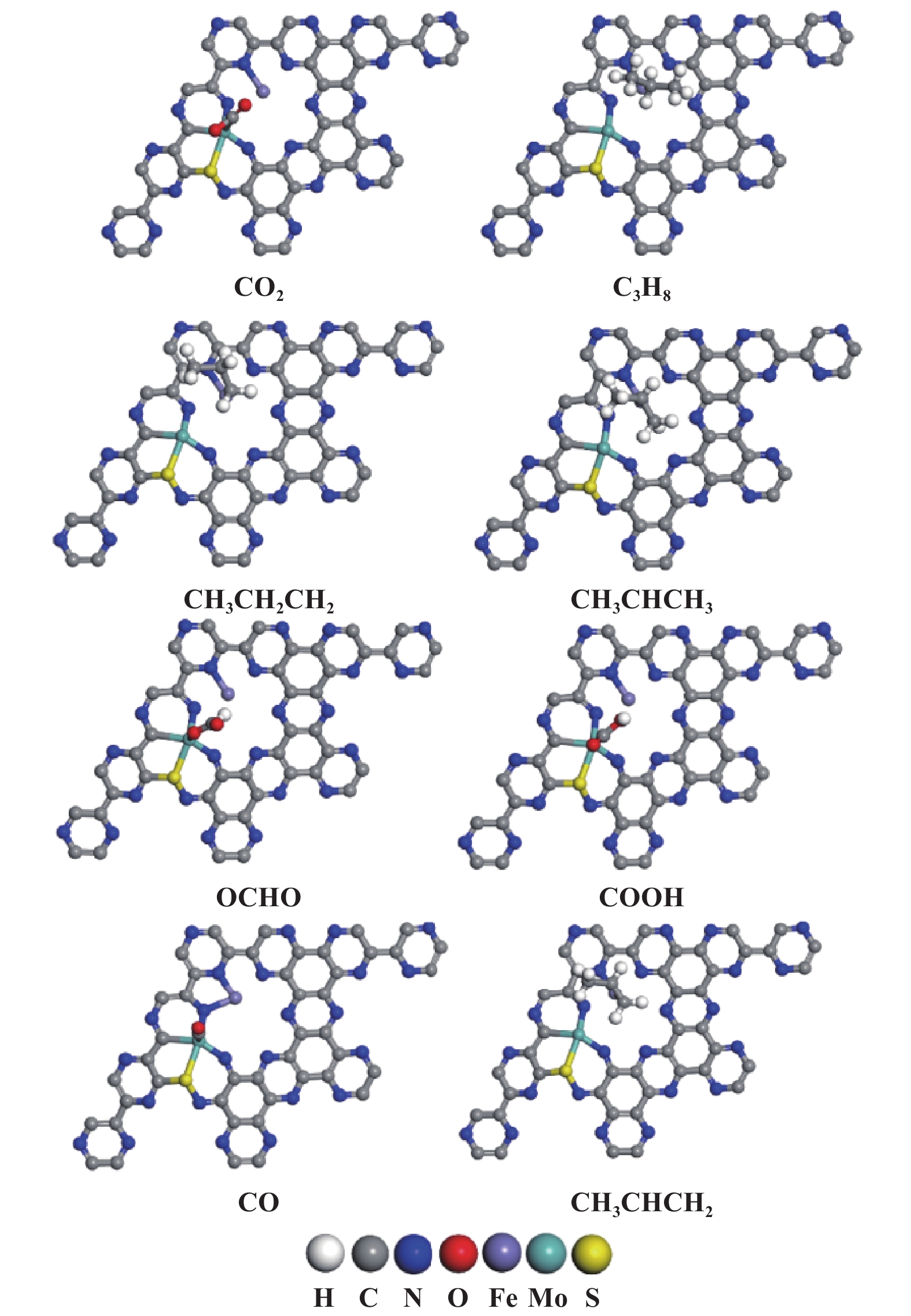
|
图 3 Fe/MoS-C2N催化剂上反应物、中间体和产物的最稳定构型 Fig.3 The most stable configurations of reactants, intermediates, and products on the Fe/MoS-C2N catalyst |
在金属位点上, CO2-ODH被认为是PDH和RWGS反应耦合串联进行的过程, 该过程由两步基元反应构成. 第一步基元反应为丙烷分子中的甲基或亚甲基脱氢, 脱氢产生的氢原子随即与CO2反应, 生成OCHO或COOH物种. 在第二步基元反应中, 第一步所产生的脱氢产物会进一步发生甲基或亚甲基脱氢反应, 主要产物是丙烯, 副反应是甲基或亚甲基发生二次脱氢反应, 随后氢原子与COOH反应生成CO和H2O, 或与OCHO反应生成甲酸.
计算了Fe/Mo-C2N和Fe/MoS-C2N催化剂表面CO2氧化C3H8反应可能步骤的反应热和能垒, 确定了最优反应路径. 以Fe/MoS-C2N为例, 催化剂表面C3H8初步氧化过程中初态(IS)、过渡态(TS)及终态(FS)的构型如图4所示. Fe/Mo-C2N催化剂表面的IS、TS、FS的构型与Fe/MoS-C2N相似, 其相应的反应热和能垒的计算结果汇于表4, 并绘制相应的自由能图, 如图5所示.

|
图 4 Fe/MoS-C2N催化剂上CO2氧化C3H8反应IS、TS和FS的最稳定构型 Fig.4 The most stable configurations of IS, TS and FS in the reaction of CO2 oxidation of C3H8 on the Fe/MoS-C2N catalyst |
| 表 4 Fe/Mo-C2N和Fe/MoS-C2N催化剂上CO2氧化C3H8各基元反应的反应热和能垒 Table 4 Reaction energies and energy barriers of CO2 oxidation C3H8 elementary reactions on the Fe/Mo-C2N and Fe/MoS-C2N catalysts |
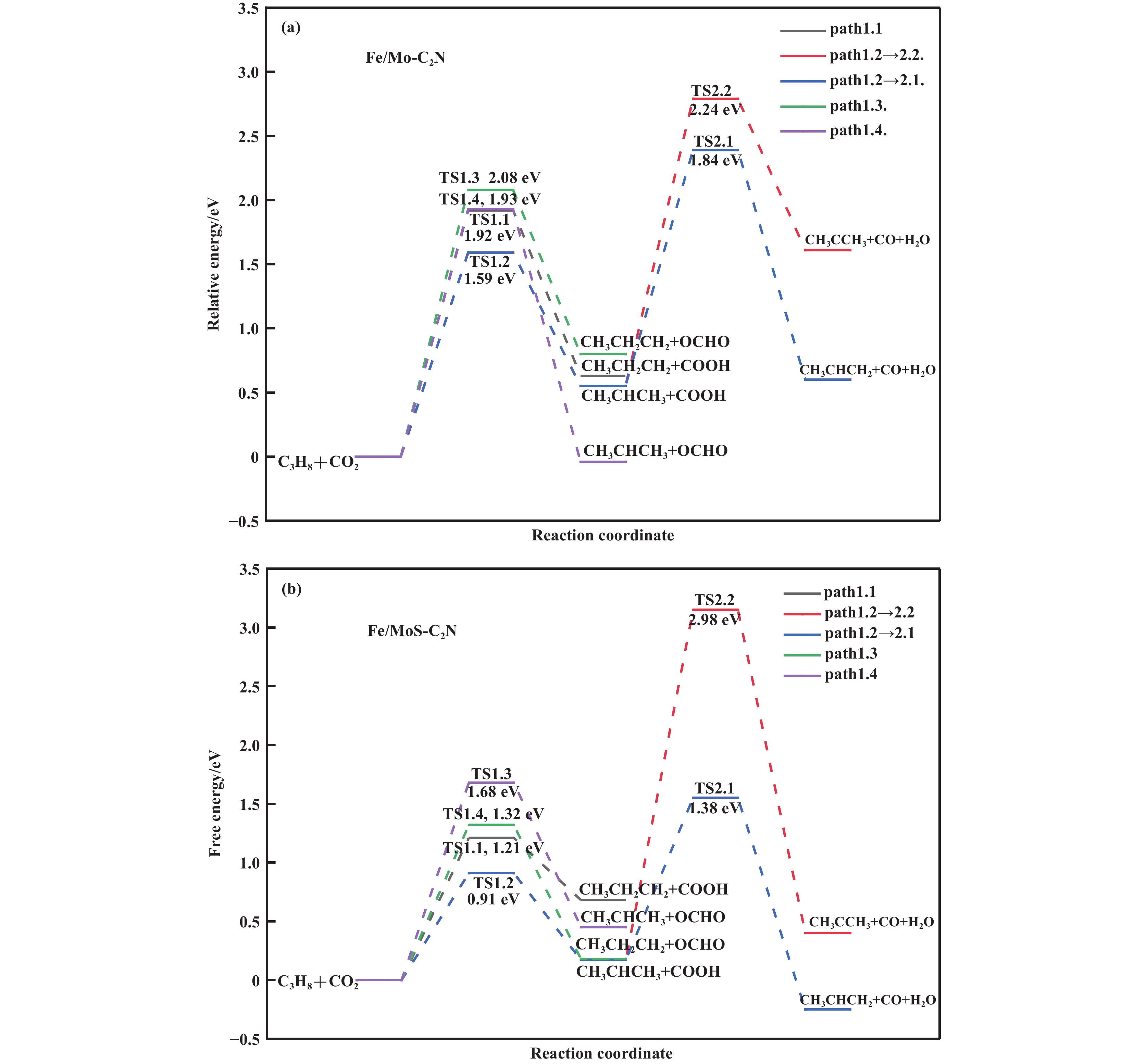
|
图 5 (a) Fe/Mo-C2N和(b) Fe/MoS-C2N催化剂上CO2氧化C3H8反应的自由能图 Fig.5 Free energy diagrams of CO2 oxidation of C3H8 on the (a) Fe/Mo-C2N and (b) Fe/MoS-C2N catalysts |
在Fe/Mo-C2N表面, 相比于其他路径, 丙烷亚甲基脱氢并加成到CO2的O原子上生成COOH(path 1.2)这一基元反应表现出最低的能垒, 为1.59 eV, 相应的反应热为0.55 eV. 随后的第二次脱氢过程中, 甲基脱氢与中间体COOH反应(path 2.1)相比于亚甲基脱氢(path 2.2)能垒更低, 其能垒为1.84 eV, 反应热为0.15 eV. 最终产物为H2O和CO, 生成的H2O吸附于Fe、Mo两金属的中间空隙上方, 吸附能为−0.17 eV, 表明其易于脱附.
随后计算了Fe/MoS-C2N催化剂表面各基元反应的反应热和能垒, 在第一步脱氢步骤中, 能垒最低的反应仍是亚甲基脱氢并加到CO2上生成COOH, 为0.91 eV, 反应热为0.17 eV, 第二步脱氢是甲基脱氢加到COOH上, 生成CO和H2O, 能垒为1.38 eV, 反应热为−0.42 eV. 相较于S取代前, 第一步和第二步反应能垒显著下降, 这说明S元素的掺杂有助于Mo原子活化CO2, 有利于降低反应能垒.
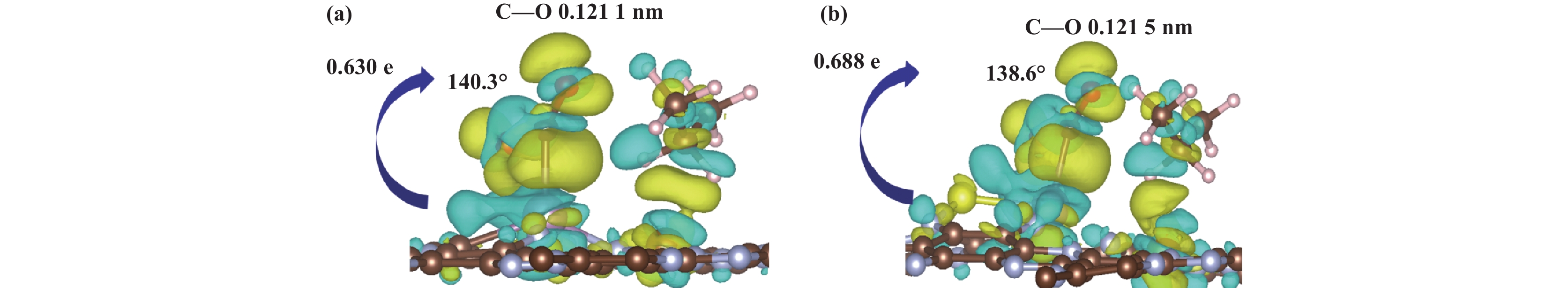
2.4 电子结构分析图6展示了Fe/Mo-C2N和Fe/MoS-C2N催化剂上吸附CO2和C3H8最稳定构型的差分电荷密度分布. 差分电荷密度分析表明, 由于S的电负性低于C, 配位S原子的引入增加了Mo活性中心的电子密度, 进而增强了Fe/MoS-C2N催化剂与CO2之间的相互作用. 具体而言, 电子转移量由掺杂前的0.630 e增加至掺杂后的0.688 e, CO2的C―O键键长由
|
图 6 (a) Fe/Mo-C2N和(b) Fe/MoS-C2N催化剂上CO2和C3H8最稳定构型的差分电荷密度 Fig.6 The differential charge density of CO2 and C3H8 in the most stable configurations on the (a) Fe/Mo-C2N and (b) Fe/MoS-C2N catalysts |
本研究基于密度泛函理论, 系统探究了C3H8和CO2在Fe/Mo-C2N和Fe/MoS-C2N催化剂表面的吸附行为及反应机理. 通过计算各物种的吸附能以及各基元反应的反应热和能垒, 明确了最优反应路径和速率控制步骤, 揭示了S掺杂对催化性能的调控机制. 研究结果表明: (1)在Fe/Mo-C2N和Fe/MoS-C2N催化剂表面, CO2优先吸附于Mo位点, 而C3H8则倾向于吸附在Fe位点, FeMo双原子协同实现了C3H8 和CO2的同步活化. 最优路径为C3H8+CO2→CH3CHCH3+COOH→CH3CHCH2+H2O+CO, 第二步加氢过程为速率控制步骤; (2) Fe/MoS-C2N催化剂的S掺杂有助于调控Mo活性中心的电子结构, 增强Mo与CO2的相互作用以促进CO2的活化. 与未掺杂体系相比, Fe/MoS-C2N催化剂将两步反应能垒分别降低至0.91 和1.38 eV, 表现出优异的催化性能. 本研究所建立的模型和计算结果可为CO2氧化C3H8 脱氢反应催化剂的设计和开发提供理论参考.
| [1] |
Propane dehydrogenation: Catalyst development, new chemistry, and emerging technologies[J]. Chem Soc Rev, 2021, 50(5): 3315–3354.
DOI:10.1039/D0CS00814A |
| [2] |
Cu-promoted zirconia catalysts for non-oxidative propane dehydrogenation[J]. Appl Catal A-Gen, 2019, 586: 117211.
DOI:10.1016/j.apcata.2019.117211 |
| [3] |
Oxidative dehydrogenation of propane into propene over chromium oxides[J]. Ind Eng Chem Res, 2022, 61(13): 4546–4560.
DOI:10.1021/acs.iecr.2c00813 |
| [4] |
Advanced design and development of catalysts in propane dehydrogenation[J]. Nanoscale, 2022, 14(28): 9963–9988.
DOI:10.1039/D2NR02208G |
| [5] |
CexZr1−xO2-supported CrOx catalysts for CO2-assisted oxidative dehydrogenation of propane-probing the active sites and strategies for enhanced stability[J]. ACS Catal, 2022, 13(1): 213–223.
DOI:10.1021/acscatal.2c05286 |
| [6] |
Comparison of direct and CO2-oxidative dehydrogenation of propane[J]. Trends Chem, 2023, 5(11): 840–852.
DOI:10.1016/j.trechm.2023.09.001 |
| [7] |
Oxidative dehydrogenation of propane to propylene with soft oxidants via heterogeneous catalysis[J]. ACS Catal, 2021, 11(4): 2182–2234.
DOI:10.1021/acscatal.0c03999 |
| [8] |
Kinetic modeling of the oxidative dehydrogenation of propane with CO2 over a CrOx/SiO2 catalyst and assessment of CO2 utilization[J]. Chem Eng J, 2024, 494: 153178.
DOI:10.1016/j.cej.2024.153178 |
| [9] |
Facilitating CO2 dissociation via Fe doping on supported vanadium oxides for intensified oxidative dehydrogenation of propane[J]. Chem Eng J, 2024, 481: 148231.
DOI:10.1016/j.cej.2023.148231 |
| [10] |
Active and selective nature of supported CrOx for the oxidative dehydrogenation of propane with carbon dioxide[J]. Appl Catal B-Environ, 2021, 297: 120400.
DOI:10.1016/j.apcatb.2021.120400 |
| [11] |
CO2 assisted oxidative dehydrogenation of propane to propylene over fluidizable MoO3/La2O3-γAl2O3 catalysts[J]. J CO2 Util, 2020, 42: 101329.
DOI:10.1016/j.jcou.2020.101329 |
| [12] |
Preparation of highly dispersed chromium oxide catalysts supported on mesoporous silica for the oxidative dehydrogenation of propane using CO2: Insight into the nature of catalytically active chromium sites[J]. ACS Catal, 2012, 2(9): 1893–1903.
DOI:10.1021/cs300198u |
| [13] |
Structured bifunctional catalysts for CO2 activation and oxidative dehydrogenation of propane[J]. ACS Sustainable Chem Eng, 2021, 9(16): 5716–5727.
DOI:10.1021/acssuschemeng.1c00882 |
| [14] |
Catalytic performance and stability of Fe-doped CeO2 in propane oxidative dehydrogenation using carbon dioxide as an oxidant[J]. Catal Sci Technol, 2020, 10(13): 4362–4372.
DOI:10.1039/D0CY00586J |
| [15] |
Effect of acid-base characteristics of In2O3-Al2O3(ZrO2) compositions on their catalytic properties in the oxidative dehydrogenation of propane to propylene with CO2[J]. Theor Exp Chem, 2019, 55(3): 207–214.
DOI:10.1007/s11237-019-09610-9 |
| [16] |
Screening of transition metal doped two-dimensional C2N (TM-C2N) as high-performance catalyst for the non-oxidative propane dehydrogenation[J]. Mol Catal, 2022, 528: 112501.
DOI:10.1016/j.mcat.2022.112501 |
| [17] |
On-purpose design of dual active sites in single V atom anchored C2N nanosheets for propane dehydrogenation catalysis[J]. Inorg Chem Front, 2022, 9(21): 5517–5526.
DOI:10.1039/D2QI01463G |
| [18] |
Single-atom molybdenum-N3 sites for selective hydrogenation of CO2 to CO[J]. Angew Chem Int Edit, 2022, 61(37): e202203836.
DOI:10.1002/anie.202203836 |
| [19] |
Direct and highly selective conversion of synthesis gas into lower olefins: Design of a bifunctional catalyst combining methanol synthesis and carbon-carbon coupling[J]. Angew Chem Int Edit, 2016, 55(15): 4725–4728.
DOI:10.1002/anie.201601208 |
| [20] |
Simultaneous activation of CH4 and CO2 for concerted C-C coupling at oxide-oxide interfaces[J]. ACS Catal, 2019, 9(4): 3187–3197.
DOI:10.1021/acscatal.9b00291 |
| [21] |
Promoting electrocatalytic CO2 reduction to CO via sulfur-doped Co-N-C single-atom catalyst[J]. Chin J Chem, 2023, 41(24): 3553–3559.
DOI:10.1002/cjoc.202300372 |
| [22] |
Investigating the synergistic effect of sulfur and nitrogen co-doping in graphene for enhanced CO2 reduction to CO: A computational study[J]. Diam Relat Mater, 2023, 139: 110310.
DOI:10.1016/j.diamond.2023.110310 |
| [23] |
Density functional theory of electronic structure[J]. J Phys Chem, 1996, 100(31): 12974–12980.
DOI:10.1021/jp960669l |
| [24] |
DFT study on adsorption and cracking mechanism of methanol on the Cu4-C5N2H2 surface(甲醇在Cu4-C5N2H2表面吸附和裂解机理的DFT研究)[J]. J Mol Catal (China)(分子催化(中英文)), 2025, 39(1): 34–40.
DOI:10.16084/j.issn1001-3555.2025.01.004 |
| [25] |
A density functional theory study on the reaction mechanism for synthesis of 2,5-dihydroxyterephthalic acid by aromatization(芳构化法合成2,5-二羟基对苯二甲酸反应机理的密度泛函理论研究)[J]. J Mol Catal (China)(分子催化(中英文)), 2024, 38(3): 234–244.
DOI:10.16084/j.issn1001-3555.2024.03.005 |
| [26] |
Research progress of the DFT study on the acetylene hydrochlorination over gold catalyst(金催化乙炔氢氯化的密度泛函理论研究进展)[J]. J Mol Catal (China)(分子催化(中英文)), 2024, 38(3): 273–283.
DOI:10.16084/j.issn1001-3555.2024.03.009 |
| [27] |
Density functional theory calculation of CO2 hydrogenation over single Zr atom incorporated N doped graphene(氮掺杂石墨烯负载单原子Zr催化CO2加氢的密度泛函理论研究)[J]. J Mol Catal (China)(分子催化), 2023, 37(5): 419–427.
DOI:10.16084/j.issn1001-3555.2023.05.001 |
| [28] |
N-ligand regulated heterogenous copper catalyst for selective hydrogenation of cinnamaldehyde(1,10-菲啰啉修饰Cu/Al2O3催化肉桂醛羰基高效选择性加氢)[J]. J Mol Catal (China)(分子催化), 2023, 37(3): 213–224.
DOI:10.16084/j.issn1001-3555.2023.03.001 |
| [29] |
Accurate and simple analytic representation of the electron-gas correlation energy[J]. Phys Rev B, 1992, 45(23): 13244–13249.
DOI:10.1103/PhysRevB.45.13244 |
| [30] |
A consistent and accurate ab initio parametrization of density functional dispersion correction (DFT-D) for the 94 elements H-Pu[J]. J Chem Phys, 2010, 132(15): 154104.
DOI:10.1063/1.3382344 |
| [31] |
A climbing image nudged elastic band method for finding saddle points and minimum energy paths[J]. J Chem Phys, 2000, 113(22): 9901–9904.
DOI:10.1063/1.1329672 |
| [32] |
Nitrogenated holey two-dimensional structures[J]. Nat Commun, 2015, 6(1): 6486.
DOI:10.1038/ncomms7486 |
| [33] |
Single-and double-atom catalyst anchored on graphene-like C2N for ORR and OER: Mechanistic insight and catalyst screening[J]. Carbon Lett, 2024, 34(5): 1367–1383.
DOI:10.1007/s42823-024-00693-6 |
 2025, Vol. 39
2025, Vol. 39


