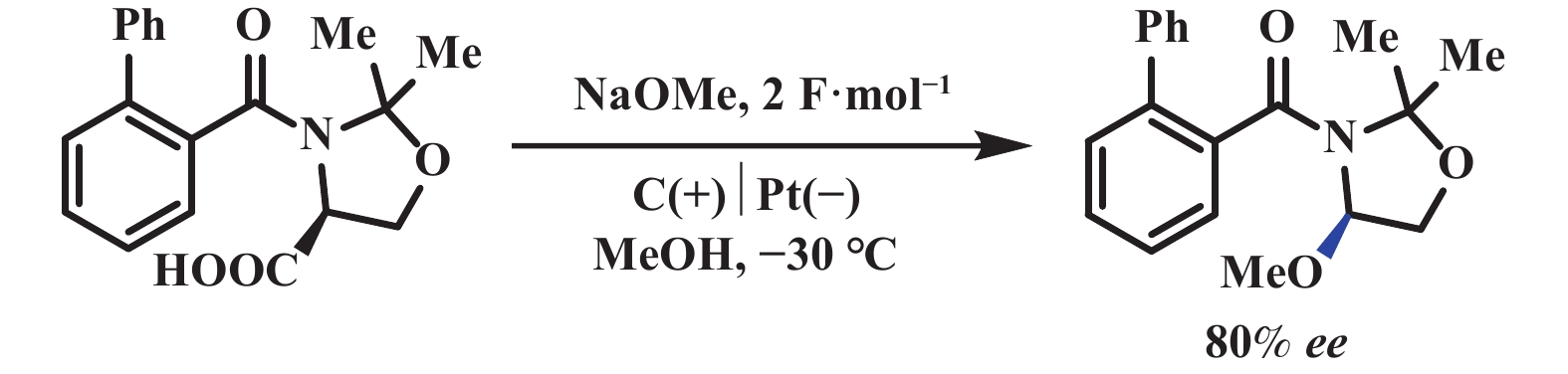脂肪族羧酸作为一类重要的有机合成砌块, 因其具有稳定、无毒、廉价且易于获取的特点, 可从天然资源或通过合成来制得. 在诸多涉及羧酸的反应中, 脱羧反应是构建各类化学键的有效策略, 能够合成多种有价值的化合物, 如天然产物、药物活性成分和农用化学品等[1−5]. 然而, 传统的脱羧反应通常需要在高温条件下进行, 且依赖于过渡金属或光化学介导, 存在使用昂贵催化剂、强氧化剂或高温反应等问题[6−8]. 电化学脱羧偶联反应作为一种新兴的有机合成方法, 近年来受到广泛关注. 该反应通过阳极直接氧化或间接氧化羧酸, 使其转化为活性自由基或碳正离子中间体, 进而实现碳–碳键及碳–杂原子键的形成. 与传统的过渡金属催化和光催化脱羧反应相比, 电化学脱羧反应具有诸多优势, 如反应条件温和、无需额外添加氧化剂和强碱, 副产物通常为CO2和H2, 符合绿色化学和可持续发展的要求[9−13]. 自1848年Kolbe首次报道电解脱羧反应以来, 电化学脱羧技术经历了漫长的发展历程[14−15]. 近年来, 随着电化学合成装置的改进和新催化体系的开发, 电化学脱羧反应在选择性、底物适用性和官能团耐受性等方面取得了显著进展. 本文重点介绍过渡金属催化的电化学脱羧在C―C、C―N、C―O、C―S和C―X键形成中的最新研究进展, 并探讨其反应机理和应用前景, 为相关领域的研究者提供参考.
1 电化学脱羧形成C―C键电化学金属催化将电化学和金属催化相结合起来, 极大地拓宽了电化学合成的范围. 2014年, MacMillan和Doyle课题组开创性地报道了光/镍协同催化的脂肪酸和芳基卤化物的脱羧偶联反应[16]. 在该反应体系中, 光催化剂诱导脂肪酸发生脱羧反应, 产生的烷基自由基与芳基卤化物在镍催化下进行交叉偶联, 从而实现C(sp3)–C(sp2)键的构建. 2016年, Weix课题组[17]探索利用NHPI酯和锌粉还原剂在镍催化下实现C(sp3)–C(sp2)脱羧偶联反应. NHPI酯作为一种常见的氧化还原活性酯, 在反应中作为烷基自由基前体. 在锌粉和镍催化剂的共同作用下, NHPI酯发生脱羧反应, 生成的烷基自由基与相应的芳基卤化物进行交叉偶联. 然而, 上述两种方法存在能量转换效率低和使用金属还原剂的弊端. 针对上述问题, 2018年, Bio课题组[18]发展了一种镍催化电化学还原脱羧偶联反应. 该反应采用分室电解池, 反应以亲电性的NHPI酯和碘苯作为原料, RVC作为阴、阳极材料, 三乙胺作为牺牲阳极试剂, 以中等的收率得到目标产物. 机理研究表明: NHPI酯经历阴极单电子还原产生烷基自由基R•, 芳基碘与LnNi0发生氧化加成, 生成Ar–LnNiⅡX中间体, 随后与R•反应, 生成Ar–LnNiIII–R活性物种, 经还原消除得到目标产物和LnNiIX, LnNiIX中间体再经阴极还原实现完成LnNi0的催化循环(图1).
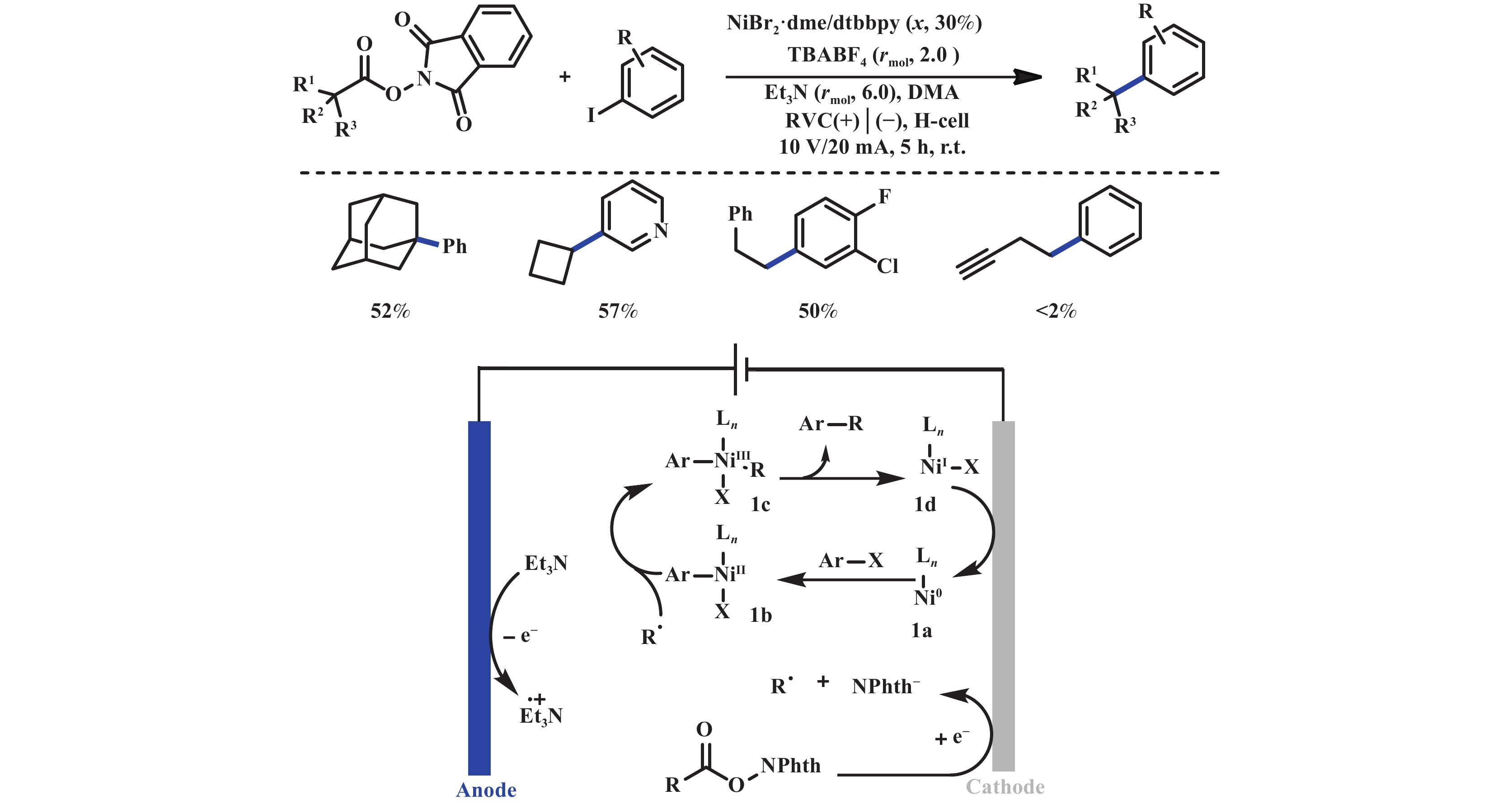
|
图 1 镍催化的电化学脱羧C(sp3)–C(sp2)偶联反应[18] Fig.1 Nickel-catalyzed electrochemical decarboxylative C(sp3)–C(sp2) couplings[18] |
2019年, 曾程初课题组[19]报道了电化学驱动镍催化的NHPI酯与喹喔啉酮还原脱羧偶联反应. 该反应能够以中等至优异的产率得到3-烷基喹喔啉酮. 反应机理涉及Ni(Ⅱ)在阴极还原为Ni(Ⅰ), 与NHPI酯发生单电子还原生成Ni(Ⅱ)物种和环己基自由基. 无法排除的是, NHPI酯也有可能直接在阴极还原生成环己基自由基. 随后, 环己基自由基加成到喹喔啉酮Ni(Ⅱ)物种2.1, 产生自由基阳离子中间体2.2, 随即, 脱质子产生中间体2.3. 最后经单电子氧化, 失去一分子Ni(Ⅱ)得到最终产物2.4(图2). 同年, Loren课题组[20]利用烷基羧酸盐和N-羟基邻苯二甲酰亚胺四甲基脲六氟磷酸盐(PITU)原位制备NHPI酯, 在镍催化下实现一锅法电还原脱羧交叉偶联反应. 该反应使用锌作牺牲阳极, RVC为阴极, 3 mA的恒定电流下, 以中等至优异的收率得到目标产物. 但该体系难以兼容碘代杂芳烃和给电子取代基的碘代芳烃, 对于羧酸底物仅适用于一级和二级羧酸, 对于三级酸和α-氨基酸类底物反应效果不佳(图3).
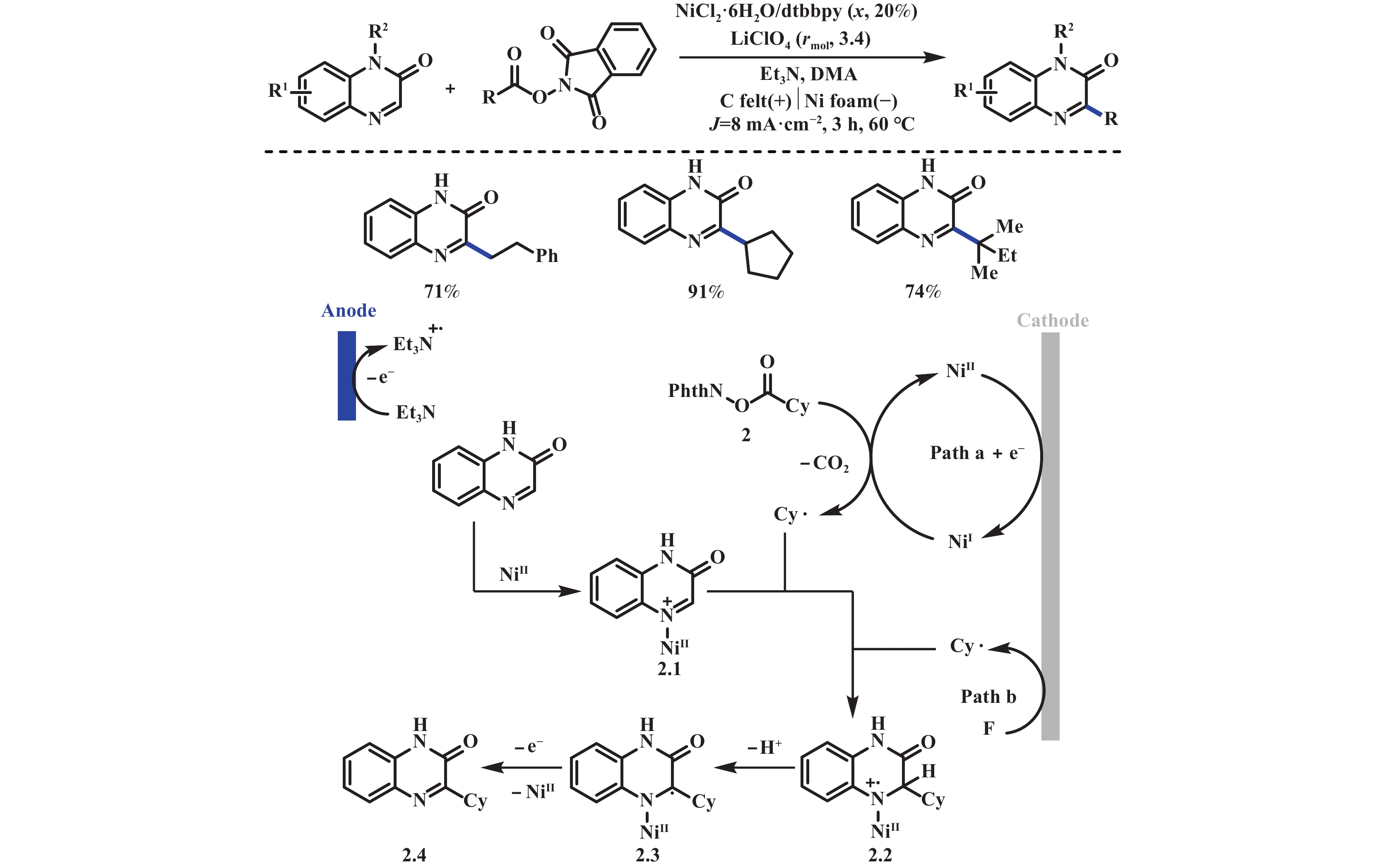
|
图 2 电化学驱动镍催化的C(sp3)–C(sp2)偶联反应[19] Fig.2 Nickel-catalyzed electrochemical decarboxylative C(sp3)–C(sp2) couplings[19] |
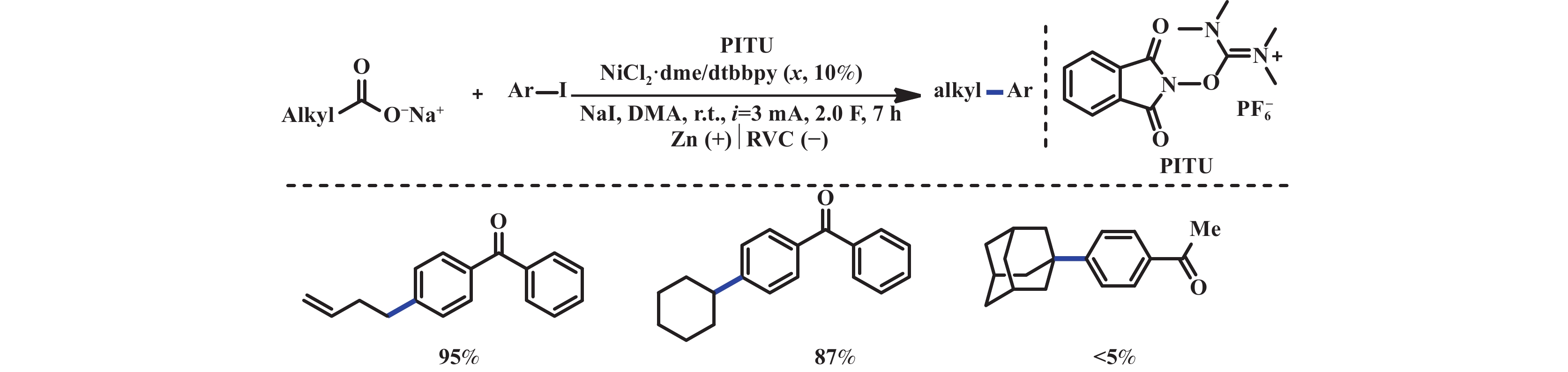
|
图 3 电化学驱动镍催化的脱羧芳基化反应[20] Fig.3 Electrochemically driven nickel-catalyzed decarboxylative arylation reaction[20] |
2022年, 梅天胜课题组[21]采用汇聚型成对电解的策略实现了镍催化的吲哚3-乙酸与芳基溴脱羧交叉偶联反应. 该反应无需氧化还原试剂和牺牲电极, 芳基溴试剂底物适用范围较广, 但羧酸类底物局限于受保护的吲哚乙酸. 该反应能够成功实现的关键在于阳极氧化脱羧与阴极亲电试剂还原, 两者间的速率和电势要相互匹配, 且产生的中间体至少有一个足够稳定能够迁移至对电极表面. 机理研究表明: 该反应涉及NiI/NiⅢ的催化循环过程, 有机碱对脱羧反应至关重要, 能够有效降低羧酸的氧化电位(图4).
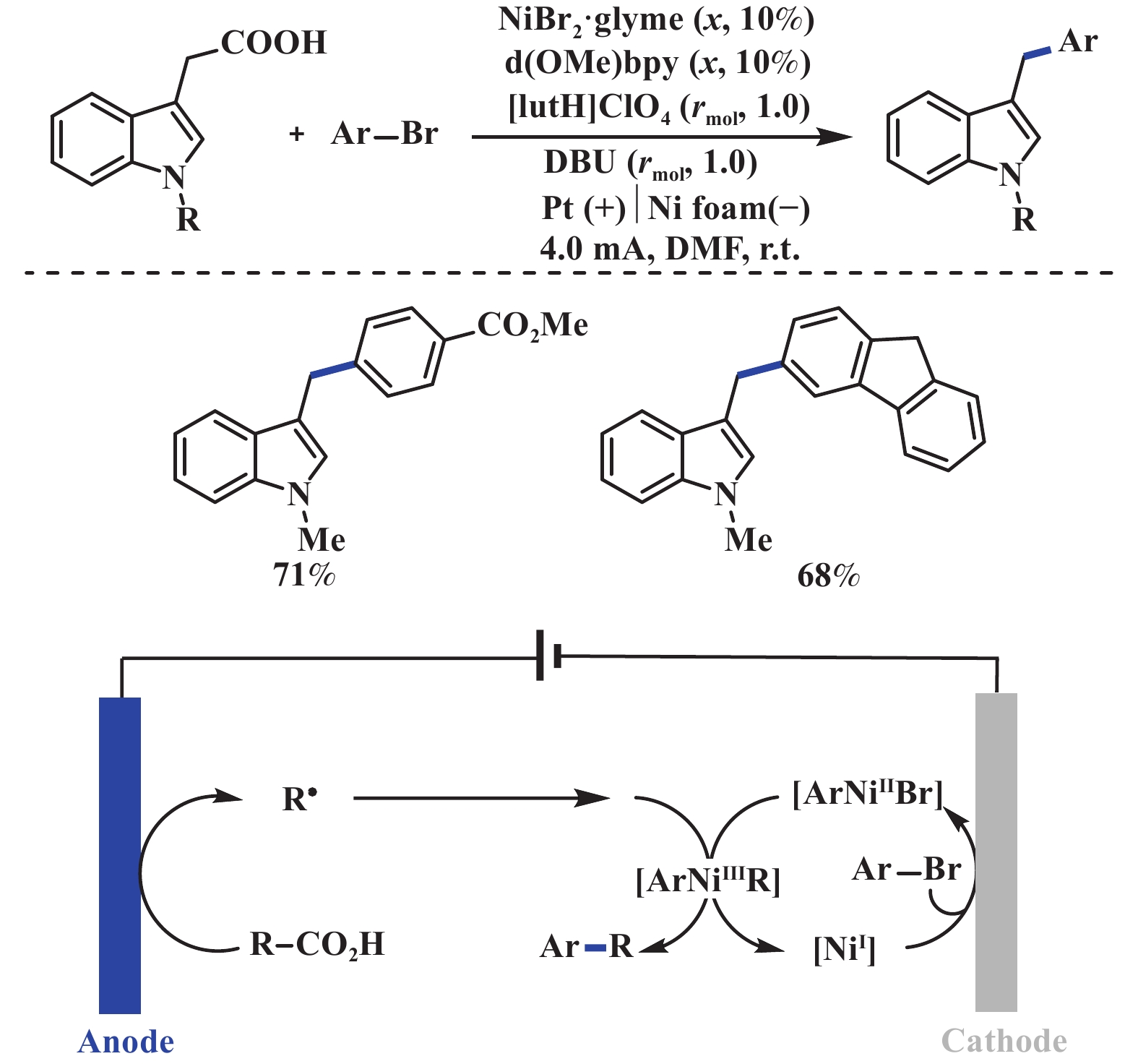
|
图 4 电化学驱动镍催化的吲哚3-乙酸脱羧芳基化反应[21] Fig.4 Electrochemical nickel-catalyzed decarboxylative arylation of indole-3-acetic acid[21] |
2023年, 付年凯课题组[22]采用光电协同双金属催化的策略, 实现了具有挑战性的简单脂肪酸脱羧芳基化反应. 该反应是一个汇聚型成对电解反应, 阳极氧化产生Ce(Ⅳ)羧酸盐, 阴极还原产生Ni(Ⅱ)芳基物种. 该反应成功的关键在于生成的两种金属中间体具有相对稳定性, 因此它们可以迁移至本体溶液中进行脱羧偶联反应. 该策略克服了传统汇聚式成对电解的局限性, 即由自由基物种的短暂寿命所引起的. 值得注意的是, 乙酸甚至氘代乙酸在该体系中同样适用, 可应用于同位素标记的生物活性分子当中. 循环伏安研究表明(CV), 邻苯二甲酰亚胺能够保护芳基Ni(Ⅱ)配合物, 从而避免受阳极氧化和阴极还原的影响(图5). 同年, 徐海超、张俊良、付年凯课题组[23−25]独立报道了光电化学金属催化的脱羧不对称氰基化反应. 这些课题组采用相同的反应设计, 通过LMCT(Ligand-to-Metal Charge Transfer)策略, 使用Ce催化剂来诱导脱羧, Cu/二噁唑啉配合物来促进不对称氰基化反应. 机理研究表明, 可见光诱导Ce(Ⅳ)―O键均裂, 随后脱羧, 产生苄基自由基. Cu(Ⅱ)捕获苄基自由基, 随后还原消除得到氰基化产物. 与此同时, Ce(Ⅳ)和Cu(Ⅱ)再次在阳极氧化再生, 重新参与到催化循环中(图6).
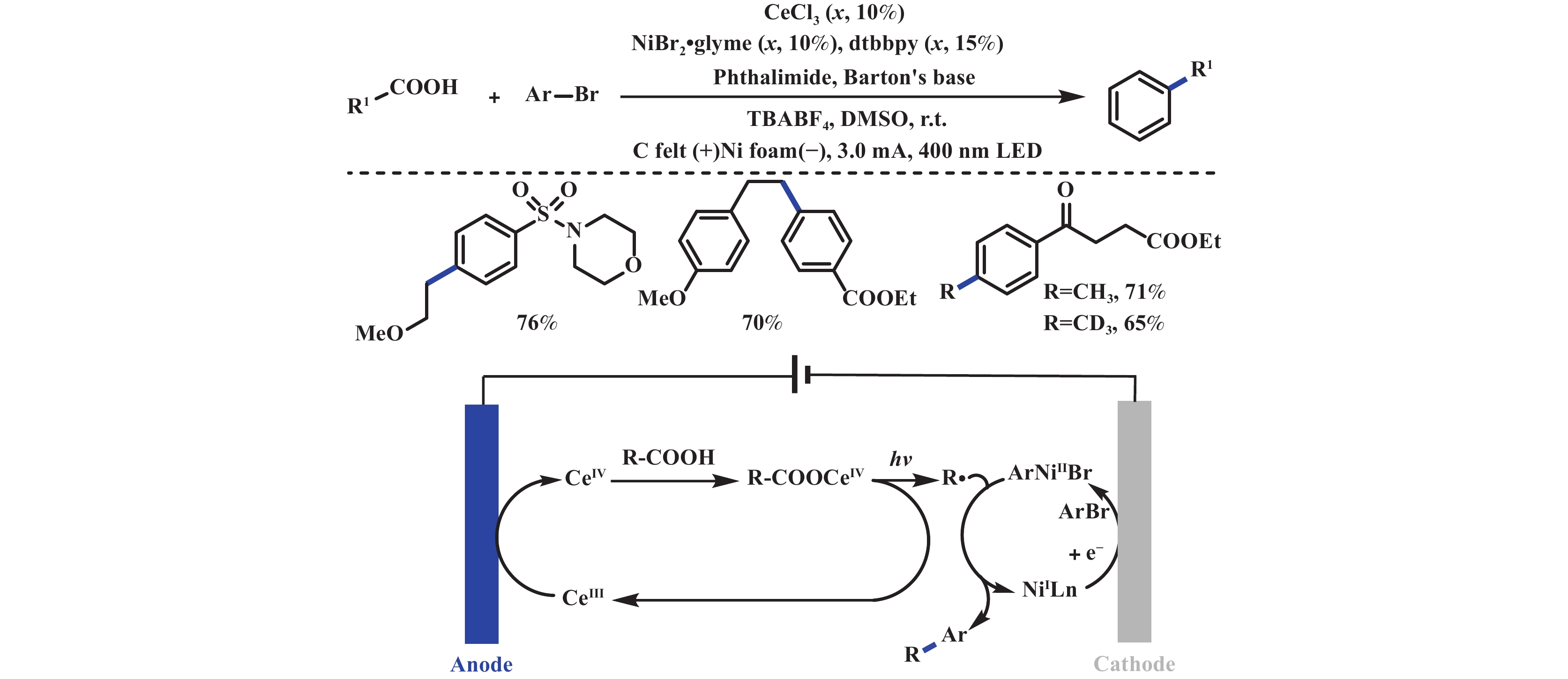
|
图 5 光电协同金属催化脱羧芳基化[22] Fig.5 Electrophotochemical synergistic metal-catalyzed decarboxylative arylation[22] |
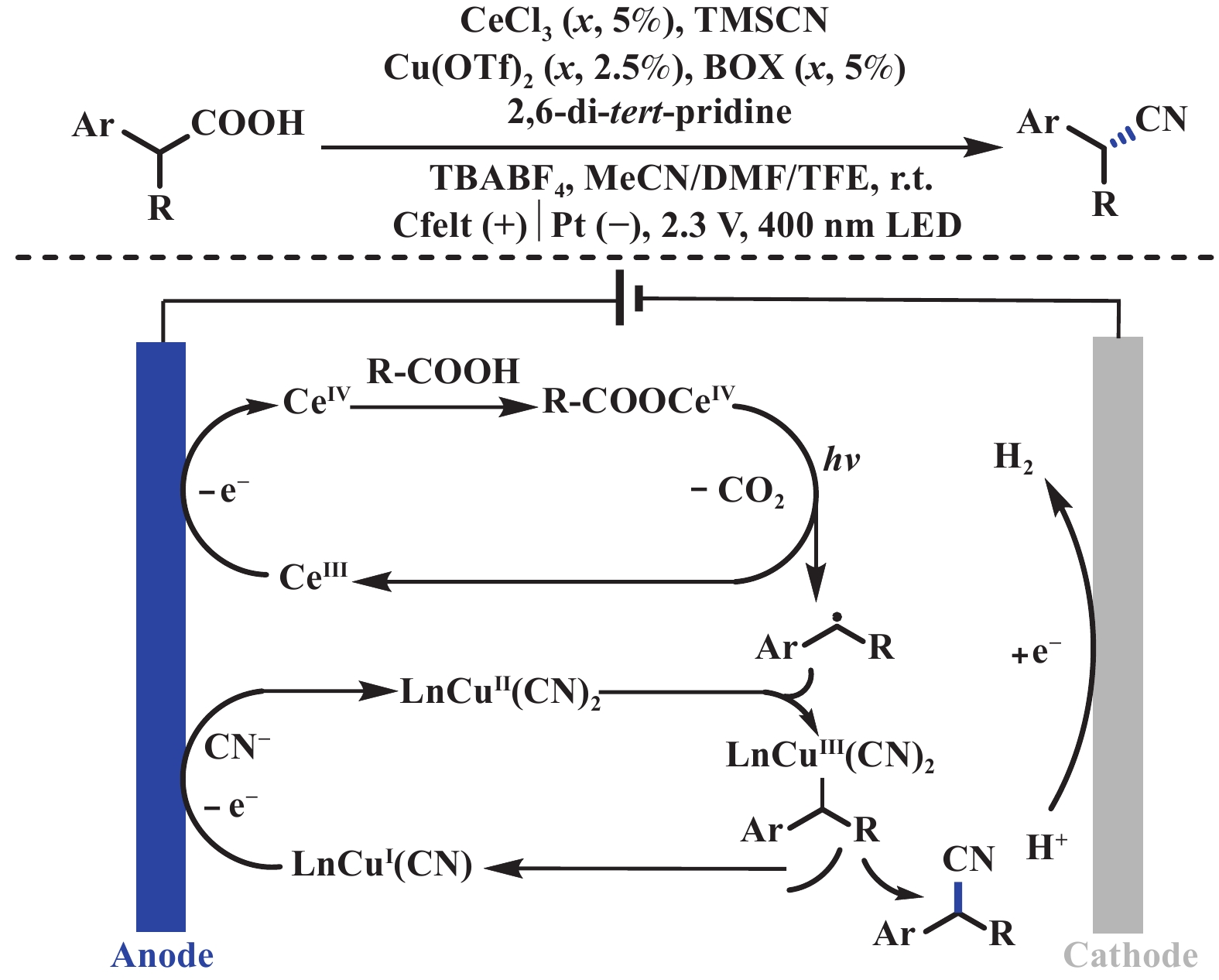
|
图 6 光电协同铜催化不对称脱羧氰基化[23−25] Fig.6 Electrophotochemical synergistic copper-catalyzed asymmetric decarboxylative cyanation[23−25] |
基于光电协同双金属催化的策略, 付年凯课题组[26]进一步实现了直接脱羧烯基化反应. 该反应通过Ce/Ni双过渡金属电催化, 实现了脂肪族羧酸与乙烯基卤化物的直接脱羧烯基化, 用于合成各种取代烯烃和天然复杂酸的直接修饰, 并可用于芳基乙酸的不对称脱羧烯基化反应. 值得注意的是, 简单的一级烷基羧酸可以轻易地作为碳中心自由基前体参与反应, 反应体系需要加入苯甲酸钾来稳定Ni(Ⅱ)物种, 确保该物种能够迁移至对电极并捕获烷基自由基(图7).
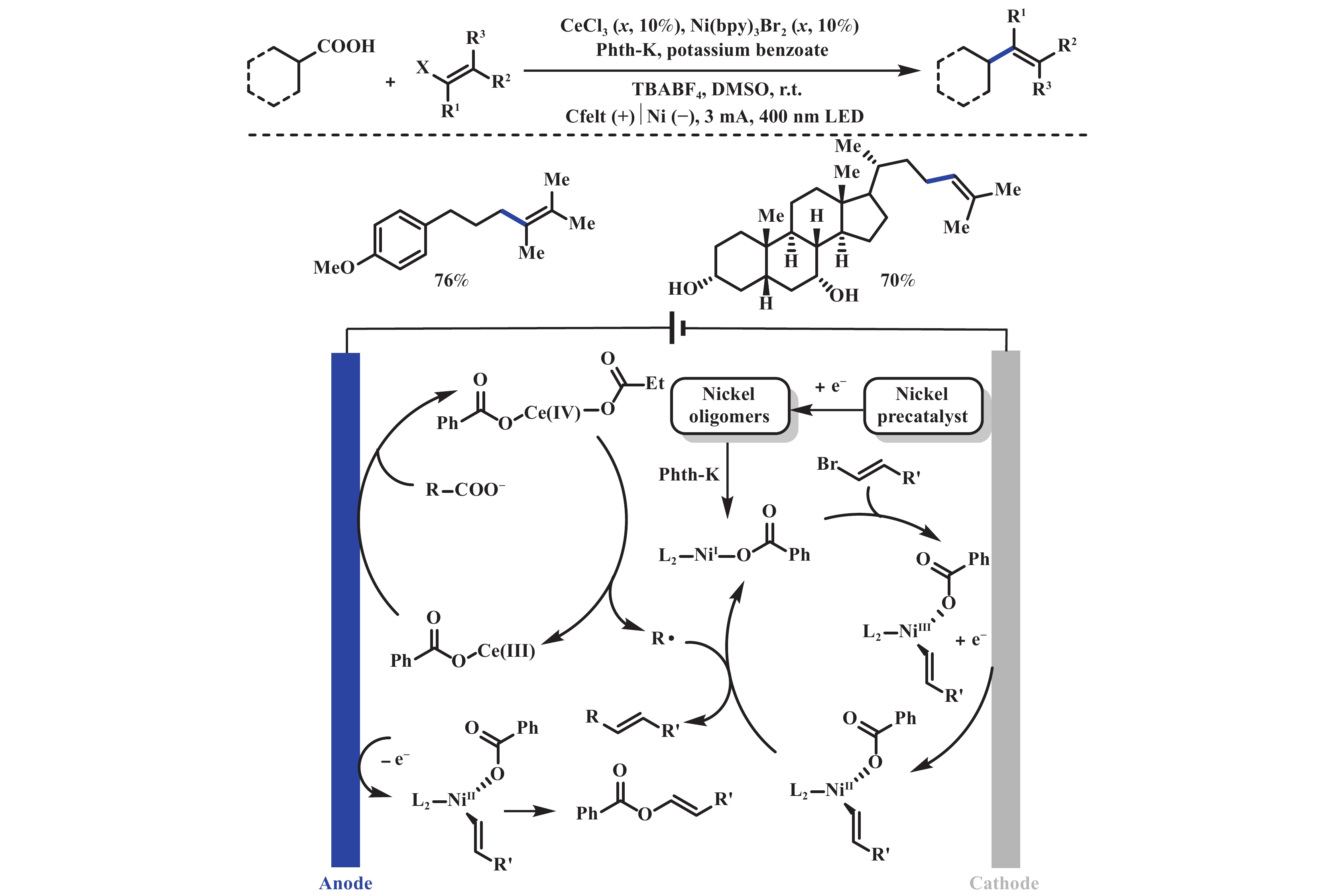
|
图 7 光电协同金属催化脱羧烯基化[26] Fig.7 Electrophotochemical synergistic metal-catalyzed decarboxylative alkenylation[26] |
2024年, 李超课题组[27]采用汇聚型成对电解的策略实现了电化学脱羧C(sp2)–C(sp3)交叉偶联反应, 该反应使用廉价易得的烷基羧酸和C(sp2)–I作为底物, 反应条件温和, 无需对天然脂肪酸进行预活化, 并且广泛适用于各种芳基、杂芳基和烯基碘化物, 从而为C(sp2)–C(sp3)键的构建提供了强大而灵活的途径. 机理研究表明: 该反应通过阳极PPh3/NaI介导生成N-羟基邻苯二甲酰亚胺酯, 从而原位活化羧酸; 与此同时, 阴极发生由Ni (Ⅰ)物种促进的还原交叉偶联过程(图8).
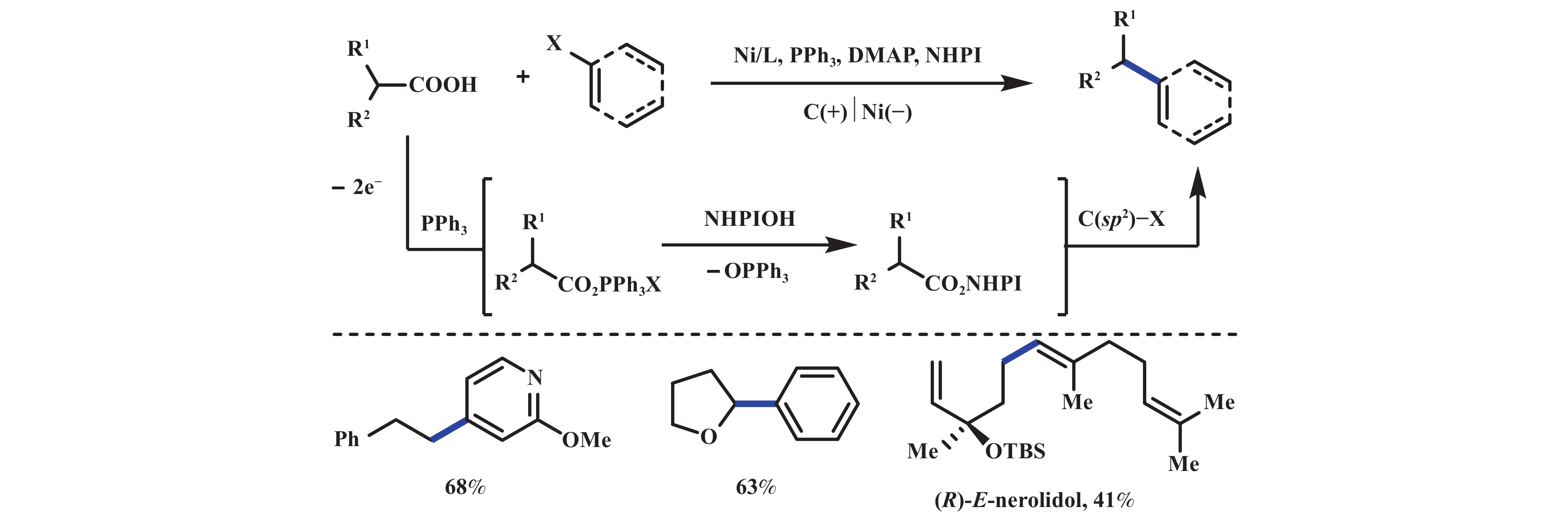
|
图 8 成对电解脱羧C(sp2)–C(sp3)交叉偶联[27] Fig.8 Paired electrolytic decarboxylative C(sp2)–C(sp3) cross-coupling[27] |
Kolbe异组分偶联反应通常局限于结构简单的一级羧酸和可产生相对稳定自由基的二级羧酸之间, 对于含氮官能团(如酰胺、胺)以及更复杂的底物却无法实现. 2022年, Baran教授团队[28]利用镍-电催化策略, 成功实现了两种羧酸原位生成氧化还原活性酯(Redox active ester, RAEs)的双脱羧交叉偶联反应, 极大地简化了复杂分子的合成步骤. 该反应不仅操作简单、条件温和、官能团耐受性好, 而且可实现1°–1°、1°–2°、1°–3°、2°–2°等不同位阻碳中心的交叉偶联反应. 此外, 该反应无需严格的无水无氧条件即可通过一锅法实现, 即在反应体系中原位生成RAEs, 无需分离纯化及溶剂置换即可直接参与后续的电还原脱羧偶联反应(图9).
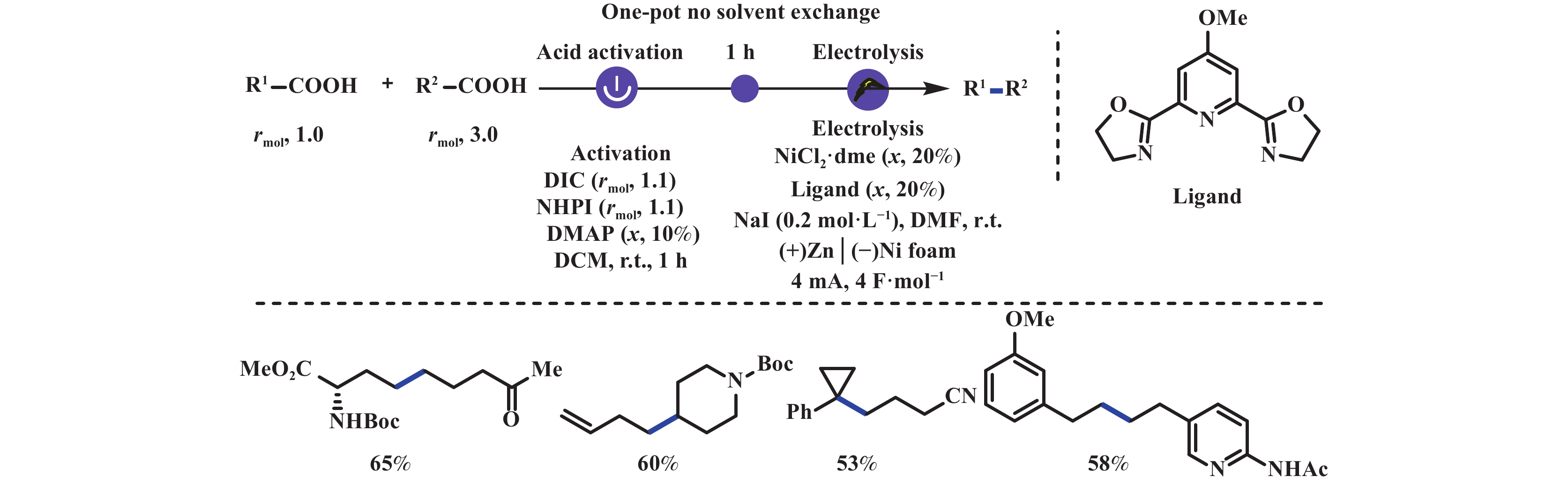
|
图 9 镍-电催化双脱羧交叉偶联反应[28] Fig.9 Nickel-electrocatalytic double decarboxylation cross-coupling reaction[28] |
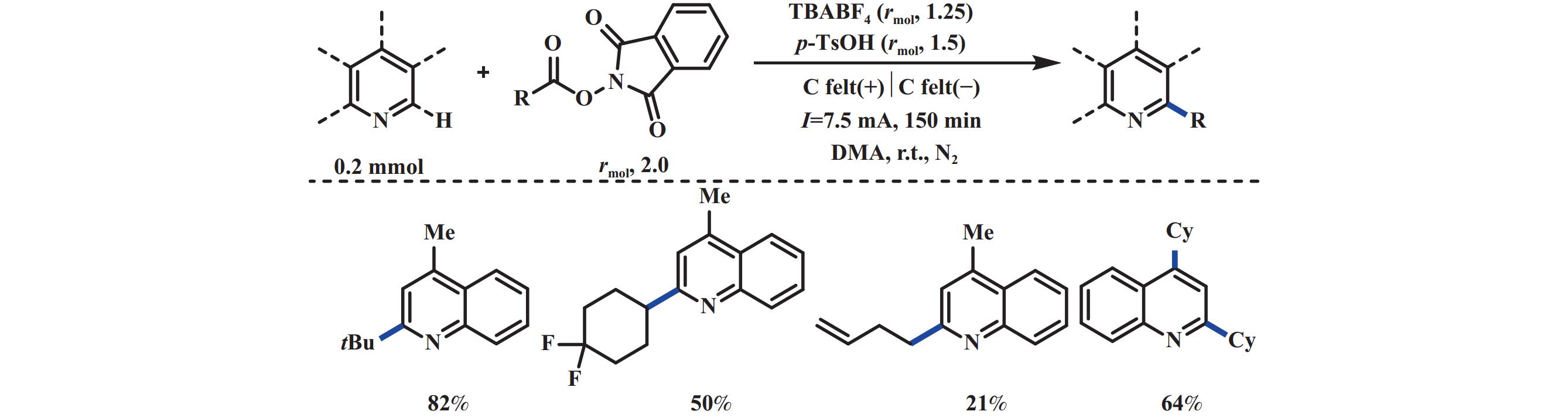
Minisci反应是烷基或者酰基自由基对缺电子芳杂环的亲核自由基取代反应, 是合成各种取代芳杂环化合物直接有效的方法之一. 2019年, 雷爱文课题组[29]报道了一种无需金属催化剂便可实现NHPI酯与喹啉之间的电化学脱羧Minisci反应. 该反应能够兼容一级、二级、三级烷基酸, 并能以中等至优异的产率得到目标产物. 然而, 一级酸反应效果不佳, 这可能跟一级碳自由基过于活泼有关. 体系中对甲苯磺酸(p-TsOH)提供酸性环境, 具有活化喹啉的作用. 该反应另外一个特点是使用廉价的碳毡作为电极, 在7.5 mA恒电流条件下电解, 仅需2.5 h便可完全转化, 凸显出电化学反应的高效性(图10).
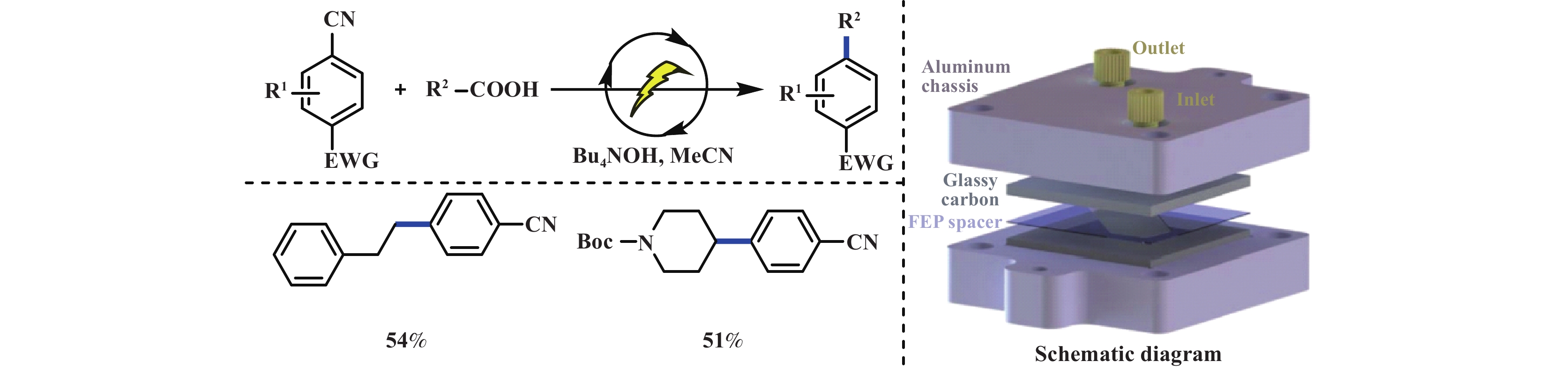
在传统电化学装置中, 阴阳极之间的距离从毫米到厘米不等, 产生的稳态自由基来不及扩散到瞬态自由基附近便会失活, 因此无法实现有效的交叉偶联. 而微流控技术可以实现微米级通道, 提供可控的、快速的物质传输机会. 2020年Jensen教授和Buchwald教授[30]合作利用微流控技术实现了在两个电极同时产生活性中间体, 并发生自由基–自由基交叉偶联反应和Minisci反应等. 该反应成功的关键在于正负电极之间相距仅有25 μm, 确保了活性中间体在分解之前能够发生反应(图11). 已报道的Minisci酰基化反应大多使用过渡金属催化剂和强氧化剂, 然而酰化产物存在过度氧化和多取代的缺点. 2017年曾程初课题组[31]利用α-酮酸作为酰基化试剂首次报道了缺电子含氮芳杂环化合物的电化学脱羧Minisci反应. 他们以丙酮酸为酰基自由基前体, 价廉易得的NH4I作为氧化还原媒介, 石墨片为阴、阳极, 在3 mA∙cm−2恒电流电解下, 实现了多种喹喔啉衍生物的乙酰化. 该反应具有良好的底物普适性和官能团容忍性. 此外, 在低电流密度下, 能够维持酰基自由基在较低的浓度, 进而实现氮杂芳烃的单酰基化. 值得注意的是, 添加六氟异丙醇, 不仅可用于阴极析氢, 还可以稳定酰基自由基. 机理研究表明, α-酮酸首先和氮杂芳烃相互作用, 形成α-酮酸阴离子和质子化的氮杂芳烃. 随后, α-酮酸阴离子与阳极原位生成的I2反应形成碘代的α-酮酸中间体(CH3COCOOI), 该中间体均裂产生碘自由基和羧基自由基, 随即脱羧产生酰基自由基, 并与质子化的氮杂芳烃反应, 最后氧化脱去质子生成目标产物(图12). 在此基础上, 2019年该课题组又相继报道了在镍催化下α-酮酸为酰基源的电化学脱羧Minisci酰基化反应[32]. 该反应以铂为阳极、石墨为阴极, 在单室电解池中以中等收率得到目标产物. 其中, 底物范围由烷基酮酸进一步拓展至芳基酮酸, 但该反应无法适用于异喹啉、苯并噻唑类底物. 反应由Ni(Ⅱ)与酮酸的配合物经阳极单电子氧化产生Ni(Ⅲ)中间体, 随即经内球型电子转移过程产生酰基自由基, 进而发生后续反应(图13).
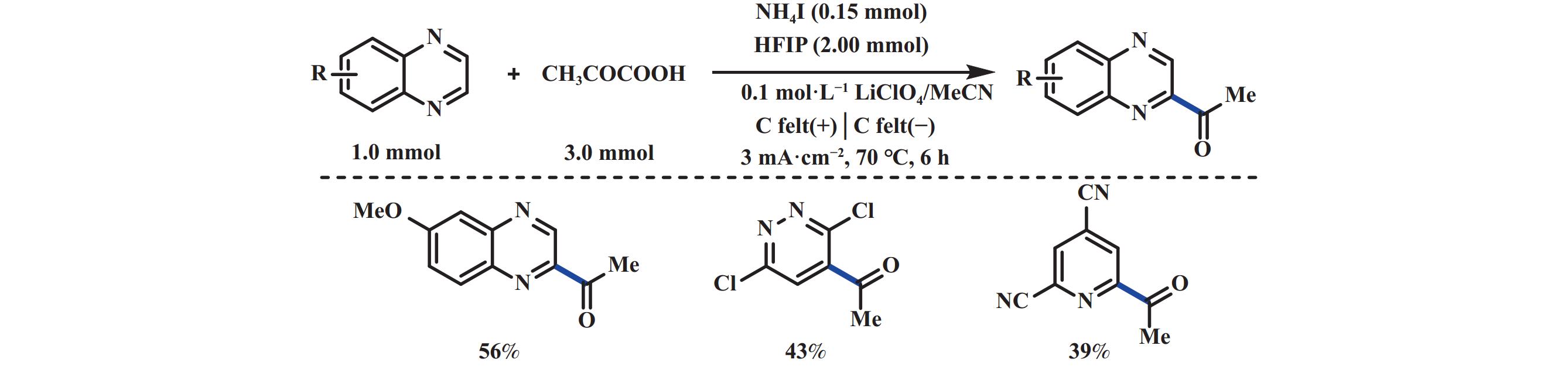
|
图 12 NH4I介导的电化学脱羧Minisci酰基化反应[31] Fig.12 NH4I-mediated electrochemical decarboxylative Minisci acylation[31] |
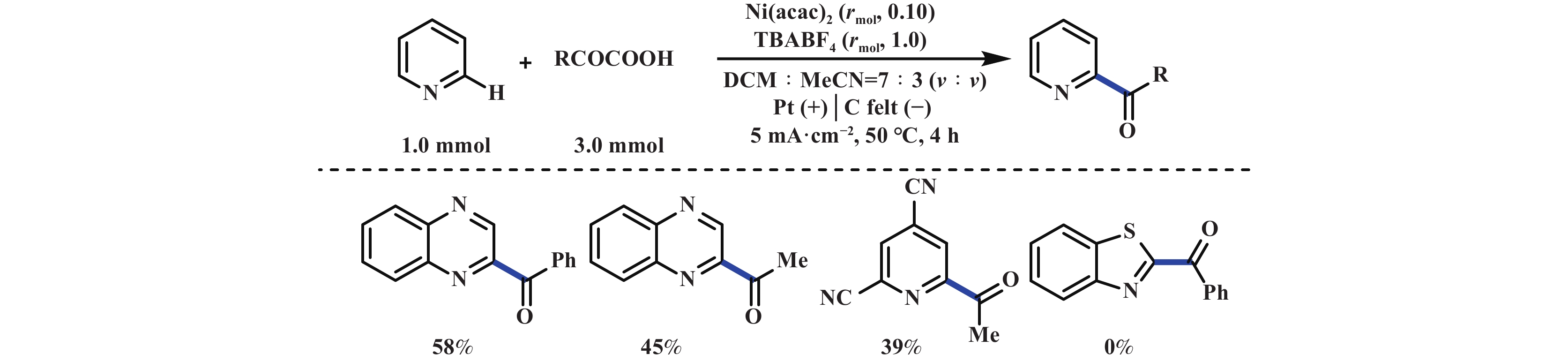
|
图 13 镍催化的电化学脱羧Minisci酰基化反应[32] Fig.13 Nickel-catalyzed electrochemical decarboxylative Minisci acylation[32] |
尽管羧酸的电催化氧化是一种极具吸引力的合成手段, 但其转化通常仅限于自偶联或进一步氧化后再被亲核性溶剂捕获. 这类反应通常需要在高电势下进行, 因而无法与一些金属催化剂相兼容. 2022年, Sevov课题组[33]报道了铁催化的缺电子烯烃氢烷基化反应. 该反应借助于羧酸盐在阳极表面聚集形成自组装单分子层, 继而优先促进羧酸的选择性氧化脱羧. 由于单分子层的存在阻止了易被氧化的铁催化剂扩散至阳极表面, 避免了铁催化剂的氧化失活. 此外, 单分子层并不会导致电极钝化, 而且在一定程度上抑制了电极的氧化浸出. 机理研究表明: 羧酸底物在阳极表面吸附, 避免了铁催化剂的氧化失活(图14).
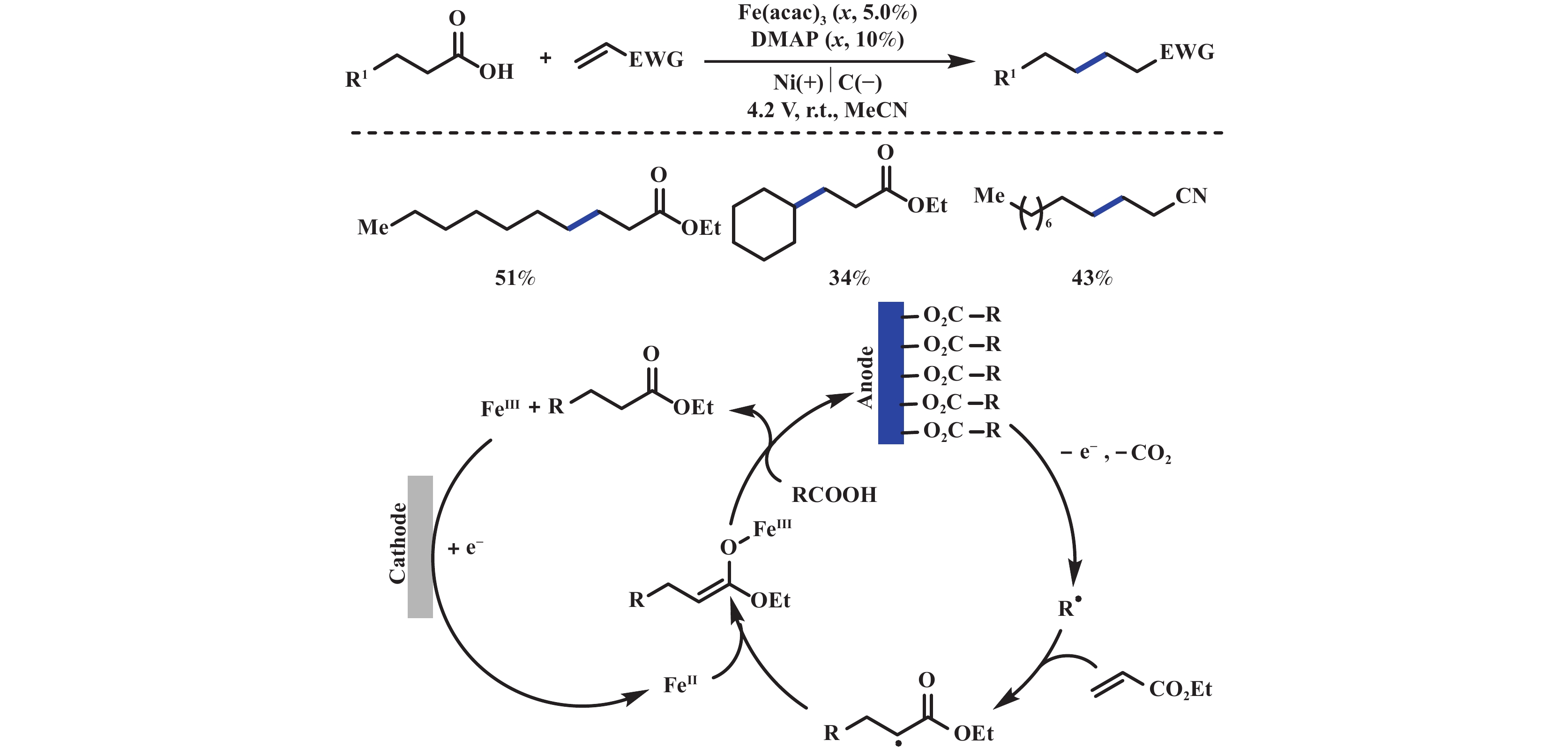
|
图 14 铁催化剂控制的电氧化自组装羧酸单分子层脱羧官能团化[33] Fig.14 Iron catalyst-controlled electrooxidation self-assembly carboxylic acid monolayer decarboxylation functionalization[33] |
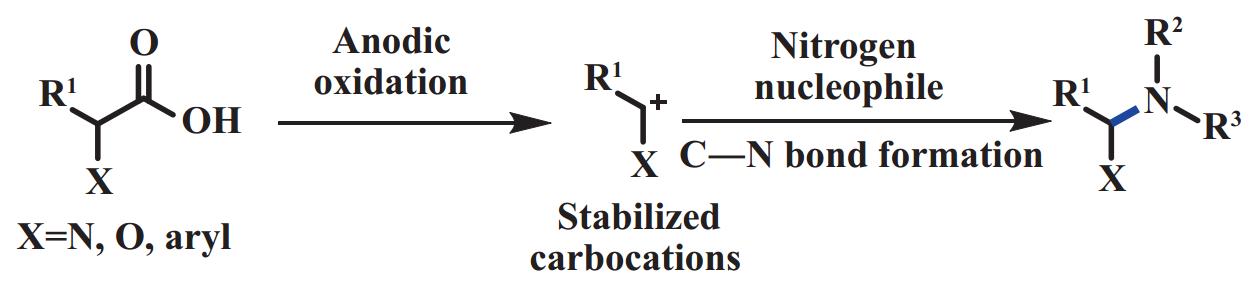
C―N键的构建是有机化学中最重要的转化之一, 由此产生的含氮化合物广泛存在于天然产物、医药、农药和材料工业中. 在几种形成C―N键的方法中, 过渡金属催化的交叉偶联反应被广泛研究. 电化学脱羧具有温和、高效、环境友好等特点, 吸引了研究人员在无金属催化剂和化学氧化剂条件下制备C―N键偶联的产物. 然而, 通过Hofer-Moest脱羧形成碳正离子中间体很容易发生副反应, 例如重排、消除或者与亲核性溶剂反应. 因此, 为了促进C―N键的形成, 所形成的碳正离子中间体需要足够稳定, 以便在分解前能够与亲核性较强的含氮试剂反应, 例如α-氮取代、α-氧取代羧酸, 苯乙酸类底物(图15).
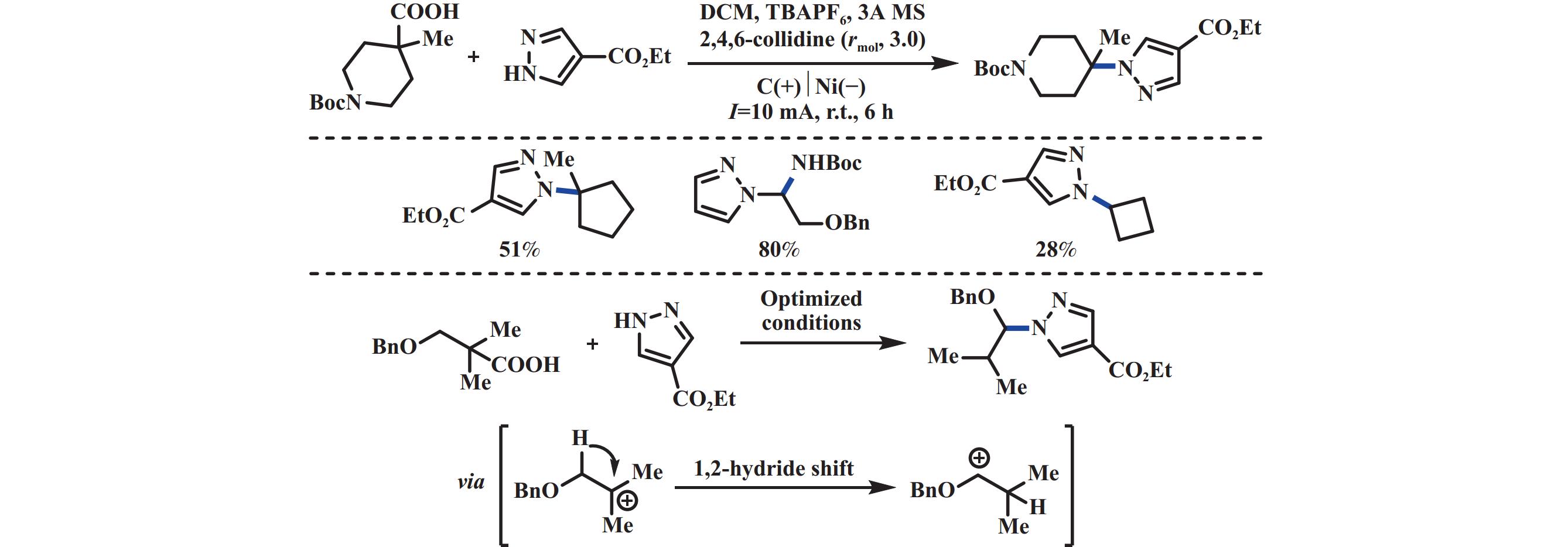
2019年, 汪志勇课题组[34]利用碘介导的电化学脱羧方式构筑C(sp2)–N键, 在没有金属和强氧化剂的情况下合成1,3-二取代咪唑[1,5-a]喹啉化合物. 机理研究表明: 首先, 阳极氧化产生的I2和喹啉原位形成碘代中间体. 之后该中间体和氨基酸反应得到胺取代中间体, 随后被I2氧化得到亚胺中间体. 进一步在I2和NaHCO3作用下生成酰基次碘酸盐中间体, 该中间体不稳定会立刻均裂脱羧, 最后经氧化胺化/芳构化, 得到最终产物(图16). 2019年, 王亚辉课题组[35]报道了通过电化学氧化氨基酸实现了C(sp3)–N偶联的反应. 该反应通过阳极氧化脱羧形成稳定的碳正离子中间体, 随后被唑类或酰胺类氮亲核试剂捕获, 生成C―N键偶联的产物. 该反应底物范围局限于能够产生稳定碳正离子的羧酸, 包括α-氮取代、α-氧取代类羧酸以及苯乙酸类底物. 各种氮亲核试剂如(1,2,3-三氮唑、苯并三氮唑和四氮唑衍生物)均能够有效地参与反应(图17). 2020年, Baran课题组[36]报道了电化学驱动阳极氧化脱羧实现了含氮杂环的烷基化反应. 该反应底物范围广, 不局限于能够产生稳定碳正离子的底物, 普通的二级、三级羧酸也能够以中等至优异的产率得到目标产物. 该反应以碳作阳极、镍作阴极, 2,4,6-collidine为有机碱, 通过向体系中加入分子筛, 可以有效地避免脱羧醚化的副产物. 机理验证实验表明: 该反应是一个碳正离子的过程(图18).
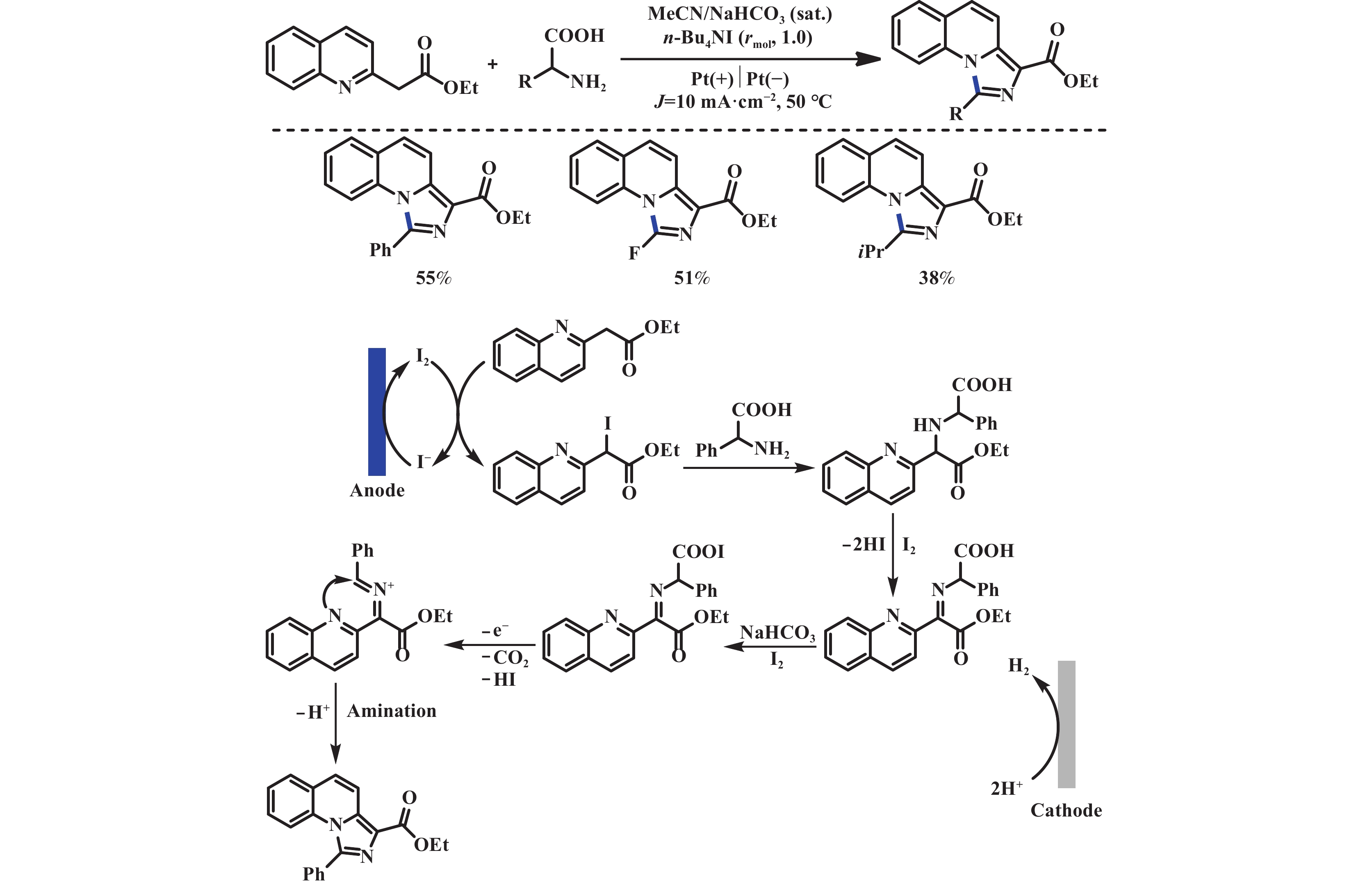
|
图 16 碘介导的电化学脱羧构筑C(sp2)–N键[34] Fig.16 Iodide-mediated electrochemical decarboxylation to construct C(sp2)–N bond[34] |
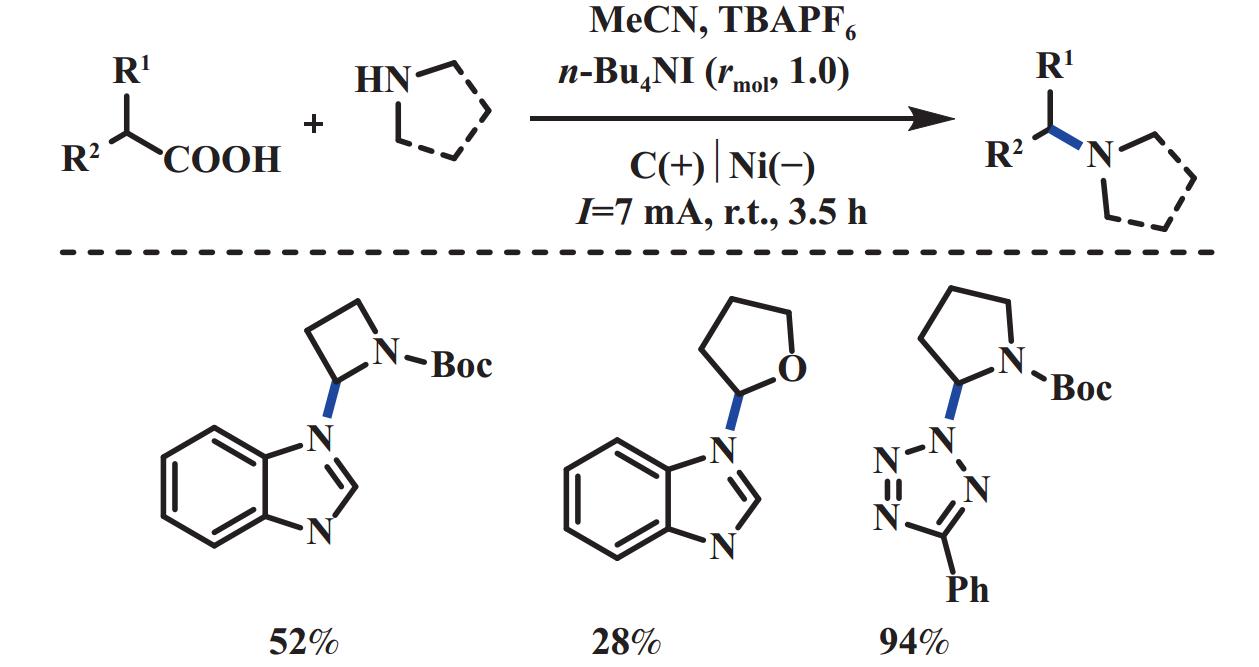
|
图 17 电化学氧化脱羧构筑C(sp3)–N键[35] Fig.17 Electrochemical oxidative decarboxylation to construct C(sp3)–N bond[35] |
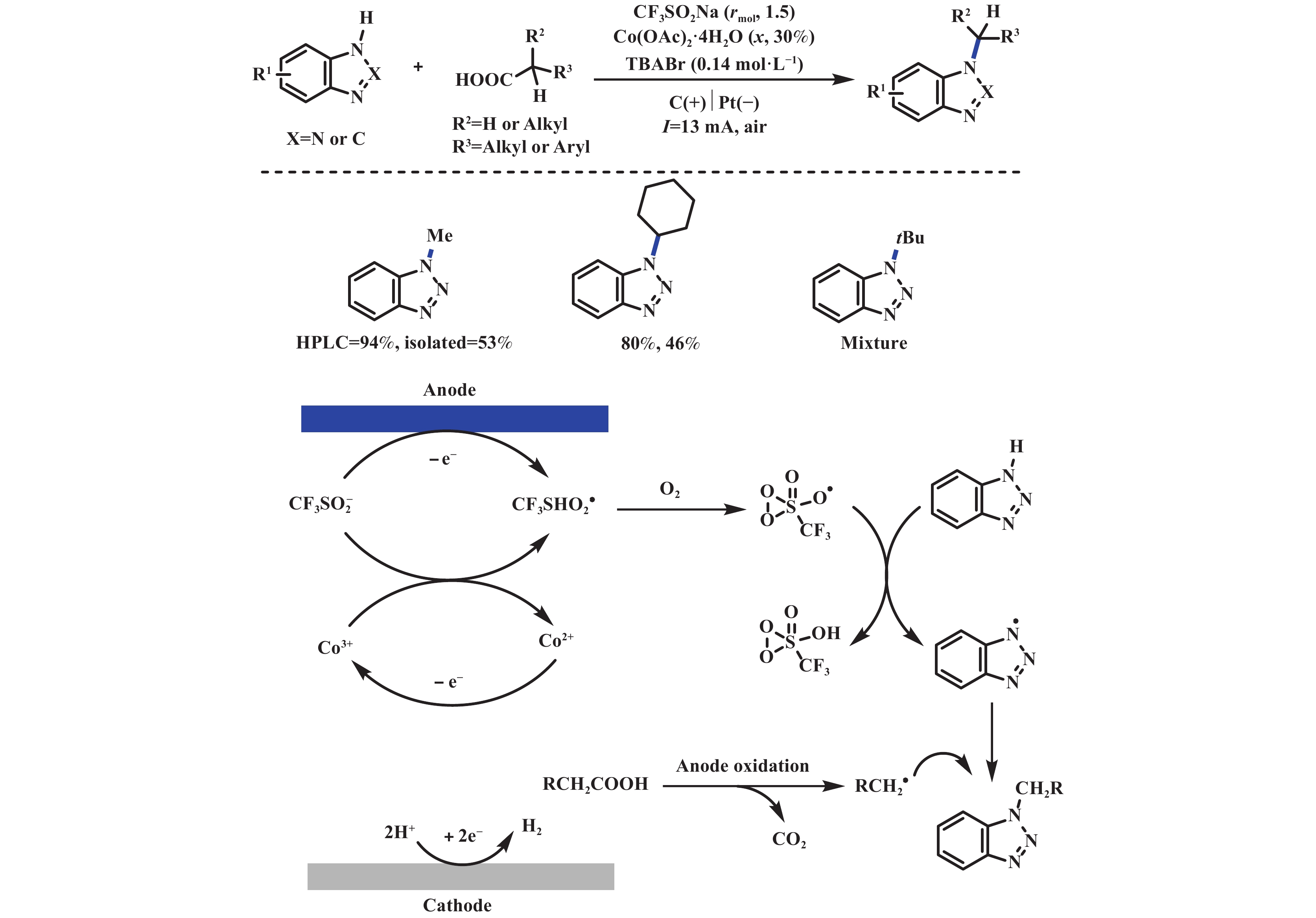
2023年, 张延华课题组[37]报道了一例在Co(OAc)2∙4H2O催化下, 电化学脱羧C(sp3)–N偶联反应. 该反应能够很好地解决简单一级、二级羧酸的问题, 但由于产物不稳定的原因, 导致分离产率比HPLC产率低很多. 机理研究表明三氟甲磺酸钠和氧气在体系中至关重要, 反应可能是一个涉及自由基的过程(图19). 2022年, 付年凯课题组[38]通过光电催化体系实现了羧酸化合物的温和脱羧叠氮化修饰, 其中Ce(Ⅳ)在光照条件下实现脱羧过程, 而Mn(Ⅲ)则实现叠氮的转移. 该反应在400 nm LED灯照射下, 通过Ce/Mn双催化, 可实现多种羧酸底物在单室电解池中转化为叠氮化物. 该反应由Ce和Mn阳极氧化来驱动, 从而避免了羧酸盐和叠氮阴离子在阳极表面的直接氧化, Ce(Ⅲ)和Mn(Ⅱ)都可以在极其温和的条件下被氧化(Eonset = 0.10 V vs Fc+/0). 此外, LMCT机理的固有特性赋予了其优异的化学选择性, 从而使反应体系更具有兼容性. 利用光/电能量分步输入的特点, 以及高价金属中间体的稳定性, 作者构建出连续流动的电光反应器用于规模化合成(图20).
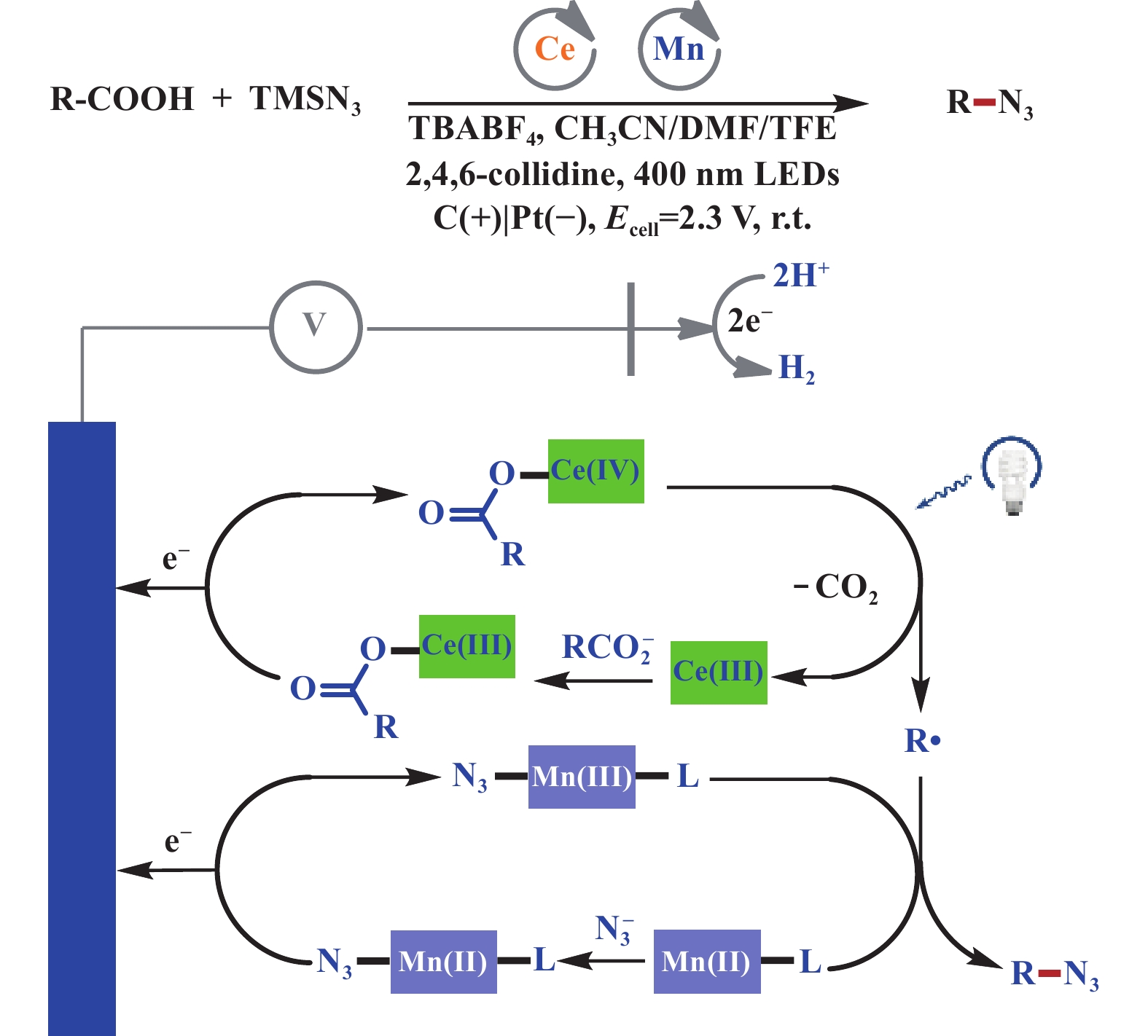
|
图 20 光电协同脱羧叠氮化反应[38] Fig.20 Electrophotochemical decarboxylative azidation of aliphatic carboxylic acids[38] |
2025年, 商明课题组[39]提出一种模块化合成苯胺类化合物饱和生物电子等排体的方法, 通过光电化学诱导的脱羧偶联反应实现C(sp3)–N键的偶联. 该方法结合了LMCT和铜催化胺化反应, 能够在温和的电极电位下进行反应, 且适用于各类芳胺、杂芳胺、磺酰亚胺和亚胺及笼状小环生物电子等排体骨架羧酸底物和普通烷基羧酸底物, 这些骨架可以作为生物电子等排体替代对位、邻位和间位取代芳胺结构, 验证了该策略凭借温和的反应条件及无需强氧化剂的优势, 可有效抑制笼状小环底物环张力导致的开环副反应, 为苯胺类药物生物电子等排体的模块化构筑提供了一种直接高效的方法(图21).
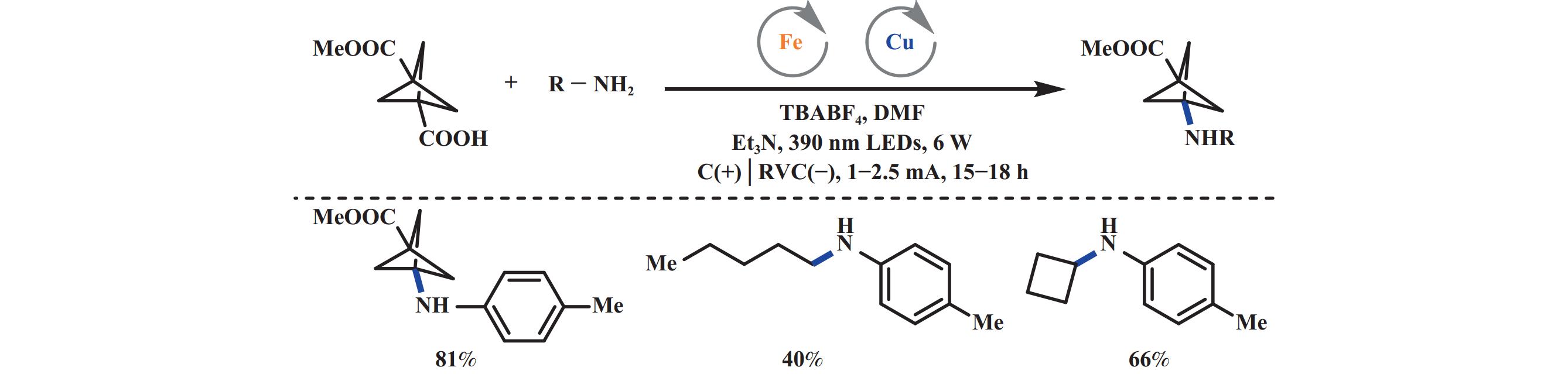
|
图 21 光电协同脱羧叠氮化反应光电化学脱羧C(sp3)–N偶联[39] Fig.21 Electrophotochemical decarboxylative C(sp3)–N coupling[39] |
Hofer-Moest反应即脂肪酸在碱性条件下电解脱羧形成碳正离子, 如果被氧亲核试剂进攻, 可用于合成各种C―O键偶联的化合物. 2007年, Fuchigami课题组[40]报道了一种新型的电催化体系, 该反应在负载型固体碱的存在下(易回收, 可重复使用), 反应溶剂甲醇作为氧亲核试剂, 高效地实现脱羧甲氧基化反应. 值得注意的是, 该反应在高电流密度下电解, 官能团兼容性明显受限. 此外, 羧酸底物类型局限于能够产生稳定碳正离子的羧酸(图22). 类似地, Matsumara课题组[41]报道了在甲醇溶液中, 通过电化学氧化丝氨酸衍生物产生光学活性的甲氧基化产物. 在低温条件下, 该反应呈现良好的对映选择性, 这是由于酰亚胺阳离子中间体的立体构象中, 碳正离子下方存在体积较大的邻苯基. 受空间位阻的影响, 甲醇更倾向于从位阻较小的上方进攻碳正离子(图23).
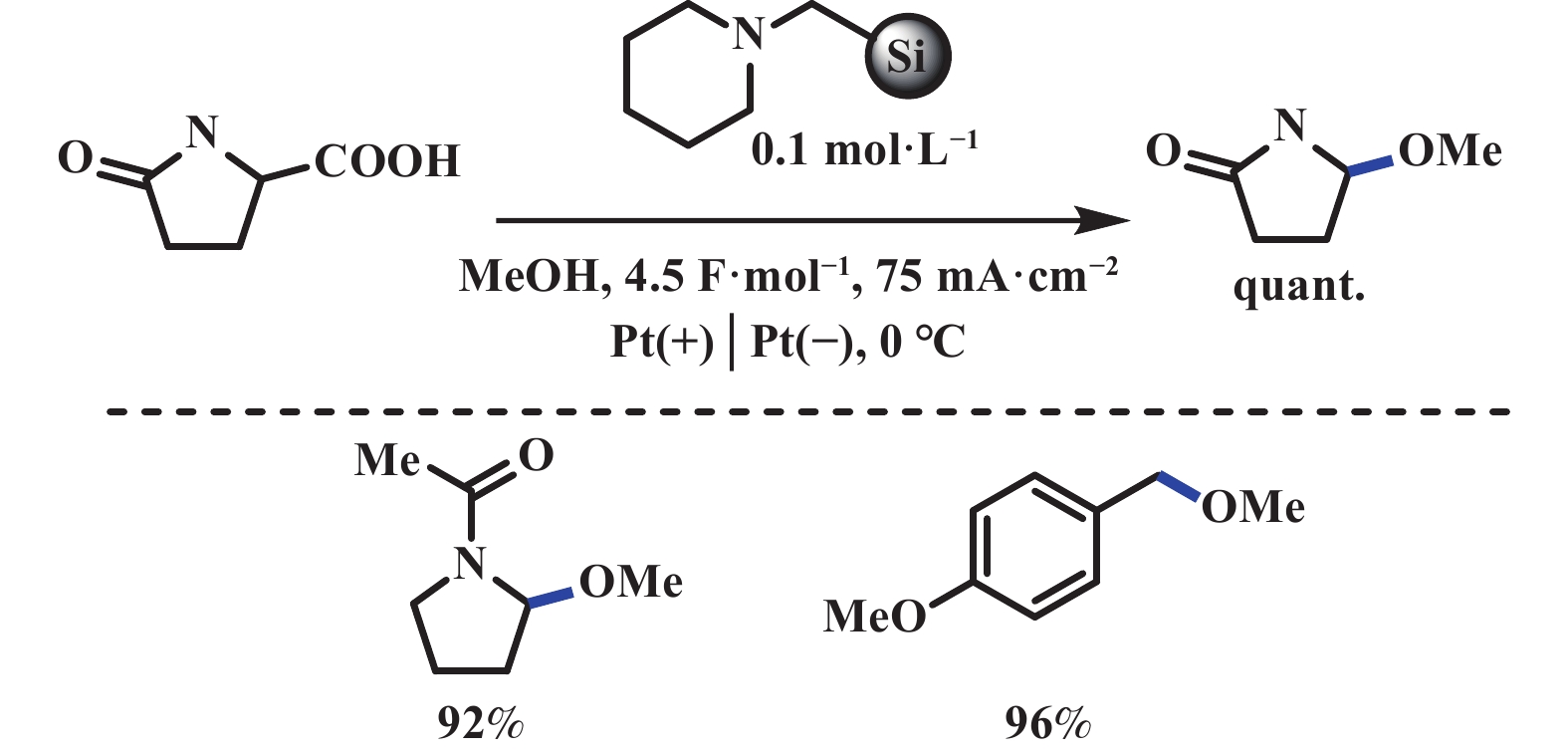
|
图 22 负载型碱促进的电化学脱羧C(sp3)–O偶联反应[40] Fig.22 Supported alkali promoted electrochemical decarboxylation C(sp3)–O couplings[40] |
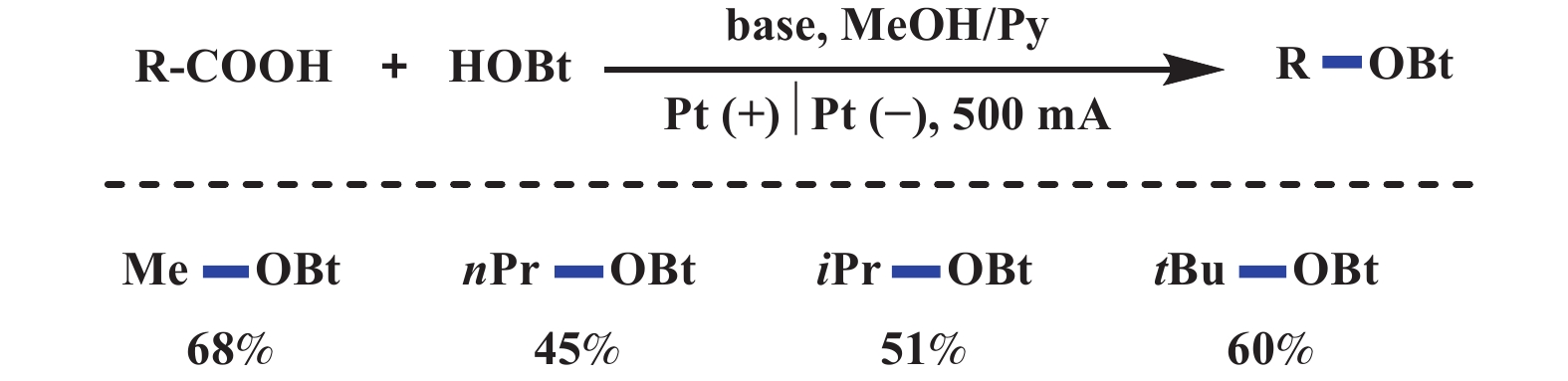
Hofer-Moest反应在醚的合成中需要使用溶剂量的醇, 极大地限制了其应用. 2019年, Baran课题组[42]报道了电化学氧化脱羧产生高活性碳正离子, 随后被氧亲核试剂进攻, 产生大位阻二烷基醚的反应. 该反应以醇作为氧亲核试剂, 2,4,6-collidine为碱, TBAPF6为电解质, 3A分子筛为干燥剂(抑制羟基化副产物), AgPF6为添加剂(牺牲阳极试剂, 避免醇的氧化), 在10 mA恒电流下通电3 h, 能够以中等至优异的产率得到大位阻二烷基醚类化合物(图24). 该反应底物适用范围广泛、易于克级放大, 并可用于药物关键中间体的合成. 2020年, Goossen课题组[43]采用自由基偶联的策略, 实现了电化学脱羧醚化反应, 解决了电化学脱羧醚化反应无法适用于简单一级羧酸的问题. 即在甲醇和吡啶的混合溶剂中, 烷基羧酸锂与1-羟基苯并三唑(HOBt有一定酸性, 容易脱质子氧化成稳定的氧自由基)阳极氧化产生两种自由基, 随后发生自由基–自由基交叉偶联反应, 生成烷基苯并三唑醚. 该反应的底物范围可以拓展到简单一级和二级烷基羧酸, 并且产物很容易实现进一步转化. 值得注意的是, HOBt相比于羧酸氧化电势更低, 优先被阳极氧化产生稳定的氧自由基. 与此同时, 高电流密度下羧酸盐能够通过氧化脱羧产生烷基自由基, 两种自由基由于都在阳极附近, 因此可以顺利地发生反应. 该反应存在的主要问题是: 高电流密度下使得一些氧化敏感的基团无法兼容(图25).
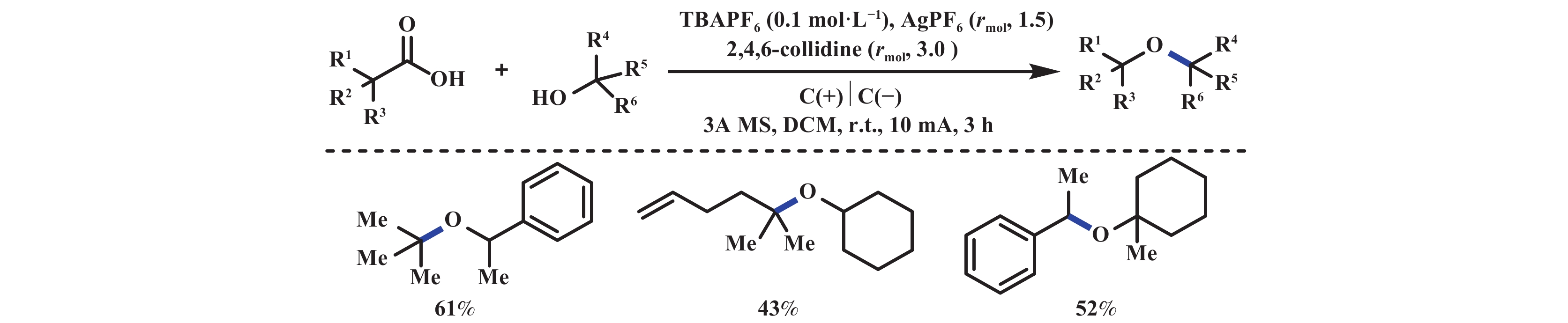
|
图 24 电化学脱羧产生大位阻二烷基醚[42] Fig.24 Electrochemical decarboxylation produces large sterically hindered dialkyl ethers[42] |
|
图 25 电化学脱羧自由基C(sp3)–O偶联反应[43] Fig.25 Electrochemical decarboxylative radical C(sp3)–O coupling reaction[43] |
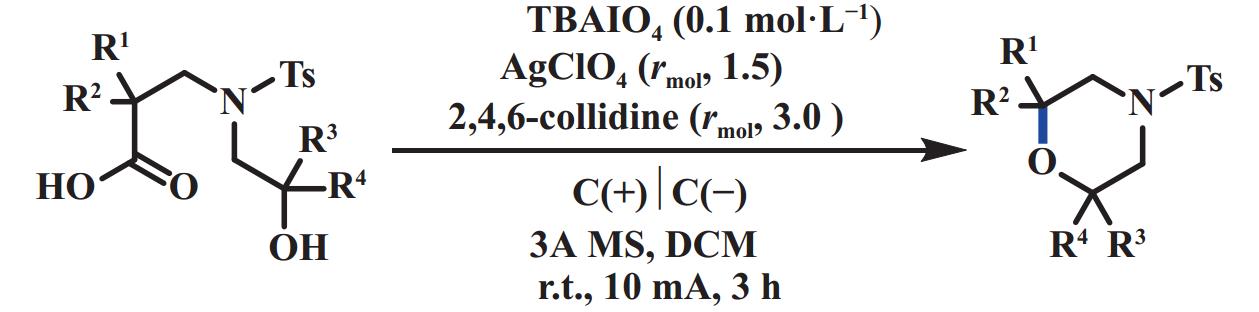
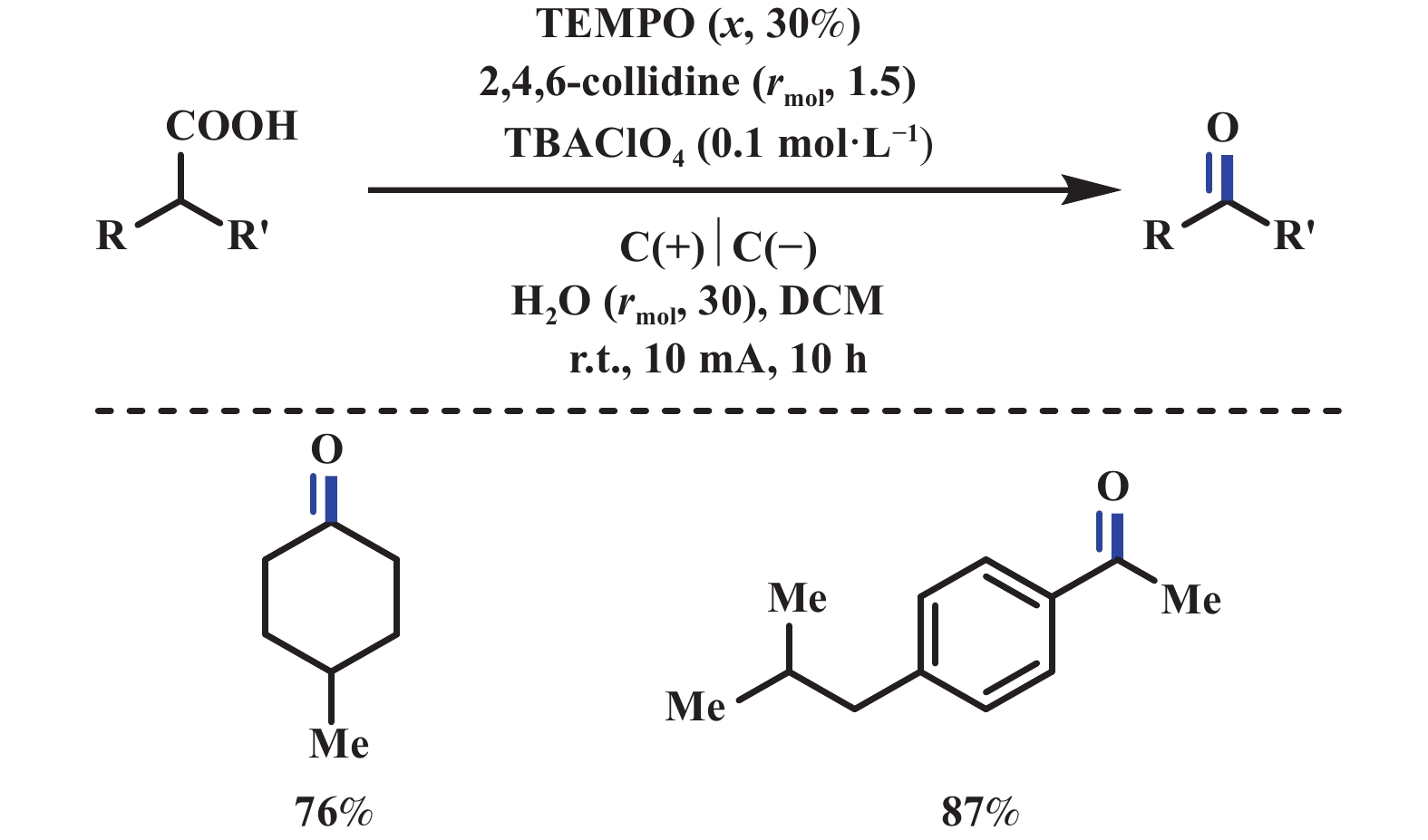
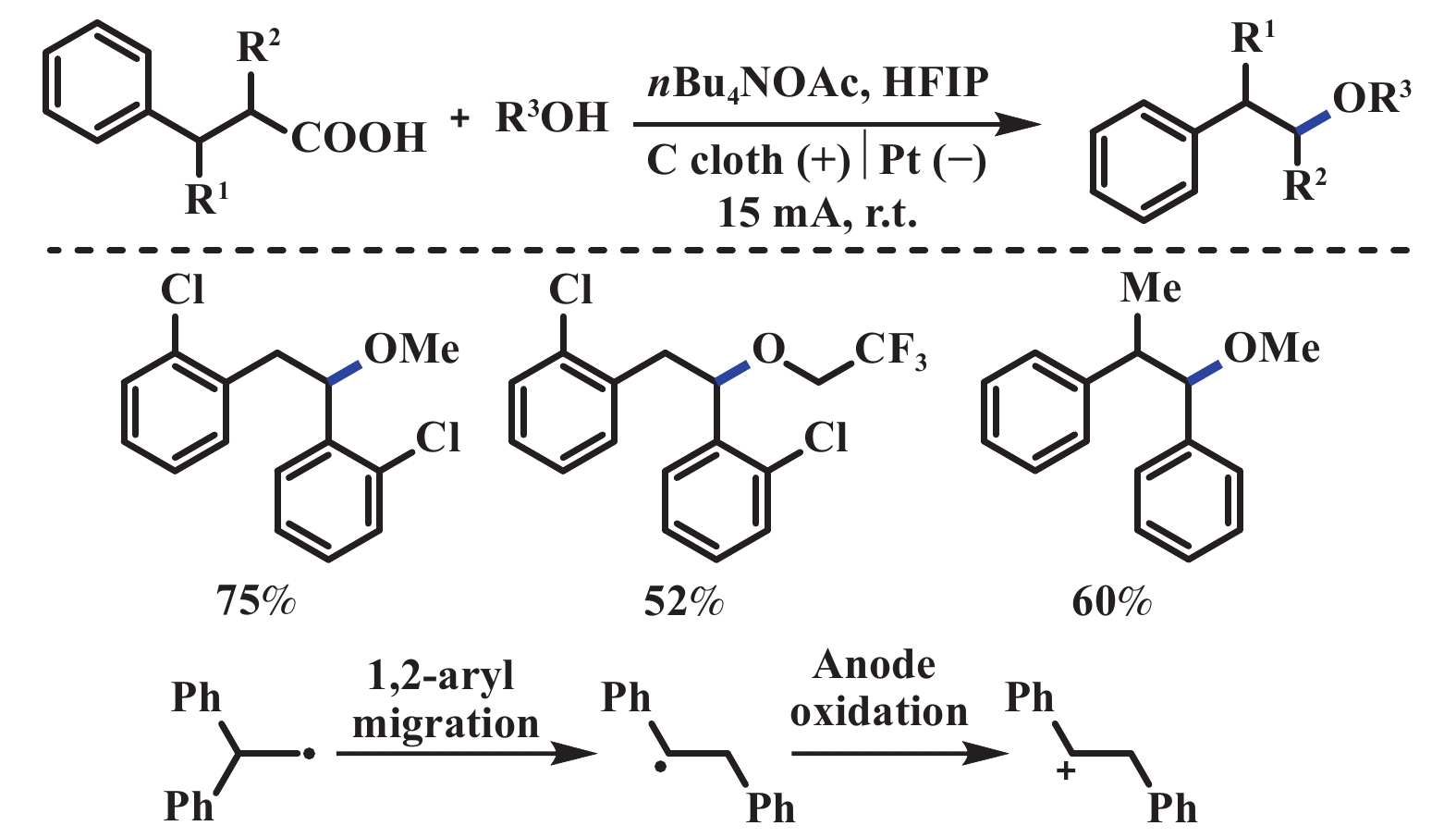
2020年, 雷爱文课题组[44]采用电化学氧化脱羧和1,2-芳基迁移的策略来合成1,2-二芳基醚. 该反应以3,3-二芳基丙酸和溶剂量的醇为底物, 碳布为阳极, 铂片为阴极, nBu4NOAc为电解质(同时也充当碱的作用), HFIP为共溶剂, 在恒电流15 mA条件下电解, 能够以中等至优异的收率得到目标产物. 通过电子顺磁共振(EPR)和对照实验结果表明, 3,3-二芳基丙酸在电化学条件下可转化为相应的1,1-二芳基乙基自由基. 经1,2-芳基迁移和阳极氧化得到苄基碳正离子, 随后与醇反应得到最终产物(图26). 2022年, Yamada课题组[45]报道了电化学脱羧分子内醚化反应, 用来制备2,6-多取代吗啉(图27). 该方法与2019年Baran课题组[42]报道的电化学脱羧醚化反应条件相类似, 不同之处在于该反应属于一个分子内的反应. 2022年, 黄申林课题组[46]报道了电化学氧化脱羧直接合成羰基化产物. 该反应以2,4,6-collidine为碱、水为氧源、TEMPO为催化剂(促进反应中间体醇进一步氧化成羰基化合物), 在二氯甲烷溶液中, 能够以中等至优异的产率生成羰基化合物. 该反应阳极分压较高, 达到了2.1 V (vs Ag/AgCl), 导致其底物范围受限, 无法兼容对氧化还原敏感的基团(图28).
|
图 26 3,3-二芳基丙酸和醇电化学脱羧交叉偶联反应[44] Fig.26 Electrochemical decarboxylative cross-coupling reaction of 3,3-diarylpropionic acid with alcohols[44] |
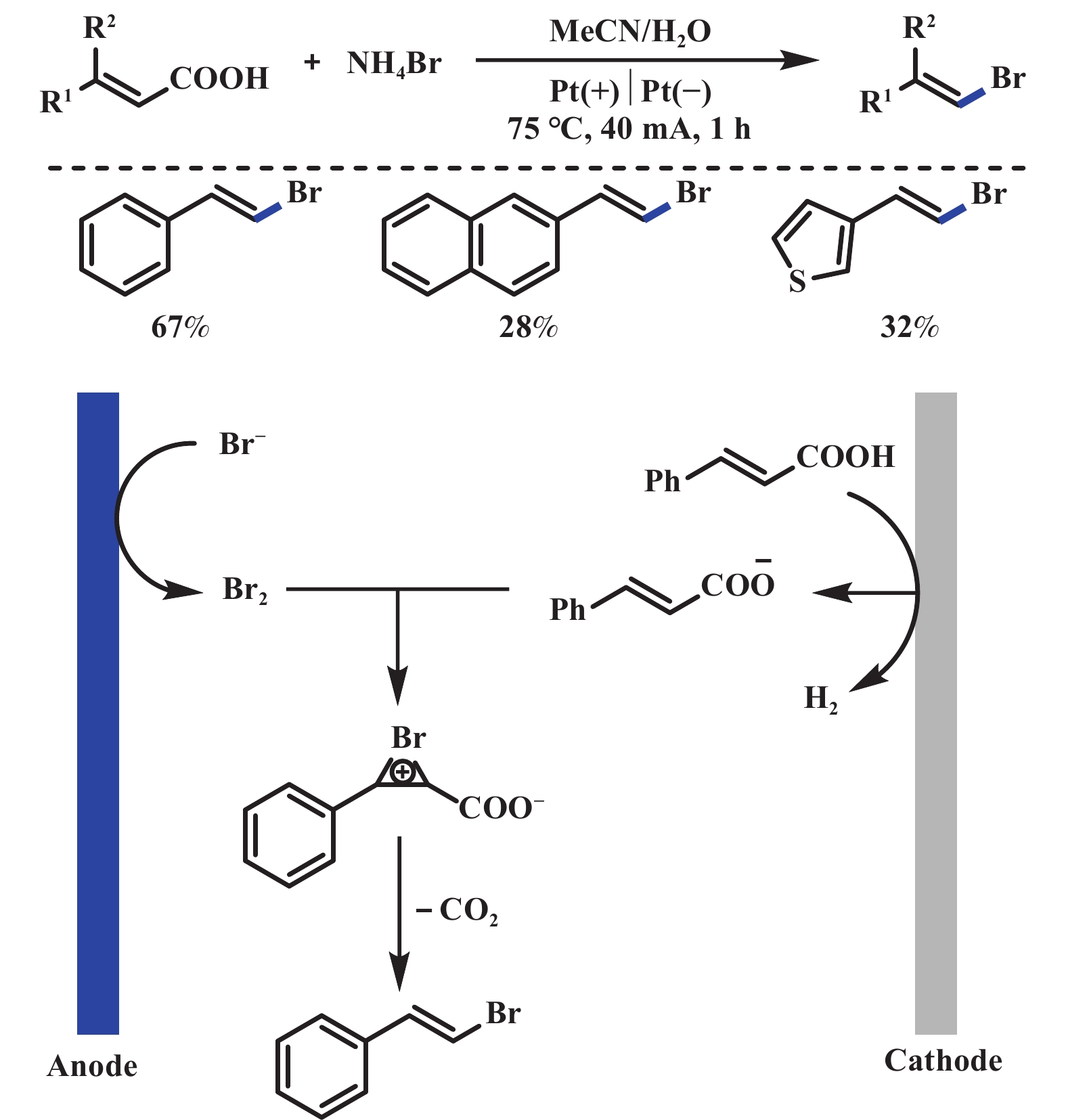
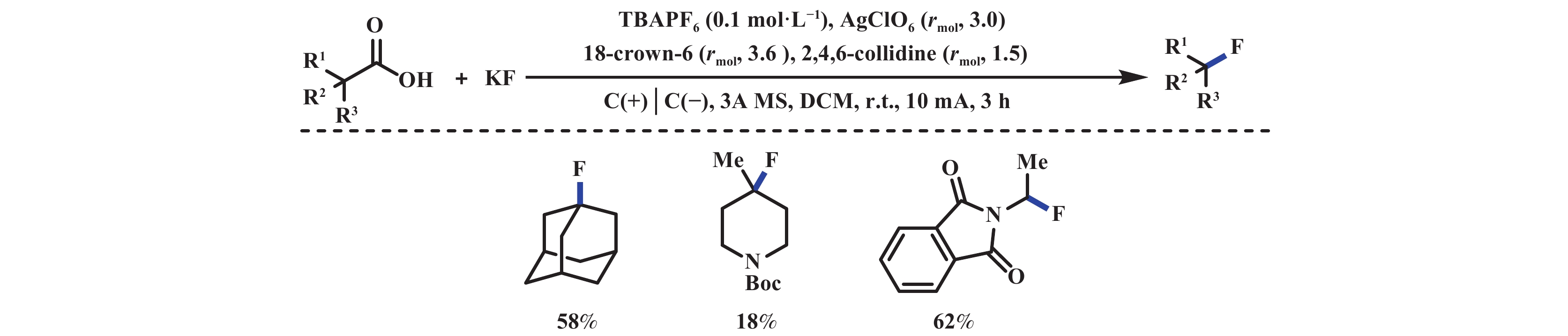
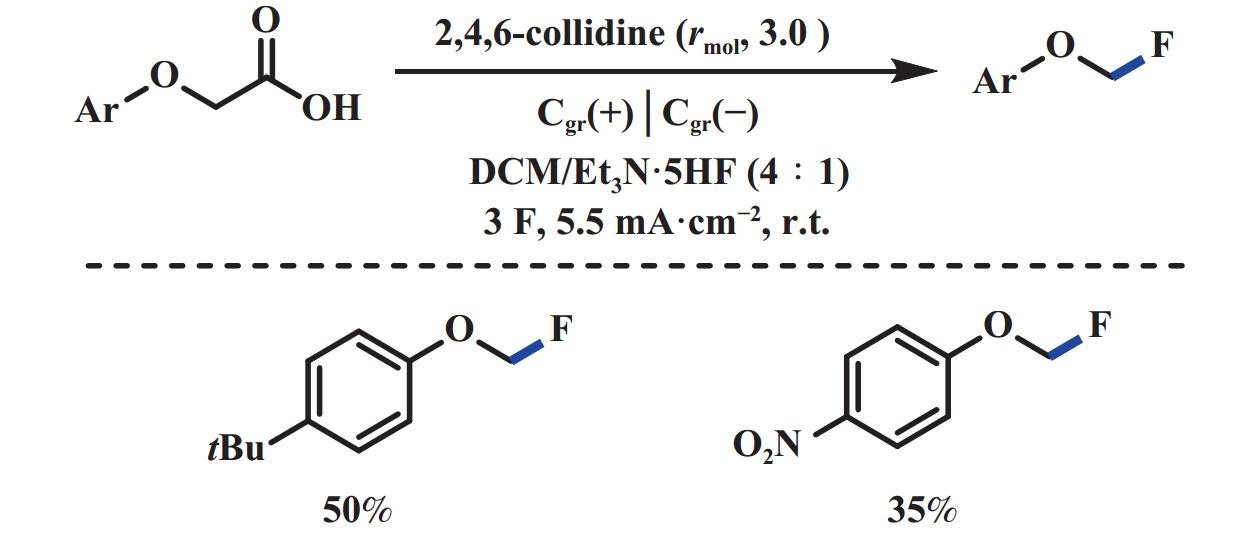
羧酸盐的脱羧卤化反应是构筑C―X键的有效方法. 例如, Hunsdiecker反应在有机合成中应用广泛, 但通常需要用到一些重金属催化剂或者高价碘试剂. 2017年, 汪志勇课题组[47]采用阳极氧化的方式, 以NH4Br为溴源, 无需过渡金属催化剂和支持电解质, 能够高效地实现肉桂酸的脱羧溴化反应. 噻吩环的电化学不稳定性和萘环的强位阻效应, 导致萘和噻吩类取代的不饱和羧酸产率较低(图29). 该反应可能经历: 溴离子阳极氧化生成一分子溴单质, 随后溴单质进攻肉桂酸阴离子得到溴鎓离子中间体, 该中间体脱羧得到目标产物. 2019年, Baran课题组[42]报道了电化学脱羧构筑大位阻二烷基醚的反应. 通过对该体系反应参数的微调: 采用廉价的氟化钾作为亲核氟化试剂, 加入18-冠-6作为相转移催化剂, 进一步实现了脱羧氟化反应(图30). 2020年, Waldvogel课题组[48]报道了类似的反应, 该反应以苯氧乙酸为底物、Et3N∙5HF为氟源, 无需相转移催化剂和银盐牺牲剂, 便可实现脱羧氟化反应, 但底物也仅限于稳定的α-氧取代羧酸(图31).
|
图 31 苯氧乙酸电化学脱羧氟化反应[48] Fig.31 Electrochemical decarboxylative fluorination of phenoxyacetic acid[48] |
电化学脱羧官能化反应研究, 最近引起了大家的广泛关注, 通过阳极直接氧化或间接氧化脱羧形成活性自由基或碳正离子中间体, 可以快速地构筑碳–碳键和碳–杂原子键, 避免使用对环境有害的氧化还原试剂. 不同课题组针对各类反应开发了多种策略, 拓展了底物范围, 并深入研究了反应机理. 然而, 该领域仍面临一些挑战: 1) 电化学脱羧反应通常需要较高的氧化电位, 因此无法兼容一些氧化还原敏感的金属催化剂; 2) 反应体系往往比较复杂, 需要电解质来提高溶液的导电性, 因此反应原子利用率较低; 3) 反应类型有限, 且极少数能实现手性转化; 4) 由于电化学反应装置无法统一, 且受电极材料、反应装置、电压电流大小等因素影响, 反应结果的重现性不佳. 基于此, 未来电化学脱羧偶联反应的研究可从以下几个方向展开: 1) 开发更加温和、高效的反应体系, 降低氧化电位, 提高与各类催化剂的兼容性, 进一步拓展底物范围, 尤其是实现对更多复杂底物和特殊官能团的兼容; 2) 优化反应条件, 减少电解质的用量, 提高原子利用率, 使反应更加绿色环保; 3) 致力于发展新型的反应类型, 探索更多新颖的化学键构建方式, 丰富电化学脱羧偶联反应的类型; 4) 深入研究手性转化的电化学脱羧反应, 开发高效的手性催化体系, 实现对映选择性合成, 为药物合成等领域提供更有力的技术支持; 5) 推动电化学反应装置的标准化和商业化, 减少实验条件差异对反应结果的影响, 提高反应的重现性, 促进该领域研究成果的广泛应用和工业化生产.
| [1] |
Decarboxylative coupling reactions: A modern strategy for C−C bond formation[J]. Chem Soc Rev, 2011, 40(10): 5030–5048.
DOI:10.1039/c1cs15093f |
| [2] |
Conversion of biomass to selected chemical products[J]. Chem Soc Rev, 2012, 41(4): 1538–1558.
DOI:10.1039/C1CS15147A |
| [3] |
Recent developments in decarboxylative cross-coupling reactions between carboxylic acids and N−H compounds[J]. RSC Adv, 2019, 9(16): 8964–8976.
DOI:10.1039/C9RA00929A |
| [4] |
Decarboxylative halogenation of organic compounds[J]. Chem Rev, 2020, 121(1): 412–484.
DOI:10.1021/acs.chemrev.0c00813 |
| [5] |
Direct decarboxylative Giese reactions[J]. Chem Soc Rev, 2022, 51(4): 1415–1453.
DOI:10.1039/D1CS01168E |
| [6] |
Metal-catalyzed decarboxylative C−H functionalization[J]. Chem Rev, 2017, 117(13): 8864–8907.
DOI:10.1021/acs.chemrev.6b00516 |
| [7] |
Visible‐light‐induced decarboxylative functionalization of carboxylic acids and their derivatives[J]. Angew Chem Int Edit, 2015, 54(52): 15632–15641.
DOI:10.1002/anie.201505731 |
| [8] |
Decarboxylative reactions with and without light: A comparison[J]. Green Chem, 2018, 20(2): 323–361.
DOI:10.1039/C7GC02949G |
| [9] |
Organic synthesis via Kolbe and related non-Kolbe electrolysis: An enabling electro-strategy[J]. React Chem Eng, 2011, 6(8): 1342–1366.
DOI:10.1039/d1re00047k |
| [10] |
Advances in electrochemical decarboxylative transformation reactions[J]. Chem Eur J, 2021, 27(10): 3213–3228.
DOI:10.1002/chem.202001764 |
| [11] |
Recent progress on electrochemical synthesis involving carboxylic acids[J]. Org Biomol Chem, 2021, 19(25): 5501–5520.
DOI:10.1039/D1OB00420D |
| [12] |
Electrosynthesis using carboxylic acid derivatives: New tricks for old reactions[J]. Acc Chem Res, 2020, 53(1): 121–134.
DOI:10.1021/acs.accounts.9b00586 |
| [13] |
(Non-) Kolbe electrolysis in biomass valorization: A discussion of potential applications[J]. Green Chem, 2020, 22(2): 286–301.
DOI:10.1039/C9GC03264A |
| [14] |
Zersetzung der Valeriansäure durch den elektrischen Strom[J]. Ann Chem Pharm, 1848, 64: 339–341.
DOI:10.1002/jlac.18480640346 |
| [15] |
Schäfer H J. Recent contributions of Kolbe electrolysis to organic synthesis[M]. Berlin, Heidelberg: Springer, 2005. DOI: 10.1007/BFb0034365.
|
| [16] |
Merging photoredox with nickel catalysis: Coupling of α-carboxyl sp3-carbons with aryl halides[J]. Science, 2014, 345(6195): 437–440.
DOI:10.1126/science.1255525 |
| [17] |
Decarboxylative cross-electrophile coupling of N-hydroxyphthalimide esters with aryl iodides[J]. J Am Chem Soc, 2016, 138(15): 5016–5019.
DOI:10.1021/jacs.6b01533 |
| [18] |
Ni-catalyzed electrochemical decarboxylative C−C couplings in batch and continuous flow[J]. Org Lett, 2018, 20(5): 1338–1341.
DOI:10.1021/acs.orglett.8b00070 |
| [19] |
Nickel-catalyzed electrochemical reductive decarboxylative coupling of N-hydroxyphthalimide esters with quinoxalinones[J]. Chem Commun, 2019, 55(97): 14685–14688.
DOI:10.1039/C9CC07840A |
| [20] |
One-pot electrochemical nickel-catalyzed decarboxylative sp2−sp3 cross-coupling[J]. Org Lett, 2019, 21(3): 816–820.
DOI:10.1021/acs.orglett.8b04090 |
| [21] |
Nickel-catalyzed decarboxylative cross-coupling of indole-3-acetic acids with aryl bromides by convergent paired electrolysis[J]. Chem Commun, 2022, 58(59): 8202–8205.
DOI:10.1039/D2CC02641D |
| [22] |
Electrophotochemical metal-catalyzed decarboxylative coupling of aliphatic carboxylic acids[J]. Chem Eur J, 2022, 28(70): e202202370.
DOI:10.1002/chem.202202370 |
| [23] |
Photoelectrochemical asymmetric catalysis enables direct and enantioselective decarboxylative cyanation[J]. J Am Chem Soc, 2022, 144(44): 20201–20206.
DOI:10.1021/jacs.2c09050 |
| [24] |
Cu-catalyzed enantioselective decarboxylative cyanation via the synergistic merger of photocatalysis and electrochemistry[J]. Chem Sci, 2023, 14(3): 705–710.
DOI:10.1039/D2SC05428K |
| [25] |
Electrophotochemical metal‐catalyzed enantioselective decarboxylative cyanation[J]. Chem Eur J, 2023, 29(24): e202203962.
DOI:10.1002/chem.202203962 |
| [26] |
Dual transition metal electrocatalysis: Direct decarboxylative alkenylation of aliphatic carboxylic acids[J]. J Am Chem Soc, 2023, 145(49): 26774–26782.
DOI:10.1021/jacs.3c08839 |
| [27] |
A convergent paired electrochemical strategy for decarboxylative C(sp2)− C(sp3) bond formation[J]. Org Chem Front, 2024, 11(7): 1941–1948.
DOI:10.1039/D3QO02141F |
| [28] |
Ni-electrocatalytic Csp3–Csp3 doubly decarboxylative coupling[J]. Nature, 2022, 606(7913): 313–318.
DOI:10.1038/s41586-022-04691-4 |
| [29] |
Catalyst-free electrochemical decarboxylative cross-coupling of N-hydroxyphthalimide esters and N-heteroarenes towards C(sp3)– C(sp2) bond formation[J]. Chem Commun, 2019, 55(99): 14922–14925.
DOI:10.1039/C9CC08528A |
| [30] |
Microfluidic electrochemistry for single-electron transfer redox-neutral reactions[J]. Science, 2020, 368(6497): 1352–1357.
DOI:10.1126/science.aba3823 |
| [31] |
Electrocatalytic Minisci acylation reaction of N-heteroarenes mediated by NH4I[J]. Org Lett, 2017, 19(20): 5517–5520.
DOI:10.1021/acs.orglett.7b02589 |
| [32] |
Nickel-catalyzed electrochemical Minisci acylation of aromatic N-heterocycles with α-keto acids via ligand-to-metal electron transfer pathway[J]. J Catal, 2020, 381: 38–43.
DOI:10.1016/j.jcat.2019.10.030 |
| [33] |
Catalyst-controlled functionalization of carboxylic acids by electrooxidation of self-assembled carboxyl monolayers[J]. Nat Commun, 2022, 13(1): 1319.
DOI:10.1038/s41467-022-28992-4 |
| [34] |
Electrocatalytic tandem synthesis of 1,3-disubstituted imidazo [1,5-a] quinolines via sequential dual oxidative C(sp3)–H amination in aqueous medium[J]. J Org Chem, 2019, 84(6): 3148–3157.
DOI:10.1021/acs.joc.8b03014 |
| [35] |
Decarboxylative C(sp3)–N bond formation by electrochemical oxidation of amino acids[J]. Org Lett, 2019, 21(22): 9262–9267.
DOI:10.1021/acs.orglett.9b03696 |
| [36] |
Electrochemical decarboxylative N-alkylation of heterocycles[J]. Org Lett, 2020, 22(19): 7594–7598.
DOI:10.1021/acs.orglett.0c02799 |
| [37] |
Aerobic electrochemical C(sp3)–N coupling between aliphatic carboxylic acids and N-heterocycles[J]. Organometallics, 2023, 42(1): 1–5.
DOI:10.1021/acs.organomet.2c00455 |
| [38] |
Electrophotochemical decarboxylative azidation of aliphatic carboxylic acids[J]. ACS Catal, 2022, 12(17): 10661–10667.
DOI:10.1021/acscatal.2c02934 |
| [39] |
Modular access to saturated bioisosteres of anilines via photoelectrochemical decarboxylative C(sp3)–N coupling[J]. Nat Commun, 2025, 16(1): 920.
DOI:10.1038/s41467-024-54648-6 |
| [40] |
Development of an electrolytic system for non-Kolbe electrolysis based on the acid−base reaction between carboxylic acids as a substrate and solid-supported bases[J]. J Am Chem Soc, 2007, 129(21): 6680–6681.
DOI:10.1021/ja070283w |
| [41] |
Highly enhanced enantioselectivity in the memory of chirality via acyliminium ions[J]. Org Lett, 2002, 4(11): 1875–1877.
DOI:10.1021/ol025865r |
| [42] |
Hindered dialkyl ether synthesis with electrogenerated carbocations[J]. Nature, 2019, 573(7774): 398–402.
DOI:10.1038/s41586-019-1539-y |
| [43] |
Taking electrodecarboxylative etherification beyond Hofer–Moest using a radical C−O coupling strategy[J]. Nat Commun, 2020, 11(1): 4407.
DOI:10.1038/s41467-020-18275-1 |
| [44] |
Electrochemical oxidative decarboxylation and 1,2-aryl migration towards the synthesis of 1,2-diaryl ethers[J]. Chem Sci, 2020, 11(36): 10000–10004.
DOI:10.1039/D0SC03708G |
| [45] |
Electrochemical synthesis of substituted morpholines via a decarboxylative intramolecular etherification[J]. Org Lett, 2022, 24(9): 1837–1841.
DOI:10.1021/acs.orglett.2c00377 |
| [46] |
Electrochemical decarboxylative oxygenation of carboxylic acids[J]. ACS Sustainable Chem Eng, 2022, 10(15): 5067–5071.
DOI:10.1021/acssuschemeng.2c01495 |
| [47] |
Decarboxylative bromination of α,β-unsaturated carboxylic acids via an anodic oxidation[J]. Chin Chem Lett, 2017, 28(6): 1159–1162.
DOI:10.1016/j.cclet.2017.04.030 |
| [48] |
Metal-free electrochemical fluorodecarboxylation of aryloxyacetic acids to fluoromethyl aryl ethers[J]. Chem Sci, 2020, 11(23): 6053–6057.
DOI:10.1039/D0SC02417A |
 2025, Vol. 39
2025, Vol. 39