2. 山东安迪新型材料有限公司, 山东 济宁272503
2. Shandong Andi New Materials Co., Ltd, Jining, 272503, China
酰胺键是形成多肽和蛋白质的基本骨架, 也广泛存在于各种药物分子中, 2023年最畅销的200种小分子药物中, 超过40%至少包含一种酰胺键, 在生物学、药学、化工等领域中有非常重要的地位[1−2]. 在生物体内, 酰胺键是氨基酸通过酶脱水缩合而成的; 而化学合成时, 酰胺键通常是使用化学计量的EDC(1-(3-二甲基氨基丙基)-3-乙基碳二亚胺)、氯化亚砜、三氯化磷、T3P(1-丙基磷酸酐)等偶联试剂将羧酸先转化为活性更高的酰氯等中间体, 再同胺进行缩合反应. 但是生产过程中会生成大量不需要的副产物, 原子经济性差且可能造成环境污染. 尽管目前一些成本更低, 分子量更低或无毒的偶联剂, 如CDI(羰基咪唑)、草酰氯、有机硅等应用的越来越多, 但是原子经济性的问题还是没有得到解决. 随着对成本和环保要求的提高, 开发高效、简洁、经济、绿色的酰胺合成方法具有广阔的前景[3−5].
羧酸本身的反应活性较差, 而且也会和胺自发形成盐阻碍酰胺化反应的进行. 除了使用偶联试剂来活化外, 研究者也提出了用其他化合物来代替羧酸进行反应的方法, 最常见的是酯, 高活性的酯能在温和条件下发生氨解, 其他低活性的酯(甲基和乙基等)可通过强碱让胺去质子化的手段来反应. 此外, 醇或醛的氧化酰胺化, 胺的氧化以及羰基化等替代方法亦有报道. 然而这些方法普遍存局限性, 路径更复杂, 所用的催化剂多为有机金属化合物等均相催化剂, 底物范围受限, 而且羧酸价廉易得, 这些所用的替代物并没有显著优势[6−9].
相比之下, 羧酸和胺直接脱水生成酰胺是一种比较理想的方式, 该过程的原子利用率高, 副产物只有水, 符合绿色环保的要求. 该反应在没有催化剂的情况下理论上是能自发进行的, 但是因为羧酸和胺会自发反应形成盐, 需要非常高的温度来克服羧酸铵盐的能垒, 是该反应的一大难点. 此外, 能直接热缩合的底物范围很窄, 尽管提高反应温度能促进那些活性低的底物发生反应, 但也可能会引发热解等问题, 所以需要使用催化剂来降低反应的能量需求和扩大底物范围, 从而实现直接酰胺化的大规模应用[10−11].
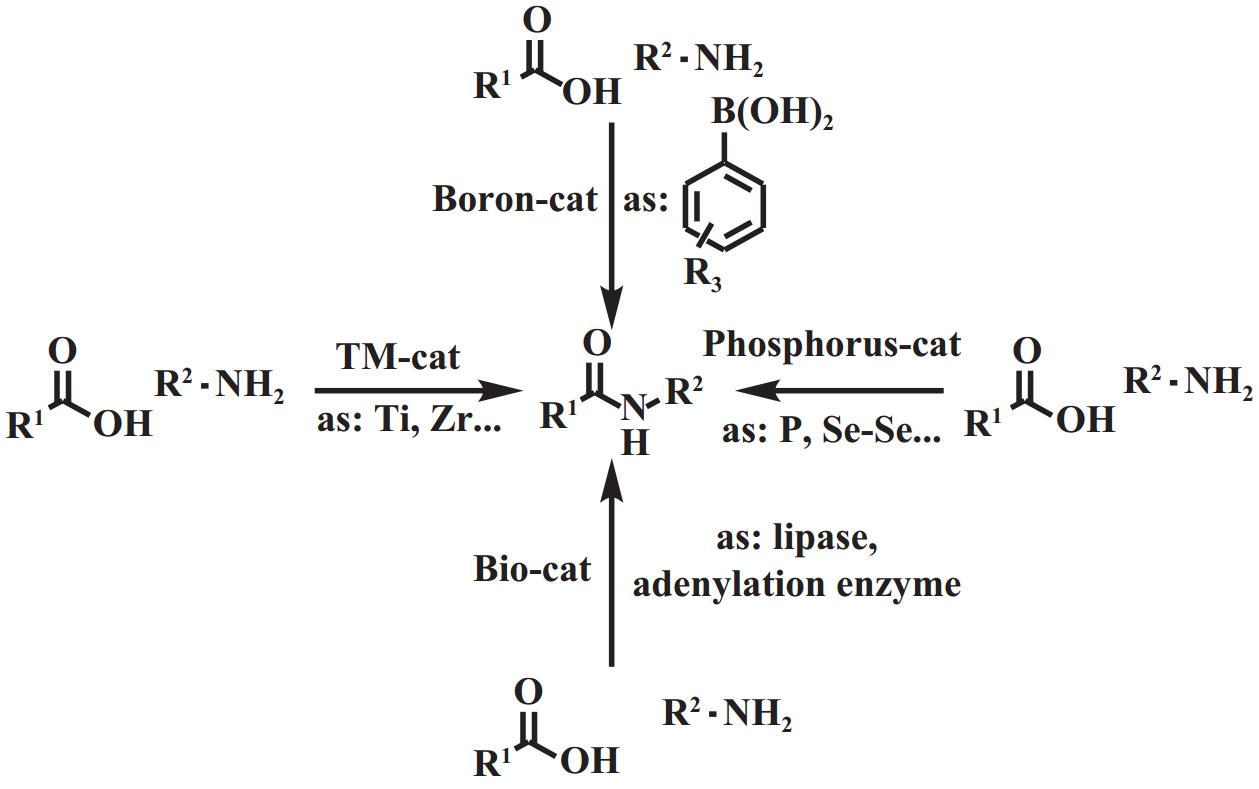
近年来, 关于直接酰胺化催化剂的研究逐渐增加, 但国内尚未有综述报道, 本文首次总结了硼基催化剂、磷基催化剂、过渡金属催化剂和生物催化剂等用于直接酰胺化反应的催化剂(图1), 以期为相关研究工作提供参考.
|
图 1 合成酰胺的反应体系汇总 Fig.1 Summary of the reaction system of synthetic amides |
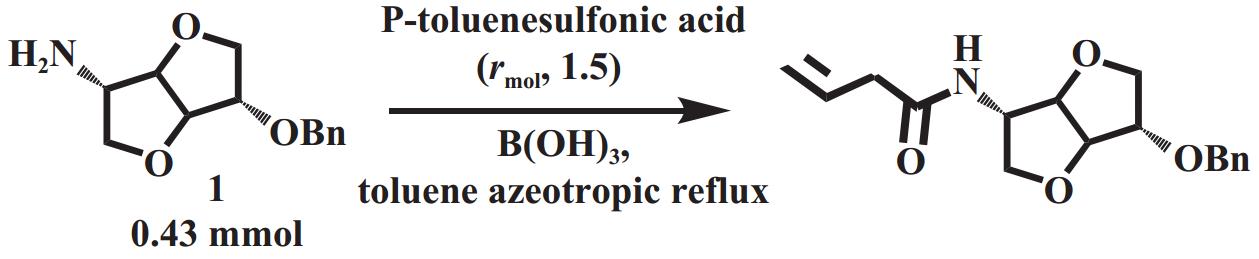
得益于硼独特的缺电子特性, 硼基催化剂是一种较强的Lewis酸催化剂, 也是酰胺合成反应中研究最多的催化剂. 但硼酸本身的酸性很弱, 在没有苯环等吸电子基团的情况下催化活性较差, 需要较高的负载量或者反应温度才能发生酰胺化反应[9]. Popowycz[12]介绍了硼酸直接催化胺1(由异山梨酯转化)和对甲基苯甲酸的反应, 需要使用0.129 mmol的硼酸才能在甲苯回流24 h得到94%的收率, 不过该方法的空间选择性好, 且对部分氨基酸结构具有兼容性. (图2)
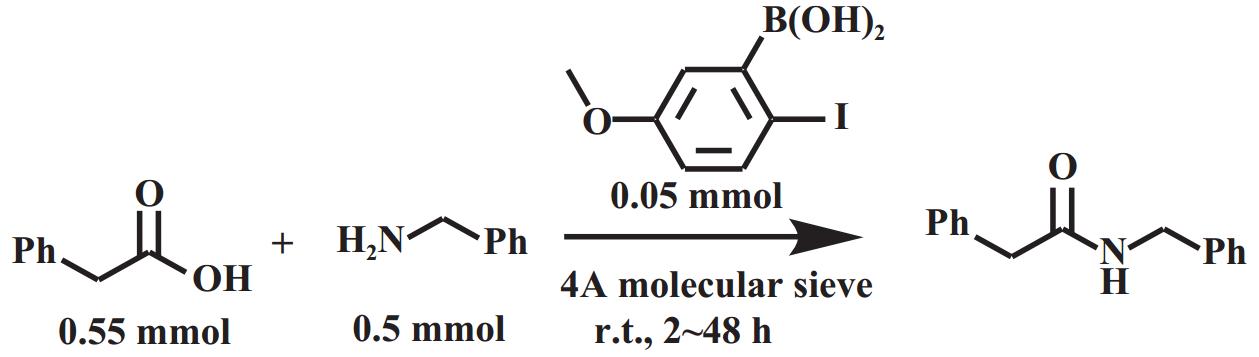
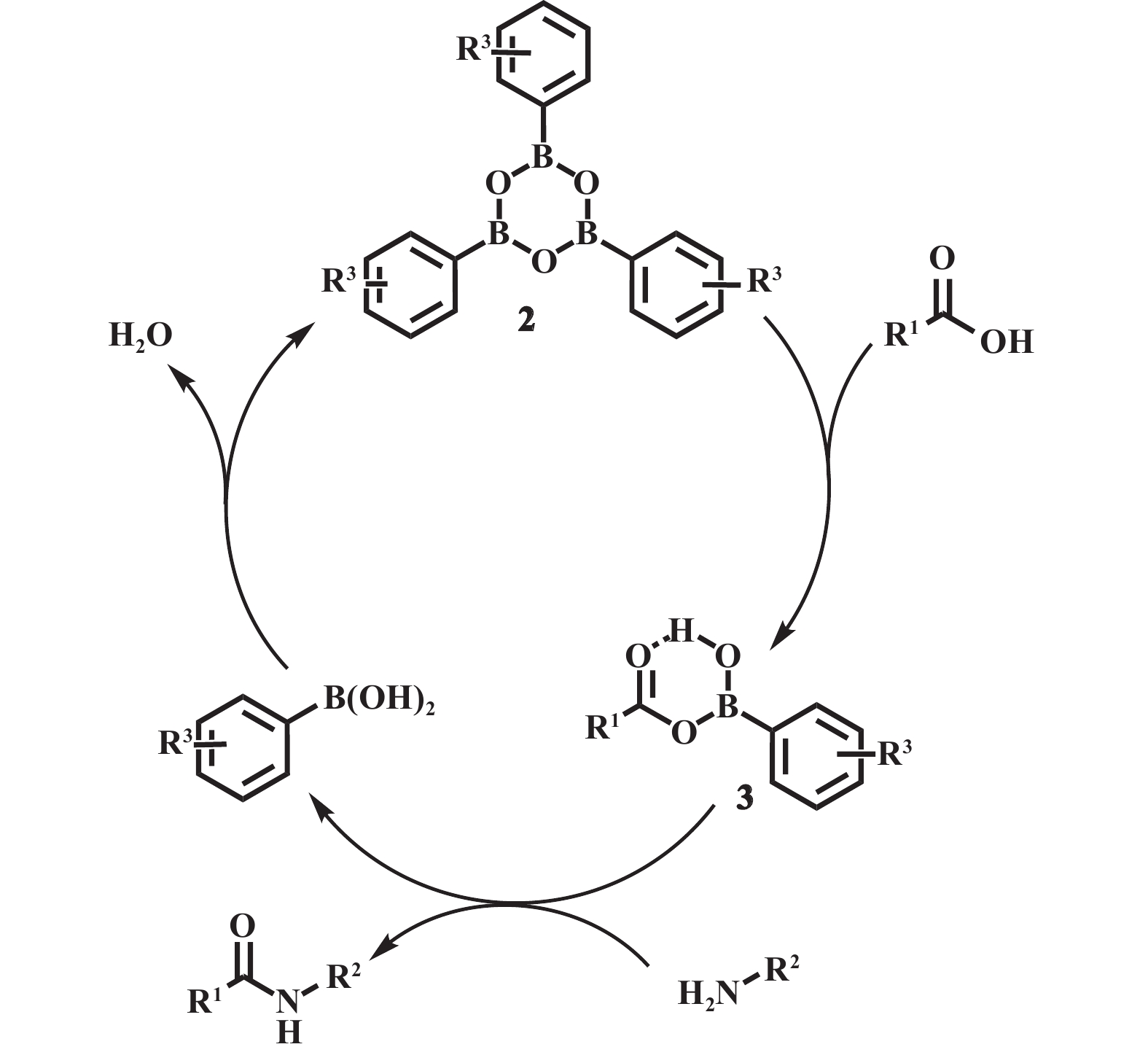
1.1.1 芳基硼酸类催化剂芳基硼酸类催化剂可以通过改变芳环上的取代基来调节其路易斯酸性, 而且芳基硼酸类催化剂适用于各种官能团, 耐水性好[2]. 1996年, Yamamoto等[13]首次报道了使用芳基硼酸作为催化剂的酰胺化反应, 其中3,4,5-三氟苯硼酸具有最优异的催化活性, 能适用于苯胺等亲核性较差的胺以及1-金刚烷羧酸等具有较大空间位阻的底物, 但是该体系需在较高温度下进行, 且需借助分子筛除水. 对于该反应的催化机理, Yamamoto提出了酰氧基硼中间体的观点(图3), 即硼酸先脱水形成三聚体2, 再与羧酸脱水反应生成酰氧基硼中间体3, 该中间体3再和胺进行反应得到相应的酰胺. 在此基础上, 邻位取代的芳基硼酸得到进一步发展, Hall等[14]使用5-甲氧基-2-碘苯基硼酸(MIBA, 图4)催化苯乙酸和苄胺的直接酰胺化, 在室温(25 ℃)下反应2 h即可得到98%的酰胺收率, 然而该催化体系仍存在一定局限性: 需要较高的催化剂负载量(0.05 mmol), 反应底物浓度较低(0.07 mol·L−1), 当应用于四氢吡啶等低活性胺类底物时, 需延长反应时间方可获得理想收率. 除MIBA外, 具有大位阻邻位取代基(如噻吩)的芳基硼酸和2-呋喃硼酸也是室温下直接酰胺化的可行催化剂[15−16]. Chen等[16]使用市售且价格低廉的2-呋喃硼酸催化苯乙酸和苄胺的反应, 在25 ℃下反应24 h可达99%的酰胺收率, 具有一定的应用价值.
|
图 3 Yamamoto 报道的芳基硼酸催化机理. R1=烷基、乙烯基、芳基, R2= 烷基、芳基, R3= F, NO2[13] Fig.3 Catalytic mechanism of aryl boronic acid reported by Yamamoto. R1= Alkyl, Vinyl; Aryl, R2= Alkyl, Arl; R3= F, NO2[13] |
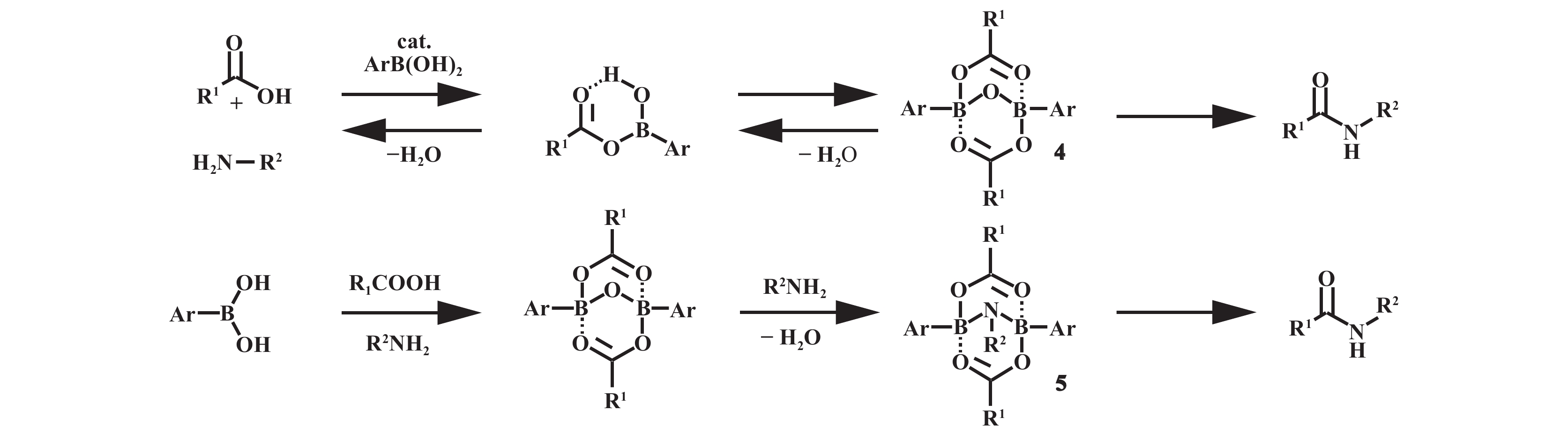
关于硼酸催化酰胺化的反应机理, 2018年, Whiting等[17]在该领域取得了重大突破. 研究表明, 该反应并非遵循最初提出的单环酰氧基硼活性中间体路径, 而是通过双环结构的中间体进行. 基于中间体的X射线分析、11BNMR波谱和反应机理的实验验证, 发现该中间体具有单酰基硼酸酯二聚体的独特结构, 即B-O-B(4)和B-NR-B(5), 其中中间体5可能是由中间体4脱水与胺反应得到的(图5). 根据这两种中间体和反应条件提出了不同的循环机理, 并通过理论计算验证, 两种路径的能垒相近, 表明二者均可能参与催化循环.
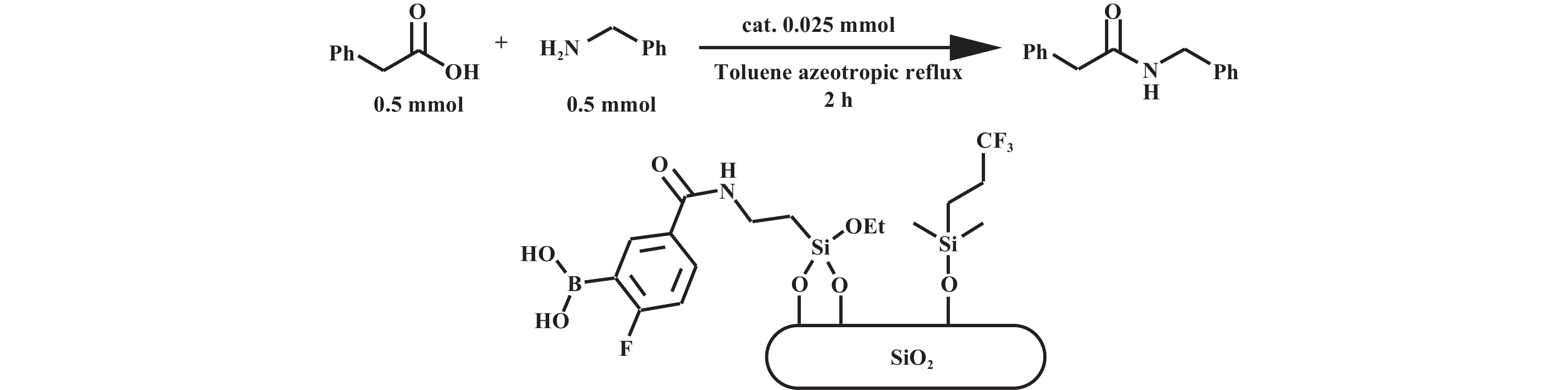
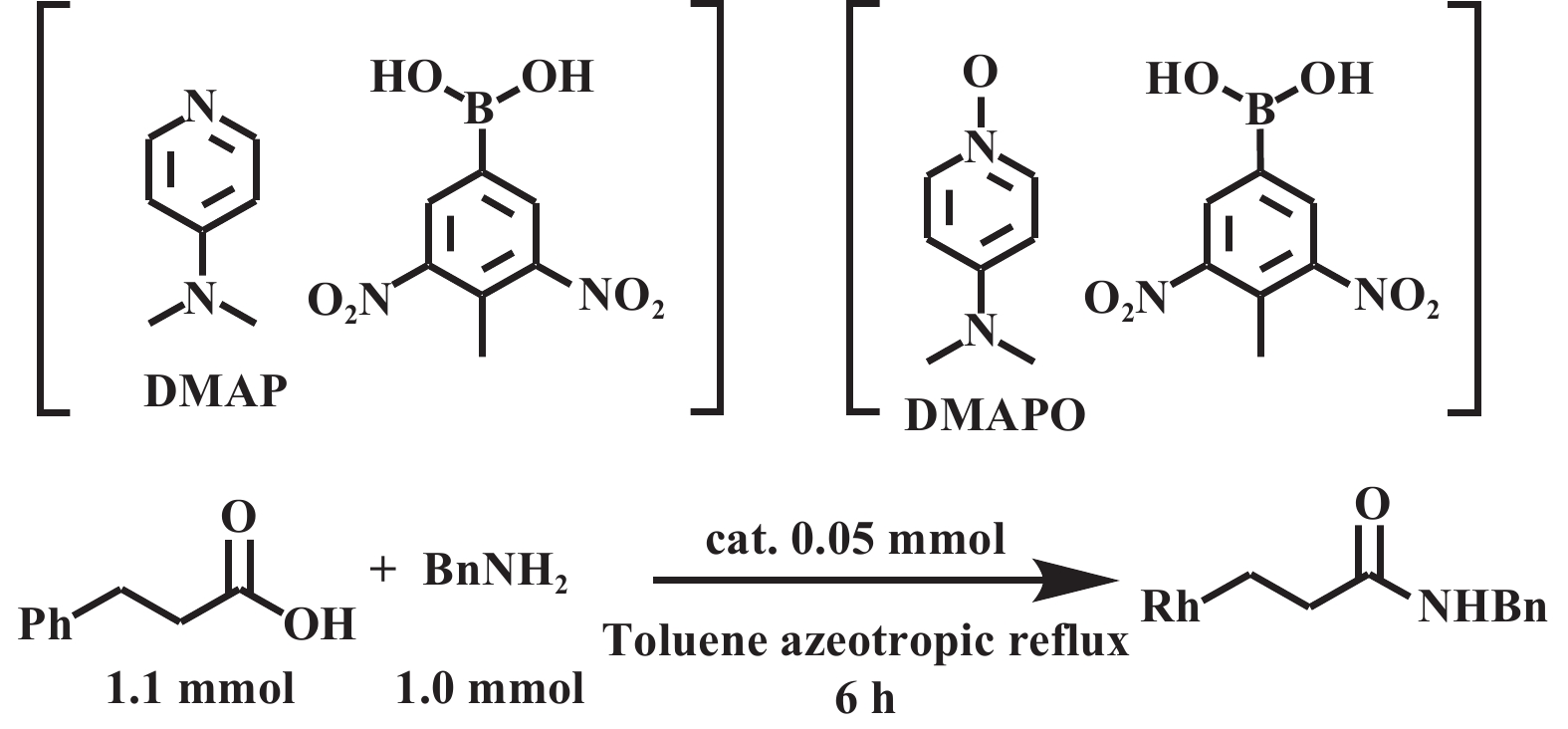
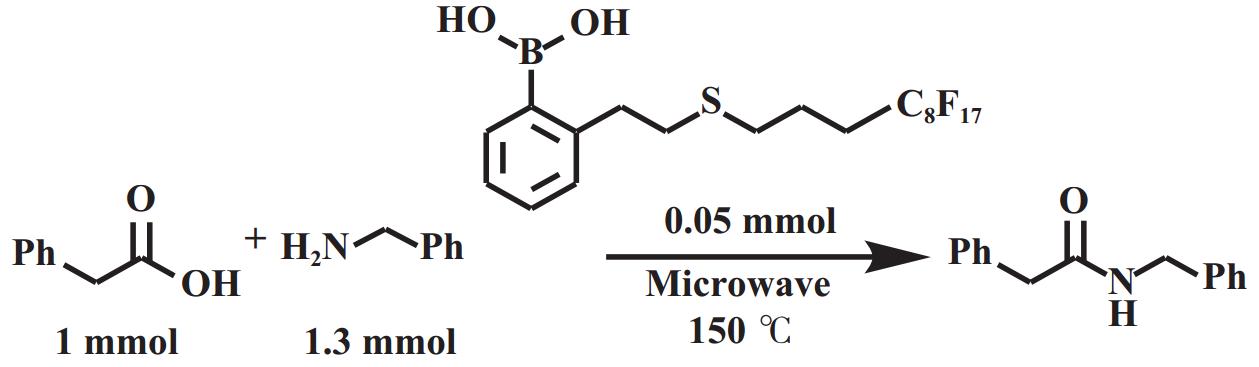
芳基硼酸类催化剂虽展现出优异的催化活性, 但其作为均相催化剂存在难以分离回收的不足, 针对这一情况, 研究者开发了包括利用助剂和催化剂形成配合物、固相萃取和固载化等多种分离手段. Ishihara等[18]报道了缺电子芳香族硼酸和DMAP或DMAPO(图6)协同催化的方法, 该方法利用了硼酸和DMAP或DMAPO形成复合物溶解度较差的特性, 通过冷却析出实现催化剂回收. 结果显示, DMAPO与硼酸形成的配合物, 在苯甲酸和己胺的酰胺化反应中可回收和重复使用3次. 而且该硼酸本身的酰胺化催化活性较低, DMAPO的引入可增强这类低活性但廉价的硼酸的性能[19]. Lo等[20]报道了一种在芳香硼酸的邻位侧链末端引入全氟烷基(C8F17), 并在无溶剂条件下用微波照射进行羧酸催化脱水酰胺化反应的方法(图7). 该方法通过固相萃取(SPE)将催化剂与粗产品分离. 在苯乙酸和苄胺的模型反应中, 催化剂可循环使用四次且活性未下降. Lee等[21]将芳基硼酸固定在介孔硅泡沫上以构建一种经济高效、可重复使用的非均相催化剂(图8). 研究表明, 将表面的其他硅醇基团负载上三氟烷基可显著提升催化活性, 适用于多种脂肪羧酸和芳香羧酸. 在苯乙酸和苄胺的反应中, 使用0.025 mmol的催化剂, 在甲苯中共沸回流2 h即可实现98%的酰胺收率. 该催化剂经过简单的过滤即可回收, 并至少可重复使用6次, 活性未见显著衰减.
|
图 6 DMAP和DMAPO作为硼酸催化酰胺化中的助催化剂[18] Fig.6 DMAP and DMAPO as cocatalysts in boric acid-catalyzed amidation[18] |
|
图 7 引入全氟烷基支链的硼酸催化剂用于直接酰胺化反应[20] Fig.7 A boric acid catalyst with perfluoroalkyl branched chains is introduced for direct amidation reactions[20] |
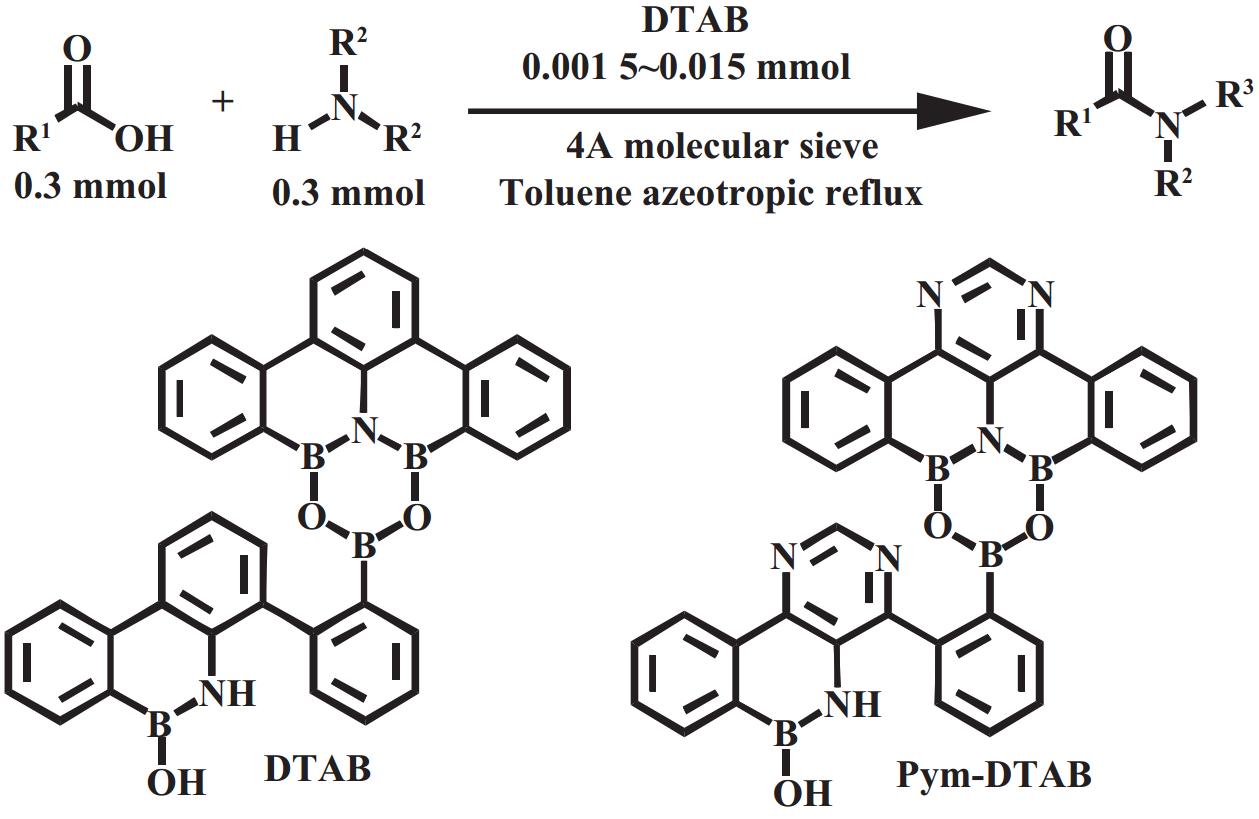
2017年, Shibasaki和Kumagai等[22]开发了含有六元杂环的多硼化合物(DATB, 见图9). DATB衍生物是具有稳定的m-三联苯支架的独特化合物, 其硼原子表现出特殊的路易斯酸性, 催化活性优于市售硼酸或金属催化剂. 仅需
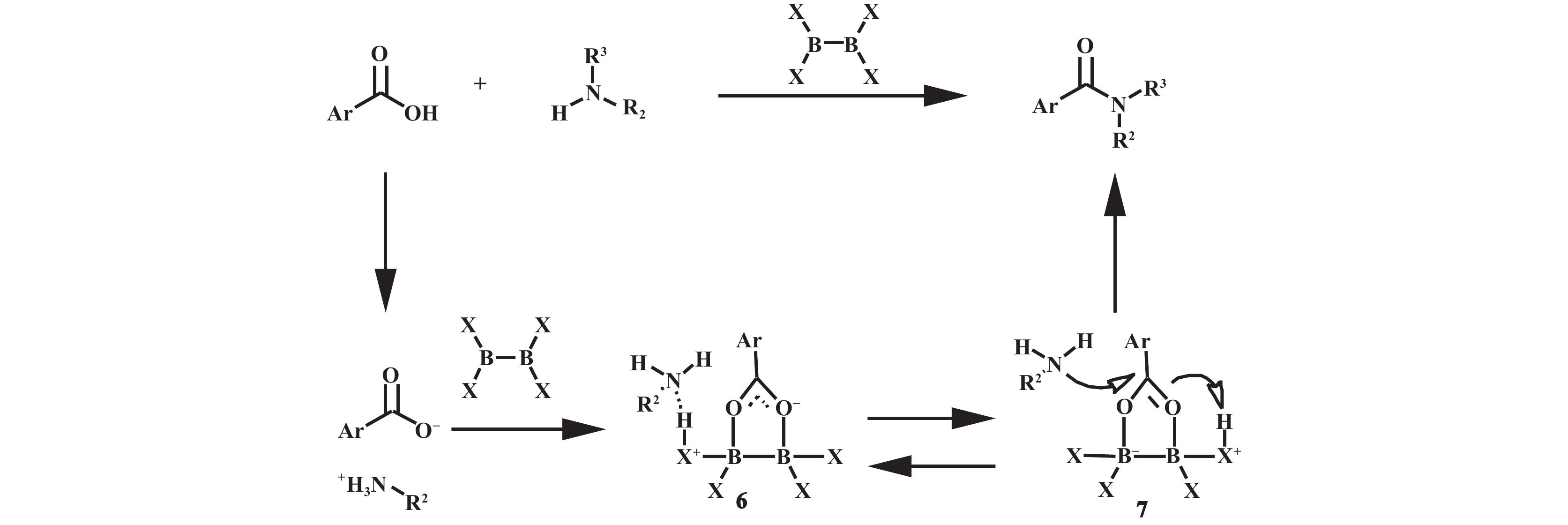
2018年, Saito等[24]报道了一种催化芳香族羧酸的酰胺化反应, 使用的催化剂具有X2B–BX2结构. 通常情况下, 芳香族羧酸由于与胺形成稳定的盐而变得惰性, 但其研究结果显示该催化剂可将羧酸铵盐转化为游离胺和羧酸盐中间体6, 随后通过电子转移形成中间体7, 最终促进其与胺的亲核进攻完成酰胺化过程(图10). 在对具有二硼结构的催化剂进行筛选后, 可商业获得的四(二甲基氨基)二硼和四羟基二硼催化剂在芳香族羧酸的直接酰胺化中显示出了优异的催化效率.
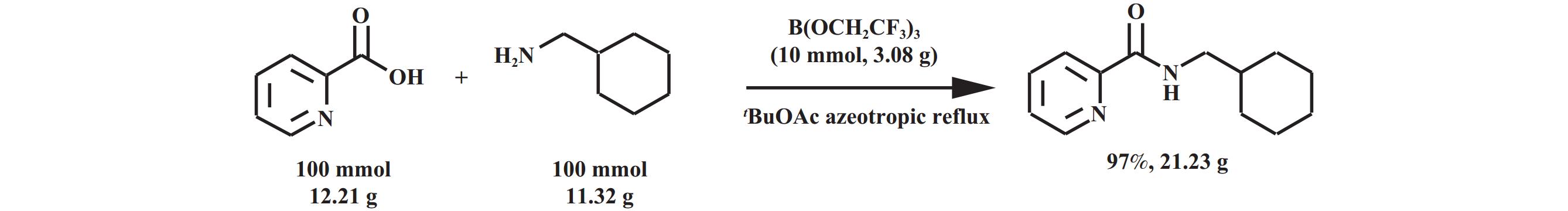
1.1.3 硼酸酯类催化剂硼酸可通过与醇或羧酸发生酯交换反应形成硼酸酯, 硼酸酯的催化活性要显著高于硼酸. Sheppard等[25]使用B(OCH2CF3)3, 以乙酸叔丁酯为溶剂催化2-吡啶甲酸和环己甲胺的反应(图11), 还使用了三种混合树脂来去除催化剂和剩余的底物, 并且放大到100 mmol的底物量仍能保持97%的收率.
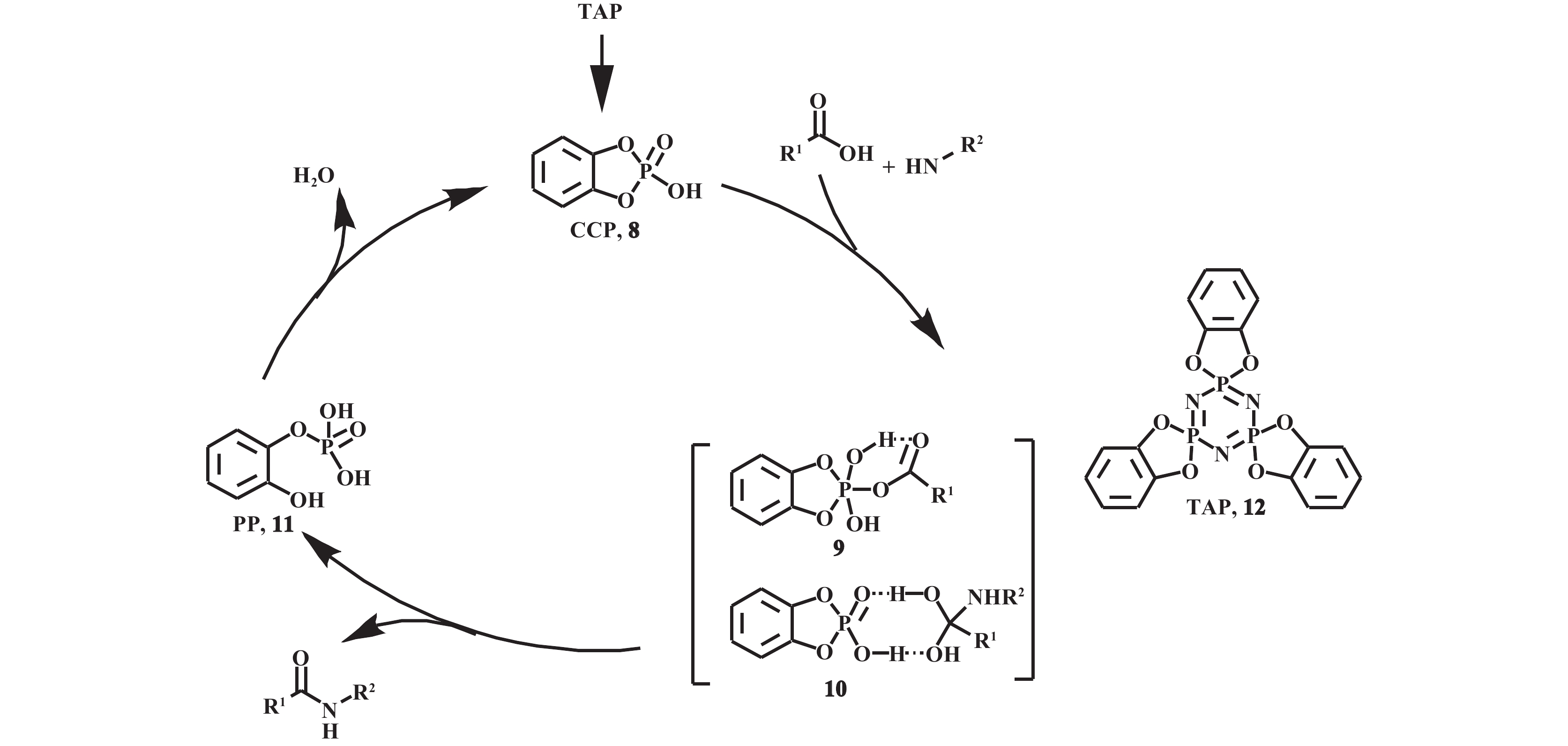
1.2 磷基催化剂 1.2.1 磷基催化剂单独使用Mecinović等[26]报道了三苯基膦CCl4催化酰胺直接合成的反应. 在该方法中, 三苯基膦先和CCl4反应转化为磷(Ⅴ), 再迅速和羧酸脱水形成活性高的混合酸酐. 磷通过二甲氧基甲基硅烷原位还原, 从而实现三苯基膦的催化循环. 2020年, Sato等[27]报道了TAP(12)催化芳香酸和胺直接酰胺化的体系. 通过31PNMR和ESI-MS实验, 确定了不同的相关催化中间体. 机理研究表明, TAP充当预催化剂, 首先原位生成2-羟基-1,3,2-苯并二氧磷杂环戊烯-2-氧化物(CCP, 8), 然后经过羧酸直接进攻CCP的磷原子或CCP和羧酸与胺反应的中间体结合这两种可能的过渡态(图12中9和10)得到酰胺. 在这个过程中, CCP被转化为2-羟基苯基二氢磷酸酯(PP, 11), 而PP脱水再生成CCP, 从而完成催化循环(图12). 但由于CCP的稳定性差, 该体系需要TAP作为预催化剂并在惰性气氛下进行反应.
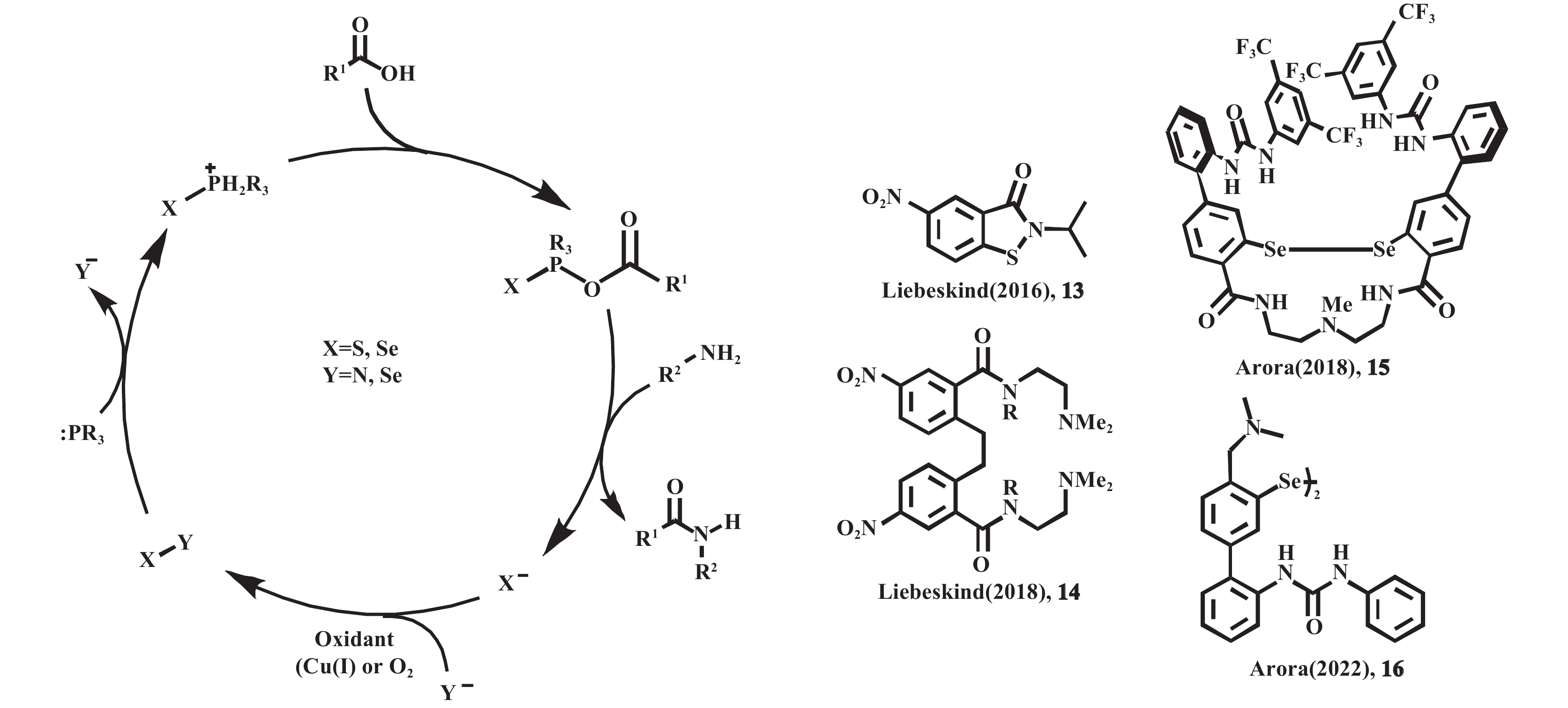
1.2.2 磷基催化剂和其他催化剂联用磷也用于其他有机催化氧化还原缩合形成酰胺键的反应. Liebeskind等[28]在2016年报道了一种苯并异噻唑13与铜(I)协同的酰胺化方法(见图13). 该体系通过有机磷化物断裂苯并异噻唑中的S—N键, 生成可活化羧酸的磷(V)物种, 进而驱动酰胺化反应进程. 铜则用于还原被氧化的苯并异噻唑, 而铜物种可以通过周围的氧气重新被氧化, 从而实现了催化循环(图13). 2018年, Liebeskind等[29]在此基础上报道了低负载量的二硒化物14形成酰胺键的方法. 该方法具有较低的催化剂负载量(0.025 mmol, 反应物1 mmol), 仅需大气中的氧气即可将还原的硒化物重新氧化, 温和的加热条件以及能够耐受包括用氨基酸保护的氨基酸、肽、核苷酸和其他功能密集的生物分子在内的各种底物, 更适用于肽的化学合成. Arora等[30]于2018年报道了一种针对Fmoc肽合成法的二硒化物催化剂. 该催化剂能够稳定羧酸和胺反应生成的四面体中间体, 且能够以高空间选择性合成多种二肽, 并证明了与标准Fmoc策略固相肽合成的兼容性, 合成的产品长达五肽. 然而合成该催化剂需要11个步骤, 并需要使用有毒试剂(如SOCl2), 其大规模应用存在一定的限制. 2022年, Arora等[31]在之前工作的基础上取得突破性进展, 成功开发出一种结构更简单的催化剂16. 该体系以氧化磷作为助催化剂(5 μmol, 反应物50 μmol), 并加入过量的PhSiH3作为还原剂完成磷的催化循环, 实现了磷助剂用量的降低, 且不需要脱水试剂(分子筛), 符合大规模生成的需求.
|
图 13 二硒化物和苯并异咪唑催化酰胺化反应的机理[28−31] Fig.13 Mechanism of diselenide and benzisimidazole catalyzing amidation reactions[28−31] |
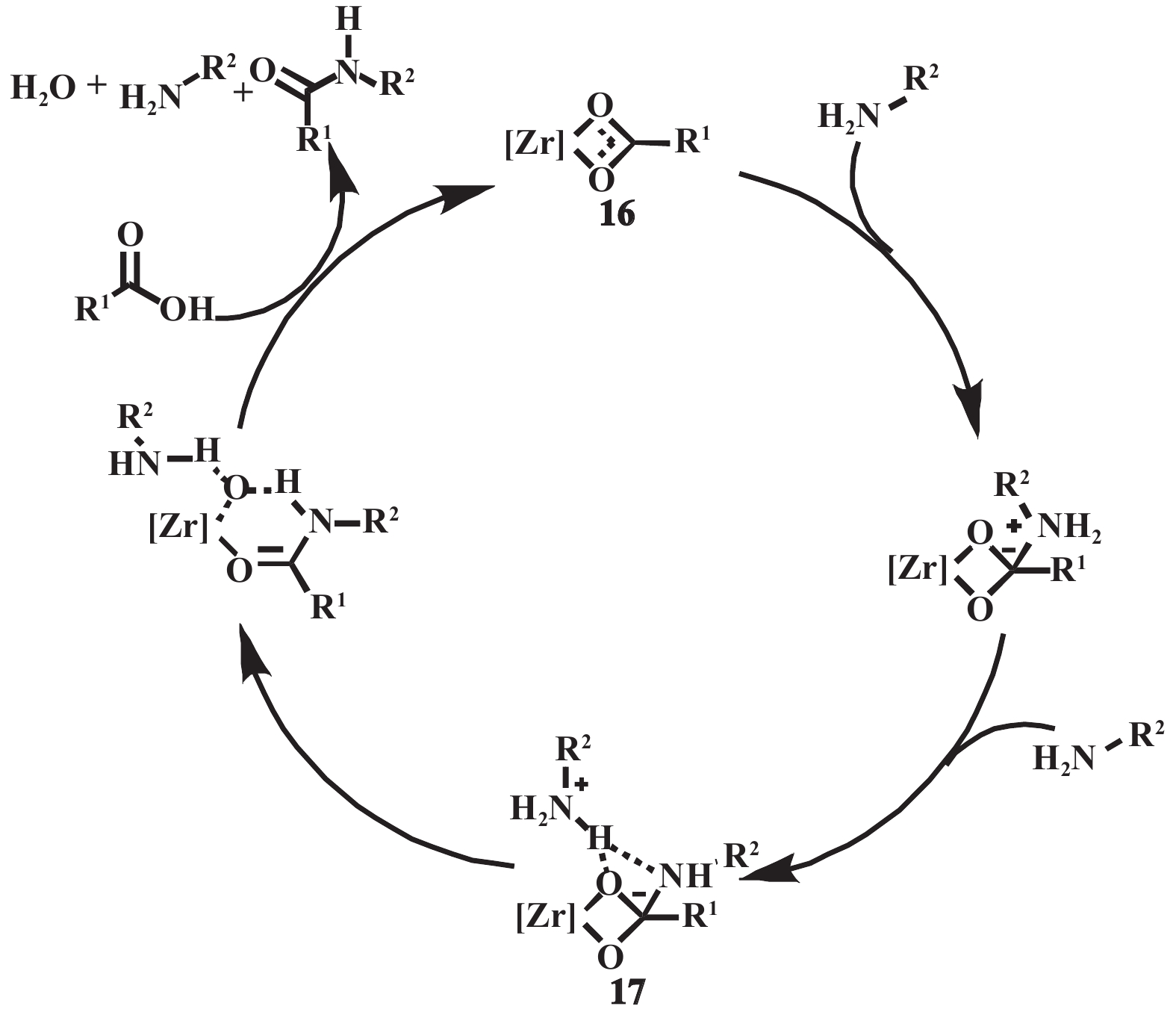
金属催化剂在直接酰胺化反应的应用中具有悠久的研究历史[3, 32−38]. 早在1988年, TiCl4体系已被报道用于该反应, 然而这些催化剂存在反应温度高, 依赖除水剂以及较高催化剂用量的限制[3]. 2012年, Aldolfsson[32]和Williams[33]开创性地分别使用锆盐和钛盐, 实现了温和条件下不活泼羧酸与胺的催化直接酰胺化, 并展现出优异的底物普适性. 其通过动力学、NMR和DFT等研究了锆催化反应的机理, 催化剂和羧酸先形成双核锆配合物16, 该配合物与胺反应产生四面体中间体17, 随后在第二个胺分子的干预下去质子化, 并发生C—O键的断裂, 最后释放酰胺、水和胺, 并再生催化剂(图14)[34].
2.2 过渡金属醇盐NiCl2、FeCl3等无机盐在直接酰胺化反应中也展现出不错的催化活性[39−40], 但其实际应用仍受限于高温或加入如CCl4等溶剂的问题[41]. 相比之下, 醇盐等有机盐在反应条件优化方面取得了一定进展, Yamamoto等[42]报道了Ta(OMe)5应用于直接酰胺化反应, 可以在接近室温的温度下催化二肽的形成, 但是其耗时较长(48 h), 且受到钽的成本和稀缺性的限制.
2.3 负载过渡金属催化剂除金属盐催化剂外, 非均相的金属氧化物等材料也被广泛应用于直接酰胺化中. Cravotto等[43]报道了微波辅助TiO2催化苯甲酸和苄胺的反应, 在100 ℃下反应20 min就可以得到97%的产物收率, 而且该TiO2可商业购买, 只需经过简单焙烧即可获得高催化活性. Hajizadeh等[44]报道了Ag/Fe3O4@SiO2-IT核壳结构催化剂, 通过表面负载的异噻唑啉酮活性位点与银纳米颗粒的协同作用, 可在温和条件下实现90%以上的目标产物收率. Parac-Vogt等[45]使用Zr-MOF催化双甘氨肽自身环化为2,5-二酮哌嗪的反应, 该方法无需格外添加除水剂, 即使在水体系中仍能保持其催化活性.
3 生物催化剂生物催化已成为现代有机合成中的重要方法, 在酰胺的直接催化合成中也有应用. Lubin-Germain等[46]开发的脂肪酶催化体系实现了羧酸与胺类化合物94%的酰胺化收率, 但该体系对二氧六环等有机溶剂存在高度依赖性, 限制了其大规模应用. 相比之下, 腺苷酰化酶(如3-异氰基丁酸腺苷酰化酶SfaB[47])在该方面具有显著优势, 其通过三磷酸腺苷(ATP)介导的羧酸活化机制生成高活性酰基磷酸中间体, 可在水相中直接催化羧酸与胺的酰胺化反应. 然而, 由于ATP在该过程中不可逆的转化为单磷酸腺苷(AMP), 该体系需化学计量级的ATP参与[48], 大幅提高了反应成本. 针对这一问题, Lelièvre等[49]通过构建多聚磷酸激酶2-Ⅲ(PPK2-Ⅲ)和无机焦磷酸酶(PPase)的ATP循环体系, 利用CoA连接酶完成了羧酸直接酰胺化, 该体系仅需添加5%的ATP, 显著提升了该体系的经济性. 酶催化具有多种优点, 仅形成水作为副产物, 酶可回收重复使用, 且反应可在水相中进行. 然而, 现有酶体系对芳香胺等低活性胺类底物的适应性仍然不足, 底物普适性受限的问题仍是制约其大规模应用的关键挑战.
4 总结与展望本文总结了羧酸和胺直接反应合成酰胺的各种方法, 这些研究都使酰胺的合成变得简单和绿色环保, 但是目前大部分方法都存在一定的缺陷, 比如需使用除水分子筛, 底物范围受限, 反应条件较为苛刻, 催化剂制备复杂, 与有机、药物和多肽合成要求存在兼容性、空间选择性等问题, 距离大规模的应用可能有一定的差距, 但是随着科研工作者在酰胺合成领域不断地深入研究, 相信以上问题将会逐渐解决, 使羧酸和胺直接酰胺化的过程变得更加简洁、高效、经济和绿色, 并最终得到广泛应用.
| [1] |
Rethinking amide bond synthesis[J]. Nature, 2011, 480(7378): 471–479.
DOI:10.1038/nature10702 |
| [2] |
Organoboron catalysis for direct amide/peptide bond formation[J]. Chem Commun, 2024, 60(80): 11202–11222.
DOI:10.1039/D4CC02994A |
| [3] |
Recent developments in catalytic amide bond formation[J]. Pept Sci, 2020, 112(6): e24210.
DOI:10.1002/pep2.24210 |
| [4] |
Large-scale applications of amide coupling reagents for the synthesis of pharmaceuticals[J]. Org Process Res Dev, 2016, 20(2): 140–177.
DOI:10.1021/op500305s |
| [5] |
Efficient and accessible silane-mediated direct amide coupling of carboxylic acids and amines[J]. Green Chem, 2021, 23(1): 288–295.
DOI:10.1039/D0GC02833A |
| [6] |
A green chemistry perspective on catalytic amide bond formation[J]. Nat Catal, 2019, 2(1): 10–17.
DOI:10.1038/s41929-018-0211-5 |
| [7] |
Hydroxy-directed amidation of carboxylic acid esters using a tantalum alkoxide catalyst[J]. J Am Chem Soc, 2016, 138(43): 14218–14221.
DOI:10.1021/jacs.6b09482 |
| [8] |
Zirconium oxide-catalyzed direct amidation of unactivated esters under continuous-flow conditions[J]. Adv Synth Catal, 2021, 363(10): 2529–2535.
DOI:10.1002/adsc.202001496 |
| [9] |
Boronic acid catalysis[J]. Chem Soc Rev, 2019, 48(13): 3475–3496.
DOI:10.1039/C9CS00191C |
| [10] |
Direct catalytic amidations from carboxylic acid and ester derivatives: A review[J]. Catalysts, 2023, 13(2): 366.
DOI:10.3390/catal13020366 |
| [11] |
Amide bond formation and peptide coupling[J]. Tetrahedron, 2005, 61(46): 10827–10852.
DOI:10.1016/j.tet.2005.08.031 |
| [12] |
Bio-based amides from renewable isosorbide by a direct and atom-economic boric acid amidation methodology[J]. Eur J Org Chem, 2016, 2016(13): 2308–2318.
DOI:10.1002/ejoc.201600186 |
| [13] |
3,4,5-Trifluorobenzeneboronic acid as an extremely active amidation catalyst[J]. J Org Chem, 1996, 61(13): 4196–4197.
DOI:10.1021/jo9606564 |
| [14] |
Direct amidation of carboxylic acids catalyzed by ortho-iodo arylboronic acids: Catalyst optimization, scope, and preliminary mechanistic study supporting a peculiar halogen acceleration effect[J]. J Org Chem, 2012, 77(19): 8386–8400.
DOI:10.1021/jo3013258 |
| [15] |
Catalytic chemical amide synthesis at room temperature: One more step toward peptide synthesis[J]. J Org Chem, 2015, 80(9): 4532–4544.
DOI:10.1021/acs.joc.5b00378 |
| [16] |
2-Furanylboronic acid as an effective catalyst for the direct amidation of carboxylic acids at room temperature[J]. Eur J Org Chem, 2015, 2015(5): 1100–1107.
DOI:10.1002/ejoc.201403468 |
| [17] |
Mechanistic insights into boron-catalysed direct amidation reactions[J]. Chem Sci, 2018, 9(4): 1058–1072.
DOI:10.1039/C7SC03595K |
| [18] |
Design of boronic acid–base complexes as reusable homogeneous catalysts in dehydrative condensations between carboxylic acids and amines[J]. Asian J Org Chem, 2017, 6(9): 1191–1194.
DOI:10.1002/ajoc.201700194 |
| [19] |
An efficient solvent-free microwave-assisted synthesis of cinnamamides by amidation reaction using phenylboronic acid/Lewis base co-catalytic system[J]. Synthesis, 2019, 51(20): 3891–3900.
DOI:10.1055/s-0039-1690132 |
| [20] |
Development of fluorous boronic acid catalysts integrated with sulfur for enhanced amidation efficiency[J]. RSC Adv, 2023, 13(25): 17420–17426.
DOI:10.1039/D3RA03300G |
| [21] |
MCF-supported boronic acids as efficient catalysts for direct amide condensation of carboxylic acids and amines[J]. Chem Commun, 2014, 50(53): 7017–7019.
DOI:10.1039/C4CC01148A |
| [22] |
Unique physicochemical and catalytic properties dictated by the B3NO2 ring system[J]. Nat Chem, 2017, 9(6): 571–577.
DOI:10.1038/nchem.2708 |
| [23] |
All non-carbon B3NO2 exotic heterocycles: Synthesis, dynamics, and catalysis[J]. Chem Eur J, 2019, 25(18): 4648–4653.
DOI:10.1002/chem.201900715 |
| [24] |
Diboron-catalyzed dehydrative amidation of aromatic carboxylic acids with amines[J]. Org Lett, 2018, 20(15): 4397–4400.
DOI:10.1021/acs.orglett.8b01480 |
| [25] |
Catalytic direct amidations in tert-butyl acetate using B(OCH2CF3)3[J]. Org Biomol Chem, 2019, 17(26): 6465–6469.
DOI:10.1039/C9OB01012B |
| [26] |
Triphenylphosphine-catalysed amide bond formation between carboxylic acids and amines[J]. Chem Commun, 2014, 50(43): 5763–5766.
DOI:10.1039/c4cc01861c |
| [27] |
Tris(o-phenylenedioxy)cyclotriphosphazene as a promoter for the formation of amide bonds between aromatic acids and amines[J]. Synthesis, 2020, 52(21): 3253–3262.
DOI:10.1055/s-0040-1707174 |
| [28] |
Benzo-isothiazolone organo/copper-cocatalyzed redox dehydrative construction of amides and peptides from carboxylic acids using (EtO)3P as the reductant and O2 in air as the terminal oxidant[J]. J Am Chem Soc, 2016, 138(21): 6715–6718.
DOI:10.1021/jacs.6b03168 |
| [29] |
Aerobic, diselenide-catalyzed redox dehydration: Amides and peptides[J]. Org Lett, 2018, 20(3): 538–541.
DOI:10.1021/acs.orglett.7b03620 |
| [30] |
Rational design of an organocatalyst for peptide bond formation[J]. J Am Chem Soc, 2019, 141(40): 15977–15985.
DOI:10.1021/jacs.9b07742 |
| [31] |
Two-component redox organocatalyst for peptide bond formation[J]. J Am Chem Soc, 2022, 144(8): 3637–3643.
DOI:10.1021/jacs.1c12798 |
| [32] |
Direct amide coupling of non-activated carboxylic acids and amines catalysed by zirconium(IV) chloride[J]. Chem-Eur J, 2012, 18(13): 3822–3826.
DOI:10.1002/chem.201104055 |
| [33] |
Direct amide formation from unactivated carboxylic acids and amines[J]. Chem Commun, 2012, 48(5): 666–668.
DOI:10.1039/C1CC15210F |
| [34] |
Mechanistic elucidation of zirconium-catalyzed direct amidation[J]. J Am Chem Soc, 2017, 139(6): 2286–2295.
DOI:10.1021/jacs.6b10973 |
| [35] |
Research progress on transition metal catalysts of tert-butyl sulfinamide(叔丁基亚磺酰胺类过渡金属手性催化剂的研究进展)[J]. J Mol Catal (China)(分子催化(中英文)), 2024, 38(5): 483–501.
DOI:10.16084/j.issn1001-3555.2024.05.009 |
| [36] |
Controlling reactivity of palladium amides for selective carbonylation towards urea and oxamide derivatives(由钯酰胺反应性调控胺的单羰和双羰化反应合成脲和草酰胺衍生物)[J]. J Mol Catal (China)(分子催化(中英文)), 2024, 38(4): 297–308.
DOI:10.16084/j.issn1001-3555.2024.04.001 |
| [37] |
Nitrogen-doped ordered mesoporous carbon supported Co nanoparticles catalyzed hydrogenation of aliphatic amides(氮掺杂的有序介孔碳负载钴纳米颗粒用于脂肪酰胺的催化加氢)[J]. J Mol Catal (China)(分子催化(中英文)), 2024, 38(3): 208–214.
DOI:10.16084/j.issn1001-3555.2024.03.002 |
| [38] |
Palladium-catalyzed hydroaminocarbonylation of alkene with triazine(钯催化的烯烃与三嗪烷氢胺羰基化反应研究)[J]. J Mol Catal (China)(分子催化), 2023, 37(3): 225–233.
DOI:10.16084/j.issn1001-3555.2023.03.002 |
| [39] |
Direct amidation of non-activated phenylacetic acid and benzylamine derivatives catalysed by NiCl2[J]. R Soc Open Sci, 2018, 5(2): 171870.
DOI:10.1098/rsos.171870 |
| [40] |
A simple and greener approach for the amide bond formation employing FeCl3 as a catalyst[J]. New J Chem, 2015, 39(10): 7746–7749.
DOI:10.1039/C5NJ01047K |
| [41] |
Direct amidation of carboxylic acids with tertiary amines: Amide formation over copper catalysts through C–N bond cleavage[J]. Eur J Org Chem, 2014, 2014(20): 4244–4247.
DOI:10.1002/ejoc.201402332 |
| [42] |
Tantalum-catalyzed amidation of amino acid homologues[J]. J Am Chem Soc, 2019, 141(48): 18926–18931.
DOI:10.1021/jacs.9b08415 |
| [43] |
Fast TiO2-catalyzed direct amidation of neat carboxylic acids under mild dielectric heating[J]. Catal Sci Technol, 2014, 4(5): 1395–1399.
DOI:10.1039/C4CY00038B |
| [44] |
Facile peptide bond formation: Effective interplay between isothiazolone rings and silanol groups at silver/iron oxide nanocomposite surfaces[J]. ACS Omega, 2019, 4(6): 10629–10639.
DOI:10.1021/acsomega.9b00986 |
| [45] |
En route to a heterogeneous catalytic direct peptide bond formation by Zr-based metal–organic framework catalysts[J]. ACS Catal, 2021, 11(13): 7647–7658.
DOI:10.1021/acscatal.1c01782 |
| [46] |
Lipase-catalyzed amidation of carboxylic acid and amines[J]. Tetrahedron Lett, 2018, 59(21): 2086–2090.
DOI:10.1016/j.tetlet.2018.04.049 |
| [47] |
Repurposing the 3-isocyanobutanoic acid adenylation enzyme sfaB for versatile amidation and thioesterification[J]. Angew Chem Int Edit, 2021, 60(4): 2030–2035.
DOI:10.1002/anie.202010042 |
| [48] |
Biocatalytic amide bond formation[J]. Green Chem, 2023, 25(8): 2958–2970.
DOI:10.1039/D3GC00456B |
| [49] |
ATP regeneration system in chemoenzymatic amide bond formation with thermophilic CoA ligase[J]. ChemCatChem, 2020, 12(4): 1184–1189.
DOI:10.1002/cctc.201901870 |
 2025, Vol. 39
2025, Vol. 39