2. 重庆医科大学附属康复医院, 重庆 400050
2. The Affiliated Rehabilitation Hospital of Chongqing Medical University, Chongqing, 400050, China
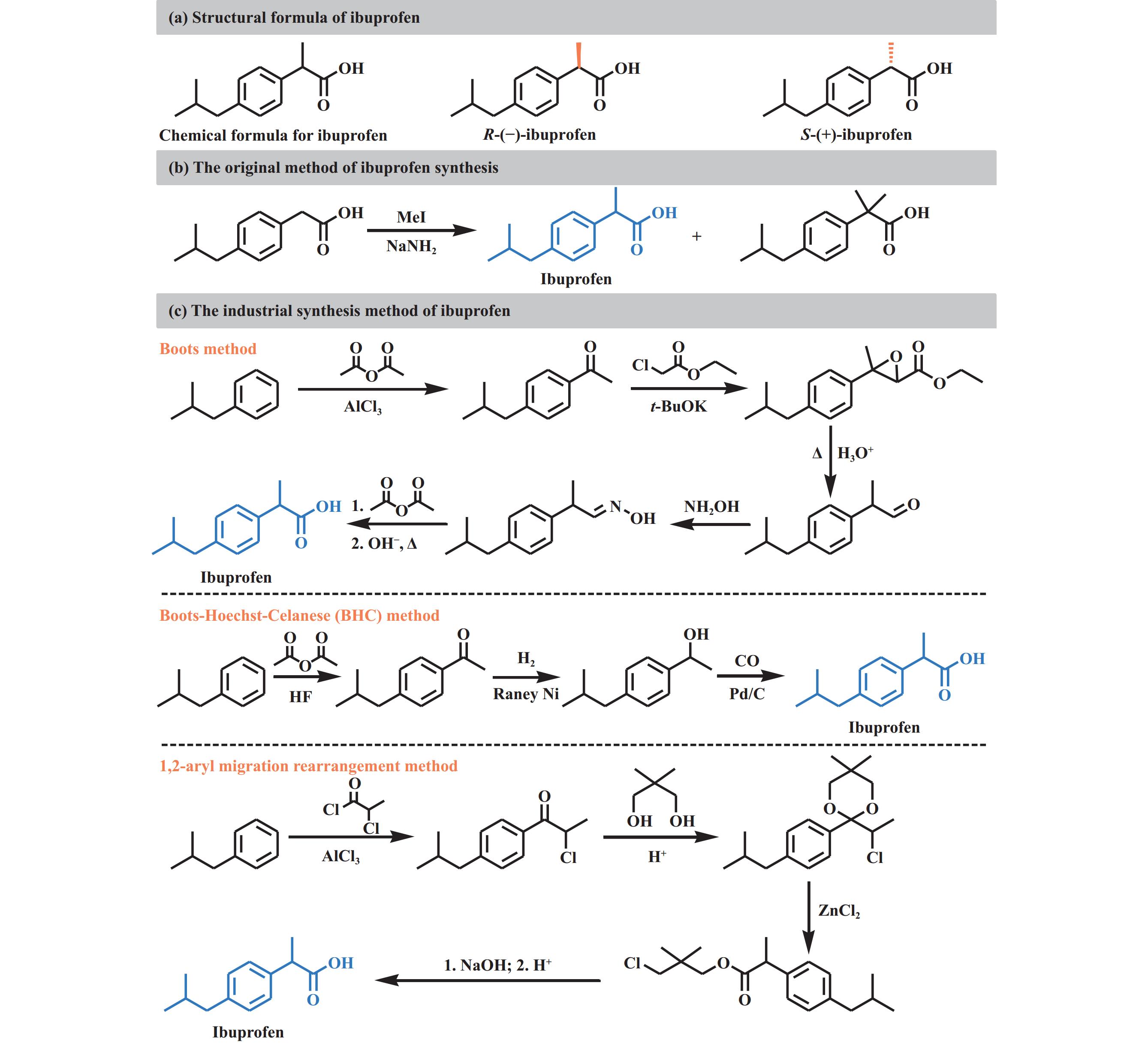
布洛芬(Ibuprofen, 图1(a))是一种常见的非甾体抗炎药(NSAIDs), 具有解热、镇痛和抗炎作用, 化学名称为2-(4-异丁基苯基)丙酸或对异丁苯丙酸[1−3]. 因其显著的止痛和退烧效果, 被广泛用于治疗感冒、发热和关节炎等疾病, 是全球销售额最高的非处方药物之一. 并且布洛芬是世界卫生组织和美国食品药品监督管理局唯一共同推荐的儿童(六个月以上)退烧药[4]. 布洛芬最早在1964年由英国博姿(Boots)公司的John Nicholson合成[1]. 起初, 他们通过对异丁基苯乙酸侧链甲基化合成了布洛芬(图1(b))[1], 但由于技术落后和生产成本高使得布洛芬的大规模生产曾一度受限. 随着技术的进步, 不断开发出新方法, 目前主要的工业化路线包括Boots法、BHC法和芳基1,2-迁移重排法等(图1(c))[5], 这实现了布洛芬的大规模生产. 2023年, 布洛芬全球市场价值约为6.9亿美元, 年产量超过4.6万吨(其中我国产量占一半), 主要市场集中在美国、欧洲(包括德国、法国、意大利)和日本[6−7]. 随着制药行业研发工作的日益深化、市场竞争的日渐加剧, 以及可持续发展要求的提升, 传统布洛芬合成方法逐渐暴露出能耗高、副反应多和工艺复杂等缺点, 导致企业面临着控制成本与提升生产工艺质量的双重压力. 因此, 绿色可持续的布洛芬合成技术成为学术界和工业界关注的焦点.
|
图 1 布洛芬的结构及合成方法 Fig.1 Structure and synthesis methods of ibuprofen |
研究人员不断开发出新的布洛芬合成方法, 包括环氧丙烷重排法[8−9]、烯烃加氢法[9]和以对异丁基苯乙烯/1-乙基-4-异丁基苯为原料的氢甲酰化/氧化、氢酯化/水解及氢羧化[10−11], 以及基于电化学[12−13]和光化学[3,14−15]的合成方法. 其中, 光化学(光催化)技术通过光能驱动反应, 在布洛芬合成中能有效减少环境污染, 以其反应条件温和、高效、生产成本低、反应产物纯度高和优异的收率等优势, 备受研究人员关注, 并为布洛芬绿色合成提供了新的发展方向[16−17]. 此外, 光化学合成技术结合连续流工艺, 有望进一步提升生产效率, 为布洛芬的工业化应用开辟新路径, 同时推动我国化学工业向绿色可持续方向转型. 催化剂的创新、反应条件的优化以及连续流技术的改进, 为布洛芬的可持续生产提供了新的可能. 尽管化学合成技术在布洛芬合成中取得了一定进展, 但其工业化应用仍面临诸多挑战. 其中, 反应机理的复杂性、催化剂的稳定性、生产成本的可控性以及大规模合成的可行性等问题尚未得到充分解决. 深入研究并优化这些关键环节, 将有助于推动光化学合成布洛芬从实验室研究向工业化应用迈进.
本文系统性地总结了光化学合成技术的原理、优势及光化学技术在布洛芬合成中的应用研究进展, 优势与挑战, 并展望光化学技术在布洛芬合成中的未来发展前景. 希望通过本文的梳理, 能够为布洛芬光化学绿色合成及工业化生产的进一步发展提供理论指导与实践参考.
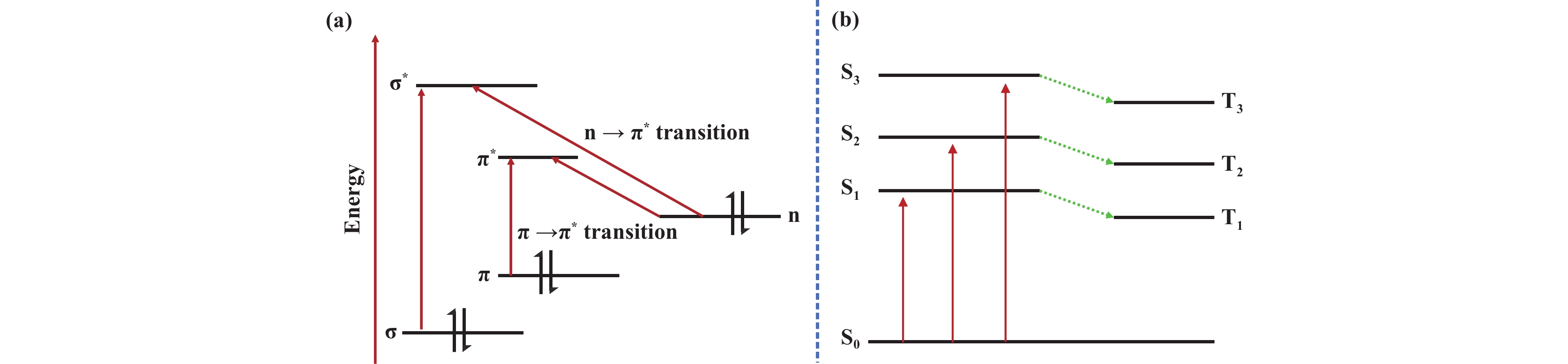
1 光化学反应的原理和优势 1.1 光化学反应的原理有机光化学反应是光化学的重要分支, 涉及光吸收、分子激发和化学转化三个关键阶段, 体现了化学与物理学科的深度交叉[18−19]. 区别于传统热力学驱动的基态反应体系, 光化学反应主要发生于分子激发态. 分子受激发后形成的激发态具有多模态特征, 通常表现为转动激发、振动激发和电子激发三种基本形式. 在有机光化学体系中, 光致激发主要表现为电子跃迁过程[18]. 如图2(a)所示, 基态有机分子吸收特定波长光子后, 成键轨道(σ/π)或非键轨道(n)中的电子受激跃迁至反键轨道(σ*/π*), 形成高能激发态. 其中n→π*和π→π*跃迁作为主要激发路径, 分别对应于紫外(200~400 nm)和可见(400~800 nm)光谱区的特征吸收带. 对于光化学合成布洛芬, 反应机理通常为羰基三重激发态(n→π*和π→π*)定向的芳基1,2-迁移, 该过程包括上述步骤.
|
图 2 有机分子的电子激发和多重态过程示意图 Fig.2 Schematic diagram of electronic excitation and multistate processes of organic molecules |
在光致电子激发过程中, 分子吸收光子能量跃迁至激发态, 其量子态特性可通过自旋多重度(Spin Multiplicity)进行描述. 根据量子力学原理, 激发态分子在磁场中会呈现塞曼分裂现象, 其裂分谱线数目与总自旋角动量量子数(S)满足关系式: 多重态=2S+1. 电子自旋相反的激发态塞曼分裂数为1, 叫做单重态S; 电子自旋相同的激发态塞曼分裂数为3, 叫做三重态T. 能级划分上, 基态定义为S0, 最接近S0的单重激发态是第一单重激发态, 记作S1, 对应的三重激发态为T1, 依次类推得到S2、S3、T2和T3等. 通常, n→π*跃迁后的激发态为S1, 而π→π*跃迁后的激发态为S2(图2(b)). 激发态分子寿命极短, 一般在10−9~10−3 s范围内[20], 其中单重态寿命约为10−9~10−5 s, 三重态寿命约为10−5~10−3 s. 激发态分子可通过物理或化学过程释放所吸收的光能. 物理过程包括辐射过程(如荧光和磷光)及非辐射过程(如内部转化、系间窜越和振动弛豫)[21]. 化学过程主要分为三类: (1)单分子光化学反应: 激发分子自身发生光分解、重排或异构化等变化的反应. 通过光化学技术合成布洛芬, 特别是光-Forskii重排通常为这类过程. (2)双分子光化学反应: 激发态分子与基态分子相互作用, 引发环加成或聚合等反应. (3)光催化反应: 光敏剂或光催化剂吸收光子并跃迁至激发态, 随后通过氧化还原或能量传递等方式引发其他化合物变化, 并最终回到基态, 如光敏反应和光催化氧化还原反应等. 光催化氢甲酰化/氧化、氢酯化/水解及氢羧化等合成布洛芬的过程通常为光催化过程.
1.2 光化学反应的优势有机光化学反应技术通过吸收光能并将其转化为化学能, 以促进化学反应进行, 是一种环境友好的合成技术, 能够提高反应效率、降低能耗和生产成本, 并在绿色有机合成、药物分子绿色合成、精细化工、能源转换和材料科学等多个领域中展现出高选择性和可控性的重要作用[20−22]. 例如, 光化学反应技术应用于烯丙基加成、环化、还原交叉偶联、开环、氧化交叉偶联、脱氢、脱磺化和脱羧等过程以合成药物分子及农用化学品[23−24]. 此外, 许多传统化学方法难以实现的转化, 如C−H键官能化、环加成反应和自由基偶联反应[25], 在光化学条件下可以高效完成, 提供新的分子构建策略, 拓展了传统合成路径. 这些应用不仅彰显了光化学技术的多功能特性, 还为环境保护和能源可持续发展提供了有力支持.
2 光化学技术在布洛芬合成中的应用布洛芬的众多合成方法中, 以芳基1,2-迁移重排法为主, 该方法涉及4步(图1(c), 芳基-1,2-迁移重排法). (1) 三氯化铝(AlCl3)催化异丁基苯与2-氯丙酰氯发生Friedel-Crafts酰基化反应合成2-氯-1-(4-异丁基)-1-丙酮; (2) 在酸性条件下与新戊二醇合成缩酮(2-(1-氯乙基)-2-(4-异丁基苯基)-5,5-二甲基-1,3-二氧六环); (3) 使用氯化锌(ZnCl2)在180 ℃下催化重排为4-异丁基-α-甲基-3-氯-2,2-二甲基丙苯乙酸酯; (4) 最后水解为布洛芬. 该方法具有产率高、安全性好和重排催化剂价廉易得、无毒等优点, 这也是我国主要采用的合成方法[3]. 但是, 该方法使用AlCl3、ZnCl2和酸碱溶液, 依然会产生大量废弃物, 也存在溶剂(石油醚)用量大、难回收、产生废水, 且新戊二醇价格较贵等缺点, 这对绿色可持续发展理念提出挑战, 因此研究人员开始开发新的布洛芬合成方法. 研究人员发现苯丙酮类化合物自身具有光化学活性[26−29], 因此在芳基1,2-迁移重排法的基础上衍生出了光化学合成布洛芬的方法. 鉴于光化学技术的优点, 研究人员逐渐开展了光化学合成布洛芬的研究.
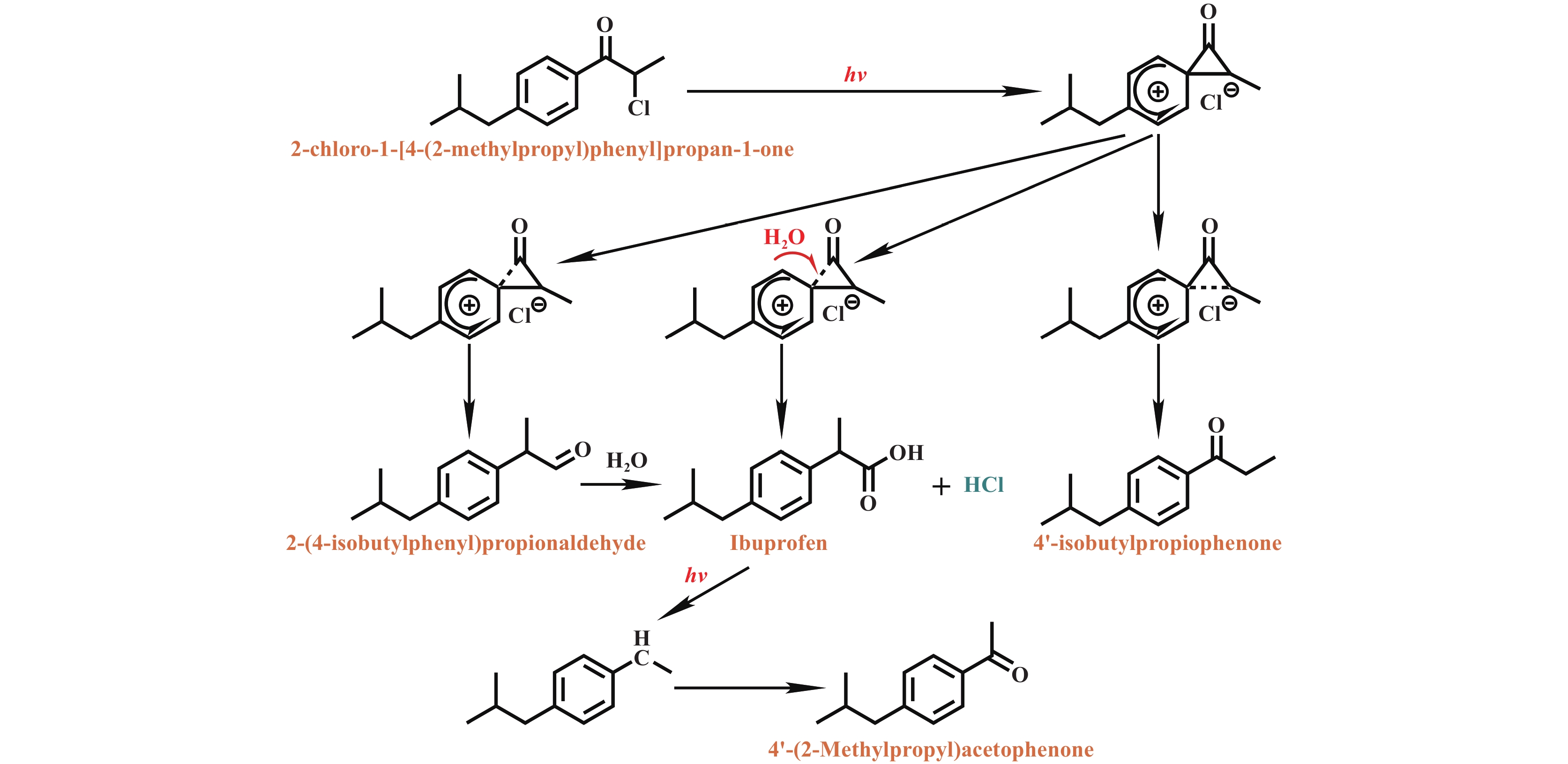
上世纪70年代, 研究人员发现苯基酮的烯醇化过程可受光激发过程影响[28−29]. 1978年, Bergmark发现α-氯-邻甲基苯乙酮在光照下环化合成茚满-1-酮[26]. 随后, Sonawane组研究了α-卤代酮的光化学过程, 并证实该过程产生自由基产物[30]. 1985年, Bergmark等[31]研究了α-氯代苯烷基酮的光烯醇化反应合成茚满-1-酮, 并在甲醇溶剂中观察到产生了芳基1,2-迁移重排的羧酸甲酯产物, 但是产率较低(~24%). 1990年Sonawane组[32]率先发现基于光诱导芳基1,2-迁移重排作为关键步骤的方法, 可以将2-氯苯丙酮有效转化为2-芳基丙酸, 产率为32.8%. 同时, 也存在竞争性光还原和亲核取代反应, 副产物分别为苯丙酮和相应的2-羟基衍生物. 另外, 观察到取代基可定向控制激发态, 从而显著影响重排过程, 该过程使用环氧丙烷作为盐酸(HCl)清除剂以提高2-芳基丙酸的产率. 事实上, 早在上世纪中叶, 研究人员就发现α-卤代酮的Favorskii重排过程, 随着光化学技术的发展才被应用于光-Favorskii重排合成布洛芬[33−36]. 并且, Kimpe等[37]于1981年率先报道α-氯酮亚胺的Favorskii重排. 他们均是基于环丙酮(或环丙亚胺)中间体发生芳基1,2-迁移重排的过程(图3).
|
图 3 光Favorskii重排(芳基1,2-迁移重排)的机理及产物 Fig.3 Mechanism and products of photo-Favorskii rearrangement (aryl 1,2-migration rearrangement) |
随后, 经过优化反应条件, Sonawane组在1994年发展了从α-氯苯丙酮合成布洛芬的新型单步高效光化学合成方法[38], 反应机理为羰基三重激发态(n→π*和π→π*)定向的芳基1,2-迁移(图3), 以中等产率合成布洛芬和酮洛芬, 产率分别为78%和70%. 另外, 羰基三重态(n,π*/π,π*)性质也在手性转移中起着重要作用, 该方法可用于合成光学活性的布洛芬和酮洛芬, 但选择性有待提升. 值得注意的是, 氯丙酰氯原料易得(生物可再生乳酸氯化)、原子利用率高, 符合工业绿色可持续发展要求. 1997年, Dhavale等[39]研究了与α-氯苯丙酮类似的取代α-氯苯乙酮在不同溶剂体系中的光反应过程, 发现芳基1,2-迁移重排受介质控制,在乙腈水溶液(95∶5)中反应可以更好地合成苯乙酸, 产率最高为81%, 同时研究了取代基对迁移能力和获得苯乙酸产率的影响(实际产量). 1998年, Usui等[40]研究了AgBF4作为氯离子清除剂的2-氯苯丙酮重排过程, 发现芳基1,2-迁移重排是分子内SN2机理, 且光诱导重排存在离子或自由基中间体参与, 这一发现与Sonawane组的发现一致[38]. 此后, 光化学合成布洛芬鲜有报道, 这可能与该过程布洛芬的选择性难提升和光合成效率低有关.
经过几十年的发展(表1), 光化学技术日趋成熟, 也成为了当前绿色合成的关注焦点之一, 被研究人员广泛应用于有机合成或药物分子合成[41−46]. 并且, 随着连续流微反应技术的发展, 部分解决了光化学合成效率低和“三废”污染防治的问题, 这使得光辅助连续流技术获得前所未有的发展, 并为社会绿色可持续发展提供了契机[43−45]. 因此, 基于光化学的连续流技术也被研究人员运用于布洛芬合成中. 2016年, Baxendale等[15]率先将光化学连续流微反应器应用于合成布洛芬, 该方法首先使用2-氯丙酰氯原料, 通过Friedel-Crafts酰基化反应合成了起始原料为α-氯苯丙酮, 然后经过光-Favorskii重排生产布洛芬. 该过程使用丙酮和H2O混合溶剂(9∶1)作为反应溶剂, 环氧丙烷作为酸清除剂. 反应结束后用二氯甲烷(DCM)溶解, 并用NaOH水溶液萃取, 然后用5 mol·L−1 HCl酸化至pH=3, 之后再用二氯甲烷(DCM)萃取三次, 合并有机层并用无水硫酸钠干燥, 过滤、溶剂蒸发后获得淡黄色油状布洛芬. 最后, 在0 ℃下从己烷中研磨, 分离出白色无定形粉末的布洛芬. 他们使用市售的Vapourtec E系列流动系统及UV-150光反应器设计了一套连续流光化学反应器(图4), 并将其应用于布洛芬合成. 该方法使布洛芬合成步骤缩短至两步, 并可以借助小型光谱仪实时分析. 研究了不同过滤器、停留时间和浓度等反应条件的影响, 为布洛芬的高效生产建立条件, 并在大规模的连续流实验上验证了最佳条件. 在布洛芬收率为76%的高收率条件下, 时空收率约为8.7 mg·min−1 (0.52 g·h−1); 在布洛芬收率为54%的条件下, 时空收率约为19.5 mg·min−1 (1.16 g·h−1). 该方法还可以应用于其他烷基酸合成, 表明这种新的光化学重排过程可有效地用于实验室规模的高附加值化合物连续合成. 虽然该工作仅研究了光化学合成步骤, 但是这为后续链接整个合成过程的连续流光化学合成布洛芬技术奠定了基础.
| 表 1 布洛芬光化学合成发展史 Table 1 History of photochemical synthesis of ibuprofen |

|
图 4 光-Favorskii重排合成布洛芬的装置[15] Fig.4 Photo-Favorskii rearrangement device for synthesis of ibuprofen[15] |
2023年, Itoh等[46]开发了一种基于自动化机械臂的连续流光合成系统, 首次实现了布洛芬的全流程集成生产(图5). 该系统将Friedel-Crafts酰基化过程和光-Favorskii重排过程两步连续反应整合为连续流光化学合成系统, 显著提升了合成效率. 光-Favorskii重排过程与Baxendale等相似[15], 研究团队对光照强度、流速和Friedel-Crafts酰基化催化剂的负载量等反应条件及后处理纯化工艺进行了系统性优化, 最终获得布洛芬的总收率为38%, 时空收率达47 mg·h−1. 这一成果为光化学合成技术在药物连续化生产中的应用提供了重要参考. 同年, 南京工业大学郭凯等[47]开发了利用微通道连续制备布洛芬的模块反应装置, 并开发了一种合成布洛芬的新型光催化方法. 该方案使用异丁基苯和2-溴丙酸甲酯为原料, 通过光催化合成对异丁基苯丙酸甲酯, 然后在酸性条件下水解获得布洛芬. 该方案利用微通道模块反应装置连续制备布洛芬, 能耗低, 反应条件温和, 反应过程更加安全、高效和绿色环保, 在后期工业化应用方面具有较大潜力. 以上三个基于光化学的连续流合成案例表明, 光化学合成布洛芬的生产效率较低, 这可能是因为反应过程中会定量产生氢卤酸(HCl和HBr). 因此, 陈芬儿团队[3]于2024年成功开发了使用甲酸钠(HCOONa)作为酸清除剂的光-Favorskii重排法(光介导2-氯-1-芳基丙酮合成2-芳基丙酸, 反应温度: 55 ℃). 该方案可在环境友好条件下快速合成多种2-芳基丙酸, 消除了工业上采用ZnO促进重排策略中的多步骤序列, 并提高了连续流光化学合成布洛芬的生产效率, 布洛芬收率为77%, 时空收率约为79 mg·min−1 (4.8 g·h−1, 相当于41.7 kg·a−1), 但合成效率仍有待提高.

|
图 5 光-Favorskii重排合成布洛芬的机器臂[46] Fig.5 Robotic arm for photo-Favorskii rearrangement in ibuprofen synthesis[46] 1. Panda 1(vial gripping, moving stationary, and operating the touch panel of V10 Touch); 2. V10 Touch (evaporation of solvent,exchanging the solvent, and redesolving the compounds); 3. Solvent refill device; 4. Panda 2 (vial gripping, moving stationary, and flow channel change); 5. Vial work station; 6. Reaction, work-up, and purification area |
虽然连续流光化学合成布洛芬前期研究结果的实际工业化应用较困难, 但是化工流程模拟的方法被用于研究连续流光化学合成布洛芬. 2023年, 上海交通大学苏远海组[48]首先求解一维轴向扩散模型的偏微分方程, 探究轴向扩散对反应产率随时间变化曲线的影响. 然后, 构建了一个包括微型光反应器、连续控制泵、大功率UV-LED光源、在线可见光吸光度分析单元和基于Raspberry Pi控制单元的自动化平台用于探究光-Favorskii重排连续流合成布洛芬. 在优化了停留时间、光强度、水含量和环氧丙烷含量后, 获得了大量的实验数据并与预测值基本一致. 最后基于动力学方程对各种实验条件进行了优化, 其最优值与实验值符合较好, 这也证明将机器学习、自动化控制等人工智能与流动化学相结合用于光化学动力学与机理研究的可行性. 2025年, 中南大学谢乐等[49]建立了连续流光化学合成布洛芬的动态反应器模型, 该模型与反应动力学模型耦合, 基于遗传算法确定了布洛芬合成的10个未知动力学参数, 并进行光强、停留时间和初始反应物浓度对布洛芬浓度分布的敏感性分析. 研究发现, 布洛芬浓度和不同光强度下的位置之间存在典型的抛物线关系, 并且布洛芬的出口浓度在所有停留时间内随着初始反应物浓度的增加而线性增加. 另外, 对于流动反应系统, 最佳停留时间仅与流速和反应器长度有关, 几乎与初始反应物浓度和光强度无关, 这为后续实验研究的开展提供了基础.
另外, 使用有机光催化剂的催化过程也应用于光催化合成布洛芬. 2019年, König等[50]报道以三异丙基硅烷硫醇为氢原子转移催化剂的光催化反应体系, 催化CO2对烷基的C—H键进行羧化, 以合成布洛芬及其他2-芳基丙酸. 该催化过程包括反应物从原位生成2,3,4,6-四(9H-咔唑-9-基)-5-(1-苯乙基)苯甲腈的还原态中接受电子, 生成苄基自由基, 经质子化后与CO2反应生成相应的羧酸. 同时, 光催化反应也被应用于布洛芬合成, 如溴化镍催化剂(NiBr)在新亚铜配体(neocuproine)存在下, 催化烯烃与CO2发生氢羧化反应生成布洛芬及其他马氏产物的羧酸[51]. 机理研究表明, 在此过程中会产生H-NiLn物种, 这促进了CO2与烯烃反应, 但这类使用CO2合成布洛芬的方法还有待进一步研究.
3 挑战与展望布洛芬作为全球最常用的非甾体抗炎药之一, 其高效、绿色合成技术备受关注. 传统热催化过程使用大量和多种的合成试剂, 使该过程能耗和成本较高. 相对而言, 光化学合成技术步骤少、简单易操作[52−53]. 尽管光化学合成技术为布洛芬的绿色合成提供了新范式, 但其工业化应用仍面临以下三个关键挑战: (1) 光利用率低. 光致激发过程, 由于反应物分子的吸光活性并不高, 导致实际太阳光能利用率低于12%, 为达到工业处理标准, 需配置千瓦级紫外照明系统, 致使电费成本占运营总支出超40%, 这极大地增加了生产成本. (2) 产物选择性调控难. 在Friedel-Crafts酰基化阶段, 传统均相催化剂易引发副反应, 如过度烷基化和位置异构产物等降低了最终布洛芬产物的收率. 另外, 如图3所示, 光化学合成步骤产物十分复杂, 已经明确有至少三种副产物, 这使目标产物布洛芬的选择性通常最高只能达到70%~80%[3,15,46]. (3) 连续化工艺适配性不足. 现有固定床或微通道反应器难以兼顾光穿透效率与传质速率, 导致时空收率仍显著低于传统热催化工艺, 如Itoh等[46]的研究时空收率仅为47 mg·h−1. 虽然光化学合成技术已在实验室实现了自动化生产布洛芬, 但在工业上进行大规模的推广仍存在着特定光谱范围和光照强度的问题. 同时, 现有的原料大多数供应于间歇性生产设计, 且改造难度高.
尽管面临诸多挑战, 但光化学合成技术已在布洛芬合成中展现出了广阔的应用前景和环境友好性, 这使得众多科研人员仍迎难而上. 例如, 研究人员通过光催化苄基或烯烃C—H活化, 实现了二氧化碳的直接插入, 成功合成布洛芬及其他2-芳基酸[50−51,54]. 然而, 该方法目前存在区域选择性副产物和产率较低的问题, 需进一步优化. 未来, 光化学合成/催化技术在布洛芬合成中的研究可从以下几个方面展开: (1) 光-Favorskii重排法的反应条件优化. 通过调控反应温度、溶剂类型、HCl淬灭剂种类和催化剂选择等条件, 可进一步提高布洛芬的产率和选择性. 此外, 探索不同的光源和/或外加光引发剂对反应的影响, 以及通过原位表征手段系统解析各要素协同作用机制, 也是未来研究的一个重要方向. (2) 连续流光化学反应器设计与工艺集成. 当前的连续流光化学反应器均为研究人员自行搭建, 开发更高效和集成化的光化学反应器可提高生产效率, 还能有效控制反应条件, 减少副产物的生成, 从而实现布洛芬高效光化学(光催化)合成. 未来如采用3D打印定制光反应器, 集成光波导与湍流增强结构(如螺旋流道)的开发, 以及耦合光电催化(PEC)技术的发展可能应用于光合成布洛芬. (3) 全生命周期绿色化. 设计高效、稳定的光催化剂或光化学系统是提升布洛芬合成效率的关键. 因此, 开发光合成-膜分离耦合工艺, 实现产物原位分离和原料循环利用将使光化学系统更加稳定. 同时, 当前研究表明, 与BHC方法类似, 利用CO2作为酰基化反应的绿色碳源(羧基)用于替代传统石油基原料[54−57], 在光合成布洛芬中展现出巨大的可行性.
综上所述, 光化学合成技术为布洛芬的绿色、高效合成提供了新的思路. 通过催化剂的创新、反应条件的优化以及工艺的改进, 未来有望实现布洛芬的可持续生产, 满足市场需求, 并降低对环境的影响.
4 总结光化学合成技术以其条件温和、高效和绿色可持续等特点, 为布洛芬的绿色合成提供了全新的路径, 科研人员通过对光化学合成技术和分离纯化技术的改进与优化, 实现了布洛芬的高效光化学合成. 但是光化学合成布洛芬的工业化生产仍然面临光利用率低和产物选择性调控难等挑战. 未来, 随着智能化技术的应用和绿色光化学合成工艺的优化, 以及连续流微通道技术的应用, 将极大增强光化学合成布洛芬技术的竞争力, 为全球布洛芬工业的可持续发展提供解决方案.
| [1] |
Rainsford K D. Ibuprofen: Discovery, development and therapeutics[M]. New York: John Wiley & Sons, Itd, 2015.
|
| [2] |
Advances on the syntheses of ibuprofen, dexibuprofen and deriva-tives(布洛芬、右旋布洛芬及其衍生物的合成进展)[J]. Chem Prod Technol(化工生产与技术), 2010, 17(2): 22–28.
DOI:10.3969/j.issn.1006-6829.2010.02.008 |
| [3] |
Photo-induced 1, 2-aryl migration of 2-chloro-1-arylpropanone under batch and flow conditions: Rapid, scalable and sustainable approach to 2-arylpropionic acids[J]. Chin Chem Lett, 2024, 35(2): 108576.
DOI:10.1016/j.cclet.2023.108576 |
| [4] |
Progress in the synthesis and application of ibuprofen(布洛芬的合成及应用研究进展)[J]. World Notes Antibiot(国外医药(抗生素分册)), 2020, 41(5): 404–410.
DOI:10.13461/j.cnki.wna.005341 |
| [5] |
Recent advances in the synthesis of ibuprofen and naproxen[J]. Molecules, 2021, 26(16): 4792.
DOI:10.3390/molecules26164792 |
| [6] |
Global Market Insights. Ibuprofen APl market-by type(standard ibuprofen, high potency ibuprofen), application(headache, arthritis, fever, dental pain), end-use(pharmaceutical & biopharmaceutical companies, CDMOs, global forecast(2024-2032) [EB/OL]. 2024-04-16 [2025-02-02]. https://www.gminsights.com/industry-analysis/ibuprofen-api-market.
|
| [7] |
Chem Analyst. Ibuprofen market analysis: Industry market size, plant capacity, production, operating efficiency, demand & supply gap, type, end-use applications, distribution channel, regional demand, company share, manufacturing process 2015-2034 [EB/OL]. 2024-03-12 [2024-06-06]. https://www.chemanalyst.com/industry-report/ibuprofen-market-3151.
|
| [8] |
郭锐, 莫泽艺, 蔡强, 等. 一种布洛芬的制备方法: CN201910471790.4[P]. 2019-06-03. [Guo R, Mo Z Y, Cai Q, et al. A method for the preparation of ibuprofen: CN201910471790.4[P]. 2019-06-03.]
Guo R, Mo Z Y, Cai Q, et al. A method for the preparation of ibuprofen: CN201910471790.4[P]. 2019-06-03.
|
| [9] |
姜标, 司玉贵, 陈君, 等. 一种制备2-芳基乳酸酯及萘普生、布洛芬的方法: CN200510026269.8[P]. 2005-12-14. [Jiang B, Si Y G, Chen J, et al. A method for the preparation of 2-aryl lactate and naproxen and ibuprofen: CN200510026269.8[P]. 2005-12-14.]
Jiang B, Si Y G, Chen J, et al. A method for the preparation of 2-aryl lactate and naproxen and ibuprofen: CN200510026269.8[P]. 2005-12-14.
|
| [10] |
Nickel-catalyzed Markovnikov addition of hydrogen cyanide to olefins. Application to nonsteroidal antiinflammatories[J]. J Org Chem, 1985, 50(25): 5370–5372.
DOI:10.1021/jo00225a072 |
| [11] |
Selective metal-catalyzed autoxidation of 2-arylpropionaldehydes. An improved synthesis of ibuprofen[J]. J Org Chem, 1987, 52(2): 287–290.
DOI:10.1021/jo00378a027 |
| [12] |
曾程初, 郭永婷, 徐坤. 一种卤素离子为电催化剂合成布洛芬中间体的方法: CN202011621086.1[P]. 2022-07-12. [Zeng C C, Guo Y T, Xu K. Method for synthesizing ibuprofen intermediate by taking halogen ions as electrocatalyst: CN202011621086.1[P]. 2022-07-12.]
Zeng C C, Guo Y T, Xu K. Method for synthesizing ibuprofen intermediate by taking halogen ions as electrocatalyst: CN202011621086.1[P]. 2022-07-12.
|
| [13] |
Electrocarboxylation of 1-chloro-(4-isobutylphenyl) ethane with a silver cathode in ionic liquids: An environmentally benign and efficient way to synthesize Ibuprofen[J]. RSC Adv, 2019, 9(26): 15115–15123.
DOI:10.1039/C9RA01781J |
| [14] |
CO2 electrolysis to multicarbon products in strong acid[J]. Science, 2021, 372(6546): 1074–1078.
DOI:10.1126/science.abg6582 |
| [15] |
Continuous photochemistry: The flow synthesis of ibuprofen via a photo-Favorskii rearrangement[J]. React Chem Eng, 2016, 1(2): 147–150.
DOI:10.1039/C5RE00037H |
| [16] |
Visible light photocatalysis as a greener approach to photochemical synthesis[J]. Nat Chem, 2010, 2(7): 527–532.
DOI:10.1038/nchem.687 |
| [17] |
Photocatalytic synthesis of small-molecule drugs by porous framework materials[J]. Chin Chem Lett, 2024, 35(3): 109065.
DOI:10.1016/j.cclet.2023.109065 |
| [18] |
Balzani V, Ceroni P, Juris A. Photochemistry and photophysics: Concepts, research, applications[M]. New York: John Wiley & Sons, Itd, 2014.
|
| [19] |
Photoredox catalysis in organic chemistry[J]. J Org Chem, 2016, 81(16): 6898–6926.
DOI:10.1021/acs.joc.6b01449 |
| [20] |
Spatiotemporal imaging of charge transfer in photocatalyst particles[J]. Nature, 2022, 610(7931): 296–301.
DOI:10.1038/s41586-022-05183-1 |
| [21] |
张金龙, 陈锋, 田宝柱, 等. 光催化[M]. 上海: 华东理工大学出版社, 2012. [Zhang J L, Chen F, Tian B Z, et al. Photocatalysis[M]. Shanghai: East China University of Science and Technology Press, 2012.]
Zhang J L, Chen F, Tian B Z, et al. Photocatalysis[M]. Shanghai: East China University of Science and Technology Press, 2012.
|
| [22] |
Photochemical reactions as key steps in organic synthesis[J]. Chem Rev, 2008, 108(3): 1052–1103.
DOI:10.1021/cr0680336 |
| [23] |
Triplet–triplet annihilation photon upconversion-mediated photochemical reactions[J]. Nat Rev Chem, 2024, 8(4): 238–255.
DOI:10.1038/s41570-024-00585-3 |
| [24] |
Photochemical reactions as synthetic tool for pharmaceutical industries[J]. Chin Chem Lett, 2024, 35(9): 109498.
DOI:10.1016/j.cclet.2024.109498 |
| [25] |
Energy transfer catalysis mediated by visible light: Principles, applications, directions[J]. Chem Soc Rev, 2018, 47(19): 7190–7202.
DOI:10.1039/C8CS00054A |
| [26] |
Photolysis of α-chloro-o-methylacetophenones[J]. J Chem Soc Chem Commun, 1978(2): 61–62.
DOI:10.1039/C39780000061 |
| [27] |
Dünkel L. Photochemical key steps in organic synthesis: An experimental course book[M]. Hoboken: John Wiley & Sons, 1995.
|
| [28] |
A rotation-controlled excited-state reaction. The photoenolization of ortho alkyl phenyl ketones[J]. J Am Chem Soc, 1976, 98(1): 239–241.
DOI:10.1021/ja00417a042 |
| [29] |
Photoenolisation[J]. Tetrahedron, 1976, 32(4): 405–422.
DOI:10.1016/0040-4020(76)80055-5 |
| [30] |
Photochemistry of haloketones-I: Reactions of some α-halocyclohexanones[J]. Tetrahedron, 1981, 37(5): 873–877.
DOI:10.1016/S0040-4020(01)97653-7 |
| [31] |
Photoenolization with a-chloro substituents[J]. J Org Chem, 1985, 50(26): 5612–5615.
DOI:10.1021/jo00350a036 |
| [32] |
Light-mediated direct transformation of 2-chloro-propiophenones into 2-arylpropionic acids[J]. Tetrahedron Lett, 1990, 31(51): 7495–7496.
DOI:10.1016/S0040-4039(00)88526-3 |
| [33] |
On the mechanism of the FAWORSKII1 rearrangement of α-HALO ketones[J]. J Am Chem Soc, 1950, 72(1): 632–633.
DOI:10.1021/ja01157a515 |
| [34] |
The alkaline rearrangement of α-haloketones. II. The mechanism of the Faworskii reaction[J]. J Am Chem Soc, 1951, 73(10): 4707–4714.
DOI:10.1021/ja01154a066 |
| [35] |
Mechanistic change in the Favorskii rearrangement on methyl substitution[J]. J Am Chem Soc, 1969, 91(14): 3949–3950.
DOI:10.1021/ja01042a049 |
| [36] |
Favorskii rearrangements: Evidence for steric control in the fission of crowded cyclopropanone intermediates[J]. J Am Chem Soc, 1970, 92(7): 2032–2035.
DOI:10.1021/ja00710a040 |
| [37] |
Favorskii-type rearrangement of α-chloro ketimines[J]. Tetrahedron Lett, 1981, 22(19): 1837–1840.
DOI:10.1016/S0040-4039(01)90454-X |
| [38] |
Photochemical rearrangement of α-chloro-propiophenones to α-arylpropanoic acids: Studies on chirality transfer and synthesis of (S)-(+)-ibuprofen and (S)-(+)-ketoprofen[J]. Tetrahedron, 1994, 50(4): 1243–1260.
DOI:10.1016/S0040-4020(01)80835-8 |
| [39] |
Media controlled photo-Favorskii type rearrangement of α-chloro acetophenones: Synthesis of phenylacetic acids[J]. Tetrahedron, 1997, 53(49): 16789–16794.
DOI:10.1016/S0040-4020(97)10081-3 |
| [40] |
Stereoselectivities in AgBF4-catalyzed and photoinduced phenyl-rearrangement of 2-chloropropiophenone[J]. Tetrahedron Lett, 1998, 39(52): 9755–9758.
DOI:10.1016/S0040-4039(98)02284-9 |
| [41] |
Visible‐light photocatalysis: Does it make a difference in organic synthesis?[J]. Angew Chem Int Edit, 2018, 57(32): 10034–10072.
DOI:10.1002/anie.201709766 |
| [42] |
Recent advances in semi-heterogenous photocatalysis in organic synthesis[J]. Chin Chem Lett, 2024, 36(2): 110469.
DOI:10.1016/j.cclet.2024.110469 |
| [43] |
Application of reactor engineering concepts in continuous flow chemistry: A review[J]. React Chem Eng, 2021, 6(8): 1295–1326.
DOI:10.1039/D1RE00004G |
| [44] |
Scalability of photochemical reactions in continuous flow mode[J]. J Flow Chem, 2021, 11(3): 223–241.
DOI:10.1007/s41981-021-00168-z |
| [45] |
Continuous flow technology-a tool for safer oxidation chemistry[J]. React Chem Eng, 2022, 7(3): 490–550.
DOI:10.1039/D1RE00520K |
| [46] |
Development of a fully automated continuous, integrated production system for all reaction processes of ibuprofen[J]. React Chem Eng, 2023, 8(5): 978–983.
DOI:10.1039/D3RE00045A |
| [47] |
郭凯, 贾成龙, 段金电, 等. 一种利用微通道模块反应装置连续制备异丁苯丙酸的方法: CN202310342914.5[P]. 2023-07-04. [Guo K, Jia C L, Duan J D, et al. A method for continuously preparing ibuprofen using a microchannel module reaction device: CN202310342914.5[P]. 2023-07-04.]
Guo K, Jia C L, Duan J D, et al. A method for continuously preparing ibuprofen using a microchannel module reaction device: CN202310342914.5[P]. 2023-07-04.
|
| [48] |
Kinetic study in an automatic continuous-flow photochemical platform with machine learning[J]. AIChE J, 2023, 69(9): e18102.
DOI:10.1002/aic.18102 |
| [49] |
Dimensionality reduction enabled efficient kinetic parameters estimation and process optimization during continuous flow synthesis of ibuprofen[J]. Chem Eng Sci, 2025, 304: 121047.
DOI:10.1016/j.ces.2024.121047 |
| [50] |
Photocarboxylation of benzylic C—H bonds[J]. J Am Chem Soc, 2019, 141(29): 11393–11397.
DOI:10.1021/jacs.9b05360 |
| [51] |
Ligand-controlled regioselective hydrocarboxylation of styrenes with CO2 by combining visible light and nickel catalysis[J]. J Am Chem Soc, 2018, 140(9): 3198–3201.
DOI:10.1021/jacs.7b13448 |
| [52] |
Research progress in photocatalytic methane conversion to high-value products(光催化甲烷转化为高价值产品的研究进展)[J]. J Mol Catal (China)(分子催化(中英文)), 2025, 39(1): 85–100.
DOI:10.16084/j.issn1001-3555.2025.01.009 |
| [53] |
Progress of photocatalyst active site modulation and its photoreduction of CO2 to C2+ products(光催化剂活性位点调控及其光还原CO2制C2+产物研究进展)[J]. J Mol Catal (China)(分子催化), 2023, 37(4): 389–396.
DOI:10.16084/j.issn1001-3555.2023.04.008 |
| [54] |
Visible-light photocatalytic di- and hydro-carboxylation of unactivated alkenes with CO2[J]. Nat Catal, 2022, 5(9): 832–838.
DOI:10.1038/s41929-022-00841-z |
| [55] |
Photocatalytic late-stage C−H functionalization[J]. Chem Rev, 2023, 123(8): 4237–4352.
DOI:10.1021/acs.chemrev.2c00478 |
| [56] |
Advances in the synthesis of carboxylic acid by photochemical conversion of CO2(光化学转化二氧化碳合成羧酸化合物的研究进展)[J]. Chin J Org Chem(有机化学), 2024, 44(10): 2997–3042.
DOI:10.6023/cjoc202405004 |
| [57] |
One pot photoenzymatic cascades to synthesize chiral aliphatic amines(光酶级联一锅法合成手性脂肪胺)[J]. J Mol Catal (China)(分子催化), 2023, 37(4): 323–330.
DOI:10.16084/j.issn1001-3555.2023.04.001 |
 2025, Vol. 39
2025, Vol. 39


